Научно-практический рецензируемый журнал.
Российский кардиологический журнал— официальный орган печати Российского кардиологического общества (РКО), научно-практический рецензируемый журнал. Главный редактор — Шляхто Е.В., Президент РКО, академик РАН, профессор, директор ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России. Санкт-Петербург, Россия.
Это научно-практический, рецензируемый журнал для кардиологов и терапевтов. Основная направленность издания — научные статьи, посвященные оригинальным и экспериментальным исследованиям, вопросам фармакотерапии и кардиохирургии сердечно-сосудистых заболеваний, новым методам диагностики.
Российский кардиологический журнал выпускается с 1996г., включен в перечень изданий, рекомендованных для публикации статей, содержащих материалы диссертаций (ВАК), включен в Scopus, DOAJ и Российский индекс научного цитирования (ядро), зарегистрирован в Клубе главных редакторов научных журналов Европейского общества кардиологов.
Science Index (2024) 9,997 (5-й процентиль, 2 место в рейтинге "Медицина и здравоохранение")
Импакт-фактор (2024) 2,116
Scopus 1,9 (35-й процентиль, Q3 по Cardiology and Cardiovascular Medicine)
Текущий выпуск
ГЕНЕТИКА В КАРДИОЛОГИИ. ОРИГИНАЛЬНЫЕ СТАТЬИ
- Исследована ассоциативная связь развития синдрома Вольфа-Паркинсона-Уайта (ВПУ) с молекулярно-генетическими полиморфными вариантами различных генов (в частности, VDR, ADRB1, SP4, MMP3и MMP9).
- Поиск молекулярно-генетических прогностических маркеров для формирования клинических проявлений и анатомического субстрата синдрома ВПУ является важной частью персонифицированной медицины и дает возможность ранней диагностики синдрома с целью прогнозирования течения заболевания.
- По результатам исследования было выявлено, что генотип 5А/5А гена MMP3снижает вероятность возникновения синдрома ВПУ практически в 2 раза, а генотип АА гена ММР9повышает риск развития неблагоприятных сердечно-сосудистых проявлений также в 2 раза.
Цель. Провести анализ ассоциации полиморфизмов в генах VDR (rs1544410), ADRB1 (rs1801252), SP4 (rs1011168), ММР3 (rs35068180) и ММР9 (rs11697325) с синдромом Вольфа-Паркинсона-Уайта (ВПУ).
Материал и методы. Всего в исследование было включено 169 пациентов с синдромом ВПУ и 158 человек, составивших контрольную группу. ДНК выделялась из лейкоцитов цельной крови фенол-хлороформным методом. Для генотипирования полиморфизмов rs1544410 и rs11697325 в генах VDR и MМР9 использовали коммерческие наборы ООО НПФ "Литех", Москва. Анализ rs1011168, rs1801252 и rs35068180 проводили с использованием комплекта реагентов для амплификации "ПЦР-Комплект" ("Синтол", Москва).
Результаты. При сравнении частоты встречаемости изучаемых полиморфизмов между пациентами с синдромом ВПУ и группой контроля достоверные отличия выявлены по rs35068180 в гене ММР3 и rs11697325 в гене ММР9. По полиморфизмам VDR (rs1544410), ADRB1 (rs1801252) и SP4 (rs1011168) отличий не выявлено. При сравнении частоты встречаемости генотипов по пяти изучаемым полиморфизмам между группами пациентов с различными клиническими вариантами синдрома ВПУ достоверные отличия обнаружены по rs1011168 в гене SP4 и rs35068180 в гене ММР3.
Заключение. Показано, что генотип 5А/5А гена MMP3 снижает вероятность возникновения синдрома ВПУ практически в 2 раза, а генотип АА гена ММР9 повышает риск развития неблагоприятных сердечно-сосудистых проявлений также в 2 раза.
Что уже известно о предмете?
- Помимо генетической предрасположенности к синдрому Вольфа-Паркинсона-Уайта (ВПУ), возможно определение фенотипических характеристик. Их совокупность позволит получить более точные данные для предупреждения развития синдрома ВПУ и аритмий при данной патологии.
Что нового?
- Результаты многофакторного регрессионного анализа выявили наиболее значимые статистические предикторы, которые потенциально могут оказать влияние на прогноз данной патологии и быть фактороми риска развития синдрома ВПУ.
Возможный вклад в клиническую практику
- Соматометрия и молекулярно-генетическое исследование может оказаться ценным инструментом для профилактики и систематического мониторинга людей групп высокого риска, ближайших родственников пациентов с синдром и феноменом ВПУ. В перспективе это может способствовать созданию инструмента для оценки риска возникновения аритмий при данном синдроме, основанного на принципах персонализированной медицины.
Цель. Изучение фенотипической и молекулярно-генетической характеристики пациентов с синдромом Вольфа-Паркинсона-Уайта (ВПУ).
Материал и методы. Основную группу составили 200 пациентов с синдромом ВПУ, среди них мужчин n=97 (n=48,5%); женщин n=103 (n=51,5%). Всем пациентам были проведены клинические, лабораторные, инструментальные исследования: электрокардиография (ЭКГ), холтеровское мониторирование ЭКГ, эхокардиография, соматометрическое исследование, которое было проведено с использованием набора инструментов по стандартной методике В. В. Бунака и молекулярно-генетическое исследование. Выделение ДНК осуществлялось фенол-хлороформным методом, а генотипирование — методом полимеразной цепной реакции.
Результаты. Результаты многофакторного регрессионного анализа выявили значимые ассоциации между рядом факторов и наличием синдрома ВПУ. Наиболее сильным предиктором являлось наличие дельта-волны на ЭКГ (отношение шансов (ОШ) =21,3; p<0,0001). Генетические варианты PRKAG3="CC" (ОШ =16,7; p=0,0009), PRKAG2="GA" (ОШ =6,3; p=0,0023) и TBX3="GG" (ОШ =6,1;
p=0,0078) также демонстрировали значимую связь с повышенной вероятностью возникновения синдрома. Увеличение длительности комплекса QRS (ОШ =1,1 на единицу; p<0,0001) и частота сердечных сокращений (ОШ =1,1; p=0,0008) на ЭКГ ассоциировалось с незначительным повышением шансов. В противоположность этому, увеличение длительности интервала QT (ОШ =0,97; p<0,0001) и более высокий рост (ОШ =0,96; p=0,0073) были ассоциированы с низким риском развития синдрома ВПУ. Нормостенический тип телосложения по шкале Rees-Eisenck значительно снижал шансы (ОШ =0,47; p=0,0367) развития данного заболевания.
Заключение. Наследственность является ключевым фактором в развитии синдрома ВПУ, что подтверждается данными многочисленных исследований. Фенотипические характеристики, в дополнение к генетическим маркерам, могут служить ценным инструментом для стратификации риска и разработки профилактических стратегий, направленных на предотвращение манифестации синдрома ВПУ.
- Генотип CG rs1333049 ANRILвыявлен у 71,4% пациентов с гиперлипопротеинемией(а) (гиперЛП(а)) и у 63,9% больных с семейной гиперхолестеринемией. Генотип AG rs10455872 гена LPA, также увеличивающий риск сердечно-сосудистых событий, выявлялся преимущественно у больных с гиперЛП(а) (в 34,3% случаев).
- Семейная гиперхолестеринемия, ассоциированная с генотипом CG/CC rs1333049 ANRIL, характеризуется агрессивным течением заболевания с развитием сердечно-сосудистых событий у 36,7% пациентов до 44 лет, преимущественно у мужчин.
- ГиперЛП(а) характеризуется меньшим приростом уровня липопротеина низкой плотности в сравнении с группой больных с семейной гиперхолестеринемией. Генотип CG/CC в этой группе пациентов определяет риск развития сердечно-сосудистых событий до 40 лет в 15% случаев.
Цель. Изучить влияние полиморфизмов rs1333049 гена ANRIL и rs10455872 гена липопротеина(а) (LPA) на клинический статус пациентов с гетерозиготной семейной гиперхолестеринемией (СГХ) и гиперлипопротеинемией(а) (гиперЛП(а)).
Материал и методы. Обследован 171 пациент от 3 до 44 лет. Определены липидный профиль, аполипопротеин В (апоВ), липопротеин(а) (ЛП(а)) иммунохемилюминесцентным методом с помощью автоматизированной модульной платформы Roche Cobas 8000. Носительство однонуклеотидных вариантов (ОНВ) определялось методом полимеразной цепной реакции на аппарате Rotor-Gene 6000 технологией аллельной дискриминации TaqMan и флюоресцентных зондов Applied Biosystems для rs10455872 (A/G) гена LPА, rs1333049 (C/G) ANRIL. Распределение частот генотипов соответствует равновесию Харди-Вайнберга. Ультразвуковое исследование брахиоцефальных сосудов оценивалось с учётом возрастных нормативов.
Результаты. Изучение взаимосвязи ОНВ rs1333049 гена ANRIL и rs10455872 LPА у пациентов с СГХ и гиперЛП(а) установило, что генотип СG rs1333049 гена ANRIL имеет прямую корреляцию с уровнем апоВ, толщиной комплекса интима-медиа (ТКИМ) в обеих целевых группах. Выявлено влияние AG генотипа rs10455872 LPА на уровень апоВ, ЛП(а) и ТКИМ у больных с СГХ и гиперЛП(а). Средний возраст развития коронарных событий составил 35 лет, в группе с СГХ число случаев инфаркта миокарда было в 2,5 раза больше, чем в группе ЛП(а).
Заключение. У пациентов с СГХ и гиперЛП(а) преобладание генотипа CG ANRIL связано с высокими апоВ, ТКИМ и частотой коронарных событий. Генотип AG rs10455872 LPА связан с высоким уровнем ЛП(а), увеличением ТКИМ и риском раннего инфаркта миокарда.
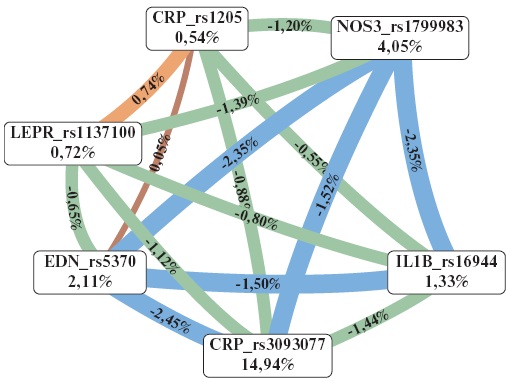
- Риск развития ишемической болезни сердца (ИБС) ассоциирован с полиморфными вариантами генов rs3093077 CRP, rs1799983 NOS3, rs5370 EDN, rs1137100 LEPR, rs16944 IL1B.
- Выявлено два гаплотипа, которые обладают выраженной взаимосвязью с предрасположенностью к развитию ИБС.
- Полиморфизм rs3093077 гена CRP ассоциирован с более высокими значениями концентрации С-реактивного белка в сыворотке пациентов с ИБС.
Цель. Провести оценку вовлеченности однонуклеотидных полиморфных вариантов генов воспалительного ответа, эндотелиальной дисфункции, липидного обмена и окислительного стресса в развитие ишемической болезни сердца (ИБС).
Материал и методы. В исследование включено 560 человек, из которых 260 пациентов с установленным диагнозом стабильная ИБС и 300 условноздоровых доноров. Выделение ДНК осуществляли из периферической крови по стандартному протоколу. Генотипирование 42 полиморфных вариантов проводили методом полимеразной цепной реакции в режиме реального времени. Сывороточные уровни исследуемых белков определяли методом твердофазного иммуноферментного анализа коммерческими наборами.
Результаты. Развитие ИБС ассоциировано с полиморфными вариантами rs3093077 гена CRP, rs1799983 гена NOS3 и rs5370 гена EDN, rs1205 гена CRP и rs1137100 гена LEPR, rs16944 гена IL1B. Установлено, что 2 гаплотипа rs16944A-rs1205T-rs3093077C-rs5370G-rs1799983G-rs1137100A (р=0,04) и rs16944A-rs1205T-rs3093077C-rs5370G-rs1799983Т-rs1137100A (р=0,032) обладают выраженной взаимосвязью с предрасположенностью к развитию ИБС. Выявлено, что носители аллеля А варианта rs3093077 гена CRP характеризовались более высокими значениями концентрации С-реактивного белка в сыворотке.
Заключение. Таким образом, проведённое исследование демонстрирует значительный вклад полиморфных вариантов генов воспалительного ответа (IL1B rs16944, CRP rs1205 и CRP rs3093077), эндотелиальной дисфункции (EDN rs5370 и NOS3 rs1799983) и липидного обмена (LEPR rs1137100) в формирование предрасположенности к развитию ИБС.
- Изучение взаимосвязи между полиморфизмом генов и степенью артериальной жёсткости у пациентов с артериальной гипертензией (АГ) может помочь при оценке их влияния на риск развития сердечно-сосудистых заболеваний.
- Полиморфизм C521T в гене AGTможет служить маркером раннего поражения сосудов у пациентов с подтвержденным диагнозом АГ.
- Изучение генетических полиморфизмов открывает новые горизонты для более глубокого понимания механизмов возникновения и развития АГ и сердечно-сосудистых заболеваний, что, в свою очередь, позволит снизить риск возникновения этих заболеваний и улучшить качество жизни пациентов.
Цель. Изучение взаимосвязи между полиморфизмами определённых генов и степенью артериальной жёсткости в исследуемых группах для оценки влияния полиморфизмов данных генов на риск развития сердечно-сосудистых заболеваний.
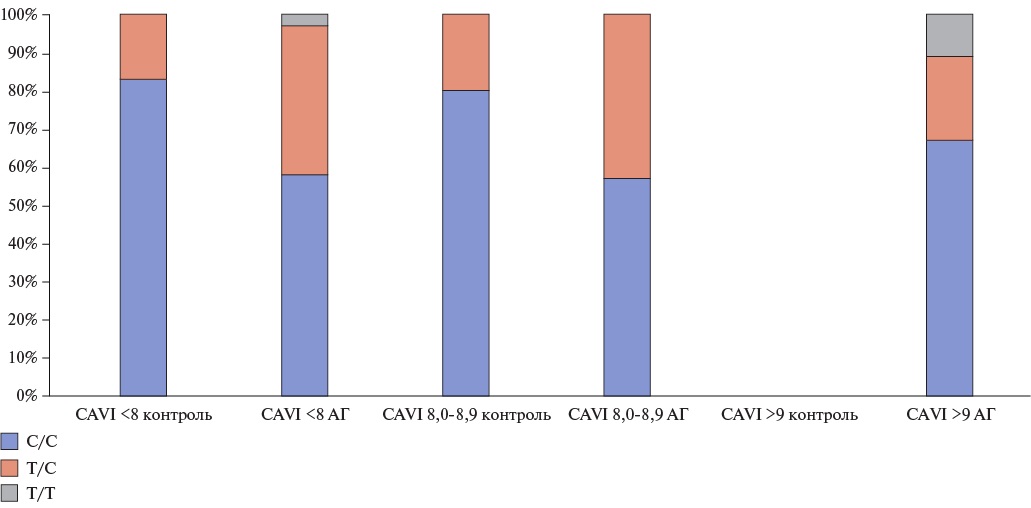
Материал и методы. Обследовано 77 пациентов, средний возраст которых составил 52,9±11,3 года. Пациентам проводились клинические, инструментальные исследования, в т.ч. объемная сфигмоплетизмография для оценки сердечно-лодыжечно-сосудистого индекса (CAVI), исследование биохимического анализа крови, определение полиморфизма генов. Пациенты были разделены на две группы в зависимости наличия артериальной гипертензии (АГ). Затем каждая группа была разделена на три подгруппы по уровню CAVI: CAVI <8, CAVI 8,0-8,9, CAVI >9.
Результаты. В группе с АГ частота встречаемости генотипов Т/С и Т/Т полиморфизма С521T гена AGT была выше во всех трех подгруппах, по сравнению с группой контроля. Генотип Т/С полиморфизма гена GNB3 C825T чаще встречался в группе с АГ в подгруппах с CAVI <8 и CAVI >9, а генотип Т/Т — в группе контроля с CAVI 8,0-8,9. В подгруппе с CAVI 8,0-8,9 аллель С/С полиморфизма гена NOS3 T786С статистически значимо чаще встречалась в контрольной группе, а аллель Т/С преобладала в контрольной группе с CAVI <8. В группе контроля с CAVI <8 и CAVI 8,0-8,9 чаще встречался генотип Т/Т полиморфизма гена NOS3 G894T, а аллель T/G встречалась чаще в группе с АГ с CAVI 8,0-8,9.
Заключение. Полиморфизм C521T гена AGT может служить маркером раннего поражения сосудов у пациентов с подтвержденным диагнозом АГ. Гомозиготный полиморфизм С/С гена AGT Т704С, по всей видимости, чаще приводит к повышению АГ. Изучение генетических полиморфизмов открывает новые горизонты для переосмысления и механизмов возникновения и развития АГ и сердечно-сосудистых заболеваний.
- У пациентов с острым инфарктом миокарда (ОИМ) выявлена ассоциация носительства генотипа GG rs1805126 гена SCN5A с ухудшением восстановления сократительной способности миокарда после курса реабилитационных мероприятий на амбулаторном этапе.
- У пациентов с ОИМ не выявлено ассоциации носительства генотипов СС, СG, GG rs16847897 гена LRRC31 с ухудшением восстановления сократительной способности миокарда после курса реабилитационных мероприятий на амбулаторном этапе.
- Визуализация с использованием эластичных карт позволила наглядно разделить пациентов с генотипами GG, АА, АG rs1805126 гена SCN5A, а также наметить направления дальнейших научных исследований с генотипами rs5186 гена AGTR1, rs1042714 гена ADRB2.
Цель. Изучить влияние генетических особенностей пациентов на восстановление сократительной способности миокарда после перенесенного острого инфаркта миокарда (ОИМ) в период амбулаторно-поликлинического периода реабилитации с использованием метода эластичных карт (обобщение метода главных компонент).
Материал и методы. В исследование включено 127 пациентов (98 мужчин и 29 женщин), в возрасте от 36 до 65 лет, средний возраст 59,0±8,7 года, перенесших ОИМ. Через 3-6 нед. после ОИМ все пациенты в течение 14 дней проходили третий (амбулаторный) этап реабилитации. Все пациенты проходили курс велотренировок. До и после велотренировок пациентам проводились: велоэргометрия, тест с шестиминутной ходьбой, оценка по шкале Борга. Восстановление сократительной способности миокарда оценивалось по изменениям показателей данных тестов. Всем пациентам проводилось выделение геномной ДНК, анализировались варианты нуклеотидной последовательности (ВНП): rs1805126 гена SCN5A, rs16847897 гена LRRC31, rs5186 гена AGTR1, rs1042714 гена ADRB2. Создание эластичных карт проводилось с использованием компьютерной программы "ElMap".
Результаты. Установлено, что имеется ассоциация носительства генотипа GG ВНП rs1805126 гена SCN5A с ухудшением восстановления сократительной способности сердца. Не выявлено ассоциации носительства генотипов СС, СG, GG ВНП rs16847897 гена LRRC31 с ухудшением восстановления сократительной способности миокарда. Визуализация с использованием эластичных карт позволила: наглядно разделить пациентов с генотипами GG, АА, АG rs1805126 гена SCN5A, наметить направления дальнейших исследований ВНП rs5186 гена AGTR1, rs1042714 гена ADRB2. При визуализации значимых различий между мужчинами и женщинами не выявлено.
Заключение. Информация об ассоциации носительства генотипов данных ВНП может быть использована для индивидуального подхода при выборе уровня нагрузки при проведении велотренировок на третьем (амбулаторном) этапе реабилитации у пациентов, перенесших ОИМ.
- Референсные генотипы GG варианта rs5370 и CC варианта rs1126643 могут являются частью генетической предрасположенности к ремоделированию левого желудочка у больных инфарктом миокарда с подъёмом сегмента ST с успешной реперфузией.
- Выявленные полиморфизмы могут указывать на новые молекулярные механизмы, лежащие в основе постинфарктного ремоделирования левого желудочка, и могут определить потенциальные терапевтические цели.
Цель. Выявить генетические особенности у пациентов с ремоделированием левого желудочка (РЛЖ) после инфаркта миокарда с подъёмом сегмента ST (ИМпST), подвергнутых чрескожному коронарному вмешательству с достоверным достижением реперфузии.
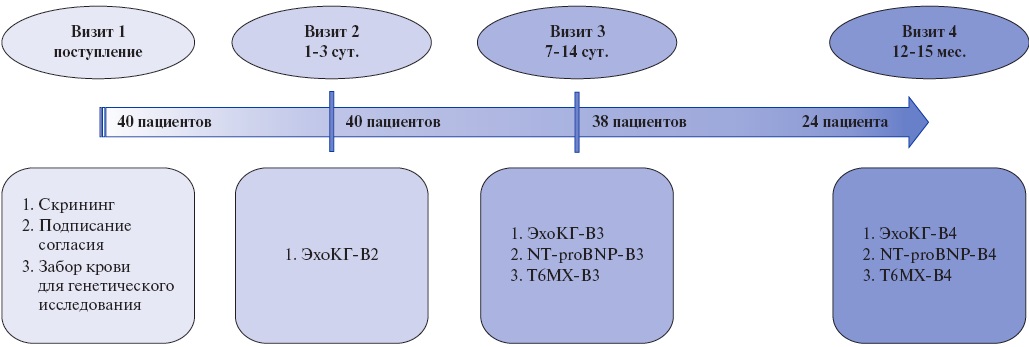
Материал и методы. В одноцентровое обсервационное исследование включено 40 больных ИМпST, успешно подвергнутых чрескожному коронарному вмешательству. Методом полимеразной цепной реакции в реальном времени с использованием коммерческих наборов определялись однонуклеотидные полиморфизмы (ОНП) генов ренин-ангиотензин-альдостероновой системы, коагуляционного каскада, функции тромбоцитов, функции эндотелия и метаболизма фолатов. В ходе наблюдения пациентам выполнялось эхокардиографическое исследование (ЭхоКГ) на 1-3 и 7-14 сут., а также через 12-15 мес. Наличие РЛЖ устанавливалось на основании: 1) комбинированного ЭхоКГкритерия: снижение фракции выброса левого желудочка <50%, увеличение его конечного диастолического объёма ≥20% или конечного систолического объёма ≥15% по данным сравнения последнего и первого ЭхоКГ; или на основании 2) клинического критерия: госпитализация по поводу декомпенсации сердечной недостаточности. На последний визит смогли явиться 24 пациента, сформировавших группы сравнения и контроля по 12 человек в каждой. Медиана наблюдения составила 392 [383; 406] дня.
Результаты. Статистически значимые межгрупповые различия были выявлены для двух полиморфизмов: rs5370 и rs1126643. В группе пациентов с РЛЖ частота генотипа GG rs5370 составила 91% (n=10) vs 40% (n=4) в группе контроля (p=0,024); частота генотипа CC rs1126643-67% (n=8) vs 8% (n=1), соответственно (p=0,009). Результаты многофакторного регрессионного анализа показали, что референсные генотипы GG ОНП rs5370 и CC ОНП rs1126643 могут быть ассоциированы с повышенным риском развития РЛЖ у больных ИМпST с достигнутой реперфузией, в то время как носительство альтернативного аллеля (как в гомозиготном, так и гетерозиготном состоянии) как минимум в одном из указанных локусов имело протективное значение.
Заключение. Референсные генотипы GG ОНП rs5370 и CC ОНП rs1126643 могут являются частью генетической предрасположенности к РЛЖ у больных ИМпST с успешной реперфузией. Полученные данные не являются исчерпывающими и требуют проверки в ходе более масштабных исследований.
- Пациенты с острым коронарным синдромом (ОКС) чаще всего переносили новую коронавирусную инфекцию (COVID-19) штамма Омикрон (2022г), а тяжелая степень тяжести COVID-19 чаще регистрировалась у пациентов, перенесших штамм Дельта.
- Вариант нуклеотидной последовательности ID rs1799752 гена АСЕассоциирован с риском развития ОКС у пациентов в зависимости от степени тяжести перенесенной COVID-19.
- Генетические маркеры могут являться предикторами развития ОКС у пациентов в зависимости от степени тяжести перенесённой COVID-19.
Цель. Оценить частоту обнаружения генотипов вариантов нуклеотидной последовательности rs1799752 гена ACE у пациентов с острым коронарным синдромом (ОКС) в зависимости от степени тяжести новой коронавирусной инфекции (COVID-19).
Материал и методы. Всего в исследование было включено 100 пациентов, из них 50 мужчин и 50 женщин, госпитализированных с диагнозом ОКС и указанием на перенесенную COVID-19 в анамнезе. Для всех пациентов проводились оценка степени тяжести перенесённой COVID-19 и вида штамма (Альфа, Дельта, Омикрон). При поступлении всем пациентам проводилась диагностика согласно протоколу обследования больных с ОКС, операция чрескожной транслюминальной коронарной ангиопластики со стентированием, генетическое исследование rs1799752 гена ACE методом полимеразной цепной реакции.
Результаты. В нашем исследовании чаще встречались пациенты, переболевшие штаммом Омикрон (87 пациентов, 73,7%). Тяжёлая степень тяжести перенесенной COVID-19 чаще регистрировалась при штамме Дельта — 7 человек (5,93%). При сравнении частот носительства генотипов rs1799752 гена АСЕ у больных с ОКС в зависимости от степени тяжести перенесённой COVID-19, получены статистически значимые различия (р=0,043). Носительство гетерозиготного генотипа ID регистрировалось чаще всего как среди амбулаторно лечившихся, так и среди госпитализированных пациентов. При разделении по полу, среди амбулаторно лечившихся мужчин и женщин, гетерозиготный вариант ID снова встречался чаще, так же как и среди женщин, госпитализированных с COVID-19.
Заключение. Вариант нуклеотидной последовательности rs1799752 (I/D) гена ACE ассоциирован с ОКС у пациентов в зависимости от степени тяжести перенесённой COVID-19.
- При расчете риска артериальной гипертензии при помощи однофакторного анализа наиболее статистически значимы негенетические факторы риска: высокий индекс массы тела, индекс талии/бедер >0,88, отягощенный наследственный анамнез по сердечно-сосудистым заболеваниям, атеросклероз, повышение общего холестерина, мужской пол, отягощенный наследственный анамнез по метаболическому синдрому.
- Однако при многофакторном анализе наилучшие чувствительность и специфичность показала совокупность только генетических факторов.
- Построение математической модели многофакторной логистической регрессии позволило ранжировать вклад различных генотипов в развитие артериальной гипертензии, при этом некоторые из генотипов вносили протективный вклад.
Цель. Выявить независимые генетические и негенетические предикторы развития артериальной гипертензии (АГ) и ранжировать их вклад в развитие заболевания, а также обозначить потенциально новые механизмы, которые могут влиять на развитие АГ.
Материал и методы. В одномоментное обсервационное исследование были включены 610 пациентов, из них 142 пациента с АГ. Всем участникам было проведено анкетирование, измерение артериального давления, биометрических показателей, молекулярно-генетическое тестирование. Выявление предикторов АГ проведено построением моделей логистических регрессий. С помощью однофакторных моделей определяли отдельные предикторы, ассоциированные с риском развития АГ. Из совокупности ковариат с достигнутым уровнем значимости p<0,3 в однофакторных моделях была построена модель многофакторной логистической регрессии для ранжирования вклада каждого признака в развитие АГ.
Результаты. На основе негенетических и генетических маркеров построена математическая модель, позволяющая оценить риск АГ, с лучшей классификацией лиц с низким генетическим риском развития АГ. Именно генетические предикторы были более значимы для оптимальных расчетов вероятности АГ в модели логистической регрессии, тогда как негенетические признаки в итоговую модель не вошли. Рассмотрены возможные механизмы, которые могут приводить к развитию АГ, на основании выявленных генетических предикторов, а также рассматривается концепция вклада протективной комбинации генетических вариантов.
Заключение. Для выявления лиц с низким риском АГ оптимально использование модели логистической регрессии, основанной на результатах молекулярногенетического тестирования. Таким образом, для пациентов с низким генетическим риском более значимыми являются факторы, связанные с образом жизни, и для них особенно важна его коррекция с целью профилактики развития АГ.
- Прогресс в специфической терапии орфанных заболеваний, маскирующихся под гипертрофическую кардиомиопатию (ГКМП), в частности, амилоидоза сердца и болезни Фабри, подчеркивает актуальность их диагностики.
- Совершенствование визуализации миокарда и доступность генетического тестирования позволяют выявлять фенокопии в среднем у каждого 20-го взрослого пациента с фенотипом ГКМП.
- Молекулярный диагноз важен не только для пациента, но и его семьи, позволяя выявлять носителей мутаций на ранних стадиях.
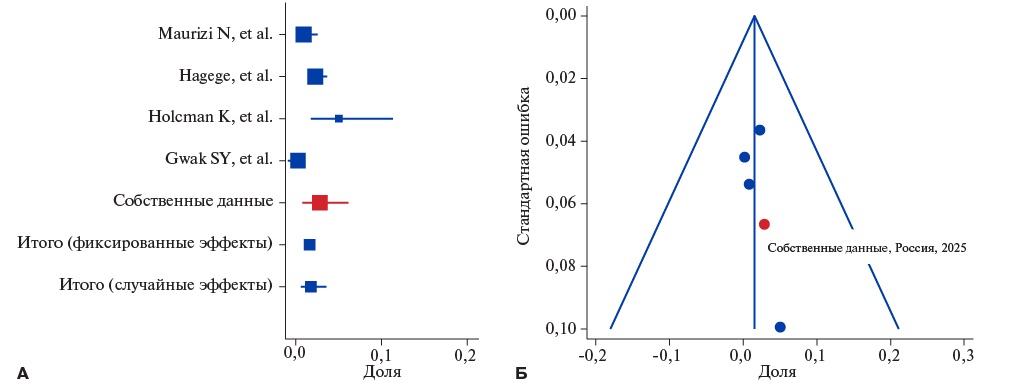
Цель. Оценить частоту встречаемости амилоидоза сердца и болезни Фабри среди взрослых пациентов с фенотипом ГКМП в российском наблюдательном исследовании и сравнить результаты с международными данными на основе мета-анализа.
Материал и методы. В проспективное исследование, проводимое в ГБУЗ ГКБ №17 ДЗМ с 2009 по 2024гг, включены 223 больных с фенотипом ГКМП (средний возраст 54±14,9 лет, 55% мужчин). Все пациенты прошли клинико-инструментальное, лабораторное и генетическое обследование. Диагнозы фенокопий верифицировались в соответствии с рекомендациями. Далее их долю в общей группе сравнивали с данными мета-анализа публикаций, отобранных в результате систематического поиска в базе PubMed по распространенности AL- и ATTRv-амилоидоза сердца и болезни Фабри среди взрослых пациентов с ГКМП.
Результаты. В нашей когорте диагноз был пересмотрен на AL-амилоидоз у шести больных (2,7%), на ATTRv-амилоидоз – у трех (1,4%) и на болезнь Фабри – у одного (0,5%). В мета-анализ включены 16 исследований (8243 пациента). Различий между российскими данными и данными других популяций не выявлено. Общая распространенность фенокопий по результатам мета-анализа с учетом российской когорты составила: AL-амилоидоз - 1,8%, ATTRv-амилоидоз - 1,2% и болезнь Фабри - 1,2%.
Заключение. Фенокопии составляют существенную долю причин фенотипа ГКМП у взрослых, а их распространенность в России сопоставима с другими популяциями. Повышенная клиническая настороженность и обязательное генетическое тестирование могут улучшить выявляемость редких заболеваний, маскирующихся под ГКМП.
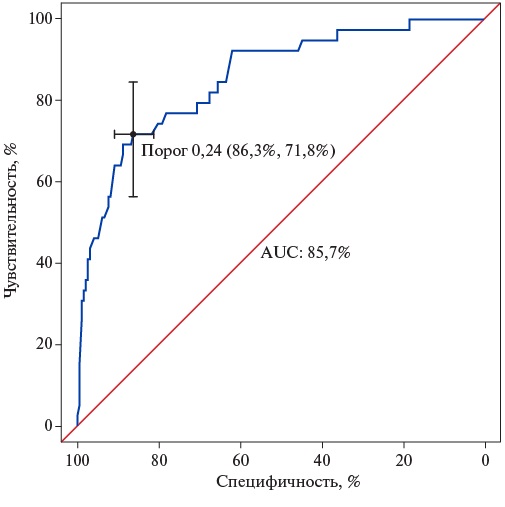
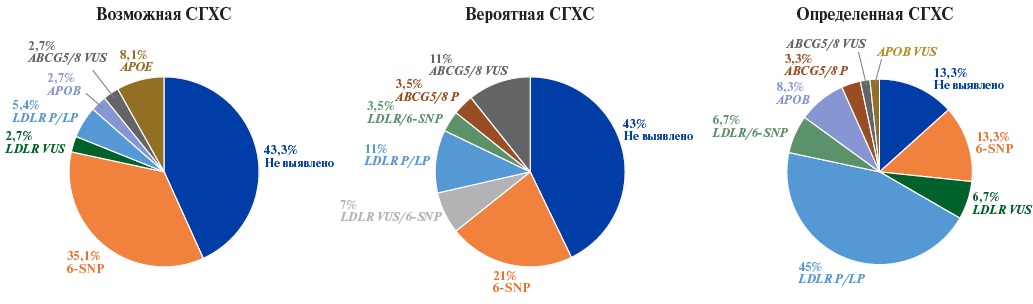
- У пациентов с возможной и вероятной семейной гиперхолестеринемией существенный вклад вносит полигенная гиперхолестеринемия (до 35,1% для примененной шкалы генетического риска (ШГР)).
- Расширенная NGS панель, включающая гены наследственных дислипидемий, а также локусы для расчета ШГР, может эффективно применяться для проведения дифференциальной диагностики, определения этиологии гиперхолестеринемии и для персонализации подходов к лечению.
Цель. Определение частоты патогенных и вероятно патогенных вариантов, ассоциированных с семейной гиперхолестеринемией (СГХС), с оценкой доли полигенной СГХС согласно шкале генетического риска (ШГР) 6-SNP среди пациентов с диагнозом возможная/вероятная/определенная СГХС в Санкт-Петербурге.
Материал и методы. В рамках исследования была проведена апробация гибридной таргетной панели для генодиагностики наследственных дислипидемий, включающей расширенный список генов, ассоциированных с моногенными дислипидемиями, и ряд однонуклеотидных вариантов, связанных с полигенной гиперхолестеринемией и сердечно-сосудистым риском. Генетическое тестирование было выполнено для 125 пациентов.
Результаты. Всего выявлено 26 патогенных и вероятно патогенных вариантов в гене LDLR у 38 пациентов, 6 вариантов неопределенного клинического значения в гене LDLR у 7 пациентов, патогенный вариант в гене APOB c.10580G>A p.Arg3527Gln выявлен у 6 пациентов. Наибольшая выявляемость причинных генетических вариантов (66,7%) была отмечена, как и ожидалось, в подгруппе пациентов с определенной СГХС. В подгруппах с диагнозом возможная и вероятная СГХС преобладали пациенты с высоким полигенным риском развития гиперхолестеринемии.
Заключение. Использование расширенной NGS панели, включающей гены наследственных дислипидемий, а также локусы для расчета ШГР, может быть критически важным для проведения дифференциальной диагностики, определения этиологии гиперхолестеринемии и для персонализации подходов к лечению.
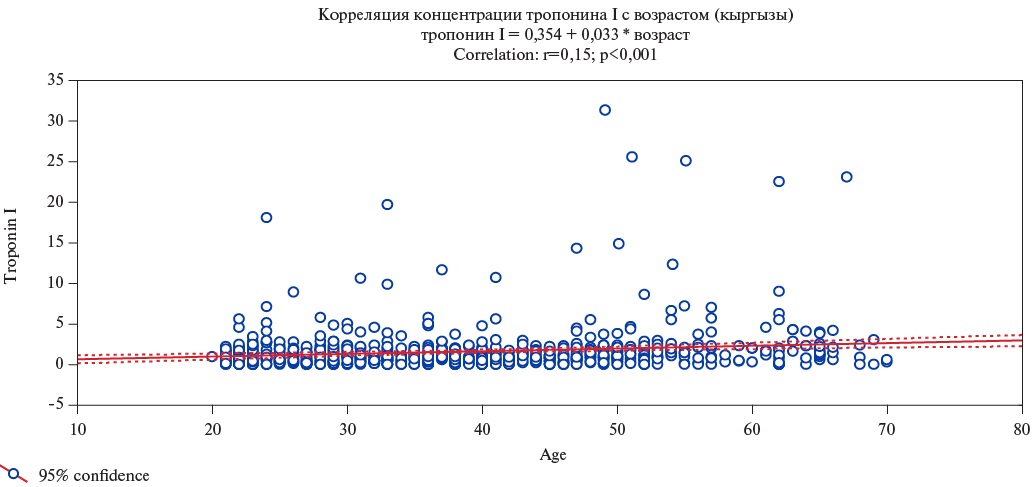
- Распределение концентрации высокочувствительного тропонина I (вчTnI) в анализируемой репрезентативной выборке (n=1162) носило ассиметричный характер со сдвигом в сторону низких значений данного показателя.
- Медиана концентрации вчTnI и интерквартильный размах в славянской группе составили 1,4 (0,8; 2,2) пг/мл, что было значимо выше, чем среди кыргызской этнической группы (1,0 (0,45; 1,85) пг/мл, р=0,003). Данное положение было справедливо как для мужчин (р=0,003), так и для женщин (р=0,001).
- Выявлена корреляционная зависимость между концентрацией вчTnIи возрастом респондентов в обеих этнических группах, более выраженная среди женщин и в кыргызской группе.
Цель. Выявить наличие этнических особенностей в распределении концентрации высокочувствительного тропонина I (вчTnI) в репрезентативной выборке жителей Чуйского региона Кыргызской Республики с учетом возрастного аспекта.
Материал и методы. Материалом исследования послужила представительная выборка населения 18-65 лет Кыргызской Республики (n=1162). Проведен анализ распределения уровней вчTnI в популяции с учетом этнической принадлежности (кыргызы, славяне). Уровень вчTnI в образцах сыворотки крови измеряли с помощью иммунохемилюминесцентного анализа с микрочастицами, используя реактивы Architect Stat High Sensitive Troponin I (Abbott, США) на автоматизированном анализаторе Architect i2000SR (Abbott, США) в утренние часы у всех обследуемых пациентов. Порог статистической значимости принят равным 0,05.
Результаты. Медиана концентрации вчTnI в кыргызской группе составила 1,0 (0,45; 1,85) пг/мл, значения 99 процентиля (Q99) — 14,9 пг/мл, что было значимо меньше в сравнении со славянской группой (Ме — 1,4 (0,8; 2,2) пг/мл, р=0,003; Q99-23,1 пг/мл). В славянской этнической группе концентрация вчTnI была выше, чем среди кыргызов при раздельном анализе у мужчин и у женщин (p<0,001). Уровни вчTnI были значимо выше у мужчин, чем у женщин как в кыргызской (p<0,001), так и в славянской (р=0,003) группах. Выявлена значимая корреляционная зависимость между концентрацией вчTnI и возрастом респондентов в обеих этнических группах. Уровень корреляционной взаимосвязи в кыргызской этнической группе составил r=0,15 (p<0,001), в славянской — была менее выраженной и составляла r=0,096 (р=0,046). Несмотря на более низкие исходные значения концентрации вчTnI, скорость его повышения с возрастом была выше у представителей кыргызского этноса.
Заключение. Выявлено наличие этнических различий в концентрации вчTnI с его более высокими значениями в славянской группе в сравнении с коренными кыргызами. При этом в обеих этнических группах уровень вчTnI был выше у мужчин и повышался с возрастом.
ОБЩЕСТВЕННОЕ ЗДОРОВЬЕ И ОРГАНИЗАЦИЯ ЗДРАВООХРАНЕНИЯ
- Концепция предотвратимой смертности позволяет выделять причины смерти, на которые система здравоохранения может повлиять максимально результативно при минимальных усилиях.
- Применение модели Донабедиана обеспечивает структурирование мероприятий по снижению смертности по блокам "структура", "процесс" и "результат".
- Представлен набор мероприятий по снижению предотвратимой смертности от болезней системы кровообращения, актуальный для применения в регионах России.
- Предложенный подход может служить основой для разработки региональных программ и оценки их результативности.
- Регулярное обновление перечня мероприятий необходимо из-за развития медицинских технологий и изменения ресурсов системы здравоохранения.
В статье демонстрируется, как концепция предотвратимой смертности может использоваться для разработки мер по снижению смертности на примере болезней системы кровообращения (БСК). При этом мероприятия структурируются по модели А. Донабедиана. Использована российская методика определения предотвратимой смертности, основанная на международных подходах и адаптированная к возможностям отечественной системы здравоохранения. Совместно с федеральными экспертами сформирован перечень мероприятий по снижению смертности от предотвратимых причин БСК. Для их систематизации применена триада Донабедиана, выделяющая ресурсы, процесс и показатели результативности для каждого мероприятия. Представлены примеры мероприятий: школы здоровья с использованием телемедицинских технологий, индивидуальное информирование пациентов и проведение стресс-эхокардиографии. Их структурирование по модели Донабедиана позволяет выявлять причины потенциально неудовлетворительных результатов и совершенствовать процессы их реализации. Интеграция концепции предотвратимой смертности с моделью Донабедиана обеспечивает рациональный выбор и оценку мер по снижению смертности от БСК, а также эффективное распределение ресурсов. Перечень мероприятий требует регулярного обновления с учётом изменений медицинских технологий и возможностей системы здравоохранения.
СОВЕТ ЭКСПЕРТОВ
- Национальные и международные данные подтверждают расхождения между реальной практикой назначения бета-адреноблокаторов (БАБ) и современными рекомендациями.
- Ключевыми проблемами остаются низкая частота назначений БАБ при наличии показаний, использование субоптимальных доз, завышенная оценка бронхообструктивных заболеваний как противопоказаний для назначения БАБ, а также низкая приверженность пациентов к приему препаратов.
- Существенным ограничением является недостаточная информированность врачей о принципах титрации доз, что приводит к ложному заключению о низкой эффективности БАБ.
- Положительными аспектами являются корректное представления врачей о целевой частоте сердечных сокращений (ЧСС) при назначении БАБ и достижение ее в большинстве случаев.
- Для оптимизации терапии БАБ необходимо внедрение образовательных программ, акцентирующих внимание на доказанных преимуществах титрации доз, а также разработка клинических алгоритмов, упрощающих процесс достижения целевых параметров ЧСС.
Применение бета-адреноблокаторов (БАБ) занимает важное место в терапии сердечно-сосудистых заболеваний, однако в реальной клинической практике сохраняются существенные расхождения с современными рекомендациями. Основные проблемы, касающиеся неоптимальных дозировок препаратов и низкой приверженности к лечению, снижают эффективность терапии и ухудшают прогноз пациентов. Под эгидой Евразийской Ассоциации Терапевтов (ЕАТ) была собрана рабочая группа, посвященная проблеме применения БАБ в реальной клинической практике. Целью рабочей группы являлось привлечение внимания к вопросу о правильности и особенностях назначении БАБ практикующими специалистами. В ходе работы были рассмотрены данные опроса врачей терапевтического профиля по особенностям назначения БАБ, факторам, влияющим на выбор конкретного препарата, восприятию группы БАБ в целом и барьерам, ограничивающим их применение. Рабочей группой ЕАТ были обсуждены результаты опроса врачей и предложены подходы к оптимизации назначений БАБ в реальной клинической практике.
Объявления
2025-12-27
Последние номера 2025 года
Уважаемые читатели,
перед новогодними праздниками последние номера выкладываются в архив с большими временными задержками. Поэтому все опубликованные выпуски выложены постатейно в разделе "Принято в печать".
2025-12-26
Благодарность рецензентам
Редакция "Российского кардиологического журнала" выражает огромную благодарность экспертам, которые рецензировали статьи на протяжении 2025 года и помогали принимать редакционные решения.
2025-09-29
Политика использования инструментов ИИ в научных статьях (утверждение)
26 сентября 2025 г. на объединенном заседании редакционной коллегии и редакционного совета была утверждена политика по использованию инструментов искусственного интеллекта в научных статьях.
2025-09-16
Единый государственный перечень научных изданий (ЕГПНИ) – «Белый список»
«Российский кардиологический журнал» вошел в Единый государственный перечень научных изданий (ЕГПНИ) – «Белый список». Ему присвоен 1-й уровень. Это важное достижение, которое подтверждает качество и значимость издания в научном сообществе.
2025-08-29
Обработка персональных данных
С 1 сентября 2025 года вступают в силу поправки в ч. 1 ст. 9 Закона № 152-ФЗ, которыми вводится новое требование к согласию на обработку персональных данных. Согласие должно быть оформлено отдельно от информационных и (или) иных документов, которые подписывает субъект персональных данных (Федеральный закон от 24 июня 2025 года №156-ФЗ).
2025-06-01
Уточнения в «Правила для авторов» в отношении рисунков
Уважаемые авторы!
Журнал вносит уточнения в «Правила для авторов» в отношение рисунков, которые предоставляются при подаче статьи для рассмотрения к публикации.
| Еще объявления... |
ISSN 2618-7620 (Online)