Перейти к:
Полиморфизм генов воспалительного ответа, эндотелиальной дисфункции, липидного обмена и окислительного стресса у пациентов с ишемической болезнью сердца
https://doi.org/10.15829/1560-4071-2025-6366
EDN: HQIUPJ
Аннотация
Цель. Провести оценку вовлеченности однонуклеотидных полиморфных вариантов генов воспалительного ответа, эндотелиальной дисфункции, липидного обмена и окислительного стресса в развитие ишемической болезни сердца (ИБС).
Материал и методы. В исследование включено 560 человек, из которых 260 пациентов с установленным диагнозом стабильная ИБС и 300 условноздоровых доноров. Выделение ДНК осуществляли из периферической крови по стандартному протоколу. Генотипирование 42 полиморфных вариантов проводили методом полимеразной цепной реакции в режиме реального времени. Сывороточные уровни исследуемых белков определяли методом твердофазного иммуноферментного анализа коммерческими наборами.
Результаты. Развитие ИБС ассоциировано с полиморфными вариантами rs3093077 гена CRP, rs1799983 гена NOS3 и rs5370 гена EDN, rs1205 гена CRP и rs1137100 гена LEPR, rs16944 гена IL1B. Установлено, что 2 гаплотипа rs16944A-rs1205T-rs3093077C-rs5370G-rs1799983G-rs1137100A (р=0,04) и rs16944A-rs1205T-rs3093077C-rs5370G-rs1799983Т-rs1137100A (р=0,032) обладают выраженной взаимосвязью с предрасположенностью к развитию ИБС. Выявлено, что носители аллеля А варианта rs3093077 гена CRP характеризовались более высокими значениями концентрации С-реактивного белка в сыворотке.
Заключение. Таким образом, проведённое исследование демонстрирует значительный вклад полиморфных вариантов генов воспалительного ответа (IL1B rs16944, CRP rs1205 и CRP rs3093077), эндотелиальной дисфункции (EDN rs5370 и NOS3 rs1799983) и липидного обмена (LEPR rs1137100) в формирование предрасположенности к развитию ИБС.
Ключевые слова
Для цитирования:
Хуторная М.В., Синицкая А.В., Хрячкова О.Н., Поддубняк А.О., Асанов М.А., Клюева А.А., Синицкий М.Ю., Понасенко А.В., Барбараш О.Л. Полиморфизм генов воспалительного ответа, эндотелиальной дисфункции, липидного обмена и окислительного стресса у пациентов с ишемической болезнью сердца. Российский кардиологический журнал. 2025;30(10):6366. https://doi.org/10.15829/1560-4071-2025-6366. EDN: HQIUPJ
For citation:
Khutornaya M.V., Sinitskaya A.V., Khryachkova O.N., Poddubnyak A.O., Asanov M.A., Klyueva A.A., Sinitsky M.Yu., Ponasenko A.V., Barbarash O.L. Polymorphisms of genes related to inflammatory response, endothelial dysfunction, lipid metabolism, and oxidative stress in patients with coronary artery disease. Russian Journal of Cardiology. 2025;30(10):6366. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6366. EDN: HQIUPJ
Ишемическая болезнь сердца (ИБС), являющаяся многофакторным заболеванием со значительным вкладом генетической составляющей — одна из ведущих патологий сердечно-сосудистого континуума во всем мире [1]. Известно, что основной патогенетической причиной развития ИБС является атеросклероз, характеризующийся хроническим воспалением, а также накоплением липидов в сосудистой стенке [2]. Наряду с традиционными факторами риска, такими как курение, диабет, гиперхолестеринемия и артериальная гипертензия, установлено, что вклад наследуемости в развитие ИБС составляет от 40 до 60% [3][4]. На сегодняшний день, благодаря проведенным полногеномным ассоциативным исследованиям (Genome-Wide Association Studies — GWAS) продемонстрировано, что с ИБС связано ~396 однонуклеотидных полиморфизмов. Среди ключевых генов можно отметить такие как APOA5, PCSK9, GUCY1A1, NOS3, ANGPTL4, LDL-R, APOC3, LPL и LPA, участвующие в регуляции уровня липидов, воспаления, сосудистого гомеостаза и артериального давления [5].
Повышенный уровень холестерина в крови, в частности, липопротеинов низкой плотности, является одним из ключевых факторов риска ИБС. Практически 20% полиморфных вариантов, ассоциированных с риском развития данной патологии, расположены вблизи последовательностей генов, участвующих в регуляции липидного обмена [5]. В последнее десятилетие отдельное внимание уделяется также роли иммунитета и воспаления в патогенезе ИБС, что стало особенно актуальным после проведения исследования CANTOS, которое продемонстрировало эффективность противовоспалительной терапии канакинумабом при лечении патологий сердечно-сосудистой системы [6]. В ряде исследований также установлены ассоциативные связи генов IL1, IL6 и IL17 с повышенным риском развития ИБС [7][8].
Известно, что развитию атеросклероза и его осложнений предшествует эндотелиальная дисфункция, характеризующаяся дисбалансом в продукции молекул монооксида азота (NO), которые вырабатываются эндотелием сосудов, результатом чего является нарушение вазодилататорной реакции и приобретение эндотелием протромботического и провоспалительного фенотипа [9]. Таким образом, современные исследования сосредоточены на поиске новых маркеров и разработке терапевтических подходов, которые будут направлены на профилактику эндотелиальной дисфункции, что позволит снизить риск развития атеросклероза и связанных с ним осложнений, в т.ч. ИБС. Целью исследования явилась оценка вовлеченности однонуклеотидных полиморфных вариантов генов воспалительного ответа, эндотелиальной дисфункции, липидного обмена и окислительного стресса в развитие ИБС.
Материал и методы
В ретроспективное одноцентровое исследование включено 260 пациентов с установленным диагнозом стабильная ИБС (209 мужчин и 51 женщина) и 300 условно-здоровых доноров (110 мужчин и 190 женщин). Диагноз ИБС установлен в соответствии с национальными рекомендациями Всероссийского научного общества кардиологов по диагностике и лечению стабильной стенокардии, а также подтвержден клиническими, анамнестическими и инструментальными методами (коронарография, стеноз коронарных артерий >50%) исследования. В группу контроля включались участники без какой-либо сердечно-сосудистой патологии. Медиана возраста условно здоровых доноров составила 53 (21;80) года. Полная клиническая характеристика исследуемых пациентов с ИБС представлена в таблице 1. Исследование одобрено локальным этическим комитетом НИИ КПССЗ (г. Кемерово) и выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации.
Таблица 1
Клинико-анамнестические данные группы наблюдения
|
Характеристики |
Общая выборка (n=260) |
|
|
Мужчины, n (%) |
209 (80,4) |
|
|
Возраст, лет, Me (Q1;Q3) |
59 (54;65) |
|
|
Оперированные в возрасте старше 60 лет, n (%) |
119 (45,8) |
|
|
Оперированные в возрасте ≤60 лет, n (%) |
141 (54,2) |
|
|
Безболевая ишемия миокарда, n (%) |
22 (8,46) |
|
|
Стенокардия, n (%) |
ФК I |
2 (0,77) |
|
ФК II |
105 (40,38) |
|
|
ФК III |
123 (47,31) |
|
|
ФК IV |
8 (3,08) |
|
|
Хроническая сердечная недостаточность, n (%) |
ФК I |
48 |
|
ФК II |
200 |
|
|
ФК III |
12 |
|
|
Длительность ишемической болезни сердца, Me (Q1;Q3) |
3 (1;8) |
|
|
Постинфарктный кардиосклероз, n (%) |
183 (70,38) |
|
|
Изолированное поражение коронарных артерий, n (%) |
89 (34,23) |
|
|
Хроническая ишемия нижних конечностей, n (%) |
103 (39,62) |
|
|
Мультифокальный атеросклероз, n (%) |
177 (68,08) |
|
|
Хроническая ишемия головного мозга, n (%) |
149 (57,31) |
|
|
ОНМК/транзиторная ишемическая атака по ишемическому типу, n (%) |
20 (7,69) |
|
|
Стенозы брахиоцефальных артерий 50% и более, n (%) |
67 (25,77) |
|
|
АГ, n (%) |
248 (95,38) |
|
|
Длительность АГ, Me (Q1;Q3) |
10 (4;20) |
|
|
Фибрилляция предсердий, n (%) |
26 (10,00) |
|
|
Желудочковая экстрасистолия, n (%) |
50 (19,23) |
|
|
Сахарный диабет 2, n (%) |
39 (15,0) |
|
|
Нарушение толерантности к глюкозе, n (%) |
37 (14,23) |
|
|
Дислипидемия, n (%) |
137 (52,69) |
|
|
Индекс атерогенности, Me (Q1;Q3) |
4,09 (2,78;5,31) |
|
|
EuroScore, баллы |
2 (1;3) |
|
Сокращения: АГ — артериальная гипертензия, ОНМК — острое нарушение мозгового кровообращения, ФК — функциональный класс.
Материалом для исследования послужила периферическая кровь, собранная из локтевой вены в пробирки, содержащие К3ЭДТА (для молекулярно-генетического анализа) и активатор свертывания (для иммуноферментного анализа).
Сывороточные уровни интерлейкина-1b (IL1b) (кат. номер BMS224-3, Thermo Scientific), CRP (кат. номер BMS288INST, Thermo Scientific), эндотелиальной синтазы азота (eNOS) (кат. номер DY950-05, RnD Systems), Endothelin-1 (кат. номер DET100, RnD Systems) определяли методом твердофазного иммуноферментного анализа коммерческими наборами в соответствии с протоколами производителей. Детекцию результатов проводили на спектрофотометре Multiskan Sky (Thermo Scientific, США).
Геномную ДНК выделяли методом фенол-хлороформной экстракции. Качество и количество полученных образцов оценивали на приборе NanoDrop 2000 (Thermo Scientific, США). Для исследования отобрано 42 полиморфных варианта 24 генов кандидатов, представленных в таблице 2. Генотипирование проводили методом полимеразной цепной реакции в режиме реального времени по технологии TaqMan на приборе Viia 7 (Applied Biosystems, США).
Таблица 2
Полиморфные варианты исследуемых генов
|
Ген |
Полиморфизм |
Белок |
|
Воспалительный ответ |
||
|
IL1b |
rs1143634 |
Interleukin-1 beta |
|
rs16944 |
||
|
IL6 |
rs1554606 |
Interleukin-6 |
|
rs1800796 |
||
|
rs2069827 |
||
|
IL6R |
rs2228145 |
Interleukin-6 receptor subunit alpha |
|
rs2229238 |
||
|
IL8 |
rs4073 |
Interleukin-8 |
|
rs2227306 |
||
|
IL10 |
rs1800871 |
Interleukin-10 |
|
rs1800872 |
||
|
rs1800896 |
||
|
IL12B |
rs3212227 |
Interleukin-12 subunit beta |
|
IL12RB1 |
rs375947 |
Interleukin-12 receptor subunit beta-1 |
|
TNF |
rs1799964 |
Tumor necrosis factor |
|
rs361525 |
||
|
rs1800629 |
||
|
CRP |
rs1205 |
C-reactive protein |
|
rs1130864 |
||
|
rs3093077 |
||
|
Эндотелиальная дисфункция |
||
|
SELE |
rs5361 |
E-selectin |
|
rs1805193 |
||
|
SELP |
rs6136 |
P-selectin |
|
SELPLG |
rs2228315 |
P-selectin glycoprotein ligand 1 |
|
EDN1 |
rs3087459 |
Endothelin-1 |
|
rs5370 |
||
|
NOS3 |
rs2070744 |
Nitric oxide synthase 3 |
|
rs1799983 |
||
|
Липидный обмен |
||
|
APOE |
rs429358 |
Apolipoprotein E |
|
rs769452 |
||
|
rs7412 |
||
|
APOB |
rs1042031 |
Apolipoprotein B-100 |
|
rs6725189 |
||
|
LPA |
rs10455872 |
Apolipoprotein(a) |
|
LIPC |
rs1800588 |
Hepatic triacylglycerol lipase |
|
INS |
rs689 |
Insulin |
|
IGF1R |
rs2229765 |
Insulin-like growth factor 1 receptor |
|
LEP |
rs7799039 |
Leptin |
|
LEPR |
rs1137101 |
Leptin receptor |
|
rs1137100 |
||
|
Окислительный стресс |
||
|
CAT |
rs1001179 |
Catalase |
|
SOD2 |
rs4880 |
Superoxide dismutase |
Результаты, полученные в ходе исследования, обрабатывали с использованием программы GraphPad Prism 8 (GraphPad Software, США). Нормальность распределения оценивали с помощью критерия Колмогорова-Смирнова. Количественные данные представляли в виде медианы (Me) и квартилей (Q1; Q3). Для сравнения значений признака в двух или более группах использовали критерии Манна-Уитни или Краскела-Уоллиса, соответственно. Статистический анализ результатов генотипирования осуществляли посредством онлайн-программы SNPstats (http://bioinfo.iconcologia.net/SNPstats). Анализ межгенных взаимодействий проводили в программе MDR v.3.0.2. Результаты считали статистически значимыми при p<0,05.
Результаты
Для всех полиморфных вариантов генов, включённых в исследование, распределение частот генотипов не имело отклонений от равновесия Харди-Вайнберга. Статистически значимые ассоциации полиморфных вариантов генов с предрасположенностью к развитию ИБС получены только для шести аллельных вариантов, представленных в таблице 3. Установлено, что носительство редкого аллеля как в гомозиготном, так и в гетерозиготном варианте генотипа по полиморфным вариантам rs3093077-А гена CRP, rs1799983-Т гена NOS3 и rs5370-Т гена EDN ассоциировано с развитием ИБС. Также определено, что гомозиготные генотипы T/T rs1205 гена CRP (p=0,043) и G/G rs1137100 гена LEPR (p=0,037) статистически значимо ассоциированы с развитием ИБС по рецессивной модели наследования, а генотипы A/G и A/A rs16944 гена IL1B по доминантной модели наследования.
Таблица 3
Анализ ассоциаций исследуемых полиморфных вариантов генов с риском развития ИБС
|
Локус |
Модели |
ОШ (95% ДИ) |
p |
|
IL1B rs16944 |
Доминантная (G/G vs A/G-A/A) |
1,62 (1,14-2,30) |
0,0072 |
|
Рецессивная (G/G-A/G vs A/A) |
1,27 (0,77-2,09) |
0,35 |
|
|
Аддитивная (A/G vs A/A vs G/G) |
1,37 (1,06-1,78) |
0,015 |
|
|
CRP rs1205 |
Доминантная (C/C vs C/T-T/T) |
1,16 (0,82-1,65) |
0,39 |
|
Рецессивная (C/C-C/T vs T/T) |
1,64 (1,01-2,65) |
0,043 |
|
|
Аддитивная (C/T vs C/C vs T/T) |
1,23 (0,96-1,58) |
0,096 |
|
|
CRP rs3093077 |
Доминантная (C/C vs A/C-A/A) |
8,04 (5,29-12,23) |
<0,0001 |
|
Рецессивная (C/C-A/C vs A/A) |
17,02 (2,22-130,32) |
<0,0001 |
|
|
Аддитивная (A/C vs C/C vs A/A) |
7,20 (4,79-10,81) |
<0,0001 |
|
|
EDN rs5370 |
Доминантная (G/G vs G/T-T/T) |
1,94 (1,36-2,77) |
0,0003 |
|
Рецессивная (G/G-G/T vs T/T) |
0,98 (0,43-2,22) |
0,0001 |
|
|
Аддитивная (G/T vs G/G vs T/T) |
1,58 (1,17-2,13) |
0,0025 |
|
|
NOS3 rs1799983 |
Доминантная (G/G vs T/G-T/T) |
2,23 (1,59-3,13) |
<0,0001 |
|
Рецессивная (G/G-T/G vs T/T) |
3,18 (1,83-5,53) |
<0,0001 |
|
|
Аддитивная (T/G vs G/G vs T/T) |
1,99 (1,54-2,56) |
<0,0001 |
|
|
LEPR rs1137100 |
Доминантная (A/A vs A/G-G/G) |
0,97 (0,69-1,35) |
0,83 |
|
Рецессивная (A/A-A/G vs G/G) |
1,94 (1,03-3,65) |
0,037 |
|
|
Аддитивная (A/G vs A/A vs G/G) |
1,10 (0,85-1,43) |
0,47 |
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов.
При анализе гаплотипов исследуемых генов установлено, что 2 гаплотипа rs16944A-rs1205T-rs3093077C-rs5370G-rs1799983G-rs1137100A (р=0,04) и rs16944A-rs1205T-rs3093077C-rs5370G-rs1799983Т-rs1137100A (р=0,032) показали выраженную взаимосвязь с предрасположенностью к развитию ИБС (табл. 4).
Таблица 4
Анализ ассоциаций гаплотипов с риском развития ИБС
|
IL1B rs16944 |
CRP rs1205 |
CRP rs3093077 |
EDN rs5370 |
NOS3 rs1799983 |
LEPR rs1137100 |
ОШ (95% ДИ) |
p |
|
|
1 |
A |
T |
C |
G |
G |
A |
2,84 (1,05-7,67) |
0,04 |
|
2 |
A |
T |
C |
G |
T |
A |
4,61 (1,14-18,62) |
0,032 |
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов.
С использованием программы MDR 3.0.2 установлено 3 наиболее значимые модели межгенных взаимодействий (одна двухлокусная, одна четырехлокусная и одна шестилокусная) (табл. 5). На рисунке 1 представлен граф межгенных взаимодействий, визуализирующий их характер. Показано, что наибольший вклад в развитие ИБС вносят полиморфные варианты rs3093077 гена CRP (14,94%) и rs1799983 гена NOS3 (4,05%). Для следующих пар полиморфных вариантов генов характерен выраженный антагонистический эффект (линии синего цвета): rs1799983 (NOS3) — rs16944 (IL1B) (-2,35% энтропии); rs1799983 (NOS3) — rs3093077 (CRP) (-1,52% энтропии); rs1799983 (NOS3) — rs5370 (EDN) (-2,35% энтропии); rs5370 (EDN) — rs16944 (IL1B) (-1,50% энтропии); rs5370 (EDN) — rs3093077 (CRP) (-2,45% энтропии). Для полиморфизмов rs1205 гена CRP и rs1137100 гена LEPR (0,74% энтропии) показан умеренно выраженный синергический эффект (линии оранжевого цвета).
Таблица 5
Модели межлокусного взаимодействия полиморфных вариантов исследуемых генов
|
Модель |
Bal. Acc. Tr. |
Bal. Acc. Test. |
Se. |
Sp. |
Cons. |
Pre. |
|
CRP rs3093077 — NOS3 rs1799983 |
0,73 |
0,73 |
0,65 |
0,82 |
10/10 |
0,76 |
|
IL1B rs16944 — CRP rs3093077 — EDN rs5370 — NOS3 rs1799983 |
0,76 |
0,73 |
0,70 |
0,81 |
10/10 |
0,76 |
|
IL1B rs16944 — CRP rs1205 — CRP rs3093077 — EDN rs5370 — NOS3 rs1799983 — LEPR rs1137100 |
0,84 |
0,69 |
0,82 |
0,85 |
10/10 |
0,83 |
Сокращения: Cons. — повторяемость результата, Pre. — точность модели, Se. — чувствительность, Sp. — специфичность, Bal. Acc. Test. — тестируемая сбалансированная точность, Bal. Acc. Tr. — тренировочная сбалансированная точность.
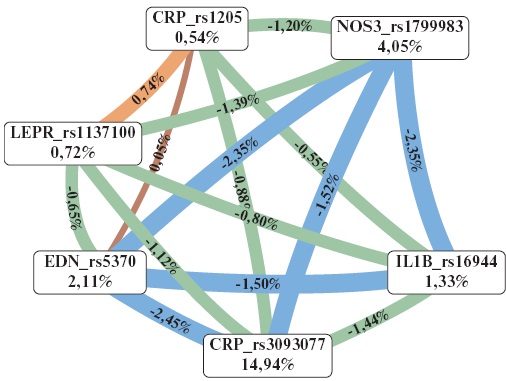
Рис. 1. Граф межгенных взаимодействий полиморфных вариантов генов IL1B, СRP, EDN, NOS3 и LEPR.
Примечание: характер взаимодействия при формировании фенотипа характеризуется цветом линии: синий — выраженный антагонизм, зеленый — умеренный антагонизм, оранжевый — умеренный синергизм, коричневый — аддитивное взаимодействие. Сила и направленность взаимодействия выражены в % энтропии.
Цветное изображение доступно в электронной версии журнала.
Следующим этапом исследования стало изучение взаимосвязи сывороточных уровней белков IL1b, CRP, eNOS и эндотелина-1 с полиморфными вариантами генов IL1B, СRP, EDN и NOS3. Сравнительный анализ позволил установить единственную ассоциацию для полиморфного варианта rs3093077 гена CRP. Выявлено, что носители аллеля А варианта rs3093077 гена CRP характеризовались более высокими значениями концентрации С-реактивного белка (СРБ) в сыворотке (табл. 6).
Таблица 6
Сывороточные уровни исследуемых белков в зависимости от генотипов
|
Белок |
Полиморфный вариант/генотипы |
p |
||
|
IL1B rs16944 |
||||
|
IL1b, пг/мл |
G/G |
A/G |
A/A |
0,927 |
|
2,03 (1,96-2,24) |
2,07 (1,95-2,26) |
2,00 (1,88-2,23) |
||
|
CRP rs1205 |
||||
|
CRP, пг/мл |
C/C |
C/T |
T/T |
0,946 |
|
13,40 (5,20-19,90) |
8,84 (5,76-23,40) |
9,47 (4,00-37,05) |
||
|
CRP rs3093077 |
||||
|
CRP, пг/мл |
C/C |
A/C |
A/A |
0,015 |
|
7,10 (3,48-15,38) |
17,70 (9,47-29,10) |
11,65 (2,69-15,95) |
||
|
NOS3 rs1799983 |
||||
|
eNOS, пг/мл |
T/T |
T/G |
G/G |
0,435 |
|
123,50 (70,49-179,40) |
107,70 (60,53-144,60) |
103,90 (53,74-150,80) |
||
|
Эндотелин-1, пг/мл |
G/G |
G/T |
T/T |
0,288 |
|
1,63 (1,34-2,21) |
1,62 (1,32-2,07) |
1,27 (1,16-1,77) |
||
Обсуждение
Риск развития ИБС зависит от комплекса взаимовлияющих традиционных факторов риска и генетической составляющей. Проведенные на сегодняшний день генетические исследования демонстрируют вовлеченность в патогенез ИБС генов, регулирующих липидный и углеводные обмены, функцию эндотелия (поддержание сосудистого гомеостаза), участвующих в поддержании системы коагуляции и иммунной системы [10]. Воспаление играет важную роль на каждом этапе прогрессирования ИБС, начиная от эндотелиальной дисфункции и заканчивая развитием острых коронарных событий, и является одним из ключевых факторов патогенеза данного заболевания [11]. Согласно литературе, показана взаимосвязь сывороточных концентраций провоспалительных цитокинов, а также ассоциации некоторых однонуклеотидных полиморфных вариантов генов, ответственных за воспалительный ответ, с риском развития ИБС, однако имеющиеся данные носят противоречивый характер [12]. В нашем исследовании выявлено три полиморфных варианта, увеличивающих риск развития ИБС в среднем в два раза: IL1B rs16944, CRP rs1205 и CRP rs3093077. IL1b — провоспалительный цитокин, регулирующий множество физиологических сигналов, которые являются ключевыми составляющими воспалительных реакций [13]. Продемонстрировано, что IL1b занимает одно из ключевых мест в атерогенезе и прогрессировании ИБС [14]. Ген IL1B, кодирующий белок IL1b, располагается в регионе 2q14.1. Наиболее изучаемыми полиморфными вариантами данного региона являются варианты rs16944 и rs1143634, влияющие на экспрессию мРНК и белка [15]. В нашем исследовании проанализированы оба аллельных варианта, однако только для полиморфизма rs16944 получены статистически значимые ассоциации с риском ИБС. Данные литературы демонстрируют наличие ассоциаций варианта rs16944 с такими заболеваниями, как рак легких, ревматоидный артрит, инфаркт миокарда и ИБС [16]. Кроме провоспалительных цитокинов, также отмечена роль острофазного СРБ, вырабатываемого гепатоцитами и эндотелиальными клетками под воздействием интерлейкина-6, IL1b и фактора некроза опухоли, в патогенезе сердечно-сосудистых катастроф, в т.ч. и ИБС [17]. В исследованиях отмечается, что повышение уровня СРБ в сыворотке крови может быть ассоциировано с определенной комбинацией генотипов полиморфных вариантов гена CRP [18]. Стоит отметить, что в нашем исследовании уровни сывороточного СРБ были связаны с генотипами полиморфного варианта rs3093077 гена CRP, однако для полиморфизма rs1205 этого же гена подобной закономерности получено не было.
Нарушение баланса между выделяемыми вазоконстрикторами и вазодилататорами, в первую очередь за счет нарушения метаболизма NO и снижения его биодоступности, может быть причиной дисфункции эндотелия [19]. Установлено, что аллельные варианты гена, кодирующего eNOS, ассоциированы с развитием ИБС и ее клиническими проявлениями, однако данные исследователей противоречивы [20]. Так, для полиморфных вариантов rs1799983 и rs2070744 гена NOS3 не установлено ассоциаций со стабильной стенокардией, а также с острым коронарным синдромом [21][22]. Полиморфный вариант rs1799983 гена NOS3 располагается в 7 экзоне и приводит к замене в 894 позиции гуанина на тимин. Исследования демонстрируют, что наличие аллеля Т связано со снижем уровня экспрессии гена NOS3, что, в свою очередь, приводит к снижению его вазопротекторного действия и повреждению эндотелия [20]. Нами также выявлен рисковый эффект аллеля Т в отношении развития ИБС, однако не было установлено ассоциаций между сывороточными уровнями eNOS и носительством рисковых генотипов полиморфизма rs1799983 гена NOS3. В противоположность NO, эндотелин-1 является одним из важнейших вазоконстрикторов. Его функция также заключается в поддержании сосудистого гомеостаза, а повышенная экспрессия данного белка может быть ассоциирована с нарушением гомеостатического баланса, что впоследствии способно приводить к неблагоприятным патологическим событиям [23]. Литературные данные демонстрируют, что полиморфные варианты гена EDN, кодирующего эндотелин-1, ассоциированы с развитием ИБС в различных популяциях [24-26]. Нами выявлен аллель Т, рисковый эффект которого реализован через гомозиготный генотип Т/Т, увеличивающий риск развития ИБС в 2 раза.
Помимо воспаления и эндотелиальной дисфункции, еще одним не менее важным звеном патогенеза ИБС является нарушение липидного обмена, характеризующееся отложением холестерина и атерогенных липопротеинов в сосудистой стенке [27]. Исследования последних лет показали, что уровень холестерина и липопротеинов низкой плотности напрямую коррелируют с тяжестью ИБС [28]. В нашем исследовании мы провели сравнительной анализ четырех генов, вовлеченных в липидный обмен (APOE, APOB, LPA и LIPC), а также генов, которые также могут быть связаны с метаболизмом липидов (INS, LEP и LEPR), и выявили только одну ассоциацию с риском развития ИБС для полиморфного варианта rs1137100 гена LEPR, кодирующего рецептор лептин. Лептин — плейотропный гормон, секретируемый адипоцитами и участвующий во многих биологических процессах, таких как воспаление, иммунный ответ, ангиогенез, поддержание сосудистого гомеостаза [29]. Увеличение уровня лептина в сыворотке крови (гиперлептинемия) ассоциировано с сердечной недостаточностью, инфарктом миокарда, гипертонией и ИБС [29][30]. Реализация биологического эффекта лептина происходит при связывании последнего с его специфическими рецепторами, которые распространены в центральной нервной системе и периферических органах и тканях [31]. Ген LEPR располагается в регионе 1p31.3 и состоит из 20 экзонов и 19 интронов [32]. Полиморфизм rs1137100 гена LEPR способен влиять на функциональную активность рецептора лептина, изменяя его связывающую способность и передачу сигнала.
Ограничения исследования. Несмотря на проведение исследования в соответствии со стандартами надлежащей клинической практики, в проведенном исследовании имеется ряд ограничений: одноцентровость и ограниченность выборки, отсутствие средних популяционных значений для сывороточного содержания исследуемых маркеров, отсутствие на данном этапе исследования данных обследования лиц из группы контроля.
Заключение
Таким образом, проведённое исследование демонстрирует значительный вклад полиморфных вариантов генов воспалительного ответа (IL1B rs16944, CRP rs1205 и CRP rs3093077), эндотелиальной дисфункции (EDN rs5370 и NOS3 rs1799983) и липидного обмена (LEPR rs1137100) в формирование предрасположенности к развитию ИБС.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Song Y, Li S, He C. PPARγ Gene polymorphisms, metabolic disorders, and coronary artery disease. Frontiers in Cardiovascular Medicine. 2022;9:808929. doi:10.3389/fcvm.2022.808929.
2. Sakkers TR, Mokry M, Civelek M, et al. Sex differences in the genetic and molecular mechanisms of coronary artery disease. Atherosclerosis. 2023;384:117279. doi:10.1016/j.atherosclerosis.2023.117279.
3. Riveros-Mckay F, Weale ME, Moore R, et al. Integrated Polygenic Tool Substantially Enhances Coronary Artery Disease Prediction. Circ Genom Precis Med. 2021;14(4):e000085. doi:10.1161/CIRCGEN.120.003304.
4. Samani NJ, Erdmann J, Hall AS, et al. Genomewide association analysis of coronary artery disease. New England Journal of Medicine. 2007;357(5):443-53. doi:10.1056/NEJMoa072366.
5. Wang H, Liu Z, Shao J, et al. Pathogenesis of premature coronary artery disease: Focus on risk factors and genetic variants. Genes & Diseases. 2020;9(2):370-80. doi:10.1016/j.gendis.2020.11.003.
6. Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377(12):1119-31. doi:10.1056/NEJMoa1707914.
7. Ghaznavi H, Soltanpour MS. Association study between rs2275913 genetic polymorphism and serum levels of IL 17A with risk of coronary artery disease. Molecular biology research communications. 2020;9(1):35-40. doi:10.22099/mbrc.2020.35442.1463.
8. Yao H, Pang Y, Chen Y, et al. Association between interleukin 6 gene polymorphism and severity of coronary artery disease in patients with diabetes. Diabetes, Metabolic Syndrome and Obesity. 2023;16:3599-608. doi:10.2147/DMSO.S427873.
9. Medina-Leyte DJ, Zepeda-García O, Domínguez-Pérez M, et al. Endothelial Dysfunction, Inflammation and Coronary Artery Disease: Potential Biomarkers and Promising Therapeutical Approaches. Int. J. Mol. Sci. 2021;22(8):3850. doi:10.3390/ijms22083850.
10. Malinowski D, Bochniak O, Luterek-Puszyńska K, et al. Genetic Risk Factors Related to Coronary Artery Disease and Role of Transforming Growth Factor Beta 1 Polymorphisms. Genes. 2023;14(7):1425. doi:10.3390/genes14071425.
11. Rafaqat S, Azam A, Hafeez R, et al. Role of interleukins in the pathogenesis of coronary heart disease: A literature review. World J Cardiol. 2025;17(3):103947. doi:10.4330/wjc.v17.i3.103947.
12. Grira N, Lahidheb D, Lamine O, et al. The Association of IL 6, TNFα and CRP Gene Polymorphisms with Coronary Artery Disease in a Tunisian Population: A Case-Control study. Biochem Genet. 2021;59(3):751-66. doi:10.1007/s10528-021-10035-0.
13. Fang Y, Xie H, Lin Z. Association between IL 1P +3954C/T polymorphism and myocardial infarction risk. A meta-analysis. Medicine. 2018;97(20):11645. doi:101097/md.0000000000011645.
14. Николаева А.М., Бабушкина Н.П., Рябов В.В. Некоторые про- и противовоспалительные цитокины, полиморфные варианты их генов и постинфарктное ремоделирование сердца. Российский кардиологический журнал. 2020;25(10):4007. doi:10.15829/1560-4071-2020-4007. EDN: LCCDHZ.
15. Yang B, Zhao H, Bin X, et al. Influence of interleukin 1 beta gene polymorphisms on the risk of myocardial infarction and ischemic stroke at young age in vivo and vitro. International Journal of Clinical and Experimental Pathology. 2015;8(11):13806-13. doi:10.1161/01.atv.0000150039.60906.02.
16. Mooney RE, Linden GJ, Winning L, et al. Association of TGFB1 rs1800469 and BCMO1 rs6564851 with coronary heart disease and IL1B rs16944 with all-cause mortality in men from the Northern Ireland PRIME study. PLoS One. 2022;17(8):e0273333. doi:10.1371/journal.pone.0273333.
17. Luo S, Zhang J, Li B, et al. Predictive value of baseline C-reactive protein level in patients with stable coronary artery disease: a meta-analysis. Medicine. 2022;101(35):e30285. doi:10.1097/MD.0000000000030331.
18. Amezcua-Castillo E, González-Pacheco H, Sáenz-San Martín A, et al. C-Reactive Protein: The Quintessential Marker of Systemic Inflammation in Coronary Artery Disease-Advancing toward Precision Medicine. Biomedicines. 2023;11(9):2444. doi:10.3390/biomedicines11092444.
19. Богданов Л.А., Кошелев В.А., Мухамадияров Р.А. и др. Современные подходы к идентификации клеточных маркеров дисфункции эндотелия. Комплексные проблемы сердечно-сосудистых заболеваний. 2024;13(3S):191-207. doi:10.17802/2306-1278-2024-13-3S-191-207.
20. Severino P, D’Amato A, Prosperi S, et al. Potential Role of eNOS Genetic Variants in Ischemic Heart Disease Susceptibility and Clinical Presentation. J. Cardiovasc. Dev. Dis. 2021;8(9):116. doi:10.3390/jcdd8090116.
21. Pawlik A, Błaszczyk H, Rać M, et al. NOS3 Gene rs1799983 and rs2070744 Polymorphisms in Patients with Unstable Angina. J Vasc Res. 2020;57(3):136-42. doi:10.1159/000506160.
22. Vargas-Alarcon G, Vallejo M, Posadas-Romero C, et al. The –974C>A (rs3087459) gene polymorphism in the endothelin gene (EDN1) is associated with risk of developing acute coronary syndrome in Mexican patients. Gene. 2014;542(2):258-62. doi:10.1016/j.gene.2013.09.003.
23. Gupta A. An Overview of Gene Variants of Endothelin 1: A Critical Regulator of Endothelial Dysfunction. In: Abukabda A, Fonner C. eds. Endothelial Dysfunction — A Novel Paradigm. 2023. ISBN: 978-1-80356-627-6.
24. Iwanicki T, Iwanicka J, Jarosz A, et al. Association between rs5370 and rs9349379 polymorphisms and coronary artery disease in Polish population. Pomeranian Journal of Life Sciences. 2022;68(4):67-72. doi:10.21164/pomjlifesci.846.
25. Nawaz SK, Yousaf M, Rani A, et al. Endothelin 1 gene variant rs5370 and risk of coronary artery disease in the local population of Pakistan, a case-control study. Pure and Applied Biology (PAB). 2021;10(4):1427-35. doi:10.19045/bspab.2021.100148.
26. Tu G, Fang Z, Zhao Y, et al. Association of +138I/D and Lys198Asn Polymorphisms in the Endothelin 1 Gene with Early Onset of Coronary Artery Disease among the Chinese Han Population. Med Sci Monit. 2020;26:e921542. doi:10.12659/MSM.921542.
27. Lazarenko V, Churilin M, Azarova I, et al. Comprehensive Statistical and Bioinformatics Analysis in the Deciphering of Putative Mechanisms by Which Lipid-Associated GWAS Loci Contribute to Coronary Artery Disease. Biomedicines. 2022;10(2):259. doi:10.3390/biomedicines10020259.
28. Jin JL, Zhang HW, Cao YX, et al. Association of small dense low-density lipoprotein with cardiovascular outcome in patients with coronary artery disease and diabetes: a prospective, observational cohort study. Cardiovascular diabetology. 2020;19(1):45. doi:10.1186/s12933-020-01015-6.
29. Raman P, Khanal S. Leptin in Atherosclerosis: Focus on Macrophages, Endothelial and Smooth Muscle Cells. Int. J. Mol. Sci. 2021;22(11):5446. doi:10.3390/ijms22115446.
30. Chen MC, Wang JH, Lee CJ, et al. Association between hyperleptinemia and cardiovascular outcomes in patients with coronary artery disease. Ther. Clin. Risk Manag. 2018;14:1855-62. doi:10.2147/TCRM.S172231.
31. Горбатовская Е.Е., Белик Е.В., Дылева Ю.А. и др. Изменение экспрессии изоформ LEPR в локальных жировых депо при коронарном атеросклерозе и приобретенных пороках сердца. Российский кардиологический журнал. 2024;29(8):5826. doi:10.15829/1560-4071-2024-5826. EDN: RUVAOW.
32. Veerabathiran R, P A, Bk I, et al. Genetic predisposition of LEPR (rs1137101) gene polymorphism related to type 2 diabetes mellitus–a meta-analysis. Annals of Medicine. 2023;55(2):2302520. doi:10.1080/07853890.2024.2302520.
Об авторах
М. В. ХуторнаяРоссия
Хуторная Мария Владимировна — к.б.н., н.с. лаборатории геномной медицины отдела экспериментальной медицины
бульвар имени академика Л.С. Барбараша, стр. 6, Кемерово, 650002
А. В. Синицкая
Россия
Синицкая Анна Викторовна — к.б.н., с.н.с. лаборатории геномной медицины отдела экспериментальной медицины
бульвар имени академика Л.С. Барбараша, стр. 6, Кемерово, 650002
О. Н. Хрячкова
Россия
Хрячкова Оксана Николаевна — к.б.н., н.с. лаборатории геномной медицины отдела экспериментальной медицины
бульвар имени академика Л.С. Барбараша, стр. 6, Кемерово, 650002
А. О. Поддубняк
Россия
Поддубняк Алена Олеговна — лаборант-исследователь лаборатории геномной медицины отдела экспериментальной медицины
бульвар имени академика Л.С. Барбараша, стр. 6, Кемерово, 650002
М. А. Асанов
Россия
Асанов Максим Айдарович — м.н.с. лаборатории геномной медицины отдела экспериментальной медицины
бульвар имени академика Л.С. Барбараша, стр. 6, Кемерово, 650002
А. А. Клюева
Россия
Клюева Анастасия Александровна — м.н.с. лаборатории геномной медицины отдела экспериментальной медицины
бульвар имени академика Л.С. Барбараша, стр. 6, Кемерово, 650002
М. Ю. Синицкий
Россия
Синицкий Максим Юрьевич — зав. лабораторией геномной медицины отдела экспериментальной медицины
бульвар имени академика Л.С. Барбараша, стр. 6, Кемерово, 650002
А. В. Понасенко
Россия
Понасенко Анастасия Валериевна — зам. директора по научной работе
ул. Чистова, д.3, корп. 1, Москва
О. Л. Барбараш
Россия
Барбараш Ольга Леонидовна — академик РАН, д.м.н., профессор, директор
бульвар имени академика Л.С. Барбараша, стр. 6, Кемерово, 650002
Дополнительные файлы
- Риск развития ишемической болезни сердца (ИБС) ассоциирован с полиморфными вариантами генов rs3093077 CRP, rs1799983 NOS3, rs5370 EDN, rs1137100 LEPR, rs16944 IL1B.
- Выявлено два гаплотипа, которые обладают выраженной взаимосвязью с предрасположенностью к развитию ИБС.
- Полиморфизм rs3093077 гена CRP ассоциирован с более высокими значениями концентрации С-реактивного белка в сыворотке пациентов с ИБС.
Рецензия
Для цитирования:
Хуторная М.В., Синицкая А.В., Хрячкова О.Н., Поддубняк А.О., Асанов М.А., Клюева А.А., Синицкий М.Ю., Понасенко А.В., Барбараш О.Л. Полиморфизм генов воспалительного ответа, эндотелиальной дисфункции, липидного обмена и окислительного стресса у пациентов с ишемической болезнью сердца. Российский кардиологический журнал. 2025;30(10):6366. https://doi.org/10.15829/1560-4071-2025-6366. EDN: HQIUPJ
For citation:
Khutornaya M.V., Sinitskaya A.V., Khryachkova O.N., Poddubnyak A.O., Asanov M.A., Klyueva A.A., Sinitsky M.Yu., Ponasenko A.V., Barbarash O.L. Polymorphisms of genes related to inflammatory response, endothelial dysfunction, lipid metabolism, and oxidative stress in patients with coronary artery disease. Russian Journal of Cardiology. 2025;30(10):6366. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6366. EDN: HQIUPJ

















































