Перейти к:
Анализ предикторов артериальной гипертензии с использованием многофакторных моделей через призму процессов старения
https://doi.org/10.15829/1560-4071-2025-6546
EDN: DQQEZL
Аннотация
Цель. Выявить независимые генетические и негенетические предикторы развития артериальной гипертензии (АГ) и ранжировать их вклад в развитие заболевания, а также обозначить потенциально новые механизмы, которые могут влиять на развитие АГ.
Материал и методы. В одномоментное обсервационное исследование были включены 610 пациентов, из них 142 пациента с АГ. Всем участникам было проведено анкетирование, измерение артериального давления, биометрических показателей, молекулярно-генетическое тестирование. Выявление предикторов АГ проведено построением моделей логистических регрессий. С помощью однофакторных моделей определяли отдельные предикторы, ассоциированные с риском развития АГ. Из совокупности ковариат с достигнутым уровнем значимости p<0,3 в однофакторных моделях была построена модель многофакторной логистической регрессии для ранжирования вклада каждого признака в развитие АГ.
Результаты. На основе негенетических и генетических маркеров построена математическая модель, позволяющая оценить риск АГ, с лучшей классификацией лиц с низким генетическим риском развития АГ. Именно генетические предикторы были более значимы для оптимальных расчетов вероятности АГ в модели логистической регрессии, тогда как негенетические признаки в итоговую модель не вошли. Рассмотрены возможные механизмы, которые могут приводить к развитию АГ, на основании выявленных генетических предикторов, а также рассматривается концепция вклада протективной комбинации генетических вариантов.
Заключение. Для выявления лиц с низким риском АГ оптимально использование модели логистической регрессии, основанной на результатах молекулярногенетического тестирования. Таким образом, для пациентов с низким генетическим риском более значимыми являются факторы, связанные с образом жизни, и для них особенно важна его коррекция с целью профилактики развития АГ.
Ключевые слова
Для цитирования:
Зеленская Е.М., Панарина А.Я., Лукинов В.Л., Слепухина А.А., Лифшиц Г.И. Анализ предикторов артериальной гипертензии с использованием многофакторных моделей через призму процессов старения. Российский кардиологический журнал. 2025;30(10):6546. https://doi.org/10.15829/1560-4071-2025-6546. EDN: DQQEZL
For citation:
Zelenskaya E.M., Panarina A.Ya., Lukinov V.L., Slepukhina A.A., Lifshits G.I. Analysis of hypertension predictors using multivariate models through the lens of aging processes. Russian Journal of Cardiology. 2025;30(10):6546. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6546. EDN: DQQEZL
Артериальная гипертензия (АГ) — одно из самых распространенных заболеваний, связанных со старением. Пожилые пациенты с АГ часто имеют повышенный риск сердечно-сосудистых осложнений, также АГ связана с ухудшением когнитивных функций [1]. В нашем исследовании мы стремились выявить основные факторы, влияющие на развитие АГ, используя модели логистической регрессии. Были проанализированы генетические и негенетические маркеры, ассоциированные в литературе с различными процессами старения [2], классически не связанными с повышением артериального давления (АД). Таким образом, мы ожидали выявить новые механизмы и процессы, которые независимо ассоциированы с развитием АГ.
Материал и методы
В одномоментное обсервационное исследование были включены 610 человек (из них 225 мужчин). 142 (23,3%) человека имели АГ. Критериями включения явились наличие информированного согласия на участие в исследовании, возраст старше 18 лет, наличие образца буккального эпителия для выделения генетического материала, наличие данных биометрических показателей: АД, рост, вес, индекс массы тела (ИМТ), окружность талии и бедер, заполнение данных анкеты (Приложение 1). Критерии исключения: отсутствие хотя бы одного из критериев включения в исследование. Ответы на вопросы анкеты не были валидированы. В ходе исследования всем участникам было проведено измерение АД на правой руке в сидячем положении после 5 минут отдыха, с использованием осциллометрического автоматического тонометра OMRON. Среднее значение АД рассчитывалось на основе трех измерений. Интервал между измерениями составлял 2 минуты. АГ диагностировалась при систолическом АД (САД) ≥140 мм рт.ст. и/или диастолическом АД (ДАД) ≥90 мм рт.ст., согласно рекомендациям, или при приеме антигипертензивных препаратов последние 2 нед. Также у всех участников измерялась частота сердечных сокращений, рост, вес, ИМТ, окружность талии и бедер.
Всем пациентам проводилось фармакогенетическое тестирование на базе Лаборатории фармакогеномики Института химической биологии и фундаментальной медицины СО РАН. Выделение ДНК проводилось из лейкоцитов цельной крови с помощью набора лабораторных реагентов для выделения "ДНК-ЭКСТРАН-1" (ЗАО "Синтол", Россия). Выделенная ДНК хранилась при температуре -80 °C. Определение аллелей проводилось методом полимеразной цепной реакции в реальном времени (Real-Time PCR) на приборе Real-Time CFX96 Touch (Bio-Rad Laboratories, Inc., США).
Был проведен анализ, включающий различные методы проверки и фильтрации данных, чтобы обеспечить достоверность результатов. Выявление предикторов АГ проводили построением моделей логистических регрессий. С помощью однофакторных моделей определяли отдельные предикторы, ассоциированные с риском развития АГ. Из совокупности ковариат с достигнутым в однофакторных моделях уровнем значимости p<0,3 методами прямого и обратного шага строили оптимальные по информационному критерию Акаике модели многофакторной логистической регрессии. Все модели прямого и обратного шага совпали. Для многофакторной модели логистической регрессии методами ROC-анализа выявляли наилучший с точки зрения отношения чувствительности и специфичности порог классификации, строили таблицу соответствия (сопряженности), по которой рассчитывали прогностические показатели: чувствительность, специфичность, частоту случаев метода, фактическую частоту случаев. Тестом Hosmer-Lemeshow исследовали согласованность прогностических частот откалиброванной модели с фактическими частотами негативных событий.
Проверку статистических гипотез проводили при критическом уровне значимости р=0,05, т.е. различия считали статистически значимыми при p<0,05.
Все статистические расчеты выполняли в программе R-Studio (версия 2022.07.2+576 Spotted Wakerobin, США) на языке R (версия 4.1.3, Австрия).
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом ИХБФМ СО РАН от 23.08.2022. До включения в исследование у всех участников было получено письменное информированное согласие.
Результаты
Представленность АГ у участников исследования с учетом пола и возраста соответствовала таковой в исследовании ЭССЕ-РФ [3]. Описательная статистика исследуемых предикторов, продемонстрировавших статистическую значимость, представлена в Приложении 2.
Для определения предикторов АГ использован метод логистической регрессии для однофакторной и многофакторной моделей (Приложение 3). Путем построения однофакторных моделей логистической регрессии выявлены отдельные значимые предикторы гипертонической болезни (ГБ) у всех пациентов. Из совокупности ковариат с достигнутым уровнем значимости p<0,3 в однофакторных моделях была построена модель многофакторной логистической регрессии. Для многофакторной прямой и обратной модели с помощью ROC-анализа были определены наилучшие показатели чувствительности — 71,8% и специфичности — 86,3% для порогового значения вероятности ГБ =23,8% [4]. Таким образом, y пациентов, у которых рассчитанная по формуле модели вероятность АГ превышала 23,8%, прогнозировали развитие АГ.
При однофакторном анализе в нашем исследовании была показана статистически значимая ассоциация АГ и таких негенетических факторов, как САД >122,5 мм рт.ст., ДАД >83,8 мм рт.ст., ИМТ >27,7 кг/м², индекс талии/бедер >0,88, отягощенный наследственный анамнез по сердечно-сосудистым заболеваниям, присутствие в анамнезе атеросклероза любой локализации, общий холестерин ≥5,2 ммоль/л, мужской пол, отягощенный наследственный анамнез по метаболическому синдрому (p<0,001 для каждого из показателей), а также некоторых других, в т.ч. генетических маркеров: GC rs2282679 (р=0,014), VDR rs2228570 (р=0,034), CFH rs1061170 (р=0,035) (см. Приложение 2).
Однако при многофакторном анализе наилучшие чувствительность и специфичность показала совокупность только генетических факторов.
Формула многофакторной модели АГ у всех пациентов представлена в общем виде в Приложении 4 и в виде таблицы (табл. 1).
Таблица 1
Генетические маркеры возраст-зависимых заболеваний, ассоциированные с АГ
|
N |
Ген |
Локус |
Сравниваемые генотипы |
Коэффициент бета |
Функция аллеля |
|
1 |
EDN1 |
rs5370 |
T/T против G/T+G/G |
+2,2 |
аллель риска |
|
2 |
CAT |
rs1001179 |
G/G против A/G+A/A |
+1,8 |
аллель риска |
|
3 |
FOXO1A |
rs4943794 |
C/C против G/G+C/G |
+1,8 |
аллель риска |
|
4 |
CFB |
rs4151667 |
T/T против A/T+A/A |
+1,6 |
аллель риска |
|
5 |
CYBA |
rs4673 |
T/T против C/T+C/C |
+1,3 |
аллель риска |
|
6 |
TERC |
rs12696304 |
C/G против C/C+G/G |
+1,2 |
аллель риска |
|
7 |
TSLP |
rs1837253 |
T/T против C/C+C/T |
+1,1 |
аллель риска |
|
8 |
CFH |
rs1061170 |
C/C против T/T+C/T |
+0,9 |
аллель риска |
|
9 |
DPP4 |
rs6741949 |
C/G против G/G+C/C |
+0,9 |
аллель риска |
|
10 |
GC |
rs2282679 |
A/A против A/C+C/С |
-1,0 |
протективный аллель |
|
11 |
VDR |
rs2228570 |
C/C против C/T+T/T |
-1,1 |
протективный аллель |
|
12 |
BCMO1 |
rs7501331 |
C/T против C/C+T/T |
-1,1 |
протективный аллель |
|
13 |
SLC23A1 |
rs33972313 |
G/G против A/G+A/A |
-1,6 |
протективный аллель |
|
14 |
AGTR1 |
rs5186 |
C/C против A/A+A/C |
-2,9 |
протективный аллель |
|
15 |
CEPT |
rs5882 |
G/G против A/A+A/G |
-17,8 |
протективный аллель |
Для исследования прогностических свойств многофакторной модели АГ составлена таблица соответствия (табл. 2) и рассчитаны прогностические показатели. Суммарное количество пациентов в многофакторной модели — 610, случаев 142 (23,3%). Полученный уровень значимости теста Hosmer-Lemeshow (p=0,1345027) свидетельствует о согласованности прогностических частот откалиброванной модели с фактическими частотами возникновения АГ. Комплексная метрика (AUC=85,7) демонстрирует очень хорошее качество классификации модели (рис. 1).
Таблица 2
Таблица сопряженности многофакторной модели риска развития АГ
|
Прогноз |
Исход |
Всего |
|
|
"+" |
"-" |
||
|
"+" |
28 |
27 |
55 |
|
"-" |
11 |
170 |
181 |
|
Всего |
39 |
197 |
236 |
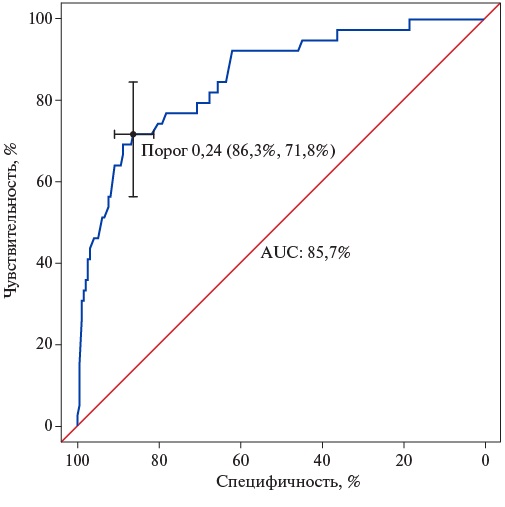
Рис. 1. Чувствительность, специфичность и порог многофакторной предиктивной модели АГ.
Обсуждение
При однофакторном анализе мы получили стандартные факторы риска АГ, такие как ИМТ >27,7 кг/м², индекс талии/бедер >0,88, отягощенный наследственный анамнез по сердечно-сосудистым заболеваниям, присутствие в анамнезе атеросклероза любой локализации, общий холестерин ≥5,2 ммоль/л, мужской пол, отягощенный наследственный анамнез по метаболическому синдрому, что соответствует современным представлениям о факторах риска ГБ [2]. Стоит отметить, что с наличием диагноза "гипертоническая болезнь" коррелировали довольно низкие, практически целевые уровни САД и ДАД (>122,5 мм рт.ст. и >83,8 мм рт.ст., соответственно), что, возможно, объясняется приемом пациентами регулярной гипотензивной терапии.
Также статистически значимую ассоциацию с АГ в однофакторном анализе показали такие генетические факторы, как генотип АА гена GC rs2282679, генотип СС гена VDR rs2228570 и генотип СС гена CFH rs1061170.
В результате исследования была получена математическая модель логистической регрессии, все значимые предикторы — полиморфизмы генов. В отличие от большинства исследований, где генетические маркеры, включенные в модель, ассоциированы только с АГ [5], мы проанализировали пул маркеров, которые использовались для оценки связи с распространенными возраст-зависимыми заболеваниями и сосудистым старением [1]. В данной работе мы преследовали цель потенциально обозначить те механизмы, которые сочетаются как независимые факторы и могут влиять на развитие АГ. Поэтому преимущество генетических факторов в модели можно расценивать как более точную замену других негенетических факторов, которые обычно присутствуют в моделях, например, такие как возраст, ИМТ, индекс талии/бедер и др. Так как мы использовали не коррелирующие предикторы, ожидалось, что ковариаты, вошедшие в модель, могут отображать укрупненные биологические процессы. Кроме привычных генов, ассоциированных в литературе с АГ (например, EDN1, AGTR1), в генетическую модель вошли и другие генетические маркеры, ассоциированные ранее с другими возраст-ассоциированными заболеваниями.
Следующие гены показали свой независимый вклад в модель, прогнозирующую вероятность возникновения АГ.
Ген EDN1 кодирует белок эндотелин-1. Эндотелин-1 в низких концентрациях взаимодействует с рецептором ETВ на поверхности эндотелия, что запускает каскад реакций, приводящих к вазодилатации. В более высоких концентрациях эндотелин-1 взаимодействует также с рецепторами ETA, что в итоге приводит к вазоконстрикции за счет высвобождения кальция в гладких мышцах сосудистой стенки. Также эндотелин-1 обладает митогенным действием на клетки гладких мышц сосудов и миоциты, что может приводить к утолщению стенки сосудов и ремоделированию сердца. Наличие гомозиготы Т/Т в локусе rs5370 гена EDN1 было ассоциировано с повышением риска АГ, что согласуется с данными литературы [6].
Ген CAT кодирует фермент каталазу, расщепляющую пероксид водорода на воду и кислород [7]. Наличие гомозиготы G/G в локусе rs1001179, располагающемся в промоторной области гена, статистически значимо повышало вероятность риска развития АГ в нашем исследовании
Ген FOXO1A кодирует белок семейства FoxO транскрипционный фактор, который запускает сигнальную последовательность, приводящую к выделению инсулин/инсулиноподобного гормона роста, играет роль в регуляции оксидативного стресса, апоптоза, аутофагии, клеточного цикла и в митогенезе. Согласно данным литературы, в периоды зрелости и старости происходит снижение числа носителей генотипа FOXO1A G/G в локусе rs4943794 (отношение шансов =0,984, P=0,004), а среди женщин, достигших возраста 90 лет, реже встречался генотип С/С, чем в общей популяции (отношение шансов =0,772, P=0,028) [8]. В нашем исследовании наличие гомозиготы С/С FOXO1A rs4943794 было ассоциировано с повышением риска развития АГ.
Ген CFB кодирует фактор комплемента B. Он относится к ранним факторам системы комплемента и обладает протеолитической активностью. Избыточная активация фактора комплемента В за счет наличия аллеля А в rs4151667 приводит к усилению иммунного воспаления за счет увеличения количества белка. В результате между сетчаткой и мембраной Бруха скапливаются друзы — желтоватые кристаллы, в состав которых входят белки системы комплемента [9]. Носительство гомозиготного генотипа ТТ CFB rs4151667 было ассоциировано в нашем исследовании с увеличением риска АГ.
Ген CYBA кодирует бета-субъединицу NADPH-оксидазу (NOX) — клеточного мембрано-связанного мультимолекулярного ферментного комплекса, локализующегося на плазматической мембране и в некоторых органеллах. Особенно обогащены этим ферментом фагоцитарные клетки, такие как макрофаги. Эти оксидазы участвуют в клеточной противомикробной защитной системе, а также в клеточной пролиферации, дифференцировке и регуляции экспрессии генов. В литературе наличие генотипа ТТ в локусе CYBA rs4673 было ассоциировано с повышением продукции свободных радикалов нейтрофилами, повышением риска ишемической болезни сердца, сахарного диабета 2 типа в сочетании с другими факторами риска [10]. В нашем исследовании также выявлена ассоциация генотипа ТТ CYBA rs4673 с повышением риска АГ.
Ген TERC кофактор в работе теломеразы — последовательность РНК в составе рибонуклеопротеида-теломеразы, обеспечивающей поддержание длины теломер хромосом. Было показано, что более короткая средняя теломер хромосом лейкоцитов связана с риском развития ряда возрастных заболеваний и предлагается как маркер биологического старения. В литературе наличие генотипа GG TERC rs12696304 было ассоциировано с склонностью к укорочению теломер и более раннему старению [11]. В нашем исследовании наличие гетерозиготы СG TERC rs12696304 было ассоциировано с повышением риска АГ.
Ген TSLP кодирует тимический стромальный лимфопоэтин — белок, принадлежащий к семейству цитокинов, который играет важную роль в созревании популяций Т-клеток за счет активации антигенпредставляющих клеток и привлекает лимфоциты в легочную ткань. Возможно, участвует в ремоделировании бронхов. Наличие хотя бы одного аллеля Т TSLP rs1837253 было ассоциировано со снижением риска развития бронхиальной астмы во взрослом возрасте по данным литературы [12]. Наличие гомозиготы ТТ TSLP rs1837253 в нашем исследовании повышало риск развития АГ.
Ген CFH кодирует фактор комплемента Н (Complement Factor H), известный как бета-1Н-белок — сывороточный гликопротеин из суперсемейства регуляторных белков системы комплемента. Этот участок входит в состав сайта связывания CFH с С-реактивным белком — белком острой фазы воспаления. Генотип С/С rs1061170 ассоциирован с повышенным уровнем С-реактивного белка в сосудистой оболочке глаза, что может провоцировать хроническое воспаление и развитие макулярной дегенерации. Исследования показали, что неизмененный вариант фактора Н (кодируется аллелем Т) позволяет лучше и эффективнее удалять продукты распада клеток, уменьшать воспаление и защищать от развития патологии [9]. В этом исследовании наличие генотипа С/С rs1061170 ассоциировано с повышенным риском развития АГ.
Ген DPP4 кодирует фермент дипептидилпептидазу-4 — мембранный фермент, экспрессирующийся на поверхности большинства клеток организма, в т.ч. на нейронах. Участвует в иммунной регуляции и в апоптозе. Является внутримембранным гликопротеином и сериновой экзопептидазой, которая расщепляет пептидную связь в дипептиде X-пролин от N-конца полипептидов и белков. По данным литературы, у носителей хотя бы одного аллеля С DPP4 rs6741949 повышен риск быстрого снижения массы гиппокампа после 70 лет, что является признаком старения нервной системы и может привести к развитию болезни Альцгеймера [13]. В нашем исследовании генотип СG DPP4 rs6741949 обладал небольшим протективным действием и был ассоциирован со снижением риска развития АГ.
VDR — ген рецептора к витамину D. Через взаимодействие с рецептором витамин D индуцирует синтез остеокальцина — основного неколлагенового белка костной ткани. Однонуклеотидные замены в rs2228570 VDR снижают афинность рецептора к витамину D. Наличие хотя бы одного аллеля Т в rs2228570 VDR ассоциировано со снижением плотности кости, эффект выражен сильнее у носителей гомозиготного варианта Т/Т [14]. В этом исследовании наличие генотипа GG было ассоциировано с некоторым снижением риска АГ.
Ген BCMO1 кодирует бетакаротенмонооксигеназу-1, которая осуществляет превращение пищевых β-каротинов в ретиналь (провитамин А). Полиморфизмы в этом гене ассоциированы со сниженной скоростью метаболизма ретиноидов и как следствие со сниженным уровнем витамина А. Является фактором риска повышения окислительного потенциала клетки (возникновения оксидативного стресса). По данным исследований, наличие хотя бы одного аллеля Т rs7501331 гена BCMO1 приводит к уменьшению преобразования β-каротина в ретинол [15]. В нашем исследовании гетерозиготный генотип СТ был ассоциирован со снижением риска АГ, в отличие от гомозиготных вариантов СС и ТТ. Возможно, что вклад генотипа ТТ не показал своей протективной значимости в отношении ГБ из-за небольшого количества таких образцов в нашей выборке.
Ген GC кодирует белок, который принадлежит к семейству генов альбумина. Это многофункциональный белок, обнаруженный в плазме, асцитической жидкости, цереброспинальной жидкости и на поверхности многих типов клеток. Он связывается с витамином D и его метаболитами в плазме и переносит их в целевые ткани. Мутация в гене ассоциирована со снижением концентрации витамина D [16]. В этой работе выявлен вклад генотипа А/А rs2282679 в снижение риска АГ.
Ген SLC23A1 кодирует белок-транспортер витамина С в эпителиальных клетках кишечника. Полиморфизм ассоциирован со сниженным уровнем витамина С в сыворотке крови, поскольку наличие хотя бы одного минорного аллеля Т в гене SLC23A1 rs33972313 приводит к снижению специфичности белка, что приводит к снижению эффективности транспорта витамина С в клетку [17]. В нашем исследовании генотип GG был ассоциирован со снижением риска АГ.
Ген AGTR1 кодирует белок — рецептор к ангиотензину II 1 типа. В нашей работе выявлен протективный вклад генотипа С/С rs5186 гена AGTR1 в развитие АГ. В большинстве научных работ носительство аллеля С rs5186 гена AGTR1 было ассоциировано с повышением риска АГ, хотя есть и единичные работы о протективном эффекте в Тайской популяции [18].
Ген CEPT — кодирует транспортер эфиров холестерина. Его функция заключается в метаболизме холестерина из липопротеидов высокой плотности в липопротеиды низкой плотности. Носители генотипа GG rs5882 гена CEPT имеют склонность к более высокому уровню липопротеидов высокой плотности, удлинению продолжительности жизни и снижению риска деменции и болезни Альцгеймера [19]. В нашем исследовании генотип GG rs5882 гена CEPT был ассоциирован со снижением риска АГ и вносил основной вклад в модель.
Заключение
В результате работы нами была создана математическая модель, способная прогнозировать повышенный риск АГ. Несмотря на то, что изначально в анализ были включены как классические негенетические, так и генетические факторы, наибольшей чувствительностью и специфичностью обладала модель, содержащая только генетические маркеры. Среди этих маркеров были как уже известные аллели, ассоциированные с повышением риска АГ, так и новые маркеры, которые не изучались ранее в связи с повышением АД и были ассоциированы в литературе с другими процессами, связанными со старением в широком смысле. Также важно отметить, что модель выявила не только рисковые факторы, но и протективные аллели, а также позволила ранжировать их вклад в развитие заболевания.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Кобалава Ж.Д., Конради А.О., Недогода С.В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(9):6117. doi:10.15829/1560-4071-2024-6117. EDN: GUEWLU.
2. Слепухина А.А., Зеленская Е.М., Лифшиц Г.И. Генетические факторы риска сосудистого старения: молекулярные механизмы, полиморфизм генов-кандидатов и генные сети. Российский кардиологический журнал. 2019;(10):78-85. doi:10.15829/1560-4071-2019-10-78-85. EDN: IORPLN.
3. Бойцов С.А., Драпкина О.М., Шляхто Е.В. и др. Исследование ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации). Десять лет спустя. Кардиоваскулярная терапия и профилактика. 2021;20(5):3007. doi:10.15829/1728-8800-2021-3007. EDN: ZPGROP.
4. Swets J. Measuring the accuracy of diagnostic systems. Science. 1988;240(4857):1285- 93. doi:10.1126/science.3287615.
5. Ковалева А.Я., Кох Н.В., Воронина Е.Н. и др. Связь генетических факторов риска с развитием артериальной гипертонии с учётом этнических различий. Российский кардиологический журнал. 2019;(10):66-71. doi:10.15829/1560-4071-2019-10-66-71. EDN: URPPTB.
6. Verweij N, Mahmud H, Leach IM, et al. Genome-wide association study on plasma levels of midregional-proadrenomedullin and C-terminal-pro-endothelin 1. Hypertension. 2013; 61(3):602-8. doi:10.1161/HYPERTENSIONAHA.111.203117.
7. Булатова И.А., Третьякова Ю.И., Щёкотов В.В. и др. Полиморфизм rs1001179 гена каталазы и оксидантный стресс у больных хроническим гепатитом С и язвенным колитом. Терапевтический архив. 2015;87(2):49-53. doi:10.17116/terarkh201587249-53.
8. Erdman, VV, Nasibullin, TR, Tuktarova, IA, et al. Analysis of FOXO1A and FOXO3A gene allele association with human longevity. Russ J Genet. 2016;52:416-22. doi:10.1134/S1022795416020034.
9. Yu Y, Bhangale TR, Fagerness J, et al. Common variants near FRK/COL10A1 and VEGFA are associated with advanced age-related macular degeneration. Hum Mol Genet. 2011;20(18):3699- 709. doi:10.1093/hmg/ddr270.
10. Stasia MJ. CYBA encoding p22(phox), the cytochrome b558 alpha polypeptide: gene structure, expression, role and physiopathology. Gene. 2016;586(1):27-35. doi:10.1016/j.gene.2016.03.050.
11. Soerensen M, Thinggaard M, Nygaard M, et al. Genetic variation in TERT and TERC and human leukocyte telomere length and longevity: a cross-sectional and longitudinal analysis. Aging Cell. 2012;(2):223-7. doi:10.1111/j.1474-9726.2011.00775.x.
12. Torgerson DG, Ampleford EJ, Chiu GY, et al. Meta-analysis of genome-wide association studies of asthma in ethnically diverse North American populations. Nat Genet. 2011;43(9):887-92. doi:10.1038/ng.888.
13. Bis JC, DeCarli C, Smith AV, et al. Common variants at 12q14 and 12q24 are associated with hippocampal volume. Nat Genet. 2012;44(5):545-51. doi:10.1038/ng.2237.
14. Moffett SP, Zmuda JM, Cauley JA, et al. Association of the VDR translation start site polymorphism and fracture risk in older women. J Bone Miner Res. 2007;(5):730-6. doi:10.1359/jbmr.070201.
15. Tourniaire F, Gouranton E, von Lintig J, et al. Вeta-сarotene conversion products and their effects on adipose tissue. Genes Nutr. 2009;3:179-87. doi:10.1007/s12263-009-0128-3.
16. Berlanga-Taylor AJ, Knight JC, et al. An integrated approach to defining genetic and environmental determinants for major clinical outcomes involving vitamin D. Mol Diagn Ther. 2014;3:261-72. doi:10.1007/s40291-014-0087-2.
17. Duell EJ, Lujan-Barroso L, Llivina C. Vitamin C transporter gene (SLC23A1 and SLC23A2) polymorphisms, plasma vitamin C levels, and gastric cancer risk in the EPIC cohort. Genes Nutr. 2013;6:549-60. doi:10.1007/s12263-013-0346-6.
18. Mottl AK, Shoham DA, North KE. Angiotensin II type 1 receptor polymorphisms and susceptibility to hypertension: a HuGE review. Genet Med. 2008;10(8):560-74. doi:10.1097/gim.0b013e3181809613.
19. Bustami J, Sukiasyan A, Kupcinskas J, et al. Cholesteryl ester transfer protein (CETP) I405V polymorphism and cardiovascular disease in eastern European Caucasians — a cross-sectional study. BMC Geriatr. 2016;16:144. doi:10.1186/s12877-016-0318 y.
Об авторах
Е. М. ЗеленскаяРоссия
М.н.с. лаборатории персонализированной медициныБУ ВО Сургутский государственный университет; аспирант кафедры кардиологии, ФГБУН Институт химической биологии и фундаментальной медицины СО РАН
проспект Ленина, д.1, Сургут, 628412, Ханты-Мансийский автономный округ — Югра,
проспект Академика Лаврентьева, д.8, Новосибирск, 630090
А. Я. Панарина
Россия
М.н.с. лаборатории персонализированной медицины, БУ ВО Сургутский государственный университет; аспирант кафедры кардиологии, ФГБУН Институт химической биологии и фундаментальной медицины СО РАН
проспект Ленина, д.1, Сургут, 628412, Ханты-Мансийский автономный округ — Югра,
проспект Академика Лаврентьева, д.8, Новосибирск, 630090
В. Л. Лукинов
Россия
В.н.с., заведующий Лаборатории численного анализа стохастических дифференциальных уравнений
проспект Академика Лаврентьева, д.6, Новосибирск, 630090
А. А. Слепухина
Россия
М.н.с. Лаборатории персонализированной медицины
проспект Академика Лаврентьева, д.8, Новосибирск, 630090
Г. И. Лифшиц
Россия
Д.м.н., г.н.с., заведующая Лабораторией персонализированной медицины
проспект Академика Лаврентьева, д.8, Новосибирск, 630090
Дополнительные файлы
- При расчете риска артериальной гипертензии при помощи однофакторного анализа наиболее статистически значимы негенетические факторы риска: высокий индекс массы тела, индекс талии/бедер >0,88, отягощенный наследственный анамнез по сердечно-сосудистым заболеваниям, атеросклероз, повышение общего холестерина, мужской пол, отягощенный наследственный анамнез по метаболическому синдрому.
- Однако при многофакторном анализе наилучшие чувствительность и специфичность показала совокупность только генетических факторов.
- Построение математической модели многофакторной логистической регрессии позволило ранжировать вклад различных генотипов в развитие артериальной гипертензии, при этом некоторые из генотипов вносили протективный вклад.
Рецензия
Для цитирования:
Зеленская Е.М., Панарина А.Я., Лукинов В.Л., Слепухина А.А., Лифшиц Г.И. Анализ предикторов артериальной гипертензии с использованием многофакторных моделей через призму процессов старения. Российский кардиологический журнал. 2025;30(10):6546. https://doi.org/10.15829/1560-4071-2025-6546. EDN: DQQEZL
For citation:
Zelenskaya E.M., Panarina A.Ya., Lukinov V.L., Slepukhina A.A., Lifshits G.I. Analysis of hypertension predictors using multivariate models through the lens of aging processes. Russian Journal of Cardiology. 2025;30(10):6546. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6546. EDN: DQQEZL

















































