КАРДИОХИРУРГИЯ
- Транскатетерная имплантация аортального клапана (TAVR) доказала свою эффективность как альтернатива хирургическому протезированию аортального клапана, особенно, для пациентов с высоким и умеренным хирургическим риском.
- Долгосрочные результаты TAVR, особенно, для молодых пациентов, остаются ограниченными. Долговечность клапанов и выживаемость требуют дальнейших исследований, особенно, в группах с низким хирургическим риском.
- Исследования, такие как PARTNER 3, имеют ограничения в экстраполяции результатов на молодых пациентов. В реальной практике пациенты и врачи чаще выбирают TAVR, несмотря на недостаток долгосрочных данных.
В последние десятилетия транскатетерная имплантация аортального клапана (TAVR) стала революционным методом лечения тяжелого аортального стеноза, особенно, для пациентов высокого хирургического риска. Исследования, такие как PARTNER и SURTAVI, подтвердили сопоставимость или превосходство TAVR по сравнению с хирургическим протезированием аортального клапана в различных категориях риска. Новейшие технологии, включая системы клапанов третьего поколения, улучшили долговечность и снизили осложнения, в частности, развитие параклапанной регургитации. Однако данные о долгосрочной выживаемости остаются ограниченными, особенно, для молодых пациентов и групп с анатомическими особенностями. Рекомендации международных ассоциаций уже давно отдают предпочтение TAVR для пожилых пациентов, тогда как для более молодых пациентов с низким хирургическим риском хирургическое вмешательство остаётся приоритетным. Тем не менее последний пункт все чаще подвергается сомнению. Статья анализирует ключевые исследования, обсуждает текущие ограничения и подчеркивает необходимость долгосрочных данных для информирования клинической практики. В заключение, TAVR — это выдающееся достижение в интервенционной кардиологии, но его оптимальное применение требует учета индивидуальных факторов пациента.
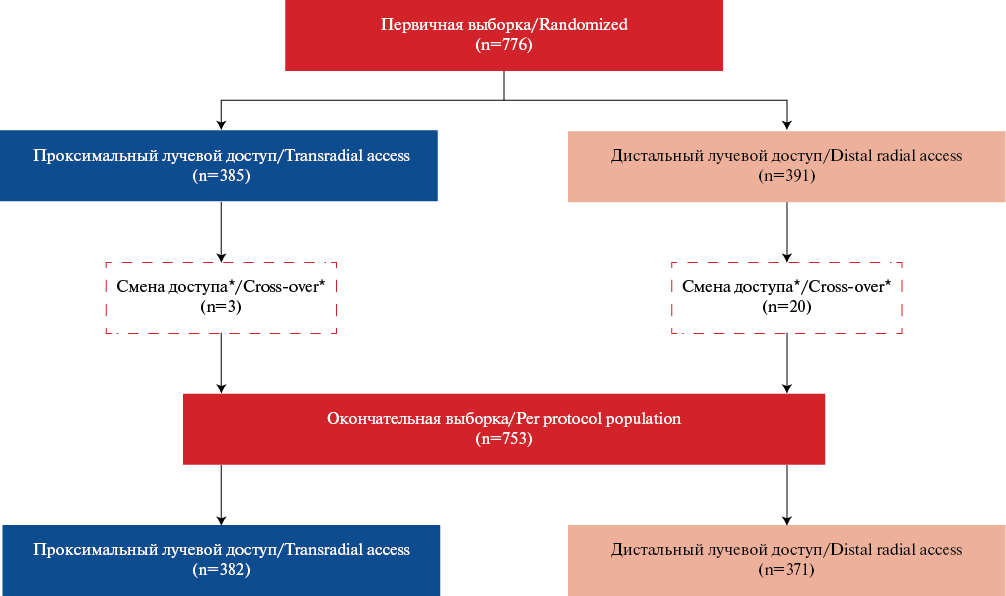
- Впервые представлены среднесрочные результаты (3 мес.) проспективного рандомизированного исследования применения дистального лучевого доступа в сравнении с классическим лучевым доступом при лечебных и диагностических вмешательствах на коронарных сосудах.
- Выявлено статистически значимое меньшее количество окклюзий лучевой артерии при проведении интервенционных процедур через дистальный лучевой доступ, а также случаи окклюзии дистальной части лучевой артерии на тыльной поверхности кисти при проходимой собственно лучевой артерии предплечья.
Цель. Оценить непосредственные и среднесрочные (3 мес.) результаты безопасности и эффективности дистального лучевого доступа (ДЛД) при интервенционных коронарных вмешательствах в сравнении с проксимальным лучевым доступом (ПЛД).
Материал и методы. Проведен анализ 776 пациентов проспективного рандомизированного исследования TENDERA: группа ДЛД — 391, и группа ПЛД — 385. После исключения пациентов с неудавшимся первичным доступом размер первичных выборок уменьшился, ДЛД — 371, ПЛД — 382. Статистически чаще смена доступа была в группе ДЛД (5,1% и 0,8%, p<0,001). Первичная конечная точка — непосредственный (госпитальный) или поздний тромбоз/ окклюзия лучевой артерии (ЛА). Вторичные конечные точки: 1 — композитная из осложнений со стороны артерии доступа; 2 — параметры доступа.
Результаты. Получены статистически значимые различия по первичной конечной точке: ДЛД 2,7% (n=10), ПЛД 6,8% (n=26), p=0,008. Окклюзия дистальной ЛА, при проходимой ЛА: ДЛД 1,3% (n=5), ПЛД 0 (0), p=0,023. Во вторичной композитной точке получены статистически значимые различия по следующим группам осложнений: кровотечение BARC тип I (ДЛД: 3,8% (n=14), ПЛД: 21,7% (n=83), p<0,001); гематома >5 см на 1 сут. (ДЛД: 10% (n=37), ПЛД: 25,9% (n=98), p<0,001); гематома >5 см на 7 сут. (ДЛД: 12,4% (n=45), ПЛД: 34,6% (n=132), p<0,001). Из параметров доступа статистически значимо различались: время пункции ДЛД 19,0 (8,0; 50), ПЛД 13,5 (5,0; 29), p<0,001; установка интродьюсера ДЛД 42,0 (26,0; 84,0), ПЛД 35,0 (23,0; 55,0), p<0,001, продолжительность гемостаза артерии доступа (мин): ДЛД 180,0 (120,0; 480,0), ПЛД 155,0 (115,0; 195,0), p<0,001. Продолжительность процедуры и флюороскопии, доза радиации, спазм ЛА в обеих группах не имели статистически значимых различий.
Заключение. В исследовании TENDERA ДЛД показал эффективность и безопасность при интервенционных коронарных вмешательствах в сравнении с ПЛД в среднесрочном периоде наблюдения: статистически значимая меньшая частота окклюзий ЛА и местных осложнений.
- Накопление хирургического опыта, активное внедрение пациент-ориентированных методик имплантации транскатетерных биопротезов аортального клапана, а также оптимизация послеоперационного ведения больных, позволили достичь высоких показателей технического успеха процедуры транскатетерной имплантации аортального клапана.
- Представленный отечественный опыт транскатетерной имплантации аортального клапана по поводу выраженного аортального стеноза у 500 пациентов демонстрирует оптимальные отдаленные результаты в отношении общей выживаемости, сердечно-сосудистой смерти, имплантации постоянного электрокардиостимулятора и репротезирования.
Цель. Оценить отдаленные исходы транскатетерной имплантации аортального клапана, включая общую выживаемость, свободу от смерти от сердечно-сосудистых причин, имплантации постоянного электрокардиостимулятора и репротезирования.
Материал и методы. В ретроспективное обсервационное исследование были включены 535 пациентов, перенесших процедуру транскатетерной имплантации аортального клапана в период с апреля 2015г по январь 2024г. Из анализа были исключены пациенты, перенесшие транскатетерную имплантацию аортального клапана по поводу умеренного стеноза или выраженной недостаточности аортального клапана (35 пациентов). Таким образом, в итоговый анализ было включено 500 пациентов. Лица мужского пола составили 40,8%. Большинство пациентов имели промежуточный хирургический риск по шкале EuroSCORE II (5,2%), а также низкий хирургический риск по шкале STS-PROM (2,9%). Медиана периода наблюдения составила 2,2 (0,6;4,1) года.
Результаты. Общая выживаемость пациентов составила 94%, 88%, 86% и 58% через 1, 3, 5 и 8 лет, соответственно. Свобода от сердечно-сосудистой смерти составила 97%, 90%, 78% и 61% через 1, 3, 5 и 8 лет, соответственно. Кумулятивная свобода от имплантации постоянного электрокардиостимулятора за весь период наблюдения составила 89,4%, репротезирования — 98,8%. Факторами, влияющими на частоту смерти от всех причин в отдаленном периоде, были мужской пол, курение, онкопатология и индексированная масса миокарда левого желудочка. Eдинственным независимым предиктором сердечно-сосудистой смерти было значение хирургического риска STS-PROM.
Заключение. Наш опыт демонстрирует удовлетворительные отдаленные результаты транскатетерной имплантации аортального клапана у пациентов с выраженным аортальным стенозом в отношении общей выживаемости, сердечно-сосудистой смерти, имплантации постоянного электрокардиостимулятора и репротезирования. Независимыми предикторами смерти от всех причин были мужской пол, курение, онкопатология и индексированная масса миокарда левого желудочка. Единственным независимым предиктором сердечно-сосудистой смерти в отдаленном периоде был хирургический риск по шкале STS-PROM.
- Сочетание операции AVNeo с аортокоронарным шунтированием является перспективной процедурой: не требует применения расходных материалов, таких как искусственные протезы с каркасом, сохраняет естественную работу кольца в сердечном цикле, тем самым, приводит к отличным гемодинамическим показателям и обеспечивает реваскуляризацию миокарда при сопутствующем поражении коронарных артерий.
Цель. Оценить непосредственные результаты процедуры Ozaki у больных с коронарным шунтированием (КШ).
Материал и методы. В ретроспективное исследование включено 416 пациентов, оперированных в ФГБУ "ФЦССХ" Министерства Здравоохранения России (г. Пенза). Больные были разделены на две группы. В первой группе 139 пациентов, которым проводилась процедура AVNeo сочетано с КШ. Вторая группа включила 277 пациентов, которым изолированно была проведена процедура AVNeo.
Результаты. Медиана времени искусственного кровообращения и ишемии миокарда в группе с AVNeo+КШ составила 146 (134-165) и 115 (104-125), соответственно, в группе с AVNeo — 117 (102-136) и 96 (82-109), соответственно. Средний градиент давления на аортальном клапане сразу после операции в группе AVNeo+КШ 5,9±3,3; в группе AVNeo — 6,4±3,1. Летальность в группе AVNeo+КШ составила 2,8% (4 больных), в группе AVNeo 0,3% (1 больной). Выживаемость на госпитальном этапе в группе AVNeo+КШ составила 97,1%; в группе AVNeo 99,6%. В группе AVNeo+КШ причинами летального исхода служили: в двух случаях периоперационный инфаркт миокарда, в одном случае пневмония и еще в одном случае полиорганная недостаточность. В группе AVNeo причиной единственного летального исхода была полиорганная недостаточность. Выявлен только один предиктор госпитальной летальности — рестернотомия по поводу кровотечения. В случае рестернотомии риск летального исхода на госпитальном этапе повышается в 1,3 раза на каждый день послеоперационного периода. Время искусственного кровообращения, инфаркт миокарда, длительность операции не влияют на летальность. Сочетание AVNeo с КШ также не оказывает влияние на госпитальную летальность (p=0,1).
Заключение. Сочетание операции AVNeo с КШ — эффективная и безопасная процедура в непосредственные сроки наблюдения.
- Нозокомиальная пневмония (НП) является наиболее частым инфекционным осложнением раннего послеоперационного периода у кардиохирургических пациентов.
- Развитие НП сопровождается увеличением рисков неблагоприятного клинического исхода и возрастанием экономических затрат.
- Наиболее значимыми факторами риска развития НП у современной когорты кардиохирургических пациентов являются наличие фибрилляции предсердий до операции, продолжительность искусственного кровообращения ≥96 мин и искусственной вентиляции легких ≥14 ч.
Цель. Изучить распространенность и факторы риска развития нозокомиальной пневмонии (НП) после кардиохирургических операций, выполненных в условиях искусственного кровообращения (ИК), на современной когорте пациентов.
Материал и методы. Проведен ретроспективный анализ историй болезни пациентов отделения сердечно-сосудистой хирургии, прооперированных в период с 01.01.2022 по 31.12.2022. В исследование последовательно включили 417 пациентов, которым выполнено кардиохирургическое вмешательство в условиях ИК. Оценивали частоту и сроки развития НП. Изучили влияние основных демографических, клинических, периоперационных факторов на риск ее развития.
Результаты. Частота пневмонии в группе за год составила 27,6%, в т.ч. после операции Frozen Elephant Trunk (FET) — 32%, после коронарного шунтирования (КШ) — 29,5%, после сочетанной операции КШ и вмешательства на сердечном клапане 26,2%, изолированной коррекции клапанного порока — 25,9%, после протезирования грудного отдела аорты по методике Hemiarch — 19,5%. Пневмония развивалась на 4,6±2,9 сут. после оперативного вмешательства. Риск развития пневмонии возрастал при наличии фибрилляции предсердий (ФП) до операции (отношение шансов (ОШ) 3,17; 95% доверительный интервал (ДИ): 1,67; 6,02, p=0,0002), длительности ИК (ОШ 1,01; 95% ДИ: 1,00; 1,01; p=0,0006), пережатия аорты (ОШ 1,01; 95% ДИ: 1,00; 1,01; p=0,0002) и искусственной вентиляции легких (ИВЛ) (ОШ 1,03; 95% ДИ: 1,01; 1,05; p=0,005). Предикторами развития пневмонии служили длительность ИК ≥96 мин (чувствительность 67,7%, специфичность 64,6%, AUC=0,681, p=0,0006) и ИВЛ ≥14 ч (чувствительность 63,1%, специфичность 69,3%, AUC=0,641, p=0,005), а также наличие ФП до операции (чувствительность 61%, специфичность 75%, p=0,0002).
Заключение. ФП до операции, длительность ИК ≥96 мин и ИВЛ ≥14 ч служат категориальными и количественными предикторами развития НП в послеоперационном периоде у современной когорты пациентов.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА, ИНФАРКТ МИОКАРДА
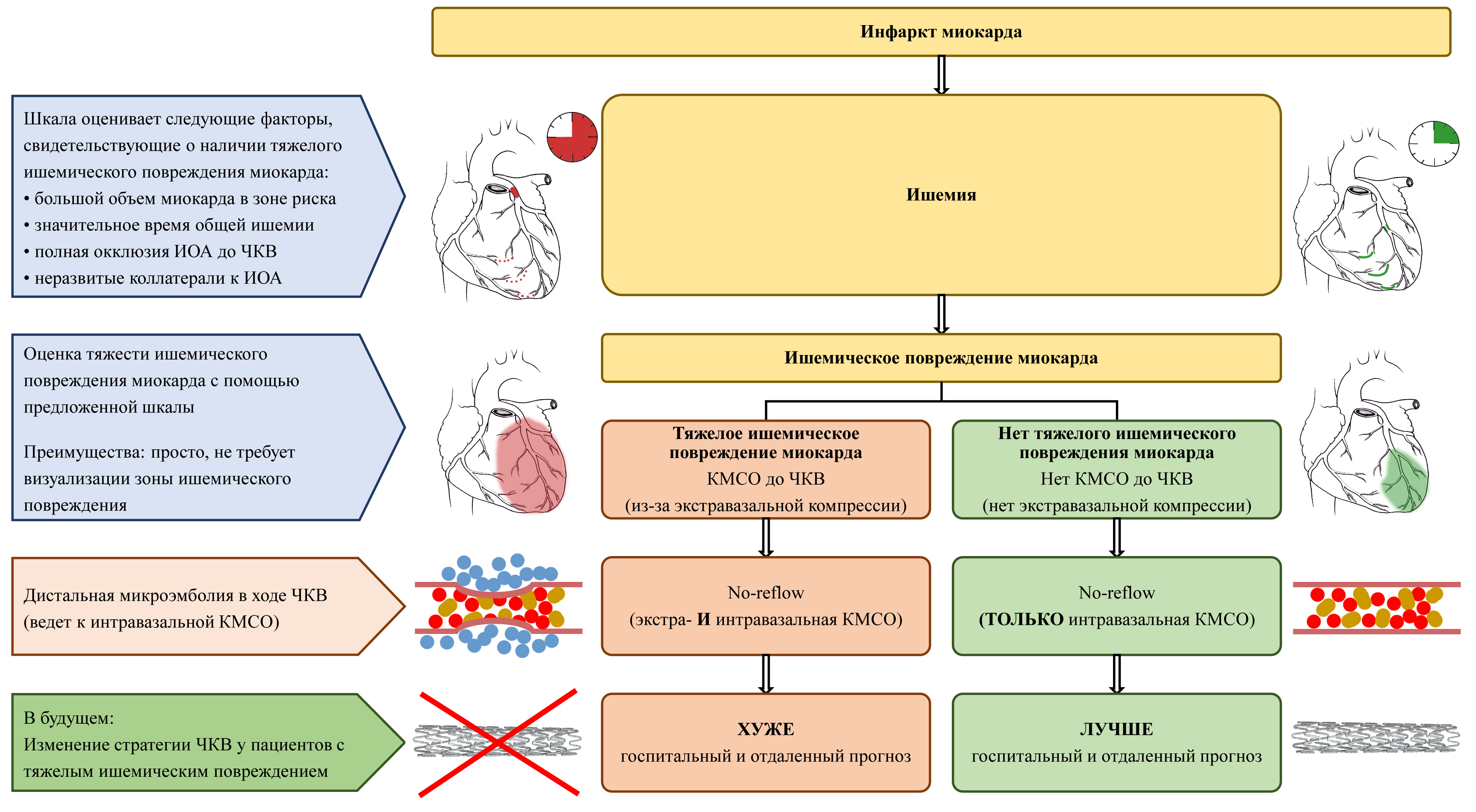
- Пациенты с инфарктом миокарда к моменту поступления на чрескожное коронарное вмешательство могут иметь тяжелое ишемическое повреждение миокарда.
- Точные методы визуализации ишемии миокарда в сосудистых центрах доступны крайне редко.
- Ишемическое повреждение одна из причин развития феномена no-reflow. Также к no-reflow ведет дистальная микроэмболия в ходе операции.
- Пациенты с no-reflow комбинированной (ишемической и эмбологенной) природы предположительно имеют неблагоприятный прогноз, что может быть аргументом для отказа от вмешательства.
- Нами предложена шкала оценки тяжести ишемического повреждения миокарда и изучен отдаленный прогноз в группах пациентов с и без тяжелой ишемии.
Цель. Создать шкалу оценки тяжести ишемического повреждения миокарда и изучить влияние сопутствующей ишемии на прогноз инфаркта миокарда (ИМ), осложненного развитием no-reflow в ходе чрескожного коронарного вмешательства (ЧКВ).
Материал и методы. Проведено одноцентровое когортное исследование. Критерии включения: ИМ, ЧКВ, общее время ишемии <48 ч и no-reflow (TIMI flow grade <3 степени или Myocardial blush grade <2 степени или резолюция сегмента ST <70%). Предложенная шкала: инфаркт-ответственное поражение в стволе левой коронарной артерии или проксимальном сегменте передней межжелудочковой артерии — 2 балла; общее время ишемии >12 ч — 1 балл; кровоток по TIMI flow grade до ЧКВ 0-1 степени — 1 балл; коллатерали 0-1 степени по Rentrop — 1 балл. Тяжелая ишемия — более 3 баллов. Для коррекции различий между группами использован propensity score matching. Медиана наблюдения 979 [743; 1318] дней.
Результаты. Проанализированы данные 18079 пациентов с острым коронарным синдромом, включено — 219. После сопоставления осталось 105 пациентов: 1 группа — 75 больных без оцененной тяжелой ишемии и 2 группа — 30 больных с оцененной тяжелой ишемией. На госпитальном этапе умерло 6 (8,0%) и 9 (30,0%) пациентов, соответственно, p<0,001. Фракция выброса левого желудочка была 47 [42; 50]% и 41 [39; 45]%, соответственно, p<0,001. Наличие тяжелой ишемии было ассоциировано с увеличением риска смерти в отдаленном периоде в 4,15 раза (95% доверительный интервал: 1,87-9,20; p<0,001).
Заключение. Наличие сопутствующего тяжелого ишемического повреждения при ИМ, осложненном развитием no-reflow в ходе ЧКВ, ассоциировано с худшей функцией левого желудочка и более высоким риском смерти на госпитальном этапе и в отдаленном периоде наблюдения.
- Адренореактивность организма играет важную роль в прогрессировании сердечной недостаточности.
- Косвенным показателем адренореактивности организма является β-адренореактивность мембран эритроцитов.
- В выборке с постинфарктным кардиосклерозом β-адренореактивность мембран эритроцитов не различалась у пациентов с сохранённой и низкой фракцией выброса.
- При сохранённой фракции выброса пациенты с гипертрофией левого желудочка отличались сниженной адренореактивностью организма.
Цель. Оценка β-адренореактивности мембран эритроцитов (β-АРМ) в зависимости от клинических параметров у пациентов с хронической сердечной недостаточностью (ХСН) с сохранённой и низкой фракцией выброса (ФВ) левого желудочка (ЛЖ), перенёсших в прошлом инфаркт миокарда.
Материал и методы. В выборку включены 89 пациентов с ХСН. У всех выявлен постинфарктный кардиосклероз. Сформированы группа c сохранённой ФВ (СНсФВ) из 64 (71,9%) пациентов и группа c низкой ФВ (СНнФВ) из 25 (28,1%) пациентов. Всем проведена оценка β-АРМ методом, основанным на факте торможения гемолиза эритроцитов, помещенных в гипоосмотическую среду, в присутствии β-адреноблокатора.
Результаты. Группы с СНсФВ и СНнФВ оказались сопоставимыми по значениям β-АРМ, в них отсутствовала линейная зависимость между β-АРМ и ФВ ЛЖ. В группе СНсФВ выявлены различия по β-АРМ в зависимости от функционального класса (ФК) ХСН (p=0,049): 42,5 (24,1; 61,9) усл. ед. при ФК I, 25,9 (17,1; 36,9) усл. ед. при ФК II, 22,2 (14,9; 27,3) усл. ед. при ФК III. Этого не наблюдалось в группе СНнФВ (p=0,143). При СНсФВ пациенты с гипертрофией ЛЖ отличались (p=0,049) более высокими значениями β-АРМ, чем пациенты без неё: 36,9 (24,2; 58,6) усл. ед. и 23,3 (16,0; 29,8) усл. ед. В то же время при СНнФВ β-АРМ была одинаковой (p=0,364) у пациентов с гипертрофией ЛЖ и без неё. В группе СНсФВ у пациентов, принимавших ингибиторы ангиотензинпревращающего фермента/блокаторы рецептора ангиотензина на момент поступления, β-АРМ оказалась в 2 раза ниже (p=0,035), чем у пациентов, не принимавших эти препараты.
Заключение. В выборке с постинфарктным кардиосклерозом пациенты с ХСН с сохранённой и низкой ФВ ЛЖ имели сопоставимую β-АРМ. При этом лица с СНсФВ и гипертрофией ЛЖ отличались от пациентов без гипертрофии повышенной β-АРМ, т.е. большей напряженностью симпатоадреналовой системы и сниженной адренореактивностью организма, чего не наблюдалось в группе с СНнФВ. В группе с СНсФВ приём ингибиторов ангиотензинпревращающего фермента/блокаторов рецептора ангиотензина в анамнезе был связан с более благоприятными показателями адренореактивности.
- Новый индекс сосудистой жесткости haSTART имеет прогностическую ценность при долгосрочном наблюдении за пациентами с ишемической болезнью сердца (ИБС) после операции аортокоронарного шунтирования.
- При индексе haSTART больше медианы у больных ИБС в период наблюдения чаще наблюдались смерть от всех причин, сердечно-сосудистая смерть и развитие комбинированной конечной точки.
- У больных ИБС с индексом haSTART ниже медианы отмечена лучшая выживаемость и лучшая выживаемость без событий по данным анализа Каплана-Майера.
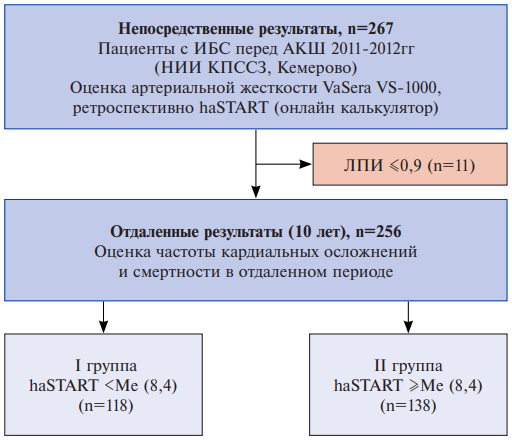
Цель. Изучить долговременное прогностическое значение нового индекса сосудистой жесткости START у больных ишемической болезнью сердца (ИБС) после аортокоронарного шунтирования (АКШ).
Материал и методы. В исследование вошли 256 пациентов ИБС, подвергшихся АКШ на базе НИИ КПССЗ г. Кемерово. Перед операцией оценивали сосудистую жесткость с помощью сердечно-лодыжечного индекса haSTART. Средний период наблюдения составил 9,7±0,9 лет. Были сформированы две группы исследования: I группа haSTART ниже медианы (Ме) индекса 8,4 (haSTART <Ме, n=118), II группа haSTART равный или выше Ме (haSTART ≥Ме, n=138). Прогностическое значение haSTART изучалось в отношении комбинированной конечной точки (ККТ): летальный исход, нефатальный инфаркт миокарда или инсульт.
Результаты. Пациенты в группе haSTART ≥Ме были статистически значимо старше, чем в группе haSTART <Ме (р<0,001). В обеих группах превалировали мужчины (76,2%). За период наблюдения летальный исход от всех причин достоверно чаще встречался в группе с haSTART ≥Ме (34,1%), чем в группе с haSTART <Ме (19,5%), р=0,009. Смерть от сердечных причин также чаще наблюдалась в группе haSTART ≥Ме, чем haSTART <Ме (23,2%, vs 8,5%, р=0,001). У больных с haSTART ≥Ме ККТ отмечалась в 45,7% случаев, по сравнению с больными с haSTART <Ме — в 30,5% случаях, р=0,013. Среди больных с наступлением летального исхода была выше частота больных со значениями haSTART ≥Ме, чем в группе выживших (67,1% и 48,9%, р=0,009). Среди больных с развитием ККТ — частота выявления у них значений индекса haSTART ≥Ме составила 63,6%, что было достоверно выше, чем в группе выживших без сердечно-сосудистых событий (47,8%, р=0,013). Кривые Каплана-Мейера выявили лучший долгосрочный прогноз в группе со значениями индекса haSTART <Ме по сравнению с группой, в которой индекс haSTART ≥Ме (р>0,05).
Заключение. Оценка индекса жесткости haSTART перед операцией АКШ, возможно, имеет прогностическое значение в отдаленном периоде наблюдения у больных ИБС.
- Из 6 анализируемых шкал-рискометров только 4 (mc2HEST, COM-AF, CHA2DS2-VASc и HATCH) обладают приемлемым предиктивным потенциалом в отношении "новой" фибрилляции предсердий у больных инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства.
- Шкалы PAFAC и POAF имеют недостаточную прогностическую точность.
- Интегративная модель на основе искусственной нейронной сети, объединяющая прогностический ресурс 6 шкал, демонстрировала более высокую точность, чем модели, разработанные с помощью дерева решений и многофакторной логистической регрессии.
Цель. Сравнительная оценка эффективности шкал POAF, PAFAC, COM-AF, HATCH, ms2HEST и CHA2DS2-VASc для прогнозирования впервые возникшей фибрилляции предсердий (ФП) у больных инфарктом миокарда с подъемом сегмента ST (ИМпST) после чрескожного коронарного вмешательства (ЧКВ) и разработка новых прогностических моделей на основе методов машинного обучения.
Материал и методы. Проведено одноцентровое ретроспективное исследование по данным 3449 электронных историй болезни пациентов с ИМпST. Было выделено 2 группы лиц, в первую из которых вошли 312 (9%) пациентов с впервые зарегистрированной ФП в послеоперационном периоде ЧКВ, а во вторую — 3139 (91%) больных без нарушения сердечного ритма. Для прогнозирования ФП использовали методы однофакторной и многофакторной логистической регрессии (ОЛР и МЛР), дерево решений (ДР), искусственные нейронные сети (ИНС).
Результаты. Результаты исследования показали, что из 6 анализируемых шкал только 4 (mc2HEST, COM-AF, CHA2DS2-VASc и HATCH) обладают приемлемым прогностическим потенциалом в отношении "новой" ФП после ЧКВ, что документировалось значениями метрики AUC в моделях ОЛР, разработанных на основе предикторов, представленных суммой баллов каждой из шкал (AUC 0,736, 0,731, 0,71 и 0,702, соответственно). Интегративная модель ИНС, объединяющая прогностический ресурс 6 шкал, демонстрировала более высокую точность, чем модели ДР и МЛР (AUC — 0,759 vs 0,745 и 0,755, p-value<0,0001).
Заключение. Дальнейшие исследования, направленные на повышение качества прогностических моделей послеоперационной ФП у больных ИМпST после ЧКВ, могут быть связаны с поиском новых предикторов, характеризующих степень поражения коронарного русла и эффективность его восстановления, интенсивность воспалительного ответа, электрофизиологический статус миокарда и др.
МЕТОДЫ ИССЛЕДОВАНИЙ
- Количественный анализ коронарного атеросклероза по данным мультиспиральной компьютерно-томографической коронарографии позволяет идентифицировать наличие кальцинированного и мягкотканного компонента коронарного атеросклероза.
- Выявлена ассоциация мягкотканного компонента атеросклеротической бляшки с тяжестью коронарного атеросклероза и повреждением сердечной мышцы у пациентов с острым инфарктом миокарда.
- Бремя мягкотканного компонента является предиктором более выраженного повреждения миокарда, по данным кардиоспецифических биомаркеров.
Цель. Изучить количественные показатели коронарного атеросклероза (КАС), по данным мультиспиральной компьютерно-томографической коронарографии (МСКТ-КГ), и выявить их ассоциацию с уровнем кардиоспецифических биомаркеров (КСБ) у пациентов с острым инфарктом миокарда (ОИМ).
Материал и методы. В исследование были включены пациенты с впервые диагностированным ОИМ. В зависимости от стенозирования коронарных артерий (КА), были сформированы две группы: 1) с обструктивным поражением КА ≥50% (MICAD); 2) с необструктивным поражением КА <50% (MINOCA). Всем пациентам определяли уровни КСБ и провели МСКТ-КГ.
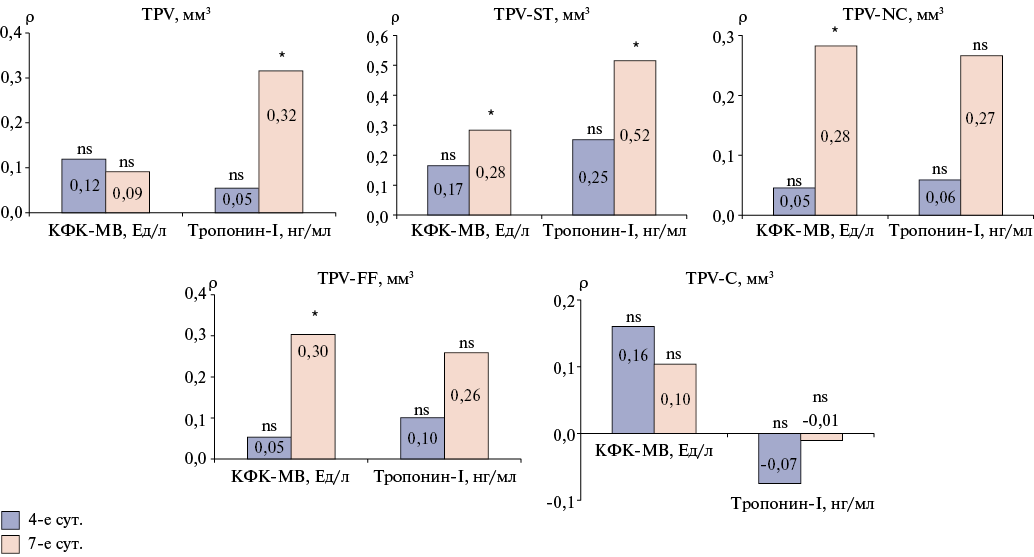
Результаты. В исследование включен 31 пациент: группу MINOCA составили 10 пациентов (5 мужчин, возраст 68 (57; 79) лет), группу MICAD — 21 пациент (13 мужчин, возраст 62 (56; 68) лет). При анализе уровней КСБ отмечалось статистически значимое повышение уровней сердечного тропонина I (сТнI) на 4-е (р=0,04) и на 7-е сутки (р=0,0009) у пациентов MICAD. Выявлено статистически значимое преобладание объема (p=0,01) и бремени (p=0,004) атеросклеротических бляшек (АСБ) низкой плотности в группе MICAD, по сравнению с MINOCA. Кроме того, у пациентов MICAD были статистически значимо повышены значения общей атеросклеротической нагрузки (р=0,01) и общего бремени мягкотканного компонента АСБ (р=0,04). Выявлена статистически значимая корреляция объема АСБ низкой плотности с сТнI на 7-е сутки (ρ=0,52, р<0,05) и бремени АСБ низкой плотности с сТнI на 7-е сутки (ρ=0,43, р<0,05).
Заключение. Мягкотканный компонент АСБ, по данным МСКТ-КГ, ассоциирован с тяжестью КАС и повреждением сердечной мышцы у пациентов с ОИМ. Бремя мягкотканного компонента — предиктор более выраженного повреждения миокарда, по данным КСБ.
- Пациенты с необструктивным атеросклеротическим поражением коронарных артерий в ~40% случаев могут иметь сниженный резерв миокардиального кровотока, по данным динамической однофотонной эмиссионной компьютерной томографии (ОФЭКТ) миокарда.
- Динамическая ОФЭКТ миокарда позволяет идентифицировать в ~30% случаев наличие микроваскулярной дисфункции у пациентов с необструктивным атеросклеротическим поражением коронарных артерий и нормальными результатами стандартной перфузионной сцинтиграфии миокарда.
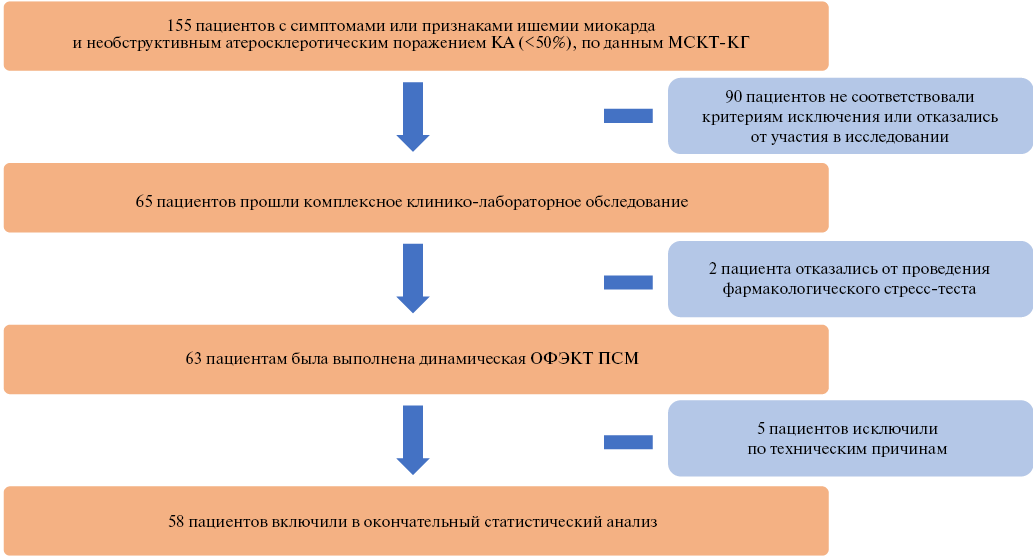
Цель. Провести сравнительный анализ стандартных индексов перфузионной сцинтиграфии миокарда (ПСМ) и количественных показателей динамической однофотонной эмиссионной компьютерной томографии (ОФЭКТ) миокарда у пациентов с необструктивным атеросклеротическим поражением коронарных артерий (НАПКА).
Материал и методы. В исследование были включены пациенты с симптомами или признаками ишемии миокарда и НАПКА (<50%). Всем пациентам была выполнена динамическая ОФЭКТ миокарда с оценкой стандартных индексов ПСМ (суммарный индекс нарушения перфузии при выполнении нагрузочной пробы (SSS), суммарный индекс нарушения перфузии в покое (SRS), разница между SSS и SRS (SDS)) и количественных показателей — миокардиальный кровоток (МК) при нагрузке (стресс-МК) и в покое (покой-МК), резерв МК (РМК) и разница стресс-МК и покой-МК (ΔМК).
Результаты. По данным ПСМ 15 (26%) пациентов имели признаки нарушения миокардиальной перфузии (SSS ≥2,0). Стандартные индексы ПСМ имели невысокие значения: SSS 0,0 (0,0; 2,0), SRS 0,0 (0,0; 0,0), SDS 0,0 (0,0; 2,0) баллов. По данным динамической ОФЭКТ миокарда 22 (38%) пациента имели сниженный РМК <2,0. Количественные показатели характеризовались большей вариабельностью, по сравнению с данными ПСМ: стресс-МК 1,34 (1,03; 1,64) мл/мин/г, покой-МК 0,58 (0,42; 0,73) мл/мин/г, РМК 2,42 (1,48; 2,85), ΔМК 0,68 (0,36; 1,09). При сопоставлении данных ПСМ с динамической ОФЭКТ миокарда (NRAC) установлено, что у 7 (12%) пациентов наличие ишемических изменений миокарда (SSS ≥2,0) ассоциировалось со сниженным РКМ <2,0, а у 28 (48%) без признаков ишемии (SSS <2,0) показатель РМК был в пределах нормальных значений ≥2,0. Однако 15 (26%) имели нормальный характер распределения радиофармацевтического препарата и сниженный РМК, что может говорить о начальных этапах развития микроваскулярной дисфункции, которая не привела к ишемическим изменениям миокарда.
Заключение. Метод динамической ОФЭКТ позволяет в ~30% случаев идентифицировать нарушение МК и РМК у пациентов с нормальными результатами стандартной ПСМ на фоне НАПКА.
МЕТОДЫ ЛЕЧЕНИЯ И ДИАГНОСТИКИ
- Диагностика повышенного уровня Лп(а) важна для ранней терапии и коррекции модифицируемых факторов риска с целью снижения риска развития сердечно-сосудистых заболеваний.
- Исследование липопротеина(а) может быть целесообразно на фоне проводимой PSCK9-таргетной терапии.
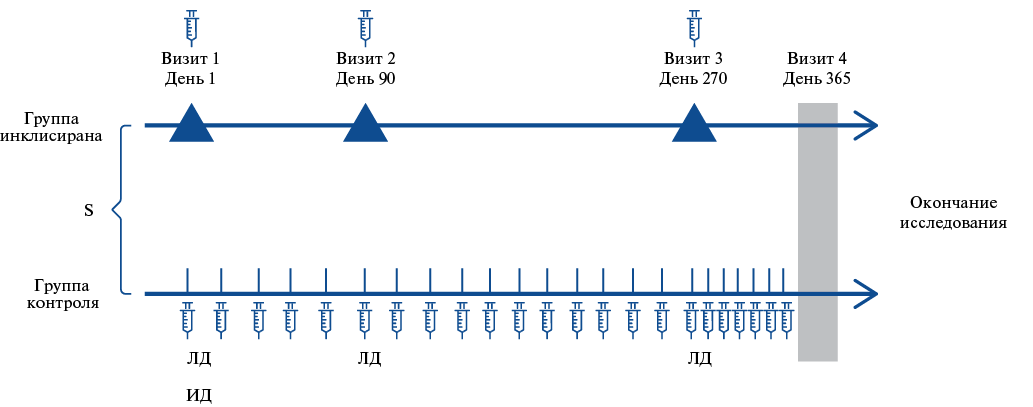
Цель. Оценить влияние PCSK9-таргетной терапии на уровни липопротеина(а) (Лп(а)) у больных, страдающих атеросклеротическими сердечно-сосудистыми заболеваниями и не достигших целевого уровня холестерина липопротеинов низкой плотности (ХС ЛНП) на базисной терапии (статины в максимально переносимых дозах и/или эзетимиб).
Материал и методы. В исследовании принимали участие 3 медицинские организации государственной системы здравоохранения города Москвы. В исследование включены 80 чел.: 50 чел. получали терапию инклисираном, 30 чел. — ингибиторами PCSK9 (алирокумаб, n=1; эволокумаб, n=29). В данном анализе представлены результаты динамики уровня Лп(а) на фоне терапии инклисираном в течение 12 мес. наблюдения. Определение Лп(а) проводилось методом турбидиметрии. Повышенный уровень Лп(а) определялся при значениях ≥50 мг/дл (125 нмоль/л).
Результаты. У 16 чел. (34,8%) определялись нормальные уровни Лп(а), у 9 чел. (19,6%) — "промежуточные", у 21 чел. (45,7%) — повышенные, при этом у 8 (17,4%) — экстремально высокие (>180 мг/дл). На фоне терапии инклисираном наблюдалось статистичеки значимое (р<0,001) снижение как уровня ХС ЛНП, так и Лп(а), соответственно, на 52% и 54,7%. На фоне терапии нормальные уровни Лп(а) оставались в пределах исходных значений; почти в половине случаев с "промежуточными" значениями Лп(а) его концентрация снижалась до нормальных показателей, а в случаях с повышенным Лп(а) у 9 из 10 пациентов его уровень снижался. Доля пациентов в группе с уровнем Лп(а) <30 мг/дл увеличилась с 35% до 41%. Ни у одного пациента к окончанию исследования не регистрировались экстремальные значения.
Заключение. Исследование Лп(а) может быть целесообразно на фоне проводимой PSCK9-таргетной терапии. Диагностика гипер-Лп(а) важна для ранней интенсивной комбинированной гиполипидемической терапии и коррекции модифицируемых факторов риска с целью снижения риска развития сердечно-сосудистых заболеваний.
- С использованием метода высокопроцессивного секвенирования участка V4 гена 16SрРНК проанализирован профиль микробиоты 76 образцов атеросклеротических бляшек, полученных во время каротидной эндартерэктомии, а также определены таксономические различия между группами пациентов с развившимся послеоперационным рестенозом и без рестеноза.
- Наиболее представленными оказались четыре семейства бактерий: Caulobacteraceae, Rhizobiaceae, Sphingobacteriaceaeи Weeksellaceae.
- Линейный дискриминантный анализ размера эффекта LefSe выявил значимо более высокую представленность микробного маркера OTU_21, относящегося к семейству Sphingomonadaceae, у пациентов с рестенозом ≥50%, а также Cloacibacterium(OTU_67), входящего в семейство Weeksellaceae, у пациентов с рестенозом >70%.
- Выявление большого разнообразия грамотрицательных бактерий в атеросклеротической бляшке, в т. ч. широко распространенных в окружающей среде, указывает на потенциальную роль микроорганизмов различного происхождения как в формировании бляшки, так и в развитии рестеноза.
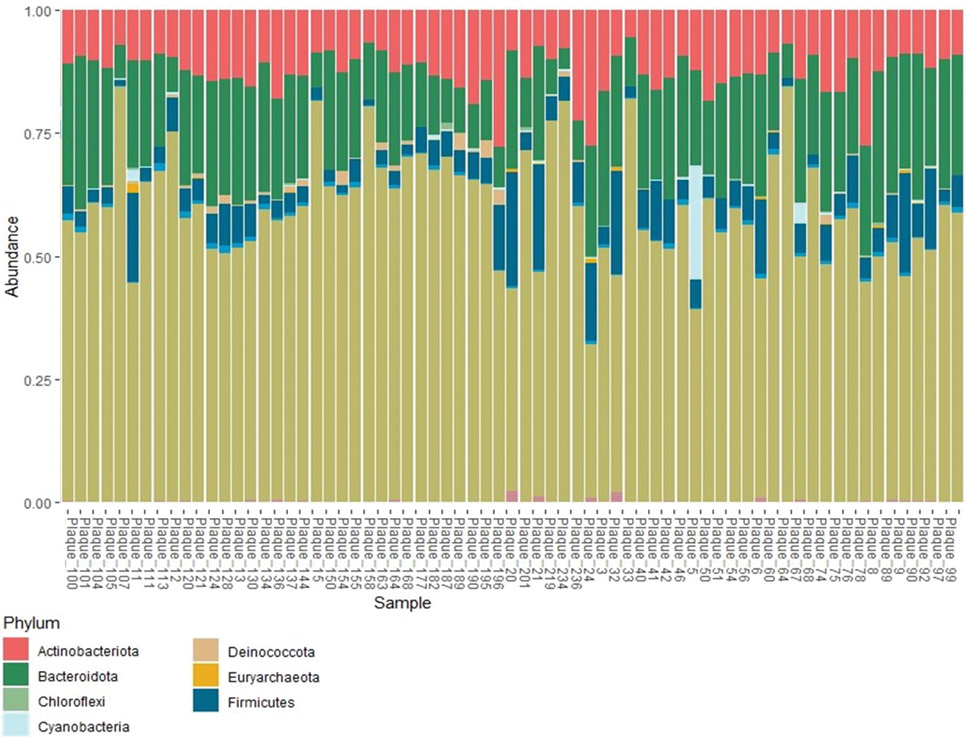
Цель. Исследовать микробиом биоптатов атеросклеротических бляшек (АСБ) больных, перенесших каротидную эндартерэктомию (КЭА).
Материал и методы. В настоящем исследовании с использованием метода высокопроцессивного секвенирования участка V4 гена 16S рРНК проанализирован профиль микробиоты 76 образцов АСБ, полученных при проведении КЭА. Доля пациентов без рестеноза, включенных в исследование, составила 20%. Медиана наблюдения за пациентами составила 1,9 года (диапазон 1,4-2,25).
Результаты. Таксономический анализ установил, что микробиом АСБ характеризуется большим разнообразием грамотрицательных бактерий, в т.ч. бактерий, широко распространенных в окружающей среде. Бактерии, наиболее представленные в АСБ, относятся к четырем семействам: Caulobacteraceae, Rhizobiaceae, Sphingobacteriaceae и Weeksellaceae. Линейный дискриминантный анализ размера эффекта LefSe выявил значимо более высокую представленность микробного маркера OTU_21, относящегося к семейству Sphingomonadaceae, в микробиоме АСБ у пациентов с рестенозом ≥50% и Cloacibacterium OTU_67, входящего в семейство Weeksellaceae, у пациентов с рестенозом >70%.
Заключение. Полученные данные подчеркивают важность изучения микробиома АСБ и позволяют предположить, что микроорганизмы различного происхождения, включая те, которые ранее не рассматривались как факторы риска, могут играть патогенетическую роль как в атерогенезе, так и в развитии рестеноза.
- У больных с обструктивным апноэ сна в сочетании с фибрилляцией предсердий (ФП) установлена более выраженная ночная гипоксемия (НГ) по сравнению с пациентами без данной аритмии.
- Эхокардиографические параметры у пациентов с ФП и обструктивным апноэ сна в сочетании с НГ характеризуются более выраженным ремоделированием предсердий и более высокой легочной гипертензией, чем у обследованных без НГ.
- Для пациентов с обструктивным апноэ сна, НГ
и ФП характерны более высокие уровни в крови биомаркеров фиброза — галектина-3 и ростового фактора дифференцировки-15, чем у больных без НГ.
Цель. Изучить ремоделирование сердца, концентрации в крови биомаркеров фиброза в зависимости от наличия ночной гипоксемии (НГ) у пациентов с фибрилляцией предсердий (ФП) и обструктивным апноэ сна (ОАС).
Материал и методы. В одномоментное сравнительное исследование, выполненное по принципу случай-контроль, включены 334 обследованных: 122 пациента с ФП(+)/ОАС(+), 117 пациентов с ФП(-)/ОАС(+), 95 пациентов с ФП(+)/ ОАС(-). Обследованным выполнены респираторное мониторирование во время сна и трансторакальная эхокардиография, определены концентрации профибротических биомаркеров в крови.
Результаты. Средний уровень сатурации крови ниже, а доля времени сна с сатурацией <90% выше у пациентов с сочетанием ФП и ОАС по сравнению с пациентами без аритмии. Диаметр левого предсердия, объемы и индексы объемов обоих предсердий, размер легочной артерии и давление в легочной артерии у пациентов с ФП в сочетании с НГ больше, чем у пациентов с ФП без НГ. Уровни галектина-3 и ростового фактора дифференцировки-15 (GDF-15) в крови выше у пациентов с ФП в сочетании с НГ, чем у пациентов с ФП без НГ и чем у больных с НГ без ФП. У пациентов с ФП в сочетании с ОАС увеличение вероятности НГ ассоциировано с высокой концентрацией в крови GDF-15 (отношение шансов 1,21, 95% доверительный интервал: 1,001-1,34, р=0,002). Наличие НГ увеличивало вероятность ФП в 2,6 раз (отношение шансов 2,57, 95% доверительный интервал: 1,47-4,46, р<0,001).
Заключение. ФП у больных с ОАС в сочетании с НГ характеризуется более значимым ремоделированием сердца (большей дилатацией левого и правого предсердий), более высокой легочной гипертензией и более высокими уровнями в крови профибротических факторов (галектина-3 и GDF-15), чем у пациентов без НГ.
КЛИНИКА И ФАРМАКОТЕРАПИЯ
- Азилсартан оказывает более сильное антигипертензивное действие, чем другие блокаторы рецепторов к ангиотензину II, в т. ч. у коморбидных больных. Имеются экспериментальные доказательства плейотропного эффекта азилсартана.
- Данные, позволившие низким дозам диуретиков занять место антигипертензивного препарата первой линии, главным образом, получены в рандомизированных клинических исследованиях с использованием именно хлорталидона.
- Хлорталидон показал большую антигипертензивную эффективность в сравнении с гидрохлоротиазидом.
- Комбинация азилсартана медоксомил/хлорталидон доказала свою большую антигипертензивную эффективность по сравнению как с комбинацией олмесартана медоксомил/гидрохлоротиазид, так и азилсартана медоксомил/гидрохлоротиазид.
В статье проведен анализ данных клинических исследований, посвященных эффективности и безопасности комбинированного гипотензивного препарата азилсартана медоксомил/хлорталидон и его компонентов. По данным анализируемых источников как отдельные его компоненты, так и их комбинация доказали свою эффективность и безопасность у больных с артериальной гипертензией, в т.ч. с коморбидной патологией. Азилсартана медоксомил продемонстрировал большую эффективность при сопоставимой безопасности в плане снижения артериального давления, как офисного, так и амбулаторного, по сравнению с кандесартаном, валсартаном, олмесартаном. Хлорталидон показал большую гипотензивную эффективность в сравнении с гидрохлоротиазидом и доказал свой протективный эффект в плане снижения сердечно-сосудистого риска. Комбинация азилсартана медоксомил/хлорталидон, в свою очередь, доказала свою безопасность и большую гипотензивную эффективность по сравнению как с комбинацией олмесартана медоксомил/гидрохлоротиазид, так и азилсартана медоксомил/гидрохлоротиазид.
ISSN 2618-7620 (Online)