Перейти к:
Дистальный лучевой доступ как альтернатива классическому лучевому доступу при проведении коронароангиографий и чрескожных коронарных вмешательств
https://doi.org/10.15829/1560-4071-2024-5737
EDN: LXDOEZ
Аннотация
Цель. Оценить непосредственные и среднесрочные (3 мес.) результаты безопасности и эффективности дистального лучевого доступа (ДЛД) при интервенционных коронарных вмешательствах в сравнении с проксимальным лучевым доступом (ПЛД).
Материал и методы. Проведен анализ 776 пациентов проспективного рандомизированного исследования TENDERA: группа ДЛД — 391, и группа ПЛД — 385. После исключения пациентов с неудавшимся первичным доступом размер первичных выборок уменьшился, ДЛД — 371, ПЛД — 382. Статистически чаще смена доступа была в группе ДЛД (5,1% и 0,8%, p<0,001). Первичная конечная точка — непосредственный (госпитальный) или поздний тромбоз/ окклюзия лучевой артерии (ЛА). Вторичные конечные точки: 1 — композитная из осложнений со стороны артерии доступа; 2 — параметры доступа.
Результаты. Получены статистически значимые различия по первичной конечной точке: ДЛД 2,7% (n=10), ПЛД 6,8% (n=26), p=0,008. Окклюзия дистальной ЛА, при проходимой ЛА: ДЛД 1,3% (n=5), ПЛД 0 (0), p=0,023. Во вторичной композитной точке получены статистически значимые различия по следующим группам осложнений: кровотечение BARC тип I (ДЛД: 3,8% (n=14), ПЛД: 21,7% (n=83), p<0,001); гематома >5 см на 1 сут. (ДЛД: 10% (n=37), ПЛД: 25,9% (n=98), p<0,001); гематома >5 см на 7 сут. (ДЛД: 12,4% (n=45), ПЛД: 34,6% (n=132), p<0,001). Из параметров доступа статистически значимо различались: время пункции ДЛД 19,0 (8,0; 50), ПЛД 13,5 (5,0; 29), p<0,001; установка интродьюсера ДЛД 42,0 (26,0; 84,0), ПЛД 35,0 (23,0; 55,0), p<0,001, продолжительность гемостаза артерии доступа (мин): ДЛД 180,0 (120,0; 480,0), ПЛД 155,0 (115,0; 195,0), p<0,001. Продолжительность процедуры и флюороскопии, доза радиации, спазм ЛА в обеих группах не имели статистически значимых различий.
Заключение. В исследовании TENDERA ДЛД показал эффективность и безопасность при интервенционных коронарных вмешательствах в сравнении с ПЛД в среднесрочном периоде наблюдения: статистически значимая меньшая частота окклюзий ЛА и местных осложнений.
Ключевые слова
Для цитирования:
Коротких А.В., Бабунашвили А.М., Каледин А.Л., Ахрамович Р.В., Деркач В.В., Портнов Р.М., Карташов Д.С. Дистальный лучевой доступ как альтернатива классическому лучевому доступу при проведении коронароангиографий и чрескожных коронарных вмешательств. Российский кардиологический журнал. 2024;29(12):5737. https://doi.org/10.15829/1560-4071-2024-5737. EDN: LXDOEZ
For citation:
Korotkikh A.V., Babunashvili A.M., Kaledin A.L., Akhramovich R.V., Derkach V.V., Portnov R.M., Kartashov D.S. Distal radial access as an alternative to conventional radial access in coronary angiography and percutaneous coronary interventions. Russian Journal of Cardiology. 2024;29(12):5737. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5737. EDN: LXDOEZ
На протяжении нескольких десятилетий бедренный доступ считался основным в мировой практике интервенционной кардиологии [1]. C увеличением количества коронароангиографий (КАГ), а в последующем и чрескожных коронарных вмешательств (ЧКВ), стало возрастать число доступ-обусловленных осложнений, в т. ч. имеющих фатальный характер из-за массивных кровотечений [2-4].
Девяностые годы XX столетия ознаменовались новой эрой — эрой начала и развития трансрадиального доступа (ТРД) в эндоваскулярной хирургии, и в первую очередь благодаря Campeau L (1989) [5] и Kiemeneij F, et al. (1993) [6]. ТРД во многих странах быстро начал набирать популярность из-за большего комфорта для пациента, быстрой активизации и сокращения койко-дня, снижения количества осложнений, особенно кровотечений, что стало важным ввиду активного назначения антиагрегантной и антикоагулянтной терапии [7][8]. Однако часть интервенционных кардиологов развитых стран Европы и Северной Америки сохраняли консерватизм, поэтому потребовалось больше 2-х десятилетий для формирования надежной доказательной базы по эффективности и безопасности ТРД, чтобы он мог использоваться в качестве предпочтительного доступа для любого ЧКВ независимо от клинической картины согласно рекомендациям ESC/EACTS по реваскуляризации миокарда [9].
Однако лучевая артерия (ЛА) ввиду ее небольшого диаметра и вариабельной анатомии также не лишена определенных осложнений, таких как спазм, диссекция, перфорация, которые могут приводить к смене доступа и удлинению процедуры [10]. Но самым частым осложнением при использовании ТРД остается ранняя и поздняя окклюзия ЛА (ОЛА), частота которой варьирует в различных исследованиях от 5 до 30% [11]. В абсолютном большинстве ОЛА протекает бессимптомно, но саму ЛА в дальнейшем проблематично повторно использовать для любых эндоваскулярных вмешательств, а также совсем невозможно при формировании артериовенозной фистулы у диализного пациента или в качестве кондуита для аортокоронарного шунта [12].
Около 10 лет назад независимо друг от друга три российских интервенционных хирурга (Бабунашвили А. М. и др. (2011), Каледин А. Л. и др. (2014), Коротких А. В. (2015)) начали активно использовать в эндоваскулярных вмешательствах доступ через анатомическую табакерку, проведя первые ретроспективные исследования, которые выявили определенные преимущества (уменьшение количества местных осложнений) нового подхода [13-16]. В 2017г произошел всплеск популярности дистального лучевого доступа (ДЛД) во всем мире, и стали появляться научные статьи по сериям клинических случаев, ретроспективные исследования, метаанализы и небольшое количество проспективных исследований по сравнению ДЛД в области анатомической табакерки и классическим проксимальным лучевым доступом (ПЛД). В последующем пункция при ДЛД модернизировалась и стала выполняться еще более дистальнее — в первом межпальцевом промежутке тыльной поверхности кисти.
В настоящее время ДЛД активно используют не только при диагностических исследованиях и ЧКВ у стабильных пациентов, но и в лечении острого коронарного синдрома (ОКС) с подъемом сегмента ST [17], онкопатологии [18], нейроинтервенционных [19][20] и периферических процедурах [21].
Но все проведенные ретроспективные исследования имеют один большой недостаток — длительность наблюдения не превышает нескольких дней после процедуры. Последнее самое крупное исследование DISCO RADIAL было опубликовано в июне 2022г, и срок наблюдения в нем не превышает 30 дней [22]. Само исследование имеет ряд ограничений, из-за которых, на наш взгляд, оно не показало статистически значимой разницы по первичной конечной точке — ОЛА в группах ДЛД и ПЛД.
Цель настоящей работы — оценить непосредственные и среднесрочные (3 мес.) результаты безопасности и эффективности ДЛД при интервенционных коронарных вмешательствах в сравнении с ПЛД по данным исследования TENDERA.
Материал и методы
Дизайн исследования. TENDERA (Traditional ENtry point and Distal puncturE of Radial Artery) (NCT04211584) — проспективное многоцентровое открытое рандомизированное клиническое исследование, созданное для оценки преимуществ ДЛД в сравнении с ПЛД в отношении частоты ОЛА предплечья в срок до 1 года после процедуры. Сроки набора пациентов в исследование: декабрь 2017г — октябрь 2021г. В 2021г были опубликованы промежуточные данные исследования TENDERA, которые показали статистически значимое меньшее количество местных осложнений ДЛД [23]. В настоящей статье проведен анализ включенных в исследование пациентов по истечении 3 мес. после процедуры.
Исследуемые доступы требуют от хирурга определенных квалификационных навыков и опыта работы. Критерии для отбора операторов в исследование: 1 — регулярно выполняет широкий спектр вмешательств ТРД на коронарном русле, в т. ч. и лечение ОКС; 2 — кроме ТРД владеет всеми другими доступами на высоком уровне (локтевой, бедренные и др.); 3 — выполнил не менее 100 процедур ДЛД.
Основная гипотеза всего исследования — ДЛД превосходит ПЛД в отношении частоты ОЛА на предплечье на сроке наблюдения до 1 года. Для группы ПЛД частота ОЛА через 1 год предполагалась 5%, выведено как среднее значение на основе большого количества исследований последних 10 лет. Для группы ДЛД предполагалось, что частота ОЛА составит 1,5%. Исследований со сроком наблюдения >1 мес. для ДЛД в настоящее время нет, а в имеющихся — ОЛА составляет ~1%. Однако мы считаем, что на сроках до 1 года количество ОЛА будет увеличиваться, поэтому процент ОЛА был увеличен. Для статистической мощности исследования 80%, двухсторонней ошибки первого рода Альфа 0,05% и цензурировании 5% необходимо 422 пациента на группу. Таким образом, общий объем выборки составил 850 пациентов. В настоящей статье выполнен анализ 776 пациентов первичной выборки (с учетом полученных результатов фактическая мощность проведенного исследования составила 90,2%) (рис. 1).
Популяция исследования и рандомизация. В исследование вошли пациенты, которым выполнены КАГ или ЧКВ с использованием гидрофильного интродьюсера 5F или 6F (операторами использовались следующие виды интродьюсеров Radifocus Introducer II Coat, Terumo; Prelude Ease, Merit Medical; Brilliant, Lepu Medical Technology) через ДЛД и ПЛД. Критерии включения: возраст пациента от 18 до 90 лет без наследственных коагулопатий; ранее не использованная ЛА с диаметром в месте пункции ≥1,5 мм; наличие антеградно проходимых как минимум двух магистральных артерий предплечья. Критерии исключения: тяжелое соматическое состояние или тяжелая сопутствующая патология, которые могут привести к несоблюдению протокола исследования и/или исказить интерпретацию данных; невозможность выполнить пункцию ЛА по любой причине; некомпенсированная коагулопатия; ОКС с подъемом ST; единственная проходимая ЛА; рост пациента >195 см. Все пациенты находились под наблюдением до выписки из стационара.
Подходящие в исследование пациенты были рандомизированы в соотношении 1:1 для ДЛД и ПЛД. Скрытое распределение выбора доступа для ЛА проводилось с использованием web-based интерактивной системы рандомизации. Рандомизация была достигнута с помощью компьютерной генерации случайных чисел со случайным размером выборок в заданном объеме.
Протокол исследования отвечает требованиям Хельсинкской декларации и получил одобрение этического комитета в каждой клинике. Все пациенты дали письменное информированное согласие.
Проведение процедуры. Перед проведением пункции всем пациентам оценивалась под ультразвуковым контролем ЛА предплечья и кисти, при этом какой именно доступ использовать — правый или левый, принимал решение непосредственно оператор. Венозный катетер обязательно ставился в контралатеральную руку. Пункцию рекомендовалось осуществлять только с проколом передней стенки артерии, при невозможности — по классической методике Сельдингера.
ДЛД осуществлялся не в области анатомической табакерки, а в более дистальной части — в первом межпальцевом промежутке тыльной поверхности кисти; под местной анестезией проводилась пункция с углом входа 15-30 к коже в направлении максимальной пульсации. Все операторы старались выполнять пункцию максимально атравматично для надкостницы костей запястья, травма которой вызывает повышенную болезненность и может привести к спазму ЛА. Классическая пункция ЛА выполнялась по стандартной методике в точке на 2,0 см выше шиловидного отростка.
После установки гидрофильного интродьюсера при проведении КАГ обязательно вводилось интраартериально 5000 ЕД нефракционированного гепарина, при ЧКВ — от 7500 ЕД и выше до достижения цифр активированного времени свертывания крови 250-300 сек. При длительных процедурах, таких как реканализация хронической коронарной окклюзии или сложное бифуркационное стентирование, активированное время свертывания крови определяли каждый час и в случае необходимости вводили дополнительно нефракционированный гепарин внутривенно.
Введение 200 мг нитроглицерина и/или 5 мг верапамила для предотвращения спазма было на усмотрение оператора, и чаще происходило уже при начальных признаках спазма ЛА.
Пункция считалась успешной, когда интродьюсер был заведен в целевую артерию. Если не удавалось провести успешную катетеризация рандомизированного места доступа из-за любых причин, то все попытки получить сосудистый доступ в другой точке на этой или контрлатеральной конечности считались сменой доступа.
В процессе проведения процедуры выполнялись следующие ангиографические исследования, связанные с артерией доступа, согласно протоколу: после установки интродьюсера — артерии доступа (ЛА и артерий предплечья), в случае наличия выраженной извитости или аномалии анатомического хода брахиоцефальных ветвей, финальная диагностическая ангиография артерии доступа перед удалением интродьюсера.
Интродьюсер из ЛА удалялся сразу после завершения процедуры. Поскольку на начало исследования на территории Российской Федерации не было зарегистрировано специализированных фирменных приспособлений для гемостаза при пункции дистальной ЛА (ДЛА), то применялась давящая марлевая повязка на 2 ч при КАГ или на 4 ч при ЧКВ. После этого повязка снималась и накладывалась асептическая наклейка. В случае продолжения кровотечения после снятия повязки, последняя накладывалась повторно еще на 2 ч до полного гемостаза. В случае ПЛД применялся patent hemostasis (патентованные устройства фирм Terumo, Merit Medical или Lepu Medical Technology). Гемостатическое устройство накладывалось без изменения давления на 2 ч после КАГ и на 4 ч ЧКВ. В дальнейшем стравливание воздуха (уменьшение давления в подушечке) происходило постепенно с помощью прилагаемого специального шприца (Terumo, Lepu Medical Technology) или постепенным откручиванием колесика (Merit Medical).
В исследовании оценивались непосредственно перипроцедурные и отдаленные результаты: данные анамнеза, факторы риска, локальный статус с обязательной ультразвуковой допплерографией, медикаментозная терапия, параметры катетеризации артерии доступа, данные ангиографии и ЧКВ, осложнения, шкала комфорта пациента и динамометрия. Все включенные в исследование пациенты с успешной катетеризацией целевой артерии должны были обязательно наблюдаться в день выписки, на 7 сут. после пункции и через 3 мес. В качестве факторов риска, которые могут повлиять на проходимость целевой артерии, выбраны холестерин, креатинин, артериальная гипертония, ОКС, сахарный диабет, курение.
В исследовании использовалась упрощенная визуальная аналоговая шкала оценки боли или дискомфорта (5 баллов вместо 10) в месте пункции ЛА для пациента: 0 — отсутствие боли и/или неудобств; 1 — боль эпизодическая (сразу после завершения) и прошла в течение 60 мин; 2 — боль (ощущение неудобства) есть, но терпима и не требует специальных мероприятий; 3 — боль (ощущение неудобства) есть, но проходит после однократного применения обезболивающего; 4 — боль (ощущение неудобства) есть и требует неоднократного применения обезболивающего препарата; 5 — боль, нарушающая комфорт пациента, несмотря на обезболивающую терапию.
Сила сжатия кисти и пальцев пациентом проверялась до процедуры и в последующем на всех этапах контроля, оценивалась в кг. В исследовании использовались следующие динамометры: Jamar Hydraulic Hand Evaluation Kit и KYTO EH101.
Конечные точки исследования. Первичная конечная точка — непосредственный (госпитальный) или поздний тромбоз/окклюзия ЛА, которая оценивалась независимым исследователем-экспертом, не участвующим в проведении процедур и индифферентным к результатам исследования. Артерия считалась окклюзированной, если не определялся кровоток в целевом сосуде по данным дуплексного ультразвукового сканирования или по данным ангиографии при проведении повторного вмешательства через другой сосудистый доступ. Если любая повторная эндоваскулярная процедура в течение 3 мес. по тем или иным причинам в любом медицинском учреждении выполнялась через исследуемый доступ, то на дату выполнения доступа он признавался проходимым и достигшим первичной конечной точки.
Вторичные конечные точки: 1 — композитная из осложнений со стороны артерии доступа: гематома >5,0 см, кровотечения согласно критериям Bleeding Academic Research Consortium (BARC) (исключая CABG related bleeding), диссекция ЛА, диссекция другой артерии верхней конечности, перфорация ЛА, тромбоз ЛА, потеря чувствительности в месте пункции, образование артериовенозных фистул и ложных аневризм, инфекция места доступа; 2 — параметры доступа: смена доступа, продолжительность этапов процедуры, флюороскопии и гемостаза, доза радиации, общее время процедуры, наличие/отсутствие спазма, боль в месте доступа, динамометрия.
Статистический анализ. Статистический анализ данных проводился с использованием пакета прикладных программ Microsoft Office 2019 для работы с электронными таблицами, IBM SPSS Statistics v.27, jamovi 2.0. Характер распределения количественных данных оценивался с помощью критерия Шапиро-Уилка, а также показателей асимметрии и эксцесса. В случае нормального распределения количественные данные представлены средними арифметическими величинами (M) и стандартными отклонениями (SD), 95% доверительным интервалом. В случае, если распределение признака отличается от нормального, количественные данные представлены при помощи медианы (Me) и интерквартильного размаха (Q1-Q3). Для представления качественных признаков использовали относительные показатели (доли, %) с указанием абсолютных величин. Сравнение 2 независимых групп по количественному признаку с нормальным распределением проводилось с помощью t-критерия Стьюдента (Student's t-test). Сравнение 2 независимых групп по одному или нескольким признакам, имеющим хотя бы в одной из групп распределение, отличное от нормального, или если вид распределений не анализировался, проводилось путем проверки статистической гипотезы о равенстве средних рангов с помощью критерия Манна-Уитни (Mann-Whitney U-test). Для определения размера эффекта при сравнении относительных показателей использовался показатель отношения шансов с 95% доверительным интервалом, рассчитанный с помощью бинарной логистической регрессии. Статистически значимыми считали различия при p≤0,05.
Результаты
С декабря 2017г по май 2021г в исследовании было рандомизировано 776 пациентов (рис. 1). С учетом исключенных пациентов, ввиду смены доступа, группу с ДЛД составил 371 человек (группа I), группу с ПЛД — 382 человека (группа II). Статистически чаще смена доступа была в группе I (5,1% и 0,8%, p<0,001).
Все данные настоящего исследования занесены в запатентованную базу данных "Результаты дистального и классического лучевого доступа при проведении ЧКВ и КАГ"1.
Исходные показатели пациентов представлены в таблице 1, группы хорошо сбалансированы. Общий средний возраст пациентов составил 62,8 лет, 65,9% мужчин, 86,7% с артериальной гипертонией и 27,1% с сахарным диабетом. 85,8% пациентов принимали аспирин, а 42,1% получали антикоагулянты в таблетированной или инъекционной форме.
Процедурные характеристики представлены в таблице 2, где есть статистически значимые различия, не влияющие на конечную точку, а лишь связаны с выбором оператора — правая сторона доступа (67,1% и 59,7%, p=0,034), или анатомическими вариантами: кальциноз брахиоцефального ствола (5,7% и 1,3%, p=0,001), который не оценивался при доступе через левую руку, поражение ствола левой коронарной артерии (5,7% и 1,3%, p=0,001). Стоит отметить весьма значимые статистические различия в количестве попыток пункции, времени пункции и установки интродьюсера, при этом никак не влияющие на общую продолжительность процедуры, время флюороскопии и поглощенную дозу, а также меньшую продолжительность сдавления места пункции ДЛА (180,0 и 155,0 мин, p<0,001) и более частое введение спазмолитиков в группе I (43,7% и 34,3%, p=0,008).
Группы по силе кисти и силе сжатия большого и указательного пальцев до процедуры и в контрольных точках после неё не имеют статистически значимых различий. Данные параметры оценивались у 55% группы I и 56% группы II. Результаты представлены в виде гистограмм на рисунках 2 А и Б.
Конечные точки. Получены статистически значимые различия по первичной конечной точке, ОЛА случилась у 10 пациентов группы I и 26 — группы II (2,7% и 6,8%, p=0,008) (табл. 3). При этом нет статически значимой разницы в дне выявления ОЛА, 48,5 (2,0-90,0) и 7,0 (2,0-90,0), p=0,520. Окклюзия ДЛА при проходимой ЛА также имела статистически значимые различия в группах (1,3% и 0%, p=0,023).
Во вторичных результатах получены статически значимые различия в пользу ДЛД по таким осложнениям, как гематома >5,0 см в месте пункции на 1 сут. (10,0% и 25,9%, p<0,001), гематома >5,0 см в месте пункции на 7 сут. (12,4% и 34,6%, p<0,001), кровотечение типа BARC 1 (3,8% и 21,7%, p<0,001); все показатели со средней статистической взаимосвязью по критерию Крамера. Кроме того, диссекция ЛА очень близка к статистически значимой разнице (1,6% и 3,9%, p=0,054). Полный анализ по конечным результатам представлен в таблице 3.
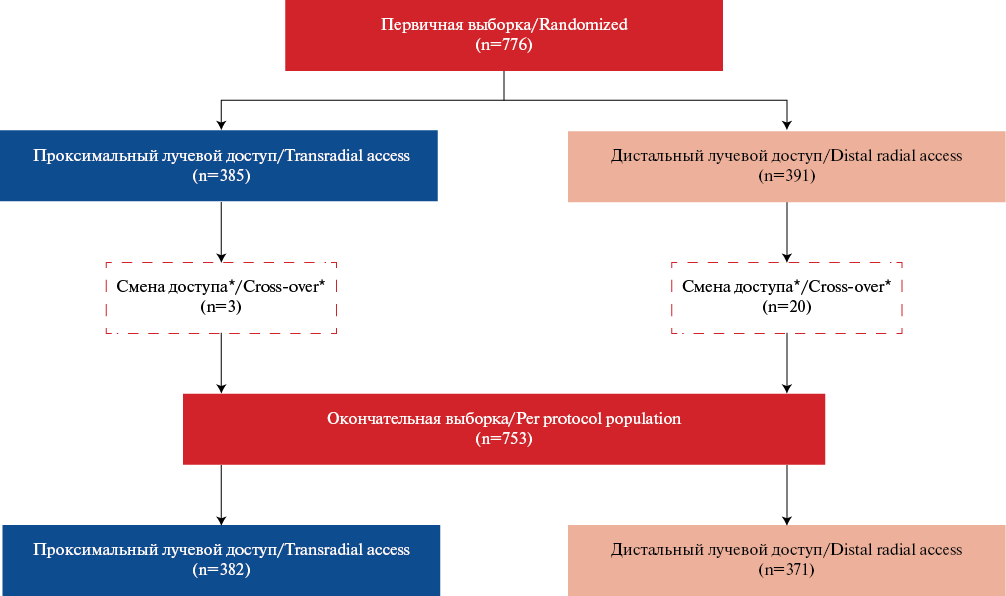
Рис. 1. Блок схема исследования.
Примечание: * — смена доступа — невозможность провести успешную катетеризацию рандомизированного места доступа из-за любых причин, с последующим сосудистым доступом в другой точке на этой или контрлатеральной конечности.
Таблица 1
Исходные данные пациентов
Показатель | Группа I | Группа II | p | V |
Возраст, лет | 63,0 (56,0-70,0) | 63,0 (56,0-69,0) | 0,873 | |
Мужчины, n (%) | 242 (65,2) | 254 (66,5) | 0,715 | |
ИМТ, кг/м2 | 29,0 (25,8-32,0) | 28,6 (26,0-32,0) | 0,738 | |
Окружность кисти, см | 19,0 (17,5-21,0) | 19,0 (17,5-21,0) | 0,530 | |
Рост, см | 171,0 (164,0-176,0) | 171,0 (164,0-178,0) | 0,529 | |
Факторы риска | ||||
Нестабильная стенокардия, n (%) | 55 (14,8) | 57 (14,9) | 0,970 | 0,001 |
Артериальная гипертензия, n (%) | 322 (86,8) | 331 (86,6) | 0,954 | 0,002 |
Сахарный диабет, n (%) | 102 (27,5) | 102 (26,7) | 0,807 | 0,009 |
Курение, n (%) | 110 (29,6) | 119 (31,2) | 0,654 | 0,016 |
Холестерин, ммоль/л | 4,8 (3,9-5,8) | 4,7 (3,8-5,6) | 0,300 | |
Креатинин, мкмоль/л | 87,2 (76,7-100,0) | 87,0 (75,0-99,0) | 0,783 | |
Кроверазжижающие препараты | ||||
Аспирин, n (%) | 319 (86,0) | 327 (85,6) | 0,881 | 0,005 |
Клопидогрел, n (%) | 168 (45,3) | 175 (45,8) | 0,884 | 0,005 |
Тикагрелор, n (%) | 52 (14,0) | 63 (16,5) | 0,345 | 0,034 |
Нефракционные гепарины, n (%) | 61 (16,4) | 62 (16,2) | 0,937 | 0,003 |
Низкомолекулярные гепарины, n (%) | 38 (10,5) | 62 (16,2) | 0,021 | 0,084 |
Варфарин, n (%) | 11 (3,0) | 13 (3,4) | 0,732 | 0,012 |
МНО | 1,1 (1,2-1,5) | 1,2 (1,3-1,8) | 0,331 | |
Оральные антикоагулянты, n (%) | 34 (9,2) | 36 (9,4) | 0,902 | 0,004 |
Примечание: ИМТ — индекс массы тела, МНО — международное нормализованное отношение.
Таблица 2
Процедурные характеристики
Показатель | Группа I | Группа II | p | V |
Правая сторона доступа, n (%) | 249 (67,1) | 228 (59,7) | 0,034 | 0,077 |
Положительный тест Аллена, n (%) | 354 (95,4) | 367 (96,1) | 0,699 | 0,031 |
КАГ, n (%) | 207 (55,8) | 193 (50,5) | 0,147 | 0,053 |
ЧКВ, n (%) | 164 (44,2) | 189 (49,5) | 0,147 | 0,053 |
Диаметр ЛА, мм | 2,2 (2,0-2,5) | 2,3 (2,0-2,5) | 0,518 | |
Диаметр ДЛА, мм | 2,5 (2,3-2,8) | 2,5 (2,3-2,9) | 0,213 | |
Количество попыток пункции | 1,0 (1,0-2,0) | 1,0 (1,0-2,0) | 0,022 | |
Время пункции, сек | 19,0 (8,0-50,0) | 13,5 (5,0-29,0) | <0,001 | |
Установка интродьюсера, сек | 42,0 (26,0-84,0) | 35,0 (23,0-55,0) | <0,001 | |
Первая катетеризация устья коронарной артерии, сек | 190,0 (135,0-300,0) | 184,5 (135,0-300,0) | 0,677 | |
Диаметр интродьюсера, F | 6,0 (6,0-6,0) | 6,0 (6,0-6,0) | 0,708 | |
Диаметр катетера, F | 5,0 (5,0-6,0) | 5,0 (5,0-6,0) | 0,851 | |
Смена катетеров, n (%) | 125 (33,7) | 145 (38,0) | 0,222 | 0,044 |
Продолжительность процедуры, мин | 20,0 (9,0-35,0) | 20,0 (7,0-35,0) | 0,395 | |
Доза радиации, mGy | 922,3 (487,3-1729,2) | 1005,0 (554,6-1893,0) | 0,178 | |
Время флюороскопии, мин | 5,4 (3,0-10,2) | 6,0 (2,8-10,8) | 0,682 | |
Патентованный гемостаз, n (%) | — | 376 (98,4) | ||
Давящая марлевая повязка, n (%) | 371 (100,0) | 6 (1,6) | <0,001 | 0,984 |
Общее время сдавления, мин | 180,0 (120,0-480,0) | 155,0 (125,0-195,0) | <0,001 | |
Балльная оценка субъективных ощущений (0-5) | 0,0 (0,0-2,0) | 0,0 (0,0-2,0) | 0,065 | |
Спазм ЛА, n (%) | 87 (23,5) | 87 (22,8) | 0,826 | 0,008 |
Вводимые препараты | ||||
Гепарин, МЕ | 5000,0 (5000,0-10000,0) | 5000,0 (7500,0-10000,0) | 0,164 | |
Спазмолитик, n (%) | 162 (43,7) | 131 (34,3) | 0,008 | 0,084 |
Блокаторы IIb/IIIa рецепторов, n (%) | 3 (0,8) | 4 (1,0) | 0,733 | 0,012 |
Вид поражения коронарных артерий | ||||
Ствол левой коронарной артерии, n (%) | 22 (5,9) | 11 (2,9) | 0,041 | 0,07 |
Однососудистое поражение, n (%) | 87 (23,5) | 94 (24,6) | 0,710 | 0,014 |
Многососудистое поражение, n (%) | 106 (28,6) | 118 (30,9) | 0,487 | 0,025 |
Хроническая окклюзия коронарной артерии, n (%) | 46 (12,4) | 34 (8,9) | 0,119 | 0,057 |
Бифуркационное поражение, n (%) | 75 (20,2) | 85 (22,3) | 0,495 | 0,025 |
Анатомия брахиоцефальных артерий | ||||
Кальциноз брахиоцефального ствола, n (%) | 21 (5,7) | 5 (1,3) | 0,001 | 0,119 |
Извитость ЛА, n (%) | 23 (6,2) | 21 (5,5) | 0,681 | 0,015 |
Высокое отхождение ЛА, n (%) | 13 (3,5) | 24 (6,3) | 0,078 | 0,064 |
Извитость брахиоцефального ствола, n (%) | 35 (9,4) | 38 (9,9) | 0,812 | 0,078 |
Сокращения: ДЛА — дистальная лучевая артерия, КАГ — коронароангиография, ЛА — лучевая артерия, ЧКВ — чрескожное коронарное вмешательство.
Рис. 2. Гистограмма силы кисти по времени.
Таблица 3
Первичные и вторичные результаты
Показатель | Группа I | Группа II | p | V |
ОЛА предплечья, n (%) | 10 (2,7) | 26 (6,8) | 0,008 | |
Окклюзия ДЛА, n (%) | 5 (1,3) | 0 (0) | 0,023 | 0,083 |
Диссекция ЛА, n (%) | 6 (1,6) | 15 (3,9) | 0,054 | 0,07 |
Тромбоз ЛА, n (%) | 0 (0,0) | 1 (0,3) | 0,324 | 0,036 |
Перфорация ЛА, n (%) | 3 (0,8) | 5 (1,3) | 0,503 | 0,024 |
Диссекция других артерий верхних конечностей, n (%) | 5 (1,3) | 4 (1,0) | 0,704 | 0,014 |
Потеря чувствительности, n (%) | 2 (0,5) | 1 (0,3) | 0,546 | 0,022 |
Гематома >5,0 см в месте пункции на 1 сут., n (%) | 37 (10,0) | 98 (25,9) | <0,001 | 0,204 |
Гематома >5,0 см в месте пункции на 7 сут., n (%) | 45 (12,4) | 132 (34,6) | <0,001 | 0,264 |
Кровотечение, BARC тип 1, n (%) | 14 (3,8) | 83 (21,7) | <0,001 | 0,268 |
Артериовенозная фистула, n (%) | 0 | 0 | ||
Ложная аневризма, n (%) | 0 | 2 (0,5) | 0,499 | 0,051 |
Инфекция в месте пункции, n (%) | 0 | 0 | — |
Сокращения: ДЛА — дистальная лучевая артерия, ЛА — лучевая артерия, ОЛА — окклюзия лучевой артерии.
Обсуждение
Исследование TENDERA — это первое проспективное многоцентровое рандомизированное клиническое исследование, сравнивающее ДЛД и ПЛД в интервенционной кардиологической практике со сроками наблюдения >1 мес., а также в максимально приближенных к ежедневной работе условиях (различные виды и диаметры интродьюсеров, диагностические и лечебные вмешательства, малое количество критериев исключения). Основной целью работы было показать превосходство ДЛД над ПЛД через меньшее число ОЛА на ранних, средних и отдаленных сроках наблюдения, которая выявлялась на дуплексном ультразвуковом сканировании или ангиографии. Для этого разработали оптимальный протокол исследования с правильным размером выборок в отличие от исследования DISCO RADIAL, где результатом стала низкая частота ОЛА в обеих группах, и ввиду заложенной небольшой ошибки II рода не получили статистически значимых различий между группами [22].
Полученные результаты по частоте ОЛА в исследуемых группах в среднесрочном периоде коррелируют с данными Eid-Lidt G, et al. (2021), где проверяли проходимость ЛА на сроках 24 ч и 1 мес. [24]. Заслуживает внимания факт, что частота ОЛА может увеличиваться со временем после вмешательства. Так, Gasparini GL, et al. (2019) обнаружили, что количество ОЛА увеличивается через 1 мес. по сравнению с первыми сутками после процедуры, что может быть связано с ремоделированием сосуда [25]. Возможно, подобный процесс происходит и в течение всего года после вмешательства. В одном из исследований авторы при многофакторном регрессионном анализе выявили связь ОЛА с несколькими факторами: женский пол, возраст, мануальная компрессия и диаметр ЛА, а в исследовании DISCO RADIL предположили, что их низкая частота ОЛА связана с использованием современных тонких интродьюсеров, адекватной антикоагулянтной перипроцедурной терапией, неокклюзионным и недлительным гемостазом [22][26]. Данные взаимосвязи будут также подробно изучены в исследовании TENDERA. Что уже интересно, в TENDERA время сдавления давящей повязкой в группе ДЛД статистически оказалось дольше, чем в группе ПЛД. Это не отразилось на первичной конечной точке, но могло отразиться на некоторых осложнениях вторичной конечной точки.
Важным среднесрочным результатом исследования TENDERA является наличие окклюзий ДЛА с проходимой ЛА в группе ДЛД, что сохраняет возможность повторного использования ЛА для эндоваскулярных процедур или других целей в будущем. Кроме того, если бы совместно с ДЛА у этих пациентов закрылась и ЛА, то количество ОЛА в группе I стало бы 15, и тогда не было бы статистической разницы по первичной конечной точке (4,0% и 6,8%, p=0,094). Впервые говорится о такой пользе доступа через ДЛА для сохранения проходимости ЛА и пациента в целом.
Отличительными особенностями настоящего исследования являются многофакторное сравнение двух доступов для поиска критериев, которые могут повлиять на первичную конечную точку, а также включение в исследование только опытных хирургов в отношении не только классических доступов, но и ДЛД.
Вторичные конечные точки и процедурные характеристики важны для лучшего понимания ДЛД. Смена доступа в группе ДЛД составила 5,1%, что более чем в 6 раз выше, чем в группе ПЛД (0,8%). Эта разница гораздо выше, чем в других схожих исследованиях и метаанализах. В максимально похожем по дизайну исследовании DISCO RADIAL разница оказалось двукратной в пользу ДЛД [22]. Однако если сравнить конкретные цифры, то частота смены доступа в DISCO RADIAL в группе ДЛД — 7,3%, а ПЛД — 3,5% [22], что, возможно, говорит о меньшем опыте хирургов в отношении к ЛА и ДЛА. В исследовании DAPROA частота смены доступа при попытке пункции ДЛА составила 13,3%, а в ANGIE — 22,3% [24, 27]. В настоящем исследовании отдаленные результаты пациентов, у которых была смена доступа, не оценивались.
Обращает на себя внимание гораздо большее количество спазмов ЛА, чем в предыдущих исследованиях, при этом спазмолитики использовались хирургами на свое усмотрение, что могло повлиять на этот показатель, а также иной подход к определению спазма ЛА — не только клинически, но и по данным ангиографии, которую проводили всем пациентам по протоколу в начале и конце процедуры [18][22][24][27].
Несмотря на статистически значимое более долгое время пункции и установку интродьюсера в группе ДЛД, по общей продолжительности операции и флюороскопии или дозе облучения различий получено не было, как и в DISCO RADIAL, в отличие от ANGIE [22][27].
Впервые одним из критериев сравнения исследуемых доступов стали сила кисти и сила сжатия большого и указательного пальцев. Статистически значимых различий в группах получено не было, что можно объяснить изучением данного критерия лишь у половины пациентов и несовершенством разработанного протокола динамометрии, но в будущем можно усовершенствовать данный подход и изучать более детально.
По вторичной конечной точке серьезные местные осложнения, такие как ложная аневризма, артериовенозная фистула, инфекция, не встречались вовсе или же были единичны, что коррелирует с данными литературы [12, 28, 29]. Однако получены существенные различия по кровотечениям I типа BARC и гематомам >5,0 см на начальных сроках наблюдения в пользу ДЛД, что может быть связано со статистически меньшей продолжительностью гемостаза в группе II. Подобных данных в других исследованиях получено не было [12][18][22][24][27-29].
В целом полученные среднесрочные результаты исследования TENDERA уже дают уникальные данные по применению ДЛД в коронарной практике опытными трансрадиальными эндоваскулярными хирургами. Основные ограничения связаны с меньшим диаметром ДЛА, что отражается на начале процедуры и требует определенной кривой обучения (порядка 50 процедур [16]), но никак не связаны с самими ЧКВ или КАГ. И эти же анатомо-физиологические особенности ДЛА, наоборот, способствуют надежному, быстрому и безопасному гемостазу в конце вмешательства, снижают при этом количество ОЛА.
Ограничения исследования. Впервые представлены результаты многоцентрового проспективного рандомизированного исследование по сравнению ДЛД и ПЛД со сроком наблюдения 3 мес. (по данным исследования TENDERA). Однако есть определенные ограничения, которые, возможно, будут учтены и устранены другими исследователями. Отсутствие в Российской Федерации зарегистрированного устройства для гемостаза ДЛА на начало исследования привело к разработке протокола гемостаза с помощью бинтовой повязки. Использование патентованного гемостаза при ДЛД может способствовать еще большему уменьшению количества гематом и кровотечений на различных сроках наблюдения. Учитывая зависимость первичного ЧКВ при ОКС с подъемом сегмента ST от времени, данная когорта пациентов была исключена из настоящего исследования. Применение спазмолитических препаратов на усмотрение оператора привело к статистически значимым различиям в группах, при этом развитие спазма ЛА в группах статистически не различалось.
Заключение
В исследовании TENDERA ДЛД показал эффективность и безопасность при интервенционных коронарных вмешательствах в сравнении с ПЛД в среднесрочном периоде наблюдения: статистически значимая меньшая частота ОЛА и местных осложнений. ПЛД в настоящее время остается золотым стандартом в интервенционной кардиологии, но ДЛД может уже сейчас выступать в качестве действенной альтернативы, особенно, у молодых пациентов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Коротких А. В., изобретатель и правообладатель. "Результаты дистального и классического лучевого доступа при проведении чрескожных коронарных вмешательств и коронарографий". Россия. RU 2022620918. 21.04.2022. https://elibrary.ru/item.asp?id=48492046.
Список литературы
1. Chiarito M, Cao D, Nicolas J, et al. Radial versus femoral access for coronary interventions: An updated systematic review and meta-analysis of randomized trials. Catheter Cardiovasc Interv. 2021;97(7):1387-96. doi:10.1002/ccd.29486.
2. Judkin MP, Gander MP. Prevention of complications of coronary arteriography. Circulation. 1974;49(4):599-602. doi:10.1161/01.cir.49.4.599.
3. Adams DF, Fraser DB, Abrams HL. The complications of coronary arteriography. Circulation. 1973;48(3):609-18. doi:10.1161/01.cir.48.3.609.
4. Dodek A, Boone JA, Hooper RO, et al. Complications of coronary arteriography. Can Med Assoc J. 1983;128(8):934-6.
5. Campeau L. Percutaneous radial artery approach for coronary angiography. Cathet Cardiovasc Diagn. 1989;16(1):3-7. doi:10.1002/ccd.1810160103.
6. Kiemeneij F, Laarman GJ. Percutaneous transradial artery approach for coronary stent implantation. Cathet Cardiovasc Diagn. 1993;30(2):173-8. doi:10.1002/ccd.1810300220.
7. Rao SV, Cohen MG, Kandzari DE, et al. The transradial approach to percutaneous coronary intervention: historical perspective, current concepts, and future directions. J Am Coll Cardiol. 2010;55(20):2187-95. doi:10.1016/j.jacc.2010.01.039.
8. Valgimigli M, Gagnor A, Calabró P, et al. MATRIX Investigators. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial. Lancet. 2015;385(9986):2465-76. doi:10.1016/S0140-6736(15)60292-6.
9. Hamon M, Pristipino C, Di Mario C, et al. Consensus document on the radial approach in percutaneous cardiovascular interventions: position paper by the European Association of Percutaneous Cardiovascular Interventions and Working Groups on Acute Cardiac Care and Thrombosis of the European Society of Cardiology. EuroIntervention. 2013; 8(11):1242-51. doi:10.4244/eijv8i11a192.
10. Gatzopoulos D, Rigatou A, Kontopodis E, et al. Alternative access site choice after initial radial access site failure for coronary angiography and intervention. J Geriatr Cardiol. 2018;15(9):585-90. doi:10.11909/j.issn.1671-5411.2018.09.001.
11. Sinha SK, Jha MJ, Mishra V, et al. Radial Artery Occlusion — Incidence, Predictors and Long-term outcome after TRAnsradial Catheterization: clinico-Doppler ultrasound-based study (RAIL-TRAC study). Acta Cardiol. 2017;72(3):318-27. doi:10.1080/00015385.2017.1305158.
12. Коротких А. В., Бабунашвили А. М. Дистальный лучевой доступ — современные тенденции. Эндоваскулярная хирургия. 2021;8(2): 135-43. doi:10.24183/2409-4080-2021-8-2-135-143.
13. Babunashvili A, Dundua D. Recanalization and reuse of early occluded radial artery within 6 days after previous transradial diagnostic procedure. Catheter Cardiovasc Interv. 2011; 77(4):530-6. doi:10.1002/ccd.22846.
14. Каледин А. Л., Кочанов И. Н., Селецкий С. С. и др. Особенности артериального доступа в эндоваскулярной хирургии у больных пожилого возраста. Успехи геронтологии. 2014;27(1):115-9.
15. Коротких А. В. Новые возможности использования лучевой артерии при проведении ангиографических исследований. Материалы научно-практической конференции с международным участием "Современные аспекты диагностики и лечения в кардиохирургии", Хабаровск. 2015:56-60. EDN UJSVVP.
16. Коротких А. В., Бондарь В. Ю. Использование глубокой ладонной ветви лучевой артерии в области анатомической табакерки при проведении ангиографических исследований. Дальневосточный медицинский журнал. 2016;1:24-7.
17. Kim Y, Lee JW, Lee SY, et al. Feasibility of primary percutaneous coronary intervention via the distal radial approach in patients with ST-elevation myocardial infarction. Korean J Intern Med. 2021;36(Suppl 1):S53-S61. doi:10.3904/kjim.2019.420.
18. Hadjivassiliou A, Cardarelli-Leite L, Jalal S, et al. Left Distal Transradial Access (ldTRA): A Comparative Assessment of Conventional and Distal Radial Artery Size. Cardiovasc Intervent Radiol. 2020;43(6):850-7. doi:10.1007/s00270-020-02485-7.
19. Rajah GB, Lieber B, Kappel AD, et al. Distal transradial access in the anatomical snuffbox for balloon guide-assisted stentriever mechanical thrombectomy: Technical note and case report. Brain Circ. 2020;6(1):60-4. doi:10.4103/bc.bc_22_19.
20. Kühn AL, de Macedo Rodrigues K, Singh J, et al. Distal radial access in the anatomical snuffbox for neurointerventions: a feasibility, safety, and proof-of-concept study. J Neurointerv Surg. 2020;12(8):798-801. doi:10.1136/neurintsurg-2019-015604.
21. Achim A, Kákonyi K, Jambrik Z, et al. Distal Radial Artery Access for Coronary and Peripheral Procedures: A Multicenter Experience. J Clin Med. 2021;10(24):5974. doi:10.3390/jcm10245974.
22. Aminian A, Sgueglia GA, Wiemer M, et al. Distal Versus Conventional Radial Access for Coronary Angiography and Intervention: The DISCO RADIAL Trial. JACC Cardiovasc Interv. 2022;15(12):1191-201. doi:10.1016/j.jcin.2022.04.032.
23. Коротких А. В., Бабунашвили А. М., Каледин А. Л. и др. Анализ промежуточных результатов сравнительного многоцентрового рандомизированного исследования TENDERA по изучению дистального лучевого доступа. Новости хирургии. 2021;29(3):285-95. doi:10.18484/2305-0047.2021.3.285.
24. Eid-Lidt G, Rivera Rodríguez A, Jimenez Castellanos J, et al. Distal Radial Artery Approach to Prevent Radial Artery Occlusion Trial. JACC Cardiovasc Interv. 2021;14(4):378-85. doi:10.1016/j.jcin.2020.10.013.
25. Gasparini GL, Garbo R, Gagnor A, et al. First prospective multicentre experience with distal transradial approach for coronary chronic total occlusion interventions using a 7 Fr Glidesheath Slender. EuroIntervention. 2019;15(1):126-8. doi:10.4244/EIJ-D-18-00648.
26. Sadaka MA, Etman W, Ahmed W, et al. Incidence and predictors of radial artery occlusion after transradial coronary catheterization. Egypt Heart J. 2019;71(1):12. doi:10.1186/s43044-019-0008-0.
27. Tsigkas G, Papageorgiou A, Moulias A, et al. Distal or Traditional Transradial Access Site for Coronary Procedures: A Single-Center, Randomized Study. JACC Cardiovasc Interv. 2022;15(1):22-32. doi:10.1016/j.jcin.2021.09.037.
28. Korotkikh AV, Babunashvili AM, Kazantsev AN, et al. Distal Radial Access: Is There a Clinical Benefit? Cardiol Rev. 2024;32(2):110-3. doi:10.1097/CRD.0000000000000472.
29. Korotkikh AV, Babunashvili AM, Kazantsev AN, et al. Distal Radial Artery Access in Non-coronary Procedures. Curr Probl Cardiol. 2023;48(8):101207. doi:10.1016/j.cpcardiol.2022.101207.
Об авторах
А. В. КороткихРоссия
К.м. н., главный врач, врач сердечно-сосудистый хирург, врач по рентгенэндоваскулярным диагностике и лечению, Клиника кардиохирургии.
Благовещенск
Конфликт интересов:
Нет
А. М. Бабунашвили
Россия
Д. м. н., профессор кафедры интервенционной кардиоангиологии; руководитель сосудистого центра, Центр эндохирургии и литотрипсии.
Москва
Конфликт интересов:
Нет
А. Л. Каледин
Россия
К.м.н., врач-хирург отделения рентгенхирургических методов диагностики и лечения.
Санкт-Петербург
Конфликт интересов:
Нет
Р. В. Ахрамович
Россия
К.м.н., врач по рентгенэндоваскулярным диагностике и лечению.
Мытищи
Конфликт интересов:
Нет
В. В. Деркач
Россия
Руководитель регионального сосудистого центра, Центр эндохирургии и литотрипсии.
Москва
Конфликт интересов:
Нет
Р. М. Портнов
Россия
Врач по рентгенэндоваскулярным диагностике и лечению, Клиника инновационной хирурги.
Клин
Конфликт интересов:
Нет
Д. С. Карташов
Россия
К. м. н., зав. ОРХМДиЛ сосудистого центра, Центр эндохирургии и литотрипсии.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
- Впервые представлены среднесрочные результаты (3 мес.) проспективного рандомизированного исследования применения дистального лучевого доступа в сравнении с классическим лучевым доступом при лечебных и диагностических вмешательствах на коронарных сосудах.
- Выявлено статистически значимое меньшее количество окклюзий лучевой артерии при проведении интервенционных процедур через дистальный лучевой доступ, а также случаи окклюзии дистальной части лучевой артерии на тыльной поверхности кисти при проходимой собственно лучевой артерии предплечья.
Рецензия
Для цитирования:
Коротких А.В., Бабунашвили А.М., Каледин А.Л., Ахрамович Р.В., Деркач В.В., Портнов Р.М., Карташов Д.С. Дистальный лучевой доступ как альтернатива классическому лучевому доступу при проведении коронароангиографий и чрескожных коронарных вмешательств. Российский кардиологический журнал. 2024;29(12):5737. https://doi.org/10.15829/1560-4071-2024-5737. EDN: LXDOEZ
For citation:
Korotkikh A.V., Babunashvili A.M., Kaledin A.L., Akhramovich R.V., Derkach V.V., Portnov R.M., Kartashov D.S. Distal radial access as an alternative to conventional radial access in coronary angiography and percutaneous coronary interventions. Russian Journal of Cardiology. 2024;29(12):5737. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5737. EDN: LXDOEZ
JATS XML

















































