Перейти к:
Сравнительный анализ стандартных индексов перфузионной сцинтиграфии миокарда и количественных показателей динамической однофотонной эмиссионной компьютерной томографии миокарда у пациентов с необструктивным атеросклеротическим поражением коронарных артерий
https://doi.org/10.15829/1560-4071-2024-6166
EDN: ZWRBDF
Аннотация
Цель. Провести сравнительный анализ стандартных индексов перфузионной сцинтиграфии миокарда (ПСМ) и количественных показателей динамической однофотонной эмиссионной компьютерной томографии (ОФЭКТ) миокарда у пациентов с необструктивным атеросклеротическим поражением коронарных артерий (НАПКА).
Материал и методы. В исследование были включены пациенты с симптомами или признаками ишемии миокарда и НАПКА (<50%). Всем пациентам была выполнена динамическая ОФЭКТ миокарда с оценкой стандартных индексов ПСМ (суммарный индекс нарушения перфузии при выполнении нагрузочной пробы (SSS), суммарный индекс нарушения перфузии в покое (SRS), разница между SSS и SRS (SDS)) и количественных показателей — миокардиальный кровоток (МК) при нагрузке (стресс-МК) и в покое (покой-МК), резерв МК (РМК) и разница стресс-МК и покой-МК (ΔМК).
Результаты. По данным ПСМ 15 (26%) пациентов имели признаки нарушения миокардиальной перфузии (SSS ≥2,0). Стандартные индексы ПСМ имели невысокие значения: SSS 0,0 (0,0; 2,0), SRS 0,0 (0,0; 0,0), SDS 0,0 (0,0; 2,0) баллов. По данным динамической ОФЭКТ миокарда 22 (38%) пациента имели сниженный РМК <2,0. Количественные показатели характеризовались большей вариабельностью, по сравнению с данными ПСМ: стресс-МК 1,34 (1,03; 1,64) мл/мин/г, покой-МК 0,58 (0,42; 0,73) мл/мин/г, РМК 2,42 (1,48; 2,85), ΔМК 0,68 (0,36; 1,09). При сопоставлении данных ПСМ с динамической ОФЭКТ миокарда (NRAC) установлено, что у 7 (12%) пациентов наличие ишемических изменений миокарда (SSS ≥2,0) ассоциировалось со сниженным РКМ <2,0, а у 28 (48%) без признаков ишемии (SSS <2,0) показатель РМК был в пределах нормальных значений ≥2,0. Однако 15 (26%) имели нормальный характер распределения радиофармацевтического препарата и сниженный РМК, что может говорить о начальных этапах развития микроваскулярной дисфункции, которая не привела к ишемическим изменениям миокарда.
Заключение. Метод динамической ОФЭКТ позволяет в ~30% случаев идентифицировать нарушение МК и РМК у пациентов с нормальными результатами стандартной ПСМ на фоне НАПКА.
Ключевые слова
Для цитирования:
Мальцева А.Н., Мочула А.В., Гракова Е.В., Копьева К.В., Цыгикало А.А., Завадовский К.В. Сравнительный анализ стандартных индексов перфузионной сцинтиграфии миокарда и количественных показателей динамической однофотонной эмиссионной компьютерной томографии миокарда у пациентов с необструктивным атеросклеротическим поражением коронарных артерий. Российский кардиологический журнал. 2024;29(12):6166. https://doi.org/10.15829/1560-4071-2024-6166. EDN: ZWRBDF
For citation:
Maltseva A.N., Mochula A.V., Grakova E.V., Kopyeva K.V., Tsygikalo A.A., Zavadovsky K.V. Comparative analysis of standard indices of myocardial perfusion scintigraphy and quantitative indicators of myocardial dynamic single-photon emission computed tomography in patients with non-obstructive coronary artery disease. Russian Journal of Cardiology. 2024;29(12):6166. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6166. EDN: ZWRBDF
Ишемическая болезнь сердца (ИБС) — это заболевание миокарда, развивающееся в результате органического или функционального нарушения кровотока в коронарных артериях (КА). На протяжении долгого периода времени медицинское сообщество считало необструктивное атеросклеротическое поражение КА (НАПКА) относительно благоприятным признаком с точки зрения тяжести течения заболевания, его возможных рисков и прогностической значимости. Однако за последние несколько лет ряд клинических исследований подтвердили, что данная группа пациентов может иметь высокую вероятность развития неблагоприятных сердечно-сосудистых событий, по сравнению с пациентами без атеросклероза КА [1].
Рабочей группой Европейского общества кардиологов выдвинуто предложение, что у 2/3 пациентов с симптомами или признаками ИБС и НАПКА, прогрессирование заболевания и развитие осложнений может быть обусловлено наличием коронарной микроваскулярной дисфункции (МД) [2]. Более того, в рекомендациях Европейского общества кардиологов 2024г пациенты с ишемией или стенокардией на фоне НАПКА были выделены в отдельную группу хронических коронарных синдромов [3]. В связи с этим появляется необходимость уделять внимание не только анатомической оценке коронарного русла, но и углубленному изучению микроциркуляции миокарда.
В настоящее время радионуклидные исследования (позитронная эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ) перфузионная сцинтиграфия миокарда (ПСМ)) хорошо зарекомендовали себя для идентификации ишемии миокарда левого желудочка (ЛЖ) и позволяют кроме визуальных и полуколичественных данных о состоянии миокардиальной перфузии получить и количественные значения миокардиального кровотока (МК) и резерва МК (РМК) [3][4].
Однако в научной литературе имеется ограниченное количество исследований, посвященных оценке МК и РМК с помощью динамической ОФЭКТ миокарда, выполненной на гамма-камере с высокочувствительными полупроводниковыми кадмий-цинк-теллуровыми детекторами (CZT-детекторы), в аспекте сравнения с данными стандартной ПСМ у пациентов с НАПКА. Ранее было установлено, что пациенты с обструктивным атеросклеротическим поражением КА имеют более низкие значения МК и РМК [5], получены данные о высокой ассоциации показателей МК и РМК с фракционным резервом кровотока [6], результатами ПЭТ миокарда [7], а также с биомаркерами дислипидемии и другими факторами риска сердечно-сосудистых заболеваний (ССЗ) [8]. Стоит учесть, что в вышеперечисленных работах проводился анализ состояния микроциркуляции у пациентов с обструктивным атеросклеротическим поражением КА, которое само по себе может влиять на показатели МК и РМК. В пилотном исследовании пациентов с семейной гиперхолестеринемией и НАПКА (n=12) определили, что начальный уровень РМК не был снижен в обеих группах пациентов, однако стресс-МК имел тенденцию к снижению, по данным динамической ОФЭКТ миокарда [9]. Поэтому остается актуальным изучение применения неинвазивных методов оценки МД у пациентов с НАПКА. В будущем дополнительные сцинтиграфические признаки МД могут привести к оптимизации медикаментозной терапии и более точной стратификации рисков развития осложнений в данной группе пациентов.
Целью исследования являлось проведение сравнительного анализа стандартных индексов ПЭТ миокарда и количественных показателей динамической ОФЭКТ миокарда у пациентов с НАПКА.
Материал и методы
Дизайн исследования. В период с 2021 по 2023гг 2400 пациентам с симптомами или признаками ишемии миокарда и показаниями к проведению неинвазивных визуализирующих методов диагностики, согласно клиническим рекомендациям Министерства здравоохранения Российской Федерации по стабильной ИБС, была выполнена мультиспиральная компьютерная томография сердца — коронарная ангиография (МСКТ-КГ). По результатам исследования 155 пациентов с НАПКА (<50%) были рассмотрены для участия в данном наблюдательном проспективном исследовании. Блок-схема, отражающая включение пациентов в исследование, представлена на рисунке 1.

Рис. 1. Блок-схема, отражающая включение пациентов в исследование.
Сокращения: ИБС — ишемическая болезнь сердца, КА — коронарные артерии, МСКТ-КГ — мультиспиральная компьютерная томография сердца — коронарная ангиография, ОФЭКТ — однофотонная эмиссионная компьютерная томография, ПСМ — перфузионная сцинтиграфия миокарда.
Критерии включения: наличие картины типичной или атипичной стенокардии и/или ее эквивалента — одышки при физической нагрузке; НАПКА (<50%) по данным МСКТ-КГ. Критерии исключения: обструктивное атеросклеротическое поражение КА (≥50%); фракция выброса ЛЖ <50%; КТ-признаки гипертрофии или дилатации ЛЖ; перенесенный в анамнезе инфаркт миокарда; состояние после реваскуляризации миокарда; неконтролируемая/резистентная артериальная гипертензия; сахарный диабет в стадии декомпенсации; морбидное ожирение (индекс массы тела ≥40 кг/м2); хроническая болезнь почек >2 стадии; наличие клапанной патологии; кардиомиопатии; воспалительные заболевания миокарда.
Исследование было проведено в соответствии с положением Хельсинкской декларации и одобрено локальным комитетом по биомедицинской этике (протокол № 204 от 18.11.2020). Все пациенты дали письменное информированное согласие для участия в исследовании.
В соответствии с дизайном и протоколом научного исследования всем пациентам было выполнено комплексное клиническое и лабораторно-инструментальное обследование, которое включало в себя сбор жалоб и анамнеза, опросники, оценивающие качество жизни и состояние здоровья "EQ-5D-5L" и "Seattle Angina Questionnaire" ("SAQ"), определение лабораторных показателей крови — общий и биохимический анализ крови, липидограмма, коагулограмма, инструментальные исследования — МСКТ-КГ (на этапе отбора) и динамическая ОФЭКТ ПСМ. Исследование выполнили с использованием научно-исследовательского оборудования "Медицинская геномика" на базе Центра коллективного пользования.
Динамическая ОФЭКТ ПСМ. Подготовка и протокол исследования, описание технических характеристик записи, обработки стандартных и динамических сцинтиграфических данных подробно нами были изложены в предыдущих работах [10][11]. Временной интервал между МСКТ-КГ и динамической ОФЭКТ ПСМ составил 11,1±8,2 дней.
Динамическая ОФЭКТ ПСМ включала в себя два этапа обследования: 1. Динамическая запись первого прохождения болюса радиофармацевтического препарата по камерам сердца для определения количественных показателей МК и РМК; 2. ПСМ — через 60 мин после первого этапа для оценки стандартных индексов нарушения перфузии.
Исследование проводили в утренние часы натощак, на фоне синусового ритма сердца, по двухдневному протоколу "покой-нагрузка" с радиофармацевтическим препаратом 99mTc-метокси-изобутил-изонитрил, для проведения фармакологического стресс-теста использовали инфузию аденозинтрифосфата в дозировке 160 мкг/кг/мин в течение 4 мин. Общая эффективная лучевая нагрузка исследования составила 4,4 до 7,5 мЗв.
Все исследования выполнили на гибридном компьютерном томографе Discovery NM/CT 570с (GE Healthcare, США), оснащенном КТ-частью с 64 рядами детекторов и ОФЭКТ-частью с CZT-детекторами. Для получения данных о МК и РМК использовали модель Net Retention с коррекцией аттенюации (NRAC) и однокомпартментную (односоставную) модель (1CAC) с коррекцией аттенюации.
В результате постпроцессинговой обработки получили количественные сцинтиграфические показатели: стресс-МК — миокардиальный кровоток при нагрузке, покой-МК — миокардиальный кровоток в покое, РМК, ΔМК — разница стресс-МК и покой-МК, а также стандартные индексы нарушения миокардиальной перфузии: Summed Stress Score (SSS) — суммарный индекс нарушения перфузии при выполнении нагрузочной пробы, Summed Rest Score (SRS) — суммарный индекс нарушения перфузии в покое, Summed Difference Score (SDS) — разница между SSS и SRS.
Нарушение миокардиальной перфузии определяли при значении SSS ≥2,0 в одном или в двух смежных сегментах полярной карты при значении SSS ≥1,0 [12], РМК относили к сниженному при его значении <2,0, основываясь на работах, проведенных при помощи ПЭТ [13].
Статистическая обработка данных. Статистическую обработку полученных результатов выполнили в программах STATISTICA 10.0 (StatSoft Inc, США) и Jamovi version 2.2.5.0 (The Jamovi project, Австралия). Графические изображения формировали в программах Jamovi version 2.2.5.0. Для проверки нормальности выборочных значений количественных показателей использовали критерий Шапиро-Уилка (распределение считалось нормальным при p>0,05). При статистическом описании количественных показателей использовали среднее арифметическое значение (M) и стандартное отклонение (SD) для выборок, подчиняющихся нормальному закону распределения, и медиана (Me) и межквартильные интервалы (25-й и 75-й процентиль) для выборок, не подчиняющихся закону нормального распределения. Качественные данные представляли абсолютными и относительными (в %) частотами. Для анализа корреляционных связей количественных показателей, не имеющих нормального распределения выборочных данных, использовали ранговый коэффициент корреляции Спирмена. Для сопоставления двух моделей обработки динамических сцинтиграфических данных применяли анализ Бланда-Альтмана с определением среднего значения разницы и пределов согласия. Все статистические решения считали значимыми при уровне значимости p<0,05.
Результаты
В исследование включено 58 пациентов (37 мужчин, возраст 55,9±9,9 лет), соответствующих критериям. Клиническая характеристика пациентов представлена в таблице 1. Все пациенты, вошедшие в исследование, имели хотя бы одну жалобу, характерную для ИБС, в соответствии с современными клиническими рекомендациями [3, 4]. По данным анамнеза, практически все пациенты имели более двух факторов риска ССЗ, чаще регистрировались следующие: артериальная гипертензия, отягощенная наследственность по ССЗ, дислипидемия и ожирение.
В аспекте получаемой медикаментозной терапии пациенты данной группы чаще всего принимали липидснижающую терапию, бета-адреноблокаторы, антиагреганты и ингибиторы ангиотензинпревращающего фермента.
Пациенты, вошедшие в исследование, характеризовались повышенными уровнями маркеров дислипидемии в сыворотке крови, в остальном показатели общего и биохимического анализа крови, коагулограммы были в пределах целевых значений (табл. 2).
В день проведения динамической ОФЭКТ миокарда пациенты заполняли опросники "EQ-5D-5L" и "SAQ", результаты которых приведены в таблице 3. В среднем, пациенты в данной выборке имели незначительные и умеренные жалобы со стороны субъективной оценки состояния своего здоровья, согласно опроснику "EQ-5D-5L". По данным опросника "SAQ", качество жизни пациентов было снижено, в большинстве за счет наличия ограничений при выполнении физических нагрузок и общего отношения к болезни, обусловленного наличием боли в грудной клетке и одышки. Корреляционный анализ показателей динамической ОФЭКТ ПСМ не выявил наличия значимых взаимосвязей с данными опросников.
Сцинтиграфическая характеристика показателей стандартной и динамической ОФЭКТ ПСМ представлена в таблице 4. Признаки нарушения миокардиальной перфузии (SSS ≥2) имели 15 (26%) пациентов. При анализе количественных данных динамической ОФЭКТ миокарда было установлено, что более трети пациентов имели сниженный РМК (<2,0) — 22 (38%) и 24 (41%) по NRAC и 1CAC моделям обработки, соответственно.
Графики распределения значений сцинтиграфических показателей динамической ОФЭКТ ПСМ представлены на рисунках 2 и 3. При сопоставлении данных ПСМ с динамической ОФЭКТ миокарда (NRAC) установлено, что у 7 (12%) пациентов наличие ишемических изменений миокарда (SSS ≥2,0) ассоциировалось со сниженным РКМ <2,0, а у 28 (48%) без признаков ишемии (SSS <2,0) показатель РМК был в пределах нормальных значений ≥2,0. Однако 15 (26%) имели нормальный характер распределения радиофармацевтического препарата и сниженный РМК, что может говорить о начальных этапах развития МД, которая не привела к ишемическим изменениям миокарда. Учитывая тот факт, что у 8 (14%) пациентов имели место SSS ≥2,0 и сохраненный РМК, можно предположить, что причиной такого результата является глобальный характер оценки РМК, который нивелирует сниженный РМК в одном из сегментов ЛЖ за счет сохраненного значения в других сегментах. При использовании модели 1CAC получили схожие результаты (табл. 4). Диаграммы сопоставления данных ПСМ и динамической ОФЭКТ миокарда представлены на рисунке 4.
Данные динамической ОФЭКТ миокарда рассчитывали с использованием двух моделей — NRAC и 1CAC. Значительная часть пациентов 50 (86%) были классифицированы в одну и ту же группу по значению РМК при использовании разных моделей обработки. Все количественные сцинтиграфические показатели, рассчитанные по моделям NRAC и 1CAC, имели сильные положительные корреляционные взаимосвязи между собой: стресс-МК (ρ=0,79, p<0,001), покой-МК (ρ=0,80, p<0,001), РМК (ρ=0,79, p<0,001) и ΔМК (ρ=0,83, p<0,001). Анализ Бланда-Альтмана показал, что обе модели сопоставимы друг с другом (p=0,73) со средним значением разницы РМК 0,03 (доверительный интервал: -0,15-0,23), что допускает использование любой из двух моделей обработки количественных показателей МК и РМК в группе пациентов с НАПКА.
Таблица 1
Клиническая характеристика пациентов с НАПКА
Показатели | Все пациенты, n=58 |
Возраст, годы | 55,9±9,9 |
Мужской пол, n (%) | 37 (64%) |
Боль в грудной клетке, n (%): — Типичная стенокардия — Атипичная стенокардия — Неангинозная боль | 49 (84%) 15 (31%) 22 (45%) 12 (24%) |
Одышка при физической нагрузке, n (%) | 42 (72%) |
Группа по ПТВ ИБС — <5% — 5-15% — >15% | 4 (7%) 25 (43%) 29 (50%) |
ПТВ ИБС, % | 15,5 (10,0; 20,0) |
Клиническая вероятность ИБС (по рекомендациям ЕОК 2024), % | 10,0 (6,0; 17,0) |
Общее количество факторов риска ССЗ, n | 3,0 (2,0; 4,0) |
Количество факторов риска ССЗ, n (%): — 1 — 2 — 3 — ≥4 | 7 (12%) 10 (17%) 25 (43%) 16 (28%) |
ИБС, n (%) | 22 (38%) |
Артериальная гипертензия, n (%) | 50 (86%) |
САД, мм рт.ст. | 122,0 (120,0; 130,0) |
ДАД, мм рт.ст. | 76,0 (70,0; 80,0) |
Дислипидемия (на момент исследования), n (%) | 33 (57%) |
Гиперхолестеринемия (на момент исследования), n (%) | 26 (45%) |
Курение, n (%) | 17 (29%) |
Индекс курильщика, пачка/годы | 26,5 (11,7; 35,0) |
Отягощенная наследственность по ССЗ, n (%) | 42 (72%) |
Ожирение (ИМТ ≥30,0 кг/м2), n (%) | 23 (40%) |
ИМТ, кг/м2 | 28,6 (26,8; 31,2) |
Нарушение толерантности к глюкозе, n (%) | 6 (10%) |
Сахарный диабет 2 типа, n (%) | 2 (3%) |
ФВ ЛЖ (по данным эхокардиографии), % | 65,0 (64,0; 67,0) |
КДО ЛЖ (по данным эхокардиографии), мл | 108,0 (98,0; 122,0) |
КСО ЛЖ (по данным эхокардиографии), мл | 38,0 (33,0; 45,0) |
Максимальный стеноз коронарных артерий (по данным МСКТ-КГ), % | 30,0 (20,0; 40,0) |
Кальциевый индекс (по данным МСКТ-КГ), ед. Агатстона | 12,0 (0,0; 62,0) |
Медикаментозная терапия | |
Бета-адреноблокаторы, n (%) | 24 (41%) |
Ингибиторы ангиотензинпревращающего фермента, n (%) | 17 (29%) |
Блокаторы рецепторов ангиотензина II, n (%) | 11 (19%) |
Диуретики, n (%) | 11 (19%) |
Антагонисты кальциевых каналов, n (%) | 14 (24%) |
Антиангинальные препараты, n (%) | 11 (19%) |
Антиагреганты, n (%) | 23 (40%) |
Липидснижающая терапия, n (%) | 29 (50%) |
Сокращения: ДАД — диастолическое артериальное давление, ЕОК — Европейское общество кардиологов, ИМТ — индекс массы тела, КДО ЛЖ — конечно-диастолический объем левого желудочка, КСО ЛЖ — конечно-систолический объем левого желудочка, МСКТ-КГ — мультиспиральная компьютерно-томографическая коронарография, ПТВ ИБС — промежуточная предтестовая вероятность ишемической болезни сердца, САД — систолическое артериальное давление, ССЗ — сердечно-сосудистые заболевания, ФВ ЛЖ — фракция выброса левого желудочка.
Таблица 2
Лабораторные показатели крови
Показатели | Все пациенты, n=58 |
ОХС, ммоль/л | 4,76 (4,01; 6,05) |
ХС ЛНП, ммоль/л | 2,95 (1,8; 3,61) |
ХС ЛВП, ммоль/л | 1,34 (1,14; 1,67) |
ТГ, ммоль/л | 1,56 (0,92; 2,22) |
ХС ЛНП/ХС ЛВП | 2,15 (1,4; 2,96) |
ИА | 2,61 (1,71; 3,55) |
ХС не-ЛВП, ммоль/л | 3,59 (2,52; 4,54) |
Глюкоза, ммоль/л | 5,87 (5,48; 6,2) |
Креатинин, мкмоль/л | 84,0 (70,0; 97,0) |
КФК, ед./л | 96,0 (73,0; 143,0) |
СРБ, мг/л | 3,3 (2,7; 7,4) |
Эритроциты, 10Е12/л | 4,89 (4,63; 5,23) |
Лейкоциты, 10Е9/л | 6,19 (5,43; 7,08) |
Тромбоциты, 10Е9/л | 242,0 (195,0; 282,5) |
Гемоглобин, г/л | 145,0 (133,5; 153,0) |
Гематокрит, % | 44,6 (41,1; 46,8) |
СОЭ, мм/ч | 7,0 (4,0; 14,0) |
МНО, отн. ед. | 0,95 (0,92; 1,01) |
АЧТВ, сек | 27,55 (26,1; 30,3) |
Фибриноген, г/л | 2,89 (2,54; 3,32) |
Сокращения: АЧТВ — активированное частичное тромбопластиновое время, ИА — индекс атерогенности, КФК — креатининфосфокиназа, МНО — международное нормализованное отношение, ОХС — общий холестерин, СОЭ — скорость оседания эритроцитов, СРБ — С-реактивный белок, ТГ — триглицериды, ХС ЛВП — холестерин липопротеинов высокой плотности, ХС ЛНП — холестерин липопротеинов низкой плотности, ХС ЛНП/ХС ЛВП — отношение холестерина липопротеинов низкой плотности к холестерину липопротеинов высокой плотности, ХС не-ЛВП — не холестерин липопротеинов высокой плотности.
Таблица 3
Субъективное качество жизни и состояние здоровья по данным опросников
Показатели | Все пациенты, n=58 |
Опросник "EQ-5D-5L" | |
Трудности при ходьбе, баллы | 1,0 (1,0; 2,0) |
Сложности при уходе за собой, баллы | 1,0 (1,0; 1,0) |
Сложности при привычной повседневной деятельности, баллы | 1,5 (1,0; 2,0) |
Наличие боли или дискомфорта, баллы | 2,0 (1,0; 2,0) |
Чувства тревоги или депрессии, баллы | 2,0 (1,0; 2,0) |
Сумма баллов, баллы | 8,0 (7,0; 10,0) |
Субъективное состояние здоровья, % | 70,0 (60,0; 85,0) |
Опросник "Seattle Angina Questionnaire" | |
Индекс ограничения физических нагрузок, % | 66,7 (57,8; 75,6) |
Индекс стабильности приступов, % | 100,0 (75,0; 100,0) |
Индекс частоты приступов, % | 85,0 (70,0; 100,0) |
Индекс удовлетворенности лечением, % | 88,8 (62,5; 100,0) |
Индекс общего отношение к болезни, % | 50,0 (41,7; 75,0) |
Таблица 4
Сцинтиграфическая характеристика пациентов
Показатели | Все пациенты, n=58 |
ПСМ | |
SSS, баллы | 0,0 (0,0; 2,0) |
SRS, баллы | 0,0 (0,0; 0,0) |
SDS, баллы | 0,0 (0,0; 2,0) |
Количество пациентов с нарушением миокардиальной перфузии (SSS ≥2,0), n (%) | 15 (26%) |
Динамическая ОФЭКТ миокарда | |
Модель NRAC | |
Стресс-МК, мл/мин/г | 1,34 (1,03; 1,64) |
Покой-МК, мл/мин/г | 0,58 (0,42; 0,73) |
РМК | 2,42 (1,48; 2,85) |
ΔМК, мл/мин/г | 0,68 (0,36; 1,09) |
Количество пациентов с РМК <2,0, n (%) | 22 (38%) |
Модель 1САС | |
Стресс-МК, мл/мин/г | 1,60 (1,20; 1,93) |
Покой-МК, мл/мин/г | 0,70 (0,51; 0,93) |
РМК | 2,17 (1,52; 2,95) |
ΔМК, мл/мин/г | 0,81 (0,43; 1,22) |
Количество пациентов с РМК <2,0, n (%) | 24 (41%) |
Сравнение ПСМ и динамической ОФЭКТ (модель NRAC) | |
Количество пациентов с SSS ≥2,0 и РМК <2,0, n (%) | 7 (12%) |
Количество пациентов с SSS ≥2,0 и РМК ≥2,0, n (%) | 8 (14%) |
Количество пациентов с SSS <2,0 и РМК <2,0, n (%) | 15 (26%) |
Количество пациентов с SSS <2,0 и РМК ≥2,0, n (%) | 28 (48%) |
Сравнение ПСМ и динамической ОФЭКТ (модель 1CAC) | |
Количество пациентов с SSS ≥2,0 и РМК <2,0, n (%) | 8 (14%) |
Количество пациентов с SSS ≥2,0 и РМК ≥2,0, n (%) | 7 (12%) |
Количество пациентов с SSS <2,0 и РМК <2,0, n (%) | 16 (27,5%) |
Количество пациентов с SSS <2,0 и РМК ≥2,0, n (%) | 27 (46,5%) |
Сокращения: ПСМ — перфузионная сцинтиграфия миокарда, покой-МК — миокардиальный кровоток в покое, РМК — резерв миокардиального кровотока, ОФЭКТ — однофотонная эмиссионная компьютерная томография, стресс-МК — миокардиальный кровоток при нагрузке, ΔМК — разница стресс-МК и покой-МК, 1CAC — однокомпартментная модель обработки с коррекцией аттенюации, NRAC — модель обработки Net Retention с коррекцией аттенюации, SDS — summed difference score, SRS — summed rest score, SSS — summed stress score.
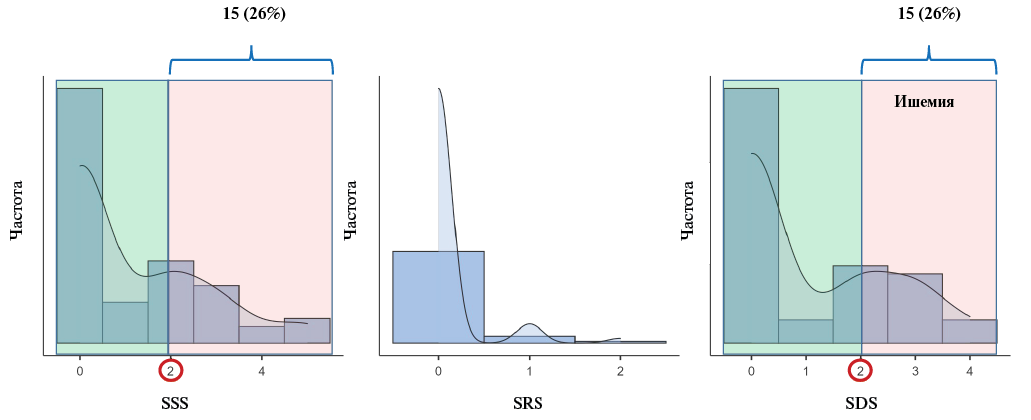
Рис. 2. Графики распределения значений полуколичественных сцинтиграфических показателей ПСМ.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: SDS — Summed Difference Score: разница между нагрузкой и покоем, SRS — Summed Rest Score: сумма баллов в покое, SSS — Summed Stress Score: сумма баллов при нагрузке, ПСМ — перфузионная сцинтиграфия миокарда.

Рис. 3. Графики распределения значений количественных сцинтиграфических показателей динамической ОФЭКТ по моделям NRAC (1-4) и 1CAC (5-8).
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: покой-МК — миокардиальный кровоток в покое, РМК — резерв миокардиального кровотока, ОФЭКТ — однофотонная эмиссионная компьютерная томография, стресс-МК — миокардиальный кровоток при нагрузке, ΔМК — разница стресс-МК и покой-МК, 1CAC — однокомпартментная модель обработки с коррекцией аттенюации, NRAC — модель обработки Net Retention с коррекцией аттенюации.

Рис. 4. Диаграммы сопоставления данных ПСМ и динамической ОФЭКТ миокарда по моделям NRAC (1) и 1CAC (2).
Сокращения: РМК — резерв миокардиального кровотока, 1CAC — однокомпартментная модель обработки с коррекцией аттенюации, NRAC — модель обработки Net Retention с коррекцией аттенюации, SSS — Summed Stress Score: сумма баллов при нагрузке.
Обсуждение
В данной работе впервые был выполнен сравнительный анализ стандартных индексов нарушения миокардиальной перфузии и количественных показателей МК и РМК, показана частота встречаемости сниженного РМК, по данным динамической ОФЭКТ миокарда, выполненной на гамма-камере с CZT-детекторами, у пациентов с НАПКА. В частности, было продемонстрировано, что практически 2/3 пациентов демонстрируют фенотип согласованного результата визуальной оценки миокардиальной перфузии и количественного определения РМК; из них практически у половины встречается согласованная норма, а у наименьшей части (не >15%) — согласованное нарушение. У 40% пациентов отмечаются несогласованные результаты ПСМ и показателя РМК — в большинстве случаев за счет отсутствия видимого дефекта миокардиальной перфузии и сниженного РМК. Данный фенотип можно интерпретировать как начальные этапы развития МД и ИБС, что позволяет стратифицировать таких пациентов в группу повышенного риска.
Ранее на небольшой выборке пациентов (n=12) было показано, что 7 из них (58%) имеют сниженный РМК, по данным ПЭТ с 18F-фтордезоксиглюкозой, на фоне НАПКА [14]. По данным других авторов, пациенты с НАПКА имеют значения МК и РМК выше, по сравнению с пациентами с обструктивным поражением КА, при этом показатель РМК может варьировать от 1,5 до 3,5 по данным динамической ОФЭКТ миокарда [5][8][14] и от 1,5 до 3,0 по данным ПЭТ миокарда [15][16].
Результаты опросников "EQ-5D-5L" и "SAQ" подтверждают, что данная выборка пациентов имеет сниженное качество жизни ввиду отрицательной оценки состояния своего здоровья, обусловленной имеющимися жалобами. Однако данные опросников не показали значимых корреляционных взаимосвязей со сцинтиграфическими показателями, вероятно, за счет малого размера выборки или из-за того, что у пациентов с НАПКА отсутствует классическая стресс-индуцированная ишемия (с высокими значениями SSS и SDS), и, соответственно, стенокардия, обусловленная ограничением МК по эпикардиальным КА. Если придерживаться данной логики, то можно предположить, что выявленные нарушения РМК представляют собой наиболее ранние (доклинические) проявления ИБС. При направлении пациентов на МСКТ-КГ у 22 (38%) был установлен диагноз ИБС, у 50 (86%) — гипертоническая болезнь, у 21 (36%) сочетание ИБС и гипертонической болезни. После проведения ПСМ у 33 (57%) пациентов установлен диагноз ИБС (у 11 (19%) пациентов впервые), остальные продолжили наблюдение с основным диагнозом "Гипертоническая болезнь", что, несомненно, показывает, что пациенты на начальных этапах развития ИБС в виде МД остаются без должного внимания с точки зрения профилактики и лечения ИБС.
Ранее нашей научной группой было показано, что показатели динамической ОФЭКТ миокарда ассоциированы с маркерами дислипидемии, в т. ч. уровни общего холестерина и холестерин липопротеинов низкой плотности являются независимым предикторами снижения РМК, а стресс-МК и РМК обратно пропорциональны значению кальциевого индекса [17][18]. Перспективы дальнейших исследований заключаются в использовании метода динамической ОФЭКТ миокарда для ранней неинвазивной диагностики МД до развития умеренной и выраженной ишемии миокарда у пациентов с НАПКА, а также для стратификации рисков и прогностической оценки в аспекте развития и прогрессирования ИБС.
Ограничения исследования. Одним из ключевых ограничений данной работы является относительно небольшой объем выборки. На момент проведения исследования пациентам не отменяли липидснижающие и антигипертензивные препараты, которые могут влиять на показатели МК и РМК, а также пациенты имели различные комбинации факторов риска ССЗ, однако это максимально приближает данное исследование к реальной клинической практике, в которой часто пациенты начинают принимать кардиологические препараты до момента проведения рентгеновских и радионуклидных методов исследования.
Заключение
Пациенты с НАПКА характеризуются большей вариабельностью значений МК и РМК по сравнению со стандартными индексами нарушения миокардиальной перфузии. Метод динамической ОФЭКТ позволяет в ~30% случаев идентифицировать нарушение МК и РМК у пациентов с нормальными результатами стандартной ПСМ на фоне НАПКА, что может явиться основанием для назначения или коррекции медикаментозной терапии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Hansen B, Holtzman JN, Juszczynski C, et al. Ischemia with No Obstructive Arteries (INOCA): A Review of the Prevalence, Diagnosis and Management. Curr Probl Cardiol. 2023;48(1):101420. doi:10.1016/j.cpcardiol.2022.101420.
2. Padro T, Manfrini O, Bugiardini R, et al. ESC Working Group on Coronary Pathophysiology and Microcirculation position paper on 'coronary microvascular dysfunction in cardiovascular disease'. Cardiovasc Res. 2020;116(4):741-55. doi:10.1093/cvr/cvaa003.
3. Vrints C, Andreotti F, Koskinas KC, et al. 2024 ESC Guidelines for the management of chronic coronary syndromes. Eur Heart J. 2024;45(36):3415-537. doi:10.1093/eurheartj/ehae177.
4. Барбараш О. Л., Карпов Ю. А., Панов А. В. и др. Стабильная ишемическая болезнь сердца. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(9):6110. doi:10.15829/1560-4071-2024-6110.
5. De Souza ACDAH, Gonçalves BKD, Tedeschi AL, et al. Quantification of myocardial flow reserve using a gamma camera with solid-state cadmium-zinc-telluride detectors: Relation to angiographic coronary artery disease. J Nucl Cardiol. 2021;28(3):876-84. doi:10.1007/s12350-019-01775-z.
6. Han S, Kim YH, Ahn JM, et al. Feasibility of dynamic stress 201Tl/rest 99mTc-tetrofosmin single photon emission computed tomography for quantification of myocardial perfusion reserve in patients with stable coronary artery disease. Eur J Nucl Med Mol Imaging. 2018;45(12):2173-80. doi:10.1007/s00259-018-4057-5.
7. Agostini D, Roule V, Nganoa C, et al. First validation of myocardial flow reserve assessed by dynamic 99mTc-sestamibi CZT-SPECT camera: head to head comparison with 15O-water PET and fractional flow reserve in patients with suspected coronary artery disease. The WATERDAY study. Eur J Nucl Med Mol Imaging. 2018;45(7):1079-90. doi:10.1007/s00259-018-3958-7.
8. Ferenczi P, Couffinhal T, Mamou A, et al. Myocardial blood flows and reserves on solid state camera: Correlations with coronary history and cardiovascular risk factors. J Nucl Cardiol. 2022;29(4):1671-8. doi:10.1007/s12350-021-02659-x.
9. Sampietro T, Sbrana F, Dal Pino B, et al. Coronary microcirculatory blood flow significantly increases upon acute and chronic cholesterol lowering: evaluation by cadmium-zinc-telluride cardiac imaging stress test. Eur J Prev Cardiol. 2022;29(8):e272-e274. doi:10.1093/eurjpc/zwac043.
10. Mochula AV, Kopeva KV, Maltseva AN, et al. The myocardial flow reserve in patients with heart failure with preserved ejection fraction. Heart Vessels. 2023;38(3):348-60. doi:10.1007/s00380-022-02161-5.
11. Мочула А. В., Мочула О. В., Мальцева А. Н. и др. Количественная оценка миокардиального кровотока методом динамической однофотонной эмиссионной компьютерной томографии миокарда: взаимосвязь с электрокардиографическими изменениями и биохимическими маркерами повреждения у пациентов с острым инфарктом миокарда. Сибирский журнал клинической и экспериментальной медицины. 2023;38(3):66-74. doi:10.29001/2073-8552-2023-38-3-66-74.
12. Arsanjani R, Hayes SW, Fish M, et al. Two-position supine/prone myocardial perfusion SPECT (MPS) imaging improves visual inter-observer correlation and agreement. J Nucl Cardiol. 2014;21(4):703-11. doi:10.1007/s12350-014-9895-3.
13. Murthy VL, Naya M, Foster CR, et al. Improved cardiac risk assessment with noninvasive measures of coronary flow reserve. Circulation. 2011;124(20):2215-24. doi:10.1161/CIRCULATIONAHA.111.050427.
14. Miyagawa M, Nishiyama Y, Uetani T, et al. Estimation of myocardial flow reserve utilizing an ultrafast cardiac SPECT: Comparison with coronary angiography, fractional flow reserve, and the SYNTAX score. Int J Cardiol. 2017;244:347-53. doi:10.1016/j.ijcard.2017.06.012.
15. Freitag MT, Bremerich J, Wild D, et al. Quantitative myocardial perfusion 82Rb-PET assessed by hybrid PET/coronary-CT: Normal values and diagnostic performance. J Nucl Cardiol. 2022;29(2):464-73. doi:10.1007/s12350-020-02264-4.
16. Kawaguchi N, Okayama H, Kido T, et al. Clinical significance of corrected relative flow reserve derived from 13N-ammonia positron emission tomography combined with coronary computed tomography angiography. J Nucl Cardiol. 2021;28(5):1851-60. doi:10.1007/s12350-019-01931-5.
17. Мальцева А. Н., Копьева К. В., Мочула А. В. и др. Ассоциация нарушений миокардиального кровотока и резерва с факторами риска сердечно-сосудистых заболеваний у пациентов с необструктивным атеросклеротическим поражением коронарных артерий. Российский кардиологический журнал. 2023;28(2):5158. doi:10.15829/1560-4071-2023-5158.
18. Мальцева А. Н., Копьева К. В., Мочула А. В. и др. Ассоциация кальциевого индекса и миокардиального кровотока при необструктивном атеросклеротическом поражении коронарных артерий. Вестник РАМН. 2023;78(2):85-95. doi:10.15690/vramn3513.
Об авторах
А. Н. МальцеваРоссия
К.м.н., м.н.с. лаборатории радионуклидных методов исследования, м.н.с. отделения рентгеновских и томографических методов диагностики.
Томск
Конфликт интересов:
Нет
А. В. Мочула
Россия
К.м.н., с.н.с. лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
Нет
Е. В. Гракова
Россия
Д.м.н., в.н.с. отделения патологии миокарда.
Томск
Конфликт интересов:
Нет
К. В. Копьева
Россия
К.м.н., с.н.с. отделения патологии миокарда.
Томск
Конфликт интересов:
Нет
А. А. Цыгикало
Россия
Лаборант-исследователь лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
Нет
К. В. Завадовский
Россия
Д.м.н., зав. отделом лучевой диагностики.
Томск
Конфликт интересов:
Нет
Дополнительные файлы
- Пациенты с необструктивным атеросклеротическим поражением коронарных артерий в ~40% случаев могут иметь сниженный резерв миокардиального кровотока, по данным динамической однофотонной эмиссионной компьютерной томографии (ОФЭКТ) миокарда.
- Динамическая ОФЭКТ миокарда позволяет идентифицировать в ~30% случаев наличие микроваскулярной дисфункции у пациентов с необструктивным атеросклеротическим поражением коронарных артерий и нормальными результатами стандартной перфузионной сцинтиграфии миокарда.
Рецензия
Для цитирования:
Мальцева А.Н., Мочула А.В., Гракова Е.В., Копьева К.В., Цыгикало А.А., Завадовский К.В. Сравнительный анализ стандартных индексов перфузионной сцинтиграфии миокарда и количественных показателей динамической однофотонной эмиссионной компьютерной томографии миокарда у пациентов с необструктивным атеросклеротическим поражением коронарных артерий. Российский кардиологический журнал. 2024;29(12):6166. https://doi.org/10.15829/1560-4071-2024-6166. EDN: ZWRBDF
For citation:
Maltseva A.N., Mochula A.V., Grakova E.V., Kopyeva K.V., Tsygikalo A.A., Zavadovsky K.V. Comparative analysis of standard indices of myocardial perfusion scintigraphy and quantitative indicators of myocardial dynamic single-photon emission computed tomography in patients with non-obstructive coronary artery disease. Russian Journal of Cardiology. 2024;29(12):6166. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6166. EDN: ZWRBDF
JATS XML

















































