РЕДАКЦИОННАЯ СТАТЬЯ
В рамках обновления российских клинических рекомендаций по сердечной недостаточности (СН) [1] рабочая группа Российского кардиологического общества обсуждает целесообразность и необходимость внесения изменений в действующую классификацию СН по стадиям с учетом международного универсального определения СН [2]. Какие для этого есть основания? Классификация любого заболевания необходима для диагностики и определения тактики ведения пациентов в практической работе врача, а также может использоваться для изучения эпидемиологии и принятия управленческих решений в здравоохранении. Действующая классификация уже не согласуется с современными представлениями об эволюции СН, стратегиями ее профилактики и лечения.
COVID-19 И БОЛЕЗНИ СИСТЕМЫ КРОВООБРАЩЕНИЯ
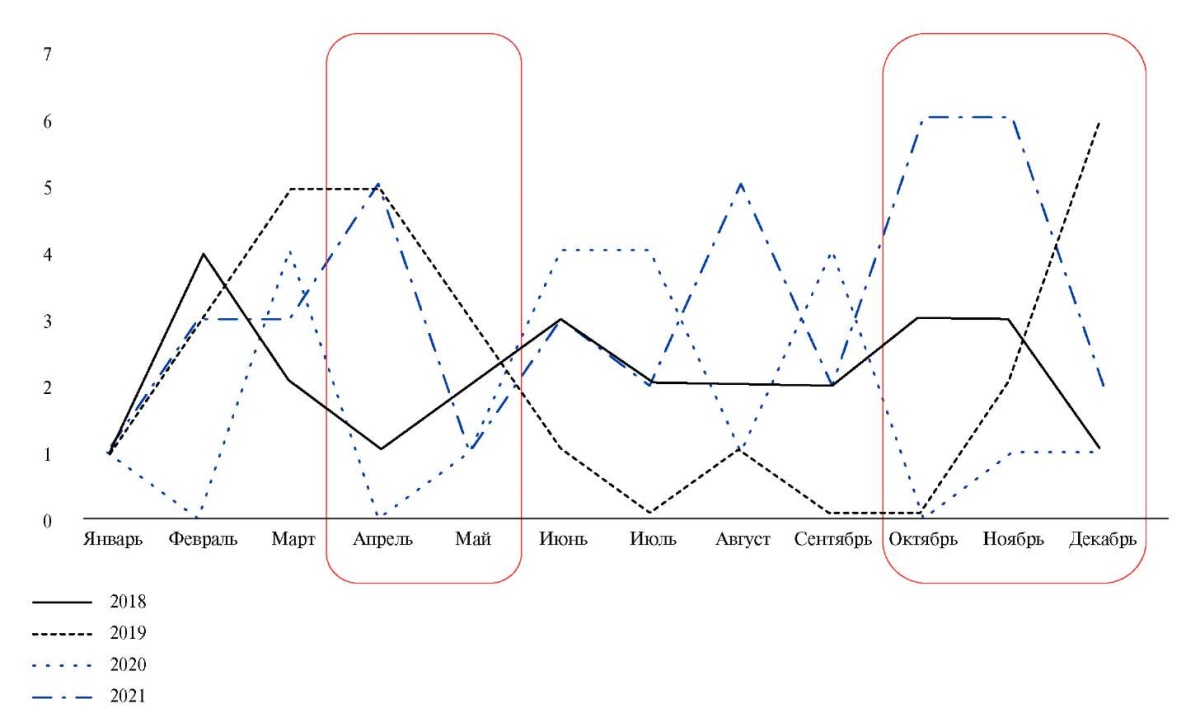
- По данным регистра АКТИВ ~80% пациентов, перенесших COVID-19, в течение года обращаются за внеплановой медицинской помощью, ~10% повторно госпитализируются.
- Наиболее частыми причинами обращения за внеплановой помощью являются: неконтролируемая артериальная гипертензия, декомпенсация сахарного диабета, дестабилизация ишемической болезни сердца.
- Летальность пациентов после выписки из стационара за год составила 3,08%. Факторами риска летального исхода являются: возраст (прямая связь), уровень гемоглобина (обратная связь), SpO2 (обратная связь) и уровень аспартатаминотрансферазы (прямая связь), тяжелая сердечная недостаточность, инсульт в анамнезе, онкологическое заболевание, острое почечное повреждение во время госпитализации.
Цель. Изучить особенности течения постковидного периода у пациентов, перенесших COronaVIrus Disease 2019 (COVID-19) в Евразийском регионе.
Материал и методы. Всего в регистр АКТИВ включено 9364 последовательно госпитализированных пациента. Начало набора пациентов в регистр АКТИВ 29.06.2020, завершение набора 30.03.2021, что соответствует 1-й и 2-й волне пандемии. Демографические, клинические, лабораторные данные, данные компьютерной томографии, клинического течения в больнице и осложнений COVID-19 были извлечены из электронных медицинских карт с использованием стандартной формы для сбора данных. Дизайн регистра предполагал для изучения особенностей течения постковидного периода проведение контрольных телефонных опросов с помощью стандартной карты через 3, 6, 12 мес.
Результаты. По данным регистра АКТИВ у 63% пациентов, перенесших COVID-19, длительно сохраняются беспокоящие их симптомы (до 1 года), которые являются вновь возникшими или следствием ухудшения уже имевшихся симптомов. После выписки из стационара пациенты, перенесшие COVID-19, обращались за внеплановой медицинской помощью в течение первых 3 мес. — 79,8% пациентов, за 4-6 мес. — 79,1%, за 7-12 мес. — 64,8%. Частота повторных госпитализаций среди выписанных пациентов в первые 3 мес. составила 11,8%, за 4-6 мес. — 10,9%, за 7-12 мес. — 10,1%. Наиболее частыми причинами обращения за внеплановой помощью в первые 3 мес. были: неконтролируемая артериальная гипертензия, декомпенсация сахарного диабета 2 типа, дестабилизация ишемической болезни сердца, заболевания желудочно-кишечного тракта, приступы фибрилляции предсердий, обострение бронхиальной астмы и хронической обструктивной болезни легких, декомпенсация хронической сердечной недостаточности (ХСН). Летальность пациентов с СOVID-19 после выписки из стационара за 12 мес. составила 3,08%. Многофакторный анализ показал, что независимыми факторами риска летального исхода являются возраст (прямая связь), уровень гемоглобина (обратная связь), сатурация крови кислородом (обратная связь) и уровень аспартатаминотрансферазы (прямая связь), а также ХСН III-IV функционального класса, инсульт в анамнезе, онкологическое заболевание, острое почечное повреждение во время госпитализации пациента. На основании выявленных факторов риска построена номограмма, позволяющая определить риск летального исхода в течение 3 мес. после выписки пациента, перенесшего COVID-19, из стационара.
Заключение. Согласно данным регистра АКТИВ окончание острого периода COVID-19 не означает полноценного выздоровления пациентов, перенесших эту инфекцию.
Цель. Исследование воздействия пандемии новой коронавирусной инфекции (COVID-19) на частоту госпитализаций, диагностику и исходы инфекционного эндокардита (ИЭ) с субанализом течения ИЭ при сочетании с COVID-19.
Материал и методы. В проспективное когортное исследование включено 168 пациентов с достоверным или вероятным ИЭ (DUKE 2015г), госпитализированных в ГБУЗ "ГКБ им. В.В. Виноградова" ДЗМ с июля 2017г по июль 2022г. Всем пациентам проводилось традиционное обследование согласно действующим клиническим рекомендациям. Изучались клинические, лабораторно-инструментальные и этиологические параметры, а также исходы. Приведены два клинических наблюдения сочетания ИЭ и COVID-19.
Результаты. При исследовании данных локального регистра больных ИЭ показана тенденция к росту частоты госпитализаций ИЭ в 2021-2022гг со снижением их количества в период длительных локдаунов в Москве и последующим всплеском после их отмены. Пациенты с ИЭ в период пандемии COVID-19 отличались более благоприятным клиническим профилем, увеличенными в 2 раза сроками диагностики ИЭ (по причине поздней госпитализации), частым выявлением Staphylococcus aureus MSSA (32,6%) и частым выполнением хирургического лечения (до 87,6% при сочетании ИЭ и активной COVID-19), а также сохраняющейся высокой внутрибольничной летальностью, но без тенденции к увеличению (30,4%). Представлены клинические наблюдения сочетания ИЭ и COVID-19, демонстрирующие вклад COVID-19 как единственного фактора риска в развитие ИЭ нативного трикуспидального клапана у пациента без предрасполагающих причин, а также как фактора неблагоприятного прогноза ИЭ нативного аортального клапана после присоединения COVID-19, приведшего к летальному исходу.
Заключение. В представленном исследовании продемонстрирован профиль пациентов с ИЭ и COVID-19 в зависимости от эпидемиологической обстановки по COVID-19 и связи с инфицированием SARS-CoV-2. Полученные данные позволяют обсуждать наличие потенциальной связи COVID-19 и ИЭ. "Команда эндокардита" определяет своевременное выполнение хирургического лечения и отсутствие тенденций к росту госпитальной летальности, независимо от эпидемиологической обстановки.
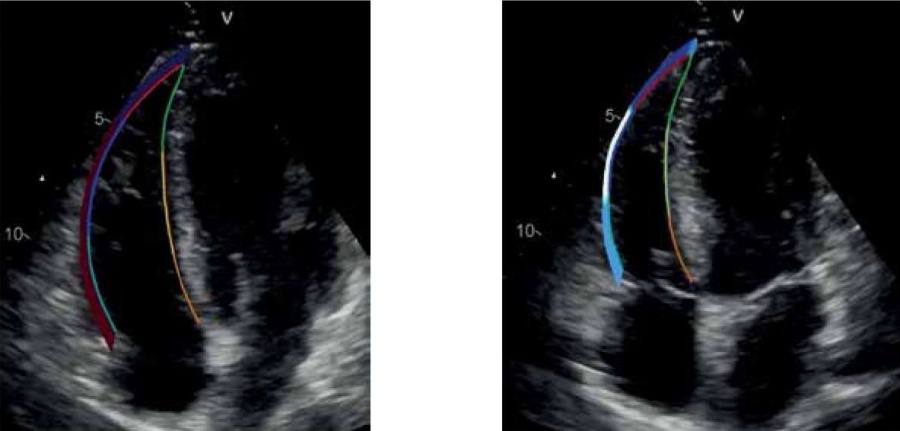
- За период наблюдения в 12 мес. у пациентов, перенесших COVID-19-пневмонию, отмечается восстановление функции правого желудочка (ПЖ) только при оценке продольной деформации (LS).
- У пациентов с исходным тяжелым поражением легких LS повышается преимущественно в базальных сегментах стенок ПЖ.
- У больных с исходным умеренным/незначительным поражением легких LS повышается в апикальных сегментах ПЖ.
Цель. Исследовать динамику морфофункциональных показателей правого желудочка (ПЖ) в зависимости от тяжести пневмонии при коронавирусной инфекции 2019г (COronaVIrus Disease 2019, COVID-19) в длительном периоде наблюдения.
Материал и методы. 200 пациентов (51,5% мужчин, средний возраст 51,4±10,9 года) были обследованы на 2 контрольных явках (через 3, 12 мес. после получения двух отрицательных результатов теста полимеразной цепной реакции). Больные были разделены на группы: I группа (n=94) — с поражением легких по данным компьютерной томографии органов грудной клетки (КТ ОГК) ≥50% при госпитализации, II группа (n=106) — пациенты c поражением легких по КТ ОГК˂ 50%.
Результаты. Группы были сопоставимы по основным клиническим и функциональным показателям через 3 мес. после COVID-19-пневмонии. При анализе динамики традиционных показателей морфофункционального статуса ПЖ выявлены незначительные изменения в рамках нормальных значений. При использовании метода отслеживания движения пятен (Speckle Tracking Echocardiography, STE) было выявлено достоверное увеличение глобальных показателей продольной деформации (longitudinal strain, LS): как эндокардиальной продольной деформации свободной стенки ПЖ (-22,7±3,2% и -24,3±3,8% в группе I, р˂ 0,001; -23,2±3,5% и -24,5±3,4% в группе II, р˂ 0,001), так и эндокардиальной деформации ПЖ (-21,0±3,1% и -22,5±3,7% в группе I, р˂ 0,001; -21,5±3,2% и -22,6±3,3% в группе II, р=0,001) в обеих группах. При анализе динамики сегментарной эндокардиальной LS было выявлено ее достоверное увеличение в группе I в базальных сегментах свободной стенки ПЖ (-26,2±5,1% и -28,1±5,1%, р=0,004) и межжелудочковой перегородки (МЖП) (-16,2 [13,9;19,5]% и -17,5 [14,6;21,4]%, р=0,024), среднем сегменте МЖП (-20,3±4,1% и -21,5±4,8%, р=0,030); в группе II — в апикальных сегментах свободной стенки ПЖ (-21,9±6,7% и -24,4±5,2%, р=0,001) и МЖП (-23,7±4,7% и -24,9±4,8%, р=0,014).
Заключение. Восстановление функции ПЖ при периоде наблюдения в 12 мес. у пациентов как с тяжелым, так и с умеренным/незначительным поражением легких при COVID-19 выявляется с помощью метода STE.
Что уже известно о предмете исследования?
- Пациенты с установленным сердечно-сосудистым заболеванием или высоким риском сердечно-сосудистых событий имеют более тяжелое течение новой коронавирусной инфекции (COVID-19) и более высокую смертность.
Что нового?
- Установлены факторы риска развития хронической сердечной недостаточности (ХСН) у пациентов с COVID-19. Выполнено ранжирование выявленных факторов риска по значимости в зависимости от величины отношения шансов, предложены чёткие количественные границы (бинарные точки) принятия решений для каждого фактора.
Возможный вклад в клиническую практику
- Полученные данные возможно будет использовать для создания доступного и экономичного метода оценки риска развития ХСН у пациентов с COVID-19 с целью эффективной его реализации в реальной клинической практике.
Цель. Установить факторы риска развития хронической сердечной недостаточности (ХСН) у пациентов с новой коронавирусной инфекцией (COVID-19).
Материал и методы. Ретроспективно отобраны истории болезни 151 пациента, находившихся на лечении в моноинфекционном госпитале в период с 03.11.2020 по 10.02.2021 с подтвержденным диагнозом COVID-19. Сбор клинико-анамнестических и лабораторных данных осуществлялся путем анализа электронных историй болезни. Сведения включали информацию о возрасте, поле, индексе массы тела, курении, сопутствующей патологии. Результаты лабораторных исследований включали клинический и биохимический анализ крови, коагулограмму, исследование острофазовых белков (С-реактивный белок (СРБ), ферритин, лактатдегидрогеназа (ЛДГ)), прокальцитонина. Диагноз ХСН был подтвержден наличием признаков и симптомов синдрома, данными эхокардиографии, показателями патологически повышенного уровня N-концевого фрагмента промозгового натрийуретического пептида (NT-proBNP). В качестве конечной точки исследования принимали риск развития ХСН.
Результаты. Исследуемая выборка пациентов была разделена на две группы в зависимости от наличия ХСН: в 1 группу вошли 46 пациентов с ХСН, во 2 группу 105 пациентов без ХСН. Медиана возраста составила 66,2 [50; 92] лет, преобладали женщины — 91 (60,3%) человек. Лабораторные показатели, такие как уровень СРБ, ЛДГ, прокальцитонин, креатинин, билирубин, статистически значимо различались между собой, а медианные значения были выше в группе пациентов с ХСН. Нейтрофильно-лимфоцитарное отношение (NLR) продемонстрировало статистически значимые межгрупповые различия: в группе больных с ХСН медиана составила 4,97% vs 3,62% (р=0,011) в группе больных без ХСН. Наиболее значимыми предикторами, повышающими риск развития ХСН, являются: возраст ≥66 лет (отношение шансов 8,038, p<0,001), уровень прокальцитонина, увеличивающий риск развития ХСН у больных в 3,8 раза (p><0,001), соотношение NLR ≥4,11% (р=0,010), тромбоцитопения ≤220×109/л (р=0,010), наличие хронической болезни почек (ХБП) в анамнезе (р=0,018). Заключение. Установлено, что предикторами риска развития ХСН являются возраст ≥66 лет, уровень прокальцитонина ≥0,09 нг/мл, отношение NLR ≥4,11%, тромбоцитопения ≤220×109/л, наличие ХБП в анамнезе, уровни ЛДГ ≥685 Ед/л и креатинина ≥102 мкмоль/л, международное нормализованное отношение ≥1,19, интервал QTc на электрокардиограмме ≥407,5 мс, билирубин ≤10,7 мкмоль/л. Важно отметить, что наилучшие значения точности демонстрирует алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке). Ключевые слова: новая коронавирусная инфекция, хроническая сердечная недостаточность, прогноз>˂ 0,001), уровень прокальцитонина, увеличивающий риск развития ХСН у больных в 3,8 раза (p<0,001), соотношение NLR ≥4,11% (р=0,010), тромбоцитопения ≤220×109/л (р=0,010), наличие хронической болезни почек (ХБП) в анамнезе (р=0,018). Заключение. Установлено, что предикторами риска развития ХСН являются возраст ≥66 лет, уровень прокальцитонина ≥0,09 нг/мл, отношение NLR ≥4,11%, тромбоцитопения ≤220×109/л, наличие ХБП в анамнезе, уровни ЛДГ ≥685 Ед/л и креатинина ≥102 мкмоль/л, международное нормализованное отношение ≥1,19, интервал QTc на электрокардиограмме ≥407,5 мс, билирубин ≤10,7 мкмоль/л. Важно отметить, что наилучшие значения точности демонстрирует алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке). Ключевые слова: новая коронавирусная инфекция, хроническая сердечная недостаточность, прогноз>˂ 0,001), соотношение NLR ≥4,11% (р=0,010), тромбоцитопения ≤220×109/л (р=0,010), наличие хронической болезни почек (ХБП) в анамнезе (р=0,018).
Заключение. Установлено, что предикторами риска развития ХСН являются возраст ≥66 лет, уровень прокальцитонина ≥0,09 нг/мл, отношение NLR ≥4,11%, тромбоцитопения ≤220×109/л, наличие ХБП в анамнезе, уровни ЛДГ ≥685 Ед/л и креатинина ≥102 мкмоль/л, международное нормализованное отношение ≥1,19, интервал QTc на электрокардиограмме ≥407,5 мс, билирубин ≤10,7 мкмоль/л. Важно отметить, что наилучшие значения точности демонстрирует алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке).
КАРДИОХИРУРГИЯ
Вопрос хирургического вмешательства на корне аорты (КоАо) в ходе одномоментного протезирования тубулярной части восходящего отдела аорты с имплантацией протеза аортального клапана (АК) у пациентов с аневризмой восходящей аорты (АВА) и стенозом АК до сих пор остается дискутабельным.
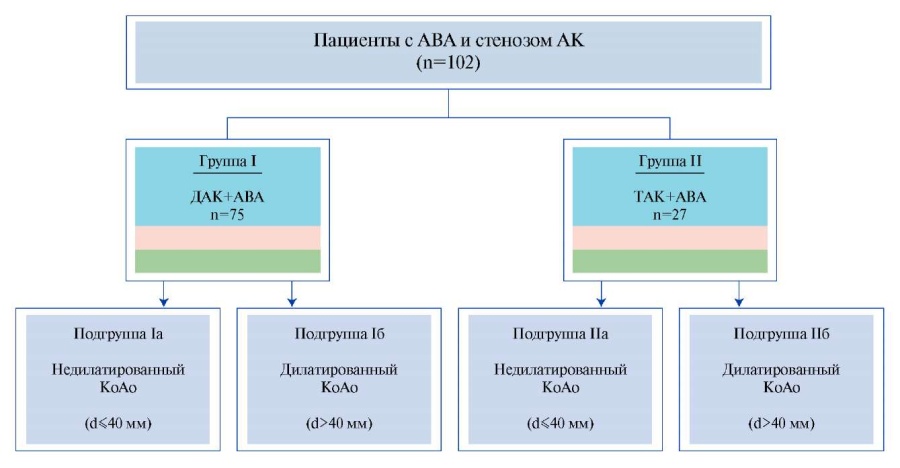
Цель. Проанализировать динамику изменения размеров сохраненного КоАо после одномоментного протезирования АК и восходящей аорты.
Материал и методы. В ретроспективное исследование было включено 102 пациента, которым с декабря 2012 по май 2022гг было выполнено одномоментное протезирование АК и восходящего отдела аорты с резекцией дуги аорты по типу "полудуги". Пациенты были разделены на 2 группы на основании морфологии АК: 1 группа — пациенты с двустворчатым АК (ДАК) и АВА (n=75), 2 группа — пациенты с трехстворчатым АК (ТАК) и АВА (n=27). В зависимости от наличия дилатации КоАо (максимальный диаметр (d) >40 мм) каждая из групп была стратифицирована еще на 2 подгруппы: пациенты без дилатации КоАо (d≤40 мм) и с его дилатацией (d>40 мм). Динамику размеров КоАо оценивали по данным компьютерной томографической ангиографии.
Результаты. Средний период наблюдения за пациентами составил 36,2±14,6 мес. Выживаемость пациентов групп ДАК+АВА и ТАК+АВА составила 96% и 100%, соответственно (p=0,380). Свобода от реоперации на КоАо составила 100% в обеих группах исследования. У пациентов с дилатированным и недилатированным КоАо группы ДАК+АВА отмечалось увеличение размеров КоАо со скоростью 0,65±0,51 мм/год и 0,32±0,27 мм/год, соответственно. У пациентов группы ТАК+АВА наблюдалась регрессия размеров дилатированного и недилатированного КоАо: 0,93±0,48 мм/год и 0,56±0,43 мм/год, соответственно.
Заключение. У пациентов с АВА в сочетании со стенотическим поражением ДАК после одномоментного хирургического вмешательства наблюдается слабоотрицательная динамика недилатированного и дилатированного КоАо в среднесрочном периоде наблюдения. У пациентов с АВА и ТАК в сроки до 3 лет отмечается инволютивная картина в отношении размеров КоАо.
- Шкалы стратификации риска осложнений у пациентов, которым требуется реконструктивное вмешательство на аортальном клапане, до сих пор не разработано.
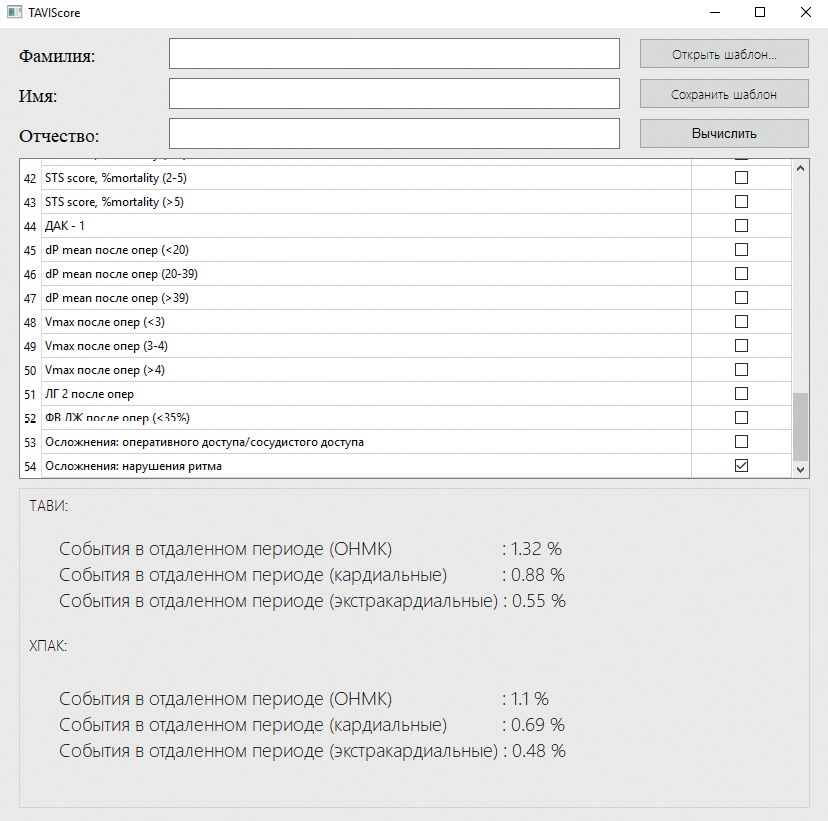
- Компьютерная программа TAVISCORE разработана на основе алгоритма определения прогностических коэффициентов определения вероятности развития осложнения после операций на аортальном клапане.
- Компьютерная программа TAVISCORE создана для стратификации риска осложнений транскатетерной имплантации аортального клапана и открытого протезирования аортального клапана.
Цель. Демонстрация компьютерной программы TAVISCORE, которая предназначена для стратификации риска осложнений после вмешательств на аортальном клапане (АК) у пациентов со сниженной фракцией выброса.
Материал и методы. За период с 2015-2022гг в ФГБУ "СЗФМИЦ им. В.А. Алмазова" Минздрава России было выполнено 128 вмешательств на АК при аортальном стенозе у пациентов со сниженной фракцией выброса: 61 открытое протезирование АК (ОПАК) и 67 транскатетерных имплантаций аортального клапана (ТИАК). Для создания интерактивного калькулятора TAVISCORE (ссылка для бесплатного скачивания: https://drive.google.com/file/d/1a3s2MK6Tpk0cIQ_aMB7xe63upEwJsJOh/view?usp=sharing) все пациенты были объединены в одну группу. Для каждого фактора, имеющегося у больного, был рассчитан прогностический коэффициент его влияния на вероятность развития события в отдаленном периоде наблюдения (смерть, инфаркт миокарда, инсульт). Следующим этапом на основе полученных расчетов и с помощью языка программирования Python 3.10.6 была создана компьютерная программа TAVISCORE.
Результаты. TAVISCORE создан для персонифицированного выбора тактики лечения больных с аортальным стенозом. Он содержит 54 фактора риска, имеющихся у пациента, и позволяет определить с какой вероятностью может быть получено кардиальное или экстракардиальное событие в отдаленном периоде наблюдения после ОПАК или ТИАК. Таким образом, тактика, которая будет иметь меньший "%" вероятности развития осложнения, может быть выбрана в качестве оптимальной в данном конкрентом случае. В ситуации, когда TAVISCORE применяется ретроспективно, уже после операции, возможно идентифицировать тех пациентов, которые будут подвержены высокому риску формирования осложнения, что позволит отобрать их для более тщательной курации и более частому скрининговому обследованию.
Заключение. TAVISCORE может применяться мультидисциплинарным консилиумом для выбора тактики лечения больных и стратификации риска осложнений после различных вариантов реконструктивного вмешательства на АК при его стенозе у пациентов со сниженной фракцией выброса. Требуется дальнейшая проспективная апробация данной программы.
- Российские рекомендации и стандарты не отвечают на многие спорные вопросы, связанные с каротидной эндартерэктомией.
- Сохранение каротидного гломуса при выполнении каротидной эндартерэктомии снижает количество осложнений.
- При выборе способа лечения пациентов со стенозами сонных артерий может применяться онлайн калькулятор стратификации риска осложнений CarotidScore.ru.
Настоящий обзор литературы охватывает публикации российских сосудистых хирургов последних лет и касается дискуссионных вопросов каротидной хирургии, среди которых: 1. Какая техника каротидной эндартерэктомии (КЭЭ) оптимальна? 2. Почему развивается рестеноз внутренней сонной артерии (ВСА) и как его ликвидировать? 3. Как оперировать двусторонние стенозы ВСА? 4. Нужно ли сохранять каротидный гломус? 5. Безопасна ли КЭЭ в острейшем периоде острого нарушения мозгового кровообращения (ОНМК)? 6. Безопасная ли КЭЭ у пациентов старческого возраста? 7. Как оперировать пациентов с сочетанным поражением ВСА и коронарных артерий? Доказательства, представленные в настоящей публикации, позволяют сделать следующие выводы: 1. При выборе техники КЭЭ следует отказаться от классической методики с пластикой зоны реконструкции заплатой ввиду высокого риска развития рестеноза ВСА. 2. Для ликвидации рестеноза ВСА следует применять каротидную ангиоплатику со стентированием (КАС). При выполнении первичной КЭЭ с транспозицией ВСА над подъязычным нервом возможно применение реКЭЭ. 3. При отсутствии противопоказаний, двусторонние стенозы ВСА можно оперировать одномоментно посредством КЭЭ. 4. КЭЭ с сохранением каротидного гломуса является операцией выбора лечения пациентов с гемодинамически значимыми стенозами ВСА ввиду исключения рисков трудноуправляемой послеоперационной артериальной гипертензии и формирования геморрагической трансформации. 5. При наличии показаний к реваскуляризации головного мозга в острейшем периоде ОНМК следует отказаться от КЭЭ в пользу КАС. 6. В старческом возрасте наиболее безопасной стратегией лечения является КАС. 7. При наличии сочетанного атеросклеротического поражения ВСА и коронарных артерий выбор тактики лечения должен осуществлять только мультидисциплинарной комиссией с учетом стратификации риска неблагоприятных кардиоваскулярных событий.
КЛИНИКА И ФАРМАКОТЕРАПИЯ
Увеличение терапевтических возможностей по лечению онкологических заболеваний определило необходимость безрецидивной выживаемости онкогематологических больных.
Профилактика развития сердечной недостаточности у пациентов, страдающих онкогематологическими заболеваниями на фоне различных схем лечения, должна носить приоритетный характер.
Использование тиотриазолина позволяет предотвратить и замедлить процессы сердечнососудистого континуума, приводящие к появлению сердечной недостаточности.
Аннотация
Цель. Оценить эффективность морфолиний-метил-триазолил-тиоацетата (тиотриазолина) в качестве кардиопротектора у больных неходжкинскими лимфомами, получавших химиотерапевтическое лечение с включением антрациклинов.
Материалы и методы. Проведено обследование 50 пациентов с неходжкинскими лимфомами на фоне курсовой противоопухолевой терапии. Пациенты были разделены на 2 группы, 1 группа (n=27) получавшая стандартную химиотерапию и 2 группа (n=23) – получавшие тиотриазолин в качестве кардиопротектора. Проводилась оценка качества жизни с помощью опросника SF-36, выполнялось определение уровня тропонина I и натрий-уретического пептида Nt-proBNP, электрокардиограмма, эхокардиография.
Результаты. В ходе проведения работы установлены статистически значимые отличия (p<0,05) по таким показателям, как: степень выраженности одышки и отеков нижних конечностей, лабораторным показателям (АЛТ, АСТ, КФК, КФК-МВ, уровень тропонина I, Nt-proBNP), инструментальным показателям (корригированный интервал QT, КСО, ФВ левого желудочка, соотношения E/A). Полученные результаты свидетельствуют о клиническом, лабораторном и инструментальном преимуществе исследуемого препарата и отражают кардиопротективный эффект тиотриазолина.
Заключение. Использование тиотриазолина позволяет предотвратить и замедлить процессы сердечно-сосудистого континуума, приводящие к появлению сердечной недостаточности или декомпенсации существующей у данной категории больных.
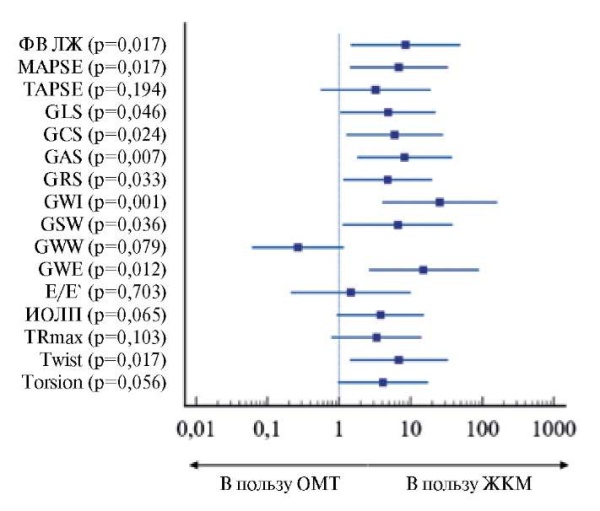
Цель. Оценить динамику показателей неинвазивной миокардиальной работы левого желудочка (ЛЖ) у пациентов с хронической сердечной недостаточностью с низкой фракцией выброса (ХСНнФВ) и дефицитом железа (ДЖ) после терапии карбоксимальтозатом железа (ЖКМ).
Материал и методы. Критерии включения: фракция выброса (ФВ) ЛЖ ≤40%, ДЖ (ферритин <100 нг/мл или ферритин 100-299 нг/мл при коэффициенте насыщения трансферрина железом ><20%), уровень гемоглобина от 100 до 140 г/л, масса тела >70 кг, получение оптимальной медикаментозной терапии (ОМТ) в рекомендуемых дозах в соответствии с рекомендациями Европейского общества кардиологов и Российского общества кардиологов. Медиана возраста 67±11,7 лет, 83% — мужчины, медиана ФВ ЛЖ 29%, медиана N-концевого промозгового натрийуретического пептида 315 нг/мл. Пациенты были рандомизированы методом конвертов. Первую группу составили 19 пациентов, получивших терапию 1500 мг ЖКМ внутривенно за 2 введения с интервалом в одну неделю между инъекциями в дополнение к ОМТ. Контрольную группу составили 16 пациентов, получавших ОМТ без назначения ЖКМ. Всем пациентам проводили стандартное эхокардиографическое исследование, дополнительно определяли показатели неинвазивной миокардиальной работы ЛЖ непосредственно перед включением в исследование и через 3 мес.
Результаты. У первой группы пациентов на фоне терапии ЖКМ выявлено увеличение ФВ ЛЖ (29,1±10,3 vs 35,4±11,1; p=0,001), систолической экскурсии фиброзного кольца митрального клапана (1,2 (1;1,6) vs 1,5 (1,3;1,9), p=0,001), глобальной продольной деформации ЛЖ (-7 (-5;-8) vs -8 (-6;-11), p=0,007) и неинвазивных показателей миокардиальной работы (глобальный индекс миокардиальной работы (826±314 vs 1041±354), p=0,0001; глобальная конструктивная работа (1173±388 vs 1435±405), p=0,0001; эффективность глобальной работы (85 (82;87) vs 86 (82;88), p=0,017)). В группе ОМТ не было выявлено достоверных изменений изучаемых параметров.
Заключение. У пациентов с ХСНнФВ и ДЖ, получавших ЖКМ, было выявлено достоверное увеличение систолической функции ЛЖ, включая неинвазивные индексы миокардиальной работы, по сравнению с контрольной группой.
МЕТОДЫ ИССЛЕДОВАНИЯ
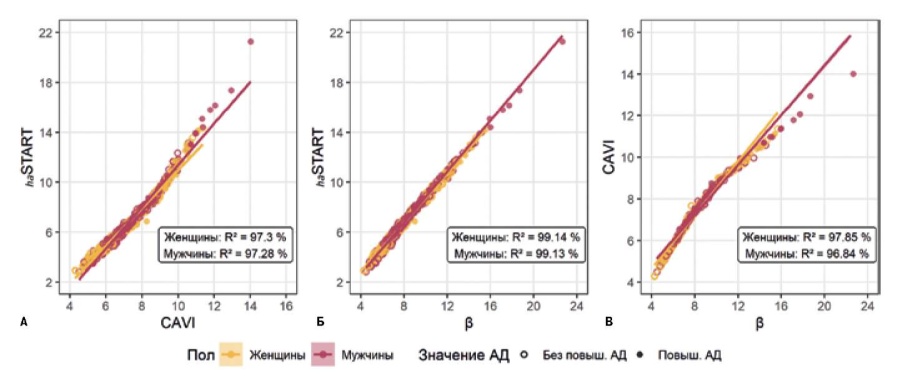
- Новые разработки в оценке жесткости артерий — START индекс.
- Сравнение нового показателя жесткости сосудов START индекс с индексом CAVI.
- Индекс жесткости сосудистой стенки START значимо коррелирует с индексом CAVI.
Цель. Сравнение сердечно-лодыжечного индекса (CAVI) и нового индекса START, отражающих жесткость сосудистой стенки, оценка их значений и корреляций с клиническими показателями.
Материал и методы. В многоцентровом исследовании участвовали 928 случайно выбранных пациентов, из них 403 мужчины и 525 женщин в возрасте от 18 до 89 лет, средний возраст 41±15,8 лет. Критерием включения был возраст старше 18 лет. К критериям невключения относились: психические заболевания, тяжелые соматические и онкологические заболевания, наличие противопоказаний для проведения объемной сфигмографии с помощью аппарата Fukuda Denshi VS-1500 VaSera, отсутствие согласия пациента. Критерии исключения: лодыжечно-плечевой индекс <1,0 и >1,3. Далее по основным параметрам, полученным с помощью объемной сфигмографии, рассчитывался новый индекс START. Сопоставление значений индексов и анализ их корреляции с клиническими показателями, такими как возраст, систолическое артериальное давление, диастолическое артериальное давление, пульсовое давление (ПД), индекс массы тела и частота сердечных сокращений (ЧСС), осуществлены при помощи однофакторной и множественной линейной регрессии, дисперсионного анализа, расчета коэффициента Пирсона (r), в программной среде R версии 4.0.2.
Результаты. В рамках статистического анализа выявлена высокая корреляция между индексами жесткости сосудистой стенки START и CAVI (r=0,986, p<0,001). Значения обоих индексов значимо увеличиваются с возрастом (ANOVA p><0,001). И START, и CAVI коррелируют со всеми исследуемыми клиническими показателями, однако у мужчин отсутствует взаимосвязь индексов с ПД и ЧСС (p>0,05). Согласно результатам множественной линейной регрессии, связь значений диастолического артериального давления в возрасте 30-60 лет и ПД возрасте 18-40 лет с индексом START более выражена, чем с индексом CAVI. Однако дальнейшее исследование математической модели не выявило значимой разницы в значениях индексов для групп с повышенным давлением и без такового.
Заключение. Индекс жесткости сосудистой стенки START значимо коррелирует с индексом CAVI, не демонстрируя существенных отличий от CAVI в количественной взаимосвязи с параметрами артериального давления, индекса массы тела, ЧСС и полом в различных подгруппах исследуемых.
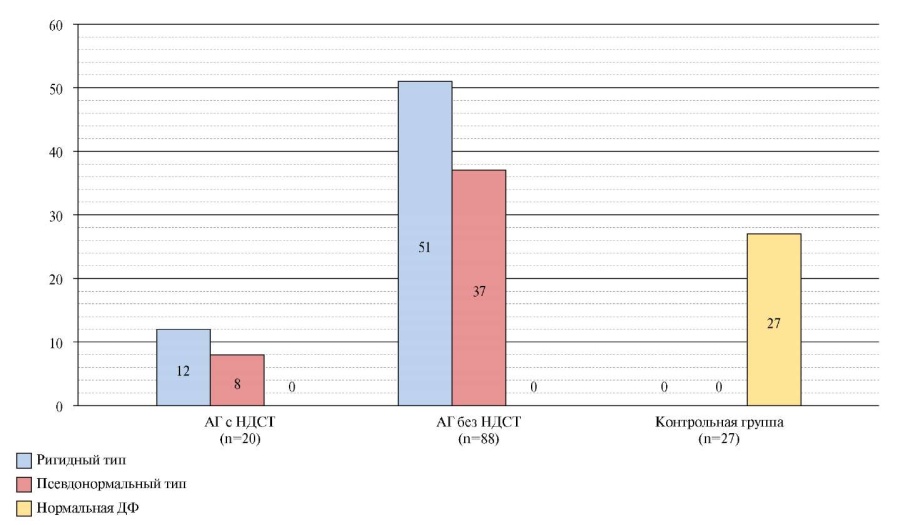
- В проведенном исследовании среди женщин, находящихся в поздней постменопаузе и имеющих недифференцированную дисплазию соединительной ткани и артериальную гипертензию, наиболее часто выявлялись начальные нарушения диастолической функции, соответствующие ригидному типу.
- При всей схожести клинической картины и спектра встречаемости различных типов диастолической дисфункции больные с артериальной гипертензией и недифференцированной дисплазией соединительной ткани имели более выраженное нарушение диастолической функции левого желудочка в сравнении с пациентами, имеющими только артериальную гипертензию.
- Проведенный анализ свидетельствует о значимом вкладе ассоциированной с артериальной гипертензией недифференцированной дисплазии соединительной ткани в развитие диастолической дисфункции левого желудочка.
Цель. Выявить особенности диастолической функции (ДФ) миокарда у женщин в поздней постменопаузе с недифференцированной дисплазией соединительной ткани (НДСТ) и артериальной гипертензией (АГ).
Материал и методы. В одномоментное исследование включено 135 женщин, находящихся в постменопаузе, медиана возраста — 68 лет (65÷70,5 лет). Анамнез собран по стандартизированной анкете. Верификация НДСТ проводилась согласно клиническим рекомендациям. Всем пациентам проводилось cтандартное трансторакальное эхокардиосканирование. Оценка ДФ левого желудочка (ЛЖ) проводилась по трансмитральному потоку. Классифицировали диастолическую дисфункцию (ДД) ЛЖ по трём типам: ригидный, псевдонормальный и рестриктивный. Статистическая обработка проведена в среде "STATISTICA 13.0". Мера усреднения данных — медиана, мера разброса — 25%÷75%. Значимость различий оценивали с использованием критериев Манна-Уитни. Различия признавались значимыми при p<0,05. Результаты. Первая группа — 20 (14,8%) пациентов с верифицированными НДСТ и АГ, 2 группа — 88 (65,2%) пациентов с АГ, не имеющих НДСТ, группа контроля — 23 (30%) пациента без АГ, не имеющих критериев НДСТ. Различий по возрасту, продолжительности постменопаузы и индексу массы тела между группами не выявлено. В первой группе выявлено статистически значимое снижение отношения пиковой скорости раннедиастолического наполнения ЛЖ к пиковой скорости позднедиастолического наполнения ЛЖ (p><0,01). Выявлено значимое увеличение конечного диастолического напряжения стенки ЛЖ в 1 группе. У 108 (100%) пациенток выявлена ДД ЛЖ, среди пациенток группы контроля ДД не выявлено. У 8 (40%) пациенток в 1 группе выявлен псевдонормальный тип ДД, у 12 из 20 пациенток (60%) — ДД ригидного типа. При оценке ДФ у пациенток 2 группы установлено значимое снижение — отношения пиковой скорости раннедиастолического наполнения ЛЖ к пиковой скорости позднедиастолического наполнения ЛЖ, значимое увеличение конечного диастолического напряжения стенки ЛЖ и конечного диастолического давления. У 2 из 3 (57,80%) пациенток 2 группы выявлена ДД ригидного типа, псевдонормальный тип — у 32,2% пациенток данной группы. Пациентки 2 группы имели значимое снижение ранней диастолической скорости движения митрального кольца (p<0,01). Заключение. Проведенный анализ эхокардиографических характеристик миокарда свидетельствует о значимом вкладе ассоциированной с АГ НДСТ в развитие ДД ЛЖ у женщин постменопаузального периода. Ключевые слова: хроническая сердечная недостаточность, диастолическая дисфункция, эхокардиография, недифференцированная дисплазия соединительной ткани ˂ 0,05.
Результаты. Первая группа — 20 (14,8%) пациентов с верифицированными НДСТ и АГ, 2 группа — 88 (65,2%) пациентов с АГ, не имеющих НДСТ, группа контроля — 23 (30%) пациента без АГ, не имеющих критериев НДСТ. Различий по возрасту, продолжительности постменопаузы и индексу массы тела между группами не выявлено. В первой группе выявлено статистически значимое снижение отношения пиковой скорости раннедиастолического наполнения ЛЖ к пиковой скорости позднедиастолического наполнения ЛЖ (p˂0,01). Выявлено значимое увеличение конечного диастолического напряжения стенки ЛЖ в 1 группе. У 108 (100%) пациенток выявлена ДД ЛЖ, среди пациенток группы контроля ДД не выявлено. У 8 (40%) пациенток в 1 группе выявлен псевдонормальный тип ДД, у 12 из 20 пациенток (60%) — ДД ригидного типа. При оценке ДФ у пациенток 2 группы установлено значимое снижение — отношения пиковой скорости раннедиастолического наполнения ЛЖ к пиковой скорости позднедиастолического наполнения ЛЖ, значимое увеличение конечного диастолического напряжения стенки ЛЖ и конечного диастолического давления. У 2 из 3 (57,80%) пациенток 2 группы выявлена ДД ригидного типа, псевдонормальный тип — у 32,2% пациенток данной группы. Пациентки 2 группы имели значимое снижение ранней диастолической скорости движения митрального кольца (p˂0,01).
Заключение. Проведенный анализ эхокардиографических характеристик миокарда свидетельствует о значимом вкладе ассоциированной с АГ НДСТ в развитие ДД ЛЖ у женщин постменопаузального периода.
- Рассмотрена роль N-концевого фрагмента промозгового натрийуретического пептида (NTproBNP) в качестве маркера сердечно-сосудистых заболеваний в ассоциации, объясняющей механизм патогенеза резистентной артериальной гипертензии (РАГ).
- Повышенное высвобождение мозгового натрийуретического пептида является компенсаторной реакцией, направленной на снижение артериального давления и адаптацию организма, поэтому использование NT-proBNP может быть перспективным для определения прогноза РАГ.
- Согласно данным последних клинических исследований, перспективным видится применение двойного ингибирования активности неприлизина и сакубитрила/валсартана для снижения уровня NT-proBNP и эффективного контроля артериального давления у пациентов с РАГ.
Современная медицина успешно использует N-концевой фрагмент мозгового натрийуретического гормона (В-типа) (NT-proBNP) в качестве биомаркера многих сердечно-сосудистых заболеваний. Согласно ряду исследований, NTproBNP также может играть роль в развитии резистентной артериальной гипертензии (РАГ), но существующие работы касаются этого вопроса лишь косвенно. В свою очередь, РАГ наносит серьёзный ущерб экономической и социальной сферам жизни общества, ухудшая качество жизни пациентов. Таким образом, сложность верификации и лечения РАГ, противоречивость описанных ассоциаций NT-proBNP и РАГ делает эту тему как никогда актуальной.
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Рабочая группа по диагностике и лечению острой и хронической сердечной недостаточности Европейского
общества кардиологов (ESC).
При участии Ассоциации сердечной недостаточности (HFA) в составе ESC.
ISSN 2618-7620 (Online)