Перейти к:
Динамика изменения размеров корня аорты после одномоментной коррекции стенозированного аортального клапана и аневризмы восходящей аорты
https://doi.org/10.15829/1560-4071-2023-5198
Аннотация
Вопрос хирургического вмешательства на корне аорты (КоАо) в ходе одномоментного протезирования тубулярной части восходящего отдела аорты с имплантацией протеза аортального клапана (АК) у пациентов с аневризмой восходящей аорты (АВА) и стенозом АК до сих пор остается дискутабельным.
Цель. Проанализировать динамику изменения размеров сохраненного КоАо после одномоментного протезирования АК и восходящей аорты.
Материал и методы. В ретроспективное исследование было включено 102 пациента, которым с декабря 2012 по май 2022гг было выполнено одномоментное протезирование АК и восходящего отдела аорты с резекцией дуги аорты по типу "полудуги". Пациенты были разделены на 2 группы на основании морфологии АК: 1 группа — пациенты с двустворчатым АК (ДАК) и АВА (n=75), 2 группа — пациенты с трехстворчатым АК (ТАК) и АВА (n=27). В зависимости от наличия дилатации КоАо (максимальный диаметр (d) >40 мм) каждая из групп была стратифицирована еще на 2 подгруппы: пациенты без дилатации КоАо (d≤40 мм) и с его дилатацией (d>40 мм). Динамику размеров КоАо оценивали по данным компьютерной томографической ангиографии.
Результаты. Средний период наблюдения за пациентами составил 36,2±14,6 мес. Выживаемость пациентов групп ДАК+АВА и ТАК+АВА составила 96% и 100%, соответственно (p=0,380). Свобода от реоперации на КоАо составила 100% в обеих группах исследования. У пациентов с дилатированным и недилатированным КоАо группы ДАК+АВА отмечалось увеличение размеров КоАо со скоростью 0,65±0,51 мм/год и 0,32±0,27 мм/год, соответственно. У пациентов группы ТАК+АВА наблюдалась регрессия размеров дилатированного и недилатированного КоАо: 0,93±0,48 мм/год и 0,56±0,43 мм/год, соответственно.
Заключение. У пациентов с АВА в сочетании со стенотическим поражением ДАК после одномоментного хирургического вмешательства наблюдается слабоотрицательная динамика недилатированного и дилатированного КоАо в среднесрочном периоде наблюдения. У пациентов с АВА и ТАК в сроки до 3 лет отмечается инволютивная картина в отношении размеров КоАо.
Ключевые слова
Для цитирования:
Панфилов Д.С., Базарбекова Б.А., Панфилова Н.О., Саушкин В.В., Сондуев Э.Л., Сазонова С.И., Козлов Б.Н. Динамика изменения размеров корня аорты после одномоментной коррекции стенозированного аортального клапана и аневризмы восходящей аорты. Российский кардиологический журнал. 2023;28(1):5198. https://doi.org/10.15829/1560-4071-2023-5198
For citation:
Panfilov D.S., Bazarbekova B.A., Panfilova N.O., Saushkin V.V., Sonduev E.L., Sazonova S.I., Kozlov B.N. Changes in aortic root dimensions after ascending aortic repair with concomitant aortic valve replacement. Russian Journal of Cardiology. 2023;28(1):5198. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5198
Аневризма восходящей аорты (АВА) нередко сочетается с патологией аортального клапана (АК), что, в свою очередь, усугубляет тяжесть основного заболевания и увеличивает риски развития осложнений [1].
Вместе с тем у ряда пациентов отмечается сочетанная дилатация корня аорты (КоАо). При этом его диаметр не соответствует критериям для хирургической реконструкции данного сегмента аорты, указанным в соответствующих руководствах [2]. Тем не менее вопрос необходимости вмешательства на недилатированном и дилатированном КоАо при одномоментном протезировании стенозированного АК и восходящей аорты остается актуальным и не изучен до конца. Потребность в решении этой проблемы обусловлена в первую очередь возможной необходимостью реоперации вследствие прогрессирующей дилатации в отдаленном послеоперационном периоде нереконструированного сегмента аорты [3], а также вероятностью развития аорто-ассоциированных осложнений у этой категории пациентов [4]. Согласно данным литературы, риск развития негативных событий при сохранении КоАо выше у пациентов с двухстворчатым АК (ДАК) (вследствие его генетической ассоциации с аортопатиями) по сравнению с его трикуспидальной конфигурацией (ТАК) [5][6].
На сегодняшний день отсутствуют работы, содержащие убедительные данные о необходимости сохранения или резекции дилатированного КоАо у пациентов в ходе сочетанного вмешательства по поводу АВА и ДАК/ТАК. С учетом этого факта целью данного исследования явился анализ динамики изменения размеров сохраненного КоАо после одномоментного протезирования АК и восходящей аорты.
Материал и методы
Данное исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice), проведено в соответствии с этическими нормами, изложенными в Хельсинкской декларации 2013г, и одобрено локальным этическим комитетом НИИ кардиологии Томского НИМЦ (протокол № 213 от 12.05.2021).
В ретроспективное исследование было включено 102 пациента, которым с декабря 2012 по май 2022гг в плановом порядке было выполнено одномоментное протезирование восходящего отдела аорты с резекцией дуги аорты по типу "полудуги" и АК по поводу сочетания аневризмы аорты со стенозом АК. Критериями исключения из исследования были синдромная патология аорты, клапанный/протезный эндокардит, расслоение аорты, повторные кардиохирургические операции, связанные со вскрытием перикарда, недостаточность АК, необходимость сочетанного протезирования митрального или трикуспидального клапана, острый коронарный синдром, диаметр КоАо >50 мм, возраст пациентов старше 75 лет, а также наличие тяжелых сопутствующих патологий, не позволяющих провести хирургическую реконструкцию восходящей аорты (тяжелая онкопатология, тяжелая хроническая сердечная недостаточность). Период наблюдения за пациентами составил 36,2±14,6 мес.
Всем пациентам была выполнена компьютерно-томографическая ангиография (КТА) до хирургического вмешательства, а также через 12, 24 и 36 мес. после операции. В каждую контрольную точку на изображениях КТА проводили измерение диаметра аорты в диастолу по внутреннему контуру сосуда на уровне фиброзного кольца, синусов Вальсальвы, синотубулярного соединения, восходящей аорты проксимальнее устья брахиоцефального ствола, проксимальнее и дистальнее устья левой подключичной артерии, на уровне левого предсердия и диафрагмы. Для анализа использовали максимальный диаметр аорты на уровне синусов Вальсальвы (d). Скорость изменения диаметра КоАо рассчитывали как сумму диаметров аорты на уровне синусов Вальсальвы, измеренных в каждую контрольную точку, деленную на 3 года (мм/год).
Все пациенты были разделены на 2 группы на основании морфологии АК: 1 группа — пациенты с ДАК и АВА (ДАК+АВА, n=75), 2 группа — пациенты с ТАК и АВА (ТАК+АВА, n=27). Каждая из групп была дополнительно стратифицирована еще на 2 подгруппы. Критерием для распределения пациентов в подгруппы было наличие дилатации КоАо (d>40 мм) или ее отсутствие (d≤40 мм). Таким образом, были сформированы подгруппы 1а — пациенты с ДАК без дилатации КоАо (n=36) и 1б — пациенты с ДАК с дилатацией КоАо (n=39). Аналогичным образом были сформированы подгруппа 2а — пациенты с ТАК без дилатации КоАо (n=9) и 2б — пациенты с ТАК с дилатацией КоАо (n=18). Дизайн исследования представлен на рисунке 1.

Рис. 1. Дизайн исследования.
Сокращения: АВА — аневризма восходящего отдела аорты, АК — аортальный клапан, ДАК — двухстворчатый аортальный клапан, КоАо — корень аорты, ТАК — трехстворчатый аортальный клапан, d — максимальный диаметр аорты на уровне синусов Вальсальвы в диастолу по данным компьютерно-томографической ангиографии.
Техника измерения аорты
КТА проводили на кардиологическом гибридном томографе Discovery NM/CT 570C (GE Healthcare). Для контрастирования грудной аорты использовали йодсодержащий инфузионный препарат с концентрацией йода 370-400 мг/мл, в объеме 60-110 мл (в зависимости от массы тела пациента), со скоростью 4-5,5 мл/сек. Сканирование проводилось в ретроспективном режиме электрокардиографической синхронизации для последующего реформатирования изображений в 10 фазах сердечного цикла. Параметры записи исследования: напряжение на трубке 120 кВ, сила тока 300-600 мА с электрокардиографической модуляцией, скорость вращения трубки 0,4 с, питч: 0,20-0,22 (в зависимости от частоты сердечных сокращений). Изображения были реконструированы по стандартным протоколам с толщиной срезов 0,625 мм. Обработка полученных изображений проводилась на рабочей станции Advantage Workstations 4.3 (GE Healthcare) с последующим измерением размеров всех отделов грудной аорты и построением объемных реконструкций.
Операционный протокол
Всем пациентам было выполнено одномоментное протезирование АК и протезирование восходящей аорты с реконструкцией дуги аорты по типу "полудуги" в условиях умеренной гипотермии (28-30° С), циркуляторного ареста и антеградной перфузии головного мозга через брахиоцефальный ствол [7].
В ходе протезирования восходящей аорты использовали технику открытого аортального анастомоза. Дистальный аортальный анастомоз формировали напротив супрааортальных сосудов, начиная от устья левой подключичной артерии до брахиоцефального ствола по малой кривизне дуги аорты. Местом формирования проксимального анастомоза был участок аорты на уровне синотубулярного соединения.
Вмешательство на АК включало в себя иссечение измененных створок, декальцинацию кольца АК и механического или биологического протеза АК, используя технику отдельных П-образных швов. Выбор протеза осуществляли с учетом современных рекомендаций и предпочтения пациента.
Статистический анализ. Статистическая обработка данных проводилась в программе STASTICA 10.0. Нормальность распределения количественных показателей проверяли с помощью критерия Шапиро-Уилка. Параметры, подчиняющиеся нормальному закону распределения, описаны с помощью среднего значения (M) и стандартного отклонения (SD); не подчиняющиеся нормальному закону распределения — с помощью медианы (Me) и интерквартильного интервала (Q25-Q75). Качественные данные описаны частотой встречаемости и процентами. При нормальном законе распределения данных для проверки статистической значимости различий количественных показателей в сравниваемых группах использовали t-критерий Стьюдента для независимых групп; критерий Манна-Уитни — при неизвестном законе распределения. Для сравнения категориальных переменных использовались точный критерий Фишера и критерий хи-квадрат. Межгрупповой анализ выживаемости и свободы от реопераций у оперированных пациентов проводили по методу Kaplan-Meier. Границы статистической значимости результатов определяли как p<0,05.
Результаты
Демографическая характеристика пациентов в подгруппах, основная и сопутствующая патология, а также результаты инструментальных исследований до операции представлены в таблице 1. В анализируемых подгруппах не было различий, кроме статистически значимого преобладания мужчин в подгруппе 1б по сравнению с подгруппой 1а (p=0,03).
Таблица 1
Дооперационная характеристика пациентов по подгруппам
1 группа ДАК+АВА | 2 группа ТАК+АВА | ||||||
Параметр | 1а (КоАо<40 мм) | 1б (КоАо>40 мм) | Уровень p | 2а (КоАо<40 мм) | 2б (КоАо>40 мм) | Уровень p | |
Возраст, лет | 53,4±12,2 | 55,1±13,3 | 0,56 | 64,3±7,4 | 60,7±9,3 | 0,49 | |
Мужской пол, n (%) | 20 (55,5%) | 31 (79,5%) | 0,03 | 3 (33,3%) | 6 (33,3%) | 0,99 | |
ДСТ, n (%) | 17 (47,2%) | 24 (61,5%) | 0,21 | 2 (22,2%) | 9 (50%) | 0,17 | |
ИБС, n (%) | 1 (2,8%) | 4 (10,26%) | 0,67 | 1 (11,1%) | 3 (16,7%) | 0,71 | |
АГ, n (%) | 21 (58,3%) | 24 (61,5%) | 0,77 | 4 (44,4%) | 11 (61,1%) | 0,41 | |
ФП, n (%) | – | 3 (7,69%) | 0,09 | 1 (11,1%) | 3 (16,7%) | 0,71 | |
ХОБЛ, n (%) | 1 (2,8%) | 6 (15,38%) | 0,06 | 1 (11,1%) | 1 (5,56%) | 0,61 | |
ХБП, n (%) | 1 (2,8%) | 4 (10,26%) | 0,19 | – | 1 (5,56%) | 0,26 | |
ФК NYHA | I | 10 (27,8%) | 5 (12,8%) | 0,11 | 1 (11,1%) | – | 0,15 |
II | 10 (27,8%) | 11 (28,2%) | 0,97 | 2 (22,2%) | 5 (27,8%) | 0,76 | |
III | 7 (19,4%) | 9 (23,1%) | 0,71 | 2 (22,2%) | 5 (27,8%) | 0,76 | |
IV | – | – | – | – | – | – | |
Эхокардиография | |||||||
ФВ, % | 65 [ 62; 69] | 62 [ 55; 65] | 0,001 | 64 [ 62; 65] | 62 [ 57; 64] | 0,32 | |
КДО, мл | 108,5 [ 84; 129] | 132 [ 103; 182] | 0,02 | 125 [ 106; 142] | 136,5 [ 113; 168] | 0,35 | |
КСО, мл | 34 [ 28; 50] | 48 [ 37; 76] | 0,005 | 45 [ 35; 54] | 53,5 [ 40; 61] | 0,25 | |
Пиковый градиент АК, мм рт.ст. | 60,5 [ 38; 71] | 57 [ 33; 71] | 0,45 | 57,5 [ 54,5; 83] | 56 [ 42; 76] | 0,64 | |
Средний градиент АК, мм рт.ст. | 35,5 [ 22; 41] | 30 [ 17; 40] | 0,22 | 34,5 [ 31; 47] | 31 [ 22; 43] | 0,48 | |
Мультиспиральная компьютерная томография | |||||||
Фиброзное кольцо АК | 24±2,3 | 26,3±3,2 | <0,001 | 23±1,9 | 26±2,3 | 0,002 | |
Синусы Вальсальвы | 38 [ 36; 39] | 45 [ 43; 47] | <0,001 | 38 [ 36; 39] | 46 [ 42; 48] | <0,001 | |
СТС | 35,5 [ 34; 41] | 43 [ 40; 47] | <0,001 | 34 [ 33; 69,5] | 45 [ 39; 56] | 0,06 | |
Восходящая аорта | 50 [ 47; 52] | 53 [ 50; 56] | 0,002 | 52 [ 50; 55] | 54,5 [ 51; 79] | 0,36 | |
Дуга аорты | 38 [ 36; 42] | 39,5 [ 36; 44] | 0,32 | 43,5 [ 40; 73] | 45 [ 42; 46] | 0,62 | |
Сокращения: АВА — аневризма восходящего отдела аорты, АГ — артериальная гипертензия, АК — аортальный клапан, ДАК — двухстворчатый аортальный клапан, ДСТ — дисплазия соединительных тканей, ИБС — ишемическая болезнь сердца, КДО — конечно-диастолический объем, КоАо — корень аорты, КСО — конечно-систолический объем, ТАК — трехстворчатый аортальный клапан, СТС — синотубулярное соединение, ФВ — фракция выброса, ФК — функциональный класс, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ХБП — хроническая болезнь почек, NYHA — New York Heart Association.
ДАК в сочетании с АВА
Исходно в подгруппах 1а и 1б размеры КоАо у пациентов составили 38 [ 36; 39] мм и 45 [ 43; 47] мм, соответственно (p<0,001). В течение всего периода наблюдения после операции была отмечена тенденция к увеличению размеров аорты у пациентов обеих подгрупп. Так, в подгруппе 1а через 12, 24 и 36 мес. после операции регистрировали увеличение диаметра КоАо на 0,32±0,08 мм, 0,33±0,07 мм и 0,33±0,08 мм, соответственно. В подгруппе 1б темп увеличения диаметра КоАо был несколько больше и составил 0,88±0,26 мм, 0,36±0,07 мм и 0,71±0,09 мм в сроки 12, 24 и 36 мес., соответственно. У пациентов с дилатированным и недилатированным КоАо группы ДАК+АВА отмечалось увеличение размеров КоАо со скоростью 0,65±0,51 мм/год и 0,32±0,27 мм/год, соответственно (p=0,041). Динамика роста КоАо у пациентов в подгруппах 1а и 1б представлена на рисунке 2.
Свобода от реоперации на проксимальном отделе грудной аорты в течение 36 мес. составила 100% в обеих подгруппах. Среднесрочная выживаемость пациентов в подгруппах 1а и 1б составила 94,4% и 97,4%, соответственно (p=0,324) (рис. 3).
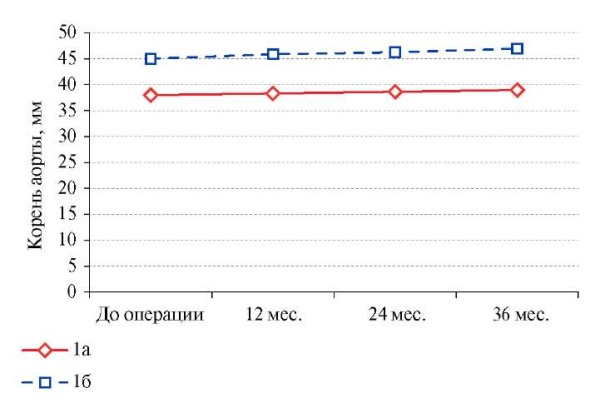
Рис. 2. Динамика изменения размеров КоАо у пациентов с ДАК и АВА при нормальных его размерах (1а) и дилатации (1б).

Рис. 3. Кривая выживаемости Kaplan-Meier в подгруппах с недилатированным (1а) и дилатированным (1б) КоАо у пациентов с АВА и бикуспидальным АК.
ТАК в сочетании с АВА
Дооперационные значения размеров недилатированного и дилатированного КоАо у пациентов с ТАК составили 38 [ 36; 39] мм и 46 [ 42; 48] мм, соответственно (p<0,001). У данной категории лиц отмечали обратную динамику изменения размеров КоАо по сравнению с пациентами с ДАК. Так, в подгруппе 2а размер КоАо в сроки 12, 24 и 36 мес. сокращался на 1,0±0,5 мм 0,2±0,1 мм и 0,5±0,1 мм, соответственно. При этом в подгруппе 2б также было зафиксировано сокращение размеров: на 1,7±0,9 мм, 0,6±0,3 мм и 0,5±0,2 мм в сроки 12, 24 и 36 мес., соответственно (рис. 4). В целом у пациентов группы ТАК+АВА наблюдалась регрессия размеров дилатированного и недилатированного КоАо: 0,93±0,48 мм/год и 0,56±0,43 мм/год, соответственно (p=0,028).
Свобода от реоперации на КоАо в течение 36 мес. составила 100% в обеих подгруппах. Выживаемость пациентов в течение трехлетнего периода наблюдения в подгруппах 2а и 2б составила 100%.

Рис. 4. Динамика изменения размеров КоАо у пациентов с ТАК и АВА при нормальных его размерах (2а) и дилатации (2б).
Обсуждение
Согласно данным литературы аневризма КоАо является показанием к реконструктивной операции как изолированно, так и в сочетании с протезированием других сегментов грудной аорты вне зависимости от морфологии АК [2][8]. Однако менее ясен риск аортальных событий при дилатации КоАо, не достигающей критериев аневризмы (40-49 мм), особенно у пациентов с ДАК.
Существует мнение, что ДАК, имея эмбриологическую общность с восходящей аортой, оказывает негативное воздействие на аортальную стенку не только тубулярной части, но и КоАо [9]. Кроме того, представлены данные о том, что пациенты с двустворчатым АК характеризуются высокой частотой дилатации нерезецированного КоАо после вмешательств на восходящем отделе аорты в отсроченном послеоперационном периоде, что может провоцировать развитие негативных аорто-ассоциированных событий [5][6]. Таким образом, по мнению ряда авторов, при АВА, сочетающейся с поражением АК, целесообразно выполнять максимально радикальную процедуру, включающую протезирование не только тубулярной части аорты, но также и КоАо, особенно у пациентов с ДАК [5][10]. В подтверждение этого тезиса Salihi, et al. [11] опубликовали результаты, продемонстрировавшие более быстрый рост КоАо у пациентов с ДАК по сравнению с пациентами с ТАК (p=0,01). Regeer, et al. [12] предположили, что непосредственной причиной дилатации КоАо в этом случае является двустворчатое строение АК, которое обусловливает изменение внутриаортальной гемодинамики. Это, в свою очередь, оказывает влияние на статус аортальной стенки, приводя к ее расширению. В то же время другая группа ученых, исходя из полученных результатов собственного исследования, пришла к выводу, что ДАК не увеличивает частоту неблагоприятных аортальных событий по сравнению с ТАК (p=0,758) [13].
В связи с ограниченным объемом опубликованных сравнительных продольных исследований по оценке динамики размеров недилатированного и дилатированного КоАо при стенотическом поражении АК до сих пор отсутствует истинное понимание масштаба обсуждаемой проблемы. В настоящем исследовании проведена аналитическая оценка динамики размеров КоАо с учетом морфологии АК после одномоментного протезирования тубулярного сегмента восходящей аорты и стенозированного АК, позволяющая дополнить базу компаративных исследований с целью выработки адекватной хирургической стратегии у этой категории больных.
Полученные в ходе данной работы данные свидетельствуют о том, что КоАо при ДАК имеет относительно медленный темп роста как в случаях недилатированного, так и в случаях расширенного КоАо. Полученные данные согласуются с результатами других исследований [14][15]. Так, Peterss S, et al. [14] отметили слабый темп роста КоАо в послеоперационном периоде у пациентов, составивший 0,27-0,51 мм/год (в среднем 0,41 мм/год). Также Milewski RK, et al. не выявили значимых различий в отношении скорости роста нерезецированного КоАо между пациентами с двустворчатой и трехстворчатой конфигурацией АК, сделав вывод об отсутствии значимого увеличения КоАо в обеих исследуемых группах [16]. Более того, Vendramin I, et al. [17] в своем исследовании отметили уменьшение размеров КоАо в послеоперационном периоде у пациентов с ДАК. В нашем исследовании мы наблюдали умеренный темп увеличения КоАо в отсроченном послеоперационном периоде у пациентов с ДАК, не требовавшим повторного вмешательства. У пациентов с ТАК мы выявили обратную динамику изменения размеров КоАо. Регрессия размеров КоАо у этой группы больных может быть следствием протезирования стенозированного АК, являющегося причиной турбулентного потока крови. После данного вмешательства поток крови становится ламинарным в связи с прекращением измененного гемодинамического воздействия на стенку аорты, а корень аорты перестает быть скомпрометированным участком. Таким образом, учитывая полученные данные, протезирование лишь аневризматически расширенного сегмента восходящей аорты без вмешательства на КоАо представляется допустимой хирургической тактикой.
Ограничения исследования. Основными ограничениями исследования являются относительно малый размер выборки, ретроспективный анализ и недостаточный срок наблюдения за прооперированными пациентами. Коррекция данных условий позволила бы предоставить более точные данные.
Заключение
У пациентов с АВА в сочетании со стенотическим поражением ДАК после одномоментного хирургического вмешательства наблюдается слабоотрицательная динамика недилатированного и дилатированного КоАо в среднесрочном периоде наблюдения. У пациентов с АВА и ТАК в сроки до 36 мес. отмечается инволютивная картина в отношении размеров КоАо.
С учётом полученных данных при выборе объема оперативного вмешательства сохранение даже дилатированного КоАо у пациентов с АВА вне зависимости от морфологии стенозированного АК представляется возможной хирургической тактикой.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 21-15-00160, https://rscf.ru/project/21-15-00160.
Список литературы
1. Keane MG, Wiegers SE, Plappert T, et al. Bicuspid aortic valves are associated with aortic dilatation out of proportion to coexistent valvular lesions. Circulation. 2000;102(19 Suppl 3):III35-9. doi:10.1161/01.cir.102.suppl_3.iii-35.
2. Абугов С.А., Аверина Т.Б., Акчурин Р.С. и др. Клинические рекомендации. Рекомендации по диагностике и лечению заболеваний аорты (2017). Кардиология и сердечно-сосудистая хирургия. 2018;11(1):7-67.
3. Koda Y, Okada K. Clinical Outcomes of Aortic Root Reoperation. Kyobu Geka. 2021;74(10):763-9. Japanese.
4. Zafar MA, Li Y, Rizzo JA, et al. Height alone, rather than body surface area, suffices for risk estimation in ascending aortic aneurysm. J Thorac Cardiovasc Surg. 2018;155(5):1938- 50. doi:10.1016/j.jtcvs.2017.10.140.
5. Borger MA, Preston M, Ivanov J, et al. Should the ascending aorta be replaced more frequently in patients with bicuspid aortic valve disease? J Thorac Cardiovasc Surg. 2004;128(5):677-83. doi:10.1016/j.jtcvs.2004.07.009.
6. Yasuda H, Nakatani S, Stugaard M, et al. Failure to prevent progressive dilation of ascending aorta by aortic valve replacement in patients with bicuspid aortic valve: comparison with tricuspid aortic valve. Circulation. 2003;108(Suppl 1): II291-II294. doi:10.1161/01.cir.0000087449.03964.fb.
7. Козлов Б. Н., Панфилов Д. С., Горохов А.С. и др. Результаты радикальной реконструкции аневризм грудной аорты по методике hemi-arch. Кардиология и сердечно-сосудистая хирургия. 2016;9(1):42-6. doi:10.17116/kardio20169142-46.
8. Чарчян Э.Р., Белов Ю.В., Скворцов А.А. и др. Выбор метода пластики аортального клапана в хирургии корня и восходящей аорты. Патология кровообращения и кардиохирургия. 2016;20(2):26-34. doi:10.21688/1681-3472-2016-2-26-34.
9. Pisano C, D’Amico F, Balistreri CR, et al. Biomechanical properties and histomorphometric features of aortic tissue in patients with or without bicuspid aortic valve. J Thorac Dis. 2020;12(5):2304-16. doi:10.21037/jtd.2020.03.122.
10. Nazer RI, Elhenawy AM, Fazel SS, et al. The influence of operative techniques on the outcomes of bicuspid aortic valve disease and aortic dilatation. Ann Thorac Surg. 2010;89:1918-24. doi:10.1016/j.athoracsur.2010.02.070.
11. Salihi S, Cantürk E, Köksal C, Alp HM. Should Sinus of Valsalva be Replaced in Patients with Dilated Ascending Aorta and Aortic Valve Diseases? Braz J Cardiovasc Surg. 2018;33(6):573-8. doi:10.21470/1678-9741-2018-0093.
12. Regeer MV, Versteegh MI, Klautz RJ, et al. Effect of Aortic Valve Replacement on Aortic Root Dilatation Rate in Patients With Bicuspid and Tricuspid Aortic Valves. Ann Thorac Surg. 2016;102(6):1981-7. doi:10.1016/j.athoracsur.2016.05.038.
13. Sun J, Chen S, Sun C, et al. Outcomes After Isolated Aortic Valve Replacement in Patients with Bicuspid vs Tricuspid Aortic Valve. Semin Thorac Cardiovasc Surg. 2021;S1043- 0679(21)00378-6. doi:10.1053/j.semtcvs.2021.08.001.
14. Peterss S, Bhandari R, Rizzo JA, et al. The Aortic Root: Natural History After Root-Sparing Ascending Replacement in Nonsyndromic Aneurysmal Patients. Ann Thorac Surg. 2017;103(3):828-33. doi:10.1016/j.athoracsur.2016.06.081.
15. Филиппов А.А., Щербинин Т.С., Гордеев М. Л. Динамика расширения корня аорты после протезирования двустворчатого аортального клапана и хирургической коррекции расширения восходящей аорты. Кардиология и сердечно-сосудистая хирургия. 2021;14(6):464-70. doi:10.17116/kardio202114061464.
16. Milewski RK, Habertheuer A, Bavaria JE, et al. Fate of remnant sinuses of Valsalva in patients with bicuspid and trileaflet valves undergoing aortic valve, ascending aorta, and aortic arch replacement. J Thorac Cardiovasc Surg. 2017;154(2):421-32. doi:10.1016/j.jtcvs.2017.03.150.
17. Vendramin I, Meneguzzi M, Sponga S, et al. Bicuspid aortic valve disease and ascending aortic aneurysm: should an aortic root replacement be mandatory? Eur J Cardiothorac Surg. 2016;49(1):103-9. doi:10.1093/ejcts/ezv069.
Об авторах
Д. С. ПанфиловРоссия
д.м.н., с.н.с. ОССХ,
Томск
Б. А. Базарбекова
Россия
аспирант ОССХ, врач сердечно-сосудистый хирург кардиохирургического отделения № 1,
Томск
Н. О. Панфилова
Россия
к.м.н., врач-рентгенолог,
Новокузнецк
В. В. Саушкин
Россия
к.м.н., врач-радиолог в лаборатории радионуклидных методов исследования,
Томск
Э. Л. Сондуев
Россия
врач сердечно-сосудистый хирург кардиохирургического отделения № 1,
Томск
С. И. Сазонова
Россия
д.м.н., в.н.с. лаборатории радионуклидных методов исследования,
Томск
Б. Н. Козлов
Россия
д.м.н., в.н.с. ОССХ, руководитель отделения сердечно-сосудистой хирургии,
Томск
Дополнительные файлы
Рецензия
Для цитирования:
Панфилов Д.С., Базарбекова Б.А., Панфилова Н.О., Саушкин В.В., Сондуев Э.Л., Сазонова С.И., Козлов Б.Н. Динамика изменения размеров корня аорты после одномоментной коррекции стенозированного аортального клапана и аневризмы восходящей аорты. Российский кардиологический журнал. 2023;28(1):5198. https://doi.org/10.15829/1560-4071-2023-5198
For citation:
Panfilov D.S., Bazarbekova B.A., Panfilova N.O., Saushkin V.V., Sonduev E.L., Sazonova S.I., Kozlov B.N. Changes in aortic root dimensions after ascending aortic repair with concomitant aortic valve replacement. Russian Journal of Cardiology. 2023;28(1):5198. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5198
JATS XML

















































