Перейти к:
Предикторы развития рестеноза сонной артерии после каротидной эндартерэктомии
https://doi.org/10.15829/1560-4071-2025-6139
EDN: QNUZTD
Аннотация
Цель. Определить предикторы рестеноза сонной артерии у пациентов после каротидной эндартерэктомии (КЭА).
Материал и методы. В исследование были включены 100 больных стенозирующим атеросклерозом сонных артерий, перенесших операцию КЭА. Объем обследования включал биохимический и клинический скрининговые тесты, компьютерную ангиографию и ультразвуковое дуплексное сканирование сонных артерий до и после операции. Медиана наблюдения составила 1,9 лет [1,4;2,25]. В ходе проспективного наблюдения нами были отобраны пациенты с развившимся послеоперационным рестенозом и контрольная группа пациентов без рестеноза, у которых удалось получить наиболее полную информацию о характере послеоперационного течения заболевания, в т.ч. о данных ультразвукового дуплексного сканирования сонных артерий и конечных точках. В финальный анализ вошли 76 пациентов: 55 мужчин и 21 женщина, средний возраст 67 лет у мужчин и 66,5 лет у женщин. В зависимости от степени рестеноза пациенты были разделены на группы следующим образом: без рестеноза (0-19%), умеренный рестеноз (20-50%), значимый рестеноз (от 51%).
Результаты. Согласно результатам многофакторного регрессионного анализа, ключевыми предикторами рестеноза оказались: уровень глюкозы, коэффициент атерогенности и скорость клубочковой фильтрации (СКФ). Статистически значимыми параметрами, связанными с тяжестью рестеноза, явились: СКФ, уровень глюкозы, линейная скорость кровотока после операции, индекс массы тела и возраст (все лабораторные показатели оценивались перед хирургическим вмешательством). У пациентов без рестеноза наблюдались отличия по сравнению с группой с умеренным рестенозом по таким факторам, как коэффициент атерогенности, уровень фибриногена, глюкозы и протромбина, а также курению. Кроме того, группа с выраженным рестенозом проявляла значимые различия с группой без рестеноза по показателям СКФ. Показано, что частота развития рестеноза увеличивается спустя 12 мес. после оперативного вмешательства, достигая своего пика к двум годам наблюдения. Мы не выявили статистически достоверных ассоциаций вида оперативного вмешательства (классическая/эверсионная КЭА) с развитием различных послеоперационных осложнений, за исключением тромбоза в раннем послеоперационном периоде.
Заключение. Таким образом, согласно данным нашего исследования, вероятность развития рестеноза оказалась ассоциирована с традиционными факторами риска сердечно-сосудистых заболеваний, такими как нарушение углеводного и липидного обмена, воспаление, снижение СКФ и ожирение, и нарастает с увеличением послеоперационного периода наблюдения. Полученные данные позволяют предположить, что механизмы, лежащие в основе патогенеза рестеноза, схожи с теми, что приводят к развитию атеросклероза.
Для цитирования:
Колесова Е.П., Верховская Е.В., Ванюркин А.Г., Зайкова Е.К., Кван В.В., Калинина О.В., Чернявский М.А., Маслянский А.Л., Яковлев А.Н., Бабенко А.Ю., Конради А.О., Шляхто Е.В. Предикторы развития рестеноза сонной артерии после каротидной эндартерэктомии. Российский кардиологический журнал. 2025;30(2):6139. https://doi.org/10.15829/1560-4071-2025-6139. EDN: QNUZTD
For citation:
Kolesova E.P., Verkhovskaya E.V., Vanyurkin A.G., Zaykova E.K., Kvan V.V., Kalinina O.V., Chernyavsky M.A., Maslyansky A.L., Yakovlev A.N., Babenko A.Yu., Konradi A.O., Shlyakhto E.V. Predictors of carotid artery restenosis after carotid endarterectomy. Russian Journal of Cardiology. 2025;30(2):6139. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6139. EDN: QNUZTD
Стеноз сонной артерии (ССА) представляет собой клиническое состояние, характеризующееся сужением или окклюзией сонных артерий, главным образом вследствие атеросклероза. Атеросклеротические бляшки (АСБ) чаще всего локализуются в области бифуркации общей сонной артерии, включая устье и луковицу внутренней сонной артерии (ВСА) [1].
ССА способен вызывать гипоперфузию головного мозга, что приводит к развитию неврологической симптоматики и повышает риск возникновения ишемического инсульта. Известно, что симптомный ССА ответственен примерно за 20% случаев инсульта, а ~2% взрослого населения страдают бессимптомным течением ССА [2][3]. Общие факторы риска развития ССА включают немодифицируемые факторы риска, такие как пожилой возраст и мужской пол, а также различные модифицируемые факторы, такие как курение, низкая физическая активность, ожирение, дислипидемия, артериальная гипертензия (АГ) и сахарный диабет [4].
В настоящее время для хирургического лечения данной патологии применяются два основных подхода: открытая хирургия и эндоваскулярное вмешательство. Открытая хирургия включает в себя каротидную эндартерэктомию (КЭА), которая, в свою очередь, подразделяется на эверсионную и классическую. Классическая КЭА — это хирургическая процедура, при которой АСБ, вызывающую сужение сонной артерии, удаляют, а затем целостность артерии восстанавливают с помощью заплаты из ксеноперикарда, политетрафторэтилена или дакрона. При эверсионной КЭА ВСА отсекают в области устья с последующим её выворачиванием и удалением АСБ [5]. Затем выполняют реимплантацию ВСА в область бифуркации. Эндоваскулярное вмешательство представляет собой баллонную ангиопластику со стентированием поражённого участка брахиоцефальной артерии.
В рекомендациях Общества сосудистой хирургии КЭА является основным вариантом хирургического лечения для симптомных пациентов со стенозом 50-99% и бессимптомных пациентов со стенозом 70-99% [6]. Несмотря на то, что КЭА считается высокоэффективной, после данного хирургического вмешательства у больных имеют место различные послеоперационные осложнения, среди которых выделяют ранние и отдаленные. Так, согласно обзору литературы, рассматривающему различные подходы к КЭА, применяемые в России, отмечается, что классическая техника чаще приводит к развитию рестеноза в отдаленные сроки, а также может быть связана с образованием аневризмы и инфекционных осложнений в области шва. В свою очередь, эверсионная методика сопряжена с повышенным риском интраоперационного тромбоза, что обусловлено отслойкой интимы в зоне выполнения эндартерэктомии [7]. Рестеноз является одним из наиболее распространенных осложнений в отдаленном послеоперационном периоде и может вызывать преходящие нарушения мозгового кровообращения, тем самым приводить к возникновению неврологических симптомов и инсульту [8][9].
Материал и методы
Дизайн исследования. В исследование были включены 100 пациентов со стенозирующим атеросклерозом сонных артерий, подвергшихся оперативному вмешательству (КЭА) в отделении сосудистой хирургии ФГБУ "НМИЦ им. В. А. Алмазова" в период с 2021 по 2023гг.
Всем пациентам было выполнено стандартное обследование в рамках предоперационной подготовки, в т. ч. биохимический и клинический скрининг, компьютерная томографическая ангиография и ультразвуковое дуплексное сканирование (УЗДС) сонных артерий. После выписки из стационара проводилось проспективное наблюдение за пациентами, выполнялось контрольное УЗДС сонных артерий, а также осуществлялась оценка наличия послеоперационных осложнений и сбор конечных точек. После сбора конечных точек были отобраны 76 пациентов, у которых удалось получить наиболее полную информацию о характере послеоперационного течения заболевания, в т. ч. о данных УЗДС сонных артерий и конечных точках. Пациенты были разделены на две группы: пациенты с развившимся послеоперационным рестенозом и контрольная группа — без рестеноза. Всего было обследовано 76 пациентов, 55 мужчин и 21 женщина, средний возраст 67 лет у мужчин и 66,5 лет у женщин. Эверсионная КЭА была выполнена 57,89% пациентов, классическая КЭА — 42,1% пациентов. Медиана наблюдения составила 1,9 лет [ 1,4;2,25]. У большей части больных наблюдались мультифокальный атеросклероз и АГ, у трети — ожирение и сахарный диабет. Более половины пациентов имели сопутствующий диагноз ишемической болезни сердца, среди которых треть имела острый инфаркт миокарда (ИМ) в анамнезе. Чуть более половины пациентов оказались курильщиками, распространенность курения была выше среди мужчин. Женщины чаще страдали сахарным диабетом и заболеваниями щитовидной железы. Нестабильная АСБ чаще выявлялась среди женщин. Кальцинированные АСБ были выявлены у 70% больных, одинаково у мужчин и женщин. Все пациенты получали терапию статинами, после выписки всем были рекомендованы дезагреганты; антикоагулянты назначались при наличии показаний (фибрилляция предсердий, наличие механического протеза клапана сердца). Данные лекарственные препараты были рекомендованы пациентам в терапевтических диапазонах доз, в соответствии с действующими клиническими рекомендациями с учетом индивидуальных ограничений и противопоказаний к применению (табл. 1).
Таблица 1
Общая характеристика участников исследования и характеристики стеноза сонных артерий
Показатель | Все | Мужчины | Женщины | p |
Общие сведения и антропометрия | ||||
Возраст на момент эпизода, годы | 67,0 [ 62,0;72,0] | 67,0 [ 61,7;72,5] | 66,5 [ 62,7;69,2] | 0,9 |
ИМТ, кг/м2 | 27,7 [ 17,4;42,5] | 27,3 [ 17,4;38,7] | 28,6 [ 18,1;42,5] | 0,9 |
Ожирение (по критерию ИМТ), n (%) | 23 (28) | 16 (28) | 7 (29) | 0,9 |
Курение, n (%) | 22 (52) | 15 (65) | 7 (36) | 0,001 |
САД, мм рт.ст. | 136,5 [ 100;210] | 137,4 [ 120;180] | 134,5 [ 100;210] | 0,3 |
ДАД, мм рт.ст. | 80,56 [ 60;110] | 81,2 [ 70;100] | 78,9 [ 60;110] | 0,5 |
Сопутствующие заболевания | ||||
Наличие атеросклероза других локализаций, n (%) | 52 (70) | 37 (72) | 15 (65) | 0,4 |
Отягощенная наследственность по атеросклерозу, n (%) | 26 (55) | 18 (52) | 8 (61) | 0,4 |
ОНМК в анамнезе, n (%) | 24 (30) | 20 (35) | 4 (16) | 0,09 |
ОИМ в анамнезе, n (%) | 22 (27) | 14 (25) | 8 (33) | 0,4 |
ИБС, n (%) | 49 (61) | 34 (60) | 15 (62) | 0,8 |
АГ, n (%) | 78 (97) | 55 (98) | 23 (95) | 0,5 |
СД, n (%) | 27 (33) | 15 (26) | 12 (50) | 0,04 |
Заболевание щитовидной железы, n (%) | 12 (15) | 4 (7) | 8 (33) | 0,005 |
Сопутствующая терапия | ||||
Статины до и после госпитализации, n (%) | 76 (10) | 55 (100) | 21 (100) | 1,0 |
Антикоагулянты после госпитализации, n (%) | 11 (16) | 8 (19) | 3 (13) | 0,054 |
Дезагреганты после госпитализации, n (%) | 37 (77) | 22 (73) | 15 (83) | 0,832 |
Характеристики стеноза и АСБ до операции | ||||
Стеноз целевой зоны до операции, % | 80,2 [ 50,0;99,0] | 81,5 [ 65,0;99,0] | 80,4 [ 50,0;99,0] | 0,9 |
Протяжённая АСБ, мм | 24,0 [ 19,0;31,2] | 25,0 [ 19,0;33,0] | 22,0 [ 19,5;27,0] | 0,4 |
Кальцинированная АСБ, n (%) | 45 (70) | 31 (70) | 14 (70) | 0,8 |
Стабильная АСБ, n (%) | 28 (43) | 24 (53) | 4 (20) | 0,01 |
Сокращения: АГ — артериальная гипертензия, АСБ — атеросклеротическая бляшка, ДАД — диастолическое артериальное давление, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ЛСК — линейная скорость кровотока, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, САД — систолическое артериальное давление, СД — сахарный диабет.
Исследование проводилось в соответствии с Хельсинкской декларацией и одобрено Комитетом по этике НМИЦ им. В. А. Алмазова (№ 4104-21 от 12.04.2021). Все участники подписали информированное согласие.
Исследование выполнено при поддержке Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2022-301).
Критерии включения в исследование:
- Планируемое оперативное вмешательство (КЭА) по следующим показаниям: асимптомный каротидный стеноз >60%, симптомный каротидный стеноз 50-99%.
- Возраст старше 18 лет.
- Подписание информированного согласия.
Критерии невключения/исключения:
- Выявление противопоказаний к оперативному вмешательству.
- Наличие патологии, лимитирующей наблюдение в отдаленном послеоперационном периоде.
- Скорость клубочковой фильтрации (СКФ) <30 мл/мин/1,73 м2.
- Повышение аланинаминотрансферазы и/или аспартатаминотрансферазы, щелочной фосфатазы более, чем в 3 раза выше верхней границы нормы.
- Онкологические и миелопролиферативные заболевания не в стадии ремиссии.
- Злоупотребление психоактивными веществами, алкоголем.
- Беременность или период лактации.
- Отказ от участия в исследовании.
Клинико-лабораторные методы исследования. Всем пациентам в рамках предоперационной подготовки проводился сбор анамнеза, осмотр с измерением антропометрических показателей, артериального давления (АД) и пульса, лабораторное и инструментальное обследование.
При антропометрии измерение роста (медицинский ростомер (Россия)) и веса (медицинские весы ВЭМ-150 — "Масса-К" (Россия)) проводилось без обуви и верхней одежды с последующим расчетом индекса массы тела по формуле Кетле (отношение массы тела в килограммах к росту в метрах, возведенному в квадрат). Измерение АД и частоты сердечных сокращений было выполнено при помощи автоматического аппарата OMRON на правой руке после 5 минут отдыха сидя трижды: 2 раза сидя и 1 раз стоя (после 3 мин ортостаза). Далее из результатов трех измерений рассчитывались средние значения систолического и диастолического АД, частоты сердечных сокращений.
Натощак были определены следующие лабораторные показатели: клинический анализ крови, коагулограмма, общий холестерин, липопротеиды низкой плотности, липопротеиды высокой плотности, триглицериды, аланинаминотрансфераза, аспартатаминотрансфераза, креатинин, глюкоза, фибриноген (Abbott Architect 8000, США; реагенты Abbott Diagnostic). СКФ рассчитывали по формуле CKD-EPI [10]. Уровень С-реактивного белка определяли натощак на следующий день после оперативного вмешательства (Cobas Integra 400 plus, Швейцария; реагенты Roche-diagnostics).
УЗДС сонных артерий было выполнено с помощью портативной диагностической системы My Sono U6 (Samsung, Корея). Оценка факта наличия или отсутствия АСБ проводилась с определением степени стеноза, измеренного методом "по диаметру" в процентах [11].
Компьютерная томографическая ангиография сонных артерий была выполнена на аппарате Somatom Definition Force (Siemens) с мультипланарной и трëхмерной реконструкцией компьютерного томографического изображения. Производилась регистрация следующих показателей: степень стеноза ВСА по NASCET, оценка кальциноза артерии, протяженность стеноза и извитость сонной артерии.
После выписки из стационара больные находились под диспансерным наблюдением. В срок от 12 до 22 мес. пациентам было выполнено контрольное УЗДС сонных артерий, а также произведён сбор клинической информации по жалобам и наличию отдаленных послеоперационных осложнений. Основные конечные точки: развитие рестеноза ВСА по данным УЗДС, развитие транзиторной ишемической атаки/острого нарушения мозгового кровообращения в оперированном сосудистом бассейне, развитие острого ИМ, рецидив неврологической симптоматики, наличие повторных операций на целевом сегменте, смерть пациента. Пациенты — жители Санкт-Петербурга и Ленинградской области были приглашены на очный визит, контакт с иногородними пациентами осуществлялся по телефону, а также по электронной почте.
Статистическая обработка данных. Для оцениваемых параметров была проверена статистическая гипотеза об отсутствии эквивалентности средних по двустороннему критерию с уровнем значимости 0,05. Категориальные (качественные) данные были описаны с использованием процентных и абсолютных значений. Интервальные (количественные) данные были представлены в виде среднего арифметического и стандартного отклонения (для нормально распределенных данных) или с использованием медианы и межквартильного интервала (для распределений, отличных от нормального). Данные были проверены на нормальность с помощью теста Колмогорова-Смирнова или Шапиро-Уилка. Для распределений данных, отличных от нормального, использовалась модель линейной регрессии. Сравнение между двумя группами интервальных данных производилось с помощью t-теста и U-критерия Манна-Уитни. Для категориальных данных сравнения проводились с использованием точного критерия Фишера и критерия ANOVA on Rankings. Все расчеты проводились на платформе Python.
Результаты
При анализе данных лабораторных исследований, полученных накануне оперативного вмешательства, у мужчин были обнаружены более высокие уровни коэффициента атерогенности, креатинина, калия, протромбинового времени, активированного частичного тромбопластинового времени, а также нейтрофильно-лимфоцитарного индекса. У женщин наблюдался более высокий уровень общего холестерина, лимфоцитов и протромбина (табл. 2). Таким образом, нами были выявлены закономерные особенности: различие в спектре факторов риска атеросклероза у мужчин и женщин, а также большая распространенность аутоиммунных заболеваний у женщин (аутоиммунный тиреоидит).
Отдельно были проанализированы различные послеоперационные осложнения (табл. 3). Общее количество включенных в исследование пациентов без рестеноза составило 16 человек (20%), с рестенозом от 20% до 50% — 30 человек (38%), с рестенозом >50% — 20 человек (26%), с рестенозом >70% — 10 человек (12%). Распространенность рестеноза >50% оказалась значимо выше среди мужчин. Распространенность таких осложнений, как кровотечение и острый ИМ, оказалась низкой, у 10% больных развились транзиторная ишемическая атака/острое нарушение мозгового кровообращения и рецидив неврологической симптоматики в послеоперационном периоде. Смерть была зарегистрирована у 1 пациента (развитие повторного фатального ишемического инсульта спустя 1,5 года после операции).
Для анализа сравнительных характеристик групп рестеноза по ключевым параметрам был использован метод множественной логистической регрессии. Исследование проведено среди трёх категорий пациентов: 1 — без рестеноза (0-19%), 2 — с умеренным рестенозом (20-50%), 3 — с выраженным рестенозом (>51%), при этом в качестве контрольной служила первая группа. У пациентов, не имеющих рестеноза, были выявлены отличия по сравнению с группой с умеренным рестенозом по таким параметрам, как коэффициент атерогенности, уровни фибриногена, глюкозы и протромбина, а также по факту курения. Кроме того, группа с выраженным рестенозом показывала значительные отличия от группы без рестеноза по значениям СКФ, как представлено в таблице 4.
Дополнительно нами был проведен многофакторный регрессионный анализ предикторов рестеноза, по результатам которого свою значимость сохранили уровень глюкозы, коэффициент атерогенности и СКФ (табл. 5). Тогда как переменными, ассоциированными со степенью (процентом ССА в зоне вмешательства) рестеноза, оказались: СКФ, уровень глюкозы, линейная скорость кровотока после операции, индекс массы тела и возраст (табл. 6).
Таким образом, можно предположить, что наиболее универсальными лабораторными предикторами принадлежности пациента к той или иной группе рестеноза являются: коэффициент атерогенности, уровень глюкозы, уровень фибриногена и СКФ.
Для определения количества (доли) пациентов, у которых развился рестеноз в зависимости от прошедшего после оперативного вмешательства времени, была построена обратная кривая Каплана-Мейера. Анализируя кривую, можно заметить, что на ранних этапах после вмешательства, в течение первого года, уровень рестеноза остаётся относительно низким, однако после 12 мес. риск значительно возрастает, достигая пика к двум годам. Наибольшее количество пациентов с рестенозом >50% приходится на временной интервал 2 года после операции (рис. 1). Это может быть связано как с временным эффектом комплаентности пациентов в вопросах соблюдения рекомендаций по приёму лекарственных препаратов и соблюдения здорового образа жизни, так и с динамикой сосудистого ремоделирования. Этот факт подчеркивает важность долгосрочного наблюдения за пациентами, перенесшими КЭА, и необходимость разработки эффективных стратегий профилактики рестеноза.
Стоит отметить, что нам не удалось выявить статистически достоверных ассоциаций вида оперативного вмешательства (классическая/эверсионная КЭА) с развитием различных послеоперационных осложнений, за исключением тромбоза в раннем послеоперационном периоде (табл. 7).
Таблица 2
Лабораторные показатели
Показатель | Все | Мужчины | Женщины | p |
Лабораторные данные до оперативного вмешательства | ||||
Креатинин, мкмоль/л | 77,9 [ 71,2;92,0] | 82,8 [ 73,4;92,8] | 72,7 [ 66,1;80,5] | 0,003 |
СКФ, мл/мин/1,73 м2 | 81,7 [ 65,1;98,9] | 84,1 [ 66,6;100,2] | 78,2 [ 63,1;86,7] | 0,2 |
Общий холестерин, ммоль/л | 3,9 [ 3,4;4,6] | 3,8 [ 3,3;4,4] | 4,9 [ 3,4;5,4] | 0,04 |
ЛВП, ммоль/л | 1,1 [ 0,9;1,2] | 1,1 [ 0,9;1,2] | 1,1 [ 0,9;1,3] | 0,3 |
ЛНП, ммоль/л | 2,3 [ 1,7;3,1] | 2,3 [ 1,6;3,1] | 2,2 [ 1,9;2,4] | 0,6 |
ЛНП >1,4 ммоль/л, n (%) | 56 (73,6) | 39 (71) | 17 (100) | 0,1 |
Триглицериды, ммоль/л | 1,2 [ 0,9;1,7] | 1,1 [ 0,9;1,9] | 1,3 [ 1,11;1,67] | 0,8 |
Коэффициент атерогенности | 2,4 [ 1,9;3,3] | 2,8 [ 2,2;3,6] | 2,1 [ 1,8;2,5] | 0,02 |
Протромбиновое время, сек | 13,5 [ 13,0;14,5] | 13,8 [ 13,1;14,7] | 13,1 [ 12,8;13,5] | 0,003 |
Протромбин по Квику, % | 97,0 [ 84,5;105,5] | 91,5 [ 81,7;104,0] | 103,0 [ 97,5;109,0] | 0,007 |
АЧТВ, сек | 36,05 [ 34,0;37,9] | 36,5 [ 34,9;38,8] | 34,3 [ 32,2;37,2] | 0,01 |
Калий, ммоль/л | 4,3 [ 4,0;4,5] | 4,3 [ 4,1;4,6] | 4,1 [ 3,9;4,4] | 0,03 |
Нейтрофилы, 10^9/л | 6,6 [ 4,6;9,01] | 7,2 [ 5,2;9,6] | 4,8 [ 3,6;7,1] | 0,004 |
Лимфоциты, 10^9/л | 1,8 [ 1,5;2,4] | 1,6 [ 1,3;2,3] | 2,05 [ 1,8;2,4] | 0,04 |
Нейтрофильно-лимфоцитарный индекс | 2,1 [ 1,4;2,7] | 2,3 [ 1,6;3,02] | 1,9 [ 1,3;2,4] | 0,03 |
Фибриноген >3,5 г/л, n (%) | 34 (44,7) | 28 (52) | 6 (30) | 0,1 |
Сокращения: АЧТВ — активированное частичное тромбопластиновое время, ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, СКФ — скорость клубочковой фильтрации, СРБ — С-реактивный белок.
Таблица 3
Послеоперационные осложнения
Показатель | Все | Мужчины | Женщины | p |
Ранние послеоперационные осложнения | ||||
Ранние послеоперационные осложнения, n (%) | 2 (2) | 2 (3) | 0 (0) | 1,0 |
Кровотечение в раннем послеоперационном периоде, n (%) | 1 (1) | 1 (2) | 0 (0) | 0,1 |
ОИМ в послеоперационном периоде, n (%) | 1 (1) | 1 (2) | 0 (0) | 0,1 |
Поздние послеоперационные осложнения | ||||
Рестеноз 20-50%, n (%) | 30 (38) | 19 (34) | 11 (47) | 0,2 |
Рестеноз >50%, n (%) | 20 (26) | 20 (38) | 0 (0) | 0,01 |
Рестеноз >70%, n (%) | 10 (12) | 10 (18) | 0 (0) | 0,1 |
Отсутствие рестеноза, n (%) | 16 (20) | 9 (16) | 7 (30) | 0,1 |
ОНМК/ТИА в послеоперационном периоде в прооперированном сосудистом бассейне, n (%) | 5 (8) | 4 (10) | 1 (4) | 0,6 |
Рецидив неврологической симптоматики, n (%) | 6 (10) | 5 (13) | 1 (5) | 0,08 |
Наличие повторных операций на целевом сегменте, n (%) | 2 (3) | 2 (4) | 0 (0) | 0,5 |
Смерть пациента, n (%) | 1 (3) | 1 (4) | 0 (0) | 0,7 |
Сокращения: ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ТИА — транзиторная ишемическая атака.
Таблица 4
Сравнительная характеристика трех групп рестеноза (метод множественной логистической регрессии)
Показатель | Группа 1 vs 2 | Группа 1 vs 2 | Группа 1 vs 3 | Группа 1 vs 3 |
p | ОР [ДИ] | p | ОР [ДИ] | |
Коэффициент атерогенности | 0,06 | 0,55 [ 0,3; 1,02] | 0,78 | 0,91 [ 0,49; 1,7] |
Фибриноген до операции, г/л | 0,05 | 0,44 [ 0,2; 1,0] | 1 | 1,0 [ 0,41; 2,44] |
Протромбин по Квику, % | 0,01 | 0,94 [ 0,9; 0,99] | 0,38 | 0,98 [ 0,94; 1,02] |
Курение | 0,02 | 0,36 [ 0,15; 0,87] | 0,1 | 0,41 [ 0,14; 1,2] |
Глюкоза, ммоль/л | 0,08 | 0,55 [ 0,28; 1,09] | 0,13 | 1,81 [ 0,84; 3,89] |
СКФ, мл/мин/1,73 м2 | 0,95 | 1,0 [ 0,97; 1,03] | 0,03 | 1,04 [ 1,0; 1,07] |
Сокращения: ДИ — доверительный интервал, ОР — отношение рисков, СКФ — скорость клубочковой фильтрации.
Таблица 5
Многофакторный регрессионный анализ предикторов рестеноза
Показатель | p | ОР [ДИ] |
Коэффициент атерогенности | 0,04 | 2,1 [ 1,03; 4,29] |
Фибриноген до операции, г/л | 0,08 | 2,4 [ 0,89; 6,52] |
Протромбин по Квику до операции, % | 0,15 | 1,04 [ 0,99; 1,1] |
Курение | 0,73 | 0,82 [ 0,26; 2,53] |
Глюкоза до операции, ммоль/л | 0,03 | 2,01 [ 1,08; 3,77] |
СКФ, мл/мин/1,73 м2 | 0,03 | 1,04 [ 1,0; 1,08] |
Сокращения: ДИ — доверительный интервал, ОР — отношение рисков, СКФ — скорость клубочковой фильтрации.
Таблица 7
Анализ ассоциации вида хирургической техники (каротидная/эверсионная КЭА) с развитием послеоперационных осложнений
Осложнение | Эверсионная КЭА | Классическая КЭА | p |
Рестеноз ≥20%, n (%) | 35 (58,3) | 25 (41,6) | 0,37 |
Рецидив неврологической симптоматики, n (%) | 3 (60) | 2 (40) | 0,81 |
ОИМ в послеоперационном периоде, n (%) | 0 | 1 (1,31) | 0,83 |
ОНМК/ТИА в послеоперационном периоде в прооперированном сосудистом бассейне, n (%) | 3 (75) | 1 (25) | 0,73 |
Кровотечение в раннем послеоперационном периоде, n (%) | 1 (1,31) | 0 | 0,98 |
Тромбоз в раннем послеоперационном периоде, n (%) | 15 (30) | 34 (70) | 0,01 |
Сокращения: КЭА — каротидная эндартерэктомия, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ТИА — транзиторная ишемическая атака.
Таблица 6
Анализ факторов, ассоциированных со степенью рестеноза
Показатель | P | Beta |
СКФ, мл/мин/1,73 м2 | 0,01 | 0,03 |
Глюкоза, ммоль/л | 0,01 | 0,88 |
ЛСК после операции, см/с | 0,01 | 0,03 |
ИМТ, кг/м2 | 0,03 | 0,14 |
Возраст, лет | 0,03 | 0,04 |
Сокращения: ИМТ — индекс массы тела, ЛСК — линейная скорость кровотока, СКФ — скорость клубочковой фильтрации.
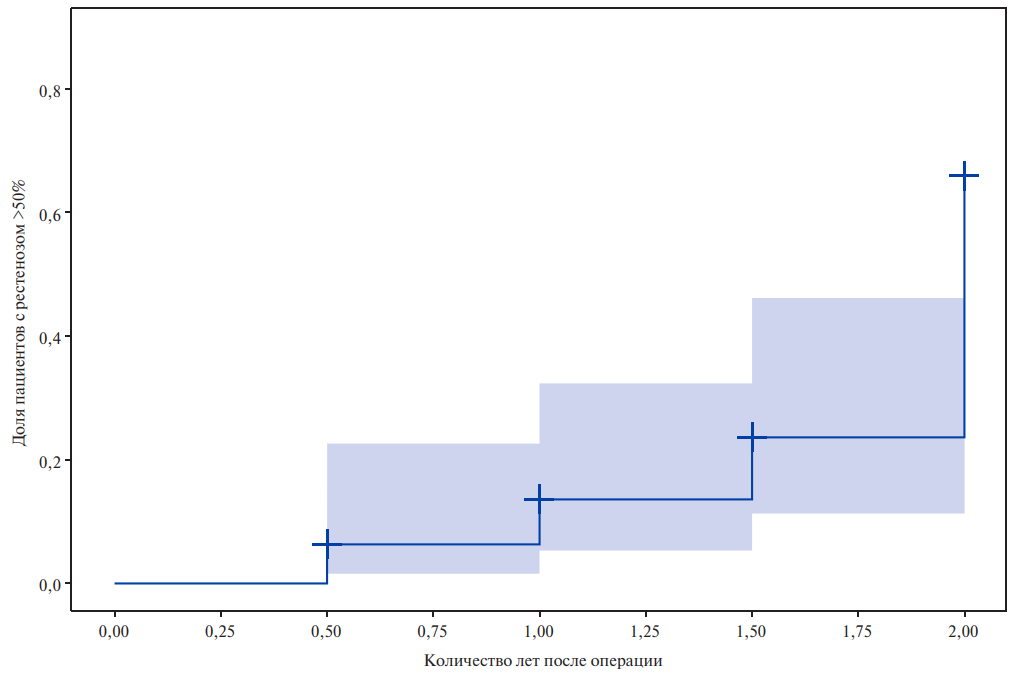
Рис. 1. Кривая развития рестеноза >50% в зависимости от времени наблюдения.
Обсуждение
По результатам нашего исследования рестеноз >50% чаще развивался у мужчин, что может быть связано с большей распространенностью традиционных факторов риска атеросклероза среди мужчин, таких как табакокурение. В ряде работ также была показана прогностическая значимость курения в развитии рестеноза. Так, в рандомизированном клиническом исследовании, посвященном изучению КЭА и стентирования сонных артерий (CREST), курение предсказывало повышенную частоту развития рестеноза после КЭА [12]. Кроме того, в крупном метаанализе было показано, что женский пол и статус курения достоверно связаны с рецидивирующим стенозом после КЭА [13]. Тем не менее, что касается гендерных различий, другие авторы показали противоположные результаты — частота развития рестеноза оказалась выше среди женщин [14][15].
Важно отметить, что развитие рестеноза может быть обусловлено множеством факторов, включая технические особенности операции. Однако мы не выявили таковых ассоциаций с видом оперативного вмешательства (классическая/эверсионная техники), что может быть связано с малым размером выборки. В то же время результаты других проспективных исследований демонстрируют более низкую частоту развития рестеноза после эверсионной КЭА по сравнению с классической техникой [16][17], либо отсутствие таковых различий [18]. Таким образом, вопрос о риске развития рестеноза после различных техник эндартерэктомии остаётся актуальным и требует дальнейших исследований. Безусловно, для сравнения этих методик необходимо проведение исследований на больших когортах, а также учитывать множество факторов, таких как диаметр сосуда, исходное состояние пациента, а также наличие сопутствующих заболеваний.
Основными предикторами рестеноза в нашей работе оказались: дислипидемия, ожирение, гипергликемия и СКФ, а также повышение уровня фибриногена. Снижение СКФ может указывать на наличие хронической болезни почек и является важным предиктором, влияющим на сосудистое здоровье, что находит подтверждение в работах других авторов. Так, при анализе более, чем 1700 пациентов, перенесших эндартерэктомию, было выявлено, что единственным предиктором рестеноза ≥70% оказалось наличие почечной недостаточности. Кроме того, в течение 11-летнего периода наблюдения почечная недостаточность явилась предиктором развития ишемического инсульта [19]. При исследовании факторов риска развития серьезных нежелательных явлений (развитие инсульта, ИМ, смерть) на когорте больных с метаболическим синдромом, перенесших каротидную реваскуляризацию (стентирование и эндартерэктомия), было обнаружено, что у пациентов с метаболическим синдромом вероятность возникновения осложнений была выше, чем у больных без метаболического синдрома (23% vs 14%, P=0,001) [20].
Дислипидемия может способствовать прогрессированию атеросклеротического процесса, который, в свою очередь, увеличивает вероятность рестеноза в послеоперационном периоде. Эндотелиальная дисфункция, обусловленная дислипидемией, нарушает баланс между вазодилатацией и вазоконстрикцией, усугубляя состояние сосудов и повышая вероятность образования тромбов. К сожалению, в настоящее время отсутствуют убедительные данные литературы, посвященные анализу ассоциации дислипидемии и рестеноза.
Следует заметить, что в процессе стандартной предоперационной подготовки мы не проводили оценку уровня С-реактивного белка, что не позволило оценить его предиктивную роль. Тем не менее обнаружение повышенного уровня фибриногена как маркера рестеноза может быть обусловлено тем, что его высокие показатели указывают на активацию гемостаза, что, в свою очередь, повышает вероятность тромбообразования и может свидетельствовать о наличии подострого воспалительного процесса в организме. Выявление фибриногена в числе предикторов развития рестеноза в нашем исследовании согласуется с данными других авторов [21].
Таким образом, выявленные нами предикторы одновременно являются патогенетическими факторами риска развития атеросклероза и других сердечно-сосудистых заболеваний, в связи с чем можно предположить общность механизмов развития атеросклероза сонных артерий и рестеноза после КЭА.
Заключение
Важно отметить, что многогранность факторов, способствующих развитию рестеноза, требует комплексного подхода к диагностике и послеоперационному наблюдению пациентов. Тщательный контроль традиционных факторов риска, таких как АГ, дислипидемия и нарушения углеводного обмена, должен стать приоритетом в послеоперационном ведении.
Данные наблюдения подчеркивают значимость комплексного подхода к оценке риска развития рестеноза у пациентов. Учитывая, что коэффициент атерогенности, уровень глюкозы и СКФ определены как основные предикторы, вероятно, можно рекомендовать их включение в рутинные клинические протоколы для оценки риска развития рестеноза. Наконец, дальнейшие исследования должны сосредоточиться на разработке моделей предсказания развития рестеноза, которые смогут учитывать как традиционные, так и новые факторы риска, включая маркеры воспаления. Кроме того, безусловно, ученым необходимо сосредоточиться на поиске новых биомаркеров, которые позволят более точно прогнозировать риск рестеноза, а также на разработке комплексных программ реабилитации, направленных на снижение общего кардиоваскулярного риска среди пациентов после операции.
Отношения и деятельность. Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2022-301 от 20.04.2022).
Список литературы
1. Heck D, Jost A. Carotid stenosis, stroke, and carotid artery revascularization. Prog Cardiovasc Dis. 2021;65:49-54. doi:10.1016/j.pcad.2021.03.005.
2. Arasu R, Arasu A, Muller J. Carotid artery stenosis: An approach to its diagnosis and management. Aust J Gen Pract. 2021;50(11):821-5. doi:10.31128/AJGP-10-20-5664.
3. Bonati LH, Jansen O, de Borst GJ, Brown MM. Management of atherosclerotic extracranial carotid artery stenosis. Lancet Neurol. 2022;21(3):273-83. doi:10.1016/S1474-4422(21)00359-8.
4. Чернявский М. А., Иртюга О. Б., Янишевский С. Н. и др. Российский консенсус по диагностике и лечению пациентов со стенозом сонных артерий. Российский кардиологический журнал. 2022;27(11):5284. doi:10.15829/1560-4071-2022-5284.
5. Uno M, Takai H, Yagi K, Matsubara S. Surgical Technique for Carotid Endarterectomy: Current Methods and Problems. Neurol Med Chir (Tokyo). 2020;60(9):419-28. doi:10.2176/nmc.ra.2020-0111.
6. AbuRahma AF, Avgerinos ED, Chang RW, et al. Society for Vascular Surgery clinical practice guidelines for management of extracranial cerebrovascular disease. J Vasc Surg. 2022;75(1S):4S-22S. doi:10.1016/j.jvs.2021.04.073.
7. Казанцев А. Н., Виноградов Р. А., Черных К. П. и др. Методы каротидной эндартерэктомии. Российский кардиологический журнал. 2021;26(9):4445. doi:10.15829/1560-4071-2021-4445.
8. Казанцев А. Н., Хубулава Г. Г., Кравчук В. Н. и др. Эволюция каротидной эндартерэктомии. Обзор литературы. Патология кровообращения и кардиохирургия. 2020;24(4):22-32. doi:10.21688/1681-3472-2020-4-22-32.
9. Яриков А. В., Фраерман А.П., Смирнов П.В. и др. Осложнения каротидной эндартерэктомии. Здравоохранение Югры: опыт и инновации. 2022;1(30):43-57.
10. Levey AS, Stevens LA, Schmid CH, et al.; CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150(9):604-12. doi:10.7326/0003-4819-150-9-200905050-00006. Erratum in: Ann Intern Med. 2011;155(6):408.
11. Stein JH, Korcarz CE, Hurst RT, et al.; American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Endorsed by the Society for Vascular Medicine. J Am Soc Echocardiogr. 2008;21(2): 93-111; quiz 189-90. doi:10.1016/j.echo.2007.11.011. Erratum in: J Am Soc Echocardiogr. 2008;21(4):376.
12. Lal BK, Beach KW, Roubin GS, et al.; CREST Investigators. Restenosis after carotid artery stenting and endarterectomy: a secondary analysis of CREST, a randomised controlled trial. Lancet Neurol. 2012;11(9):755-63. doi:10.1016/S1474-4422(12)70159-X.
13. Texakalidis P, Tzoumas A, Giannopoulos S, et al. Risk Factors for Restenosis After Carotid Revascularization: A Meta-Analysis of Hazard Ratios. World Neurosurg. 2019; 125:414-24. doi:10.1016/j.wneu.2019.02.065.
14. den Hartog AG, Algra A, Moll FL, et al. Mechanisms of gender-related outcome differences after carotid endarterectomy. J Vasc Surg. 2010;52(4):1062-71, 1071.e1-6. doi:10.1016/j.jvs.2010.03.068.
15. Pasqui E, de Donato G, Alba G, et al. Early and Long-Term Outcomes of Carotid Stenting and Carotid Endarterectomy in Women. Front Surg. 2021;8:646204. doi:10.3389/fsurg.2021.646204.
16. Белов Ю. В., Казанцев А. Н., Виноградов Р. А. и др. Десятилетние отдаленные результаты классической и эверсионной каротидной эндартерэктомии. Многоцентровое исследование. Российский кардиологический журнал. 2021;26(12):4742. doi:10.15829/1560-4071-2021-4742.
17. Belov YV, Kazantsev AN, Vinogradov RA, et al. Long-term outcomes of eversion and conventional carotid endarterectomy: A multicenter clinical trial. Vascular. 2023;31(4): 717-24. doi:10.1177/17085381221084803.
18. Marsman MS, Wetterslev J, Vriens PWHE, et al. Eversion technique versus traditional carotid endarterectomy with patch angioplasty: a systematic review with metaanalyses and trial sequential analysis. Surg Open Sci. 2023;13:99-110. doi:10.1016/j.sopen.2023.05.003.
19. Avgerinos ED, Chaer RA, Naddaf A, et al. Primary closure after carotid endarterectomy is not inferior to other closure techniques. J Vasc Surg. 2016;64(3):678-83.e1. doi:10.1016/j.jvs.2016.03.415.
20. Protack CD, Bakken AM, Xu J, et al. Metabolic syndrome: A predictor of adverse outcomes after carotid revascularization. J Vasc Surg. 2009;49(5):1172-80. e1; discussion 1180. doi:10.1016/j.jvs.2008.12.011.
21. Tanaskovic S, Radak D, Aleksic N, et al. Scoring system to predict early carotid restenosis after eversion endarterectomy by analysis of inflammatory markers. J Vasc Surg. 2018;68(1):118-27. doi:10.1016/j.jvs.2017.09.054.
Об авторах
Е. П. КолесоваРоссия
к. м. н., в.н. с. НИЛ популяционной генетики НИО генетических рисков и персонифицированной профилактики НЦМУ.
Санкт-Петербург
Конфликт интересов:
нет
Е. В. Верховская
Россия
Клинический ординатор.
Санкт-Петербург
Конфликт интересов:
нет
А. Г. Ванюркин
Россия
м.н.с. НИО сосудистой и интервенционной хирургии, врач сердечно-сосудистый хирург.
Санкт-Петербург
Конфликт интересов:
нет
Е. К. Зайкова
Россия
м.н.с. НИЛ аутоиммунных и аутовоспалительных заболеваний НЦМУ.
Санкт-Петербург
Конфликт интересов:
нет
В. В. Кван
Россия
м.н.с. НИЛ популяционной генетики НИО генетических рисков и персонифицированной профилактики НЦМУ.
Санкт-Петербург
Конфликт интересов:
нет
О. В. Калинина
Россия
к. б. н., профессор кафедры лабораторной медицины и генетики, в. н. с. НИЛ аутоиммунных и аутовоспалительных заболеваний НЦМУ.
Санкт-Петербург
Конфликт интересов:
нет
М. А. Чернявский
Россия
д.м.н., зав. НИО сосудистой и интервенционной хирургии, врач сердечно-сосудистый хирург, доцент кафедры факультетской хирургии с клиникой.
Санкт-Петербург
Конфликт интересов:
нет
А. Л. Маслянский
Россия
д.м.н., руководитель НИЛ ревматологии и иммунопатологии; Санкт-Петербургский Государственный Университет, профессор.
Санкт-Петербург
Конфликт интересов:
нет
А. Н. Яковлев
Россия
к.м.н., зав. НИЛ технологий прогнозирования риска развития сердечно-сосудистых осложнений НИО генетических рисков и персонифицированной профилактики НЦМУ, зав. НИЛ острого коронарного синдрома, доцент кафедры анестезиологии и реаниматологии
Санкт-Петербург
Конфликт интересов:
нет
А. Ю. Бабенко
Россия
д.м.н., зав. НИО генетических рисков и персонифицированной профилактики, зав. НИЛ предиабета и метаболических нарушений НЦМУ, зав. НИЛ диабетологии, профессор кафедры внутренних болезней
Санкт-Петербург
Конфликт интересов:
нет
А. О. Конради
Россия
д.м.н., профессор, академик РАН, зам. генерального директора по научной работе, зав. НИО артериальной гипертензии, зав. кафедрой организации управления и экономики здравоохранения ИМО
Санкт-Петербург
Конфликт интересов:
нет
Е. В. Шляхто
Россия
Президент Российского кардиологического общества, академик РАН, профессор, д.м.н., генеральный директор.
Санкт-Петербург
Конфликт интересов:
нет
Дополнительные файлы
- Развитие рестеноза после проведения каротидной эндартерэктомии является актуальной проблемой.
- Определены наиболее значимые предикторы рестеноза: дислипидемия, повышение массы тела, нарушение углеводного обмена, снижение скорости клубочковой фильтрации, а также исходно повышенный уровень фибриногена.
- Разнообразие факторов, вызывающих рестеноз, требует комплексного подхода к послеоперационному ведению пациентов, что может обеспечить более точное прогнозирование и разработку мер по предотвращению развития данного осложнения.
Рецензия
Для цитирования:
Колесова Е.П., Верховская Е.В., Ванюркин А.Г., Зайкова Е.К., Кван В.В., Калинина О.В., Чернявский М.А., Маслянский А.Л., Яковлев А.Н., Бабенко А.Ю., Конради А.О., Шляхто Е.В. Предикторы развития рестеноза сонной артерии после каротидной эндартерэктомии. Российский кардиологический журнал. 2025;30(2):6139. https://doi.org/10.15829/1560-4071-2025-6139. EDN: QNUZTD
For citation:
Kolesova E.P., Verkhovskaya E.V., Vanyurkin A.G., Zaykova E.K., Kvan V.V., Kalinina O.V., Chernyavsky M.A., Maslyansky A.L., Yakovlev A.N., Babenko A.Yu., Konradi A.O., Shlyakhto E.V. Predictors of carotid artery restenosis after carotid endarterectomy. Russian Journal of Cardiology. 2025;30(2):6139. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6139. EDN: QNUZTD
JATS XML

















































