Перейти к:
Безопасность оральных антикоагулянтов: фокус на церебральные микрокровоизлияния
https://doi.org/10.15829/1560-4071-2025-6132
Аннотация
Сегодня широко используется назначение оральных антикоагулянтов и продолжается изучение безопасности данных препаратов. Ввиду усовершенствования методов диагностики и улучшение силы магнитно-резонансных систем, все чаще стали выявлять церебральные микрокровоизлияния (ЦМК, англ.: cerebral microbleeds, CMBs), которые представляют собой небольшие отложения макрофагов, нагруженные гемосидерином вокруг сосудов головного мозга. Последнее время ЦМК стали рассматривать в качестве предиктора внутричерепного кровоизлияния на фоне приема оральных антикоагулянтов. В связи с чем мы решили обобщить данные, касающиеся безопасности оральных антикоагулянтов в отношении развития ЦМК.
Ключевые слова
Для цитирования:
Черняева М.С., Моисеева Е.А., Погодина А.А., Прохорова .А., Зыкова О.В., Егорова Л.А., Масленникова О.М., Ломакин Н.В., Сычев Д.А. Безопасность оральных антикоагулянтов: фокус на церебральные микрокровоизлияния. Российский кардиологический журнал. 2025;30(6S):6132. https://doi.org/10.15829/1560-4071-2025-6132
For citation:
Chernyaeva M.S., Moiseeva E.A., Pogodina A.A., Prokhorova E.A., Zykova O.V., Egorova L.А., Maslennikova O.M., Lomakin N.V., Sychev D.A. Safety of oral anticoagulants: focus on cerebral microbleeds. Russian Journal of Cardiology. 2025;30(6S):6132. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6132
На сегодняшний день назначение оральных антикоагулянтов (ОАК) встречается все чаще ввиду усовершенствования методов диагностики заболеваний и расширения показаний для их применения [1-4]. Основное патогенетическое действие ОАК направлено на предотвращение тромбоэмболических осложнений, которые встречаются у пациентов с фибрилляцией предсердий (ФП), онкологическими заболеваниями, тромбозом глубоких вен нижних конечностей, а также перенесших операции эндопротезирования крупных суставов [1-3]. У пациентов с ФП ОАК эффективно снижают риск развития ишемического инсульта (ИИ), в связи с чем они рекомендованы в качестве препаратов первой линии в консенсусных рекомендациях [1, 5]. Наряду с положительным эффектом, ОАК повышают риск развития кровотечений, которые можно разделить на большие/фатальные, угрожающие жизни (внутричерепные кровоизлияния (ВЧК), желудочно-кишечные кровотечения и др.), клинически значимые небольшие и малые кровотечения [1][5][6]. В настоящее время для профилактики кровотечений используется шкала HAS-BLED, а также идентификация и устранение модифицируемых факторов риска [1][5][7]. Тем не менее частота больших кровотечений составляет ~4%, причем она повышается с возрастом [8-10].
Одним из угрожающих жизни кровотечений на фоне приема ОАК является ВЧК — кровотечение в паренхиму головного мозга, приводящее к смерти или инвалидизации у 76% больных [7]. Частота случаев ВЧК среди молодого населения снизилась (эту тенденцию связывают с улучшением контроля над артериальной гипертензией (АГ) и усовершенствованием антигипертензивной терапии), тогда как среди пожилого населения частота случаев ВЧК, наоборот, возросла [7]. Объяснением этой тенденции может быть широкое использование ОАК среди пожилого населения и все более часто встречающиеся возрастные заболевания мелких сосудов головного мозга, склонных к кровотечениям, включая церебральную амилоидную ангиопатию (ЦАА) [1][7][11][12]. Таким образом, можно предположить, что маркеры ЦАА, такие как церебральные микрокровоизлияния (ЦМК, англ.: cerebral microbleeds, CMBs), могут лучше предсказывать риск ВЧК у пациентов с ФП на фоне ОАК, а также помогут персонализировать их назначение.
Целью данного обзора является комплексное обобщение современных научных данных, касающихся безопасности ОАК в отношении развития ЦМК. В статье представлены определение и патофизиологические механизмы ЦМК, дифференциальная диагностика и факторы риска развития ЦМК, а также описаны исследования, в которых изучалась взаимосвязь ОАК с развитием ЦМК и влияние ЦМК на различные исходы у пациентов на фоне приема ОАК.
Методология исследования
Методология научного поиска сводилась к анализу результатов исследований по тематике обзора, опубликованных за последние 10 лет, и доступных научных статей на электронном ресурсе поиска Google Scholar, elibrary.ru, КиберЛенинка, PubMed, Embase, Web of Science. Ключевыми словами для поиска были: церебральные микрокровоизлияния (cerebral microbleeds, CMBs), фибрилляция предсердий (atrial fibrillation), оральные антикоагулянты (oral anticoagulants, OAC) и прямые оральные антикоагулянты (direct oral anticoagulants, DOAC).
Определение и патофизиология ЦМК
Гистопатологически ЦМК представляют собой скопления очаговых отложений макрофагов, нагруженных гемосидерином вокруг сосудов головного мозга. Гемосидерин — железосодержащий (оксид железа) продукт распада эритроцитов, который образуется вследствие их внесосудистого разрушении в очагах кровоизлияний, в т. ч. при ЦМК [13], поэтому их можно обнаружить на магнитно-резонансной томографии (МРТ). Гемосидерин придает этим очаговым поражениям парамагнитные свойства, заставляя их терять сигнал из-за восприимчивости [14].
На МРТ ЦМК представляют собой круглые или овальные гипоинтенсивные очаги размером от 2 до 10 мм в последовательности градиентного эха (Gradient-recalled echo, GRE) или в режиме изображения, взвешенном по магнитной восприимчивости (Susceptibility-weighted image, SWI) (рис. 1) [15]. На визуализацию ЦМК на МРТ влияют пространственное разрешение, время эхо-сигнала, напряженность магнитного поля. За предыдущее десятилетие наблюдалось значительное улучшение силы магнитно-резонансных систем, перешедших с 1,5 Тл на 3 Тл и недавний скачок до 7 Тл, что привело к более высокому обнаружению ЦМК. В связи с тем, что увеличивается напряженность магнитного поля МРТ и поперечное сечение становится тоньше, создается изображение с "эффектом цветения", которое превышает количество накопленного железа. Изображение становится лучше визуализируемым, поэтому факт наличия ЦМК можно подтвердить с большей точностью. В клинической практике режим SWI применяется для определения количественной оценки ЦМК, поскольку в предыдущих исследованиях он показал более высокую чувствительность для обнаружения ЦМК, чем GRE [15].
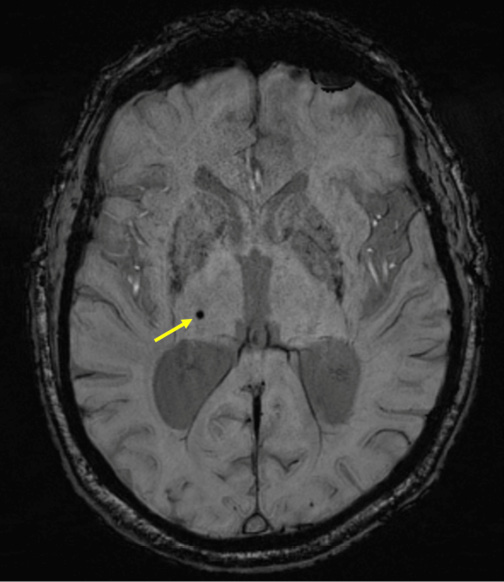
Рис. 1. ЦМК в глубоком отделе головного мозга (гипоталамус) на МРТ в режиме SWI (указывает стрелка).
Для выявления анатомического расположения ЦМК используют визуальную оценку при помощи следующих шкал: анатомическая шкала оценки микрокровоизлияний (microbleed anatomical rating scale, MARS) и шкала оценки внутримозговых кровоизлияний (brain observer micro bleed scale, BOMBS) (рис. 2, 3). Шкала MARS отличается тем, что области мозга разделены на анатомические структуры, тогда как по шкале BOMBS головной мозг условно разделили на поверхностные и глубокие отделы. Определение количества ЦМК должно в обязательном порядке учитывать их анатомическое расположение с использованием шкал визуальной оценки для того, чтобы получить необходимую клинически важную информацию [15]. Считается, что глубокие (в т. ч. инфратенториальные) ЦМК связаны с гипертонической ангиопатией, а поверхностные (лобарные) — с ЦАА [16][17].
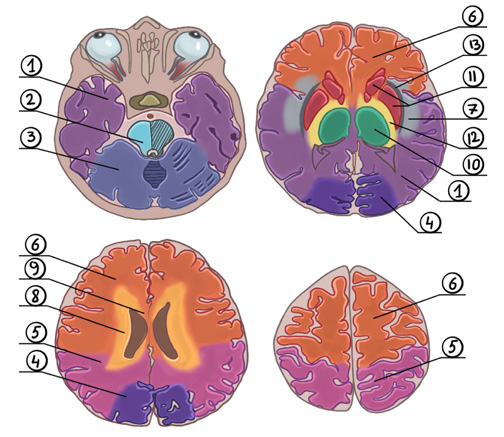
Рис. 2. Визуальная оценка ЦМК: шкала MARS.
Примечание: 1 — височная доля, 2 — ствол мозга, 3 — мозжечок, 4 — затылочная доля, 5 — теменная доля, 6 — лобная доля, 7 — инсула, 8 — глубокое перивентрикулярное белое вещество, 9 — мозолистое тело, 10 — таламус, 11 — базальные ганглии, 12 — внутренняя капсула, 13 — внешняя капсула.
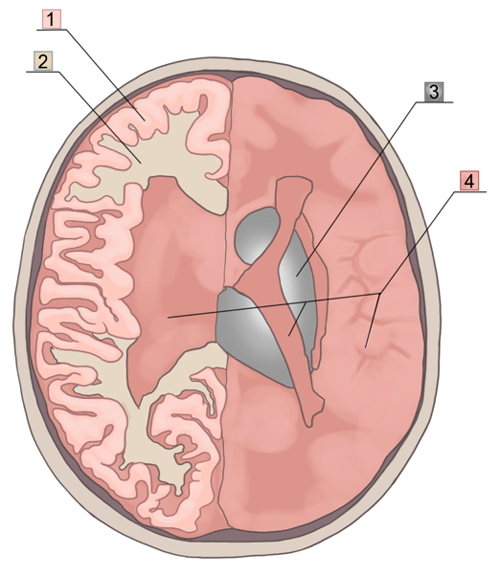
Рис. 3. Визуальная оценка ЦМК: шкала BOMBS.
Примечание: поверхностные отделы головного мозга (лобарные): 1 — кора головного мозга, 2 — подкорковая часть белого вещества головного мозга. Глубокие отделы головного мозга: 3 — хвостатое ядро, чечевицеобразное ядро, таламус, 4 — внутренние и внешние капсулы.
АГ приводит к распространенным структурным и функциональным изменениям сосудистого русла головного мозга, затрагивающим преимущественно мелкие перфорирующие интрацеребральные артерии и артериолы. Причиной избирательного поражения этих сосудов является особенность их архитектоники: отсутствие боковых ветвей, прямолинейный ход, отхождение от артериальных стволов, значительно больших по диаметру, вследствие чего гемодинамическая нагрузка на их стенку выше, чем у других артерий в головном мозгу. В результате повышенного давления возникает фибриноидный некроз, с последующими плазморрагиями в некротизированные участки стенок сосудов. В дальнейшем происходит разрыв некротизированной стенки и возникает кровоизлияние в вещество головного мозга [18]. Высокое артериальное давление приводит к сегментарному сужению мелких артерий и в дальнейшем к гипертрофии гладких мышц в средней оболочке, структурным изменениям в интрапаренхиматозных артериях и артериолах, называемым артериолосклерозом, включая микроаденому, липогиалиноз, и микроаневризму (аневризма Шарко-Бушара) [14]. Наиболее распространенными местами для гипертонической ангиопатии являются базальные ганглии, таламус, мозжечок и мост, мелкие сосуды, склонные к сосудистым повреждениям, вызванным АГ [14].
При ЦАА происходит отложение β-амилоида в средней оболочке и адвентиции сосудистых слоев кортикальных и лептоменингеальных артерий, что приводит к воспалению, окислительному стрессу, нарушению целостности стенки сосуда. Предполагается, что основной патогенез возникновения ЦМК при ЦАА связан с прямой экстравазацией крови из склонных к кровотечениям и пораженных мелких сосудов головного мозга [7][15][19][20]. Другим патогенетическим механизмом является фибриноидная дегенерация в средней оболочке и интиме сосуда вследствие накопления патологических белков, что приводит к образованию микроаневризм [14].
У пожилых людей ЦAA и гипертоническая ангиопатия могут сосуществовать, что приводит к возникновению смешанной локализации ЦМК: глубокой/инфратенториальной и лобарной, что представляет собой проблему для своевременной диагностики [14].
Другие механизмы возникновения ЦМК связаны с ангиофагией, которая представляет собой процесс захвата эмболов эндотелием и перемещение его через стенку микрососуда. Эндотелиальные ламеллоподии (выросты ламеллярной формы) окружают эмболы в течение нескольких часов после окклюзии сосуда. В последующие дни эмболы полностью поглощаются эндотелием и экстравазируются в периваскулярное пространство, что приводит к реканализации сосудов и восстановлению кровотока (рис. 4). Очищение от микроэмболов посредством ангиофагии — вспомогательный механизм сохранения тканевой перфузии головного мозга [21][22].
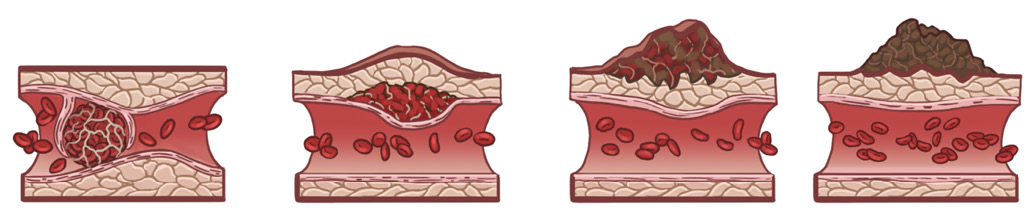
Рис. 4. Процесс ангиофагии.
Изменение гемостаза на фоне приема ОАК в сочетание с нарушением структуры и функции сосудистого русла в головном мозге, вследствие вышеуказанных механизмов, может повышать риск развития ЦМК.
Дифференциальная диагностика ЦМК
Патологии, при которых встречаются ЦМК, можно классифицировать по широким категориям (табл. 1) [14][23]. Самая большая категория, особенно, в старшей возрастной группе — это спорадические заболевания мелких сосудов, основными причинами которой являются ЦАА и гипертоническая ангиопатия. Нейродегенеративные заболевания все чаще диагностируются благодаря значительному росту наших знаний о молекулярных маркерах заболеваний.
Таблица 1
Состояния, ассоциированные с ЦМК
|
№ |
Категория |
Заболевание |
|
1 |
Спорадические заболевания мелких церебральных сосудов, включая нейродегенеративные состояния |
• Спорадическая церебральная амилоидная ангиопатия • Гипертоническая ангиопатия |
|
2 |
Заболевания мелких церебральных сосудов, связанные с воспалительными, иммунологически опосредованными и гематологическими нарушениями |
• Церебральные микрокровоизлияния, связанные с критическими заболеваниями • Системная красная волчанка • Серповидно-клеточная анемия • Лейкоз, лимфома • Синдром диссеминированного внутрисосудистого свертывания • Аутоиммунная тромбоцитопения • Инфекция H1N1 (Hemagglutinin 1, neuraminidase 1 — свиной грипп) |
|
3 |
Наследственные или генетические заболевание мелких церебральных сосудов |
• CADASIL (Сerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy, Церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией) • CARASIL (Cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy, Церебральная аутосомно-рецессивная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией) • Болезнь Фабри |
|
4 |
Другие |
• Черепно-мозговая травма • Инфекционный эндокардит • Миксома предсердия • Болезнь моямоя • PRES (Posterior reversible encephalopathy syndrome, синдром задней обратимой энцефалопатии) • Хроническая болезнь почек • Последствия лучевой терапии |
Факторы риска развития ЦМК
К значимым факторам риска развития ЦМК относят возраст, АГ и ЦАА [1][9]. Кроме того, в ряде исследований было показано, что прием ОАК или антитромботической терапии может спровоцировать возникновение ЦМК. Так, в одноцентровом когортном исследовании Horstmann S, et al. [24] было показано, что прием ОАК был ассоциирован с наличием ЦМК, причем в лобарной или смешанной локализации, а также с наличием >10 ЦМК (10,9% vs 3,1%, р=0,01). В популяционном Роттердамском исследовании Akoudad S, et al. [25] у пациентов, принимавших варфарин, была более высокая частота глубоких или инфратенториальных ЦМК по сравнению с пациентами, которые никогда не принимали варфарин (отношение рисков (ОР) 1,70, 95% доверительный интервал (ДИ): 1,24-2,34), что было подтверждено в post-hoc анализе — для глубоких/инфратенториальных ЦМК ОР 1,66, 95% ДИ: 1,06-2,60; для смешанных ЦМК ОР 1,71, 95% ДИ: 1,14-2,58. В систематическом обзоре Lovelock C, et al. [7] ЦМК встречались чаще у пациентов, принимавших варфарин (отношение шансов (ОШ) 2,7, 95% ДИ: 1,6-4,4; р<0,001), и у пациентов, принимавших антиагрегантную терапию (ААТ) (ОШ 1,7, 95% ДИ: 1,3-2,3; р<0,001), по сравнению с пациентами, которые их не принимали. В метаанализе Qiu J, et al. [26] ЦМК чаще встречались у лиц, принимавших ААТ, чем у тех, кто не принимал ААТ 31,8% vs 23,1% (ОШ 1,21, 95% ДИ: 1,07-1,36; I²=51,7%; р=0,002), причем в большей степени в лобарной локализации ОШ 1,45 (95% ДИ: 1,15-1,84; I²=0,0%; р=0,002), но не в глубокой/инфратенториальной — ОШ 1,37 (95% ДИ: 0,98-1,90; I²=77,7%; р=0,062).
Интересно, что для варфарина, в сравнении с прямыми оральными антикоагулянтами (ПОАК), связь с ЦМК была более явной. В проспективном когортном исследовании Umemura T, et al. [16] было показано, что прием варфарина (по сравнению с использованием ПОАК) ассоциирован с появлением новых ЦМК (ОШ 3,38, 95% ДИ: 1,02-11,42). А метаанализ Cheng Y, et al. [27] показал, что прием ОАК был связан с повышенным риском распространенности ЦМК (ОШ 1,54, 95% ДИ: 1,26-1,88; I²=40%), причем в большей степени в лобарной локализации 1,68 (95% ДИ: 1,22-2,32; I²=24%), но не глубокой или инфратенториальной — ОШ 1,50 (95% ДИ: 0,89-2,55, I²=79%). В 17 исследованиях (n=10727) была обнаружена связь между использованием варфарина и распространенностью ЦМК (ОШ 1,64, 95% ДИ: 1,23-2,18; I²=41%), тогда как в трех исследованиях (n=521), посвященных влиянию ПОАК, авторы не обнаружили никакой связи с использованием ПОАК и распространенностью ЦМК (OР 0,82, 95% ДИ: 0,51-1,33; I²=0%).
В таблице 2 представлены известные факторы риска ЦМК [7][15][16][24][25][28-38], с учетом выборки, в которой проводилось исследование, а также с указанием влияния фактора риска на локализацию ЦМК (все, лобарные или глубокие) или на их количество.
Таблица 2
Факторы риска развития ЦМК
|
Факторы риска |
Выборка |
Примечание |
|
Пожилой возраст |
общая популяция, ФП без инсульта, ИИ и ТИА, ВЧК |
все [7][15][16], количество ЦМК [15] |
|
Артериальная гипертензия (и поражение органов-мишеней) |
общая популяция, ФП без инсульта, ИИ и ТИА, ВЧК |
глубокие [7][15][28][29] |
|
Диастолическое артериальное давление |
ФП без инсульта |
лобарные [7] |
|
Факторы сердечно-сосудистого риска |
ФП без инсульта |
глубокие [7] |
|
Курение |
общая популяция |
все [15] |
|
Шкала CHADS2 |
ФП без инсульта, ФП и ИИ |
все [16] |
|
Гиперхолестеринемия |
общая популяция |
данные противоречивы [15] |
|
Гипохолестеринемия, гипотриглицеридемия, сниженный уровень липопротеидов низкой плотности |
общая популяция, ИИ и ТИА, ВЧК |
все [30] |
|
Сниженный уровень липопротеидов высокой плотности |
общая популяция, ИИ и ТИА, ВЧК |
глубокие [30] |
|
Сахарный диабет |
общая популяция, ИИ и ТИА |
все [15, 28] |
|
Обструктивное апноэ во сне |
ФП без инсульта |
все [16] |
|
Инсульт в анамнезе |
ИИ и ТИА, ВЧК |
все [7][29] |
|
Предшествующее ВЧК |
общая популяция, ФП и ИИ, ВЧК |
все [31][32], количество ЦМК [33] |
|
Лакунарый инфаркт |
общая популяция, ФП без инсульта, ИИ и ТИА, ВЧК |
глубокие [7], количество ЦМК [15] |
|
Хроническая болезнь почек |
общая популяция |
глубокие [15], все [34] |
|
Протеинурия |
общая популяция |
все [34] |
|
Цистатин С |
общая популяция |
глубокие [15], все [34] |
|
Матриксная металлопротеиназа, тканевой ингибитор матриксной металлопротеиназы, интерлейкин-8 |
ФП на фоне приема ОАК |
все [35] |
|
Атрофия головного мозга |
общая популяция |
лобарные [15] |
|
Гиперинтенсивность белого вещества |
общая популяция, ФП без инсульта, ФП и ИИ, ИИ и ТИА |
глубокие и лобарные [7], все [16][29], количество ЦМК [15] |
|
Лейкоареоз |
ИИ и ТИА, ВЧК |
все [7][28][33] |
|
Снижением мозгового кровотока в состоянии покоя, особенно в лобной, теменной и предклинной коре |
общая популяция |
лобарные [22] |
|
Церебральная амилоидная ангиопатия, ассоциированная с аполипопротеином е4 |
общая популяция, ФП без инсульта, ИИ и ТИА |
лобарные [7][15], количество ЦМК [15] |
|
Исходные ЦМК |
ФП без инсульта, ФП и ИИ, ИИ и ТИА, ВЧК |
все [16], количество ЦМК [7][25] |
|
≥5 ЦМК |
общая популяция, ФП и ИИ, ИИ и ТИА, ВЧК |
количество ЦМК [15][33][36] |
|
Атеросклероз крупных артерий, стеноз >50%, толщина комплекса интима медиа |
общая популяция |
все [37] |
|
Применение антитромботической или ОАК |
общая популяция, ФП без инсульта, ФП и ИИ, ИИ и ТИА, ВЧК |
варфарин — лобарные [27], глубокие [25], все [24]: количество ЦМК [27]; ОАК — лобарные [16][26] |
|
Статины |
общая популяция, ИИ и ТИА, ВЧК |
все [15], лобарные [30][38] |
Сокращения: ВЧК — внутричерепное кровоизлияние, ИИ — ишемический инсульт, ОАК — оральные антикоагулянты, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий, ЦМК — церебральные микрокровоизлияния.
Распространенность ЦМК и их влияние на клинические исходы у пациентов на фоне приема ОАК
Распространенность ЦМК на фоне приема ОАК у пациентов с ФП варьирует от 17,1% до 30% [16][32][35][39], а у пациентов с ФП и ИИ на фоне приема ОАК — от 21% до 25% [40][41], с наибольшими значениями по данным метаанализов [42-44] (табл. 3).
Таблица 3
Распространенность ЦМК и их влияние на клинические исходы у пациентов на фоне приема ОАК
|
Исследование |
Тип выборки |
Количество пациентов/когорт |
Возраст (лет) |
Исходы |
|
CROMIS-2, 2018, наблюдательное [40] |
ФП и ИИ или ТИА на фоне ОАК (ПОАК — 37%, АВК — 62%) |
1447 |
76±10 |
Распространенность ЦМК: 21%, из них лобарные ЦМК — 37,3%, глубокие ЦМК — 38,6%, смешанные ЦМК — 24,1%; ВЧК: ОР 3,67 (95% ДИ: 1,27-10,60), причем для 1 ЦМК ОР 2,03 (95% ДИ: 0,42-9,83), для ≥2 ЦМК — ОР 5,46 (95% ДИ: 1,70-17,51); ИИ: ОР 1,53 (95% ДИ: 0,85-2,76), причем для 1 ЦМК ОР 1,75 (95% ДИ: 0,84-3,65), для ≥2 ЦМК — ОР 1,32 (95% ДИ: 0,60-2,93) |
|
Badi M, 2019, когортное [46] |
ФП и МРТ-признаками минимум 1 ЦМК на фоне ОАК (41,6% — АВК, 28,6% — ПОАК и 29,9% — ни один из ОАК) |
308 |
76 [ 31,8-96,4] лет |
Распространенность ЦМК: ≥5 ЦМК 32,5%; лобарные ЦМК — 84%, глубокие ЦМК — 26,9%, инфратенториальные ЦМК — 47,7%; Общая смертность: ОР 1,23 (95% ДИ: 0,79-1,90), р=0,36 |
|
Choi HH, 2020, когортное [41] |
ФП и острым ИИ в анамнезе на фоне ОАК (ПОАК 31,6%, АВК 68,4%) |
1742 |
72,6±9,7 |
Распространенность ЦМК: 22,6%, из них 1 ЦМК — 10,7%, от 2 до 4 ЦМК — 8,6%, ≥5 ЦМК — 3,2%; лобарные ЦМК — 56,7%, глубокие ЦМК — 21,1%, смешанные ЦМК — 22,1%; ВЧК: для АВК — ОР 6,05 (95% ДИ: 1,7-21,45), p=0,005; но не для ПОАК — ОР 3,26 (95% ДИ: 0,38-27,42), p=0,276. Для лобарных ЦМК — ОР 6,11 (95% ДИ: 2,07-18,03); но не для глубоких или смешанных ЦМК — ОР 2,51 (95% ДИ: 0,51-12,34); ИИ: для АВК — ОР 2,05 (95% ДИ: 1,08-3,86), p=0,026; но не для ПОАК — ОР 1,16 (95% ДИ: 0,36-3,66), p=0,799; Для лобарных ЦМК — ОР 1,56 (95% ДИ: 0,8-3,06); но не для глубоких или смешанных ЦМК — ОР 1,93 (95% ДИ: 0,96-3,89); Общая смертность: не для АВК (ОР 2,05 (95% ДИ: 0,96-4,38), р=0,061) и не для ПОАК (ОР 2,99 (95% ДИ: 0,27-32,04), p=0,365); Комбинированный исход: MACCE для АВК — ОР 2,12 (95% ДИ: 1,32-3,43), p=0,002; но не для ПОАК риск MACCE не повышался ОР 1,42 (95% ДИ: 0,49-4,10), p=0,517; МАССЕ для лобарных ЦМК ОР 1,92 (95% ДИ: 1,15-3,22), глубокие или смешанные ЦМК ОР 1,84 (95% ДИ: 1,04-3,25) |
|
Umemura T, 2020, наблюдательное [16] |
ФП на фоне ОАК (ПОАК — 55,5%, АВК — 44,4%) |
81 |
73,2±8,2 |
Распространенность ЦМК: 23,5%; из них глубокие ЦМК — 31,6%, лобарные ЦМК — 42,1%, смешанные ЦМК — 26,3%; 1 ЦМК — 16%, ≥2 ЦМК — 7,4%; Новые ЦМК появились у 22,2%, из них глубокие ЦМК — 11,1%, лобарные ЦМК — 66,7%, смешанные ЦМК — 22,2%; Среди новых — 1 ЦМК — 13,6%, ≥2 ЦМК — 21% |
|
Wagner, 2022, когортное [39] |
ФП на фоне ОАК (ПОАК — 75%, АВК — 25%) |
310 |
78,1±9,2 |
Распространенность ЦМК: 28%; ВЧК: с ЦМК — 4,7%, без ЦМК — 1,3%; ИИ: с ЦМК 11,6%, без ЦМК 4,9%; Общая смертность: с ЦМК 20,9%, без ЦМК — 12,3%; Комбинированный исход: (ВЧК, ИИ и смерть): с ЦМК 37,2%, без ЦМК — 19,6%; ОР 2,629 (95% ДИ: 1,616-4,277); р<0,001 |
|
Das AS, 2022, когортное [32] |
ФП или ВЧК на фоне ПОАК |
180 |
76±11 |
Распространенность ЦМК: 28,3%; ВЧК: ОШ 4,07 (95% ДИ: 1,45-11,39) |
|
Strat-AF study Alfano F, 2023, когортное [35] |
ФП на фоне ОАК (ПОАК — 69,4%, АВК — 30,6%) |
170 |
77,7±6,8 |
Распространенность ЦМК: 17,1% |
|
Charidimou A, 2017, метаанализ [42] |
ФП на фоне ОАК (5 исследований — только АВК, 4 — смешанная терапия АВК и ПОАК) |
1552/9 |
от 67 до 80 |
Распространенность ЦМК: 30% (95% ДИ: 25-36), ≥5 ЦМК — 7% (95% ДИ: 4-10); ВЧК: для всех ЦМК — ОШ 2,68 (95% ДИ: 1,19-6,01), при этом для <5 ЦМК ОШ 1,9 (ДИ: 0,76-4,71), р=0,168, а для ≥5 ЦМК — ОШ 5,50 (95% ДИ: 2,07-14,66). При лобарной ЦМК — ОШ 2,88 (95% ДИ: 1,14-7,23), p=0,025, и смешанной ЦМК — ОШ 2,91 (95% ДИ: 0,99-8,54), p=0,052; Но не для глубокой ЦМК — OШ 2,43 (95% ДИ: 0,83-7,14), p=0,107; ИИ: для <5 ЦМК — ОШ 0,02 (95% ДИ: 0-0,36), для ≥5 ЦМК — ОШ 0,29 (95% ДИ: 0-2,77) |
|
Charidimou A, 2017, метаанализ [43] |
ФП и ИИ на ОАК (3 исследования — АВК; 1 исследование — ПОАК (24%) + варфарин (64%) + переход с ПОАК на варфарин и обратно (12%) |
990/4 |
от 69 до 80 |
Распространенность ЦМК: 25% (95% ДИ: 17-33%) |
|
Исследование |
Тип выборки |
Количество пациентов/когорт |
Возраст (лет) |
Исходы |
|
Liang Y, 2018, метаанализ [31] |
ИИ на ОАК (в 3 исследованиях АВК, в 2 — как ПОАК, так и АВК, в 2 — нд о типе ОАК) |
2034/7 |
нд |
ВЧК: с ЦМК 3,6%, без ЦМК 0,8%, ОШ 4,01 (95% ДИ: 1,82-8,81); р=0,001 |
|
Cheng Y, 2021, метаанализ [27] |
На фоне ОАК: 25 исследований — ТИА/ИИ, 10 — с ФП без ИИ, в 7 — с ВЧК, в 1 — смешанные ИИ, ВЧК И ТИА. В 15 исследованиях — АВК; в 1 — ПОАК, в 4 — как ПОАК, так и АВК, в 16 — нд о типе ОАК |
25245/47 |
от 59,7±8,1 до 76,2±10,6 |
ВЧК: ОШ 3,91 (95% ДИ: 2,18-7,01) |
|
Corica B, 2022, метаанализ [44] |
ФП, часть из которых принимали ОАК (нд о типе ОАК) |
6978/17 |
от 65,5 до 80,2 |
Распространенность ЦМК: 28,3% (95% ДИ: 12,2-52,9); ВЧК: ОШ 3,04 (95% ДИ: 1,83-5,06); ИИ: ОШ 1,78 (95% ДИ: 1,26-2,49) |
|
Zeng Z, 2023, метаанализ [45] |
На фоне ПОАК: в 4 исследованиях — с ИИ, 3 — с ФП, 5 — с ФП и ИИ, 2 — с ЧМТ, 1 — с венозной тромбоэмболией |
нд/20 |
от 60 до 80 |
ВЧК: ОШ 8,52; 95% ДИ: 1,46-49,65; I²=66%; p=0,02 |
Сокращения: АВК — антагонист витамина К, ВЧК — внутричерепное кровоизлияние, ДИ — доверительный интервал, ИИ — ишемический инсульт, Ме — медиана, МРТ — магнитно-резонансная томография, ОАК — оральные антикоагулянты, ОР — отношение рисков, ОШ — отношение шансов, ПОАК — прямые оральные антикоагулянты, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий, ЦМК — церебральные микрокровоизлияния, ЧМТ — черепно-мозговая травма, CROMIS-2 — Clinical Relevance of Microbleeds in Stroke, Клиническая значимость микрокровотечений при инсульте, MACCE — major adverse cerebrovascular and cardiovascular events, основные неблагоприятные цереброваскулярные и сердечно-сосудистые события: сочетание острого инсульта головного мозга, острого инфаркта миокарда, сосудистой смерти, Strat-AF study — Stratification of cerebral bleeding risk in atrial fibrillation, Стратификация риска церебральных микрокровоизлияний при фибрилляции предсердий.
Как в клинических исследованиях, так и в метаанализах было показано, что у пациентов на фоне приема ОАК наличие ЦМК влияет на развитие ВЧК [27][31][32][39-42][45]. Также риск ВЧК увеличивается по мере увеличения количества ЦМК [40][42] и при строго лобарном их расположении [41][42]. Причем по результатам одного когортного исследования [41] у пациентов на фоне приема ПОАК наличие ЦМК не повышало риск развития ВЧК, в отличие от группы антагонистов витамина К, однако в недавнем метаанализе [45] было выявлено, что ЦМК на фоне ПОАК могут быть связаны с развитием ВЧК, но с доказательством низкого качества по шкале GRADE (The Grades of Recommendation, Assessment, Development and Evaluation; Система классификации, оценки, разработки и экспертизы рекомендаций) (табл. 3).
Также наличие ЦМК влияет на развитие ИИ и комбинированные исходы [39][41], хоть и в меньшей степени, чем на ВЧК, тогда как влияние наличия ЦМК на общую смертность остается противоречивым [39][41][46] (табл. 3).
Помимо того, что наличие ЦМК повышает риск развития ВЧК, ИИ и комбинированных исходов, их наличие может приводить к другим исходам. Так, для пациентов, об антикоагулянтном статусе которых данные отсутствовали, ЦМК были ассоциированы со снижением когнитивных функций [47-49], увеличением объемов серого и белого вещества и толщины коры головного мозга [50], а также с плохим функциональным исходом по шкале Рэнкин [51-54]. Роль ЦМК в развитии болезни Альцгеймера у пациентов с болезнью церебральных мелких сосудов головного мозга в исследованиях не доказана [55][56]. Что касается влияния ЦМК на деменцию (любого подтипа), данные остаются противоречивыми для выборки пациентов с болезнью церебральных мелких сосудов [55] и пациентов с различным когнитивным статусом [57].
Заключение
По данным обзора литературы показано, что ЦМК представляют собой небольшие скопления отложений макрофагов нагруженных гемосидерином, поэтому их можно обнаружить на МРТ. Важно определять не только анатомическое расположение ЦМК, но также количество и глубину их залегания, что отражено в специальных шкалах MARS и BOMBS. Считается, что у пациентов на фоне приема ОАК поверхностные (лобарные) ЦМК и увеличение их количества ассоциированы с повышением риска ВЧК почти в 6 раз. Также ЦМК ассоциированы с повышенным риском ИИ и комбинированных исходов, однако в меньшей степени. К значимым факторам риска развития ЦМК относят возраст, АГ и ЦАА. В то же время была показана связь между приемом ОАК и возникновением ЦМК, в результате изменения гемостаза в сочетании с нарушением структуры и функции сосудистого русла в головном мозге. Рядом авторов было установлено, что прием ОАК, главным образом антагонистов витамина К, может быть связан с возникновением новых очагов ЦМК. Также есть исследования, которые показывают связь между приемом ПОАК и возникновением ЦМК. Частота встречаемости ЦМК у пациентов на фоне приема ОАК достигает 30% и увеличивается с возрастом.
Полученные нами результаты представляют интерес для кардиологов, неврологов, терапевтов, гериатров, которым необходимо уделить внимание в плане настороженности относительно выявления ЦМК у пациентов на фоне приема ОАК. Одновременно с этим, наша статья будет актуальной для врачей лучевой диагностики в вопросе расшифровки и описании ЦМК для клиницистов.
На сегодняшний день не существует четких алгоритмов ведения пациентов с ЦМК на фоне приема ОАК, в связи с чем перспективным направлением изучения безопасности приема ОАК было бы проведение дальнейших исследований в этой области. Важно, чтобы эти исследования включали в себя не только изучение распространенности, анатомическое расположение, факторы риска ЦМК и их влияние на различные исходы, но и сделать акцент на изучение пациентов на фоне приема ПОАК, т. к. ПОАК в настоящий момент используются в большей степени, чем антагонисты витамина К, а также разработать четкий алгоритм ведения пациентов с ЦМК на фоне приема ОАК.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. doi:10.15829/1560-4071-2021-4594.
2. Лобастов К. В., Счастливцев И. В. Актуальный статус прямых оральных антикоагулянтов при лечении венозных тромбоэмболических осложнений у онкологических больных. Рациональная Фармакотерапия в Кардиологии. 2020;16(2):286-95. doi:10.20996/1819-6446-2020-04-10.
3. Божкова С. А., Новокшонова А. А., Дроздова П. В. Аспекты практического применения прямых оральных антикоагулянтов в стационаре травматолого-ортопедического профиля. Хирургия. Журнал им. Н. И. Пирогова. 2014; (11):48-54.
4. Праскурничий Е. А., Морозова О. И. Клинический статус и бремя фибрилляции предсердий у лиц с ожирением: оценка эффектов реализации программ по контролю массы тела. Вестник современной клинической медицины. 2021;14(4):15-26. doi:10.20969/VSKM.2021.14(4).15-26.
5. Hindricks G., Potpara T., Dagres N. и др. Рекомендации ESC 2020 по диагностике и лечению пациентов с фибрилляцией предсердий, разработанные совместно с европейской ассоциацией кардиоторакальной хирургии (EACTS). Российский кардиологический журнал. 2021;26(9):4701. doi:10.15829/1560-4071-2021-4701.
6. Сычев Д. А., Черняева М. С., Рожкова М. А. и др. Безопасность прямых оральных антикоагулянтов в лечении фибрилляции предсердий у гериатрических пациентов: фокус на клинически значимые небольшие кровотечения. Фарматека. 2024;31(4):8-23. doi:10.18565/pharmateca.2024.4.8-23.
7. Wilson D, Jäger HR, Werring DJ. Anticoagulation for Atrial Fibrillation in Patients with Cerebral Microbleeds. Curr Atheroscler Rep. 2015;17(8):47. doi:10.1007/s11883-015-0524-7.
8. Yamashita T, Suzuki S, Inoue H, et al. Two-year outcomes of more than 30 000 elderly patients with atrial fibrillation: results from the All Nippon AF In the Elderly (ANAFIE) Registry. Eur Heart J Qual Care Clin Outcomes. 2022;8(2):202-13. doi:10.1093/ehjqcco/qcab025.
9. Patti G, Lucerna M, Pecen L, et al. Thromboembolic Risk, Bleeding Outcomes and Effect of Different Antithrombotic Strategies in Very Elderly Patients With Atrial Fibrillation: A Sub-Analysis From the PREFER in AF (PREventionoF Thromboembolic Events-European Registry in Atrial Fibrillation). J Am Heart Assoc. 2017;6(7):e005657. doi:10.1161/JAHA.117.005657.
10. Halvorsen S, Atar D, Yang H, et al. Efficacy and safety of apixaban compared with warfarin according to age for stroke prevention in atrial fibrillation: observations from the ARISTOTLE trial. Eur Heart J. 2014;35(28):1864-72. doi:10.1093/eurheartj/ehu046.
11. Корнилова А. А., Лагода О. В., Танашян М. М. Церебральная амилоидная ангиопатия в сочетании с пароксизмальной формой фибрилляции предсердий. Российский неврологический журнал. 2020;25(4):31-7. doi:10.30629/2658-7947-2020-25-4-31-37.
12. Новосадова О. А., Семенова Т. Н., Григорьева В. Н. Церебральнаяа амилоидная ангиопатия, коморбидная с фибрилляцией предсердий. Журнал неврологии и психиатрии им. С. С. Корсакова. 2021;121(3-2):46-52. doi:10.17116/jnevro202112103246.
13. Сеитова Р. Р. Значение микроскопических морфологических признаков резорбции кровоизлияний в диагностике давности повреждений мягких тканей и внутренних органов. Судебная медицина. 2019;5(S1):85-6.
14. Agarwal A, Ajmera P, Sharma P, et al. Cerebral microbleeds: Causes, clinical relevance, and imaging approach — A narrative review. J Neurosci Rural Pract. 2024;15(2):169-81. doi:10.25259/JNRP_351_2023.
15. Lee J, Song E, Oh E, et al. Characteristics of Сerebral Microbleeds. Neurocognition disorder in dementia. 2018;17(3):73-82. doi:10.12779/dnd.2018.17.3.73.
16. Umemura T, Mashita S, Kawamura T. Oral anticoagulant use and the development of new cerebral microbleeds in cardioembolic stroke patients with atrial fibrillation. PLoS One. 2020;15(9):e0238456. doi:10.1371/journal.pone.0238456.
17. Новосадова О. А., Кулеш А. А., Григорьева В. Н. Диагностика церебральной амилоидной ангиопатии: на пути к Бостонским критериям 2.0. Российский неврологический журнал. 2020;25(5):4-13. doi:10.30629/2658-7947-2020-25-5-4-13.
18. Гулевская Т. С., Ануфриев П. Л., Евдокименко А. Н. Современное состояние проблемы церебральной микроангиопатии при артериальной гипертензии. Архив патологии. 2021;83(6):45-53. doi:10.17116/patol20218306145.
19. Мхитарян Э. А., Фатеева В. В., Камчатнов П. Р. Церебральная амилоидная ангиопатия. Журнал неврологии и психиатрии им. С. С. Корсакова. 2024;124(2):85-90. doi:10.17116/jnevro202412402185.
20. Кулеш А. А., Дробаха В. Е., Шестаков В. В. Геморрагические проявления церебральной амилоидной ангиопатии — от патогенеза к клиническому значению Неврология, нейропсихиатрия, психосоматика. 2018;10(3):4-11. doi:10.14412/2074-2711-2018-3-4-11.
21. Grutzendler J, Murikinati S, Hiner B, et al. Angiophagy prevents early embolus washout but recanalizes microvessels through embolus extravasation. Sci Transl Med. 2014; 6(226):226ra31. doi:10.1126/scitranslmed.3006585.
22. van der Wijk AE, Georgakopoulou T, Majolée J, et al. Microembolus clearance through angiophagy is an auxiliary mechanism preserving tissue perfusion in the rat brain. Acta Neuropathol Commun. 2020;8(1):195. doi:10.1186/s40478-020-01071-9.
23. Полякова Т. А., Левин О. С. Церебральные микрокровоизлияния при цереброваскулярных и нейродегенеративных заболеваниях с когнитивными нарушениями. Журнал неврологии и психиатрии им. С. С. Корсакова. 2016;116(6-2):19-27. doi:10.17116/jnevro20161166219-27.
24. Horstmann S, Möhlenbruch M, Wegele C, et al. Prevalence of atrial fibrillation and association of previous antithrombotic treatment in patients with cerebral microbleeds. Eur J Neurol. 2015;22(10):1355-62. doi:10.1111/ene.12608.
25. Akoudad S, Darweesh SK, Leening MJ, et al. Use of coumarin anticoagulants and cerebral microbleeds in the general population. Stroke. 2014;45(11):3436-9. doi:10.1161/STROKEAHA.114.007112.
26. Qiu J, Ye H, Wang J, et al. Antiplatelet Therapy, Cerebral Microbleeds, and Intracerebral Hemorrhage: A Meta-Analysis. Stroke. 2018;49(7):1751-4. doi:10.1161/STROKEAHA.118.021789.
27. Cheng Y, Wang Y, Song Q, et al. Use of anticoagulant therapy and cerebral microbleeds: a systematic review and meta-analysis. J Neurol. 2021;268(5):1666-79. doi:10.1007/s00415-019-09572-x.
28. Cai J, Fu J, Yan S, et al. Clinical Outcome in Acute Ischemic Stroke Patients With Microbleeds After Thrombolytic Therapy: A Meta-Analysis. Medicine (Baltimore). 2015; 94(52):e2379. doi:10.1097/MD.0000000000002379.
29. Wang DN, Hou XW, Yang BW, et al. Quantity of Cerebral Microbleeds, Antiplatelet Therapy, and Intracerebral Hemorrhage Outcomes: A Systematic Review and Meta-analysis. J Stroke Cerebrovasc Dis. 2015;24(12):2728-37. doi:10.1016/j.jstrokecerebrovasdis.2015.08.003.
30. Feng X, Tang Q, Cheng C, et al. Low serum lipid levels, use of statin and cerebral microbleeds: A systematic review and meta-analysis. J Clin Neurosci. 2021;94:216-25. doi:10.1016/j.jocn.2021.10.032.
31. Liang Y, Song Q, Jiao Y, et al. Cerebral Microbleeds and the Safety of Anticoagulation in Ischemic Stroke Patients: A Systematic Review and Meta-Analysis. Clin Neuropharmacol. 2018;41(6):202-9. doi:10.1097/WNF.0000000000000306.
32. Das AS, Gökçal E, Regenhardt RW, et al. Clinical and neuroimaging risk factors associated with the development of intracerebral hemorrhage while taking direct oral anticoagulants. J Neurol. 2022;269(12):6589-96. doi:10.1007/s00415-022-11333-2.
33. Charidimou A, Imaizumi T, Moulin S, et al. Brain hemorrhage recurrence, small vessel disease type, and cerebral microbleeds: A meta-analysis. Neurology. 2017;89(8): 820-9. doi:10.1212/WNL.0000000000004259.
34. Makin SD, Cook FA, Dennis MS, et al. Cerebral small vessel disease and renal function: systematic review and meta-analysis. Cerebrovasc Dis. 2015;39(1):39-52. doi:10.1159/000369777.
35. Alfano F, Cesari F, Gori AM, et al. The Role of Extracellular Matrix and Inflammation in the Stratification of Bleeding and Thrombotic Risk of Atrial Fibrillation on Oral Anticoagulant Therapy: Insights from Strat-Af Study. J Clin Med. 2023;12(21):6866. doi:10.3390/jcm12216866.
36. Wilson D, Charidimou A, Ambler G, et al. Recurrent stroke risk and cerebral microbleed burden in ischemic stroke and TIA: A meta-analysis. Neurology. 2016;87(14):1501-10. doi:10.1212/WNL.0000000000003183.
37. Ding L, Hong Y, Peng B. Association between large artery atherosclerosis and cerebral microbleeds: a systematic review and meta-analysis. Stroke Vasc Neurol. 2017;2(1):7-14. doi:10.1136/svn-2016-000049.
38. Katsanos AH, Lioutas VA, Charidimou A, et al. International META-MICROBLEEDS Initiative. Statin treatment and cerebral microbleeds: A systematic review and meta-analysis. J Neurol Sci. 2021;420:117224. doi:10.1016/j.jns.2020.117224.
39. Wagner B, Hert L, Polymeris AA, et al. Impact of type of oral anticoagulants in patients with cerebral microbleeds after atrial fibrillation-related ischemic stroke or TIA: Results of the NOACISP-LONGTERM registry. Front Neurol. 2022;13:964723. doi:10.3389/fneur.2022.964723.
40. Wilson D, Ambler G, Shakeshaft C, et al. Cerebral microbleeds and intracranial haemorrhage risk in patients anticoagulated for atrial fibrillation after acute ischaemic stroke or transient ischaemic attack (CROMIS-2): a multicentre observational cohort study. Lancet Neurol. 2018;17(6):539-47. doi:10.1016/S1474-4422(18)30145-5.
41. Choi HН, Kim JH, Lee K, et al. Microcirculation and outcome in patients with acute ischemic stroke and atrial fibrillation taking anticoagulants. Stroke. 2020;51(12): 3514-22. doi:10.1161/STROKEAHA.120.030300.
42. Charidimou A, Karayiannis C, Song TJ, et al. International META-MICROBLEEDS Initiative. Brain microbleeds, anticoagulation, and hemorrhage risk: Meta-analysis in stroke patients with AF. Neurology. 2017;89(23):2317-26. doi:10.1212/WNL.0000000000004704.
43. Charidimou A, Boulouis G, Shams S, et al. International META-MICROBLEEDS Initiative. Intracerebral haemorrhage risk in microbleed-positive ischaemic stroke patients with atrial fibrillation: Preliminary meta-analysis of cohorts and anticoagulation decision schema. J Neurol Sci. 2017;378:102-9. doi:10.1016/j.jns.2017.04.042.
44. Corica B, Romiti GF, Raparelli V, et al. Epidemiology of cerebral microbleeds and risk of adverse outcomes in atrial fibrillation: a systematic review and meta-analysis. Europace. 2022;24(9):1395-403. doi:10.1093/europace/euac028.
45. Zeng Z, Chen J, Qian J, et al. Risk Factors for Anticoagulant-Associated Intracranial Hemorrhage: A Systematic Review and Meta-analysis. Neurocrit Care. 2023;38(3): 812-20. doi:10.1007/s12028-022-01671-4.
46. Badi MK, Vilanilam GK, Gupta V, et al. Pharmacotherapy for Patients with Atrial Fibrillation and Cerebral Microbleeds. J Stroke Cerebrovasc Dis. 2019;28(8):2159-67. doi:10.1016/j.jstrokecerebrovasdis.2019.04.027.
47. Wu R, Feng C, Zhao Y, et al. A meta-analysis of association between cerebral microbleeds and cognitive impairment. Med Sci Monit. 2014;20:2189-98. doi:10.12659/MSM.891004.
48. Li X, Yuan J, Yang L, et al. The significant effects of cerebral microbleeds on cognitive dysfunction: An updated meta-analysis. PLoS One. 2017;12(9):e0185145. doi:10.1371/journal.pone.0185145.
49. Остроумова О. Д., Кочетков А. И., Остроумова Т. М. Фибрилляция предсердий и когнитивные нарушения: церебральные микрокровоизлияния как новый фактор риска и возможности антикоагулянтной терапии (часть 2). Неврология, нейропсихиатрия, психосоматика. 2020;12(4):107-12. doi:10.14412/2074-2711-2020-4-107-112.
50. Beaman C, Kozii K, Hilal S, et al. Cerebral Microbleeds, Cerebral Amyloid Angiopathy, and Their Relationships to Quantitative Markers of Neurodegeneration. Neurology. 2022;98(16):e1605-e1616. doi:10.1212/WNL.0000000000200142.
51. Yan J, Qiu J, Wu X, et al. Pretreatment cerebral microbleeds and symptomatic intracerebral hemorrhage post-thrombolysis: a systematic review and meta-analysis. J Neurol. 2020;267(2):301-7. doi:10.1007/s00415-018-9156-5.
52. Charidimou A, Turc G, Oppenheim C, et al. Microbleeds, Cerebral Hemorrhage, and Functional Outcome After Stroke Thrombolysis. Stroke. 2017;48(8):2084-90. doi:10.1161/STROKEAHA.116.012992.
53. Wang S, Lv Y, Zheng X, et al. The impact of cerebral microbleeds on intracerebral hemorrhage and poor functional outcome of acute ischemic stroke patients treated with intravenous thrombolysis: a systematic review and meta-analysis. J Neurol. 2017; 264(7):1309-19. doi:10.1007/s00415-016-8339-1.
54. Charidimou A, Shoamanesh A. International META-MICROBLEEDS Initiative. Clinical relevance of microbleeds in acute stroke thrombolysis: Comprehensive meta-analysis. Neurology. 2016;87(15):1534-41. doi:10.1212/WNL.0000000000003207.
55. Debette S, Schilling S, Duperron MG, et al. Clinical Significance of Magnetic Resonance Imaging Markers of Vascular Brain Injury: A Systematic Review and Meta-analysis. JAMA Neurol. 2019;76(1):81-94. doi:10.1001/jamaneurol.2018.3122.
56. Liu Y, Braidy N, Poljak A, et al. Cerebral small vessel disease and the risk of Alzheimer's disease: A systematic review. Ageing Res Rev. 2018;47:41-8. doi:10.1016/j.arr.2018.06.002.
57. Hussein AS, Shawqi M, Bahbah EI, et al. Do cerebral microbleeds increase the risk of dementia? A systematic review and meta-analysis. IBRO Neurosci Rep. 2022;14:86-94. doi:10.1016/j.ibneur.2022.12.009.
Об авторах
М. С. ЧерняеваРоссия
Марина Сергеевна Черняева — к. м. н., доцент кафедры клинической фармакологии и терапии им. акад. Б. Е. Вотчала; доцент кафедры внутренних болезней и профилактической медицины; зав. отделением гериатрии; главный внештатный специалист по гериатрии ДЗМ в ЮВАО г. Москвы.
Москва
Конфликт интересов:
нет
Е. А. Моисеева
Россия
Екатерина Александровна Моисеева — врач-терапевт консультативного отделения.
Москва
Конфликт интересов:
нет
А. А. Погодина
Россия
Анастасия Алексеевна Погодина — студент 6 курса.
Москва
Конфликт интересов:
нет
Е. А. Прохорова
Россия
Екатерина Алексеевна Прохорова — к. м. н., с. н. с. отдела клинической физиологии, инструментальной и лучевой диагностики, врач-рентгенолог отделения рентгендиагностики и компьютерной томографии.
Москва
Конфликт интересов:
нет
О. В. Зыкова
Россия
Оксана Валентиновна Зыкова — к. м. н., врач-невролог, зам. главного врача по клинико-экспертной работе.
Москва
Конфликт интересов:
нет
Л. А. Егорова
Россия
Лариса Александровна Егорова — д. м. н., профессор кафедры внутренних болезней и профилактической медицины.
Москва
Конфликт интересов:
нет
О. М. Масленникова
Россия
Ольга Михайловна Масленникова — д. м. н., зав. кафедрой внутренних болезней и профилактической медицины.
Москва
Конфликт интересов:
нет
Н. В. Ломакин
Россия
Никита Валерьевич Ломакин — д. м. н., зав. кафедрой кардиологии; зав. кардиологическим отделением № 2, главный внештатный специалист кардиолог Управления Делами Президента РФ.
Москва
Конфликт интересов:
нет
Д. А. Сычев
Россия
Дмитрий Алексеевич Сычев — д. м. н., профессор, профессор РАН, академик РАН, заслуженный деятель науки РФ, зав. кафедрой клинической фармакологии и терапии им. акад. Б.Е. Вотчала.
Москва
Конфликт интересов:
нет
Дополнительные файлы
Что уже известно о предмете исследования?
- Церебральные микрокровоизлияния (ЦМК) рассматривают как предиктор внутричерепного кровоизлияния, что требует анализа современных научных данных относительно безопасности оральных антикоагулянтов.
Что нового?
- Частота встречаемости ЦМК на фоне приема оральных антикоагулянтов у пациентов с фибрилляцией предсердий достигает 30% и увеличивается с возрастом. Поверхностные ЦМК и увеличение их количества ассоциированы с повышением риска внутричерепных кровоизлияний в 6 раз.
Возможный вклад в клиническую практику
- Необходимы дальнейшие исследования в этой области у пациентов на фоне приема прямых оральных антикоагулянтов, т. к. данные остаются противоречивыми.
Рецензия
Для цитирования:
Черняева М.С., Моисеева Е.А., Погодина А.А., Прохорова .А., Зыкова О.В., Егорова Л.А., Масленникова О.М., Ломакин Н.В., Сычев Д.А. Безопасность оральных антикоагулянтов: фокус на церебральные микрокровоизлияния. Российский кардиологический журнал. 2025;30(6S):6132. https://doi.org/10.15829/1560-4071-2025-6132
For citation:
Chernyaeva M.S., Moiseeva E.A., Pogodina A.A., Prokhorova E.A., Zykova O.V., Egorova L.А., Maslennikova O.M., Lomakin N.V., Sychev D.A. Safety of oral anticoagulants: focus on cerebral microbleeds. Russian Journal of Cardiology. 2025;30(6S):6132. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6132
JATS XML

















































