Перейти к:
Роль визуализирующих методов в оценке уязвимых бляшек и эффективности гиполипидемической терапии
https://doi.org/10.15829/1560-4071-2024-5984
EDN: FRLPZA
Аннотация
Цель — оценить возможности различных методов визуализации в диагностике уязвимых атеросклеротических бляшек (АСБ) в коронарных артериях и их стабилизации с применением различных режимов гиполипидемической терапии.
Поиск источников проводился в базе PubMed с использованием следующих ключевых слов: "vulnerable (unstable) plaque" AND "PCSK9 inhibitors" AND "intravascular ultrasound" OR "optical coherence tomography" OR "computed tomography angiography". В итоге было отобрано 8 оригинальных клинических исследований, соответствовавших цели данного обзора. Оценены результаты исследований, проводивших визуализацию АСБ и определение их регресса на фоне различных режимов гиполипидемической терапии — GLAGVO, ODYSSEY J, PACMAN-AMI, HUYGENS, ALTAIR, ARCHITECT и других. Результаты большинства работ установили преимущества комбинированного режима гиполипидемической терапии (статин + ингибитор PCSK9) в снижении числа сердечно-сосудистых осложнений в сравнении с монотерапией статинами. Уменьшение объема АСБ варьировало от 0,95% до 2,13% у пациентов, получавших комбинацию гиполипидемических препаратов, при этом на фоне монотерапии этот показатель увеличился с 0,05% до 0,92% (GLAGOV, PACMAN-AMI). Динамика минимальной толщины фиброзной капсулы варьировала в пределах 18,0-62,67 мкм при применении комбинации препаратов и 13,2-33,19 мкм на фоне монотерапии (PACMAN-AMI, Gao F). Регресс липидной дуги составил 57,5о на фоне комбинированной терапии (статин и ингибитор PCSK9) и 31,4о при приеме одного статина (HUYGENS). Использование визуализирующих методов диагностики предоставляет возможность выявления уязвимых АСБ, что помогает в принятии решения о целесообразности использования комбинированной гиполипидемической терапии. Кроме того, визуализация состояния АСБ позволяет оценивать эффективность проводимого лечения.
Ключевые слова
Для цитирования:
Бикбаева Г.Р., Ковальская А.Н., Кузнецова К.В., Павлова Т.В., Дупляков Д.В. Роль визуализирующих методов в оценке уязвимых бляшек и эффективности гиполипидемической терапии. Российский кардиологический журнал. 2024;29(8):5984. https://doi.org/10.15829/1560-4071-2024-5984. EDN: FRLPZA
For citation:
Bikbaeva G.R., Kovalskaya A.N., Kuznetsova K.V., Pavlova T.V., Duplyakov D.V. Role of imaging techniques in the assessment of vulnerable plaques and the effectiveness of lipid-lowering therapy. Russian Journal of Cardiology. 2024;29(8):5984. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5984. EDN: FRLPZA
Вероятность развития острого коронарного синдрома (ОКС) в значительной степени зависит от присутствия в коронарной артерии (КА) нестабильной атеросклеротической бляшки (АСБ). Уже достаточно давно было установлено, что за несколько недель или месяцев до развития ОКС по результатам инвазивной ангиографии только у 2/3 всех пациентов имелось гемодинамически значимое сужение просвета КА [1].
Уязвимость АСБ зависит от ее морфологических особенностей и выраженности ремоделирования КА [2], которое проявляется увеличением наружного диаметра при аккомодации к растущей АСБ для предотвращения сужения просвета сосуда. Применение современных липидснижающих препаратов оказывает стабилизирующее действие на АСБ и снижает вероятность прогрессирования процессов ремоделирования сосудов.
Цель работы — изучение возможностей визуализирующих методов в обнаружении уязвимых АСБ в КА и оценке возможности липидснижающей терапии в их стабилизации.
Материал и методы
Поиск рандомизированных клинических исследований (РКИ) проводился на ресурсах Pubmed, Scopus, Web of Science и eLIBRARY по ключевым словам: "coronary artery disease", "imaging", "intravascular ultrasound", "vulnerable plaques", "near-infrared spectroscopy", "coronary computed tomographic angiography", "optical coherence tomography", positron emission tomography", "statins", "ezetimib", "PCSK9 inhibitors". Всего было отобрано 8 исследований, соответствовавших целям нашего обзора (табл. 1) [3-10].
Таблица 1
Клинические исследования, изучавшие влияние ингибиторов PCSK9 на регресс АСБ КА
Исследование | Год | Дизайн | Число пациентов (PCSK9/контроль) | Ингибитор PCSK9 | Контроль | Основное заболевание | Длительность наблюдения (нед.) |
ВСУЗИ | |||||||
ODYSSEY J | 2019 | РКИ | 93/89 | алирокумаб 75/150 мг + статин (аторвастатин ≥10 мг или розувастатин ≥5 мг) | аторвастатин ≥10 мг или розувастатин ≥5 мг | ОКС | 36 |
GLAGVO | 2016 | РКИ | 484/484 | эволокумаб 420 мг + статин | статин + плацебо | ХИБС | 78 |
PACMAN-AMI | 2022 | РКИ | 148/152 | алирокумаб 150 мг + розувастатин 20 мг | розувастатин 20 мг + плацебо | ИМ | 52 |
ОКТ | |||||||
HUYGENS | 2021 | РКИ | 80/81 | эволокумаб 420 мг + аторвастатин ≥40 мг | плацебо + аторвастатин ≥40 мг | ИМбпST | 52 |
Yano | 2019 | 18/40 | эволокумаб 140 мг + розувастатин 5 мг | розувастатин 5 мг | ОКС | 12 | |
ALTAIR | 2020 | РКИ | 12/12 | алирокумаб 75 мг + розувастатин 10 мг | розувастатин 10 мг | ХИБС или ОКС | 36 |
Gao F, et al., 2021 | 2021 | РКИ | 30/3 | алирокумаб 75 мг + аторвастатин 20 мг или розувастатин 10 мг | аторвастатин 20 мг или розувастатин 10 мг | ИБС или ОКС | 36 |
МСКТ | |||||||
ARCHITECT | 2023 | одногрупповое | 104 | алирокумаб | — | семейная ГХС без клинических проявлений атеросклеротического ССЗ | 78 |
Сокращения: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ГХС — гиперхолестеринемия, ИМ — инфаркт миокарда, ИМбпST — инфаркт миокарда без подъема сегмента ST, МСКТ — мультиспиральная компьютерная томография, ОКС — острый коронарный синдром, ОКТ — оптическая когерентная томография, РКИ — рандомизированное клиническое исследование, ССЗ — сердечно-сосудистые заболевания, ХИБС — хроническая ишемическая болезнь сердца, PCSK9 — пропротеин-конвертаза субтилин/кексин типа 9.
Результаты
Стабильные и нестабильные АСБ
Стабильность АСБ зависит от ее размеров, конфигурации и строения. Для стабильных бляшек характерна толстая, плотная фиброзная покрышка, богатая коллагеном. Такие АСБ растут медленно (в течение многих лет) и как правило могут не оказывать значимого влияния на кровоснабжение органов. Для нестабильных АСБ, напротив, характерна тонкая фиброзная капсула (<65 мкм); присутствие признаков активного воспаления (инфильтрация фиброзной покрышки клетками воспаления, в основном — макрофагами, активированными Т-клетками и тучными клетками); крупное липидное ядро, которое занимает >40% от объема АСБ; кровоизлияния и участки микрокальциноза в ядре [11]. Такой тип АСБ также называют уязвимыми.
Дестабилизация АСБ развивается вследствие целого ряда процессов в сосудистой стенке — это ферроптоз, некроптоз, вторичный некроз, пироптоз, прогрессия воспаления. Совокупность этих процессов способствует истончению фиброзной покрышки и, при определенных условиях, к её разрыву, что сопровождается активацией свертывающей системы крови и образованием тромба. В зависимости от размера сформировавшегося тромба и его локализации клинически этот процесс проявляется нестабильной стенокардией, инфарктом миокарда (ИМ), ишемическим инсультом или тромбозом артерий конечностей. Нестабильность АСБ ассоциируется и с высоким риском развития фатальных сердечно-сосудистых событий — при аутопсии было установлено, что до 70% случаев острого коронарного тромбоза возникли на фоне нестабильной АСБ с признаками воспаления [12], а внезапная коронарная смерть развилась вследствие разрыва АСБ с последующим тромбозом в 73% случаев [13].
Роль визуализирующих методов в диагностике уязвимой АСБ
Определить критерии уязвимой АСБ можно с помощью визуализирующих методов обследования КА, которые позволяют получать изображения с высоким разрешением в непосредственной близости от неё.
Инвазивная коронароангиография (рис. 1) является золотым стандартом в диагностике атеросклеротического поражения КА. Однако данный метод не обладает предиктивной способностью в отношении предсказания развития острых сердечно-сосудистых событий, т. к. получаемое изображение не позволяет оценить структуру сосудистой стенки и ее размеры, определить признаки нестабильности атеросклеротических образований. Кроме того, некоторые особенности этого метода снижают качество визуализации (кальцинаты в сосудистой стенке, перекрывающиеся ракурсы сосудов).
Появление более современных методов внутрисосудистой визуализации (ВСВ) расширило возможности диагностики АСБ. Первым методом, позволившим изучать параметры АСБ in vivo, было внутрисосудистое ультразвуковое исследование (ВСУЗИ), которое стало использоваться >30 лет назад [14]. ВСУЗИ позволяет оценивать продольные и поперечные размеры сосуда, определять выраженность его ремоделирования, величину и структуру АСБ в режиме реального времени. В то время как коронарная ангиография позволяет получить только проекцию просвета сосуда и не оценивает его структуру, ВСУЗИ дает возможность изучать послойное строение артерии с выделением интимы, гладко-мышечного и соединительно-тканного слоев (рис. 2). Если же ВСУЗИ используется при выполнении чрескожного коронарного вмешательства (ЧКВ) в качестве метода контролирующей визуализации, то такой подход снижает риски неполного покрытия стентом пораженного участка, неоптимального раскрытия стента, диссекции стенки сосуда. Кроме того, данная методика позволяет повысить минимальную площадь просвета стента в сравнении с ангиографическим контролем. Соответственно, эти методологические преимущества сопровождаются снижением частоты развития ишемических событий [15][16]. Учитывая эти достоинства, ВСУЗИ в течение некоторого времени считалось классическим инструментом оценки неоинтимальной гиперплазии, однако на настоящий момент возможностей данной технологии недостаточно для надежного определения отдельных компонентов АСБ, которые и считаются показателями, определяющими ее уязвимость. Эти факторы способствовали разработке более совершенных модификаций ВСУЗИ, которые используют специальные вычислительные алгоритмы, позволяющие получить дополнительные данные об уязвимости АСБ.
Оптическая когерентная томография (ОКТ) — это метод визуализации высокого разрешения, который также может быть использован для определения критериев уязвимости АСБ и заживления неоинтимы после вмешательства на КА (рис. 3). Впервые ОКТ была предложена в 1991г учеными Массачусетского технологического института для визуализации поперечного сечения сетчатки. В 2001г ОКТ впервые была применена для получения интракоронарного изображения патологии артериальной стенки, и с тех пор широко используется для оценки состояния стенок КА. Данный метод для получения изображения поперечного сечения КА применяет излучение в спектре ближнего инфракрасного света. В сравнении с ультразвуковым, это более высокочастотное и коротковолновое излучение, что дает более четкое (примерно в 10 раз) разрешение в сравнении с ВСУЗИ. Кроме того, ОКТ позволяет определять фиброзные АСБ и липиды в ее структуре, а также выявлять разрывы интимы и классифицировать тромбы на коагуляционные и тромбоцитарные на основании интенсивности затухания сигнала. Показано, что чувствительность ОКТ в обнаружении тромба приближается к 100%, в то время как для ВСУЗИ составляет 33%. Характерными параметрами, позволяющими точно идентифицировать уязвимые АСБ, являются следующие: тонкая фиброзная капсула, большое некротическое ядро, неоангиогенез, воспалительные изменения в покрышке АСБ [17].
C помощью ОКТ возможна детализация степени и толщины кальцификации АСБ. В исследовании OPTICO-ACS [18] у 155 пациентов с ОКС с помощью ОКТ был оценен фенотип кальцификации в месте тромбоза, вызывавшем ОКС. Также одновременно было проведено определение провоспалительных цитокинов интерлейкина-8 и фактора некроза опухоли-α. Кроме того, оценивалась частота больших сердечно-сосудистых осложнений (ССО) в течение 12 мес. с момента развития ОКС. По результатам ОКТ кальцификация была выявлена в 45,2% АСБ, явившихся причиной развития ОКС. При этом АСБ с кальцификацией характеризовались статистически значимым повышением содержания интерлейкина-8, фактора некроза опухоли-α, циркулирующих нейтрофилов по сравнению с АСБ без кальцификации. Более того, частота больших ССО в течение 12 мес. была выше у пациентов с кальцификацией АСБ, чем без нее (16,4% vs 5,3%; р<0,05).
ОКТ позволяет определить фенотип повреждения фиброзной капсулы АСБ при ОКС — эрозию или разрыв. Gerhardt T, et al. показали [19], что в случае разрыва фиброзной капсулы уровни экспрессии провоспалительных цитокинов были выше как исходно, так и через 90 сут. после ОКС. Частота ССО в течение 2 лет была выше среди лиц с разрывом фиброзной капсулы АСБ, чем с ее эрозией — 14,3% vs 26,7%, (р=0,02). Фенотип повреждения АСБ ассоциируется с особенностями строения тромба, возникающего в ответ на дефект покрытия, что может оказывать влияние на эффективность антитромботической терапии [20]. Тромбы, сформированные при разрыве АСБ, как правило, богаты фибрином и эритроцитами и в меньшей степени — тромбоцитами ("красные" тромбы), в то время как эрозированные АСБ приводят к образованию тромбов, богатых тромбоцитами ("белые" тромбы). Состав тромба определяет его механические свойства с точки зрения стабильности и эмболизации, а также устойчивости к лизису.
ОКТ целесообразно выполнять перед проведением ЧКВ, т. к. этот подход обеспечивает получение предварительной информации о типе изъязвления АСБ, наличии кальцификации, структуре тромба — тех факторов, которые могут осложнить проведение процедуры ЧКВ. Критериями ОКТ, позволяющими принять решение о коронарном вмешательстве, являются наличие тромба и минимальная площадь поперечного просвета сосуда <3,5 мм2 [21]. Исследования, оценивавшие эффективность выполнения ЧКВ под контролем ОКТ, в сравнении с ВСУЗИ, установили аналогичные клинические и ангиографические результаты [22]. После стентирования ОКТ позволяет в автоматическом режиме высчитывать площадь просвета контрольного сосуда и минимальную площадь стента с целью оценки достигнутого после вмешательства расширения. Кроме того, ОКТ выявляет диссекции и перфорации, возникшие в процессе стентирования [21][22].
Недостатками ОКТ является низкое прохождение сигнала сквозь ткани (на 1-3 мм), что не позволяет оценить морфологию стенки КА на всю глубину. Тем не менее в настоящее время техника оценки КА при ОКТ продолжает совершенствоваться [23]. В сравнении с ВСУЗИ, наибольшее преимущество ОКТ заключается в возможности определения рестеноза стента, т. к. ВСУЗИ зачастую не обнаруживает мягкую неоинтимальную АСБ [21]. Еще одним преимуществом ОКТ является хорошая воспроизводимость измерений, что важно и для клинической практики, и для проведения научных исследований.
В проспективном РКИ OCTIVUS [24] сравнивалась эффективность ЧКВ в зависимости от метода контроля — ОКТ или ВСУЗИ — у 2008 пациентов с доказанным поражением КА. За первичную конечную точку была принята совокупность смерти от сердечно-сосудистых причин, ИМ, связанного со стентированным сосудом, или реваскуляризация стентированного сосуда, вызванная ишемией, в течение одного года. Результаты показали не меньшую эффективность ОКТ в сравнении с ВСУЗИ (р<0,001). Частота контраст-индуцированной нефропатии была сопоставимой (р=0,85), а частота серьезных процедурных осложнений была ниже в группе ОКТ, чем в группе ВСУЗИ (2,2% vs 3,7%; р=0,047).
В настоящее время изучается возможность преодоления ограничений методов ВСУЗИ и ОКТ путем создания гибридной ВСВ [25]. Комбинированная визуализация ВСУЗИ-ОКТ позволяет получить комплексное изображение коронарной АСБ. Сочетание нескольких методов ВСВ дает более обширную информацию о морфологии и составе АСБ, позволяет охарактеризовать ее фенотип и расширить понимание патофизиологии ОКС [26-28]. В последние годы отмечается тенденция более частого применения методов ВСВ. Так, анализ страховой базы Medicare с включением 1189470 пациентов, перенесших ЧКВ, показал, что при его выполнении в 2013г ВСВ применялась у 9,5% пациентов, а в 2019г — у 15,4% [16].
Еще одним методом визуализации, позволяющим оценивать состояние коронарного русла, является компьютерная томография (КТ) (рис. 4). Изображение, полученное при выполнении КТ, представляет собой карту распределения рентгеновской плотности объекта, выраженного в стандартизованной шкале Хаунсфилда (HU). Мультиспиральная компьютерная томография (МСКТ) обеспечила новые возможности в неинвазивной диагностике поражения КА. В последние годы также были установлены критерии нестабильности АСБ, определение которых возможно in vivo. Обнаружение этих критериев может иметь важнейшее значение в выборе тактики дальнейшего ведения пациента [29]. К ним относятся следующие показатели:
- увеличенный объем АСБ, приводящий к относительному расширению диаметра КА — так называемое "положительное ремоделирование". Для его оценки используется количественный показатель — индекс ремоделирования (ИР), который вычисляется по формуле: ИР=Д1/Д2, где Д1 — диаметр сосуда на уровне АСБ, Д2 — диаметр интактного сегмента проксимальнее АСБ. Положительным ремоделированием принято считать превышения диаметра сосуда в месте АСБ более чем на 10% по сравнению с референтным сегментом;
- участок АСБ низкой плотности (<30 единиц Хаунсфильда (HU));
- точечные кальцинаты в составе АСБ — неравномерные включения мелких кальциевых депозитов протяженностью <3 мм, занимающих только одну сторону АСБ на изображениях, выполненных в поперечном сечении КА;
- феномен "кругового свечения" — кольцевидное усиление рентгеновской плотности по периферии АСБ, не превышающее 130 HU;
- неровный контур АСБ или наличие разрыва.
Помимо этих показателей Американской ассоциацией кардиологов (AHA) предложены дополнительные геометрические характеристики КА [30]:
- расстояние от устья сосуда до стента — чем меньше расстояние от устья до стента, тем выше риск развития ОКС (<39 мм для левой КА и <60 мм для правой КА);
- извитость — наличие одного изгиба >90или трех изгибов от 45до 90 с использованием трёхточечного угла внутри очага поражения;
- бифуркационное поражение.
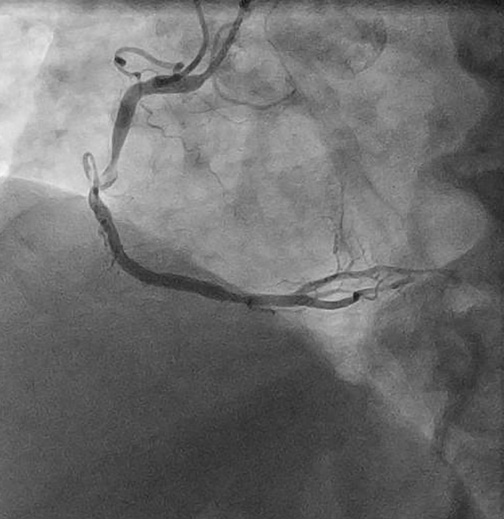
Рис. 1. Пристеночный тромбоз (указан стрелкой) правой КА на коронарографии.
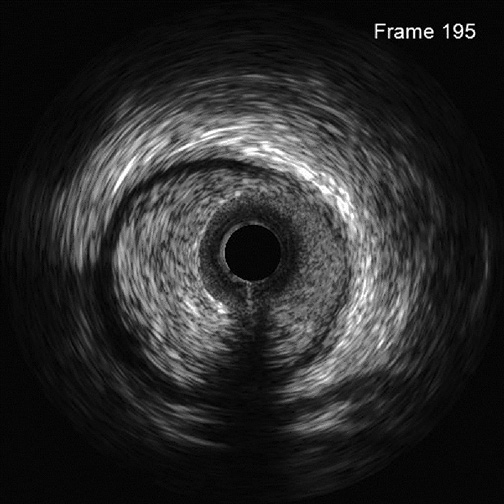
Рис. 2. Стеноз до 90% (указан стрелкой) КА по данным ВСУЗИ.
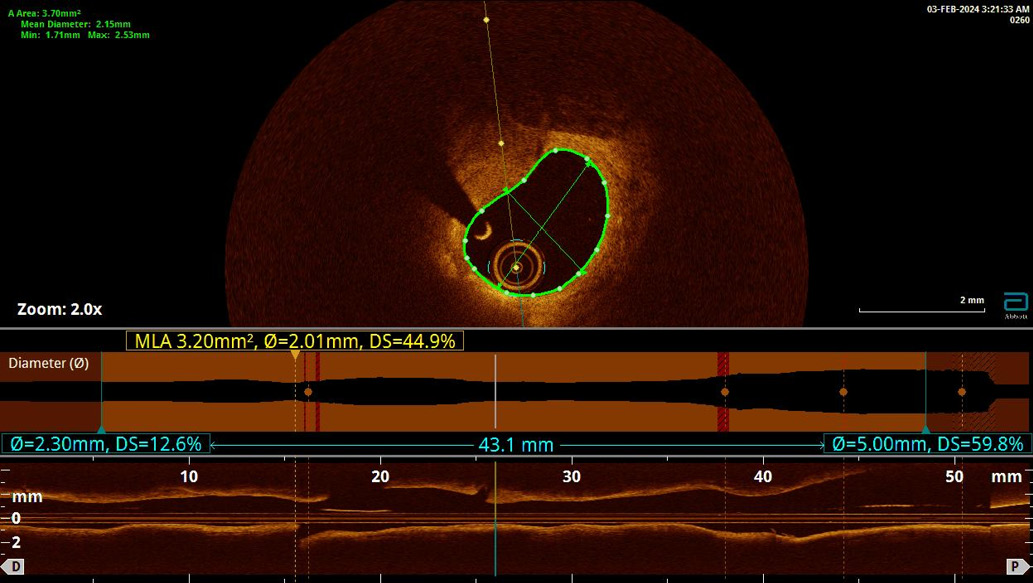
Рис. 3. Нестабильная АСБ с большим липидным ядром (указана стрелкой) по данным ОКТ.
Примечание: цветное изображение доступно в электронной версии журнала.
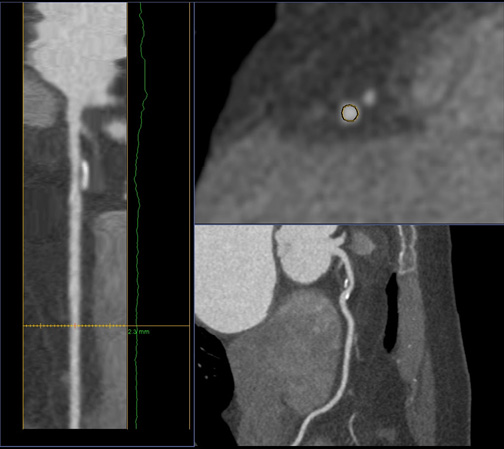
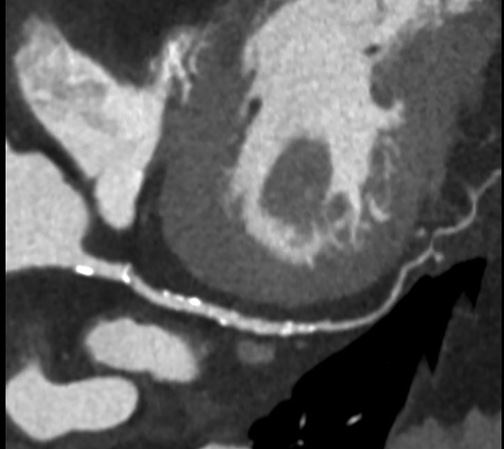
Рис. 4. МСКТ. А) Стрелкой указано положительное ремоделирование. Б) Стрелкой указаны точечные кальцинаты.
КТ-ангиография является быстрым неинвазивным методом оценки состояния АСБ. Результаты КТ-ангиографии хорошо коррелируют с данными ВСУЗИ [31]. Недостатком МСКТ является невозможность достоверного выявления АСБ с тонкой капсулой вследствие недостаточного пространственного разрешения (~0,3-0,5 мм). По этой же причине МСКТ не позволяет четко разграничить АСБ с неповрежденной покрышкой у больных ОКС от поражений у больных со стабильной стенокардией. Однако о наличии АСБ с тонкой капсулой можно косвенно судить по наличию "светящегося кольца" в поперечном сечении артерии, которое визуализируется при преобладании липидного компонента в структуре АСБ, наличии микрокальцинатов и проявлениях ангиогенеза [32]. В настоящее время ведется работа по улучшению визуализации компонентов АСБ с помощью МСКТ с использованием наночастиц.
Параметры объема АСБ, полученные при проведении МСКТ, имеют высокую степень корреляции с аналогичными параметрами, полученными при выполнении ВСУЗИ. Опубликованы данные, свидетельствующие, что АСБ с признаками положительного ремоделирования (превышение диаметра сосуда в области АСБ более чем на 10% по сравнению с диаметром интактного сосуда), с низкой плотностью, наличием точечных (<3 мм) кальцинатов статистически значимо чаще выявлялись у больных ОКС, в то время как у пациентов со стабильной ишемической болезнью сердца (ИБС) чаще определялись АСБ с кальцинатами более крупного размера [33][34]. Кроме того, было показано, что возможности МСКТ в выявлении нестабильных АСБ сопоставимы с возможностями ОКТ [35].
Таким образом, несмотря на некоторые недостатки МСКТ, связанные с ограничением получения изображений высокого разрешения, ее ценность заключается в предоставлении достоверной информации для стратификации риска развития ССО. Кроме того, МСКТ может помочь в выявлении больных с высоким риском рецидива ишемических эпизодов после перенесенного ОКС без подъема SТ путем измерения общего числа некальцинированных АСБ, которые достоверно ассоциируются с неблагоприятным прогнозом.
К настоящему моменту появляется все больше доказательств того, что визуализация АСБ позволяет выявить пациентов высокого риска ССО. Так, в 2023г были опубликованы результаты систематического обзора и анализа прогностического влияния уязвимых АСБ на частоту больших сердечно-сосудистых нежелательных событий [36]. В данную работу вошло 30 исследований (21 ретроспективное, 9 проспективных), включавших в целом 30369 пациентов. Оценка характеристик АСБ проводилась с использованием визуализирующих методов (в 4 исследованиях — ОКТ, в 5 — ВСУЗИ, в 21 — КТ). Показатели "уязвимости" включали целый ряд параметров — низкую минимальную площадь просвета, АСБ с тонкой покрышкой, высокое содержание липидов в ядре, точечную кальцификацию, феномен "кругового свечения", позитивное ремоделирование и другие. Результаты показали, что выявление более чем одного критерия "уязвимости" АСБ с помощью визуализирующих методов исследования имеет высокую прогностическую ценность относительно развития больших сердечно-сосудистых событий (показатель "площадь по кривой" составил 0,87).
Позитронная эмиссионная томография (ПЭТ) — это метод радионуклидной диагностики, принцип работы которого заключается в оценке распределения в организме различных биологически активных веществ, меченных радиофармпрепаратом (РФП). ПЭТ позволяет оценить объем кровотока, функцию и метаболизм органов или тканей на клеточном и молекулярном уровнях. Особую ценность имеет возможность визуализации клеточной перфузии органов-мишеней, кровоснабжаемых атеросклеротически измененными артериями, и в том числе — миокарда.
ПЭТ также является основным методом визуализации атеросклероза на молекулярном уровне. В настоящее время используются десятки РФП для высокочувствительной визуализации практически всех этапов атерогенеза (хемотаксис, аккумуляция липопротеидов, ангиогенез, протеолиз, тромбоз). Повышенная активность метаболизма в нестабильной АСБ обусловлена макрофагальным ответом, который может быть установлен с помощью фтордезоксиглюкозы (ФДГ), т. к. выраженность ее накопления в зоне АСБ пропорциональна количеству макрофагов. При этом данный показатель не связан с площадью и объемом АСБ. Метод является количественным, его основной параметр SUV (Standardized Uptake Value, стандартизованный уровень захвата РФП) высоко воспроизводим, что позволяет проводить объективные сопоставления в динамике [37]. Изменение образа жизни и терапия статинами сопровождаются снижением накопления ФДГ в сосудистой стенке параллельно с нормализацией показателей липидного обмена [38]. Эти результаты касаются визуализации сонных артерий и аорты. Однако исследование накопления ФДГ в КА представляет определенную техническую проблему вследствие относительно невысокой разрешающей способности ПЭТ (3-5 мм), а также вследствие того, что в норме в миокарде ФДГ накапливается с интенсивностью, намного превышающей ее накопление в КА. В настоящее время разработан новый протокол подготовки пациента к исследованию, включающий в т. ч. и предварительную низкоуглеводную высокожирную диету, что приводит к снижению накопления ФДГ в миокарде, и, следовательно, к значительному улучшению визуализации стенок КА [39].
Исследования, выполненные на гибридных ПЭТ/КТ-томографах, показали, что визуализация кальцинатов в КА по данным КТ далеко не всегда совпадает с зонами повышенного накопления ФДГ по результатам ПЭТ. Эти работы заставили более детально изучать взаимоотношение процессов кальцификации и воспалительного ответа. В отличие от КТ, при ПЭТ с ФДГ выявляется воспалительный компонент АСБ, причем максимальное включение ФДГ отражает текущий высокий уровень воспаления в АСБ, имеющей высокую вероятность разрыва [40]. Еще одна возможная точка приложения визуализации с ФДГ — это выявление воспалительных процессов в зоне стентирования КА. Кроме того, регулярно появляется информация о использовании новых экспериментальных РФП, и к настоящему моменту разработано >20 соединений, способных визуализировать различные этапы атерогенеза на животных моделях или in vitro, с акцентом на визуализацию нестабильных АСБ
Роль визуализирующих методов в оценке эффективности гиполипидемической терапии
Гиполипидемическая терапия широко применяется в современной кардиологии. К настоящему моменту доступен целый ряд лекарственных препаратов, эффективность применения которых доказана на большом клиническом материале.
Ингибиторы синтеза холестерина (статины) — это один из наиболее изученных классов препаратов для первичной и вторичной профилактики сердечно-сосудистых заболеваний (ССЗ). Статины конкурентно ингибируют ГМГ-КоА-редуктазу — важнейший фермент синтеза холестерина (ХС) на этапе превращения ацетил-КоА в мевалоновую кислоту. Максимальную доказательную базу в популяции кардиологических пациентов имеют аторвастатин и розувастатин. В случае необходимости интенсификации гиполипидемической терапии, к статину рекомендуется назначить ингибитор всасывания ХС в кишечнике эзетимиб [41]. Эзетимиб обычно назначают в комбинации со статинами, если высокие дозы последних недостаточно эффективны в достижении целевого уровня липопротеидов низкой плотности (ЛНП). Эзетимиб может быть назначен в качестве монотерапии в случае непереносимости статинов. Однако монотерапия эзетимибом в клинических исследованиях не изучалась.
Ингибиторы пропротеин-конвертазы субтилин/кексин типа 9 (PCSK9) — это моноклональные антитела, которые существенно отличаются от статинов и эзетимиба как по своей природе, так и по механизму гиполипидемического действия. Разработка ингибиторов PCSK9 стала возможна после открытия роли гена и белка PCSK9 в метаболизме ХС. Связывание фермента PCSK9 с доменами рецепторов ЛНП приводит к их деградации и, соответственно, к снижению плотности их распределения, что вызывает снижение метаболизма ЛНП и приводит к гиперхолестеринемии (ГХС). Целенаправленное ингибирование PCSK9 с помощью моноклональных антител способствует активации рецепторов ЛНП, что сопровождается усилением захвата ЛНП из кровотока и, следовательно, снижением их содержания в плазме крови [42].
РКИ III фазы LAPLACE-2 с эволокумабом включало пациентов, у которых несмотря на терапию статинами в максимальных дозах уровни ЛНП оставались повышенными (в среднем 2,8 ммоль/л). Присоединение к терапии статином эволокумаба показало дополнительное снижение уровней ЛНП на 75% по сравнению с монотерапией статином. Было показано, что у 94% пациентов уровень ЛНП снижался <1,8 ммоль/л. Эффективность эволокумаба не зависела от пола, возраста, типа/дозы статина и исходного уровня ЛНП [43].
В РКИ III фазы GAUSS-2 эволокумаб назначался пациентам с непереносимостью статинов в эффективных дозах. По результатам исследования, 46% пациентов, получавших эволокумаб, достигали снижения уровня ЛНП <1,8 ммоль/л [44]. Эффективность эволокумаба у пациентов с семейной гетерозиготной ГХС была изучена в РКИ RUTHERFORD-2, в котором пациентам с подобранной гиполипидемической терапией дополнительно назначались эволокумаб или плацебо. Результаты исследования показали, что эволокумаб при добавлении к проводимой гиполипидемической терапии снижал уровень ЛНП дополнительно на 60% в сравнении с плацебо, что позволило достичь целевого уровня ЛНП (<1,8 ммоль/л) у 67% больных группы эволокумаба по сравнению c 2% у получавших плацебо [45].
Алирокумаб, согласно данным РКИ II и III фазы программы ODYSSEY [46], продемонстрировал значительное преимущество в снижении уровня ЛНП у пациентов с первичной ГХС в сравнении с контрольными группами (плацебо, эзетимиб или модификация терапии статинами) как в качестве монотерапии, так и при комбинации со статинами и другими липидснижающими препаратами. Кроме того, было установлено, что алирокумаб оказывает влияние и на другие атерогенные фракции ХС — аполипопротеин В и липопротеин(а). При этом алирокумаб характеризуется хорошей переносимостью и высокой безопасностью, вследствие чего может применяться при недостижении целевых значений ХС ЛНП при терапии статинами, а также в случае непереносимости статинов или при семейной гетерозиготной ГХС.
В настоящее время интенсификация гиполипидемической терапии у пациентов очень высокого сердечно-сосудистого риска рассматривается в качестве эффективной и оправданной стратегии. В последней версии российских рекомендаций, посвященных ведению пациентов с нарушениями липидного обмена (2023), рассматривается возможность применения стартовой комбинированной гиполипидемической терапии [41]:
- в случае значительного повышения уровня ХС ЛНП у больных очень высокого риска (>4,0 ммоль/л), рекомендуется рассмотреть возможность инициального назначения статина и эзетимиба, предпочтительно в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) (УУР А, УДЦ 1);
- в случае значительного повышения уровня ХС ЛНП у больных экстремального или очень высокого риска (>5,0 ммоль/л), рекомендуется рассмотреть возможность инициального назначения статина в максимально переносимой дозе+эзетимиб+ингибитор РСSК9: алирокумаба, эволокумаба или инклисирана (УУР А, УДЦ 1).
Этот аспект гиполипидемический терапии тем более актуален, что появляется все больше данных о недостаточной эффективности монотерапии статинами у некоторых пациентов с поражением КА атеросклеротического генеза. Так, целью исследования Suzuki N, et al. [47] было определение характеристик пациентов, у которых, несмотря на первичную профилактику статинами в течение как минимум 6 мес., сохранялись критерии "уязвимости" АСБ. В качестве метода ВСВ применялось ВСУЗИ. Результаты показали, что пациенты с "уязвимыми" АСБ были моложе, имели более высокие уровни ЛНП, триглицеридов и ХС не липопротеидов высокой плотности, чем пациенты из группы с неуязвимыми АСБ. Авторы делают вывод о целесообразности более активной гиполипидемической терапии для первичной профилактики ССЗ.
Проведено несколько исследований, в которых с применением визуализирующих методик сравнивали влияние на параметры АСБ монотерапии статинами и их комбинации с ингибиторами PCSK9 с помощью ВСУЗИ и ОКТ (табл. 1).
В исследование ODYSSEY-J-IVUS [3] было включено 206 пациентов, перенесших ОКС в течение 4 нед. до включения, с уровнем ЛНП ≥2,59 ммоль/л (≥100 мг/дл). Первая группа получала аторвастатин ≥10 мг/сут. или розувастатин ≥5 мг/сут. Вторая группа получала комбинацию статина и алирокумаба (75 мг каждые 2 нед.), и если через 14 нед. исследования уровень ЛНП был ≥2,59 ммоль/л, дозу алирокумаба повышали до 150 мг каждые 2 нед. Общая длительность исследования составила 36±2 нед. ВСУЗИ проводилось исходно и по окончании исследования. На основании результатов ВСУЗИ было установлено снижение процентного изменения нормализованного общего объема АСБ на 3,1% в группе монотерапии и на 4,8% в группе комбинированной терапии (р=0,23). Абсолютное изменение процентного объема АСБ составило 1,3% и 1,4%, соответственно (р=0,79). Уровень ЛНП через 36 нед. исследования снизился на 13,4% в группе монотерапии, в то время как в группе комбинированного гиполипидемического лечения — на 63,9% (р<0,0001). Параметры безопасности были сопоставимы в группах сравнения.
Исследование GLAGOV включало 968 больных с атеросклерозом КА, подтвержденным по результатам коронарографии [4]. Первая группа получала эволокумаб (420 мг ежемесячно), вторая — плацебо. Общая длительность исследования составила 78 нед. ВСУЗИ выполнялось при включении в исследование и через 78 нед. По итогам исследования объем АСБ увеличился на 0,05% в группе плацебо и снизился на 0,95% при приеме эволокумаба (95% доверительный интервал (ДИ): -1,8% — -0,64%; р<0,001). Общий объем АСБ уменьшился на 0,9 мм3 в группе плацебо и на 5,8 мм3 в группе эволокумаба (95% ДИ: -7,3 — -2,5; р<0,001). Регресс АСБ зафиксирован у 64,3% пациентов, принимавших эволокумаб, и у 47,3%, принимавших плацебо. Кроме того, в группе эволокумаба был достигнут более низкий уровень ЛНП (93,0 vs 36,6 мг/дл; 95% ДИ: -59,7 — -53,4; р<0,001).
Исследование PACMAN-AMI [5] включало 300 пациентов, перенесших ЧКВ вследствие острого ИМ. Пациенты дополнительно к терапии розувастатином (20 мг/сут.) получали алирокумаб (150 мг каждые 2 нед.) или плацебо. Длительность наблюдения составляла 52 нед. ВСУЗИ проводилось в начале и конце исследования. В итоге объем АСБ уменьшился на 2,13% в группе алирокумаба и на 0,92% в группе плацебо (95% ДИ: -1,78% — -0,65%; р<0,001). Среднее изменение минимальной толщины фиброзной капсулы составило 62,67 мкм в группе алирокумаба и 33,19 мкм в группе плацебо (95% ДИ: 11,75-47,55; р=0,001).
Исследование Gao F, et al. включало 61 пациента с хронической ИБС или ОКС, и с поражением КА на 50-70% диаметра [6], с уровнем ЛНП ≥1,81 ммоль/л для пациентов с ОКС или ≥2,59 ммоль/л для пациентов без ОКС. Исходно все пациенты получали розувастатин ≥10 мг/сут. или аторвастатин ≥20 мг/сут. Первая группа получала алирокумаб (75 мг каждые 2 нед.), вторая — только статин. Общая длительность исследования составила 36±2 нед. ОКТ проводили исходно и при окончании наблюдения. В результате, в группе комбинированной терапии в сравнении с группой монотерапии было получено статистически значимое увеличение минимальной толщины фиброзной покрышки (18,0 [ 10,8-29,2] мкм vs 13,2 [ 7,4-18,6] мкм; р=0,029) и площади минимального просвета (0,20 [ 0,10-0,33] мм2 vs 0,13 [ 0,12-0,24] мм2; р=0,006), а также большее снижение максимальной липидной дуги (15,1 [ 7,8-24,5] vs 8,4 [ 2,0-10,5]; p=0,008).Снижение уровня ЛНП в группе комбинированной терапии было статистически значимо больше, чем в группе монотерапии (1,72±0,51 vs 0,96±0,59, р<0,0001).
Исследование HUYGENS [7] включало 161 пациента с ИМ без подъема сегмента ST. Сравнивались эволокумаб (420 мг) и плацебо. Длительность наблюдения составила 52 нед. В течение исследования проводилась серия ОКТ. В группе эволокумаба было получено более выраженное повышение минимальной толщины капсулы (+42,7 vs +21,5 мкм; р=0,015), регресс липидной дуги (-57,5 vs -31,4; р=0,04), снижение макрофагального индекса (-3,17 vs -1,45 мм; р=0,04) и уровня ЛНП (28,1 vs 87,2 мг/дл; р<0,001).
Исследование Yano H, et al. [8] включало 58 пациентов с ОКС, перенесших ЧКВ. Все пациенты получали розувастатин (5 мг/сут.), из них 18 — эволокумаб (140 мг каждые 2 нед.). ОКТ проводилась исходно, через 4 и 12 нед. наблюдения. Результаты показали, что увеличение толщины фиброзной покрышки АСБ (177,7±33,2 vs 164,0±30,4; р<0,001) и снижение макрофагального индекса (7,0±1,8 vs 8,0±2,2; р=0,002) к концу исследования были больше в группе комбинированной терапии.
Исследование ALTAIR [9] включало 24 пациента с хронической ИБС или ОКС и уровнем ЛНП >70 мг/дл. Все пациенты получали розувастатин (10 мг/сут.), из них 12 — дополнительно алирокумаб (75 мг каждые 2 нед.). Длительность наблюдения составляла 36 нед. ОКТ выполнялась исходно и по окончании исследования. Результаты установили, что в группе алирокумаба толщина фиброзной капсулы увеличилась больше, чем в группе монотерапии (190 мм [ 128-220] vs 90 мм [ 60-125]; p=0,001), а макрофагальный индекс был ниже (-28,4% [ -35,3% до -19,0%] vs -10,2% [ -25,3% до 4,3%]; p=0,033).
Исследование ARCHITECT [10] по дизайну было открытым многоцентровым одногрупповым и включало 104 пациентов с семейной ГХС без клинических проявлений коронарного атеросклероза. Дополнительно к высокоинтенсивной терапии статином (как в комбинации с эзетимибом, так и без него) все пациенты получали алирокумаб (150 мг каждые 2 нед.). МСКТ выполнялась исходно и через 78 нед. лечения. В результате терапии объем АСБ изменился с 34,6% [ 32,5-36,8] при поступлении до 30,4% [ 27,4-33,4] при последующем наблюдении (P<0,001). Также было установлено изменение морфологии АСБ: увеличение доли кальцинации (+0,3%; P<0,001) и фиброза (+6,2%; P<0,001) покрышки, при этом доля фиброзно-жировых (-3,9%; р<0,001) и некротических (-0,6%; P<0,001) структур снизилась. Медиана ЛНП составляла 138,9 [ 117,5-175,3] мг/дл исходно и 45,0 [ 36,0-65,0] мг/дл по окончании исследования (р<0,001).
Заключение
ВСУЗИ, ОКТ и МСКТ позволяют не только выявлять уязвимые АСБ и достоверно прогнозировать риск развития коронарных осложнений, но и отслеживать динамику атеросклеротического процесса и эффективность проводимого лечения — как инвазивного, так и медикаментозного.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Shah PK. Mechanisms of plaque vulnerability and rupture. J Am Coll Cardiol. 2003;19;41(4):15S-22S. doi:10.1016/s0735-1097(02)02834-6.
2. Mann JM, Davies MJ. Vulnerable plaque. Relation of characteristics to degree of stenosis in human coronary arteries. Circulation. 1996;94(5):928-31. doi:10.1161/01.cir.94.5.928.
3. Ako J, Hibi K, Tsujita K, et al. Effect of alirocumab on coronary atheroma volume in japanese patients with acute coronary syndrome — The ODYSSEY J-IVUS trial. Circ J. 2019;83:2025-33. doi:10.1253/circj.CJ-19-0412.
4. Nicholls SJ, Puri R, Anderson T, et al. Effect of Evolocumab on Progression of Coronary Disease in Statin-Treated Patients: The GLAGOV Randomized Clinical Trial. JAMA. 2016;13;316(22):2373-84. doi:10.1001/jama.2016.16951.
5. Räber L, Ueki Y, Otsuka T, et al. Effect of alirocumab added to high-intensity statin therapy on coronary atherosclerosis in patients with acute myocardial infarction: the PACMAN-AMI randomized clinical trial. JAMA. 2022;327:1771-81. doi:10.1001/jama.2022.5218.
6. Gao F, Wang ZJ, Ma XT, et al. Effect of alirocumab on coronary plaque in patients with coronary artery disease assessed by optical coherence tomography. Lipids Health Dis. 2021;12;20(1):106. doi:10.1186/s12944-021-01528-3.
7. Nicholls SJ, Kataoka Y, Nissen SE, et al. Effect of Evolocumab on Coronary Plaque Phenotype and Burden in Statin-Treated Patients Following Myocardial Infarction. JACC Cardiovasc Imaging. 2022;15(7):1308-21. doi:10.1016/j.jcmg.2022.03.002.
8. Yano H, Horinaka S, Ishimitsu T. Effect of evolocumab therapy on coronary fibrous cap thickness assessed by optical coherence tomography in patients with acute coronary syndrome. J Cardiol. 2020;75:289-95. doi:10.1016/j.jjcc.2019.08.002.
9. Sugizaki Y, Otake H, Kawamori H, et al. Adding alirocumab to rosuvastatin helps reduce the vulnerability of thin-cap fibroatheroma: an ALTAIR trial report. JACC Cardiovasc Imaging. 2020;13:1452-4. doi:10.1016/j.jcmg.2020.01.021.
10. Pérez de Isla L, Díaz-Díaz JL, Romero MJ, et al. Alirocumab and Coronary Atherosclerosis in Asymptomatic Patients with Familial Hypercholesterolemia: The ARCHITECT Study. Circulation. 2023;147(19):1436-43. doi:10.1161/CIRCULATIONAHA.122.062557.
11. Fishbein MC. The vulnerable and unstable atherosclerotic plaque. Cardiovasc Pathol. 2010;19(1):6-11. doi:10.1016/j.carpath.2008.08.004.
12. Virmani R, Kolodgie FD, Burke AP, et al. Lessons from sudden coronary death: a comprehensive morphological classification scheme for atherosclerotic lesions. Arterioscler Thromb Vasc Biol. 2000;20(5):1262-75. doi:10.1161/01.atv.20.5.1262.
13. Davies MJ. Anatomic features in victims of sudden coronary death: coronary artery pathology. Circulation. 1992;85:119-24.
14. Potkin BN, Bartorelli AL, Gessert JM, et al. Coronary artery imaging with intravascular high-frequency ultrasound. Circulation. 1990;81(5):1575-85. doi:10.1161/01.cir.81.5.1575.
15. Räber L, Mintz GS, Koskinas KC, et al. ESC Scientific Document Group. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39(35):3281-300. doi:10.1093/eurheartj/ehy285.
16. Fazel R, Yeh RW, Cohen DJ, et al. Intravascular imaging during percutaneous coronary intervention: temporal trends and clinical outcomes in the USA. Eur Heart J. 2023;44(38):3845-55. doi:10.1093/eurheartj/ehad430.
17. Кочергин Н. А., Кочергина А. М. Возможности оптической когерентной томографии и внутрисосудистого ультразвука в выявлении нестабильных бляшек в коронарных артериях. Кардиоваскулярная терапия и профилактика. 2022;21(1):2909. doi:10.15829/1728-8800-2022-2909.
18. Nelles G, Abdelwahed YS, Alyaqoob A, et al. Spotty calcium deposits within acute coronary syndrome (ACS)-causing culprit lesions impact inflammatory vessel-wall interactions and are associated with higher cardiovascular event rates at one year follow-up: Results from the prospective translational OPTICO-ACS study program. Atherosclerosis. 2023;385:117284. doi:10.1016/j.atherosclerosis.2023.117284.
19. Gerhardt T, Seppelt C, Abdelwahed YS, et al. Culprit plaque morphology determines inflammatory risk and clinical outcomes in acute coronary syndrome. Eur Heart J. 2023;44(38):3911-25. doi:10.1093/eurheartj/ehad334.
20. Baaten CCFMJ, Nagy M, Bergmeier W, et al. Platelet biology and function: plaque erosion vs. rupture. Eur Heart J. 2024;45(1):18-31. doi:10.1093/eurheartj/ehad720.
21. Gutiérrez-Chico JL, Alegría-Barrero E, Teijeiro-Mestre R, et al. Optical Coherence Tomography From Research to Practice. Eur. Heart J. Cardiovasc. Imaging. 2012;13(5):370-84. doi:10.1093/ehjci/jes025.
22. Kume T, Uemura S. Current clinical applications of coronary optical coherence tomography. Cardiovasc Interv Ther. 2018;33(1):1-10. doi:10.1007/s12928-017-0483-8.
23. Maehara A, Matsumura M, Ali ZA, et al. IVUS-Guided Versus OCT-Guided Coronary Stent Implantation: A Critical Appraisal. JACC CardiovascImaging. 2017;10(12):1487-503. doi:10.1016/j.jcmg.2017.09.008.
24. Kang DY, Ahn JM, Yun SC, et al. Optical Coherence Tomography-Guided or Intravascular Ultrasound-Guided Percutaneous Coronary Intervention: The OCTIVUS Randomized Clinical Trial. Circulation. 2023;148(16):1195-206. doi:10.1161/CIRCULATIONAHA.123.066429.
25. Bourantas CV, Jaffer FA, Gijsen FJ, et al. Hybrid intravascular imaging: recent advances, technical considerations, and current applications in the study of plaque pathophysiology. Eur. Heart J. 2017;38(6):400-12. doi:10.1093/eurheartj/ehw097.
26. Legutko J, Bryniarski KL, Kaluza GL, et al. Intracoronary Imaging of Vulnerable Plaque-From Clinical Research to Everyday Practice. J Clin Med. 2022;11(22):6639. doi:10.3390/jcm11226639.
27. Kubo T, Terada K, Ino Y, et al. Combined Use of Multiple Intravascular Imaging Techniques in Acute Coronary Syndrome. Front Cardiovasc Med. 2022;8:824128. doi:10.3389/fcvm.2021.824128.
28. Gurgoglione FL, Denegri A, Russo M, et al. Intracoronary Imaging of Coronary Atherosclerotic Plaque: From Assessment of Pathophysiological Mechanisms to Therapeutic Implication. Int J Mol Sci. 2023;24(6):5155. doi:10.3390/ijms24065155.
29. Puchner SB. Liu T, Mayrhofer T, et al. High-risk plaque detected on coronary CT angiography predicts acute coronary syndromes independent of significant stenosis in acute chest pain: results from the ROMICAT-II trial. J Am Coll Cardiol. 2014;64(7):684-92. doi:10.1016/j.jacc.2014.05.039.
30. Han D, Lin A, Kuronuma K, et al. Association of Plaque Location and Vessel Geometry Determined by Coronary Computed Tomographic Angiography With Future Acute Coronary Syndrome-Causing Culprit Lesions. JAMA Cardiol. 2022;7(3):309-19. doi:10.1001/jamacardio.2021.5705.
31. Шария М. А., Шабанова М. С., Веселова Т. Н. и др. Сопоставление результатов компьютерной томографии и внутрисосудистого ультразвукового исследования в оценке параметров атеросклеротических бляшек коронарных артерий. Медицинская визуализация. 2018;(4):7-19. doi:10.24835/1607-0763-2018-4-7-19.
32. Kashiwagi M, Tanaka A, Kitabata H, et al. Comparison of diagnostic accuracy between multidetector computed tomography and virtual histology intravascular ultrasound for detecting optical coherence tomography-derived fibroatheroma. Cardiovasc Interv Ther. 2014;29(2):102-8. doi:10.1007/s12928-013-0219-3.
33. Hoffmann U, Moselewski F, Nieman K, et al. Noninvasive Assessment of Plaque Morphology and Composition in Culprit and Stable Lesions in Acute Coronary Syndrome and Stable Lesions in Stable Angina by Multidetector Computed Tomography. J Am Coll Cardiol. 2006;47(8):1655-62. doi:10.1016/j.jacc.2006.01.041.
34. Pundziute G, Schuijf JD, Jukema JW, et al. Head-to-Head Comparison of Coronary Plaque Evaluation Between Multislice Computed Tomography and Intravascular Ultrasound Radiofrequency Data Analysis. JACC: Cardiovascular Interventions. 2008;1(2):176-82. doi:10.1016/j.jcin.2008.01.007.
35. Kinoshita D, Suzuki K, Usui E, et al. High-Risk Plaques on Coronary Computed Tomography Angiography: Correlation With Optical Coherence Tomography. JACC Cardiovasc Imaging. 2024;17(4):382-91. doi:10.1016/j.jcmg.2023.08.005.
36. Gallone G, Bellettini M, Gatti M, et al. Coronary Plaque Characteristics Associated With Major Adverse Cardiovascular Events in Atherosclerotic Patients and Lesions: A Systematic Review and Meta-Analysis. JACC Cardiovasc Imaging. 2023;16(12):1584-604. doi:10.1016/j.jcmg.2023.08.006.
37. Rudd JH, Myers KS, Bansilal S, et al. Atherosclerosis inflammation imaging with 18F-FDG PET: carotid, iliac, and femoral uptake reproducibility, quantification methods, and recommendations. J Nucl Med. 2008;49(6):871-8. doi:10.2967/jnumed.107.050294.
38. Lee J, On YK, Lee EJ, et al. Reversal of vascular 18F-FDG uptake with plasma high-density lipoprotein elevation by atherogenic risk reduction. J Nucl Med. 2008;49(8):1277-82. doi:10.2967/jnumed.108.052233.
39. Rogers IS, Nasir K, Figueroa AL, et al. Feasibility of FDG imaging of the coronary arteries: comparison between acute coronary syndrome and stable angina. JACC Cardiovasc Imaging. 2010;3(4):388-97. doi:10.1016/j.jcmg.2010.01.004.
40. Rudd JH, Narula J, Strauss HW, et al. Imaging atherosclerotic plaque inflammation by fluorodeoxyglucose with positron emission tomography: ready for prime time? J Am Coll Cardiol. 2010;55(23):2527-35. doi:10.1016/j.jacc.2009.12.061.
41. Ежов М. В., Кухарчук В. В., Сергиенко И. В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471.
42. Шикалева А. А., Максимов М. Л., Киселева Н. М. и др. Ингибиторы пропротеин конвертазы субтилизин/ кексин типа 9 (PCSK9) в лечении дислипидемии. Медицинский Совет. 2020;(21):12-8. doi:10.21518/2079-701X-2020-21-12-18.
43. Robinson JG. Contemporary evidence-based guidelines: practice based on the strongest evidence. Mayo Clin Proc. 2014;89(9):1176-82. doi:10.1016/j.mayocp.2014.07.008.
44. Nissen SE, Stroes E, Dent-Acosta RE, et al.; GAUSS-3 Investigators. Efficacy and Tolerability of Evolocumab vs Ezetimibe in Patients With Muscle-Related Statin Intolerance: The GAUSS-3 Randomized Clinical Trial. JAMA. 2016;315(15):1580-90. doi:10.1001/jama.2016.3608.
45. Raal FJ, Stein EA, Dufour R, et al. RUTHERFORD-2 Investigators. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. Lancet. 2015;385(9965):331-40. doi:10.1016/S0140-6736(14)61399-4.
46. Cannon CP, Cariou B, Blom D, et al. ODYSSEY COMBO II Investigators. Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolaemia on maximally tolerated doses of statins: the ODYSSEY COMBO II randomized controlled trial. Eur Heart J. 2015;36(19):1186-94. doi:10.1093/eurheartj/ehv028.
47. Suzuki N, Yokoi T, Kimura T, et al. Risk Factors for Vulnerable Plaque Detected Using Near-Infrared Spectroscopy in Patients Receiving Statin Therapy with No History of Coronary Artery Disease. Int Heart J. 2023;64(4):577-83. doi:10.1536/ihj.23-011.
Об авторах
Г. Р. БикбаеваРоссия
Бикбаева Гузель Рунаровна — врач-кардиолог ГБУЗ СОККД им. В.П. Полякова; аспирант кафедры пропедевтической терапии с курсом кардиологии ФГБОУ ВО СамГМУ Минздрава России.
Самара
Конфликт интересов:
Нет
А. Н. Ковальская
Россия
Ковальская Анна Николаевна — врач-кардиолог, аспирант кафедры пропедевтической терапии с курсом кардиологии.
Самара
Конфликт интересов:
Нет
К. В. Кузнецова
Россия
Кузнецова Карина Владиславовна — врач-кардиолог ГБУЗ СОККД им. В.П. Полякова; аспирант кафедры пропедевтической терапии с курсом кардиологии ФГБОУ ВО СамГМУ Минздрава России.
Самара
Конфликт интересов:
Нет
Т. В. Павлова
Россия
Павлова Татьяна Валентиновна — д. м. н., профессор, зав. отделением клинических исследований кафедры пропедевтической терапии с курсом кардиологии ФГБОУ ВО СамГМУ Минздрава России.
Самара
Конфликт интересов:
Нет
Д. В. Дупляков
Россия
Дупляков Дмитрий Викторович — д. м. н., профессор, зам. главного врача по медицинской части ГБУЗ СОККД им. В.П. Полякова; зав. кафедрой пропедевтической терапии с курсом кардиологии ФГБОУ ВО СамГМУ Минздрава России.
Самара
Конфликт интересов:
Нет
Дополнительные файлы
- Показана важная роль визуализирующих методов в выявлении уязвимой атеросклеротической бляшки.
- Внутрисосудистое ультразвуковое исследование, оптическая когерентная томография и мультиспиральная компьютерная томография способны прогнозировать риск развития коронарных осложнений.
- Визуализирующие методы позволяют отслеживать динамику атеросклеротического процесса и эффективность проводимого лечения.
Рецензия
Для цитирования:
Бикбаева Г.Р., Ковальская А.Н., Кузнецова К.В., Павлова Т.В., Дупляков Д.В. Роль визуализирующих методов в оценке уязвимых бляшек и эффективности гиполипидемической терапии. Российский кардиологический журнал. 2024;29(8):5984. https://doi.org/10.15829/1560-4071-2024-5984. EDN: FRLPZA
For citation:
Bikbaeva G.R., Kovalskaya A.N., Kuznetsova K.V., Pavlova T.V., Duplyakov D.V. Role of imaging techniques in the assessment of vulnerable plaques and the effectiveness of lipid-lowering therapy. Russian Journal of Cardiology. 2024;29(8):5984. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5984. EDN: FRLPZA
JATS XML

















































