Перейти к:
Динапения и пресаркопения у пациентов с коронарным атеросклерозом: клинические предикторы и структурно-функциональные особенности сердца
https://doi.org/10.15829/1560-4071-2025-5967
EDN: NIHATL
Аннотация
Цель. Оценить частоту распространенности динапении, пресаркопении и связь данных патологий со структурно-функциональными параметрами сердца у пациентов с коронарным атеросклерозом.
Материал и методы. В исследование включено 136 человек со стабильными формами ишемической болезни сердца (ИБС). Для измерения мышечной силы пациентам выполнялась динамометрия. У женщин признаком снижения мышечной силы являлось снижение захвата <16 кг, у мужчин — <27 кг (согласно рекомендациям Writing Group for the European Working Group on Sarcopenia in Older People 2 от 2019г). Всем пациентам выполнялась компьютерная томография с последующим расчетом скелетно-мышечного индекса (СМИ, см²/м²). Пороговыми значениями СМИ, снижение относительно которых расценивалось как уменьшение объема мышечной ткани по сравнению с нормой, являлись 52,4 см²/м² для мужчин и 38,5 см²/м² для женщин. При наличии у пациентов изолированного снижения СМИ по данным компьютерной томографии состояние классифицировалось как пресаркопения; при снижении мышечной силы по данным динамометрии, состояние расценивалось как динапения. Всем пациентам выполнялась эхокардиография по стандартной методике.
Результаты. При проведении анализа установлено, что лица с пресаркопенией были представлены исключительно мужским полом и были более высокого роста 175 (168; 179) см по сравнению с лицами, имеющими нормальную мышечную массу: рост 166 (159; 172,5) см (р=0,001), однако индекс массы тела при наличии пресаркопении был меньше — 27,3 (24,4; 30,3) кг/м² и 29,5 (25,8; 33,1) кг/м² — у лиц без данной патологии (р=0,02). При сравнении эхокардиографических параметров установлено меньшее значение фракции выброса левого желудочка (ЛЖ) среди пациентов с пресаркопенией. Конечный диастолический объем ЛЖ, конечный систолический объем ЛЖ, конечный диастолический размер ЛЖ и конечный систолический размер ЛЖ были в группе пациентов с пресаркопенией больше в сравнении с остальными пациентами (p<0,05). У пациентов с пресаркопенией чаще в анамнезе регистрировался перенесенный инфаркт миокарда (24 пациента, что составило 68,6% от данной группы против 41 (46,6%) — из группы без пресаркопении) (р=0,02). Пациенты с динапенией отличались по следующим параметрам: соответствовали более старшему возрасту — 68 (65,6; 71,4) лет по сравнению с остальной выборкой — 65 лет (63; 67,9), большей своей частью были представлены женщинами (74,2%) с менее высоким ростом — 164 (159,6; 165,4) см по сравнению с лицами без динапении — 170 (168; 172) см (p<0,05). У пациентов с динапенией чаще в анамнезе встречался сахарный диабет 2 типа и хроническая болезнь почек (p<0,05).
Заключение. Пациенты с пресаркопенией и ИБС чаще имеют в анамнезе перенесенный инфаркт миокарда и больше размеры и объемы полости ЛЖ. Пациенты с динапенией и коронарным атеросклерозом чаще принадлежат к женскому полу, имеют более низкий рост, чаще страдают хронической болезнью почек и сахарным диабетом.
Ключевые слова
Для цитирования:
Неешпапа А.Г., Каретникова В.Н., Кривошапова К.Е., Карпова Е.И., Коков А.Н., Барбараш О.Л. Динапения и пресаркопения у пациентов с коронарным атеросклерозом: клинические предикторы и структурно-функциональные особенности сердца. Российский кардиологический журнал. 2025;30(1):5967. https://doi.org/10.15829/1560-4071-2025-5967. EDN: NIHATL
For citation:
Neeshpapa A.G., Karetnikova V.N., Krivoshapova K.E., Karpova E.I., Kokov A.N., Barbarash O.L. Dynapenia and presarcopenia in patients with coronary atherosclerosis: clinical predictors and cardiac structural and functional features. Russian Journal of Cardiology. 2025;30(1):5967. (In Russ.) https://doi.org/10.15829/1560-4071-2025-5967. EDN: NIHATL
Саркопения, являясь прогрессирующим генерализованным заболеванием скелетной мускулатуры, характеризуется низкой мышечной силой, уменьшением количества мышц или низким их качеством и сопровождается снижением физической работоспособности пациента [1]. Распространенность саркопении составляет 5-13% среди лиц старше 60 лет и 11-50% — в возрастной категории старше 80 лет. Существует ряд определений и критериев саркопении, использующих разные пороговые значения количественных диагностических параметров и приводящих к отсутствию стандартизации, что затрудняет их применение в клинической практике [2][3]. Согласно рекомендациям Writing Group for the European Working Group on Sarcopenia in Older People 2 2019 г (EWGSOP2), низкая мышечная сила является основным критерием саркопении, поскольку именно мышечная сила служит наиболее надежным показателем мышечной функции в целом. Диагноз саркопении становится вероятным при обнаружении низкой мышечной силы, а подтверждается при уменьшении количества или снижении качества мышц [1]. Консенсус EWGSOP (2010) также отдельно выделяет термин "пресаркопения" [4], которая является доклинической стадией саркопении, и характеризуется снижением массы скелетных мышц без снижения мышечной силы или функции. Пресаркопения — это первая стадия заболевания и обязательный пункт для постановки диагноза "саркопения" [4]. Также в 2008г Clark BC, et al. ввели термин динапения [5], при которой снижение мышечной силы не обязательно сопровождается уменьшением массы скелетных мышц, при этом измерение массы/объема скелетных мышц не всегда требуется для диагностики динапении [6]. Предполагается, что ишемическая болезнь сердца (ИБС) и саркопения имеют общие механизмы развития. У пациентов с сердечно-сосудистыми заболеваниями (ССЗ) системное воспаление, окислительный стресс, эндотелиальная дисфункция, снижение мышечного кровотока, нарушения углеводного обмена, возрастные изменения гормонального фона и сниженная физическая активность (как в силу возраста, так и вследствие ограничений, вызванных ССЗ), вероятно, способствуют саркопении, связанной с кардиологической патологией [7]. Метаанализ Pacifico J, et al. (2020) продемонстрировал высокую распространенность саркопении при ИБС (до трети пациентов) [8].
Изучение взаимного влияния нарушений мышечного статуса и ИБС, учитывая возраст-ассоциированное увеличение их распространенности, является актуальным и значимым для клинической практики.
Целью исследования являлось оценить частоту выявления динапении, пресаркопении и их связь со структурно-функциональными параметрами сердца у пациентов с коронарным атеросклерозом.
Материал и методы
В исследование включено 136 человек, поступивших в Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний г. Кемерово для планового чрескожного коронарного вмешательства. Предварительно минимальный объем выборки был рассчитан при помощи калькулятора размера выборки1 и составил 94 пациента. Перед включением в исследование пациентами подписывалось добровольное информированное согласие, одобренное локальным этическим комитетом Научно-исследовательского института комплексных проблем сердечно-сосудистых заболеваний, протокол № 12 от 27.12.2019. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Формирование выборки проводилось в сплошном порядке, основными критериями включения являлись: возраст, превышающий 18 лет, стабильная на момент госпитализации ИБС (стенокардия I-III функционального класса и/или постинфарктный кардиосклероз), целью госпитализации являлось выполнение планового чрескожного коронарного вмешательства. Применены следующие критерии исключения: установленные заболевания нервно-мышечной системы, длительная терапия глюкокортикостероидами, цитостатиками, антидепрессантами, миорелаксантами и барбитуратами. Медиана возраста пациентов составила 66 (64; 68) лет. В выборке преобладали лица мужского пола — 81 (59,6%), все включенные женщины были в периоде постменопаузы, 53 пациента (38%) страдали ожирением (I-III степень), 95,6% — имели фоновую гипертоническую болезнь; инфаркт миокарда (ИМ) в анамнезе встречался у половины пациентов, при этом у большинства из них была сохранная фракция выброса (ФВ) левого желудочка (ЛЖ). У всех пациентов был установлен диагноз хронической сердечной недостаточности (ХСН), у большего числа (58,8%) она соответствовала I стадии (по классификации Стражеско-Василенко). Основные клинико-анамнестические характеристики участников исследования представлены в таблице 1.
Таблица 1
Характеристика пациентов с коронарным атеросклерозом, поступивших для планового чрескожного коронарного вмешательства
Признак | Значение | |
Возраст, лет (Me, Q25; Q75) | 66 (64; 68) | |
Пол, n (%) | мужчины 81 (59,6) | |
женщины 55 (40,4) | ||
Вес (Me, Q25; Q75) | 81 (71,5; 95) | |
Рост, см (Me, Q25; Q75) | 168 (162; 175) | |
Индекс массы тела, кг/м² (Me, Q25; Q75) | 29 (25,3; 33,9) | |
Ожирение, n (%) | I степень | 35 (25,7) |
II степень | 15 (11) | |
III степень | 3 (2,2) | |
Пресаркопения, n (%) | 36 (26,5) | |
Динапения, n (%) | 31 (22,7) | |
Характер поражения коронарного русла, n (%) | однососудистое | 41 (30,1) |
двухсосудистое | 52 (38,2) | |
трехсосудистое | 43 (31,6) | |
Инфаркт миокарда в анамнезе, n (%) | 71 (52,2) | |
Фибрилляция предсердий, n (%) | 24 (17,3) | |
Гипертоническая болезнь, n (%) | 130 (95,6) | |
Хроническая сердечная недостаточность (стадии), n (%) | I стадия | 80 (58,8) |
IIа стадия | 53 (39) | |
IIб стадия | 3 (2,2) | |
Хроническая сердечная недостаточность (функциональный класс), n (%) | I | 12 (8,8) |
II | 116 (85,3) | |
III | 8 (5,9) | |
Сахарный диабет 2 типа, n (%) | 43 (31,6) | |
Курение, n (%) | 26 (19,1) | |
Острое нарушение мозгового кровообращения в анамнезе, n (%) | 10 (7,4) | |
Хроническая болезнь почек, n (%) | 44 (32,4) | |
Хроническая обструктивная болезнь почек, n (%) | 2 (1,5) | |
Скелетно-мышечный индекс, см²/м² (Me, Q25; Q75) | 52,69 (50,3; 55,3) | |
Площадь мышц, см² (Me, Q25; Q75) | 149,3 (119,4; 178,9) | |
КДО ЛЖ, мл (Me, Q25; Q75) | 135 (113; 154) | |
КСО ЛЖ, мл (Me, Q25; Q75) | 44 (40; 62) | |
Ударный объем ЛЖ, мл (Me, Q25; Q75) | 83 (72; 95,5) | |
КДР ЛЖ, см (Me, Q25; Q75) | 5,3 (4,9; 5,6) | |
КСР ЛЖ, см (Me, Q25; Q75) | 3,3 (3,17; 3,8) | |
Задняя стенка ЛЖ, см (Me, Q25; Q75) | 1,1 (1,1; 1,2) | |
Межжелудочковая перегородка, см (Me, Q25; Q75) | 1,2 (1,0; 1,3) | |
ФВ ЛЖ, % (Me, Q25; Q75) | 64 (60; 68) | |
Соотношение E/A (Me, Q25; Q75) | 0,69 (0,66; 0,84) | |
Индекс массы миокарда, г/м² (Me, Q25; Q75) | 121 (104; 144) | |
Левое предсердие, см (Me, Q25; Q75) | 4,3 (4,0; 4,6) | |
Правый желудочек, см (Me, Q25; Q75) | 2,7 (2,3; 2,9) | |
Сокращения: КДО — конечный диастолический объем, КДР — конечный систолический размер, КСО — конечный систолический объем, КСР — конечный систолический размер, ЛЖ — левый желудочек, ФВ — фракция выброса.
В Российской Федерации в настоящее время отсутствуют рекомендации как по саркопении, так и по ее компонентам в виде динапении и пресаркопении, в связи с этим данные патологические состояния верифицировали в соответствии с рекомендациями европейской рабочей группы EWGSOP2 от 2019г [1]. Всем пациентам выполнялась динамометрия в качестве простого и информативного метода измерения мышечной силы. Использовался медицинский динамометр ДМЭР-120 (АО "Твес", Россия). Сила захвата определялась двумя последовательными измерениями на каждой руке с выбором наилучшего результата. У женщин признаком снижения мышечной силы являлось снижение захвата <16 кг, у мужчин <27 кг (EWGSOP2, 2019) [1].
Для расчета количества мышечной ткани пациентам выполнялась компьютерная томография на мультиспиральном компьютерном томографе Somatom Sensation 64 (Siemens, Германия). Ручным методом были очерчены контуры мышц (большой поясничной мышцы, квадратной мышцы спины, подвздошно-реберных мышц, наружных косых мышц живота, паравертебральных мышц) на уровне тела L3-позвонка. Диапазон аттенуации составил 29-150 HU. В последующем рассчитывался скелетно-мышечный индекс (СМИ) — площадь мышечной ткани, нормализованная к квадрату показателя роста пациента (см²/м²). Пороговыми значениями СМИ, снижение относительно которых расценивалось как уменьшение объема мышечной ткани по сравнению с нормой, являлись 52,4 см²/м² для мужчин и 38,5 см²/м² для женщин [9][10]. При наличии у пациентов изолированного снижения СМИ по данным компьютерной томографии без сопутствующего снижения силы и функции мышц, состояние классифицировалось как пресаркопения, при снижении мышечной силы по данным динамометрии, состояние расценивалось как динапения. Эхокардиография выполнялась на аппарате "GE VIVID T8" (General Electric, США) цветным допплеровским сканированием и двухмерным методом по стандартной методике. ФВ оценивалась биплановым методом.
Статистический анализ. Для проведения статистических расчетов использовалась программа MedCalc, версия 20.215-64 bit (Бельгия). Проверка на нормальное распределение количественных данных выполнялась с помощью критерия Шапиро-Уилка, распределение рассматриваемых данных не являлось нормальным. Количественные показатели в статье представлены в виде медианы и квартильного размаха в скобках (Ме (Q25; Q75)). Качественные — в виде частот и процентов (n, %). Сравнительный анализ по количественному признаку среди двух групп выполнялся при помощи U-критерия Манна-Уитни; по качественному показателю сравнение групп проводилось с расчетом χ² Пирсона. Уровень статистической значимости принимался при p<0,05. ROC-кривые (ROC — Receive Operative Curve) применялись для расчета порогового значения показателей с учетом сочетания оптимальных значений специфичности и чувствительности. Качество модели рассматривалось как хорошее/среднее при р<0,05 и площадью под ROC-кривой (AUC) >0,6-0,7. Логистический регрессионный анализ выполнялся по методу пошагового отбора, на основании параметров, показавших свою значимость при выполнении однофакторного типа анализа.
Результаты
При анализе группы пациентов с пресаркопенией было установлено, что все они представлены мужчинами более высокого роста 175 (168; 179) см по сравнению с лицами, имеющими нормальную мышечную массу (рост 166 (159; 172,5) см (р=0,001)), однако индекс массы тела при наличии пресаркопении был меньше — 27,3 (24,4; 30,3) кг/м² и 29,5 (25,8; 33,1) кг/м² — у лиц без данной патологии (р=0,02). Закономерно СМИ в группе пресаркопении также был меньше (р=0,0001). При сравнении основных эхокардиографических параметров установлено меньшее значение ФВ среди пациентов с пресаркопенией, а такие показатели как конечный диастолический объем (КДО), конечный систолический объем (КСО), конечный диастолический размер (КДР) и конечный систолический размер (КСР) ЛЖ были значимо больше в сравнении с остальными пациентами выборки. При этом КСО (норма 21-61 мл) в группе пресаркопении превышал верхнюю границу нормы [11], остальные показатели соответствовали нормативному диапазону. У пациентов с пресаркопенией значимо чаще в анамнезе регистрировался перенесенный ИМ (24 больных (68,6%) против 41 (46,6%) — из группы без пресаркопении (р=0,02)). Данные, по которым отмечены различия групп, представлены в таблице 2.
Таблица 2
Особенности пациентов с ИБС в зависимости от наличия пресаркопении
Показатель | Группа пациентов с пресаркопенией | Группа пациентов без пресаркопении | Уровень значимости, р |
Мужской пол, n (%) | 36 (100) | — | — |
Рост, см (Me, Q25; Q75) | 175 (168; 179) | 166 (159; 172,5) | 0,001 |
Индекс массы тела, кг/м² (Me, Q25; Q75) | 27,3 (24,4; 30,3) | 29,5 (25,8; 33,1) | 0,02 |
Скелетно-мышечный индекс, см²/м² (Me, Q25; Q75) | 45,5 (42,7; 49,1) | 56,7 (49,5; 63,2) | 0,0001 |
Инфаркт миокарда в анамнезе, n (%) | 24 (68,6) | 41 (46,6) | 0,02 |
ФВ ЛЖ, % (Me, Q25; Q75) | 62 (52,2; 64) | 65 (61; 69) | 0,0040 |
КСР ЛЖ, см (Me, Q25; Q75) | 3,7 (3,2; 4,2) | 3,3 (3,0; 3,6) | 0,0053 |
КДР ЛЖ, см (Me, Q25; Q75) | 5,5 (5,2; 5,9) | 5,2 (4,8; 5,5) | 0,0085 |
КСО ЛЖ, мл (Me, Q25; Q75) | 66 (41,7; 82) | 44 (35; 54) | 0,0035 |
КДО ЛЖ, мл (Me, Q25; Q75) | 147 (130; 173) | 130 (108; 147) | 0,0092 |
Сокращения: КДО — конечный диастолический объем, КДР — конечный систолический размер, КСО — конечный систолический объем, КСР — конечный систолический размер, ЛЖ — левый желудочек, ФВ — фракция выброса.
В результате ROC-анализа свою значимость показали рост и эхокардиографические (КДО ЛЖ, КСО ЛЖ, КДР ЛЖ, КСР ЛЖ, ФВ ЛЖ). Подробные статистические данные представлены в таблице 3 и на рисунке 1.
Таблица 3
Площадь под характеристической ROC-кривой, 95% доверительный интервал показателей, ассоциированных с пресаркопенией
Показатели | AUC | Уровень значимости, p | 95% ДИ | Пороговое значение | Чувствительность | Специфичность | |
Нижняя граница | Верхняя граница | ||||||
КДО ЛЖ, мл | 0,666 | 0,007 | 0,571 | 0,752 | >130 | 70,4 | 54,7 |
КСО ЛЖ, мл | 0,686 | 0,0013 | 0,592 | 0,770 | >47 | 63 | 60,5 |
КДР ЛЖ, см | 0,668 | 0,006 | 0,573 | 0,754 | >5,2 | 70,4 | 57,6 |
КСР ЛЖ, см | 0,698 | 0,002 | 0,583 | 0,763 | >3,65 | 50 | 78,5 |
ФВ ЛЖ, % | 0,684 | 0,001 | 0,590 | 0,768 | 62 | 59,3 | 65,1 |
Сокращения: ДИ — доверительный интервал, КДО — конечный диастолический объем, КДР — конечный систолический размер, КСО — конечный систолический объем, КСР — конечный систолический размер, ЛЖ — левый желудочек, ФВ — фракция выброса.
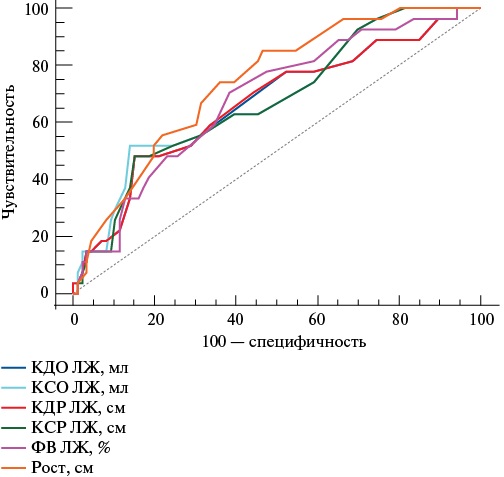
Рис. 1. ROC-кривые параметров, ассоциированных с пресаркопенией.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: КДО — конечный диастолический объем, КДР — конечный диастолический размер, КСО — конечный систолический объем, КСР — конечный систолический размер, ЛЖ — левый желудочек, ФВ — фракция выброса.
В результате бинарной логистической регрессии выявлены два независимых клинических предиктора, ассоциированных с пресаркопенией: рост и ИМ в анамнезе (табл. 4).
Таблица 4
Результаты бинарной логистической регрессии для факторов, ассоциированных с пресаркопенией
Факторы | Отношение шансов | 95% доверительный интервал | Коэффициент | χ² Вальда | Стандартная ошибка | Уровень значимости, p |
Рост, см | 1,124 | 1,06; 1,1895 | 0,117 | 16,56 | 0,028 | <0,0001 |
Инфаркт миокарда в анамнезе | 3,25 | 1,33; 7,9 | 1,179 | 6,71 | 0,4548 | 0,0095 |
Константа | — | — | -21,63 | — | — | — |
Примечание: процент правильной классификации модели составил 77,94%, AUC — 0,771; р<0,0001.
Пациенты с динапенией отличались по следующим параметрам: соответствовали более старшему возрасту — 68 (65,6; 71,4) лет по сравнению с остальной выборкой — 65 лет (63; 67,9), большей частью были представлены женщинами (74,2%) с менее высоким ростом — 164 (159,6; 165,4) см по сравнению с лицами без динапении — 170 (168; 172) см и закономерно имели меньшие значения динамометрии 16 (12,7; 22) кг, при 30 (29; 32) кг в остальной выборке. У пациентов с динапенией чаще в анамнезе встречался сахарный диабет (СД) 2 типа и хроническая болезнь почек (ХБП) (табл. 5).
Таблица 5
Особенности пациентов с динапенией
Показатель | Пациенты с динапенией, n=31 | Пациенты без снижения мышечной силы, n=105 | Уровень значимости, р |
Возраст, лет (Me, Q25; Q75) | 68 (62,7; 73,5) | 65 (60; 70) | 0,03 |
Женский пол, n, % | 23 (74,2) | 32 (30,5) | 0,0001 |
Скелетно-мышечный индекс, см²/м² (Me, Q25; Q75) | 57,9 (54,5; 63,4) | 50,3 (43,6; 59) | 0,0003 |
Рост, см (Me, Q25; Q75) | 164 (157,5; 169,7) | 170 (164; 176) | 0,0010 |
Динамометрия, кг (Me, Q25; Q75) | 16 (11; 22) | 30 (20; 38) | 0,0001 |
Хроническая болезнь почек, n, % | 15 (48,4) | 29 (27,6) | 0,03 |
Сахарный диабет 2 типа, n, % | 15 (48,4) | 29 (27,6) | 0,05 |
В результате ROC-анализа свою значимость у пациентов с динапенией показали следующие параметры: возраст, СМИ, рост (табл. 6, рис. 2).
Таблица 6
Площадь под характеристической ROC-кривой, 95% доверительный интервал показателей, ассоциированных с динапенией
Показатели | AUC | Уровень значимости, p | 95% доверительный интервал | Пороговое значение | Чувствительность | Специфичность | |
Нижняя граница | Верхняя граница | ||||||
Возраст, лет | 0,627 | 0,021 | 0,540 | 0,708 | >64 | 74,2 | 49,5 |
Скелетно-мышечный индекс, см²/м² | 0,714 | 0,001 | 0,631 | 0,788 | >53,4 | 77,4 | 65,7 |
Рост, см | 0,683 | 0,001 | 0,608 | 0,769 | <166 | 71 | 67,6 |
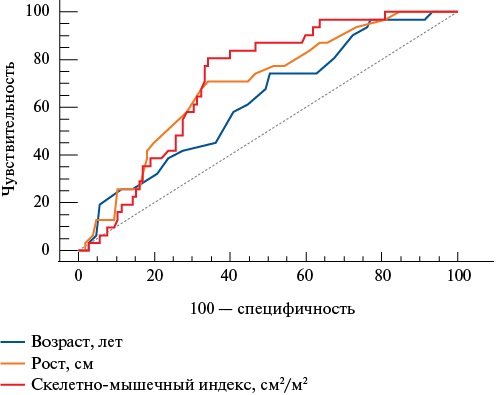
Рис. 2. ROC-кривые параметров, ассоциированных с динапенией.
Примечание: цветное изображение доступно в электронной версии журнала.
Для определения наиболее значимых клинических предикторов динапении выполнен многофакторный анализ методом логистической регрессии, выявлен независимый клинический предиктор, ассоциированный с динапенией: СМИ (табл. 7).
Таблица 7
Результаты бинарной логистической регрессии для факторов, ассоциирующихся с динапенией
Факторы | Отношение шансов | 95% доверительный интервал | Коэффициент | χ² Вальда | Стандартная ошибка | Уровень значимости, p |
Скелетно-мышечный индекс, см²/м² | 1,05 | 1,0148; 1,0927 | 0,051648 | 6,27 | 0,018877 | 0,0062 |
Константа | — | — | -4,05 | — | — |
Примечание: процент правильной классификации модели составил 75%, AUC — 0,714; р=0,0002.
Обсуждение
Помимо общераспространенного мнения о том, что динапения и пресаркопения являются частью одной общей концепции [7], именуемой саркопения, существуют альтернативные взгляды, рассматривающие динапению как независимую патологию со значительной ролью в прогнозе пациентов и имеющую иные патофизиологические пути развития (например, изменения сократительных свойств мышц или нарушения иннервации) [5]. Эти данные требуют дальнейшего изучения. Известно, что динапения связана с повышенным уровнем смертности, снижением нормальной повседневной активности и ухудшением качества жизни. Динапения может рассматриваться как независимый предиктор смертности у пожилых людей, тем не менее ее прогностическая польза для пациентов с ССЗ окончательно не установлена, хотя по данным ограниченного количества исследований, данная патология существенно связана с более высоким уровнем смертности от всех причин у пациентов с ССЗ [12][13]. Существуют данные, что снижение мышечной силы более значимо для риска ССЗ и смертности, чем уменьшение мышечной массы [14]. В проведенном нами исследовании среди пациентов с установленным диагнозом ИБС частота выявления снижения мышечной массы и мышечной силы была схожей (четверть пациентов). При этом среди лиц с динапенией преобладали женщины более старшего возраста, а группа с пресаркопенией представлена мужчинами без существенной разницы по возрасту в сравнении с остальной выборкой. Пациенты с пресаркопенией имели более высокий рост, что можно объяснить принадлежностью всех пациентов с данной патологией к мужскому полу. По результатам некоторых исследований ранее были выявлены различия по большей частоте встречаемости таких нарушений мышечного статуса, как динапения и саркопения (включая ее компоненты) у мужчин и женщин, доступные данные говорят о том, что эти патологии наиболее характерны для лиц женского пола, соответствующих более старшей возрастной категории, что частично (группа динапении) совпадает с нашими результатами [15][16].
Клиническая характеристика пациентов с ИБС и начальными нарушениями мышечного статуса свидетельствует о наличии ХСН. В настоящее время предполагается взаимосвязь между патофизиологическими путями сердечной недостаточности (СН), возрастными изменениями состава тела и саркопенией. Биологически активные вещества, первоначально секретирующиеся при развитии СН в качестве контррегуляторных механизмов в течение длительного времени потенциально могут вызывать повреждение кардиомиоцитов и сосудистой стенки с формированием морфофункциональных нарушений. Кардиоскелетная миопатия взаимосвязана с изменениями миофибрилл, сократительных белков, активностью митохондрий, снижением кровотока и соотношением капилляры/волокона. Данная миопатия при СН, вероятно, связана с непереносимостью физических нагрузок. Распространенность низкой мышечной массы у пациентов с СН варьирует от 19,5% до 47,3% и связана с плохой физической работоспособностью, ухудшением сократительной функции ЛЖ и более высокой частотой госпитализаций, вызванных декомпенсацией. Тем не менее распространенность низкой аппендикулярной массы может существенно варьировать в разных популяциях и в зависимости от критериев, используемых для ее определения, в связи с этим на сегодняшний день все еще недостаточно информации для точной оценки распространенности (пре-)саркопении при СН [17][18]. Согласно полученным в ходе исследования данным путем сравнительного анализа определена связь пресаркопении с рядом структурно-функциональных параметров сердца: более высокими значениями КСР, КДР, КДО и меньшим значением ФВ (однако в рамках фенотипа ХСН с сохраненной ФВ). Данные изменения у пациентов с пресаркопенией можно объяснить большей распространенностью перенесенного ИМ, который запускает каскад изменений в виде начальных проявлений ремоделирования миокарда и скелетной мышечной ткани с уменьшением ее объемов, как дебюта последующих изменений в виде прогрессирующей ХСН и саркопении, что требует динамического наблюдения пациентов с повторным обследованием.
По данным проведенного исследования получена связь динапении с СД 2 типа и ХБП. СД 2 типа является хроническим метаболическим заболеванием с тяжелыми системными последствиями как для макро-, так и для микроциркуляторного русла. Ряд исследований продемонстрировал вклад СД в выраженное нарушение мышечной функции, по сравнению с недиабетической популяцией [19][20]. Более того, СД 2 типа также может способствовать прогрессированию динапении и вызывать снижение мышечной массы, ускоряя дебют различных нарушений мышечного статуса [19]. При сравнении уровня креатинина группы пациентов с динапенией и СД с остальной выборкой не было получено статистически значимых различий. Тем не менее ХБП, как и любое хроническое заболевание, несет риски развития саркопении [21]. Частота влияния ХБП на динапению по литературным данным в настоящее время не определена вследствие ограниченного количества информации по данному вопросу.
В проведенном исследовании среди лиц группы динапении преобладали женщины более старшего возраста, с меньшим ростом, что объясняется половой принадлежностью большинства, входящих в эту группу. Ранее установлено, что структурные и функциональные изменения яичников, которые происходят во время климакса, особенно после менопаузы, вызывают эндокринные изменения и приводят к нарушениям в составе тела [22]. Эти изменения, в свою очередь, могут усиливать развитие неблагоприятных состояний, таких как мышечная слабость — динапения. Распространенность динапении у женщин в постменопаузе варьирует в пределах 18,76-34,4%, что вызывает серьезные опасения по поводу состояния здоровья в целом, учитывая, что динапения является важным фактором риска неблагоприятных исходов в виде саркопении, хрупкости, повышения рисков падений и переломов. Более того, это состояние в целом ассоциировано с высоким риском смертности, что определяет необходимость мониторинга с оценкой уровня мышечной силы [23].
Установленная ассоциация динапении с более высокими значениями СМИ может свидетельствовать об отсутствии единой этиологии и причинно-следственных связей этих состояний: динапения и пресаркопения могут развиваться параллельно в силу разнообразных патогенетических механизмов и факторов [5][15]. По литературным данным, полученным Uchida S, et al. (2020), также отмечено, что снижение силы скелетных мышц с возрастом не демонстрирует прямой корреляции с уменьшением массы/объема скелетных мышц, а вклад мышечной атрофии в снижение мышечной силы относительно невелик [12].
Ограничения исследования. Ограничениями данного исследования служит относительно небольшая выборка пациентов с ИБС и нарушениями состава тела, тем не менее ограниченное количество данных по этой тематике объясняет необходимость проведения дальнейших исследований.
Заключение
Пациенты с пресаркопенией и ИБС чаще имеют в анамнезе перенесенный ИМ и большие размеры и объемы полости ЛЖ сердца. Пациенты с динапенией и коронарным атеросклерозом чаще принадлежат к женскому полу, имеют более низкий рост, чаще страдают ХБП и СД, несмотря на большее значение показателя СМИ по данным компьютерной томографии. Установленные нами ассоциации позволяют рассматривать пресаркопению и динапению не только в виде звеньев одного патологического процесса, именуемого саркопения, но и в качестве изолированных вариантов патологии, не всегда имеющих однозначную взаимосвязь.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. https://socioline.ru/rv.php.
Список литературы
1. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. doi:10.1093/ageing/afy169.
2. Xue Q, Wu J, Ren Y, et al. Sarcopenia predicts adverse outcomes in an elderly population with coronary artery disease: a systematic review and meta-analysis. BMC Geriatr. 2021;21(1):493. doi:10.1186/s12877-021-02438-w.
3. Цыганков Д. А., Кривошапова К. Е., Цыганкова Д. П. Ультразвуковые возможности диагностики саркопенического ожирения (обзор литературы). Российский кардиологический журнал. 2023;28(3S):5345. doi:10.15829/1560-4071-2023-5345.
4. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010;39(4):412-23. doi:10.1093/ageing/afq03420392703.
5. Clark BC, Manini TM. Sarcopenia =/= dynapenia. J Gerontol A Biol Sci Med Sci. 2008;63:829-34. doi:10.1093/gerona/63.8.829.
6. Akishita M, Kozaki K, Iijima K, et al. Chapter 1 Definitions and diagnosis of sarcopenia. Geriatr Gerontol Int. 2018;18(1):7-12. doi:10.1111/ggi.13311.
7. Sasaki KI, Fukumoto Y. Sarcopenia as a comorbidity of cardiovascular disease. J Cardiol. 2022;79(5):596-604. doi:10.1016/j.jjcc.2021.10.013.
8. Pacifico J, Geerlings MAJ, Reijnierse EM, et al. Prevalence of sarcopenia as a comorbid disease: A systematic review and meta-analysis. Exp Gerontol. 2020;131:110801. doi:10.1016/j.exger.2019.110801.
9. Масенко В. Л., Коков А. Н., Григорьева И. И. и др. Лучевые методы диагностики саркопении. Исследования и практика в медицине. 2019;6(4):127-37. doi:10.17709/2409-2231-2019-6-4-13.
10. Amini B, Boyle SP, Boutin RD, et al. Approaches to Assessment of Muscle Mass and Myosteatosis on Computed Tomography: A Systematic Review. J Gerontol A Biol Sci Med Sci. 2019;74(10):1671-8. doi:10.1093/gerona/glz034.
11. Бобров А. Л. Клинические нормы. Эхокардиография. Москва: ГЭОТАР-Медиа, 2020. p. 80. ISBN: 978-5-9704-5893-8.
12. Uchida S, Kamiya K, Hamazaki N, et al. Prognostic utility of dynapenia in patients with cardiovascular disease. Clin Nutr. 2021;40(4):2210-8. doi:10.1016/j.clnu.2020.09.050.
13. Yoshikoshi S, Yamamoto S, Suzuki Y, et al. Associations between dynapenia, cardiovascular hospitalizations, and all-cause mortality among patients on haemodialysis. J Cachexia Sarcopenia Muscle. 2022;13(5):2417-25. doi:10.1002/jcsm.13039.
14. Teixeira IA, Coutinho ESF, Marinho V, et al. Prevalence of dynapenia and overlap with disability, depression, and executive dysfunction. Rev Saude Publica. 2023;57:43. doi:10.11606/s1518-8787.2023057004580.
15. Borges VS, Lima-Costa MFF, Andrade FB. A nationwide study on prevalence and factors associated with dynapenia in older adults: ELSI-Brazil. Cad Saude Publica. 2020;36(4):e00107319. doi:10.1590/0102-311X00107319.
16. Maffei K. Evaluation of dynapenia in the elderly in São Caetano do Sul, São Paulo, Brazil. Fisioterapia em Movimento. 2019;32:e003218. doi:10.1590/1980-5918.032.AO18.
17. Canteri AL, Gusmon LB, Zanini AC, et al. Sarcopenia in heart failure with reduced ejection fraction. Am J Cardiovasc Dis. 2019;9(6):116-26.
18. Xu B, Guo Z, Jiang B, et al. Factors affecting sarcopenia in older patients with chronic diseases. Ann Palliat Med. 2022;11(3):972-83. doi:10.21037/apm-22-201.
19. Santos DNDD, Coelho CG, Diniz MFHS, et al. Dynapenia and sarcopenia: association with the diagnosis, duration and complication of type 2 diabetes mellitus in ELSA-Brasil. Cad Saude Publica. 2024;40(1):e00081223. doi:10.1590/0102-311XEN081223.
20. Takahashi F, Hashimoto Y, Kaji A, et al. Sarcopenia is associated with a risk of mortality in people with type 2 diabetes mellitus. Front endocrinol (Lausanne). 2021;12:783363. doi:10.3389/fendo.2021.783363.
21. Гасанов М. З., Батюшин М. М., Терентьев В. П. и др. Влияние хронической болезни почек на метаболизм мышечной ткани у пациентов на гемодиализе. Южно-Российский журнал терапевтической практики. 2022;3(1):83-8. doi:10.21886/2712-8156-2022-3-1-83-88.
22. Chidi-Ogbolu N, Baar K. Effect of estrogen on musculoskeletal performance and injury risk. Front Physiol. 2019;9:1834. doi:10.3389/fphys.2018.01834.
23. Santos LD, Miranda CG, Silva IESE, et al. Anthropometric indicators as predictors of dynapenia in postmenopausal women. Motriz: Revista de Educação Física. 2022;28:e10220001522. doi:10.1590/S1980-657420220001522.
Об авторах
А. Г. НеешпапаРоссия
Неешпапа Анастасия Геннадьевна — к.м.н., н.с. лаборатории патологии кровообращения отдела клинической кардиологии.
Кемерово
Конфликт интересов:
Нет
В. Н. Каретникова
Россия
Каретникова Виктория Николаевна — д.м.н., профессор кафедры кардиологии и сердечно-сосудистой хирургии КемГМУ; зав. лабораторией патологии кровообращения отдела клинической кардиологии НИИ КПССЗ.
Кемерово
Конфликт интересов:
Нет
К. Е. Кривошапова
Россия
Кривошапова Кристина Евгеньевна — к.м.н., н.с. лаборатории коморбидности при сердечно-сосудистых заболеваниях отдела клинической кардиологии.
Кемерово
Конфликт интересов:
Нет
Е. И. Карпова
Россия
Карпова Евгения Иссаевна — ординатор по специальности кардиология.
Кемерово
Конфликт интересов:
Нет
А. Н. Коков
Россия
Коков Александр Николаевич — д.м.н., в.н.с. лаборатории патологии кровообращения отдела клинической кардиологии.
Кемерово
Конфликт интересов:
Нет
О. Л. Барбараш
Россия
Барбараш Ольга Леонидовна — д.м.н., профессор, академик РАН, директор НИИ КПССЗ; зав. кафедрой кардиологии и сердечно-сосудистой хирургии КемГМУ.
Кемерово
Конфликт интересов:
Нет
Дополнительные файлы
- Нарушения костно-мышечного статуса у пациентов с ишемической болезнью сердца могут быть представлены динапенией и пресаркопенией и встречаются примерно у четверти пациентов.
- Пресаркопения и динапения могут рассматриваться не только как составляющие компоненты саркопении, но и как самостоятельные патологии, не всегда взаимосвязанные между собой.
Рецензия
Для цитирования:
Неешпапа А.Г., Каретникова В.Н., Кривошапова К.Е., Карпова Е.И., Коков А.Н., Барбараш О.Л. Динапения и пресаркопения у пациентов с коронарным атеросклерозом: клинические предикторы и структурно-функциональные особенности сердца. Российский кардиологический журнал. 2025;30(1):5967. https://doi.org/10.15829/1560-4071-2025-5967. EDN: NIHATL
For citation:
Neeshpapa A.G., Karetnikova V.N., Krivoshapova K.E., Karpova E.I., Kokov A.N., Barbarash O.L. Dynapenia and presarcopenia in patients with coronary atherosclerosis: clinical predictors and cardiac structural and functional features. Russian Journal of Cardiology. 2025;30(1):5967. (In Russ.) https://doi.org/10.15829/1560-4071-2025-5967. EDN: NIHATL
JATS XML

















































