Перейти к:
Фенотип семейной гетерозиготной гиперхолестеринемии, обусловленной делецией экзонов 2-10 гена LDLR: клинический случай
https://doi.org/10.15829/1560-4071-2024-5927
EDN: LTZCMT
Аннотация
Введение. Анализ и сопоставление клинико-функциональных особенностей больных семейной гиперхолестеринемией (СГХС) с данными молекулярногенетического исследования позволяют уточнить характер течения заболевания и определить тактику наблюдения пациентов с учетом клиникогенетического статуса. Учитывая то, что в диагностике СГХС ведущими являются биохимические критерии, изучение семейных случаев дополняет представление о заболевании.
Краткое описание. Проведен анализ генеалогического и индивидуального анамнеза, физикальное и общеклиническое обследование троих членов семьи, оценка расширенного липидного спектра, ультразвуковое исследование сосудов. Проведено двухэтапное молекулярно-генетическое исследование: на первом этапе — параллельное секвенирование 60 ассоциированных с СГХС генов, второй этап — оценка ДНК методом Multiplex Ligation-dependent Probe Amplification гена, кодирующего рецептор липопротеинов низкой плотности (low density lipid receptor, LDLR), для выявления крупных делеций.
Дискуссия. Было выявлено, что у пациентов с делецией в экзонах 2-10 гена LDLR выявляются наиболее тяжелые клинико-лабораторные нарушения и раннее развитие сердечно-сосудистых заболеваний.
В семьях с СГХС выявляется наибольшая концентрация геномных нарушений, которые могут приводить к формированию атеросклеротического поражения сосудов даже у детей дошкольного возраста и могут потребовать выйти за рамки стандартной гиполипидемической терапии вплоть до применения новых биологических генно-инженерных препаратов.
Ключевые слова
Для цитирования:
Моисеева А.М., Иванова О.Н., Емельянчик В.С., Емельянчик Е.Ю., Мариловцева О.В., Никулина С.Ю., Протопопов А.В. Фенотип семейной гетерозиготной гиперхолестеринемии, обусловленной делецией экзонов 2-10 гена LDLR: клинический случай. Российский кардиологический журнал. 2024;29(10S):5927. https://doi.org/10.15829/1560-4071-2024-5927. EDN: LTZCMT
For citation:
Moiseeva A.M., Ivanova O.N., Emelyanchik V.S., Emelyanchik E.Yu., Marilovtseva O.V., Nikulina S.Yu., Protopopov A.V. Phenotype of heterozygous familial hypercholesterolemia caused by deletion of LDLR gene exons 2-10: a case report. Russian Journal of Cardiology. 2024;29(10S):5927. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5927. EDN: LTZCMT
Семейная гетерозиготная гиперхолестеринемия (СГХС) имеет более высокую распространенность в Российской популяции по сравнению с европейскими, которая достигает 1:173 [1]. В странах, где отсутствует универсальный и/или таргетный скрининг, выявление пациентов с СГХС не превышает 1% от числа всех больных [2]. Это делает заболевание "невидимым" для большинства врачей амбулаторного звена, особенно, у пациентов до 40 лет; в результате СГХС диагностируется на этапе развития острых форм ишемической болезни сердца (ИБС). Особенно ярко это проявляется у молодых людей с СГХС и субклиническим течением атеросклеротических заболеваний [3].
Учитывая высокий сердечно-сосудистый риск, связанный с длительной экспозицией высоких концентраций холестерина липопротеинов низкой плотности (ЛНП), для стратификации сердечно-сосудистого риска у молодых пациентов необходим анализ корреляции клинических симптомов СГХС и генетической архитектуры заболевания [1][3].
Патогенные варианты гена рецептора ЛНП (low density lipid receptor, LDLR) обусловливают до 80-85% случаев СГХС. Функциональная роль рецептора ЛНП заключается в захвате и связывании частиц на поверхности печёночной клетки и её последующем погружении в клетку для утилизации [4]. В базе вариантов Human Gene Mutation Database Professional 2022.1 описан 2331 уникальный патогенный вариант в LDLR. Из них 18% — это крупные перестройки. Основная причина таких перестроек — относительно высокая частота Alu повторов внутри гена LDLR — 2,2/1 т. п. н.
Аутосомно-доминантный тип наследования заболевания предполагает самую высокую его распространённость в группе наследственных болезней, наличие клинических проявлений у людей обоего пола и поражение 50% потомства в каждом поколении семьи. Так как главным признаком СГХС является ранний старт атеросклеротического поражения сосудов, сопоставление клинических особенностей заболевания с генотипом способно определить его пенетрантность и тяжесть клинических проявлений [5][6]. Соответственно, ведущий вклад сердечно-сосудистых заболеваний (ССЗ) в смертность населения в России стимулирует поиск новых патогенных вариантов LDLR в разных регионах России [7].
Мы представляем клинический случай наблюдения троих членов семьи Х. с СГХС, диагностированной до 40 лет. Среди родственников пробанда 1-2 степени родства обнаружена высокая концентрация пациентов с ранним стартом ИБС, повторными, и в т. ч. фатальными коронарными событиями, несмотря на оказание помощи пациентам в рентген-кардиохирургических стационарах (рис. 1).
Целью данной работы является анализ фенотипических особенностей заболевания в двух поколениях семьи с СГХС и сопоставление клинических данных со структурным вариантом генома пациентов.
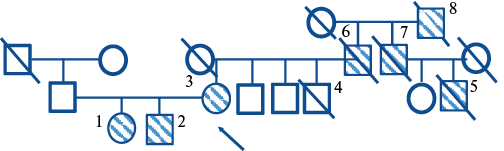
Рис. 1. Генеалогический анамнез семьи Х.
Примечание: штрих — гетерозиготная СГХС. 1 — 11 лет, 2 — 7 лет, 3 — пробанд (35 лет), 4 — погиб трагически в 33 года, 5 — ЧКВ, 2019 и фатальный ОИМ в 55 лет, 6 — фатальный ОИМ в 57 лет, 7 — документировано 4 ОИМ, ЧКВ, аортокоронарное шунтирование до 50 лет (в 54 года — фатальный ОИМ), 8 — внезапная смерть до 40 лет.
Сокращения: ОИМ — острый инфаркт миокарда, СГХС — семейная гиперхолестеринемия, ЧКВ — чрескожное коронарное вмешательство.
Клинический случай
Проведен анализ генеалогического и индивидуального анамнеза, физикальное и общеклиническое обследование, оценка расширенного липидного спектра, ультразвуковое исследование (УЗИ) сосудов у троих членов одной семьи, затем — двухэтапное молекулярно-генетическое исследование: вначале параллельное секвенирование 60 генов, ассоциированных с СГХС, далее — оценка ДНК методом Multiplex Ligation-dependent Probe Amplification (MLPA) гена LDLR для выявления крупных делеций. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен этическими комитетами клинических центров. У всех участников было получено письменное информированное согласие.
Пробанд. Под наблюдением находится женщина 35 лет и двое ее детей. В течение 10 лет у неё отмечаются подъёмы артериального давления (АД) до 195/100 мм рт.ст. Впервые высокий уровень холестерина выявлен в 2011г: общий холестерин (ОХС) 10,48 ммоль/л, ЛНП — 7,68 ммоль/л, лечения не получала. Имеет отягощенный наследственный анамнез по СГХС и ССЗ (рис. 1).
Внешних симптомов дислипидемии (кожных и сухожильных ксантом, ксантелазм, липоидной дуги роговицы) нет, отмечается избыточная масса тела — индекс массы тела =27,1 кг/м2. В 2020г обратилась за медицинской помощью по поводу артериальной гипертензии (АГ), была проведена коронароангиография, изменений в коронарных артериях не выявила; по данным эхокардиографии локальной гипокинезии стенок камер нет, признаки 1 типа диастолической дисфункции. Выставлен диагноз: Гипертоническая болезнь 2 ст., риск 3, гиперлипопротеинемия IIa. С этого момента начала комбинированную антигипертензивную и гиполипидемическую терапию: аторвастатин 40 мг, лозартан 25 мг в сутки.
На фоне непостоянной терапии в 2022г ОХС 10,01 ммоль/л, ЛНП 7,63 ммоль/л, триглицериды (ТГ) 1,75 ммоль/л, липопротеины высокой плотности (ЛВП) 1,58 ммоль/л, коэффициент атерогенности 5,34 (N до 2,6), липопротеин (а) 141,66 нг/мл, аполипопротеин В 2,29 г/л, аполипопротеин А1 1,55 г/л. По данным УЗИ сосудов толщина комплекса интима-медиа (ТКИМ) сонных артерий — 0,5 и 0,6 мм, линейная скорость кровотока с обеих сторон — 63 см/с (допустимые значения), определен стеноз общей сонной артерии 20% и утолщение ТКИМ внутренней сонной артерии справа до 0,8 мм в бифуркации; признаки стенозирования общей бедренной артерии справа до 20%, ТКИМ правой и левой бедренных артерий — 0,7 мм и 0,8 мм. В связи с отсутствием эффективности монотерапии статином, начата комбинированная терапия розувастатин 40 мг + эзетимиб 20 мг.
В мае 2023г контрольное обследование установило резистентность к терапии: ОХС 8,83 ммоль/л, ЛВП 1,99 ммоль/л, липопротеиды очень низкой плотности 0,67 ммоль/л, ТГ 1,47 ммоль/л, ЛНП 6,17 ммоль/л. С ноября 2022г оба ребёнка пробанда обследованы и находятся под наблюдением кардиолога-липидолога в Красноярском краевом клиническом Центре охраны материнства и детства и к маю 2023г получено молекулярно-генетическое подтверждение диагноза СГХС. Согласно Голландским критериям (Dutch Lipid Clinic Network Criteria), число баллов пробанда составило: семейный анамнез 2 + история заболевания 1 + лабораторный анализ 8 + функциональная мутация LDLR 8 =19 баллов.
В связи с этим диагноз переквалифицирован: СГХС, гетерозиготная, определённая. Гиперлипопротеинемия (а). Атеросклероз со стенозированием 20% общей и правой внутренней сонной артерии, бедренных артерий. Гипертоническая болезнь, 3 ст. Очень высокий риск.
Учитывая очень высокий риск ССЗ, врачом-липидологом был назначен курс терапии инклисираном — первая инъекция 284 мг подкожно, повторные рекомендованы 1 раз в 6 мес.
Первый ребёнок. Дочь, 11 лет, предъявляет жалобы на головные боли, сопровождающиеся тошнотой, подъёмом АД до 146/70 мм рт.ст. В 2019г наблюдалась с подозрением на синдром слабости синусового узла (эпизоды ухудшения состояния с головной болью, ощущением жара, тошноты, нехватки воздуха, по данным мониторирования электрокардиограммы документирована пауза 3,21 сек, преходящая атриовентрикулярная блокада 1 ст.) аритмологом, диагноз не подтверждён. В 2020г обращение в детскую больницу с жалобами на появление эпизодов по типу транзиторной ишемической атаки длительностью до 7 мин, ощущение тошноты, тяжёлый язык, несвязную затруднённую речь, бледнеет носогубный треугольник, синеют губы. В детской больнице г. Минусинска впервые выявлен уровень ОХС 9,31 ммоль/л. В 2021г значения колебались в пределах 8,81-9,72 ммоль/л, сохранялись приступы головной боли, тошноты на фоне АД 130-140/80 мм рт.ст.
Из анамнеза жизни: от III беременности (в 7 нед. угроза прерывания), I самостоятельных родов в 35 нед. с весом 2320, по шкале Апгар 8/9 баллов. На первом году жизни развивалась по возрасту. Вакцинация по национальному календарю. Частые респираторные инфекции до 5 лет. Занимается гимнастикой и кикбоксингом, к физическим нагрузкам адаптирована.
Status praesens: сознание ясное. Рост 154 см, вес 49,0 кг, индекс массы тела =20,7 кг/м2. Физическое развитие гармоничное, половое Ма2, Р1, Ах1, Ме0. Кожа чистая, умеренной влажности. Периферических признаков дислипидемии нет. Подкожно-жировой слой развит достаточно, распределен равномерно. Тургор тканей сохранен. Периферические лимфоузлы не увеличены, безболезненны, эластичны, подчелюстные и задние шейные до 1,3 см. Костно-суставная система без патологии. Частота дыхательных движений 18 в мин, перкуторный звук ясный лёгочный, дыхание везикулярное, проводится симметрично над лёгочными полями, хрипов нет. Верхушечный толчок в 5 межреберье, на 0,5 см кнутри от левой среднеключичной линии. Частота сердечных сокращений 76 уд./мин, тоны сердца ясные, ритмичные, шум не определяется. АД — 152/80 мм рт.ст. Живот симметричный, при пальпации мягкий, безболезненный. Край печени и селезёнка не пальпируются. Физиологические отправления не нарушены.
По результатам обследования выявлена тяжёлая гиперхолестеринемия: ОХС 8,93 ммоль/л, ЛНП 7,58 ммоль/л, ТГ 0,91 ммоль/л, липопротеин (а) 82,74 нмоль/л (N — до 30 нмоль/л), аполипопротеин А1 1,38 г/л (N 1,08-2,25), аполипопротеин В 1,6 г/л, (N 0,6-1,17), аланинаминотрансфераза 14,8 Ед/л, аспартатаминотрансфераза 36,4 Ед/л, глюкоза 4,9 ммоль/л, креатинин 55,7 мкмоль/л.
По данным суточного мониторирования АД среднее давление за сутки — 119/66 мм рт.ст. (90 перцентиль по возрасту, полу и росту — 114/72 мм рт.ст.), максимальное АД — 158/84 мм рт.ст., суточный индекс АД 14% (N), индекс времени гипертензии по систолическому АД — 58% времени наблюдения, соответствует АГ. Эхокардиография не выявила увеличения полостей сердца и утолщения стенок камеры левого желудочка, сократимость миокарда сохранена, полости не расширены, систолическое давление в легочной артерии 21 мм рт.ст. По данным УЗИ сосудов отмечается увеличение ТКИМ в общих сонных артериях до 0,5 мм, что превысило 95 перцентиль на 0,08 мм.
Выставлен диагноз: СГХС, гетерозиготная, определённая. Гиперлипопротеинемия (а). АГ, 1 ст. Высокий риск. Назначена гиполипидемическая терапия в соответствии с возрастом.
Второй ребёнок. Сын, 7 лет, жалоб не высказывает. Активный, подвижный, физические нагрузки переносит удовлетворительно, занимается футболом. Вес — 23 кг, рост — 120 см, индекс массы тела =
15,977 кг/м2. Физическое развитие гармоничное, среднее, половое — допубертатное. Кожа и слизистые оболочки чистые, бледно-розовые, умеренной влажности. Подкожно-жировой слой развит достаточно, распределен равномерно. Тургор тканей сохранен, мышечный тонус достаточный. Периферические лимфоузлы не увеличены, безболезненны, эластичны, подчелюстные до 1 см. Костно-суставная система без видимой патологии. Носовое дыхание свободное. Щитовидная железа 1 ст. Язык чистый, зев спокоен, миндалины не увеличены. Частота дыхательных движений 22 в мин, дыхание проводится симметрично, везикулярное, хрипов нет. Область сердца без деформаций, границы сердца соответствуют возрастной норме. Частота сердечных сокращений 98 уд./мин, тоны ясные, ритмичные, шума нет. АД — 98/50 мм рт.ст. Живот при пальпации мягкий, безболезненный, печень и селезёнка не пальпируются. Стул регулярный, оформлен. Мочеиспускание свободное. Липоидной дуги роговицы не выявлено, кожных и сухожильных ксантом нет. Моторное и нервно-психическое развитие соответствует возрасту.
При обследовании выявлено: ОХС 7,98 ммоль/л, холестерин ЛВП 1,35 ммоль/л, холестерин ЛНП 6,57 ммоль/л, ТГ 0,59 ммоль/л, липопротеин (а) 46,34 нмоль/л, аполипопротеин А1 1,47 г/л (N 1,08-2,25), аполипопротеин В 1,5 г/л, (N 0,6-1,17), аланинаминотрансфераза 14,8 Ед/л, аспартатаминотрансфераза 36,4 Ед/л, глюкоза 4,9 ммоль/л, креатинин 55,7 мкмоль/л.
По данным эхокардиографии полости сердца соответствуют возрастным и антропометрическим нормативам, функциональных нарушений нет, индекс массы миокарда левого желудочка — 54,86 г/м2, систолическое давление в легочной артерии — 22 мм рт.ст. По результатам суточного мониторирования АД среднее систолическое АД соответствует 90-му перцентилю, максимальное повышается до 137/76 мм рт.ст., индекс времени гипертензии в течение суток — 41%. По данным УЗИ сосудов выявлено увеличение ТКИМ левой сонной артерии до 0,5 мм, что превышает 95 перцентиль. Выставлен диагноз: СГХС, гетерозиготная, определённая. АГ. Высокий риск. Назначена гиполипидемическая терапия в соответствии с возрастом.
Все трое членов семьи были обследованы в ФГБНУ МГНЦ им. акад. Н. П. Бочкова методом массового параллельного секвенирования 60 генов, ассоциированных с дислипидемиями, патогенных и вероятно патогенных вариантов не выявлено. Поэтому на втором этапе было проведено молекулярно-генетическое исследование методом MLPA на ДНК, выделенной из клеток крови, проведен анализ копийности экзонов гена LDLR для поиска крупных перестроек. Анализ проведен с использованием реактивов SALSA_MLPA_Probe mix P062-LDLR, генетического анализатора ABI-Prism 3500, программного обеспечения Coffalyser.Net. У всех троих пациентов выявлена гетерозиготная делеция экзонов 2-10 гена LDLR (NM_000527). В международной базе вариантов человека такая делеция описана как патогенная у пациентов с гиперхолестеринемией (HGMD_2022.1_CG108024).
Обсуждение
В мире описано около 5 тыс. вариантов гена LDLR, из которых 2 тыс. ассоциированы с СГХС и ещё 1 тыс. являются вероятно патогенными [7]. Сопоставление клинических данных с генотипом пациентов в разных странах представляет новые данные о клиническом значении структурных нарушений гена LDLR, позволяет выявить прогностические маркеры и популяционные отличия заболевания.
По результатам работы Di Taranto MD, et al. установлено, что на структуру и функции рецептора к ЛНП значительное влияние оказывают изменения в области промотора, нарушающие транскрипцию в результате образования преждевременных стоп-кодонов, а также более крупные перестройки, к которым относятся сдвиг рамки считывания и делеции. Точечные (миссенс-мутации) не всегда вызывают патологию, поэтому каждая вновь выявленная сопоставляется с клиническим профилем пациента. Авторы данного исследования на смешанной возрастной группе неродственных больных СГХС показали рост уровня холестерина по мере продвижения от миссенс-мутаций LDLR (76,1% обследованных) к пациентам с дефектными (3,2% компаунд-гетерозигот), биаллельными вариантами (1 пациент квалифицирован как двойная гетерозигота по делеции экзонов 11-18) к самым худшим — нулевым вариантам (0,7% гомозигот) [8]. Параллельно был отмечен рост стратификации СГХС по критериям DLCN от маловероятной до определённой. Важно, что в педиатрической группе клинико-генетическая корреляция была более выраженной, а число клинически значимых мутаций значимо больше, чем у взрослых обследуемых.
В ряде работ изучение фено-генотипических корреляций выявило связь между наличием мутаций в LDLR и ранним стартом и тяжестью ИБС у молодых пациентов [9-12]. Исследование функционального значения вариантов LDLR установило, что мутации кодона преждевременного терминирования, варианты сайта сплайсинга и сдвига рамки считывания, могут порождать нулевые аллели или преждевременное усечение LDLR с активностью рецепторов <2% [10].
Обзорный анализ спектра патогенных вариантов LDLR в России по результатам исследований, проведённых до 2022г, установил, что 39,4% выявленных мутаций являются специфичными для России [13], но распределение их было таким же, как и в других странах [9-11]. Даная работа позволила выделить 5 мажорных мутаций, встречавшихся более, чем в 10 семьях пациентов с СГХС, а также проследить самую частую локализацию нарушений: максимальная плотность мутаций в расчёте на один нуклеотид выявлена в девятом экзоне в отличие от мировых баз, где акцент пришёлся на четвёртый экзон.
Одним из важнейших результатов работы Васильева В. Б. и др. стало выявление редких патогенных вариантов генов, ассоциированных с СГХС, и в т. ч. описание делеций 2-10 экзонов LDLR [13].
В нашем клиническом примере делеции в LDLR у всех троих пациентов также обнаружены в экзонах 2-10. Структурные нарушения LDLR вызвали тяжёлые атерогенные сдвиги как у пробанда, так и у её детей. Кроме того, у всех обследованных членов семьи выявлены высокие концентрации аполипопротеина В и липопротеина (а), наиболее выраженные у матери. Аполипопротеин В является обязательной частью всех транспортных частиц холестерина, и сопряжён с развитием ИБС, включая острые коронарные события [14]. Гиперлипопротеинемия (а) связана с кальцинозом аортального клапана, ранним и быстро прогрессирующим атеросклерозом [15].
У пробанда получено подтверждение раннего развития атеросклероза — увеличение ТКИМ и атеросклеротическая бляшка, особую опасность представляет его сочетание с АГ и резистентностью к гиполипидемической терапии.
Клинические проявления СГХС у детей представлены биохимическими и ультразвуковыми симптомами, комбинацией дислипидемии с АГ. Возможно, ранние проявления атеросклероза обусловлены сочетанием СГХС, обусловленной геномной перестройкой LDLR, с гиперлипопротеинемией (а).
Заключение
Каскадный скрининг с применением комплексного обследования, включающего как таргетный молекулярно-генетический анализ, так и (в случае отрицательного результата) мультиплексную лигазо-зависимую полимеразную цепную реакцию, позволяет выявить крупные перестройки в гене рецептора к ЛНП. На примере данного клинического случая показано, что геномные нарушения вызывают формирование атеросклеротического поражения сосудов у детей дошкольного возраста и могут потребовать расширения гиполипидемической терапии вплоть до применения препарата синтетической микроРНК с целью подавления фермента, разрушающего рецепторы к ЛНП. При сопоставлении клинических нарушений с результатом MLPA получено веское обоснование раннего старта гиполипидемической терапии у детей.
Информированное согласие
До включения в исследование у всех участников было получено письменное информированное согласие.
Благодарности. Авторы выражают глубокую благодарность к. б. н., руководителю Центра коллективного пользования "Молекулярные и клеточные технологии" Пожиленковой Елене Анатольевне за возможность хранения биологических образцов обследуемых; а также выражают глубочайшую признательность д. м. н., заведующей Лабораторией наследственных болезней обмена веществ и Лабораторией селективного скрининга Захаровой Екатерине Юрьевне за проведение двухэтапного молекулярно-генетического анализа у членов данной семьи.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Мешков А.Н., Ершова А.И., Шальнова С.А. и др. Кросс-секционное исследование по оценке распространенности семейной гиперхолестеринемии в отдельных регионах Российской Федерации: актуальность, дизайн исследования и исходные характеристики участников. Рациональная Фармакотерапия в Кардиологии 2020;16(1):24-32. DOI:10.20996/1819-6446-2020-02-17
2. Ежов М.В., Кухарчук В.В., Сергиенко И.В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471. EDN YVZOWJ
3. Яхонтов Д.А., Останина Ю.О., Пахарукова М.Ю. и др. Мультифокальный атеросклероз у больных ишемической болезнью сердца различных возрастных групп. Клинико-гемодинамические параллели. Сибирское медицинское обозрение. 2018;(2): 70-77. DOI: 10.20333/2500136-2018-2-70-77
4. Jeon H, Blacklow SC. Structure and physiologic function of the low-density lipoprotein receptor. Annu Rev Biochem. 2005;74:535–62. https://doi.org/10.1146/annurev.biochem.74.082803.133354
5. Ежов М.В., Сергиенко И.В., Колмакова Т.Е. и др. Семейная гиперхолестеринемия. Учебно-методическое пособие для слушателей дополнительного профессионального образования по специальностям «Кардиология», «Врач общей практики», «Терапия». Москва: ООО «Патисс», 2021 с. 84. ISBN 978-5-93856-265-3
6. Митина Е.В., Кузнецов В.И., Стуров Н.В. и др. Основы медико-генетического консультирования и принципы лечения пациентов с наследственными нарушениями липидного обмена. Фармакология & Фармакотерапия. 2022;(3):46-53. DOI:10.46393/27132129_2022_3_46
7. Mori A, Malaquias VB, Bonjur K, et al. Functional analyses of LDLR genetic variants found in familial hypercholesterolemic patients, using CRISPR/Cas9. Atherosclerosis. 2023;379(1):13-14 DOI:10.1016/j.atherosclerosis.2023.06.720
8. Di Taranto MD, Giacobbe C, Palma D, et al. Genetic spectrum of familial hypercholesterolemia and correlations with clinical expression: Implications for diagnosis improvement. Clin Genet. 2021;100(5):529-541. doi: 10.1111/cge.14036.
9. Athar M, Toonsi M, Abduljaleel Z, et al. Novel LDLR Variant in Familial Hypercholesterolemia: NGS-Based Identification, In Silico Characterization, and Pharmacogenetic Insights. Life (Basel). 2023;13(7):1542. https://doi.org/10.3390/life13071542
10. Turkyilmaz А, Kurnaz Е, Alavanda C, et al. The Spectrum of Low-Density Lipoprotein Receptor Mutations in a Large Turkish Cohort of Patients with Familial Hypercholesterolemia. Metabolic Syndrome and Related Disorders. 2021;19:6, 340-346 doi.org/10.1089/met.2021.0004
11. Paththinige CS, Rajapakse JRDK, Constantine GR, et al. Spectrum of low-density lipoprotein receptor (LDLR) mutations in a cohort of Sri Lankan patients with familial hypercholesterolemia – a preliminary report. Lipids Health Dis. 2018;17(1):100. https://doi.org/10.1186/s12944-018-0763-z
12. Тимощенко О.В., Иванощук Д.Е., Семаев С.Е. и др. Молекулярно-генетическая диагностика гетерозиготной формы семейной гиперхолестеринемии в молодом возрасте: клинический случай. Атеросклероз. 2022;18(1):76-80. https://doi.org/10.52727/2078-256X-2022-18-1-76-80
13. Васильев В.Б., Захарова Ф.М., Богословская Т.Ю. и др. Анализ спектра мутаций гена рецептора низкой плотности (LDLR) при семейной гиперхолестеринемии в России. Вавиловский журнал генетики и селекции. 2022;26(3):319-326. DOI 10.18699/VJGB-22-38
14. Zang Ch, Ni J, Chen Z. Apolipoprotein B Displays Superior Predictive Value Than Other Lipids for Long-Term Prognosis in Coronary Atherosclerosis Patients and Particular Subpopulations: A Retrospective Study. Clinical Therapy. 2022;44(8):1071-1092 doi.org/10.1016/j.clinthera.2022.06.010
15. Patel AP, Wang M, Pirruccello JP. Lipoprotein(a) Concentrations and Incident Atherosclerotic Cardiovascular Disease: New Insights from a Large National Biobank. Arterioscler Tjromb Vasc Biol. 2021;41:465-74. doi:10.1161/ATVBAHA.120.315291
Об авторах
А. М. МоисееваРоссия
Анастасия Марковна Моисеева — аспирант 1-го года по направлению "Педиатрия"
Красноярск
О. Н. Иванова
Россия
Ольга Николаевна Иванова — к.м.н., с.н.с.
Красноярск
В. С. Емельянчик
Россия
Василий Сергеевич Емельянчик— клинический ординатор 2-го года по направлению "Терапия"
Красноярск
Е. Ю. Емельянчик
Россия
Елена Юрьевна Емельянчик — д.м.н., профессор кафедры педиатрии ИПО, врач-кардиолог КГБУЗ ККБ
Красноярск
О. В. Мариловцева
Россия
Ольга Валерьевна Мариловцева — ассистент кафедры кардиологии, функциональной и клинико-лабораторной диагностики ИПО, врач-кардиолог "Амбулаторного кардиологического диспансера" на базе краевой клиникодиагностической поликлиники при КГБУЗ ККБ
Красноярск
С. Ю. Никулина
Россия
Светлана Юрьевна Никулина — д.м.н., профессор, зав. кафедрой факультетской терапии, врач-кардиолог КМКБ № 20 им. И. С. Берзона
Красноярск
А. В. Протопопов
Россия
Алексей Владимирович Протопопов — д.м.н., профессор, ректор, зав. кафедрой лучевой диагностики ИПО, врач отделения рентгенохирургических методов диагностики и лечения КГБУЗ ККБ
Красноярск
Дополнительные файлы
Рецензия
Для цитирования:
Моисеева А.М., Иванова О.Н., Емельянчик В.С., Емельянчик Е.Ю., Мариловцева О.В., Никулина С.Ю., Протопопов А.В. Фенотип семейной гетерозиготной гиперхолестеринемии, обусловленной делецией экзонов 2-10 гена LDLR: клинический случай. Российский кардиологический журнал. 2024;29(10S):5927. https://doi.org/10.15829/1560-4071-2024-5927. EDN: LTZCMT
For citation:
Moiseeva A.M., Ivanova O.N., Emelyanchik V.S., Emelyanchik E.Yu., Marilovtseva O.V., Nikulina S.Yu., Protopopov A.V. Phenotype of heterozygous familial hypercholesterolemia caused by deletion of LDLR gene exons 2-10: a case report. Russian Journal of Cardiology. 2024;29(10S):5927. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5927. EDN: LTZCMT
JATS XML

















































