Перейти к:
Современные алгоритмы терапии статинами
https://doi.org/10.15829/1560-4071-2023-5594
EDN: AVMAYP
Аннотация
Ингибиторы ГМГ-КоА редуктазы (статины) — ключевой класс препаратов для лечения и профилактики атеросклероза и его осложнений. Эти препараты с высоким классом доказательности прочно вошли в российские и международные рекомендации. Вместе с тем использование этих препаратов в рутинной клинической практике пока не оптимально, значительная часть пациентов очень высокого сердечно-сосудистого риска, принимая начальные дозы статинов, не достигают целевых уровней холестерина липопротеидов низкой плотности. Статья посвящена анализу международных и российских рекомендаций для оптимизации монотерапии статинов, включая их назначение в первичной профилактике с использованием реклассификаторов сердечнососудистого риска, значений коронарного кальция, ультразвуковой допплерографии сонных артерий и уровня липопротеина (а).
Ключевые слова
Для цитирования:
Сусеков А.В. Современные алгоритмы терапии статинами. Российский кардиологический журнал. 2023;28(10):5594. https://doi.org/10.15829/1560-4071-2023-5594. EDN: AVMAYP
For citation:
Susekov V.A. Modern algorithms for statin therapy. Russian Journal of Cardiology. 2023;28(10):5594. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5594. EDN: AVMAYP
Введение
Ингибиторы ГМГ-КоА редуктазы (статины) прочно вошли в повседневную клиническую практику и являются основой для эффективной первичной и вторичной профилактики атеросклероза и его осложнений [1-5]. За последние 40 с лишним лет применения этого класса препаратов накоплен большой опыт по эффективности статинотерапии [6-9], возможности стабилизации/регрессии атеросклероза [10-14], а также широкого использования статинов в комбинированной терапии [15-20]. Положительные результаты контролируемых исследований с эзетимибом [15] и кумабами [16][17] позволили снизить целевые уровни холестерина (ХС) <1,4 ммоль/л во всем мире. Основные принципы комбинированной терапии изложены в отдельных Рекомендациях EAS [18]. Однако в Российской Федерации (РФ) и во всем мире остаются проблемы достижения целевых уровней липидов, интенсификации монотерапии статинами и широкого внедрения комбинированной липидснижающей терапии. В 2023г вышла новая версия российских рекомендаций по липидам, в основу которой легли Европейские рекомендации 2019 [2]. В них отражено много новых положений, включая диагностику и управление наследственной гиперхолестеринемией, принципы комбинированной гиполипидемической терапии (статины + эзетимиб, кумабы и инклисиран) и т.д. [4]. Но, к сожалению, в них нет четкого алгоритма монотерапии статинами, особенно, в первичной профилактике, нет информации по реклассификаторам сердечно-сосудистого риска (ССР), которые необходимы для переоценки тактики лечения у лиц низкого/умеренного ССР и др. [4]. В настоящей публикации представлен обзор новых международных и российских рекомендаций по липидснижающей терапии с акцентом на монотерапию статинами. Обсуждается новый европейский алгоритм SCORE2 в контексте стратификации ССР в первичной профилактике, представлен анализ реклассификации ССР с использованием клинических, лабораторных параметров — липопротеина (а) (Лп(а)), а также современные аспекты использования инструментальных реклассификаторов — коронарного кальция и ультразвуковой допплерографии (УЗДГ) сонных артерий. Представлен возможный алгоритм монотерапии статинами умеренными/высокими дозами с акцентом на первичную профилактику у лиц низкого/умеренного и высокого ССР, с учетом российских рекомендаций по липидам/УЗДГ диагностике каротидного атеросклероза (КА) и некоторых международных рекомендаций 2021-2023гг.
Категория низкого и умеренного ССР. Реклассификаторы ССР
Пациенты низкого ССР — это преимущественно лица молодого и среднего возраста обоего пола с нормальным артериальным давлением (АД), некурящие, без выраженной гиперхолестеринемии, у которых 10-летний риск фатальных/нефатальных сердечно-сосудистых осложнений (ССО) по алгоритму SCORE2 не превышает 2,5% (для лиц до 50 лет), ниже 5% для пациентов 50-69 лет и не превышает 7,5% для возрастной группы ≥70 лет [3]. По алгоритму SCORE2, все мужчины в РФ старше 40 лет, независимо от уровня липидов, АД, статуса по курению — относятся к категории высокого/ очень высокого ССР и являются потенциальными кандидатами для старта статинотерапии с целевым уровнем ХС липопротеидов низкой плотности (ХСЛНП) <1,8 ммоль/л. В международных [1-3] и отчасти в российских рекомендациях по кардиоваскулярной профилактике [5] предложено использовать дополнительные реклассификаторы/усилители ССР (табл. 1). В рекомендациях ESC 2021 по кардиоваскулярной профилактике (SCORE2) категория низкого/ умеренного ССР объединена и актуальна только для некурящих женщин 40-44 лет без АГ с уровнем ХСнеЛВП ≤5,9 ммоль/л [3].
Роль коронарного кальция при оценке ССР и старте терапии статинами
Процесс кальцификации коронарных артерий, который начинается с апоптоза макрофагов и образования содержащих кальций пузырьков в матриксе сосудов — естественный процесс эволюции сосудистой стенки, является важным морфологическим субстратом при развитии сердечно-сосудистого заболевания [19]. Степень кальциноза коронарных артерий (определяемый как индекс Агатстона или кальциевый индекс (КИ)) [20] прямо коррелирует с частотой больших ССО атеросклеротической этиологии и его величина тесно связана как со стартом, так и с интенсификацией терапии статинами [1-5][21][22]. Значение КИ, равное 0 у лиц умеренного ССР с ХС-ЛНП 1,8-4,9 ммоль/л является основанием к отсрочке назначения статинов, по крайней мере, на 3 года [23][24]. Если значение КИ 1-99 и <75 перцентиля для данного пола и расы, но возраст больного старше 55 лет, рекомендовано начать терапию статинами (IIaB) [1]. Почти во всех рекомендациях [1-3][5][23], если КИ >100 ЕД (а для рекомендаций National Lipid Association USA (NLA) еще и КИ ≥75 перцентиля), то статины назначаются обязательно (например, Крестор 10-20 мг/сут. или аторвастатин 20-40 мг/сут.) (степень доказательности IIaB). Интенсификация терапии статинами показана (консенсус NLA 2021), если КИ ≥300, и особенно ≥1000, что требует 50% и достижения/поддержания целевого уровня «плохого холестерина» <2,6 ммоль/л [23]. Помимо абсолютных значений КИ, для обоснования назначения статинов можно использовать показатели >75 перцентиля КИ для данного пола/возраста/ расовой принадлежности [23]. В российских рекомендациях по кардиоваскулярной профилактике коронарный кальций считается модификатором ССР для лиц умеренного ССР, у которых риски находятся в пограничных значениях для принятия терапевтических решений (IIbB) [5]. При исследовании на коронарный кальций пациент получает небольшую дозу радиации (0,74-1,27 mSv), что сопоставимо с дозой, получаемой при маммографии.
Таблица 1
Реклассификаторы ССР (адаптировано из российских и международных рекомендаций [1-5])
Лабораторные реклассификаторы: постоянное повышение уровня триглицеридов ≥2 ммоль/л; повышение высокочувствительного С-реактивного белка ≥2,0 мг/л; липопротеин (а) ≥50 мг/дл или ≥125 нмоль/л; повышение уровня апоВ ≥130 мг/дл.
Клинические реклассификаторы: первичная (наследственная) гиперхолестеринемия; отягощенный семейный анамнез (м <55 лет, ж <65 лет); метаболический синдром; ожирение; низкая физическая активность; психосоциальный стресс; большие психиатрические расстройства; мерцательная аритмия; социальная депривация; хрупкое телосложение (у пожилых); гипертрофия левого желудочка; генетика (индекс полигенного риска, Polygenic Score); кальциевый индекс (индекс Агатсона >100); лодыжечно-плечевой индекс <0,9; хроническая болезнь почек (скорость клубочковой фильтрации 15-59 мл/мин/1,73 м2); стеноз в сонных артериях ≥50%; хроническое воспаление (псориаз, ревматоидный артрит, системная красная волчанка, ВИЧ/СПИД); преэклампсия при родах; преждевременная менопауза.
Сокращения: ВИЧ – вирус иммунодефицита человека, СПИД – синдром приобретённого иммунного дефицита.
Атеросклеротические бляшки в сонных артериях (по данным УЗДГ) как реклассификатор ССР
Согласно результатам российских и зарубежных исследований, распространенность бессимптомного нестенозирующего КА велика и варьирует в широких пределах, увеличиваясь с возрастом [25-28]. Так, по данным исследования в неорганизованной по-
пуляции г. Томска, встречаемость КА у мужчин составила 36% и 24% у женщин [25]. В другой работе (обследование популяции в 40-67 лет Ивановской области) показано, что распространенность КА (≥1 атеросклеротическая бляшка (АСБ)) была весьма значимой и составила 76% у мужчин и 59% у женщин, феморального атеросклероза — 55% и 28%, соответственно [28]. В этой выборке у 42% лиц возрасте 40-44 года уже могут быть выявлены АСБ [28]. Во многих международных и российских рекомендациях наличие АСБ в некоронарных (главным образом, сонных) артериях — валидированный инструментальный реклассификатор ССР, преимущественно в сторону его повышения (умеренный/высокий ССР) [1-5][29-31]. Как отмечено в российских рекомендациях по кардиоваскулярной профилактике [5], измерение толщины комплекса интима-медиа больше не является маркером/реклассификатором ССР, в то время как наличие АСБ в сонных артериях 25-49% указывает на высокий, а наличие АСБ в некоронарных артериях ≥50% — на очень высокий ССР и требует ежегодного проведения дуплексного сканирования с оценкой эхогенности [31]. Помимо процента стеноза в сонных артериях в российском консенсусе по фокусированному ультразвуковому исследованию сосудов рекомендовано оценивать высоту АСБ [31]. Определение максимального стеноза <25% при высоте АСБ ≥1,5 мм реклассифицирует пациента в категорию высокого ССР, аналогично при стенозе в 25% но <50% и высоте АСБ или <50% и высоте ≥2,5 мм — пациент также относится к категории высокого ССР [31]. При стенозе в сонных артериях ≥50% больной относится к категории очень высокого ССР, что корреспондирует с другими российскими рекомендациями по сонным артериям [30]. Заслуживает внимания точка зрения в Американских Рекомендациях USPSTF, что проведение УЗДГ сонных артерий у бессимтомных пациентов (без анамнеза инсульта и неврологических симптомов транзиторной ишемической атаки) в общей популяции не оправдано, т.к. при таком подходе вред перевешивает пользу из-за ложноположительных результатов теста [32]. К плюсам использования УЗДГ сонных артерий у бессимптомных больных относят: 1) отсутствие радиационной нагрузки; 2) тесную связь с риском ишемического инсульта; 3) развитие АСБ в сонных обычно происходит раньше кальцификации коронарных артерий и аорты [33]. К недостаткам этого теста относится: 1) отсутствие стандартизации определения “burden score” — индекса бремени атеросклероза; 2) меньшая специфичность для КА; 3) зависимость от оператора, выполняющего это исследование [33]. Автор придерживается точки зрения, изложенной в российских рекомендациях по кардиоваскулярной профилактике, что из инструментальных тестов — реклассификаторов риска приоритет нужно отдавать определению КИ, а тест УЗДГ сонных артерий носит вспомогательный характер [5]. Наличие стенозов в сонных артериях ≥50% использовать как эквивалент ишемической болезни сердца (очень высокий ССР). Наличие у пациента некоронарной АСБ ≥50% — это хороший мотиватор для повышения приверженности терапии статинами и аспирином у больных, имеющих к этому показания.
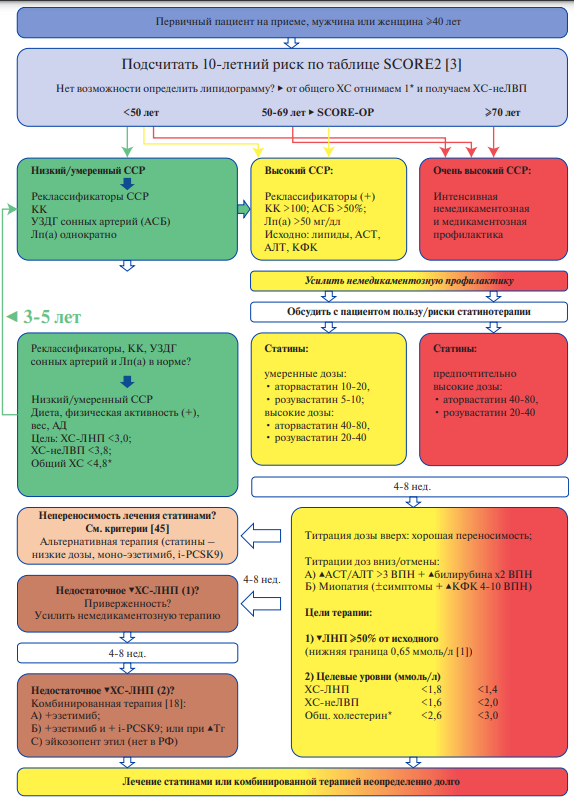
Рис. 1. Алгоритм терапии статинами у больных низкого, умеренного и высокого ССР (адаптировано из [1-5][30][31][34-37][45]).
Примечание: * — при невозможности в лаборатории определить липидограмму подсчитать ХС-неЛВП можно (с некоторыми допущениями) по формуле: ХС-неЛВП = Общий ХС — 1 (средний уровень ХС-ЛВП примерно 1 ммоль/л). Неприменимо при СД 2 типа и выраженной гипертриглицеридемии с Тг >5,6 ммоль/л.
Сокращения: АД — артериальное давление, АЛТ — аланинаминотрансфераза, АСБ — атеросклеротическая бляшка, АСТ — аспартатаминотрансфераза, ВПН — верхний предел нормы, КК — коронарный кальций, КФК — креатинфосфокиназа, Лп(а) — липопротеин (а), РФ — Российская Федерация, СД — сахарный диабет, ССР — сердечно-сосудистый риск, УЗДГ — ультразвуковая допплерография, ХС — холестерин, ХС-ЛНП — холестерин липопротеидов низкой плотности, ХС-неЛНП — холестерин не-липопротеидов низкой плотности.
Повышение уровня Лп(а) в плазме крови как реклассификатор ССР
Из лабораторных реклассификаторов ССР в рекомендациях больше всего внимания уделяется повышению уровня Лп(а) [1-5]. Высокий уровень Лп(а) (>50 мг/дл) — независимый фактор ССР, атеросклероза и риска развития стеноза аортального клапана [34-37]. Насчитывается >40 изоформ апо(а), что связано со значительной вариабельностью молекулярного веса апо(а) (275-800 килодальтон). Скорость синтеза апо(а) в гепатоцитах обратно коррелирует с размером апо(а), поэтому у лиц с низким молекулярным весом изоформ апо(а) концентрация Лп(а) обычно выше. В клинической практике принято измерять Лп(а) в мг/дл (масса всей частицы апо(а), апоВ-100, ХС, эфиры 18 ХС, фосфолипиды, триглицериды). Для стандартизации рекомендуют более точный тест — измерение Лп(а) в нмоль/л, значения Лп(а) в нмоль/л не зависят от количества изоформ этого липопротеина [34]. В российских Рекомендациях по липидам и кардиоваскулярной профилактике указано о необходимости измерять Лп(а) у любого взрослого хотя бы раз в жизни и ССР при его уровне >180 эквивалентен таковому семейной гетерозиготной гиперхолестеринемии [4][5]. В этих же Рекомендациях есть указание, что если у больных с семейной гиперхолестеринемией Лп(а) >50 мг/дл, то это является показанием для плазмафереза или ЛНП-афереза, однако не указано, является ли повышение Лп(а) показанием для интенсификации липидснижающей терапии. В рекомендациях по кардиоваскулярной профилактике 2022г нет указаний для использования уровня Лп(а) как реклассификатора ССР при решении вопроса о терапии статинами, более того, другие биомаркеры крови или мочи также не рекомендованы для рутинного использования в клинике (уровень/степень доказательности IIIB) [5]. В рекомендациях АСС/АНА 2018г указано, что нет специфических указаний для скрининга [1]. Повышенный уровень Лп(а) (≥50 мг/дл или 125 нмоль/л) — «усилитель» ССР в пользу статинотерапии для лиц 4075 лет без сахарного диабета (СД) с 10-летним ССР >5-19,9% [1]. В консенсусе EAS по Лп(а) 2022г подчеркивается причинно-следственная связь между Лп(а) и ССР, стенозом аортального клапана даже при сниженном уровне ХС-ЛНП, но не подтверждается связь гипер Лп(а) с венозной тромбоэмболией и нарушением фибринолиза [37]. Низкий уровень Лп(а) в течение всей жизни связан с риском развития СД 2 типа. С учетом положения этого консенсуса, уровни Лп(а) включены в таблицу абсолютного риска больших ССО со значениями в 10, 30, 50, 75 и 100 мг/дл [37]. Соответственно, терапия статинами в первичной профилактике может быть начата у лиц умеренного риска (по старому алгоритму SCORE ≥1 — <5%) и уровнем Лп(а) от 50-75 мг/дл, а у лиц высокого ССР (≥5 — <10 по SCORE) при Лп(а) 30-50 мг/дл. У больных очень высокого ССР решение об интенсивной терапии статинами принимается безотносительно уровня Лп(а), с достижением целевых уровней ХСЛНП по принципу «чем меньше «плохой» ХС, тем лучше» с нижней границей в 0,65 ммоль/л [1]. В европейском консенсусе по Лп(а) представлена таблица интенсификации снижения ХС-ЛНП при различных значениях Лп(а) (от 50 до 300 нмоль/л) для того, чтобы снизить пожизненный ССР [37].
Возможный алгоритм статинотерапии как основа для снижения ССР и первая ступень для комбинированной гиполипидемической терапии
В идеале при оценке риска серьезных ССО в первичной профилактике необходимо оценивать абсолютный риск. При относительном риске (RR) ССО в 10% он кажется высоким, но если частота сердечно-сосудистых событий в референсной группе может стремиться к 0, следовательно, RR =10 все еще значительно ниже абсолютного риска [38]. Как обсуждалось ранее, доля пациентов низкого/умеренного ССР в РФ достаточно мала (SCORE2) — это некурящие женщины не старше 44 лет, с нормальным АД и уровнем ХС-неЛВП <6 ммоль/л [3]. Де-факто за исключением пациентов с семейной гиперхолестеринемией первичную профилактику статинами можно рассматривать всем женщинам старше 44 лет безотносительно курения, липидов и АД и всем мужчинам старше 40 лет. Конечно, широкомасштабное назначение статинов всем лицам старше 40 лет невозможно по многим причинам, прежде всего по категории стоимость-эффективность и большой нагрузки на систему здравоохранения. Согласно таблице SCORE2 для стран очень высокого ССР, подавляющее большинство пациентов относится к тем, которым показана терапия статинами умеренными или высокими дозами. Если попытаться использовать «туннельный подход» с постепенным сужением количества больных на каждом этапе, которым действительно нужны статины, с учетом последних рекомендаций по липидам необходимо ориентироваться на: 1) желание пациента; 2) максимальные стартовые и (важно!) продолжающиеся усилия по немедикаментозной профилактике; 3) 95-й перцентиль распределения ХС-ЛНП в популяции для данного пола и возраста; 4) использование реклассификаторов или усилителей ССР (табл. 1). Далее при необходимости можно провести исследования на КИ, УЗДГ сонных артерий с определением % стеноза, высоты и эхогенности АСБ и определить уровень Лп(а). Если взять данные лаборатории in vitro с большой выборкой тестов на общий ХС у мужчин (n=25284) и у женщин (n=26751) [39], и, условно, уровни ХС-ЛВП в 1 ммоль/л, то для 40-летнего некурящего мужчины с cистолическим АД 120-140 мм рт.ст. медиана общего ХС будет 5,64 ммоль/л, расчетный уровень ХС-неЛВП — 4,6 ммоль/л и риск SCORE2 — 5% (высокий ССР). Для 40-летней некурящей женщины с систолическим АД <140 мм рт.ст. медиана общего ХС по данным in vitro — 5,42 ммоль/л, рассчитанный уровень ХС-неЛВП — 4,2 ммоль/л и SCORE2 — 3% [3]. Оба этих гипотетических пациента требуют старта статинотерапии из-за высокого ССР. В реальной практике таких пациентов практически не бывает и при осмотре и лабораторном/инструментальном обследовании обязательно найдутся реклассификаторы, повышающие ССР в рамках высокого или даже очень высокого. По данным различных российских наблюдательных исследований, достижение целевых уровней ХС-ЛНП у больных высокого/ очень высокого ССР далеко от идеального [40-42]. По данным Ipsos Prindex (2019) только 2% кардиологов в 14 российских городах назначали розувастатин 40 мг/сут., а аторвастатин 80 мг/сут. назначался лишь в 1% случаев. Согласно данным российского ретроспективно-проспективного исследования РЕГИОН-ИМ (n=3620), практически всем пациентам (95%) с острым инфарктом миокарда были назначены статины (эквивалентные аторвастатину 40 и 80 мг/сут.), чтобы добиться достижения целевого уровня ХС-ЛНП <1,4 ммоль/л через 6 мес. наблюдения (n=218) [43]. Основные выводы исследования РЕГИОН-ИМ: большинство больных с инфарктом миокарда в РФ требуют терапию ингибиторами PCSK9. Исходный уровень ХС-ЛНП на средних дозах статинов в исследовании FOURIER был 2,4 ммоль/л [16], в ODYSSEY OUTCOMES (преимущественно высокие дозы статинов) — 2,3 ммоль/л [17], т.е. значительно ниже, чем у больных в регистре РЕГИОНИМ. Возможно, в этом регистре были получены ложноотрицательные результаты из-за того, что высокие медианы ХС-ЛНП на статинах были «вытянуты вверх» включением больных с выраженной гиперхолестеринемией [43]. Внедрение принципов трехступенчатой комбинированной терапии (статины + эзетимиб + кумабы) должно проводиться в соответствии с рекомендациями [1-5], за исключением случаев реальной непереносимости статинов, которая встречается нечасто. Мнимая непереносимость статинов в клинической практике статинов нередко является серьезным барьером в адекватной терапии. Реальная частота отмены статинов по данным исследования USAGE была 7,5% [44], а встречаемость фармакологических (не общих) случаев статинассоциированной миопатии составляет лишь 1-2% (0,5-4%) [45], а вовсе не 10,5%, как сообщалось в высокоцитируемом исследовании PRIMO 2005г [46]. Другой тезис, который активно продвигается в практическом здравоохранении как основание для старта комбинированной гиполипидемической терапии: статины в высоких дозах недостаточно снижают уровень ХС-ЛНП. По данным завершенных исследований, монотерапия оригинальным аторвастатином позволяет снижать уровень ХС-ЛНП от 45% до 50%, а Крестором 40 мг/сут. — от 50 до 55% [47]. Оригинальный розувастатин (Крестор) по результатам завершенных исследований программы Галактика и исследований Юпитер и ВОЯЖЕР — обладает максимальным эффектом снижения на уровень ХС-ЛНП вплоть до 55% (мг/сут.) в исследовании STELLAR. Максимальный процент снижения ХС-ЛНП у пациентов очень высокого ССР в исследовании ODYSSEY LONG-TERM с алирокумабом составил 62%, при этом 46% больных получали максимально переносимую терапию статинами высокими дозами [48]. В другом проекте с алирокумабом ODYSSEY ALTERNATIVE, где участвовали пациенты с непереносимостью статинов, эффект на уровень ХС-ЛНП был значительно ниже: -52% к 8 нед., и -54% к 24 нед. [49]. Аналогично в исследованиях ORION-10 и 11 среднее снижение уровня ХС-ЛНП при инъекциях инклисирана 300 мг/1 раз в полгода составило -54% [50], а в повседневной практике в Германии (n=79, 9 мес.) — только 26,5% [50]. Вместе с тем анализ мировой литературы показывает, что в западных и восточных/азиатских популяциях в основе доказательной терапии лежит монотерапия статинами с пропорцией интенсивной терапии в 11-42% [51-54]. Возможный алгоритм применения статинов у пациентов низкого/умеренного или высокого/очень высокого ССР представлен на рисунке 1. Он основан на анализе последних российских и международных рекомендаций 2021-2023 [1-5][30][31][34-37][45] и отражает точку зрения автора, степень доказательности Д.
Заключение
Таким образом, монотерапия статинами является основой первичной и вторичной профилактики атеросклероза, обеспечивая в адекватных дозах до 50-55% снижения уровня ХС-ЛНП, что достаточно для большинства пациентов высокого ССР. Повышение стартовых и средних доз статинов в повседневной клинической практике, а также увеличение пропорции больных высокого ССР, получающих интенсивную статинотерапию — основа для современной комбинированной терапии и, пожалуй, единственный путь для снижения сердечно-сосудистой смертности в нашей стране.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Grundy SM, Stone NJ, Bailey AL, et al. A Report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2019;73(24):e285-e350. doi:10.1016/j.jacc.2018.11.003.
2. Authors/Task Force Members; ESC Committee for Practice Guidelines (CPG); ESC National Cardiac Societies 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis. 2019;290:140-205. doi:10.1016/j.atherosclerosis.2019.08.014.
3. ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies. Eur Heart J. 2021;42(34):3227-337. doi:10.1093/eurheartj/ehab484.
4. Ежов М.В., Кухарчук В.В., Сергиенко И.В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471.
5. Бойцов С.А., Погосова Н.В., Аншелес А.А. и др. Кардиоваскулярная профилактика 2022. Российские национальные рекомендации. Российский кардиологический журнал. 2023;28(5):5452. doi:10.15829/1560-4071-2023-5452.
6. Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81. doi:10.1016/S0140-6736(10)61350-5.
7. Cholesterol Treatment Trialist Collaborators. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012(11);380(9841):581-90.
8. Cholesterol Treatment Trialists (CTT) Collaborators. Fulcher J, O’Connel R, Voysey M.Efficacy and safety of LDL-lowering therapy among men and women: metaanalysis of individual data from 174,000 participants in 27 randomised trials. Lancet. 2015;385:1397-405.
9. Canon C, Steinberg A, Murphy SA. Meta-Analysis of Cardiovascular Outcomes Trials Comparing Intensive Versus Moderate Statin Therapy. J Am Coll Cardiol. 2006;48:438-45.
10. Nissen SE, Tuzcu EM, Schoenhagen P, et al. REVERSAL Investigators. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis: a randomized controlled trial. JAMA. 2004;3;291(9):1071-80.
11. Okazaki S, Yokoyama T, Miyauchi K, et al. Early Statin Treatment in Patients With Acute Coronary Syndrome Demonstration of the Beneficial Effect on Atherosclerotic Lesions by Serial Volumetric Intravascular Ultrasound Analysis During Half a Year After Coronary Event: The ESTABLISH Study. Circulation. 2004;110:1061-8.
12. Underhill HR, Yuan C, Zhao X-Q, et al. Effect of rosuvastatin therapy on carotid plaque morphology and composition in moderately hypercholesterolemic patients: a highresolution magnetic resonance imaging trial. Am Heart J. 2008;155(3):584.e1-8. doi:10.1016/j.ahj.2007.11.018.
13. Nissen SE, Nicholls SJ, Sipahi I, et al. Effect of Very High-Intensity Statin Therapy on Regression of Coronary Atherosclerosis The ASTEROID Trial. JAMA. 2006;295(13):1556- 65. doi:10.1001/jama.295.13.jpc60002.
14. Nicholls S, Ballantyne C, Barter Ph, et al. Effects of two intensive statin regimens on progression of coronary disease. N Engl J Med. 2011;365:2078-87.
15. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J. Med. 2015;372(25):2387-97. doi:10.1056/NEJMoa1410489.
16. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713-22. doi:10.1056/NEJMoa1615664.
17. Schwartz GG, Steg GP, Szarek M, et al.; ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018;379(22):2097-107.
18. Averna M, Banach M, Bruckert E, et al. Practical guidance for combination lipid-modifying therapy in high- and very-high-risk patients: A statement from a European Atherosclerosis Society Task Force. Atherosclerosis. 2021;325:99-109.
19. Otsuka F, Sakakura K, Yahagi K, et al. Has our understanding of calcification in human coronary atherosclerosis progressed? Arteriosclerosis Thromb Vascular Biology. 2014;34(4):724-36.
20. Agatston AS, Janowitz WR, Hildner FJ, et al. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 1990;15:827.
21. Greenland P, Blaha MJ, Budoff MJ, et al. Coronary calcium score and cardiovascular risk. J Am Coll Cardiol. 2018;72(4):434-47.
22. Orringer CE, Blaha MJ, Blankstein R, et al. The National Lipid Association scientific statement on coronary artery calcium scoring to guide preventive strategies for ASCVD risk reduction. NLA Scientific Statement. Journal of Clinical Lipidology. 2021;15(1):33-60.
23. Mortensen MB, Fuster V, Muntendam P, et al. A simple disease-guided approach to personalize ACC/AHA approach to personalize ACC/AHA-recommended statin allocation in elderly people: the BioImage Study. J Am Coll Cardiol. 2016;68(9):881-91.
24. Салтыкова М.М., Уразалина С.Ж., Балахонова Т.В. и др. Частота выявления атеросклеротических бляшек в сонных артериях у мужчин и женщин с низким и умеренным СС риском по шкале SCORE в разных возрастных группах. Кардиологический вестник. 2011;2:16-20.
25. Балахонова Т.В., Жернакова Ю.В., Кавешников В.С. и др. Распространенность каротидного атеросклероза в неорганизованной популяции Томска. Системные гипертензии. 2014;4(11):37-42.
26. Головина А.Е., Катамадзе Н.О., Бондарева Е.В. и др. Роль ультразвуковой визуализации субклинического атеросклероза сонных артерий в прогнозировании сердечно-сосудистого риска в рамках первичной кардиоваскулярной профилактики. Атеросклероз и дислипидемии. 2017;1:5-16.
27. Ершова А.И., Балахонова Т.В., Мешков А. Н. и др. Распространенность атеросклероза сонных и бедренных артерий среди населения Ивановской области: исследование АТЕРОГЕН-Иваново. Кардиоваскулярная терапия и профилактика. 2021;20(5):2994. doi:10.15829/1728-8800-2021-2994.
28. Honda O, Sugiyama S, Kugiyama K, et al. Echolucent carotid plaques predict future coronary events in patients with coronary artery disease. J Am Coll Cardiol. 2004;43(7):1177-84.
29. Чернявский М. А., Иртюга О. Б., Янишевский С. Н., и др. Российский Консенсус по диагностике и лечению сонных артерий. Российский кардиологический журнал. 2022;27(11):5284. doi:10.15829/1560-4071-2022-5284.
30. Балахонова Т.В., Ершова А.И., Ежов М.В., и др. Фокусированное ультразвуковое исследование сосудов. Консенсус российских экспертов. Кардиоваскулярная терапия и профилактика. 2022;21(7):3333. doi:10.15829/1728-8800-2022-3333.
31. Krist AH, Davidson KW, Mangione CM, et al. Screening for Asymptomatic Carotid Artery Stenosis: US Preventive Services Task Force Recommendation Statement. JAMA. 2021;325(5):476-81. doi:10.1001/jama.2020.26988.
32. Razavi AC, Mehta A, Sperling LS. Statin therapy for the primary prevention of cardiovascular disease: Pros. Atherosclerosis. 2022;356:41-5.
33. Cegla J, France M, Marcovina SM, et al. Lp(a): When and how to measure it? Annals of Clinical. Biochemistry. 2021;58(1):16-21.
34. Catapano A, Daccord M, Damato E, et al. How should public health recommendations address Lp(a) measurement, a causative risk factor for cardiovascular disease (CVD)? Atherosclerosis. 2022;349:136-43. doi:10.1016/j.atherosclerosis.2022.02.013.
35. Reines-Soffer G, Ginsberg G, Berglund L, et al. Lipoprotein (a): a genetically determined, causal and prevalent risk factor for atherosclerotic cardiovascular disease: a scientific statement from the American Heart Association. Arterioscler Thromb Vasc Biol. 2022;42:e48-e60. doi:10.1161/ATV.0000000000000147.
36. Kronenberg F, Mora S, Stroes E, et al. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. European Heart Journal. 2022;43:3925-46. doi:10.1093/eurheartj/ehac361.
37. LLoyd-Jones DM, Braun LT, Smith SC, et al. Use of Risk Assessment Tools to Guide Decision-Making in the Primary Prevention of Atherosclerotic Cardiovascular Disease A Special Report From the American Heart Association and American College of Cardiology. JACC. 2019;73(24):3153-67.
38. Игонина Н.А., Журавлева Е.А., Кондрашева Е.А. и др. Анализ данных массового исследования холестерина у населения (к вопросу о референсных значениях холестерина). Клиническая лабораторная диагностика. 2013;1:11-7.
39. Оганов Р.Г., Кухарчук В.В., Арутюнов Г.П. и др. Сохраняющиеся нарушения показателей липидного спектра у пациентов с дислипидемией, получающих статины, в реальной клинической практике в Российской Федерации (российская часть исследования DYSIS). Кардиоваскулярная терапия и профилактика. 2012;11(4):1-10.
40. Ершова А.И., Мешков А.Н., Якушин С.С. и др. Диагностика и лечение больных с выраженной гиперхолестеринемией в реальной амбулаторно-клинической практике (по данным регистра РЕКВАЗА). Рациональная фармакотерапия в кардиологии. 2014;10(6):612-6.
41. Ахмеджанов Н. М., Небиеридзе Д.В., Сафарян А.С. и др. Анализ распространенности гиперхолестеринемии в условиях амбулаторной практики (по данным исследования АРГО): часть I.Рациональная фармакотерапия в кардиологии. 2015;11(3):252-9.
42. Бойцов С.А., Шахнович Р.М., Терещенко С.Н. и др. Распространенность гиперлипидемии и особенности липидснижающей терапии у пациентов с инфарктом миокарда по данным Российского регистра острого инфаркта миокарда РЕГИОН-ИМ. Кардиология. 2022;62(7):12-22. doi:10.18087/cardio.2022.7.n2051.
43. Cohen JD, Brinton EA, Ito MK. Understanding Statin Use in America and Gaps in Patient Education (USAGE): An internet-based survey of 10,138 current and former statin users. J Clin Lipidology. 2012;(3):208-15.
44. Warden B, Guyton JR, Covacs AC, et al. Assessment and management of statinassociated muscle symptoms (SAMS): A clinical perspective from the National Lipid Association. Journal of Clinical Lipidology. 2023;17:19-39.
45. Bruckert E, Hayem G, Dejager S, et al. Mild to Moderate Muscular Symptoms with HighDosage Statin Therapy in Hyperlipidemic Patients — The PRIMO Study. Cardiovascular Drugs and Therapy. 2005;19:403-14.
46. Сусеков А.В. Гиполипидемическ ая эффективность и профиль безопасности высоких доз аторвастатина и розувастатина. Кардиология. 2023;63(2):59-67. doi:10.18087/cardio.2023.2.n2407.
47. Robinson JG, Farnier M, Krempf M, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N England J Med. 2015;372(16):1489-99.
48. Moriarty PM, Write RS, Kallend D, et al. for the Odyssey Alternative Investigators. Efficacy and safety of alirocumab vs ezetimibe in statin-intolerant patients with a statin rechallenge arm: the ODYSSEY Alternative randomized trial. Journal of Clinical Lipidology. 2015;9:758- 69.
49. Ray KK, Wright RS, Kallend D, et al. Two Phase 3 Trials of Inclisiran in Patients with elevated LDL Cholesterol. N Engl J Med. 2020;382(16):1507-19. doi:10.1056/NEJMoa1912387.
50. Makhmudova U, Schatz U, Perakasis N, et al.; German Inclisiran Network (GIN). High interindividual variability in LDLcholesterol reductions after inclisiran administration in a realworld multicenter setting in Germany. Clin Res Cardiol (2023). doi:10.1007/s00392-023-02247-8.
51. Vrablik MV, Seiferd B, Parkhomenko A, et al. Lipid-lowering therapy use in primary and secondary care in Central and Eastern Europe: DA VINCI observational study. Atherosclerosis. 2021:334;66-75.
52. Barrios V, Soronan J, Carter AM, et al. Lipid management across Europe in the real-world setting: a rapid evidence review. Curr Med Res Opinion. 2021;37(12):2049-59. doi:10.1080/03007995.2021.1973396.
53. Gavina C, Carvalho DS, Afonso-Silva M, et al. Cardiovascular Risk Profile and Lipid Management in the Population-Based Cohort Study LATINO: 20 Years of Real-World Data. J.Clin. Med. 2022;11:6825. doi:10.3390/jcm1122682.
54. Pinto L, Farghaly M, Nunna S, et al. Lipid-lowering therapy patterns and the risk of cardiovascular events in the 1 year after acute myocardial infarction in United Arab Emirates. PLoS ONE. 2022;17(9):e0268709. doi:10.1371/journal.pone.0268709.
Об авторе
А. В. СусековРоссия
Доктор медицинских наук, профессор кафедры клинической фармакологии и терапии
Москва
Рецензия
Для цитирования:
Сусеков А.В. Современные алгоритмы терапии статинами. Российский кардиологический журнал. 2023;28(10):5594. https://doi.org/10.15829/1560-4071-2023-5594. EDN: AVMAYP
For citation:
Susekov V.A. Modern algorithms for statin therapy. Russian Journal of Cardiology. 2023;28(10):5594. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5594. EDN: AVMAYP
JATS XML

















































