Перейти к:
Ассоциация полиморфизмов генов FGA, ITGA2, PAI-1 с развитием тромбоэмболии легочной артерии
https://doi.org/10.15829/1560-4071-2023-5507
EDN: LTXUQK
Аннотация
Цель. Исследование связи полиморфизмов генов (FGA, ITGA2, PAI-1) с развитием тромбоэмболии легочной артерии (ТЭЛА).
Материал и методы. Мы обследовали 120 пациентов с ТЭЛА, которые составили основную группу (средний возраст — 63,22±3,16 лет). Количество мужчин — 66, средний возраст — 60,24±3,17 лет. Количество женщин — 54, средний возраст — 66,19±3,67 лет. Контрольную группу составили 200 человек, средний возраст — 64,92±3,50 лет. Банк ДНК НИИТПМ — филиал ИЦиГ СО РАН сформирован в ходе проведения ряда популяционных скринингов. Все пациенты дали письменное добровольное информированное согласие на участие в молекулярно-генетическом исследовании. В работе осуществлялся расчет следующих выходных данных и параметров на основе собранных входящих статистических данных: стандартной девиации; вычисление среднего квадратичного значения; Хи-квадрата Пирсона; отношения правдоподобия; точного критерия Фишера и линейно-линейной связи.
Результаты. Было выявлено, что вероятность развития ТЭЛА среди женщин — носительниц генотипа ID полиморфизма rs35496957 гена FGA в группе с ТЭЛА в 2,08 раза превышает таковой в группе контроля (95% доверительный интервал (ДИ): 1,06-4,09; р=0,32); среди женщин носительниц генотипа TT полиморфизма rs1126643 гена ITGA2 в группе с ТЭЛА — в 3,08 раза по сравнению с контрольной группой (95% ДИ: 1,36-6,97; р=0,006).
Заключение. Изучение генетических факторов развития ТЭЛА (FGA, ITGA2, PAI-1) необходимо для создания персонифицированного подхода к ведению пациента на всех этапах.
Для цитирования:
Крючкова Н.М., Никулина С.Ю., Чернова А.А., Максимов В.Н. Ассоциация полиморфизмов генов FGA, ITGA2, PAI-1 с развитием тромбоэмболии легочной артерии. Российский кардиологический журнал. 2023;28(10):5507. https://doi.org/10.15829/1560-4071-2023-5507. EDN: LTXUQK
For citation:
Kryuchkova N.M., Nikulina S.Yu., Chernova A.A., Maksimov V.N. Association of FGA, ITGA2, PAI-1 gene polymorphisms with pulmonary embolism. Russian Journal of Cardiology. 2023;28(10):5507. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5507. EDN: LTXUQK
Тромбоэмболия легочной артерии (ТЭЛА) — одно из часто встречающихся неотложных состояний в клинической практике. Заболеваемость ТЭЛА составляет 39-115 случаев на 100 тыс. населения, а у лиц старше 80 лет вероятность заболевания в 8 раз выше, чем у людей в возрасте от 40 до 50 лет. Ежегодная частота рецидивов после окончания терапевтической коагуляции составляет 2,5-4,3%, в зависимости от профиля риска. Госпитальная смертность составила 57,4-71,4% после массивной ТЭЛА с остановкой сердца, 5,8-11,2% при субмассивной ТЭЛА с дисфункцией правого желудочка и 0,4-0,9% при ТЭЛА низкого риска [1][2].
ТЭЛА — это мультифакторное заболевание, обусловленное как приобретенными, так и наследственными факторами риска. Понимание клинического и генетического риска ТЭЛА определяет выбор как профилактического, так и лечебного алгоритма ведения пациентов. Некоторые исследователи полагают, что наличие определенных полиморфизмов генов ассоциировано с более тяжелым течением заболевания [3].
Противоречивость данных опубликованных исследований, посвященных генетической природе ТЭЛА, показывает неоднозначность полученных сведений. Исследователями даже высказывается мнение, что ни один генетический дефект не может предсказать риск рецидива венозной тромбоэмболии (ВТЭ) на текущем этапе накопления сведений [4]. Данная проблема остается, несмотря на внушительность количества проведенных исследований генетических детерминант и полиморфизмов, ассоциированных с риском развития ТЭЛА. Мнения различных авторов по поводу взаимосвязи полиморфизмов генов, в частности FGA, PAI-1, ITGA2 различаются, поэтому необходим анализ полиморфизмов для создания персонифицированного подхода на этапах лечебнодиагностического ведения пациентов.
Фибриноген является фактором F1 свертываемости крови и локализован на длинном плече IV хромосомы. Фибриноген отвечает за регуляцию финального этапа каскада коагуляции, он представляет собой гликопротеин с 340 кДа, который синтезируется в печени и активируется до фибрина тромбином. Полиморфизмы в гене фибриногена альфа (FGA) были связаны с ВТЭ [5]. Несколькими исследовательскими группами была доказана ассоциация полиморфизма гена FGA (rs35496957) с предрасположенностью к хронической тромбоэмболической легочной гипертензии, связанной с низкой стабильностью мРНК длинной изоформы α-фибриногена, при этом продемонстрирована роль микро-РНК miR-759, взаимодействующей с полиморфным участком. Предрасположенность к патологии может быть связана с большим количеством общей фракции α-фибриногена и меньшим количеством его длинной изоформы [6].
Интегрин α2 (1181 аминокислота) кодируется геном ITGA2, который расположен на хромосоме 5 и содержит 30 экзонов. Гены GP1BA и ITGA2 кодируют, соответственно, гликопротеин Ib и интегрин α2β1, которые отвечают за связывание тромбоцитов с коллагеном. Выявлено, что SNP гена ITAG2, идентифицированный как gPLA C807T (rs1126643), изменяет экспрессию гликопротеинов мембраны тромбоцитов Ia/IIa. Носители генотипа TT (гомозиготные носители минорного аллеля) экспрессируют самые высокие уровни, носители CT (гетерозиготы) промежуточные уровни, а носители CC (гомозиготные носители основного аллеля) самые низкие уровни GPIa/IIa [7].
Полиморфизм С807Т представляет собой нуклеотидную замену цитозина на тимин. Наличие Т-аллеля ассоциируется с увеличением скорости адгезии тромбоцитов, что может являться фактором риска тромбофилии. Выявлена достоверная ассоциация полиморфизма C807T гена ITGA2, встречающегося у 60% пациентов со злокачественными опухолями торакоабдоминальной локализации и с венозным тромбозом и ТЭЛА в анамнезе, vs 19,8% случаев в контрольной группе онкологических больных (в гомозиготном состоянии в 22,5% и в 6,2% наблюдений, соответственно) [8]. Исследован полиморфизм гена ITGA2 у пациентов с болезнью Кавасаки (БК) разного возраста и пола, которая является системным васкулитом, и вызывает формирование поражений коронарных артерий (ПКА) в качестве наиболее распространенного последствия. Обнаружен значительно повышенный риск БК с ПКА, связанный с генотипами ITGA2 rs1126643 (CT против CC, отношение шансов (ОШ) =1,57, доверительный интервал (ДИ): 1,16-2,12, p=0,0032; CT/TT vs CC: ОШ =1,49, ДИ: 1,12-2,00, p=0,0068; T vs C: ОШ =1,66, ДИ: 1,16-2,51, p=0,0165). Выявлено также, что носители ге-
нотипа CT/TT имели значительный риск БК с восприимчивостью к ПКА у детей в возрасте до 60 мес., а генотип CT/TT был достоверно связан с повышенным риском образования чешуек и ПКА по сравнению с генотипом CC [9]. Мутация C807 в гене ITGA2 связана с риском раннего инфаркта миокарда, ишемического инсульта, эмболии, тромбоза после ангиопластики и стентирования коронарных артерий. Установлено, что носительство аллеля T ITGA2 характерно для 72,1% пациентов с острым коронарным синдромом и сочетается со спонтанным ускорением агрегации тромбоцитов и повышает чувствительность тромбоцитов к аденозинофосфату и коллагену. Полученные результаты позволяют рассматривать носительство Т-аллеля как маркер предрасположенности к тромбофилии [10].
Ингибитор активатора плазминогена-1 — член суперсемейства ингибиторов сериновых протеаз (serpin) с антипротеазной активностью, является основным физиологическим ингибитором активаторов плазминогена (PAs) тканевого типа (tPA) и урокиназного типа (uPA), а следовательно, ингибитором перицеллюлярного протеолиза и внутрисосудистого фибринолиза, соответственно. Избыток ингибитора активатора плазминогена-1 приведет к гиперкоагуляционному состоянию за счет ингибирования tPA [11]. Ген, кодирующий данный белок, — PAI-1 или SERPINE1. Сообщалось, что 4G/5G полиморфизм PAI-1 связан с риском ВТЭ, ишемического инсульта, некроза бедренной кости, диабетической нефропатии, рака и системной красной волчанки. Однако связь полиморфизма PAI-1 4G/5G с восприимчивостью, эффективностью лечения и рецидивирующим статусом ВТЭ изучена недостаточно [12]. Возможность влияния полиморфизма PAI‐1 на индивидуальную восприимчивость к тромботическим нарушениям, в частности ВТЭ, не отрицается. В последние годы во многих исследованиях сообщалось о результатах, касающихся потенциальных ассоциаций между полиморфизмом A/G PAI‐1 rs1799889 и ВТЭ. Однако результаты были несколько противоречивыми. Существует мнение, что полиморфизм PAI-1 rs1799889 был достоверно связан с ВТЭ у европеоидов и жителей Восточной Азии. Дальнейшие анализы выявили аналогичные значимые ассоциации у них с тромбозом глубоких вен и с мутацией фактора V Лейдена [13].
Цель работы: исследование связи полиморфизмов генов (FGA, ITGA2, PAI-1) с развитием ТЭЛА.
Материал и методы
В работе приняли участие 120 пациентов (основная группа), перенесшие ТЭЛА. Средний возраст составил 63,22±3,16 лет (66 мужчин, средний возраст — 60,24±3,17 лет; 54 женщины, средний возраст — 66,19±3,67 лет). Контрольная группа (200 человек, средний возраст — 64,92±3,50 лет) была сформирована из банка ДНК НИИТПМ — филиал ИЦиГ СО РАН (100 мужчин, средний возраст — 63,64±3,03 лет; 100 женщин, средний возраст — 70,05±3,89 лет). Банк ДНК НИИТПМ — филиал ИЦиГ СО РАН сформирован на основе популяционной выборки 45-69-летних жителей Октябрьского и Кировского районов г. Новосибирска (9400 человек), которая была собрана НИИ терапии СО РАМН в ходе работы по международному проекту HAPIEE (Health, Alcohol and Psychosocial factors In Eastern Europe). Программа исследования включала: измерение артериального давления, антропометрия (рост, масса, объём талии, бёдер), социально-демографические характеристики, опрос о личном и семейном анамнезе заболеваний, курении, употреблении алкоголя (частота и типичная доза), уровне физической активности, оценку липидного профиля (общий холестерин; триглицериды, холестерин липопротеидов высокой плотности), опрос на выявление стенокардии напряжения (Rose), электрокардиограмма покоя в 12 отведениях. Все пациенты дали письменное добровольное информированное согласие на участие в молекулярно-генетическом исследовании.
Таблица 1
Анализ гендерных и возрастных параметров пациентов основной и контрольной групп
|
Показатель |
Абсолютное число |
Относительное число (%) |
Средний возраст |
|
Основная группа |
|||
|
Мужчины |
66 |
55,9 |
60,24±3,17 |
|
Женщины |
54 |
44,1 |
66,19±3,67 |
|
Всего |
120 |
100 |
63,22±3,16 |
|
Группа контроля |
|||
|
Мужчины |
100 |
50 |
63,64±3,03 |
|
Женщины |
100 |
50 |
70,05±3,89 |
|
Всего |
200 |
100 |
64,92±3,50 |
Таблица 2
Сравнительная характеристика частоты встречаемости генотипов полиморфизма rs35496957 гена FGA в исследуемых группах
|
Генотипы |
Основная группа |
Контрольная группа |
||
|
Абс. |
Отн. |
Абс. |
Отн. |
|
|
II |
8 |
6,7 |
15 |
7,5 |
|
ID |
65 |
54,2 |
97 |
48,5 |
|
DD |
47 |
39,2 |
88 |
44,0 |
Таблица 3
Сравнительная характеристика частоты встречаемости генотипов и аллелей полиморфизма rs1126643 гена ITGA2 в основной и контрольной группах
|
Генотипы |
Основная группа |
Контрольная группа |
||
|
Абс. |
Отн. |
Абс. |
Отн. |
|
|
СС |
44 |
36,7 |
69 |
34,5 |
|
СТ |
48 |
40,0 |
101 |
50,5 |
|
ТТ |
28 |
23,3 |
30 |
15,0 |
В таблице 1 приведены параметры исследуемых пациентов основной и контрольной групп.
В работе использовались образцы цельной крови, плазмы и сыворотки, образцы ДНК. Проводился анализ историй болезни пациентов, перенесших ТЭЛА в анамнезе. Экстракцию ДНК из венозной крови проводили фенол-хлороформным методом. FGA (Del/Ins) rs35496957 генотипировали с помощью полимеразной цепной реакции с фланкирующими праймерами-8202 A/G. Полиморфизмы генов (ITGA2, PAI-1) тестировали с помощью полимеразной цепной реакции в реальном времени на тест-системах производства «ДНК-технология» на приборе ДТ-Прайм.
Работа осуществлялась на базе ноутбука DELL Latitude 5420 Intel(R) Core (TM) i5 под управлением операционной системы Windows 10. Для структурирования и обработки статистических данных в работе использовался Microsoft Excel из комплекса программного обеспечения пакета Microsoft Office и программный пакет для статистического анализа STATISTICA. В работе осуществлялся расчет следующих выходных данных и параметров на основе собранных входящих статистических данных: вычисление среднего квадратичного значения, стандартной девиации, t-критерия Стьюдента.
Результаты
Анализ частоты встречаемости генотипов полиморфизма rs35496957 гена FGA среди исследуемых пациентов приведен в таблице 2.
Рисунки 1 и 2 представляют информацию о частоте встречаемости генотипов и аллелей полиморфизма rs35496957 гена FGA в основной и контрольной группах соответственно гендерной характеристике. Соответственно представленным данным можно отметить факт того, что отношение шансов обнаружить женщин носительниц генотипа ID полиморфизма rs35496957 гена FGA в группе с ТЭЛА в 2,08 раза превышает таковой в группе контроля (95% ДИ: 1,06-4,09; р=0,32).
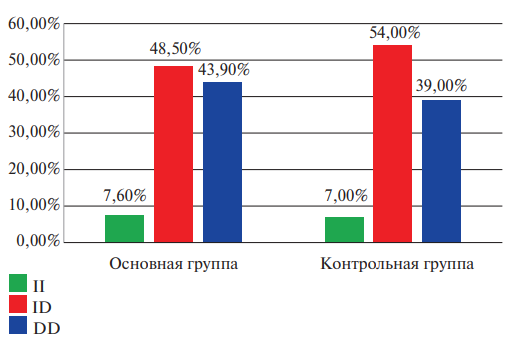
Рис. 1. Соотношение частоты встречаемости генотипов полиморфизма rs35496957 гена FGA в контрольной и основной группах у мужчин (в процентном соотношении).
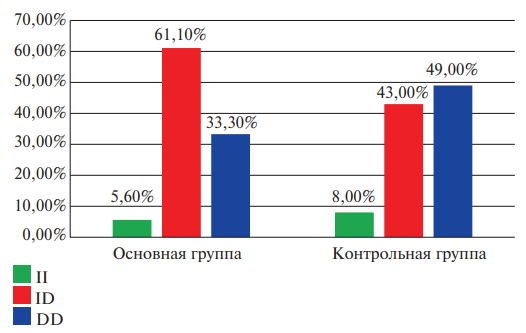
Рис. 2. Отношение частоты встречаемости генотипов полиморфизма rs35496957 гена FGA в контрольной и основной группах у женщин (в процентном соотношении).
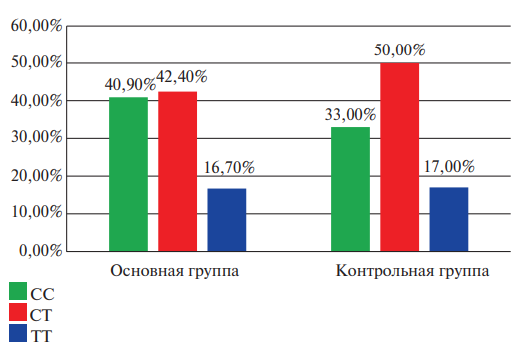
Рис. 3. Сравнительная характеристика частоты встречаемости генотипов полиморфизма rs1126643 гена ITGA2 среди мужчин исследуемых групп (в процентном соотношении).
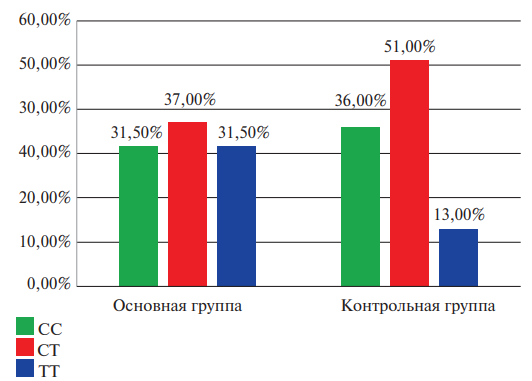
Рис. 4. Сравнительная характеристика частоты встречаемости генотипов полиморфизма rs1126643 гена ITGA2 среди исследуемых женщин двух групп (в процентном соотношении).
Анализ частоты встречаемости генотипов полиморфизма rs1126643 гена ITGA2 в контрольной и основной группах приведен в таблице 3.
На рисунках 3 и 4 приведен сравнительный анализ частоты встречаемости генотипов полиморфизма rs1126643 гена ITGA2 в группах исследования с учетом половой принадлежности.
Результаты свидетельствуют о том, что вероятность выявления женщин носительниц генотипа TT полиморфизма rs1126643 гена ITGA2 в группе с ТЭЛА в 3,08 раза выше по сравнению с контрольной группой (95% ДИ: 1,36-6,97; р=0,006).
На рисунке 5 проанализирована частота встречаемости генотипов и аллелей гена PAI rs1799889 (-675 5G>4G) в изучаемых группах.
Полученные данные оказались сопоставимыми, статистически значимых различий выявлено не было. Отмечена тенденция более частой встречаемости генотипа GT полиморфизма гена PAI-1 rs1799889 (-675 5G>4G) в группе с ТЭЛА.
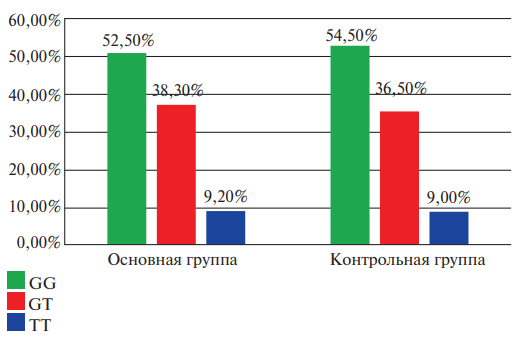
Рис. 5. Сравнительная характеристика частоты встречаемости генотипов гена PAI-1 rs1799889 (-675 5G>4G) среди исследуемых пациентов двух групп (в процентном соотношении).
Обсуждение
В настоящее время большое внимание в исследовательских работах уделяется вопросам полиморфизма генов у пациентов, перенесших в анамнезе ТЭЛА, и их роли в развитии данного патологического состояния [14].
Предрасполагающими к возникновению ТЭЛА при наличии различных ДНК-полиморфизмов являются такие факторы, как: тромбоз глубоких вен в анамнезе, онкопатология, хирургические вмешательства, избыточная масса тела, вредные привычки, прием оральных контрацептивов [15].
В нашей работе при исследовании связи полиморфизмов генов (FGA, ITGA2, PAI-1) с развитием ТЭЛА также было продемонстрировано, что среди женщин, носительниц генотипа ID полиморфизма rs35496957 гена FGA в основной группе, вероятность развития ТЭЛА в 2,08 раза превышает таковой в группе контроля (95% ДИ: 1,06-4,09; р=0,32). Зарегистрировано, что вероятность выявления женщин — носительниц генотипа TT полиморфизма rs1126643 гена ITGA2 в группе с ТЭЛА в 3,08 раза выше по сравнению с контрольной группой (95% ДИ: 1,36-6,97; р=0,006).
Таким образом, дальнейшее выполнение работ, направленных на выявление связи между развитием ТЭЛА и полиморфизмом определенных генов, имеет важное прогностическое значение при оценке алгоритмов ведения пациентов в клинической практике.
Заключение
Изучение генетических факторов развития ТЭЛА (FGA, ITGA2, PAI-1) необходимо для создания персонифицированного подхода к ведению пациента на всех этапах.
Отношения и деятельность. Молекулярно-генетический фрагмент исследования выполнен в рамках бюджетной темы № 122031700094-5.
Список литературы
1. Крукович А.А., Примак Н.В., Захарчук Н.В. и др. Тромбоэмболия легочной артерии: вопросы диагностики и прогноза. Тихоокеанский медицинский журнал. 2017;4:31-7. doi:10.17238/PmJ1609-1175.2017.4.31-37.
2. Макарова Н.В., Бусалаева Е.И., Туйзарова И.А. и др. Сложности диагностики тромбоэмболии легочной артерии в клинической практике. Ульяновский медикобиологический журнал. 2022;3:35-42. doi:10.34014/2227-1848-2022-3-35-42.
3. Zöller B, Svensson PJ, Dahlbäck B, et al. Genetic risk factors for venous thromboembolism. Expert Rev Hematol. 2020;13(9):971-81. doi:10.1080/17474086.2020.1804354.
4. Hodeib H, Youssef A, Allam AA, et al. Genetic Risk Profiling Associated with Recurrent Unprovoked Venous Thromboembolism. Genes (Basel). 2021;12(6):874. doi:10.3390/genes12060874.
5. Jankowska KI, Sauna ZE, Atreya CD. Role of microRNAs in Hemophilia and Thrombosis in Humans. Int J Mol Sci. 2020;21(10):3598. doi:10.3390/ijms21103598.
6. Золотова Е.А., Симакова М.А., Жиленкова Ю.И. и др. Роль микро-РНК в патогенезе венозных тромбоэмболических осложнений. Российский журнал персонализированной медицины. 2022;2(1):43-50. doi:10.18705/2782-3806-2022-2-1-43-50.
7. Rath D, Schaeffeler E, Winter S, et al. GPla Polymorphisms Are Associated with Outcomes in Patients at High Cardiovascular Risk. Front Cardiovasc Med. 2017;4:52. doi:10.3389/fcvm.2017.00052.
8. Королева А.А., Герасимов С.С., Кононец П.В. и др. Оценка роли полиморфизмов генов системы гемостаза в развитии венозного тромбоза и тромбоэмболии легочной артерии в периоперационном периоде у пациентов со злокачественными опухолями торакоабдоминальной локализации. Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. 2021;9(1):55-62. doi:10.33029/2308-1198-2021-9-1-55-62.
9. Yuan J, Jiang Z, Li M, et al. Integrin α2 gene polymorphism is a risk factor of coronary artery lesions in Chinese children with Kawasaki disease. Pediatr Rheumatol Online J. 2021;19(1):12. doi:10.1186/s12969-021-00494-5.
10. Netiazhenko V, Liakhotska AV. Hypercholesterolemia as a factor in the risk stratification of patients with hypertension depending on the ITGA2 gene polymorphism. European Heart Journal. 2021;42(Supplement_1):ehab724.2331. doi:10.1093/eurheartj/ehab724.2331
11. Капустин С.И., Сидорова Ж.Ю., Шмелева В.М. и др. Особенности аллельного полиморфизма некоторых генов системы гемостаза у больных с тромбозом глубоких вен, осложненным тромбоэмболией легочной артерии. Вестник гематологии. 2017;13(4):37-42.
12. Dayco J, Ataya T, Tidwell C, et al. Plasminogen Activator Inhibitor-1 4G/5G Polymorphism Presenting as Recurrent Ischemic Stroke: The Microthrombi Shower. Cureus. 2022;14(4):e23828. doi:10.7759/cureus.23828.
13. Wang Z, Kong L, Luo G, et al. Clinical impact of the PAI-1 4G/5G polymorphism in Chinese patients with venous thromboembolism. Thromb J. 2022;20(1):68. doi:10.1186/s12959-022-00430-x.
14. Мелкумян А.Л., Берковский А.Л., Васильев С.А. и др. Тромботические заболевания и состояния — диагностика и контроль антикоагулянтной терапии. Медицинский совет. 2020;(21):256-66. doi:10.21518/2079-701X-2020-21-256-266.
15. Панченко Е.П., Балахонова Т.В., Данилов Н.М. и др. Диагностика и лечение тромбоэмболии лёгочной артерии: клинические рекомендации евразийской ассоциации кардиологов для практических врачей. Евразийский Кардиологический Журнал. 2021;(1):44-77. doi:10.38109/2225-1685-2021-1-44-77
Об авторах
Н. М. КрючковаРоссия
Крючкова Нина Михайловна — аспирант кафедры факультетской терапии, врач-кардиолог
Красноярск
С. Ю. Никулина
Россия
Никулина Светлана Юрьевна — доктор медицинских наук, профессор, заведующий кафедрой факультетской терапии
Красноярск
А. А. Чернова
Россия
Чернова Анна Александровна — доктор медицинских наук, профессор кафедры факультетской терапии КрасГМУ им. проф. В.Ф. Войно-Ясенецкого, руководитель отдела науки и инноваций СКЦ ФМБА России
г. Красноярск, ул. Партизана Железняка, 1, 660022
В. Н. Максимов
Россия
Максимов Владимир Николаевич — доктор медицинских наук, профессор, заведующий лабораторией молекулярно-генетических исследований терапевтических заболеваний
Новосибирск
Дополнительные файлы
Рецензия
Для цитирования:
Крючкова Н.М., Никулина С.Ю., Чернова А.А., Максимов В.Н. Ассоциация полиморфизмов генов FGA, ITGA2, PAI-1 с развитием тромбоэмболии легочной артерии. Российский кардиологический журнал. 2023;28(10):5507. https://doi.org/10.15829/1560-4071-2023-5507. EDN: LTXUQK
For citation:
Kryuchkova N.M., Nikulina S.Yu., Chernova A.A., Maksimov V.N. Association of FGA, ITGA2, PAI-1 gene polymorphisms with pulmonary embolism. Russian Journal of Cardiology. 2023;28(10):5507. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5507. EDN: LTXUQK
JATS XML

















































