Перейти к:
Фактор дифференцировки роста-15 — новый показатель неблагоприятного прогноза при неосложненном инфаркте миокарда
https://doi.org/10.15829/1560-4071-2023-5381
EDN: SAEQOS
Аннотация
Цель. Оценить роль фактора дифференцировки роста-15 (GDF-15) в долгосрочном прогнозе у пациентов с неосложненным инфарктом миокарда (ИМ).
Материал и методы. В исследование включено 118 пациентов с неосложненным ИМ с подъемом и без подъема сегмента ST на электрокардиограмме. Помимо рутинного обследования всем пациентам было проведено определение GDF-15, а также N-концевого промозгового натрийуретического пептида (NT-proBNP) методом иммуноферментного анализа в первые 48 ч от начала клинической картины ИМ. Динамика состояния пациентов оценивалась методами опроса через 1, 3, 6, 12 мес., а также анализа медицинской документации при возникновении повторных сердечно-сосудистых событий (ССС) и летальных исходов. Конечными точками были сердечно-сосудистая смерть, госпитализации в стационар по поводу повторного ИМ и/или нестабильной стенокардии. Для оценки значимости количественных признаков при прогнозировании повторных ССС применялся метод анализа ROC-кривых. Оценка функции выживаемости пациентов проводилась по методу Каплана-Мейера.
Результаты. За 12 мес. наблюдения было зарегистрировано 29 повторных ССС, в т.ч. 2 летальных исхода и 8 повторных ИМ. GDF-15 показал прогностическую способность в отношении повторных ССС с чувствительностью 77,3% и специфичностью 56,2% (ROC AUC 0,7±0,065 (95% доверительный интервал (ДИ): 0,572-0,827), p=0,004). Пациенты, у которых GDF-15 был
≥2,075 нг мл, имели более высокий риск повторных ССС (отношение рисков (ОР) 3,4 (95% ДИ: 1,342-8,613), р=0,005). Другим прогностическим фактором, влияющим на скорость наступления повторных ССС, оказался NT-proBNP. Уровень NT-proBNP ≥578 пг/мл ассоциировался с увеличением риска кардиоваскулярной смерти и повторных госпитализаций по поводу нестабильной стенокардии и повторного ИМ (ОР 4,3 (95% ДИ: 1,828-10,239), р=0,00019).
Заключение. Сочетанное повышение уровней GDF-15 2,075 нг/мл и NTproBNP ≥578 пг/мл у пациентов с неосложненным ИМ свидетельствует об увеличении риска повторных ССС в течение следующих 12 мес. (ОР 4,5 (95% ДИ: 2,087-9,736), р=0,00018).
Ключевые слова
Для цитирования:
Сабирзянова А.А., Галявич А.С., Балеева Л.В., Галеева З.М. Фактор дифференцировки роста-15 — новый показатель неблагоприятного прогноза при неосложненном инфаркте миокарда. Российский кардиологический журнал. 2023;28(8):5381. https://doi.org/10.15829/1560-4071-2023-5381. EDN: SAEQOS
For citation:
Sabirzyanova A.S., Galyavich A.S., Baleeva L.V., Galeeva Z.V. Growth differentiation factor-15 — a new indicator of unfavorable prognosis in uncomplicated myocardial infarction. Russian Journal of Cardiology. 2023;28(8):5381. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5381. EDN: SAEQOS
Болезни системы кровообращения являются лидирующей причиной смертности взрослого населения в Российской Федерации. В их структуре инфаркт миокарда (ИМ) занимает одно из первых мест [1]. На сегодняшний день оценка прогноза пациентов после ИМ и связанный с этим поиск новых информативных маркеров и создание прогностических шкал являются актуальными задачами. Перспективным в этой области является изучение потенциальной прогностической способности одного из новых биомаркеров — фактора дифференцировки роста-15 (GDF-15). GDF-15 — это маркер окислительного стресса и воспаления, который экспрессируется и при остром повреждении тканей [2]. Исследований, изучающих роль GDF-15 у пациентов с ИМ, не так много. Предполагается, что повышенные уровни GDF-15 независимо связаны со смертностью у пациентов с ИМ с подъемом и без подъема сегмента ST на электрокардиограмме (ЭКГ) [3][4].
Материал и методы
Проведено проспективное обсервационное исследование, в которое было включено 118 пациентов с ИМ с подъемом или без подъема сегмента ST на ЭКГ в возрасте до 70 лет, подписавших добровольное информированное согласие на участие в исследовании. Критериями исключения из исследования были: возраст старше 70 лет; острое и/или обострение хронического воспалительного заболевания любой этиологии и локализации в течение 6 мес. до госпитализации; заболевания соединительной ткани; сахарный диабет 1 типа или 2 типа; острое нарушение мозгового кровообращения или транзиторная ишемическая атака менее чем за 6 мес. до включения в исследование; любые нарушения ритма и/или проводимости сердца, требующие медикаментозного лечения, в т.ч. фибрилляция предсердий; сердечная недостаточность II и выше класса по Killip; фракция выброса по Симпсону <40% по данным эхокардиографии (ЭхоКГ); онкологические заболевания в анамнезе; беременность и период лактации; алкоголизм; наркомания.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен Локальным этическим комитетом (протокол № 4 от 24.04.2018г).
Всем пациентам, включенным в исследование, проводилось обследование, включающее: сбор анамнеза; физикальный осмотр; лабораторные анализы (в т.ч. общий анализ крови, биохимический анализ крови, включавший креатинин, мочевину, калий, натрий, полный липидный профиль, определение уровней высокочувствительного тропонина T и N-концевого промозгового натрийуретического пептида (NT-proBNP), скорости клубочковой фильтрации, коагулограмму); инструментальные методы исследования (в т.ч. ЭКГ, суточное мониторирование ЭКГ, ЭхоКГ).
Также всем пациентам был определен уровень GDF-15 в плазме сэндвич-методом иммуноферментного анализа в первые 48 ч от начала клинической картины ИМ. Иммуноферментный анализ проводился с использованием реактивов ELISA Kit for Growth Differentiation factor 15 (Cloud-Clone Corp., США). Чувствительность метода 0,065 нг/мл. Диапазон определения GDF-15 составлял 0,156-10 нг/мл.
Клиническая динамика состояния пациентов оценивалась методом опроса через 1, 3, 6 и 12 мес. после выписки из стационара, а также проводился анализ медицинской документации в случаях развития повторных сердечно-сосудистых событий (ССС) и летальных исходов. Регистрировались повторные ССС, включающие повторный ИМ и/или госпитализации в стационар по причине нестабильной стенокардии, а также летальные исходы.
Лечение всех пациентов проводилось в соответствии с современными клиническими рекомендациями. Не было различий по частоте назначения основных групп лекарственных препаратов у пациентов с последующим развитием повторных ССС и пациентов без развития повторных ССС в течение 12 мес. наблюдения, что показано в таблице 1.
Всем включенным в исследование пациентам при поступлении была проведена коронароангиография, после чего 96 пациентам было проведено стентирование коронарных артерий (включая 7, которым была проведена догоспитальная тромболитическая терапия), у 6 пациентов в качестве метода реваскуляризации было выбрано экстренное аортокоронарное/маммарокоронарное шунтирование, у 16 реваскуляризации проведено не было. По результатам анализа не было выявлено зависимости развития повторных ССС от отсутствия или наличия реваскуляризации, а также ее стратегии (χ2=1,9; p=0,164).
Анализ данных проводился по 110 параметрам, включая клинические, лабораторные и инструментальные показатели. Статистическая обработка полученных данных проводилась с помощью программы IBM SPSS Statistics v23.1.1. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Колмогорова-Смирнова. Описание количественных показателей, имевших нормальное распределение, представлялось в виде средних арифметических величин (M) и стандартных отклонений (σ), как M±σ. Количественные показатели, чье распределение отличалось от нормального, описывались с помощью значений медианы (Me) и нижнего и верхнего квартилей (Q1-Q3). Статистическая значимость различий количественных показателей оценивалась по t-критерию Стьюдента для нормального распределения и по непараметрическому U-критерию Манна-Уитни для распределения, отличающегося от нормального; для качественных показателей использовался критерий χ2 Пирсона. В качестве показателя тесноты связи между количественными показателями использовались коэффициенты корреляции Пирсона и Спирмена. Независимое влияние потенциальных факторов риска, в т.ч. уровня GDF- 15, на вероятность наступления повторных ССС за 12 мес. наблюдения оценивалось с помощью регрессионного анализа. Для оценки диагностической значимости количественных признаков при прогнозировании повторных ССС применялся метод анализа ROC-кривых. Оценка функции выживаемости пациентов проводилась по методу Каплана-Мейера. Результаты считались статистически значимыми при значениях p≤0,05.
Таблица 1
Частота назначения основных групп лекарственных препаратов
|
Группа препаратов |
Пациенты с повторными ССС (n=22) |
Пациенты без повторных ССС (n=96) |
p |
|
Ацетилсалициловая кислота |
100% |
100% |
1,000 |
|
Ингибиторы P2Y12 рецепторов |
100% |
100% |
1,000 |
|
Бета-адреноблокаторы |
100% |
91,7% |
0,161 |
|
иАПФ/БРА |
95,5% |
82,3% |
0,122 |
|
Ингибиторы ГМГ-КоА-редуктазы |
95,5% |
97,9% |
0,51 |
Сокращения: БРА — блокаторы рецепторов ангиотензина II, ГМГ-КоА-редуктаза — 3-гидрокси-3-метилглютарил-кофермент А редуктаза, иАПФ — ингибиторы ангиотензинпревращающего фермента, ССС — сердечно-сосудистые события.
Результаты
Средний возраст включенных в исследование пациентов составил 57,3±8,7 лет. Среди них было 97 мужчин (82,2%) и 21 женщина (17,8%). В исследование включались пациенты, у которых был анамнез по сердечно-сосудистым заболеваниям, а именно у 65,3% пациентов была гипертоническая болезнь, у 12,7% имелся постинфарктный кардиосклероз, а 2,5% пациентов перенесли аортокоронарное шунтирование.
Средний уровень GDF-15 у пациентов с неосложненным ИМ составил 2,25±1,0 нг/мл. Не было выявлено зависимости уровней GDF-15 от возраста и пола пациентов. При анализе GDF-15 в подгруппах не обнаружено статистически значимой зависимости его концентрации с наличием у пациентов традиционных сердечно-сосудистых факторов риска, таких как курение, индекс массы тела, гипертоническая болезнь, постинфарктный кардиосклероз в анамнезе, уровни общего холестерина и холестерина липопротеидов низкой плотности.
За 12 мес. наблюдения 22,8% пациентов повторно госпитализировались в стационары по поводу нестабильной стенокардии или повторного ИМ. Всего случилось 29 повторных ССС, в т.ч. 2 летальных исхода и 8 повторных ИМ. Оба летальных исхода по данным аутопсии произошли за счет крупноочагового трансмурального ИМ. На рисунке 1 представлено распределение повторных ССС по времени наблюдения.
В таблице 2 представлена характеристика подгрупп пациентов с наличием повторных ССС и без них в течение 12 мес. наблюдения. Пациенты с повторными ССС были старше (66,36±7,43 vs 56,61±8,89 лет; p=0,047) и имели более высокие уровни GDF-15 (2,82±1,12 vs 2,13±0,95 нг/мл; p=0,012) и NT-proBNP (1449,5 (198,25; 2950,75) vs 269 (123; 875,75) пг/мл; p=0,05).
Нами была проведена оценка прогностического значения уровня GDF-15 у пациентов с неосложненным ИМ с помощью метода анализа ROC-кривых с определением оптимального разделяющего значения GDF-15 (точки отсечения), позволяющего классифицировать пациентов по степени риска наступления повторных ССС с наилучшим сочетанием чувствительности и специфичности, что представлено на рисунке 2. Точкой отсечения стало значение GDF-15 2,075 нг/мл, при чувствительности 0,773 (77,3%) и 0,438 1-специфичности (соответствует специфичности, равной 56,2%). Площадь под кривой (ROC AUC) равна 0,7±0,065 (95% доверительный интервал (ДИ): 0,572-0,827), p=0,004, что свидетельствует о хорошей прогностической способности GDF-15.
Выявлено, что имеются значимые различия в частоте и времени появления первого повторного ССС у пациентов после неосложненного ИМ в зависимости от уровней GDF-15, что графически показано на рисунке 3 в виде кривых выживаемости Каплана-Мейера. Среднее ожидаемое время без повторного ССС в группе пациентов с GDF-15 <2,075 нг/мл составляет 11,36±0,35 мес. (95% ДИ: 10,67-12,04), а в группе пациентов с GDF-15 ≥2,075 нг/мл — 9,85±0,53 мес. (95% ДИ: 8,8-10,89), p=0,005. Мы можем сделать вывод, что имеются значимые различия в функции вероятности не получить комбинированную конечную точку в виде кардиоваскулярной смертности и повторных госпитализаций по поводу нестабильной стенокардии и повторного ИМ в зависимости от уровня GDF-15. Пациенты, у которых GDF-15 ≥2,075 нг/мл, имеют более высокий риск повторных ССС (отношение рисков (ОР) 3,4 (95% ДИ: 1,342-8,613), р=0,005).
Еще одним биомаркером, который показал взаимосвязь с повторными ССС в нашем исследовании, а также корреляционную связь умеренного порядка с GDF-15 (r=0,36, p<0,01), был NT-proBNP. ROC-кривая для NT-proBNP и кривые выживаемости Каплана-Мейера для пациентов с уровнями NT-proBNP ниже и выше точки отсечения представлены на рисунках 4 и 5. NT-proBNP обладает средней прогностической способностью (ROC AUC =0,69±0,069 (95% ДИ: 0,561-0,832), p=0,004), с точкой отсечения, равной 578 пг/мл для 0,727 (72,7%) чувствительности и 0,302 1-специфичности (69,8% специфичности). Среднее ожидаемое время без повторного ССС в группе пациентов с NT-proBNP <578 пг/мл составляет 11,27±0,29 мес. (95% ДИ: 10,71-11,84), а в группе пациентов с NT-proBNP ≥578 пг/мл — 9,51±0,65 мес. (95% ДИ: 8,24-10,79), p=0,00002. Получается, что в нашем исследовании уровень NT-proBNP ≥578 пг/мл ассоциировался с увеличением риска кардиоваскулярной смерти и повторных госпитализаций по поводу нестабильной стенокардии и повторного ИМ (ОР 4,3 (95% ДИ: 1,828-10,239), р=0,00019).
Исходя из полученных результатов, была оценена возможность совместного применения двух биомаркеров — GDF-15 и NT-proBNP — для прогнозирования высокого риска повторных ССС, что наглядно продемонстрировано на рисунке 6, показывающем кривые кумулятивного риска в подгруппах пациентов, у которых одновременно оба маркера были выше или ниже точек отсечения, найденных с помощью ROC-анализа. Таким образом, пациенты, у которых GDF-15 был ≥2,075 нг/мл одновременно с NT-proBNP ≥578 пг/мл, имели более высокий риск повторных ССС, включая сердечно-сосудистую смертность и повторные госпитализации по причине нестабильной стенокардии и повторного ИМ (ОР 4,5 (95% ДИ: 2,087-9,736), р=0,00018).
Таблица 2
Характеристика подгрупп пациентов с наличием повторных ССС и без повторных ССС в течение 12 мес. наблюдения
|
Характеристика |
Пациенты с повторными ССС (n=22), М±σ/Me (Q1; Q3) |
Пациенты без повторных ССС (n=96), М±σ/Me (Q1; Q3) |
p |
|
Возраст, лет |
66,36±7,43 |
56,61±8,89 |
0,047 |
|
Пол: мужчины/женщины, абс. (%) |
18 (81,8)/4 (18,2) |
79 (82,3)/17 (17,7) |
0,959 |
|
Гипертоническая болезнь в анамнезе, % |
95,4 |
83,3 |
0,145 |
|
Курение, % |
27,3 |
37,5 |
0,367 |
|
Инфаркт миокарда в анамнезе, % |
22,7 |
10,4 |
0,118 |
|
Стентирование коронарных артерий в анамнезе, % |
9,1 |
5,2 |
0,487 |
|
Систолическое АД при поступлении, мм рт.ст. |
130±15,18 |
130,17±20,44 |
0,966 |
|
Диастолическое АД при поступлении, мм рт.ст. |
78,68±6,61 |
78,4±12,05 |
0,879 |
|
ЧСС при поступлении, уд./мин |
76±10,98 |
74,73±11,19 |
0,629 |
|
Индекс массы тела, кг/м2 |
28,81±5,09 |
27,98±4,51 |
0,488 |
|
Миоглобин, нг/мл |
109,5 (43,8; 323,0) |
119,5 (54,7; 249,75) |
0,631 |
|
Тропонин I, нг/мл |
15,1 (6,12; 63,62) |
25,4 (5,6; 100) |
0,596 |
|
NT-proBNP, пг/мл |
1449,5 (198,25; 2950,75) |
269 (123; 875,75) |
0,05 |
|
Общий холестерин, ммоль/л |
4,97±1,27 |
5,11±1,42 |
0,651 |
|
ЛНП, ммоль/л |
3,27±1,07 |
3,31±1,24 |
0,863 |
|
ЛВП, ммоль/л |
0,94±0,2 |
0,95±0,22 |
0,879 |
|
Триглицериды, ммоль/л |
1,71±0,55 |
1,89±1,13 |
0,278 |
|
Креатинин, мкмоль/л |
98,66±19,17 |
91,89±14,61 |
0,132 |
|
Скорость клубочковой фильтрации, мл/мин |
76 (65,25; 85,5) |
77 (69; 92) |
0,258 |
|
Натрий, ммоль/л |
142,11±4,48 |
141,17±3,61 |
0,368 |
|
Калий, ммоль/л |
4,01±0,35 |
4,08±0,59 |
0,491 |
|
Аланинаминотрансфераза, Ед/л |
33,6 (19,35; 58,25) |
27,2 (19,97; 41,3) |
0,388 |
|
Аспартатаминотрансфераза, Ед/л |
34,85 (23,65; 54,37) |
30,2 (23; 50,27) |
0,599 |
|
Общий билирубин, мкмоль/л |
10,7 (7,82; 16,95) |
9,4 (7,32; 14,3) |
0,3 |
|
Гемоглобин, г/л |
144,14±14,81 |
141,35±14,11 |
0,429 |
|
Эритроциты, ×1012/л |
4,59±0,42 |
4,46±0,47 |
0,354 |
|
Лейкоциты, ×109/л |
8,85 (7,97; 12,35) |
9,6 (7,05; 11,47) |
0,78 |
|
Тромбоциты, ×109/л |
236,5 (220,5; 302,25) |
257,5 (222,75; 300,75) |
0,876 |
|
Протромбиновое время, сек |
11,25 (10,55; 14,45) |
11,8 (10,8; 12,97) |
0,989 |
|
АЧТВ, сек |
35,8 (31,45; 60,2) |
36,45 (31,22; 74,57) |
0,756 |
|
Фибриноген, г/л |
2,8 (2,27; 4,3) |
2,65 (2,2; 3,3) |
0,313 |
|
GDF-15, нг/мл |
2,82±1,12 |
2,13±0,95 |
0,012 |
|
ФВ ЛЖ по ЭхоКГ, % |
49,23±6,42 |
51,23±7,59 |
0,211 |
|
Масса миокарда ЛЖ по ЭхоКГ, г |
200,76±55,69 |
206,78±56,47 |
0,651 |
|
Индекс массы миокарда ЛЖ по ЭхоКГ, г/м2 |
105,87±31,03 |
106,37±27,58 |
0,945 |
|
Толщина МЖП по ЭхоКГ, см |
1,12±0,13 |
1,15±0,19 |
0,303 |
|
Размер ЛП по ЭхоКГ, см |
3,74±0,44 |
3,77±0,44 |
0,806 |
|
СДЛА по ЭхоКГ, мм рт.ст. |
29,5 (24,75; 37) |
28 (24; 31) |
0,211 |
|
КДО ЛЖ по ЭхоКГ, мл |
95 (83; 120,5) |
88,5 (76; 104,25) |
0,107 |
|
Суправентрикулярные экстрасистолы по ХМТ ЭКГ, количество/сут. |
17,5 (7,75; 94,75) |
14,5 (6; 61,75) |
0,369 |
|
Желудочковые экстрасистолы по ХМТ ЭКГ, количество/сут. |
4 (2; 47,75) |
4,5 (0,25; 24,75) |
0,749 |
|
QT при мин. ЧСС по ХМТ ЭКГ, мс |
429,86±46,69 |
429,81±38,77 |
0,996 |
Сокращения: АД — артериальное давление, АЧТВ — активированное частичное протромбиновое время, КДО — конечный диастолический объем, ЛП — левое предсердие, ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, ЛЖ — левый желудочек, МЖП — межжелудочковая перегородка, СДЛА — систолической давление в легочной артерии, ФВ — фракция выброса, ХМТ ЭКГ — Холтеровское мониторирование электрокардиограммы, ЧСС — частота сердечных сокращений, ЭхоКГ — эхокардиография, GDF-15 — фактор дифференцировки роста-15, NT-proBNP — N-концевой промозговой натрийуретический пептид.
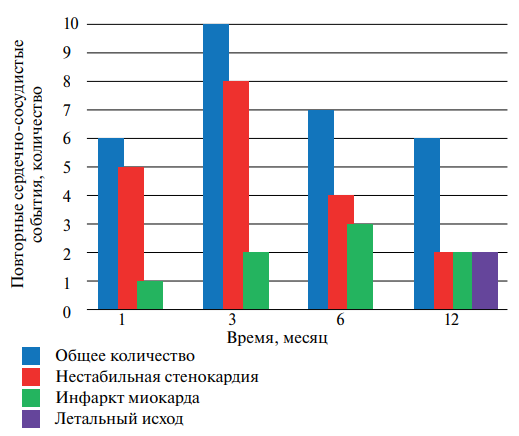
Рис. 1. Повторные ССС во временном разрезе.
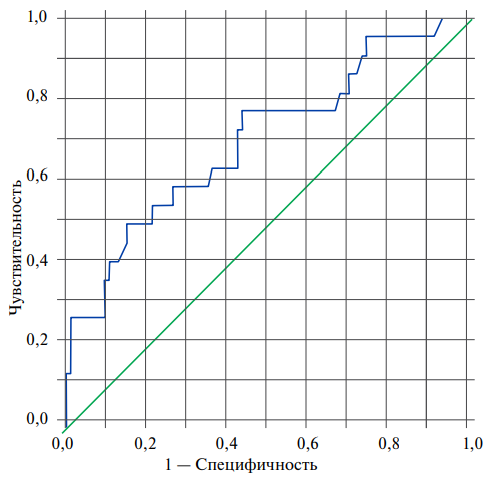
Рис. 2. ROC-кривая прогностической способности GDF-15 (ROC AUC 0,7±0,065 (95% ДИ: 0,572-0,827), p=0,004).
Примечание: цветное изображение доступно в электронной версии журнала.
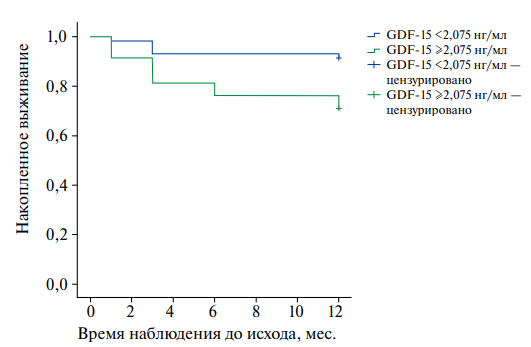
Рис. 3. График кривых выживаемости у пациентов с GDF-15 <2,075 нг/мл (верхняя) и GDF-15 ≥2,075 нг/мл (нижняя), p=0,005.
Примечание: цветное изображение доступно в электронной версии журнала.
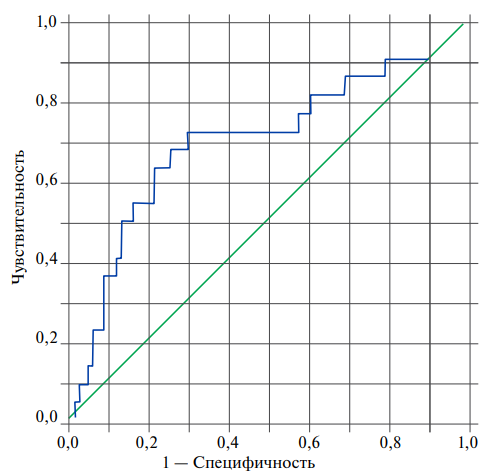
Рис. 4. ROC-кривая прогностической способности NT-proBNP (ROC AUC 0,69±0,069 (95% ДИ: 0,561-0,832), p=0,004).
Примечание: цветное изображение доступно в электронной версии журнала.
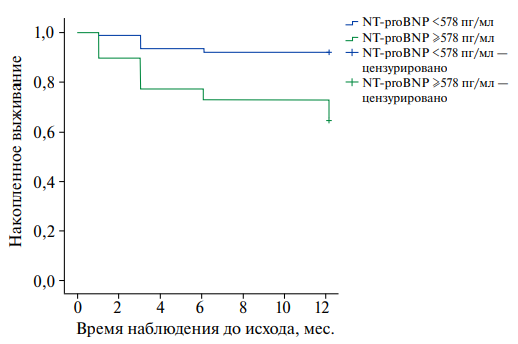
Рис. 5. График кривых выживаемости у пациентов с NT-proBNP <578 пг/мл (верхняя) и NT-proBNP ≥578 пг/мл (нижняя), p=0,00002.
Примечание: цветное изображение доступно в электронной версии журнала.
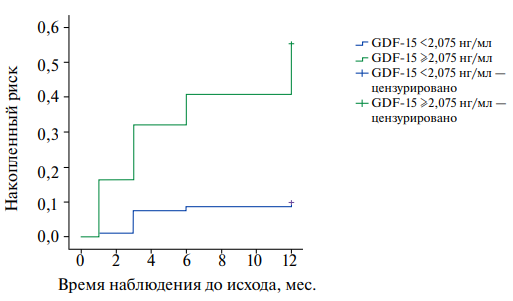
Рис. 6. График кумулятивного риска развития повторных ССС у пациентов с GDF-15 <2,075 нг/мл и NT-proBNP <578 пг/мл (нижняя кривая) и GDF-15 ≥2,075 нг/мл и NT-proBNP ≥578 пг/мл (верхняя кривая), р=0,00018.
Примечание: цветное изображение доступно в электронной версии журнала.
Обсуждение
До сих пор не так много исследований посвящено роли GDF-15 при ИМ. Результаты зарубежных исследований свидетельствуют о том, что уровни GDF-15 положительно коррелируют со статусом курения пациента, наличием сахарного диабета и гипертонической болезни, перенесенным ИМ, нарушением функции почек, а также с уровнями NT-proBNP, тропонина Т, C-реактивного белка [5][6]. Однако в нашем исследовании не было выявлено достоверной разницы и значимой зависимости концентрации GDF-15 с наличием у пациентов традиционных сердечно-сосудистых факторов риска. В опубликованном нами ранее анализе были описаны выявленные корреляционные связи GDF-15, включая его связь с уровнями NT-proBNP (r=0,36, p<0,01), тропонина Т (r=0,21, p=0,02), лейкоцитов (r=0,32, p<0,01), мочевины (r=0,20, p=0,04), а также с фракцией выброса по Симпсону по данным ЭхоКГ (r=-0,32, p<0,01) и толщиной межжелудочковой перегородки (r=-0,26, p<0,01) [7].
Согласно имеющимся данным уровни GDF-15 независимо связаны со смертностью у пациентов с ИМ с подъемом и без подъема сегмента ST на ЭКГ [3][4]. GDF-15 также показал в различных исследованиях свою независимую связь с сердечно-сосудистой смертностью и госпитализациями по поводу декомпенсации хронической сердечной недостаточности при всех атеросклеротических сердечно-сосудистых заболеваниях [2][4][8][9]. А прогностическая ценность GDF-15 отдельно в отношении ИМ наблюдалась только у пациентов со стабильной ишемической болезнью сердца, но не у пациентов с острым коронарным синдромом (ОКС) [10]. Сразу в нескольких работах было отмечено, что среди пациентов с ОКС связь повышенного уровня GDF-15 со смертностью была сильнее, чем его связь с повторным ИМ [4][10]. Наше исследование также показало, что высокие уровни GDF-15 связаны с повышенным риском повторных ССС, включая сердечно-сосудистую смерть, госпитализации по поводу нестабильной стенокардии и повторного ИМ. По итогам исследования нам не представилось возможным достоверно оценить взаимосвязь GDF-15 отдельно со смертностью пациентов, т.к. за период наблюдения в 12 мес. было зарегистрировано только 2 летальных исхода и также невозможно говорить о связи GDF-15 отдельно с повторным ИМ с точки зрения статистической достоверности ввиду малого количества повторных событий.
Зарубежные исследователи начали изучать добавление GDF-15 в прогностические шкалы риска, в т.ч. было показано, что интеграция GDF-15 в шкалу GRACE увеличивает прогностическую ценность этой шкалы у пациентов с ОКС без подъема сегмента ST на ЭКГ [11]. Наше исследование показало, что у пациентов с неосложненным ИМ в остром периоде совместная оценка двух биомаркеров — GDF-15 и NT-proBNP — является перспективной для определения отдаленного прогноза. Известно, что GDF-15 и NT-proBNP имеют некоторые общие патофизиологические триггеры, включая гемодинамическую перегрузку и миокардиальный стресс [5][12]. Однако, в отличие от NT-proBNP, более широкая палитра стрессоров индуцирует продукцию GDF-15 не только в миокарде, но также в эндотелиальных клетках, адипоцитах, макрофагах и в тканях атеросклеротических бляшек [13][14]. Таким образом, можно предположить, что совместное определение этих биомаркеров усиливает их прогностическую ценность, а включение определения уровней GDF-15 и NT-proBNP в мультимаркерные шкалы стратификации риска и прогноза у пациентов с неосложненным ИМ является перспективным направлением для дальнейших исследований.
Ограничения исследования. Небольшая выборка пациентов и малое количество повторных ССС в исследовании, в т.ч. летальных исходов, зарегистрированных за 12 мес. наблюдения, могут послужить ограничением для интерпретации полученных результатов.
Заключение
GDF-15 обладает хорошей прогностической способностью у пациентов с неосложненным ИМ (ROC AUC 0,7±0,065 (95% ДИ: 0,572-0,827), p=0,004). Уровень GDF-15 ≥2,075 нг/мл отражает высокий риск повторных ССС (сердечно-сосудистая смерть, госпитализации по поводу нестабильной стенокардии и повторного ИМ) в течение 12 мес. (ОР 3,4 (95% ДИ: 1,342-8,613), р=0,005). Сочетанное повышение уровней GDF-15 ≥2,075 нг/мл и NT-proBNP ≥578 пг/ мл у данной категории пациентов еще больше увеличивает риск повторных ССС (ОР 4,5 (95% ДИ: 2,087-9,736), р=0,00018).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Galkin SS, Bobylev SN, Burlakova EA, et al. Russian Statistical Yearbook 2022: Stat.book/ Rosstat. R76 М. 2022. 691 p. (In Russ.) Галкин С. С., Бобылев С. Н., Бурлакова Е. А. и др. Российский статистический ежегодник. 2022: Стат.сб./Росстат. Р76 М. 2022. 691 с. ISBN: 978-5-9906962-5-9.
2. Wesseling M, de Poel J, de Jager S. Growth differentiation factor 15 in adverse cardiac remodelling: from biomarker to causal player. ESC Heart Failure 2020;7:1488-501. doi:10.1002/ehf2.12728.
3. Zelniker TA, Jarolim P, Silverman M, et al. Prognostic role of GDF-15 across the spectrum of clinical risk in patients with NSTE-ACS. Clin Chem Lab Med. 2019;57:1084-92. doi:10.1515/cclm-2018-1081.
4. Buljubasic N, Vroegindewey MM, Oemrawsingh RM, et al. Temporal pattern of growth differentiation factor-15 protein after acute coronary syndrome (from the BIOMArCS study). Am J Cardiol. 2019;124:8-13. doi:10.1016/j.amjcard.2019.03.049.
5. Li J, Cui Y, Huang A, et al. Additional diagnostic value of growth differentiation factor-15 (GDF-15) to N-terminal B-type natriuretic peptide (NT-proBNP) in patients with different stages of heart failure. Med Sci Monit. 2018;24:4992-9. doi:10.12659/msm.910671.
6. Kou H, Jin X, Gao D, et al. Association between growth differentiation factor 15 and left ventricular hypertrophy in hypertensive patients and healthy adults. Clin Exp Hypertens. 2018;40:8-15. doi:10.1080/10641963.2016.1273948.
7. Сабирзянова А. А., Галявич А. С., Балеева Л. В. и др. Фактор дифференцировки роста-15 у пациентов в острой стадии инфаркта миокарда. Кардиология. 2020;60(11):42-8. doi:10.18087/cardio.2020.11.n1251.
8. Hagstrom E, Held C, Stewart RA, et al. Growth differentiation factor 15 predicts all-cause morbidity and mortality in stable coronary heart disease. Clin Chem. 2017;63:325-33. doi:10.1373/clinchem.2016.260570.
9. Nurmohamed NS, Belo Pereira JP, Hoogeveen RM, et al. Targeted proteomics improves cardiovascular risk prediction in secondary prevention. Eur Heart J. 2022;43:1569-77. doi:10.1093/eurheartj/ehac055.
10. Kato ET, Morrow DA, Guo J, et al. Growth differentiation factor 15 and cardiovascular risk: individual patient meta-analysis. European Heart Journal. 2023;44(4);293-300. doi:10.1093/eurheartj/ehac577.
11. Hung J, Roos A, Kadesjo E, et al. Performance of the GRACE 2.0 score in patients with type 1 and type 2 myocardial infarction. Eur. Heart J. 2020;0:1-10. doi:10.1093/eurheartj/ehaa375.
12. Meijers WC, van der Velde AR, Muller Kobold AC, et al. Variability of biomarkers in patients with chronic heart failure and healthy controls. Eur J Heart Fail. 2017;19:357-65. doi:10.1002/ejhf.669.
13. Wollert KC, Kempf T, Wallentin L. Growth differentiation factor 15 as a biomarker in cardiovascular disease. Clin Chem 2017;63:140-51. doi:10.1373/clinchem.2016.255174.
14. Sithiravel C, Roysland R, Alaour B, et al. Biological variation, reference change values and index of individuality of GDF-15. Clin Chem Lab Med. 2022;60:593-6. doi:10.1515/cclm2021-0769.
Об авторах
А. А. СабирзяноваРоссия
Александра Андреевна Сабирзянова — кандидат медицинских наук, ассистент кафедры кардиологии ФПК и ППС.
Казань
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
А. С. Галявич
Россия
Альберт Сарварович Галявич — доктор медицинских наук, профессор, заведующий кафедрой кардиологии ФПК и ППС.
Казань
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Л. В. Балеева
Россия
Лариса Васильевна Балеева — кандидат медицинских наук, доцент кафедры кардиологии ФПК и ППС.
Казань
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
З. М. Галеева
Россия
Зульфия Марселевна Галеева — кандидат медицинских наук, доцент кафедры кардиологии ФПК и ППС.
Казань
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
Рецензия
Для цитирования:
Сабирзянова А.А., Галявич А.С., Балеева Л.В., Галеева З.М. Фактор дифференцировки роста-15 — новый показатель неблагоприятного прогноза при неосложненном инфаркте миокарда. Российский кардиологический журнал. 2023;28(8):5381. https://doi.org/10.15829/1560-4071-2023-5381. EDN: SAEQOS
For citation:
Sabirzyanova A.S., Galyavich A.S., Baleeva L.V., Galeeva Z.V. Growth differentiation factor-15 — a new indicator of unfavorable prognosis in uncomplicated myocardial infarction. Russian Journal of Cardiology. 2023;28(8):5381. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5381. EDN: SAEQOS

















































