Перейти к:
Новые и традиционные эхокардиографические показатели для выбора тактики ведения пациентов с дегенеративными заболеваниями митрального клапана
https://doi.org/10.15829/1560-4071-2022-5138
Аннотация
Митральная недостаточность (МН) — второй по распространенности и частоте показаний к кардиохирургическим вмешательствам клапанный порок сердца. Тяжелая МН характеризуется значительным снижением толерантности к физической нагрузке и высокой смертностью. Наиболее распространенной органической патологией митрального клапана (МК) являются дегенеративные заболевания. Детальная и систематическая оценка аппарата МК и механизмов МН имеет решающее значение для ведения этих пациентов, планирования вида и сроков хирургического вмешательства. Ведущую роль среди современных методов визуализации у пациентов с патологией играет эхокардиография. При исследовании пациента с МН необходимо определить точный механизм развития регургитации, степень ее выраженности и гемодинамические последствия. Целью обзора является анализ возможностей применения традиционных и новых эхокардиографических показателей для выбора тактики ведения пациентов с дегенеративными заболеваниями МК.
Ключевые слова
Для цитирования:
Терешина О.В., Дмитриев О.В. Новые и традиционные эхокардиографические показатели для выбора тактики ведения пациентов с дегенеративными заболеваниями митрального клапана. Российский кардиологический журнал. 2022;27(8):5138. https://doi.org/10.15829/1560-4071-2022-5138
For citation:
Tereshina O.V., Dmitiev O.V. Novel and conventional echocardiographic parameters for choosing management tactics in patients with degenerative mitral valve diseases. Russian Journal of Cardiology. 2022;27(8):5138. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5138
Митральная недостаточность (МН) определяется как аномальный ретроградный поток крови из левого желудочка (ЛЖ) в левое предсердие (ЛП) во время сокращения желудочка. Незначительная МН выявляется почти у 50% здоровых людей [1]. Распространенность порока значимо увеличивается с возрастом. Так, тяжёлая МН относительно редко встречается до пятого десятилетия жизни, однако определяется уже у 13,3% людей в возрасте старше 75 лет [1]. Умеренная и тяжелая недостаточность часто прогрессирует с течением времени. Больные с тяжелой МН имеют значительно сниженную переносимость физической нагрузки и повышенный риск летального исхода [1]. Наилучшей стратегией лечения для пациентов с тяжелой первичной МН, особенно, при появлении симптомов, считается хирургическое вмешательство [2][3]. Предоперационная эхокардиографическая оценка является важным этапом не только для выбора того или иного вмешательства, но и необходима для прогнозирования и предотвращения послеоперационных осложнений [4][5]. В последние годы в связи с появлением новых технологий возможности эхокардиографии (ЭхоКГ) значительно расширились. Целью обзора является анализ возможностей применения традиционных и новых эхокардиографических показателей для выбора тактики ведения пациентов с дегенеративными заболеваниями митрального клапана (МК). Поиск литературы был выполнен с помощью электронных библиографических баз данных (Medline, PubMed, ScienceDirect, Elibrary) без ограничений по дате. Было проанализировано 354 резюме и изучены 104 полнотекстовые статьи.
Работоспособность МК зависит от механической и функциональной целостности всех его компонентов: передней и задней створок, кольца, хорд, обеих папиллярных мышц, ЛП и ЛЖ. К недостаточности МК может привести изолированная или комбинированная анатомическая и функциональная аномалия любого из этих элементов.
МН подразделяется на первичную, если поражены преимущественно створки МК, и вторичную, когда нарушение кооптации створок связано с расширением и дисфункцией ЛЖ и/или дилатацией ЛП. Первичное анатомическое поражение митрального аппарата, лежащее в основе первичной МН, наиболее часто связано с дегенеративными изменениями. У ряда пациентов первичная и вторичная МН могут сосуществовать (смешанное заболевание). В большинстве случаев ЭхоКГ позволяет дифференцировать функциональную и дегенеративную МН на основании наличия структурных изменений аппарата МК [1][4][5].
Пролапс МК (ПМК) является наиболее распространенной причиной первичной МН и имеет широкий спектр клинических проявлений, который варьирует от незначительных симптомов, до катастрофических осложнений, включая церебральную эмболию, инфекционный эндокардит и тяжелую клапанную регургитацию, требующую хирургической коррекции. У небольшого количества пациентов с повышенным риском внезапной сердечной смерти (ВСС) поражение клапана классифицируется как злокачественный ПМК [6][7]. Из когорты пациентов, подвергающихся хирургическому вмешательству с МН, большинство имеют ПМК, вызванный первичным миксоматозом, первичным отрывом створок или кальцификацией кольца [8]. Другие, менее распространенные причины пролапса, включают острую ревматическую болезнь МК, синдром Марфана, инфекционный эндокардит, острый разрыв папиллярной мышцы или острую ишемию миокарда с вовлечением папиллярной мышцы.
Седловидная форма кольца МК создает сложности для двухмерной (2D) ЭхоКГ диагностики, вследствие чего физиологический легкий прогиб тела передней створки в апикальной четырехкамерной позиции в систолу может ошибочно трактоваться как ПМК [9][10]. Пролапс следует диагностировать только в тех случаях, когда за пределы кольца МК в ЛП поднимается свободный край створки. Признание этого факта привело к мнению, что диагноз ПМК должен ставиться только на эхокардиографических изображениях по длинной оси ЛЖ, что находит подтверждение в актуальных рекомендациях [2][4]. Однако этот подход не учитывает, что по длинной оси ЛЖ визуализируются только A2 и Р2 сегменты МК. По мнению ряда исследователей, для диагностики ПМК возможно использовать любую проекцию, помня о том, что легкий прогиб тела передней створки (т.е. <5 мм над плоскостью кольца) является нормой. Этот прогиб может быть более выраженным у пациентов с маленьким желудочком, удлинёнными передними створками и в состоянии обезвоживания. Однако смещение свободного края створки любого сегмента МК над плоскостью кольца является явно патологическим, независимо от ЭхоКГ плоскости сечения [10]. Визуализация края створки над плоскостью кольца чаще всего связана с разрывом хорды, но у некоторых пациентов может наблюдаться и без отрыва, из-за выраженного удлинения хорд.
Описаны два основных фенотипа ПМК [4][11]. Первая группа пациентов — это больные с тяжелой диффузной миксоматозной дегенерацией всего МК. При этом клапан характеризуется утолщением и избыточностью ткани створок, удлиненными хордами, значительной дилатацией кольца и, иногда, транслокацией задней части кольца МК в ЛП [12]. Данное состояние определяется как болезнь Барлоу. У другой группы больных ПМК возникает вследствие отрыва хорд. Эти пациенты, как правило, относятся к более старшей возрастной группе, а створки МК представляются тонкими и хрупкими. Эта патология описывается как фиброэластическая недостаточность. Однако патологоанатомические исследования подтверждают, что достоверно отличить фиброэластическую недостаточность от болезни Барлоу возможно только при количественной гистологической оценке [11]. Хотя не существует точного определения болезни Барлоу, есть основания полагать, что его следует использовать для описания пациентов с тяжелой миксоматозной дегенерацией МК, значительным увеличением всех сегментов створок, прогибом нескольких сегментов, с пролапсом или без пролапса края створок, и значительно расширенным кольцом. Расширение кольца является важным фактором, вызывающим митральную регургитацию [10].
Морфологические изменения, описанные при пролапсе, включают не только изменения створок. Все больше внимания привлекает патологическое изменение пространственного расположения кольца МК [12]. Патологическое прикрепление определяется как систолическая дислокация кольца МК в ЛП, вследствие чего кольцо функционально отделено от ЛЖ. В результате этой аномалии возникает парадоксальная динамика кольца МК, т.к. во время сердечного цикла кольцо движется с ЛП, а не с ЛЖ. В систолу происходит расширение и уплощение кольца, в результате чего задняя стенка ЛЖ смещается наружу в систолу и внутрь в диастолу [12]. Систолическое уплощение кольца МК увеличивает механическое напряжение створок и хорд МК, что может ускорить дегенеративный процесс [13]. Дислокация кольца встречается преимущественно в области задней створки, наиболее часто в области бокового (P1) и среднего (P2) сегментов [12][13].
Выявление патологического соединения кольца требует тщательного покадрового анализа изображений. При трансторакальной ЭхоКГ оно оценивается путем измерения расстояния от места прикрепления задней створки к стенке ЛП (верхняя граница разобщения) до места соединения ЛП с миокардом ЛЖ (нижняя граница разобщения) [13]. Измерение должно выполняться в парастернальной позиции по длинной оси в конце систолы (рис. 1). При 2D чреспищеводной ЭхоКГ (ЧП-ЭхоКГ) лучше подходит измерение во время систолы в средне-пищеводной 4-камерной проекции на уровне P2 сегмента при угле 0° [13].
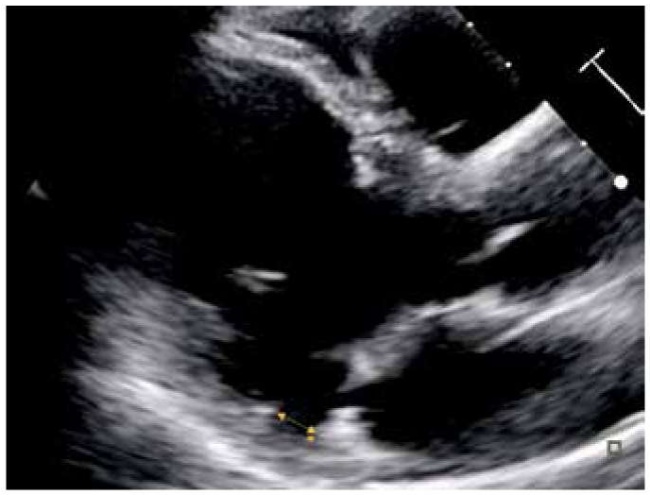
Рис. 1. Патологическое прикрепление митрального кольца (желтая звездочка).
Примечание: измерение расстояния от места прикрепления задней створки к стенке ЛП до места соединения ЛП с миокардом желудочка (желтая двойная стрелка) в парастернальной позиции по длинной оси при 2D трансторакальной ЭхоКГ.
Сокращения: ЛП — левое предсердие, ЭхоКГ — эхокардиография, 2D — двухмерный.
Трехмерная (3D) ЭхоКГ позволяет провести более детальный анализ размеров и динамики кольца МК [14-16]. При 3D ЧП-ЭхоКГ было продемонстрировано, что при патологическом прикреплении кольца отсутствуют раннее систолическое углубление седловидной формы клапана и уменьшение площади кольца. В поздней систоле седловидная форма углубляется, но происходит значительное увеличение площади кольца [14][16]. При использовании мультипланарной реконструкции при 3D можно исследовать пространственное соотношение прикрепления задней створки к стенке ЛП в нескольких плоскостях и оценить не только дистанцию расхождения, но и окружную протяженность патологического прикрепления кольца МК [17].
Появляется все больше доказательств связи дислокации кольца с желудочковыми аритмиями и ВСС [6][18]. Предполагают, что злокачественный аритмогенный фенотип ПМК может привести к ВСС в результате сложных аритмий, вызванных повторяющимся натяжением и подтягиванием хордально-папиллярного аппарата, а также базальных и средних сегментов ЛЖ. Морфофункциональными характеристиками злокачественного пролапса, связанного с риском ВСС, являются: толщина створки МК ≥5 мм, дислокация кольца МК в ЛП, парадоксальное систолическое увеличение диаметра кольца МК, увеличение скорости кольца МК при тканевой допплерографии, высокая механическая дисперсия при speckle-tracking ЭхоКГ и фиброз, определяемый по позднему гадолиниевому усилению при магнитно-резонансной томографии [18].
При планировании хирургического вмешательства необходимы обязательные дополнительные измерения: площадь кольца, длина хорды и створки, диаметр выносящего тракта ЛЖ, расстояние между передней створкой и межжелудочковой перегородкой (МЖП), митрально-аортальный угол, толщина МЖП. Важное значение имеют наличие кальцификации клапана и субаортального утолщения МЖП. В литературе описаны анатомические характеристики, связанные с повышенной вероятностью неудачи реконструкции: большая центральная струя регургитации, выраженная дилатация кольца (>50 мм), вовлечение ≥3 сегментов клапана, обширная кальцификация клапана [19].
Одной из важных проблем послеоперационного периода является возникновение переднего систолического движения МК. Факторами риска возникновения этого осложнения при 2D являются расстояние между точкой кооптации и перегородкой <2,5 см, митрально-аортальный угол <120°, длина задней створки >15 мм и соотношение между длинами передней и задней створок <1,3, толщина МЖП >15 мм, не дилатированный и гипердинамический ЛЖ [20][21].
Применение ЧП-ЭхоКГ позволяет детально оценить морфологию клапана, при этом могут быть лучше идентифицированы и сопоставлены с анатомическими данными эксцентричные потоки МН. Следует учитывать возникновение и направление потока МН, который обычно направлен в сторону, противоположную от пролабирующей створки. У пациентов с пролапсом обеих створок могут определяться два потока — “скрещенные мечи”, а в случае симметричного пролапса обоих створок может присутствовать центральная струя регургитации. Для подтверждения диагноза тяжелой МН при ЧП-ЭхоКГ рекомендуется использовать регистрацию обратного систолического потока в легочных венах [4][5][22].
3D визуализация МК при ЧП-ЭхоКГ превосходит 2D в идентификации сегментов, в определении точной морфологии и локализации поражений МК, оценке динамических изменений митрального кольца, в оценке распространённости патологического прикрепления кольца, а также в обнаружении расщеплений и перфораций створок [23-27]. 3D ЭхоКГ позволяет дополнительно оценить клапан в плане возможности выполнения реконструктивной операции. Установлено, что наличие обширной кальцификации створки или кольца, пролапс передней створки МК, пролапс обеих створок или болезнь Барлоу ставят возможность выполнения реконструкции под сомнение (рис. 2) [21][27][28].
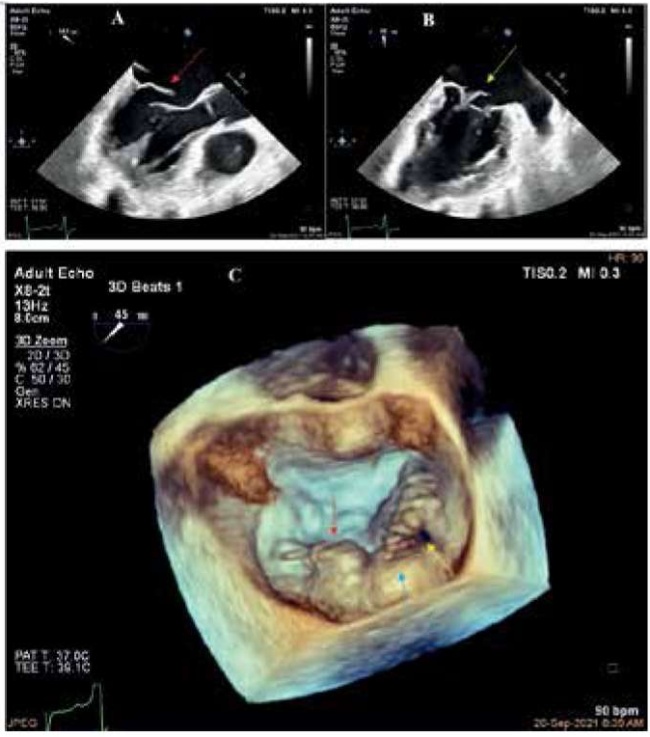
Рис. 2. Полисегментарный ПМК, отрыв P2 и А3 сегментов.
Примечание: (A) 2D-изображение, показывающее отрыв хорд P2 сегмента задней створки в сечении по длинной оси ЛЖ (красная стрелка), и (B) 2D-изображение, показывающее отрыв хорд А3 сегмента передней створки в комиссуральном сечении (желтая стрелка). (С) 3D-изображение по короткой оси митрального клапана (“хирургический вид”), отрыв P2 (красная стрелка), комиссуральный отрыв А3 (желтая стрелка), пролапс Р3 (синяя стрелка).
Сокращения: ЛЖ — левый желудочек, 2D — двухмерный, 3D — трехмерный.
3D ЧП-ЭхоКГ лучше подходит для оценки периметра и площади митрального кольца, которые необходимы для определения размера кольца или ленты для аннулопластики (рис. 3). При первичной МН должны быть измерены ширина и высота створки и оценено межтригональное расстояние [21][27].
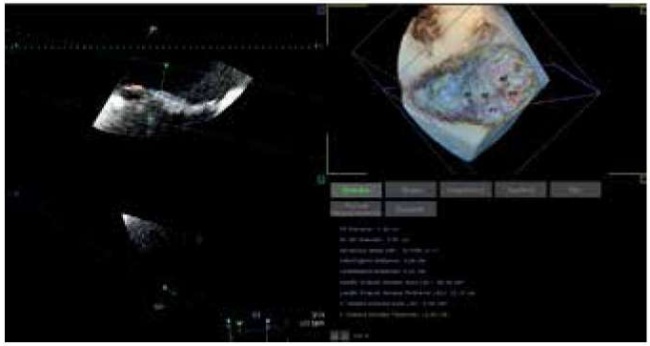
Рис. 3. Пример 3D моделирования МК при полисегментарном пролапсе, используемый для количественного анализа структур МК.
Большая площадь поверхности передней створки (>8 см2), рассчитанная в 3D, увеличивает риск переднего систолического движения МК, особенно если используется кольцо меньшего размера [20][21].
Мультипланарная реконструкция 3D изображений МК с цветовым допплеровским картированием позволяет произвести прямое измерение площади регургитационного отверстия (vena contracta area, VCA) [29]. При этом ортогональные плоскости визуализации (x и y) ориентируются через длинную ось потока регургитации, а плоскость z устанавливается перпендикулярно самой узкой области поперечного сечения потока на уровне vena contracta. VCA измеряется путем ручной планиметрии цветового доплеровского сигнала в плоскости z (рис. 4). Значение 3D VCA >0,4 см2 предполагает тяжелую МН. Определение VCA имеет преимущества у пациентов с множественными потоками МН и расширенным ЛЖ [30].
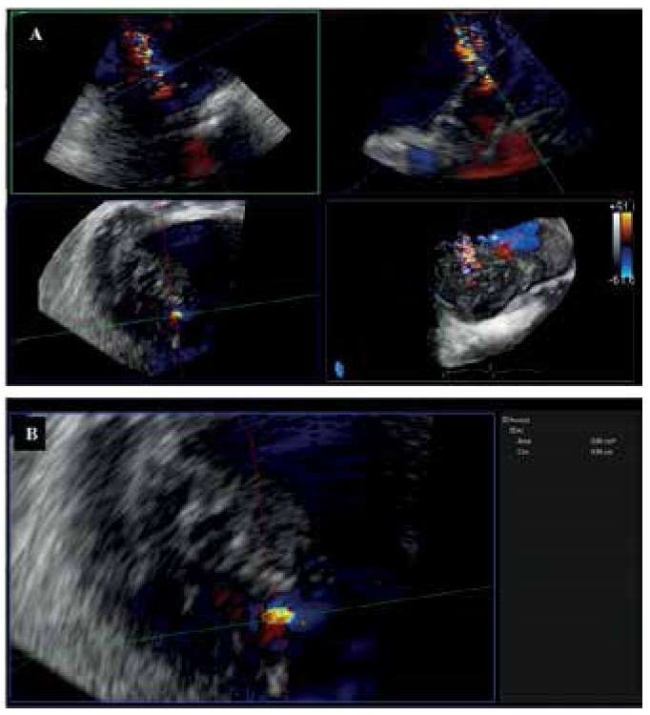
Рис. 4. Пример использования 3D c цветовым допплеровским картированием для расчета площади VCA.
Примечание: А — мульти-планарная реконструкция МК, В — измерение VCA по оси Z.
Сокращения: МК — митральный клапан, VCA — vena contracta area, анатомическая площадь “шейки” потока регургитации в цветовом допплеровском картировании.
ЭхоКГ представляет важную информацию о структурных и гемодинамических последствиях МН, что играет ключевую роль в принятии решения об оптимальном сроке хирургического вмешательства. Без своевременной хирургической коррекции перегрузки левых камер прогрессирует дисфункция ЛЖ, возникает фибрилляция предсердий (ФП), вторичная легочная гипертензия и, в конечном счете, дисфункция правого желудочка (ПЖ).
При хронической дегенеративной МН объемная перегрузка с увеличенной преднагрузкой приводит к увеличению ЛЖ, что является основным компенсаторным механизмом. При этом развивается эксцентрическое ремоделирование ЛЖ, с преимущественным увеличением объема при незначительном или нулевом увеличении толщины стенок. Диастолическая функция при таком типе ремоделирования обычно не нарушена. Сочетание повышенной преднагрузки с нормальной постнагрузкой и изначально сохраненной сократительной способностью ЛЖ приводит к более высокой фракции выброса ЛЖ по сравнению с нормой у этих пациентов. Поэтому при хронической МН фракция выброса ~70% должна рассматриваться как “нормальная”, а фракция выброса <60% или неспособность ЛЖ сократиться до диаметра <40 мм в конце систолы [31] уже указывает на явную дисфункцию ЛЖ и ассоциируется с ухудшением прогноза [32].
Дисфункция ЛЖ может быть не только причиной вторичной МН, но и следствием первичной МН, вызванной хронической перегрузкой объемом. Для оценки объемов и функции ЛЖ рекомендуется использовать как 2D (метод Симпсона), так и 3D ЭхоКГ (рис. 5) [33]. Исследование деформации миокарда методом speckle-tracking может обеспечить раннее выявление поражения левых отделов сердца и дополнительную прогностическую информацию при хронической МН [34]. Предоперационный глобальный продольный стрейн ЛЖ у пациентов с тяжелой МН показал более высокую прогностическую значимость по сравнению с традиционными параметрами (дисфункция ЛЖ, ФП, тип операции) [34][35].
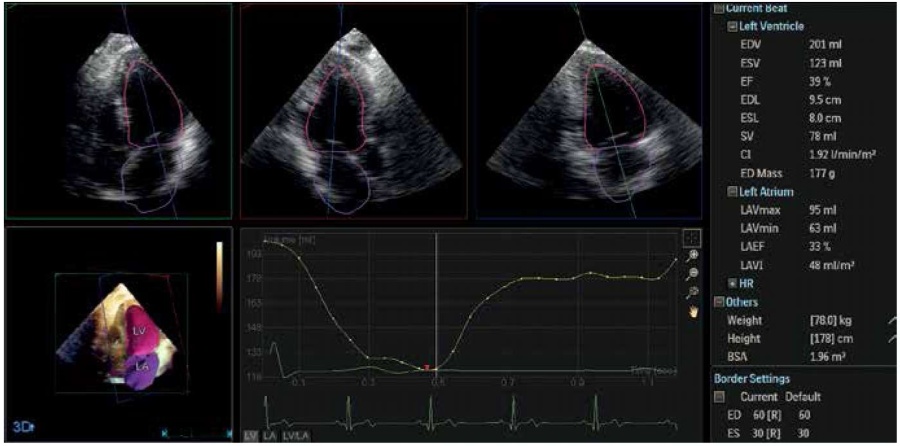
Рис. 5. 3D ЭхоКГ с расчетом объема ЛЖ и ЛП у пациента с МН.
Примечание: увеличение объемов ЛП (индекс объема ЛП 48 мл/м2) и ЛЖ (конечно-диастолический объем 201 мл), снижение систолической функции ЛЖ (фракция выброса ЛЖ 39%).
Сокращения: ЛЖ — левый желудочек, ЛП — левое предсердие.
Увеличение ЛП является следствием хронической МН. Объем ЛП следует измерять в конце систолы, используя 2D метод дисков или 3D ЭхоКГ [33]. Объемная перегрузка ЛП, на которую указывает увеличение диаметра ЛП (≥40 мм) и индекса объема ЛП (≥40 мл/м2), в значительной степени влияет на клинический исход и предсказывает возникновение ФП [31]. Из показателей деформации ЛП наиболее часто используют резервуарный и контрактильный стрейн (рис. 6). Было показано, что снижение деформации ЛП указывает на ухудшение функции ЛП и коррелирует с тяжестью МН у пациентов с бессимптомной МН, с фиброзом миокарда, вызванным тяжелой МН у пациентов с ПМК, и является достоверным предиктором исхода не только у пациентов с тяжелой МН, но и у пациентов с умеренной МН [36-38].
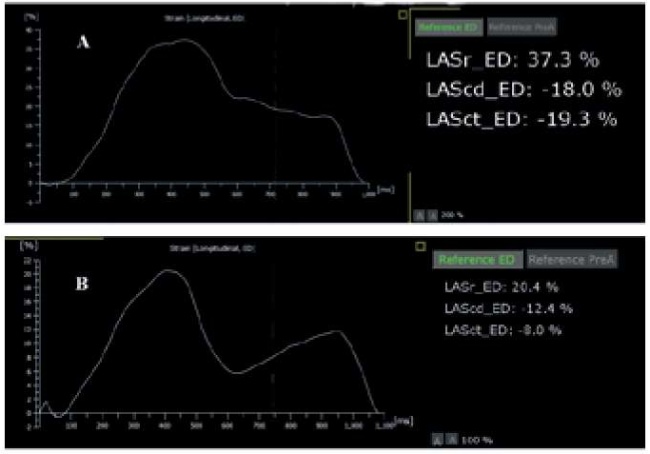
Рис. 6. Деформация ЛП у здорового (А) и у пациента с тяжелой митральной регургитацией (В).
Сокращения: LASr — резервуарный стрейн левого предсердия, LAScd — кондуитный стрейн левого предсердия, LASct — контрактильный стрейн левого предсердия.
Не менее важной в плане ведения пациентов с МН является оценка функции ПЖ, трикуспидального клапана (ТК) и систолического давления в легочной артерии. При его повышении >50 мм рт.ст. риск смерти и сердечной недостаточности увеличивается почти вдвое, а благоприятный эффект от операции МК снижается [10]. Существующие структурные и функциональные повреждения ПЖ могут представлять повышенный риск неблагоприятного исхода после кардиохирургического вмешательства [39]. Учитывая сложную геометрию ПЖ и недостатки определения функции ПЖ традиционными методами, предпочтение следует отдавать новым технологиям, таким как исследование деформации свободной стенки ПЖ. Данный показатель обеспечивает более полную оценку глобальной продольной функции ПЖ, а также показал корреляцию с давлением в ПЖ и исходом у пациентов с сердечной недостаточностью [40]. Для определения необходимости сопутствующей аннулопластики ТК необходима тщательная оценка трикуспидальной недостаточности (ТН) и размеров кольца ТК. Современные руководства предлагают выполнять вмешательство на ТК у пациентов с тяжелой ТН, которым необходимо выполнение операций на МК независимо от симптомов (класс I). Кроме того, предлагается рассмотреть хирургическое вмешательство на ТК (класс IIa) у пациентов с легкой/умеренной вторичной ТН и/или значительной дилатацией кольца ТК (≥40 мм или 21 мм/м2) [2][3].
Заключение
ЭхоКГ играет ключевую роль в оценке МН. Важно не только определить степень тяжести, но и описать морфологию клапана, механизм регургитации, а также ее гемодинамические последствия. Использование современных методов, таких как 3D ЭхоКГ и определение деформации, позволяет улучшить определение анатомических и функциональных показателей для установления оптимальных сроков и вида хирургической коррекции МН.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Bonow RO, O’Gara PT, Adams DH, et al. 2020 Focused Update of the 2017 ACC Expert Consensus Decision Pathway on the Management of Mitral Regurgitation: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2020;75(17):2236-70. doi:10.1016/j.jacc.2020.02.005.
2. 2021 Рекомендации ESC/EACTS по ведению пациентов с клапанной болезнью сердца. Российский кардиологический журнал. 2022;27(7):5160. doi:10.15829/1560-40712022-5160.
3. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/ American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2020;143(5):e72-e227. doi:10.1161/CIR.0000000000000923.
4. Lancellotti P, Pibarot P, Chambers J, et al. Scientific Document Committee of the European Association of Cardiovascular Imaging. Multi-modality imaging assessment of native valvular regurgitation: an EACVI and ESC council of valvular heart disease position paper. Eur Heart J Cardiovasc Imaging. 2022;18;23(5):e171-e232. doi:10.1093/ehjci/jeab253.
5. Nicoara A, Skubas N, Ad N, et al. Guidelines for the Use of Transesophageal Echocardiography to Assist with Surgical Decision-Making in the Operating Room: A Surgery-Based Approach: From the American Society of Echocardiography in Collaboration with the Society of Cardiovascular Anesthesiologists and the Society of Thoracic Surgeons. J Am Soc Echocardiogr. 2020;33(6):692-734. doi:10.1016/j.echo.2020.03.002.
6. Perazzolo Marra M, Basso C. Mechanical dispersion and arrhythmic mitral valve prolapse: substrate and trigger in electrical instability. Heart. 2019;105(14):1053-4. doi:10.1136/heartjnl-2019-314788.
7. Широбоких О. Е., Былова Н. А. Пролапс митрального клапана и внезапная сердечная смерть: кто в группе риска? Архивъ внутренней медицины. 2016;6(3):25-9. doi:10.20514/2226-6704-2016-6-3-25-29.
8. De Bonis M, Alfieri O, Dalrymple-Hay M, et al. Mitral Valve Repair in Degenerative Mitral Regurgitation: State of the Art. Prog Cardiovasc Dis. 2017;60(3):386-93. doi:10.1016/j.pcad.2017.10.006.
9. Малев Э. Г., Реева С. В., Тимофеев Е. В., Земцовский Э. В. Современные подходы к диагностике и оценке распространенности пролапса митрального клапана у лиц молодого возраста. Российский кардиологический журнал. 2010;(1):35-41.
10. Wunderlich NC, Beigel R, Rader F, et al. Degenerative Mitral Regurgitation: Assessment, Physical Examination, and Imaging. Curr Cardiol Rep. 2019; 22;21(8):85. doi:10.1007/s11886-019-1163-3.
11. van Wijngaarden AL, Kruithof BPT, Vinella T, et al. N. Characterization of Degenerative Mitral Valve Disease: Differences between Fibroelastic Deficiency and Barlow’s Disease. J Cardiovasc Dev Dis. 2021;8(2):23. doi:10.3390/jcdd8020023.
12. Bennett S, Thamman R, Griffiths T, et al. Mitral annular disjunction: A systematic review of the literature. Echocardiography. 2019;36(8):1549-58. doi:10.1111/echo.14437.
13. Wunderlich NC, Ho SY, Flint N, et al. Myxomatous Mitral Valve Disease with Mitral Valve Prolapse and Mitral Annular Disjunction: Clinical and Functional Significance of the Coincidence. J Cardiovasc Dev Dis. 2021;24;8(2):9. doi:10.3390/jcdd8020009.
14. Topilsky Y. Mitral Regurgitation: Anatomy, Physiology, and Pathophysiology-Lessons Learned From Surgery and Cardiac Imaging. Front Cardiovasc Med. 2020;29;7:84. doi:10.3389/fcvm.2020.00084.
15. Grewal J, Suri R, Mankad S, et al. Mitral annular dynamics in myxomatous valve disease: New insights with real-time 3-dimensional echocardiography. Circulation. 2010;121:142331. doi:10.1161/CIRCULATIONAHA.109.901181.
16. Lee AP, Jin CN, Fan Y, et al. Functional Implication of mitral annular disjunction in mitral valve prolapse: A quantitative dynamic 3D echocardiographic study. Jacc. Cardiovasc. Imaging. 2017;10:1424-33. doi:10.1016/j.jcmg.2016.11.022.
17. Dejgaard LA, Skjølsvik ET, Lie OH, et al. The mitral annulus disjunction arrhythmic syndrome. JAmColl Cardiol. 2018;72(14):1600-9. doi:10.1016/j.jacc.2018.07.070.
18. Muthukumar L, Jahangir A, Jan MF, et al. Association between Malignant Mitral Valve Prolapse and Sudden Cardiac Death: A Review. JAMA Cardiol. 2020;1;5(9):1053-61. doi:10.1001/jamacardio.2020.1412.
19. Cimino S, Guarracino F, Valenti V, et al. Echocardiography and correction of mitral regurgitation: an unbreakable link. Cardiology. 2020;145:110-20. doi:10.1159/000504248.
20. Garbi M, Monaghan MJ. Quantitative mitral valve anatomy and pathology. Echo Res Pract. 2015;2:R63-72. doi:10.1530/ERP-15-0008.
21. Gheorghe LL, Mobasseri S, Agricola E, et al. Imaging for Native Mitral Valve Surgical and Transcatheter Interventions. JACC Cardiovasc Imaging. 2021;14(1):112-27. doi:10.1016/j.jcmg.2020.11.021.
22. El-Tallawi KC, Messika-Zeitoun D, Zoghbi WA. Assessment of the severity of native mitral valve regurgitation. Prog Cardiovasc Dis. 2017;60(3):322-33. doi:10.1016/j.pcad.2017.11.005.
23. Овчаренко Е. А., Клышников К. Ю., Сизова И. Н. и др. Численная оценка анатомии фиброзного кольца митрального клапана в норме и при патологии по данным трехмерной эхокардиографии. Патология кровообращения и кардиохирургия. 2021;25(2):50-9. doi:10.21688/1681-3472-2021-2-50-59.
24. Hirasawa K, Izumo M. Role of 3D Transesophageal Echocardiography for Transcatheter Mitral Valve Repair-A Mini Review. Front Cardiovasc Med. 2022;2;9:815304. doi:10.3389/fcvm.2022.815304.
25. Sugimoto T, Dulgheru R, Marchetta S, et al. What Does 3D Echocardiography Add to 2D Echocardiography in the Assessment of Mitral Regurgitation? Curr Cardiol Rep. 2017;24;19(10):90. doi:10.1007/s11886-017-0901-7.
26. Голухова Е. З., Машина Т. В., Джанкетова В. С. и др. Трех мерная чреспищеводная эхокардиография в топической диагностике поражений митрального клапана у больных с гемодинамически значимой митральной недоста точностью. Креативная кардиология. 2020;14(4):339-48. doi:10.24022/1997-3187-2020-14-4-339-348.
27. Pastore MC, Mandoli GE, Sannino A, et al. Two and Three-Dimensional Echocardio- graphy in Primary Mitral Regurgitation: Practical Hints to Optimize the Surgical Planning. Front Cardiovasc Med. 2021;8:706165. doi:10.3389/fcvm.2021.706165.
28. Nishida H, Fukui T, Kasegawa H, et al. Causes of repair failure for degenerative mitral valve disease and reoperation outcomes. Eur J Cardiothorac Surg. 2018;53:1244-50. doi:10.1093/ejcts/ezx468.
29. Zeng X, Levine RA, Hua L, et al. Diagnostic value of vena contracta area in the quantification of mitral regurgitation severity by color Doppler 3D echocardiography. Circ Cardiovasc Imaging. 2011;4:506-13. doi:10.1161/CIRCIMAGING.110.961649.
30. Skoldborg V, Madsen PL, Dalsgaard M, et al. Quantification of mitral valve regurgitation by 2D and 3D echocardiography compared with cardiac magnetic resonance a systematic review and meta-analysis. Int J Cardiovasc Imaging. 2020;36:279-89. doi:10.1007/s10554-019-01713-7.
31. Bergstra A, Simsek C, van den Heuvel AFM. Mitral regurgitation: when to intervene? A historical perspective. Neth Heart J. 2020;28(5):266-71. doi:10.1007/s12471-020-01417-x.
32. El Sabbagh A, Reddy YNV, Nishimura RA. Mitral Valve Regurgitation in the Contemporary Era: Insights Into Diagnosis, Management, and Future Directions. JACC Cardiovasc Imaging. 2018;11(4):628-43. doi:10.1016/j.jcmg.2018.01.009.
33. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015;16:233-70. doi:10.1093/ehjci/jev014.
34. Kim HM, Cho GY, Hwang IC, et al. Myocardial strain in prediction of outcomes after surgery for severe mitral regurgitation. JACC Cardiovasc Imaging. 2018;11:1235-44. doi:10.1016/j.jcmg.2018.03.016.
35. Pastore MC, Mandoli GE, Dokollari A, et al. Speckle tracking echocardiography in primary mitral regurgitation: should we reconsider the time for intervention?. Heart Fail Rev. 2022;27(4):1247-60. doi:10.1007/s10741-021-10100-1.
36. Cameli M, Incampo E, Mondillo S. Left atrial deformation: Useful index for early detection of cardiac damage in chronic mitral regurgitation. Int J Cardiol Heart Vasc. 2017;3;17:1722. doi:10.1016/j.ijcha.2017.08.003.
37. Yang LT, Liu YW, Shih JY, et al. Predictive value of left atrial deformation on prognosis in severe primary mitral regurgitation. J Am Soc Echocardiogr. 2015;28:1309-17.e4. doi:10.1016/j.echo.2015.07.004.
38. Cameli M, Pastore MC, Righini FM, et al. Prognostic value of left atrial strain in patients with moderate asymptomatic mitral regurgitation. Int J Cardiovasc Imaging. 2019;35:1597604. doi:10.1007/s10554-019-01598-6.
39. Mandoli GE, Cameli M, Novo G, et al. Right ventricular function after cardiac surgery: the diagnostic and prognostic role of echocardiography. Heart Fail Rev. 2019;24:625-35. doi:10.1007/s10741-019-09785-2.
40. Pastore MC, Mandoli GE, Aboumarie HS, et al. Basic and advanced echocardiography in advanced heart failure: an overview. Heart Fail Rev. 2019;25:937-48. doi:10.1007/s10741-019-09865-3.
Об авторах
О. В. ТерешинаРоссия
Доцент кафедры терапии Института профессионального образования, заведующий отделением функциональной диагностики Клиник СамГМУ.
Самара
SPIN-код: 3714-7675, AuthorID: 450045
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
О. В. Дмитриев
Россия
Доцент кафедры факультетской хирургии, заведующий отделением сердечно-сосудистой хирургии Клиник СамГМУ.
Самара
доцент кафедры факультетской хирургии СамГМУ, заведующий отделением сердечно-сосудистой хирургии Клиник СамГМУ
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
Рецензия
Для цитирования:
Терешина О.В., Дмитриев О.В. Новые и традиционные эхокардиографические показатели для выбора тактики ведения пациентов с дегенеративными заболеваниями митрального клапана. Российский кардиологический журнал. 2022;27(8):5138. https://doi.org/10.15829/1560-4071-2022-5138
For citation:
Tereshina O.V., Dmitiev O.V. Novel and conventional echocardiographic parameters for choosing management tactics in patients with degenerative mitral valve diseases. Russian Journal of Cardiology. 2022;27(8):5138. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5138
JATS XML

















































