Перейти к:
Окислительно-антиоксидантные изменения в крови у молодых людей с ранней ишемической болезнью сердца на фоне абдоминального ожирения
https://doi.org/10.15829/1560-4071-2022-5055
Аннотация
Цель. Исследовать окислительно-антиоксидантный профиль крови у молодых людей с ранней ишемической болезнью сердца (ИБС) на фоне абдоминального ожирения (АО).
Материал и методы. В исследование было включено 169 человек. Основную группу составили 47 с диагнозом ранняя (до 45 лет) ИБС (по эпидемиологическим критериям “Определенная ИБС”), из них 22 человека с АО и 25 человек без АО. В контрольную группу было включено 122 без ИБС, сопоставимых с основной группой по полу, возрасту и индексу массы тела. Среди них с АО 67 человек и без АО 55 человек. У всех обследованных в крови определяли содержание общего холестерина (ХС), триглицеридов, ХС липопротеинов высокой плотности (ЛВП), МДА-модифицированных окисленных липопротеинов низкой плотности (ЛНП), супероксиддисмутазы (СОД), глутатион-пероксидазы 1 и общей антиоксидантной способности (ОАС) крови. Статистическая обработка результатов проводилась в программе SPSS 13.0.
Результаты. ОАС крови была ниже в 2,3 раза у лиц с ИБС, чем в группе лиц без ИБС, и составила 1,58 ммоль тролокса. Уровень в крови СОД в группе лиц с ИБС был в 1,16 раза выше, чем в группе лиц без ИБС. Относительный шанс наличия ранней ИБС был связан со снижением ОАС (В=-2,855; Exp(B)=0,058; 95% доверительный интервал (ДИ) 0,008-0,392; р=0,004) и с повышенным уровнем СОД (В=0,105; Exp(B)=1,076; 95% ДИ 1,031-1,196; р=0,006), независимо от пола, возраста, факторов риска.
Заключение. Таким образом, из изученных нами окислительно-антиоксидантных показателей только повышенный уровень СОД и сниженная ОАС крови могут являться потенциальными биомаркерами для выявления ранней ИБС у людей до 45 лет.
Ключевые слова
Для цитирования:
Полонская Я.В., Каштанова Е.В., Стахнёва Е.М., Шрамко В.С., Садовский Е.В., Стрюкова Е.В., Рагино Ю.И. Окислительно-антиоксидантные изменения в крови у молодых людей с ранней ишемической болезнью сердца на фоне абдоминального ожирения. Российский кардиологический журнал. 2022;27(6):5055. https://doi.org/10.15829/1560-4071-2022-5055
For citation:
Polonskaya Ya.V., Kashtanova E.V., Stakhneva E.M., Shramko V.S., Sadovsky E.V., Stryukova E.V., Ragino Yu.I. Oxidative and antioxidant changes in blood of young people with premature coronary artery disease and abdominal obesity. Russian Journal of Cardiology. 2022;27(6):5055. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5055
По данным Всемирной организации здравоохранения, ишемическая болезнь сердца (ИБС), причиной которой является атеросклероз, стоит на одном из первых мест в десятке основных причин смерти в мире, на нее приходится 31% от общего числа летальных исходов1. Несмотря на значительные успехи в улучшении диагностики и терапии ИБС, рост сердечно-сосудистых заболеваний (ССЗ) атеросклеротического генеза среди молодых людей неуклонно растет во всем мире [1]. Это обусловлено главным образом ростом факторов риска (ФР) ССЗ. Одним из таких ФР является избыточная масса тела, особенно абдоминальное ожирение (АО) [2][3]. Известно, что
наличие АО в молодом возрасте ускоряет развитие атеросклероза коронарных артерий. Сочетание АО с другими ФР ССЗ, такими как артериальная гипертензия (АГ) и гиперхолестеринемия, может способствовать прогрессированию ССЗ. Практически все изучающие эти факторы исследования на сегодняшний день проводятся у пациентов с ИБС старше 45 лет. Патофизиологические процессы, лежащие в основе влияния ожирения на прогрессирование и тяжесть ССЗ, развившихся в возрасте до 45 лет, недостаточно изучены. Учитывая влияние ожирения на здоровье человека в целом и ИБС в частности и то, что ранняя диагностика позволяет вовремя провести профилактику и эффективное лечение столь распространенного заболевания, целью нашей работы было исследовать окислительно-антиоксидантный профиль крови у молодых людей с ранней ИБС, в т.ч. на фоне АО, для выявления потенциальных биомаркеров, которые позволят диагностировать раннюю ИБС.
Материал и методы
Исследование проведено на базе популяционной выборки жителей города Новосибирска 25-44 лет, сформированной в период 2016-2017гг в НИИТПМ — филиал ИЦиГ СО РАН. В рамках популяционного скрининга было обследовано 1457 человек, заполнивших информированное согласие, забран биологический материал, создана база данных. Протокол исследования был одобрен Этическим комитетом НИИТПМ — филиал ИЦиГ СО РАН.
В рамках скрининга всем обследованным лицам проводились анкетирование с использованием комплекса валидированных анкет, включая кардиологический опросник Роуза; антропометрия, включающая измерение роста, веса, окружности талии и бёдер (ОТ и ОБ) с последующим расчетом соотношения ОТ/ОБ, индекса массы тела (ИМТ) и индекса висцерального ожирения (ИВО); сбор анамнестических данных; функциональные обследования, включая запись электрокардиографии (ЭКГ) с расшифровкой по Миннесотскому коду, ультразвуковое исследование и др. Диагноз ИБС (по эпидемиологическим критериям — “Определенная ИБС”) ставился при наличии следующих критериев: перенесенный крупноочаговый инфаркт миокарда (ИМ) (ЭКГ), стенокардия напряжения (опросник Роуза), ишемические изменения на ЭКГ без гипертрофии левого желудочка, нарушения ритма и проводимости (ЭКГ). АО регистрировали при ОТ >80 см у женщин и >94 см у мужчин. Показатель ИМТ рассчитан по формуле ИМТ = масса тела (кг)/рост (м2). Измерение артериального давления (АД) проводилось трёхкратно. АГ регистрировали при уровнях систолического АД ≥130 мм рт.ст. и/или диастолического ≥85 мм рт.ст.
В настоящее исследование было включено 169 человек. Клиническая характеристика групп представлена в таблице 1.
Таблица 1
Клиническая характеристика групп
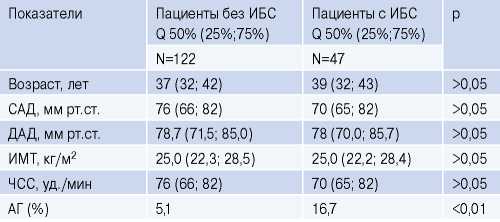
Сокращения: АГ — артериальная гипертензия, ДАД — диастолическое артериальное давление, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, САД — систолическое артериальное давление, ЧСС — частота сердечных сокращений.
Основную группу составили 47 человек (43,7% мужчин; 56,3% женщин) с диагнозом ИБС, из них 22 человека с АО и 25 без АО. В контрольную группу было включено 122 (44,8% мужчин; 55,2% женщин) без ИБС, сопоставимых с основной группой по полу, возрасту и ИМТ. Среди них с АО было 67 и без АО 55 человек.
На основе антропометрических измерений и липидного профиля крови у всех лиц, включенных в исследование, был рассчитан ИВО (табл. 2), увеличение которого в значительной степени ассоциировано с повышением кардиоваскулярного риска. Расчет ИВО проводился по формуле: Мужчины: ИВО(VAI) = ОТ/(39,68 + 1,88 × ИМТ) × (ТГ/1,03) × (1,31/ХС ЛВП), Женщины: ИВО(VAI) = ОТ/(36,58 + 1,89 × ИМТ) × (ТГ/0,81) × (1,52/ХС ЛВП).
Таблица 2
Антропометрические показатели, характеризующие количество жировой ткани Q 50% (25%; 75%)
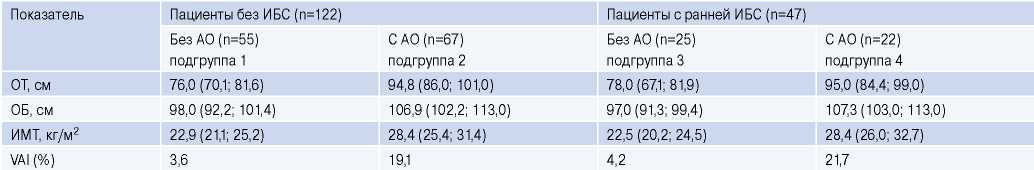
Примечание: * — VAI (%), индекс висцерального ожирения, количество пациентов с VAI выше рекомендованных значений (%).
Сокращения: АО — абдоминальное ожирение, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ОБ — окружность бёдер, ОТ — окружность талии.
Повозрастные показатели ИВО, при превышении которых сердечно-сосудистый риск резко возрастает: <30 лет — 2,52; 30-42 лет — 2,23; 42-52 года — 1,92; 52-66 лет — 1,93; >66 лет — 2,002 [4].
У всех пациентов кровь для биохимического исследования брали утром натощак из локтевой вены не ранее, чем через 12 ч после последнего приема пищи. Содержание общего холестерина (ХС), триглицеридов (ТГ) и ХС липопротеинов высокой плотности (ЛВП) в сыворотке крови определяли энзиматическим методом с использованием наборов “ThermoFisher Scientific” (Финляндия) на биохимическом анализаторе “KonelabPrime 30i” (ThermoFisher Scientific, Финляндия). Анализ концентраций в крови малонового диальдегида окисленных липопротеинов низкой плотности (ЛНП) (МДА-окЛНП), супероксиддисмутазы (СОД), глутатион-пероксидазы 1 (ГТП1) и общей антиоксидантной способности (ОАС) проводили методом иммуноферментного анализа на анализаторе Multiscam (ThermoFisher Scientific, Финляндия) с использованием тест-систем ELISA (Immundiagnostik, Bender Medsystems, Biomedica).
Статистическая обработка результатов проводилась в программе SPSS 13.0. Количественные признаки представлены в виде медиан (Me) с интерквартильным размахом (Q25%-Q75%). Группы сравнивались по Манну-Уитни, с применением критерия χ2. Статистическую значимость принимали при р<0,05.
Работа выполнена в рамках государственного задания “Эпидемиологический мониторинг состояния здоровья населения и изучение молекулярно-генетических и молекулярно-биологических механизмов развития распространенных терапевтических заболеваний в Сибири для совершенствования подходов к их диагностике, профилактике и лечению”, Рег. № 122031700094-5.
Результаты
В результате проведенного исследования нами были выявлены изменения концентраций в крови изучаемых показателей у молодых людей с ранней ИБС, которые представлены на рисунке 1. Статистически значимая разница между группами лиц с ИБС и без ИБС получена для уровней в крови СОД (р<0,0001) и ОАС (р<0,0001). ОАС крови была ниже в 2,3 раза в группе лиц с ИБС, чем в группе лиц без ИБС, и составила 1,58 мМоль тролокса. Уровень в крови СОД в группе лиц с ИБС был в 1,16 раза выше, чем в группе лиц без ИБС. Эти данные свидетельствует о значимости этих двух показателей для выявления ранней ИБС. Также отмечена тенденция (статистически не достигшая значимости) к более низким показателям в крови ХС ЛВП и МДАокЛНП у лиц с ранней ИБС. Другие исследованные биомолекулы не показали ассоциации с наличием ранней ИБС.
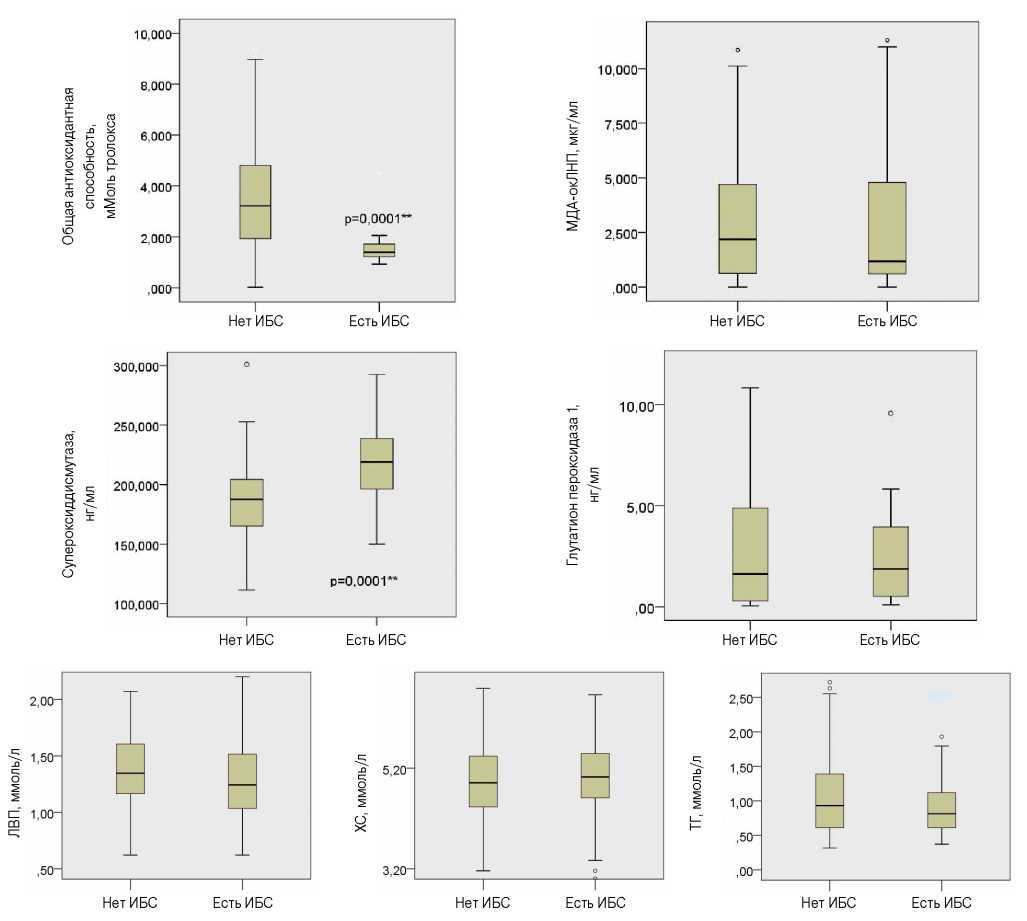
Рис. 1. Уровень изучаемых биомолекул в группах пациентов с ИБС и без ИБС.
Сокращения: ИБС — ишемическая болезнь сердца, ЛВП — липопротеины высокой плотности, МДА-окЛНП — малоновый диальдегид окисленных ЛНП, ТГ — триглицериды, ХС — холестерин.
Если рассматривать уровни изучаемых биомолекул в зависимости от наличия АО (табл. 3), то между подгруппами с АО и без него статистически значимой разницы не было обнаружено ни для МДАокЛНП, ни для ОАС. Разница между подгруппами для ОАС крови была обусловлена наличием или отсутствием ИБС (у лиц с ИБС на фоне АО этот показатель был наиболее низким — 1,34 мМоль тролокса. На изменение ГТП1 влияло наличие АО — у лиц с АО этот показатель был более, чем в 2 раза выше. Кроме того, мы отметили аналогичную явную тенденцию (статистически не достигшую значимости) у лиц с ранней ИБС на фоне АО — этот показатель также был выше, что указывает на связь ГТП1 с АО.
Таблица 3
Уровни исследованных биомолекул между подгруппами лиц с наличием и отсутствием АО
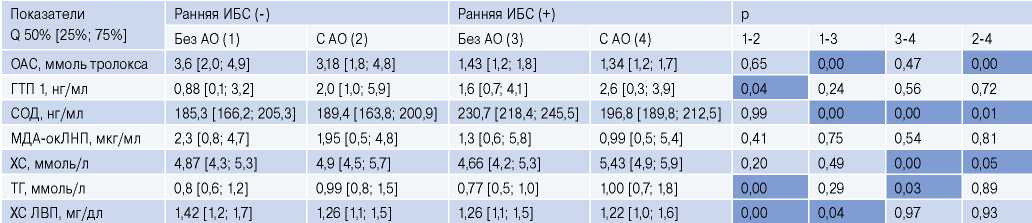
Сокращения: АО — абдоминальное ожирение, ГТП 1 — глутатион-пероксидаза 1, ИБС — ишемическая болезнь сердца, ЛВП — липопротеины высокой плотности, МДА-окЛНП — малоновый диальдегид окисленных ЛНП, ОАС — общая антиоксидантная способность, СОД — супероксиддисмутаза, ТГ — триглицериды, ХС — холестерин.
Также связь с АО показал уровень ТГ, он был статистически значимо выше в подгруппах с АО. Если рассматривать уровень общего ХС, то он был значимо выше в подгруппе “с ИБС и АО” по сравнению с остальными подгруппами и, например, был на 10% выше, чем в подгруппе без ИБС, но с ожирением. Уровень ХС ЛВП был на 13% выше у пациентов без АО и без ИБС по сравнению с другими подгруппами.
Был проведен многофакторный логистический регрессионный анализ, в качестве зависимой переменной был взят риск наличия ранней ИБС, в качестве независимых — изучаемые биомолекулы, а также пол, возраст, ИМТ, АГ, липиды крови. Относительный шанс наличия ранней ИБС был связан со снижением ОАС крови (В=-2,855; Exp(B)=0,058; 95% доверительный интервал (ДИ) 0,008-0,392; р=0,004) и с повышенным уровнем СОД (В=0,105; Exp(B)=1,076; 95% ДИ 1,031-1,196; р=0,006).
Обсуждение
Патогенез ССЗ атеросклеротического генеза является многофакторным и включает окислительный стресс, отложение липидов, образование тромба, деградацию матрикса и воспаление. Окислительный стресс и нарушение баланса между синтезом и уничтожением активных метаболитов кислорода являются важнейшими ФР развития и прогрессирования атеросклероза. Поэтому несомненный интерес представляет изучение состояния антиоксидантной системы у пациентов с ИБС. ОАС крови имеет решающее значение для защиты стенок кровеносных сосудов от окислительного повреждения. В нашем исследовании ОАС крови оказалась ниже в подгруппе лиц с ранней ИБС, что говорит о нарушении баланса про- и антиоксидантов. Наши результаты согласуются с результатами других авторов, полученными у пациентов с ИБС более старшего возраста [5].
СОД играет важную роль в защите организма от повреждающего действия радикалов кислорода, она является наиболее активным антиоксидантным ферментом в миокарде и превращает анион-радикал супероксид в перекись водорода. В нашем исследовании мы получили, что уровень СОД выше у пациентов с ранней ИБС. Такие же результаты были получены Буко И.В. и др. [6]. В работе Котовой Ю.А. и др. показатели активности СОД были ниже у больных с ИБС и сопутствующим ожирением [7]. Такое отличие от наших результатов может быть вызвано тем, что в работе Котовой Ю.А. в исследование были взяты пациенты более старшего возраста (средний возраст 61,8±8,1 лет) и изучалась активность СОД, а не ее уровень в крови. Повышение уровня СОД у более молодых пациентов с ИБС может быть связано с более высоким уровнем компенсаторных процессов в молодом возрасте, в то время как в более старшем возрасте на первое место может выходить нарушение их функциональности.
Глутатион пероксидаза — оксидоредуктаза, которая присутствует во всех клетках, включая эндотелий, разлагает перекись водорода и гидропероксиды. Недостаток ГТП усиливает атерогенез. Установлена связь между активностью ГТП и развитием ССЗ. В метаанализе Steyn M, et al. показана обратная зависимость между ИБС и активностью СОД и ГТП. Было показано, что активность ГТП определяется полом и висцеральным ожирением в популяции и может играть защитную роль в снижении риска ССЗ [8]. Pang P, et al. показали, что дефицит ГТП способствует развитию ССЗ [9]. В нашем исследовании уровень ГТП не отличался от контрольной группы у пациентов с ранней ИБС, но оказался выше у пациентов с АО как в группе контроля, так и в группе с ИБС, что указывает на высокий уровень окислительных процессов у пациентов с АО.
Нарушение про- и антиоксидантной систем способствует развитию дислипидемии. Поэтому несомненный интерес представляет комплексное изучение состояния антиоксидантной системы и липидного профиля у пациентов с ИБС.
Установлено, что окисленные ЛНП связаны со всеми стадиями атеросклероза и являются одним из ФР развития ССЗ. Lopus-Virella MF, et al. показали, что высокий исходный уровень окисленных частиц
ЛНП связан с высоким риском развития ССЗ на ранних стадиях развития заболевания, до появления других клинических признаков. Такие же выводы о связи окисленных ЛНП с ССЗ сделали Gao S, et al. [10][11]. В нашем случае не было выявлено значимой разницы между уровнями МДА-окЛНП у пациентов с ИБС и без ИБС. Вероятнее всего, это напрямую связано с активным гормонально/антиоксидантным статусом молодых людей до 45 лет.
Полученные нами данные относительно повышенного уровня ТГ у людей с АО (р<0,05) подтверждаются другими исследованиями. Так, в работе Балановой Ю.А. и др. отмечена тесная связь между ожирением и повышенными уровнями ТГ [12].
Ограничения исследования. Данное исследование является пилотным и ограничено небольшой выборкой пациентов с ИБС. В дальнейшее исследование будет включена группа с верифицированным коронарным атеросклерозом, что позволит более полно представить изменения антиоксидантного статуса у молодых людей с ИБС на фоне АО для ранней диагностики и профилактики заболевания.
Заключение
Таким образом, из изученных нами окислительно-антиоксидантных показателей только повышенный уровень СОД и сниженная ОАС крови могут являться потенциальными биомаркерами для выявления ранней ИБС у людей до 45 лет. В целом исследования в этой области позволят создавать аналитические модели, позволяющие путем определения ряда биомолекул выявлять среди трудоспособного населения пациентов с риском развития ИБС в молодом возрасте, для дальнейшего проведения профилактических мероприятий.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. World Health Organization. Cardiovascular Disease. 2019. Available online: https://www.who.int/cardiovascular_diseases/en/ (accessed on 5 March 2019).
2. Diagnosis, treatment, prevention of obesity and associated diseases (national clinical guidelines) Saint Petersburg, 2017. (In Russ.) Диагностика, лечение, профилактика ожирения и ассоциированных с ним заболеваний (национальные клинические рекомендации) Санкт-Петербург, 2017. https://scardio.ru/content/Guidelines/project/Ozhirenie_klin_rek_proekt.pdf.
Список литературы
1. Roth GA, Huffman MD, Moran AE, et al. Global and regional patterns in cardiovascular mortality from 1990 to 2013. Circulation. 2015;132(17):1667-78. doi:10.1161/CIRCULATIONAHA.114.008720.
2. Juonala M, Magnussen CG, Berenson GS, et al. Childhood adiposity, adult adiposity, and cardiovascular risk factors. N Engl J Med. 2012;365:1876. doi:10.1056/NEJMoa1010112.
3. Bastien M, Poirier P, Lemieux I, et al. Overview of epidemiology and contribution of obesity to cardiovascular disease. Prog Cardiovasc Dis. 2014;56:369. doi:10.1016/j.pcad.2013.10.016.
4. Amato MC, Giordano C, Pitrone M, et al. Cut-off points of the visceral adiposity index (VAI) identifying a visceral adipose dysfunction associated with cardiometabolic risk in a Caucasian Sicilian population. Lipids Health Dis. 2011;183(10). doi:10.1186/1476-511X-10-183.
5. Донцов А. В. Метаболический синдром как фактор дополнительного сердечно-сосудистого риска при ишемической болезни сердца. Российский медицинский журнал. 2016;22(3):120-4. doi:10.18821/0869-2106-2016-22-3-120-124.
6. Буко И. В., Канунникова Н., Грайе Али Абдалла Кадум. Показатели окислительного стресса в крови пациентов с ишемической болезнью сердца и сахарным диабетом второго типа. Актуальные проблемы биохимии: сб. материалов науч.-практ. конф.с междунар.участием, посвящ. 60-летию создания каф.биол.химии ГрГМУ , Гродно, 31 мая 2019 г. Гродно: ГрГМУ, 2019:64-8. EDN ILZMRX.
7. Котова Ю. А., Зуйкова А. А. Изучение маркеров повреждения эндотелия, окислительного и клеточного стресса у больных ИБС и сопутствующим ожирением. Вестник новых медицинских технологий. 2021;28(2):25-8. doi:10.24412/1609-2163-2021-2-25-28.
8. Steyn M, Zitouni K, Kelly FJ, et al. Sex differences in glutathione peroxidase activity and central obesity in patients with type 2 diabetes at high risk of cardio-renal disease. Antioxidants (Basel). 2019;8(12):629. doi:10.3390/antiox8120629.
9. Pang P, Abbott M, Abdi M, et al. Pre-clinical model of severe glutathione peroxidase-3 deficiency and chronic kidney disease results in coronary artery thrombosis and depressed left ventricular function. Nephrol. Dial. Transplant. 2018;33(6):923-34. doi:10.1093/ndt/gfx304.
10. Lopes-Virella MF, Bebu I, Hunt KJ, et al. DCCT/EDIC Research Group. Immune complexes and the risk of CVD in type 1 diabetes. Diabetes. 2019;68(9):1853-60. doi:10.2337/db19-0358.
11. Gao S, Zhao D, Wang M, et al. Association between circulating oxidized ldl and atherosclerotic cardiovascular disease: a meta-analysis of observational studies. Can. J. Cardiol. 2017;33(12):1624-32. doi:10.1016/j.cjca.2017.07.015.
12. Баланова Ю. А., Шальнова С. А., Деев А. Д. и др. Ожирение в российской популяции — распространенность и ассоциации с факторами риска хронических неинфекционных заболеваний. Российский кардиологический журнал. 2018;(6):123-30. doi:10.15829/1560-4071-2018-6-123-130.
Об авторах
Я. В. ПолонскаяРоссия
Полонская Яна Владимировна — старший научный сотрудник лаборатории клинических биохимических и гормональных исследований терапевтических заболеваний.
Новосибирск.
Конфликт интересов:
Нет
Е. В. Каштанова
Россия
Каштанова Елена Владимировна — заведующая лаборатории клинических биохимических и гормональных исследований терапевтических заболеваний.
Новосибирск.
Конфликт интересов:
Нет
Е. М. Стахнёва
Россия
Стахнёва Екатерина Михайловна — старший научный сотрудник лаборатории клинических биохимических и гормональных исследований терапевтических заболеваний.
Новосибирск.
Конфликт интересов:
Нет
В. С. Шрамко
Россия
Шрамко Виктория Сергеевна — научный сотрудник лаборатории клинических биохимических и гормональных исследований терапевтических заболеваний.
Новосибирск.
Конфликт интересов:
Нет
Е. В. Садовский
Россия
Садовский Евгений Викторович — младший научный сотрудник лаборатории клинических биохимических и гормональных исследований терапевтических заболеваний.
Новосибирск.
Конфликт интересов:
Нет
Е. В. Стрюкова
Россия
Стрюкова Евгения Витальевна — научный сотрудник лаборатории клинических биохимических и гормональных исследований терапевтических заболеваний.
Новосибирск.
Конфликт интересов:
Нет
Ю. И. Рагино
Россия
Рагино Юлия Игоревна — доктор медицинских наук, член-корреспондент РАН, руководитель.
Новосибирск.
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Полонская Я.В., Каштанова Е.В., Стахнёва Е.М., Шрамко В.С., Садовский Е.В., Стрюкова Е.В., Рагино Ю.И. Окислительно-антиоксидантные изменения в крови у молодых людей с ранней ишемической болезнью сердца на фоне абдоминального ожирения. Российский кардиологический журнал. 2022;27(6):5055. https://doi.org/10.15829/1560-4071-2022-5055
For citation:
Polonskaya Ya.V., Kashtanova E.V., Stakhneva E.M., Shramko V.S., Sadovsky E.V., Stryukova E.V., Ragino Yu.I. Oxidative and antioxidant changes in blood of young people with premature coronary artery disease and abdominal obesity. Russian Journal of Cardiology. 2022;27(6):5055. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5055
JATS XML

















































