Перейти к:
Алгоритм ведения пациентов с желудочковыми аритмиями, зарегистрированными в периоды бодрствования при мониторировании электрокардиограммы
https://doi.org/10.15829/1560-4071-2022-5048
Аннотация
Цель. Изучить клинико-электрокардиографические характеристики нагрузочных аритмий и разработать алгоритм ведения пациентов с желудочковыми аритмиями (ЖА), индуцированными физической нагрузкой (ФН).
Материал и методы. За период с 2015 по 2019гг из базы данных пациентов, выполнивших холтеровское мониторирование, отобраны 203 пациента с распределением ЖА в периоды бодрствования, из них выбраны 167 человек, которым был выполнен тредмил-тест (ТТ) по стандартному протоколу (Bruce). Во время ТТ оценивались качественные и количественные характеристики ЖА. Дальнейшее обследование и лечение проводилось согласно предлагаемому алгоритму.
Результаты. У 80 пациентов (48% от всех выполнивших ТТ) независимо от наличия ЖА в претесте они носили нагрузочный характер — появлялись и/или прогрессировали при ФН. Эти пациенты были включены в настоящее исследование, причинно-следственную связь ЖА с каким-либо заболеванием у них предстояло выяснить. Следуя пунктам алгоритма, у 15 человек удалось верифицировать ишемическую болезнь сердца, у 25 — гипертоническую болезнь I-II стадий, у 21 — малые аномалии развития сердца. Из оставшихся 19 человек, у которых при первичном обследовании ассоциировать ЖА, индуцированные ФН, с каким-либо заболеванием не удалось, при проспективном наблюдении у 5 человек была диагностирована аритмогенная кардиомиопатия/дисплазия правого желудочка. У остальных 14 ЖА остаются “идиопатическими”.
Заключение. С помощью представленного алгоритма можно оптимально ускорить как поиск причин ЖА, индуцированных ФН, так и выбор персонифицированного лечения.
Ключевые слова
Для цитирования:
Жабина Е.С., Тулинцева Т.Э., Трешкур Т.В. Алгоритм ведения пациентов с желудочковыми аритмиями, зарегистрированными в периоды бодрствования при мониторировании электрокардиограммы. Российский кардиологический журнал. 2022;27(7):5048. https://doi.org/10.15829/1560-4071-2022-5048
For citation:
Zhabina E.S., Tulintseva T.E., Treshkur T.V. Algorithm for the management of patients with ventricular arrhythmias recorded during wakefulness. Russian Journal of Cardiology. 2022;27(7):5048. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5048
Хроническая сердечная недостаточность (ХСН) осложняет течение многих сердечно-сосудистых заболеваний (ССЗ), затрудняя их лечение, ухудшая прогноз. Поэтому за последние два десятилетия особенный прицел делается на своевременную диагностику заболеваний сердца, поиск триггеров и маркеров, участвующих в порочном круге развития ХСН, т.е. происходит возрождение основного постулата отечественной медицины ХХ века — профилактики ССЗ [1].
Нарушение вегетативной регуляции в сторону повышения симпатической активности, имеющее место у лиц с ХСН, а также у пациентов с высоким риском её развития (ранние стадии ишемической болезни сердца (ИБС), гипертонической болезни (ГБ)), может приводить к нарушениям сердечного ритма, в частности, к наиболее жизнеугрожающим среди всех — желудочковым аритмиям (ЖА). ЖА, возникающие при измененном — гипертрофированном, ишемизированном миокарде, еще больше усугубляют его нарушенный метаболизм, уменьшают сократительную активность, а на фоне сниженного порога фибрилляции желудочков могут привести к внезапной сердечной смерти (ВСС) [2].
В действительности, ЖА по современным понятиям представляют собой весьма разнородную группу нарушений сердечного ритма как по своим качественным характеристикам, так и по клиническим особенностям. На основании электрокардиографических (ЭКГ) признаков выделяют одиночные, парные желудочковые эктопические комплексы (ЖЭК) и желудочковые тахикардии (ЖТ), которые могут быть моно- и полиморфными, неустойчивыми и устойчивыми. По клиническим особенностям ЖА еще более неоднородны — они могут быть бессимптомными, сопровождаться неприятными ощущениями или даже являться гемодинамически значимыми, встречаться как у здоровых людей, так и при разнообразной патологии. Исходя из этого, отношение к желудочковым нарушениям ритма различно, ведение больных во многом зависит от основного заболевания. При этом важно подчеркнуть, что нет такой многогранной классификации, где чётко отражалась бы связь аритмии с клинико-ЭКГ ситуацией, на фоне которой ЖА возникла — покой, физическая нагрузка (ФН), болевые эпизоды, ишемические нарушения процессов реполяризации и др. Меньше всего данных об участии вегетативной нервной системы в аритмогенезе, хотя обнаружить аритмию во время ишемии миокарда или при повышении симпатической активности — наиважнейшее дело, залог успешного лечения.
Таким образом, чтобы разорвать порочный круг прогностически неблагоприятных событий, необходимы следующие условия — своевременное выявление и лечение ССЗ, а также профилактика ВСС. Наименее изученным является звено, а, возможно, и главный маркер угрожающих состояний — ЖА, индуцированные ФН, или как их ещё называют, симпатозависимые, нагрузочные ЖА. В настоящее время не существует единого стандартного алгоритма их выявления и дальнейшего ведения таких больных [2].
Цель работы: изучив клинико-ЭКГ характеристики нагрузочных аритмий, разработать алгоритм ведения пациентов с ЖА, индуцированными ФН.
Материал и методы
Из базы данных НИЛ электрокардиологии НМИЦ им. В.А. Алмазова (Центр) за период с 2015 по 2019гг были выбраны 203 записи холтеровских мониторирований (ХМ) с преобладающим/изолированным распределением ЖА в периоды бодрствования независимо от их общего суточного количества (I пункт алгоритма). Периодами бодрствования считались все участки записи вне зависимости от времени суток, кроме периодов сна; сон был размечен согласно дневнику пациента. Из 203 пациентов были отобраны 178 человек, у которых на основании анализа электронных историй болезни отсутствовали противопоказания к проведению нагрузочной пробы — тредмил-теста (ТТ), и приглашены для очной консультации, включающей сбор анамнеза и физикальное обследование. Перед проведением ТТ им была выполнена ЭКГ, после чего отобраны 167 человек с отсутствием критериев невключения.
В исследование не включались пациенты с известной ИБС и изменениями ЭКГ покоя, затрудняющими интерпретацию нагрузочного теста. ТТ проводился по стандартному протоколу Bruce в утреннее время на оборудовании “Schiller CS-200” с использованием регистрирующей 12 отведений ЭКГ системы “Кардиотехника-07” (ЗАО “Инкарт”, Россия) без какой-либо терапии, за исключением гипотензивной. Во время нагрузочной пробы оценивались симптомность, гемодинамическая значимость, количество, морфология и комплексность ЖА, частота сердечных сокращений (ЧСС), при которой возникала аритмия. Субмаксимальная ЧСС рассчитывалась по формуле: (220 — возраст больного) × 0,85.
Оценка сегмента ST проводилась в 12 отведениях ЭКГ. Артериальное давление (АД) измеряли сфигмоманометром по методу Короткова.
Критерии включения в исследование определялись с учетом результатов ТТ: пациенты старше 18 лет, синусовый ритм, появление и/или прогрессирование ЖА во время ФН, воспроизводимые результаты ТТ. Для определения воспроизводимости результатов на следующий день при аналогичных условиях ТТ выполнялся повторно.
Прогрессированием ЖА во время ФН считалось: увеличение количества одиночных ЖЭК в 2 и более раз, а также увеличение комплексности ЖА — появление/ увеличение количества парных ЖЭК, эпизодов ЖТ.
Всем включенным в исследование пациентам проводилась эхокардиография (ЭхоКГ) на аппарате Philips iE33 Matrix, и в лаборатории Центра выполнялось биохимическое исследование крови с целью исключения электролитных, гормональных нарушений, а также оценки липидного обмена.
У каждого включенного в исследование пациента рассчитывалась претестовая вероятность (ПТВ) ИБС с учетом пола, возраста, характера болевого синдрома в грудной клетке или одышки [3]. При наличии факторов риска и/или ПТВ >15% (умеренный и высокий риск) с целью исключения ишемического характера нагрузочных ЖА при условии воспроизводимости результатов ТТ на следующий день проводилась парная нагрузочная фармакологическая проба с 0,5 мг нитроглицерина (Ng). Таким образом, при фармакологических пробах ТТ проводился трижды: первый — исходный, второй — для определения воспроизводимости результатов, и третий — на фоне Ng. Проба считалась положительной, если на фоне принятого сублингвально Ng значимо (в ≥2 раз) уменьшалось количество ЖЭК, индуцированных ФН, снижалась их комплексность, или они исчезали1. Согласно данным процитированного исследования такой ответ на нитраты мог быть указанием на связь ЖА с ишемией. С целью верификации связи ЖА с транзиторной ишемией пациентам выполнялись визуализирующие методы исследования миокарда (стресс-ЭхоКГ — 11, перфузионная однофотонная эмиссионная компьютерная томография миокарда с ФН — 1, коронароангиография (КАГ) — 15).
При наличии диагностических критериев аритмогенной кардиомиопатии/дисплазии правого желудочка (АК/ДПЖ) или подозрении на перенесенный миокардит — магнитно-резонансная томография сердца. Трем пациентам после консультации генетика было выполнено генетическое исследование. Все диагностические исследования и радиочастотная аблация (РЧА) проводились в соответствующих подразделениях Центра.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен Этическим комитетом. До включения в исследование у всех участников было получено письменное информированное согласие.
Исследование выполнено при поддержке гранта Министерства науки и высшего образования Российской Федерации (соглашение №075-15-2020- 800).
Результаты
Из 167 человек в претесте ЖА регистрировались только у 97 (58%) пациентов. Однако этот факт никак не повлиял в дальнейшем на вероятность появления/учащения эктопии во время ТТ, что демонстрируют приведенные ниже данные: А. У пациентов с наличием ЖЭК в претесте во время ФН аритмии:
а) исчезали/уменьшались в количестве — у 65;
б) исчезали, но появлялись ЖЭК другой морфологии — у 25;
в) прогрессировали — у 7.
Б. У 48 пациентов с отсутствием ЖЭК в претесте
во время ФН аритмии появлялись и/или прогрессировали.
ЖА, которые регистрировались в претесте, но во время ФН исчезали или сохранялись с тенденцией к уменьшению, не являлись объектом нашего изучения. Такие пациенты (65 человек), как и лица с невоспроизводимыми результатами, и с отсутствием ЖА при ТТ (22 человека), не включались в данное исследование, но продолжали диспансерное наблюдение согласно алгоритму ведения пациентов с ЖА [4].
Таким образом, предметом исследования стали 80 больных, у которых независимо от наличия ЖА в претесте во время ФН появлялись и/или прогрессировали и были воспроизводимы. На схеме алгоритма (рис. 1) они представлены в зависимости от поведения ЖА в виде трёх прямоугольников, объединённых штриховым овалом. К ним отнесены больные, у которых:
1. ЖА, имевшие место в претесте, прогрессировали во время ТТ (7);
2. ЖА отсутствовали в претесте, но появлялись и прогрессировали во время ТТ (48);
3. ЖА, наблюдавшиеся в претесте, исчезали, но во время ТТ появлялись и прогрессировали ЖА другой морфологии (25).
Причинно-следственную связь аритмии с какимлибо ССЗ и/или изменениями в балансе вегетативной нервной системы у этих лиц предстояло выяснить (III пункт алгоритма).

Рис. 1. Схема диагностического алгоритма при ЖА, зарегистрированных в периоды бодрствования по данным ХМ.
Сокращения: ЖА — желудочковые аритмии, ИБС — ишемическая болезнь сердца, ПТВ — претестовая вероятность, ФН — физическая нагрузка, ФР — факторы риска, ХМ — холтеровское мониторирование, ЭКГ — электрокардиография, Ng — нитроглицерин.
Во время ТТ только 23 человека (29%) предъявляли жалобы. Примечательно, что они носили общий характер и выражались в субъективном ощущении усталости, одышки и головокружения. Специфических жалоб, характерных для аритмии (перебои, неритмичное сердцебиение и т.д.), в течение пробы с ФН не было.
Из 80 пациентов, включенных в исследование, умеренная и высокая ПТВ ИБС была выявлена у 22 (28%), поэтому у них в первую очередь необходимо было исключить ишемический генез аритмий.
У трёх из них уже по завершении ТТ диагноз ИБС был вероятен, т.к. ЖА возникли на фоне депрессии сегмента ST ишемического характера — эти пациенты сразу были направлены на КАГ. Для остальных скрининговым дифференциально-диагностическим методом в нашем исследовании являлась фармакологическая проба с Ng, описанная выше.
Положительной она оказалась у 12 пациентов, что могло напрямую указывать на связь ЖА с ишемией миокарда. В дальнейшем верификация ИБС проходила с учетом сложностей в интерпретации результатов визуализирующих методов исследования у пациентов с аритмиями. Поэтому больные, имеющие частые ЖА и/или ЖА высокой комплексности на высоте ФН сразу направлялись на КАГ (5 человек), остальные — на стресс-ЭхоКГ (6 человек) и перфузионную однофотонную эмиссионную компьютерную томографию миокарда с ФН (1 человек).
В качестве демонстрации приводится один из таких 5 случаев (рис. 2). Пациент Ю., 37 лет без жалоб на нарушения ритма сердца с профилактической целью перед занятиями в тренажерном зале обратился для выполнения нагрузочной пробы. В результате на 2-й мин III ступени ТТ при ЧСС 150 уд./мин были зарегистрированы ЖЭК, которые при продолжении нагрузки увеличивались по количеству и комплексности, и к концу 3-й мин при появлении неустойчивой ЖТ тест был прекращен. Субъективно ФН перенеслась удовлетворительно. Значимых изменений сегмента ST не было (рис. 2 А). На следующий день результаты ТТ оказались воспроизводимыми (рис. 2 В). Причиной прекращения ФН также была ЖА высокой комплексности. На фоне принятого сублингвально 0,5 мг Ng выполнены три ступени нагрузки, ЖА не было (рис. 2 С). Пациент был направлен на КАГ: передняя межжелудочковая ветвь стенозирована до 90-95% в проксимальной трети локальной атеросклеротической бляшкой. После стентирования во время контрольного ТТ через 6 мес. ЖА не регистрировалась (рис. 2 D).
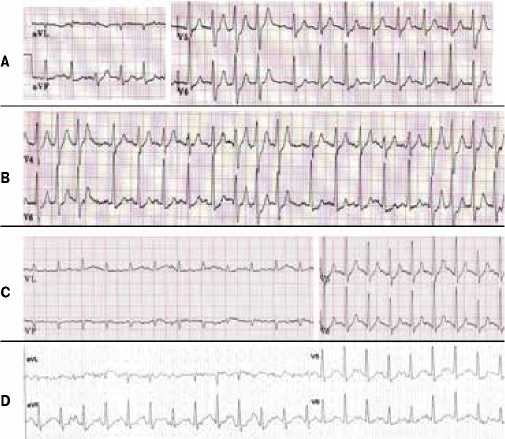
Рис. 2. Пациент Ю. 37 лет. Фрагменты ЭКГ во время выполнения ТТ. А — 1-й ТТ; В — 2-й ТТ на воспроизводимость; С — 3-й ТТ на фоне приема сублингвально 0,5 мг Ng; D — контрольный ТТ через 6 мес. после стентирования. Скорость бумаги 25 мм/с. Объяснение в тексте.
Таким образом, поставить диагноз ИБС удалось у 15 человек. Анализ показал, что это были больные более старшего возраста, с избыточной массой тела, жалобами на ухудшение переносимости ФН в течение 6-12 мес., чаще с полиморфным характером ЖА, возникновением аритмии при более низкой ЧСС (87-109 уд./мин). Пациент Ю. 37 лет, описанный выше, был исключением по многим характеристикам, однако дальнейшее ведение его также осуществлялось согласно алгоритму для пациентов со стабильной ИБС и ЖА [5]. Этим больным по результатам КАГ была проведена ангиопластика со стентированием вовлеченных коронарных артерий.
У 6 пациентов с ПТВ ИБС >15%, но отрицательной пробой с Ng ввиду того, что на высоте теста была достигнута субмаксимальная ЧСС, визуализирующие методы исследования не использовали, как и у остальных 58 пациентов с низкой ПТВ. Поиск причин аритмогенеза у них продолжался.
Однако пациентке М., 50-ти лет с умеренной ПТВ ИБС и с отсутствием ответа на Ng всё же была выполнена КАГ. Особая настороженность в этом случае возникла в связи с внезапным развитием на II ступени ТТ на фоне приёма Ng при ЧСС синусового ритма 136 уд./мин гемодинамически значимой мономорфной ЖТ (29 с, 79 комплексов) с частотой до 158 уд./мин (рис. 3). Формально увеличение количества и комплексности ЖА при пробе с Ng служит указанием на отсутствие взаимосвязи между аритмией и транзиторной ишемией миокарда, что было и подтверждено результатами КАГ. В ускоренном порядке пациентке была успешно выполнена РЧА в зоне перегородочной стенки выходного тракта правого желудочка.

Рис. 3. Фрагменты ЭКГ пациентки М. во время ТТ на фоне приёма Ng (протокол Bruce). А — внезапное развитие мономорфной ЖТ при частоте синусового ритма 136 уд./мин на II ступени теста. В — продолжение ЖТ с частотой до 157 уд./мин на 1-ой мин восстановительного периода. С — затухание ЖТ в виде уменьшения комплексности (3-4 комплекса).
Описанная выше пациентка М., 50 лет с нагрузочной ЖТ вошла в группу из 25 больных, у которых на основании данных офисных измерений АД, дневников самоконтроля АД, изменения показателей ЭхоКГ и наличия/отсутствия изменений в других органах-мишенях был установлен диагноз ГБ I-II стадий. У большинства из них (17 человек) отмечались некоторые схожие с больными ИБС характеристики аритмии на ЭКГ: полиморфный характер ЖА, более низкая ЧСС синусового ритма при возникновении аритмии (82-116 уд./мин). Однако нагрузочная ЖА у них не была связана с ишемией миокарда, и пациенты с ГБ были несколько моложе, чем больные ИБС. Дальнейшее их ведение осуществлялось согласно клиническим рекомендациям по лечению артериальной гипертензии (IV пункт алгоритма) [6]. При контрольных ТТ на фоне адекватно подобранной гипотензивной терапии отмечалось уменьшение количества эктопии вплоть до полного её исчезновения.
У 21 из 40 оставшихся пациентов с помощью ЭхоКГ удалось выявить наличие малых аномалий развития сердца (МАРС): пролапс митрального клапана с митральной регургитацией 1-2 степени (14 человек) и ложные хорды левого желудочка (7 человек). Дальнейшее их ведение осуществлялось согласно рекомендациям “Структурные аномалии сердца” от 2016г (IV пункт алгоритма) [7].
При первичном обследовании с нагрузочной ЖА у 19 пациентов не удалось обнаружить структурное заболевание сердца или другую причину, поддерживающую аритмогенез. Первичное представление о них было как о пациентах с “идиопатическими” симпатозависимыми ЖА. Клинико-ЭКГ-характеристики аритмий у пациентов с МАРС и “идиопатическими” ЖА значимо не различались: они были мономорфными, возникали при высокой ЧСС синусового ритма (118-132 уд./мин) и как правило являлись бессимптомными. Тем не менее, в сравнении с пациентами без структурных аномалий больные с МАРС имели больший средний возраст.
Особое внимание было обращено на 7 пациентов в возрасте от 18 до 27 лет с “идиопатическими” симпатозависимыми неустойчивыми ЖТ, у 4 из них ЖТ были полиморфными. За время проспективного наблюдения ЖА у них увеличивалась по данным ХМ в количестве (с 1,5-5 тыс. в сут. до 27-35 тыс.) и комплексности. На ЭхоКГ в динамике изменения выявлены только у 2 человек: у одной увеличился индекс объема левого предсердия, у другого — правого желудочка. На магнитно-резонансной томографии сердца участков фиброза и жировых включений ни у кого из этих 7 пациентов выявлено не было, что, вероятно, может свидетельствовать о ранних стадиях заболеваний, когда субстрат, доступный для визуализации, ещё не сформирован. Несмотря на это, у 5 человек нам удалось верифицировать диагноз АК/ДПЖ: в 2 случаях этому способствовали результаты гистохимического исследования биоптатов, взятых во время РЧА, в 3 — генетического исследования, направленного на выявление аритмологических синдромов. Диспансерное наблюдение оставшихся больных продолжается (III, V пункты алгоритма).
Клинический пример верификации АК/ДПЖ у женщины 36 лет, обратившейся с жалобами на периодические перебои в работе сердца, имевшей исходно при ХМ 5 тыс. ЖЭК в период бодрствования; нагрузочную неустойчивую ЖТ во время ТТ, нормальную ЭКГ покоя и ЭхоКГ, был описан и опубликован нами ранее [8]. В процессе наблюдения количество мономорфных ЖЭК у неё возросло до 35 тыс. Морфология ЖЭК у этой пациентки являлась типичной для выходного тракта правого желудочка. Учитывая количество ЖА и их морфологию, были определены показания к РЧА эктопического очага, которая была успешно проведена. Также выполнена эндомиокардиальная биопсия, и в биоптате из верхушки обнаружена остаточная площадь кардиомиоцитов с замещением фиброзной и жировой тканью 12%, из межжелудочковой перегородки — 4%. Позже при генетическом исследовании в 11 экзоне гена TMEM43 был обнаружен редкий вариант мутации p.R312W в гетерозиготном состоянии, характерный для АК/ДПЖ.
Следует отметить, что у всех пациентов, включенных в исследование, интервал QT оставался в пределах нормы.
Мы хотим акцентировать внимание на том, что далеко не сразу удаётся установить диагноз пациенту с впервые обнаруженной нагрузочной ЖА, поэтому им крайне важно продолжать диспансерное наблюдение (V пункт алгоритма). В частности, у только что упомянутой пациентки поиск заболевания, способствовавшего аритмогенезу, продолжался 10 лет. Благодаря разработанному в НИЛ электрокардиологии Центра алгоритму удается эффективно контролировать течение заболеваний, на фоне которых была выявлена нагрузочная ЖА; у 43 больных (54%) получено полное освобождение от аритмии благодаря медикаментозной терапии (17), реваскуляризации миокарда (15) и РЧА (11); у пациентов с “идиопатическими” аритмиями продолжается диагностический поиск.
Обсуждение
Про ЖА известно, что они являются одним из наиболее значимых маркеров ВСС, часто становятся дебютом ещё не выявленной структурной патологии сердца или серьезной генетически обусловленной аномалии [2, 8]. Устранение ЖА с помощью эффективного антиаритмического препарата — иногда самый короткий путь к освобождению от неё, но гораздо актуальнее изучение причинно-следственной связи аритмии и ассоциированного с ней заболевания, ибо устранение триггера ЖА может стать более радикальным средством.
Занимаясь проблемой желудочковых эктопий >30 лет, с учетом накопленного опыта мы разработали и представили дифференциально-диагностические алгоритмы ведения пациентов с ЖА разного генеза, не противоречащие имеющимся клиническим рекомендациям [4][5]. В продолжение изучения этой проблемы в настоящей статье мы предлагаем расширенный план выявления ЖА, индуцированных ФН, у пациентов с распределением ЖА в периоды бодрствования по данным ХМ в виде алгоритма.
В работе мы использовали знания о суточных и ситуационных изменениях вегетативной регуляции и предположили, что пациенты с ЖА, индуцированными ФН, чаще будут встречаться среди больных с распределением аритмий во время бодрствования по данным ХМ. В связи с этой гипотезой именно ХМ стало для нас скрининговым методом в данном исследовании. Однако мы не исключаем, что нагрузочные ЖА могут быть и случайной находкой. Например, нам встречались пациенты, которые выполняли пробу с ФН без предварительного ХМ: это были молодые люди без каких-либо жалоб, решившие пройти тест по собственной инициативе перед началом тренировок в фитнес-центре.
В этой работе мы хотим привлечь внимание врачей к проблеме индуцированных нагрузкой ЖА по нескольким причинам. Во-первых, они являются наименее изученными среди всех желудочковых нарушений ритма. Отчасти это связано с тем, что проведение нагрузочных проб в клинической практике при аритмиях не распространено, несмотря на то, что при наличии ЖА они относятся к I классу показаний [2]. Во-вторых, пациенты, как выяснилось, на такую аритмию редко жалуются: она возникает на фоне синусовой тахикардии и может не ощущаться. Отсутствие симптомности нагрузочных ЖЭК может объясняться ещё и парасистолическим характером эктопии, приводящем к образованию сливных комплексов, во время которых работа предсердий и желудочков в целом синхронизирована.
И, наконец, несмотря на то, что индуцированные ФН ЖА зарекомендовали себя как прогностически неблагоприятные, с высоким риском развития серьёзных сердечно-сосудистых событий, они не выделяются в отдельный класс и не считаются аритмиями “высоких градаций”, что способствует снижению настороженности специалистов в отношении этих аритмий [9]. Однако в ряде современных алгоритмов по ведению больных с нарушениями ритма должного внимания ЖА, индуцированным ФН, не уделяется [2][10]. Такие аритмии по определению являются симпатозависимыми: ФН — физиологичный способ усиления симпатических влияний на сердце.
Стоит подчеркнуть, что для достоверной оценки характеристик нагрузочных ЖА и определения их клинической значимости важно достижение субмаксимальной ЧСС, поэтому дозированная нагрузочная проба, проведенная под врачебным контролем, согласно протоколу и критериям её прекращения, обладает безусловным преимуществом перед ХМ в дифференциальной диагностике неясных по характеру аритмий.
Говоря о роли ХМ в диагностике нагрузочных ЖА, важно упомянуть некоторые ограничения этого метода. В большинстве программ-дешифраторов расчёт эктопии производится суммарно за время наблюдения или за час исследования, но ФН часто занимает лишь минуты, поэтому ХМ не может дать истинного представления о количестве и поведении ЖА за такой короткий период. Принципиальным это может быть при ЖЭК разных форм. Напомним, мы констатировали факт исчезновения ЖЭК одной морфологии, имевшей место в претесте, и появление другой — уже во время ФН. Доказать истинную причину полиморфизма в рамках данного исследования нам не удалось. Теоретически можно предположить две версии этого явления:
- появление новой желудочковой эктопии во время ФН из другого центра;
- или же форма ЖЭК изменилась не от локализации источника эктопии, а от скорости и пути распространения импульса в желудочках, так называемый “ложный полиморфизм” [11].
Как известно, аритмия может являться критерием прекращения нагрузочной пробы до достижения намеченной ЧСС. Определиться с характером ЖА у пациентов с умеренной и высокой ПТВ ИБС нам помогал фармакологический тест с Ng. Актуальность проведения такой пробы в ситуации дифференциального диагноза подтверждают и Froelicher VF, et al., показавшие, что риск развития ИБС среди пациентов с нагрузочными ЖА был в 3 раза выше, чем у больных без таких аритмий [12].
Лечение пациентов с ЖА, безусловно, должно проводиться с учетом основного заболевания, выраженности аритмии и выбора пациента. Напомним, что именно β-адреноблокаторам отдаётся предпочтение в лечении пациентов с ЖА, индуцированными ФН, а результаты фармакологической пробы с ними позволяют прогнозировать успешность длительной терапии.
В своём алгоритме мы предлагаем больным с ЖА, индуцированными ФН, диспансерное наблюдение, особенно, если причина аритмии ещё не выяснена. Клиницистам следует внимательно отслеживать и более агрессивно модифицировать факторы риска развития у них ССЗ. В пользу такого подхода свидетельствуют и данные Бокерии О.Л. и др., которые показали, что случаи ВСС, связанные с ФН и занятиями спортом у молодых, в большинстве сопряжены с недиагностированными заболеваниями, такими как кардиомиопатии или первичные электрические болезни сердца [13].
Заключение
В разработанном нами алгоритме ведения пациентов с ЖА, выявленными при ХМ во время бодрствования, рекомендуется проведение пробы с ФН. Частота выявления ЖА, индуцированных ФН, среди таких пациентов в нашем исследовании составила 48%. Клинико-ЭКГ-характеристика ЖА в ходе нагрузки способствует своевременной диагностике прогностически неблагоприятных заболеваний, в т.ч. ИБС и ГБ, являющихся одними из наиболее частых причин развития ХСН и ВСС. Выявление их на ранних стадиях — профилактика осложнений и снижение инвалидизации населения.
С помощью представленного диагностического алгоритма, следуя его пунктам, можно оптимально ускорить поиск как причины ЖА, так и выбора персонифицированного метода лечения.
Отношения и деятельность. Исследование выполнено при поддержке гранта Министерства науки и высшего образования Российской Федерации (соглашение № 075-15-2020-800).
1. Трешкур Т.В., Пармон Е.В., Демидова М. М. и др. Способ диагностики ишемических желудочковых нарушений ритма у больных ишемической болезнью сердца. Патент РФ на изобретение № 2280402/27.07.2006. Бюл. № 21. Ссылка активна на 13.04.2022. https://yandex.ru/patents/doc/RU2280402C2_20060727.
Список литературы
1. Российское кардиологическое общество (РКО). Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
2. Лебедев Д. С., Михайлов Е. Н., Неминущий Н. М. и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4600. doi:10.15829/15604071-2021-4600.
3. Foldyna B, Udelson JE, Karády J, et al. Pretest probability for patients with suspected obstructive coronary artery disease: re-evaluating Diamond-Forrester for the contemporary era and clinical implications: insights from the PROMISE trial. Eur Heart J Cardiovasc Imaging. 2019;20(5):574-81. doi:10.1093/ehjci/jey182.
4. Шляхто Е. В., Трешкур Т. В., Тулинцева Т. Э. и др. Алгоритм ведения пациентов с желудочковыми аритмиями. Терапевтический архив. 2015;87(5):106-12. doi:10.17116/terarkh2015875106-112.
5. Рыньгач Е. А., Трешкур Т. В., Татаринова А. А. и др. Алгоритм ведения пациентов со стабильной ишемической болезнью сердца и желудочковыми аритмиями высоких градаций. Терапевтический архив. 2017;1:94-102. doi:10.17116/terarkh201789194-102.
6. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
7. Наднациональные (международные) рекомендации. Структурные аномалии сердца. 2016. ЕАТ, БНОК, РНМОТ. Медицинский вестник Северного Кавказа. 2018;13(1-2):272-324. doi:10.14300/mnnc.2018.13040.
8. Трешкур Т. В., Пармон Е. В., Тулинцева Т. Э. и др. Профилактическая медицина. 2021;24(1):79-85. doi:10.17116/profmed20212401179.
9. Ryan M, Lown B, Horn H. Comparison of ventricular ectopic activity during 24-hour monitoring and exercise testing in patients with coronary heart disease. New England Journal of Medicine. 1975;292(5):224-9. doi:10.1056/NEJM197501302920502.
10. Под ред. Лебедев Д. С., Михайлов Е. Н. Алгоритмы ведения пациентов с нарушениями ритма сердца: учеб. пособие. — 2-е изд., испр. и доп. М.: Российское кардиологическое общество, 2021. 116 c. ISBN: 978_5_6044101_2_7.
11. Treshkur TV, Panova EA, Chmelevskii MP, et al. Determination of etiologic factors and electrophysiological features of ventricular arrhythmias in patients with coronary heart disease — the basis of successful therapy. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2014;7(4):112-7. (In Russ.)
12. Froelicher VF, Thomas M, Pillow C, et al. An epidemiological study of asymptomatic men screened with exercise testing for latent coronary heart disease. Am.J.Cardiol. 1974;34:770-6. doi:10.1016/0002-9149(74)90694-8.
13. Бокерия О. Л., Испирян А. Ю. Внезапная сердечная смерть у спортсменов. Анналы аритмологии. 2013;10(1):31-9.
Об авторах
Е. С. ЖабинаРоссия
Екатерина Сергеевна Жабина — научный сотрудник НИЛ электрокардиологии.
Санкт-Петербург
Конфликт интересов:
нет
Т. Э. Тулинцева
Россия
Татьяна Эдуардовна Тулинцева — кандидат медицинских наук, старший научный сотрудник НИЛ электрокардиологии.
Санкт-Петербург
Конфликт интересов:
нет
Т. В. Трешкур
Россия
Татьяна Васильевна Трешкур — кандидат медицинских наук, доцент, зав. НИЛ электрокардиологии.
Санкт-Петербург
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Жабина Е.С., Тулинцева Т.Э., Трешкур Т.В. Алгоритм ведения пациентов с желудочковыми аритмиями, зарегистрированными в периоды бодрствования при мониторировании электрокардиограммы. Российский кардиологический журнал. 2022;27(7):5048. https://doi.org/10.15829/1560-4071-2022-5048
For citation:
Zhabina E.S., Tulintseva T.E., Treshkur T.V. Algorithm for the management of patients with ventricular arrhythmias recorded during wakefulness. Russian Journal of Cardiology. 2022;27(7):5048. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5048
JATS XML

















































