Перейти к:
Эмболизирующие спирали: от истории к современной клинической практике
https://doi.org/10.15829/1560-4071-2025-6502
EDN: BKFLLO
Аннотация
Эндоваскулярная эмболизация с использованием спиралей является широко применяемым методом лечения различных сосудистых патологий. На рынке представлено множество типов спиралей, отличающихся конструкцией, материалом и техническими характеристиками, что позволяет выбирать оптимальные варианты в зависимости от клинической ситуации. В статье рассматриваются основные виды эндоваскулярных спиралей, их технические особенности. В заключительной части представлены клинические случаи успешного использования эндоваскулярных спиралей для эмболизации сосудистых образований и купирования кровотечений, что демонстрирует широкие возможности и важную роль этого инструментария в современной интервенционной терапии.
Для цитирования:
Бадоян А.Г., Баранов А.А., Махмудов М.А., Крестьянинов О.В., Бородин В.П., Чепелева Е.В., Козырь К.В., Хахалкин В.В., Мочалова А.Б., Владимиров С.В., Докучаева А.А. Эмболизирующие спирали: от истории к современной клинической практике. Российский кардиологический журнал. 2025;30(9S):6502. https://doi.org/10.15829/1560-4071-2025-6502. EDN: BKFLLO
For citation:
Badoyan A.G., Baranov A.A., Makhmudov M.A., Krestyaninov O.V., Borodin V.P., Chepeleva E.V., Kozyr K.V., Khakhalkin V.V., Mochalova A.B., Vladimirov S.V., Dokuchaeva A.A. Embolization coils: from history to modern clinical practice. Russian Journal of Cardiology. 2025;30(9S):6502. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6502. EDN: BKFLLO
За последние десятилетия в клинической практике наблюдается устойчивый переход от открытых хирургических вмешательств к минимально инвазивным процедурам, выполняемым под контролем визуализации в реальном времени. Минимально инвазивные вмешательства не только существенно расширили возможности лечения сосудистой патологии, но и в большинстве случаев сопровождаются меньшей частотой послеоперационных осложнений по сравнению с традиционной хирургией. Одной из таких процедур является эмболизация — методика, при которой с помощью катетера в целевой сосуд вводится агент, блокирующий кровоток. Процедуры эмболизации проводятся при различных заболеваниях, в т.ч. при аневризмах сосудов различной локализации, для остановки кровотечения или для лизиса опухоли путем блокирования ее кровоснабжения и пр. [1-3]. В настоящее время в клинической практике доступен разнообразный арсенал окклюзионных агентов, включая спирали, инъекционные клеи и эмболические частицы. Каждая категория эмболических агентов характеризуется своими сильными и слабыми сторонами и имеет несколько нишевых клинических сценариев, для которых они идеально подходят. Учитывая тенденцию увеличения количества региональных сосудистых центров в Российской Федерации, оказывающих малоинвазивную помощь пациентам как в экстренных, так и в плановых ситуациях, возрастает число эндоваскулярных эмболизирующих вмешательств [4-7]. В данной работе основное внимание уделяется внутрисосудистым спиралям — одному из наиболее широко используемых и активно развивающихся типов эмболизационных материалов.
Современные эндоваскулярные спирали отличаются широким разнообразием форм, размеров и длин, что позволяет точно адаптировать их к анатомическим особенностям сосудистого русла и клиническим задачам эмболизации. По форме спирали могут быть спиралевидными (helical), прямыми (straight), коническими (tornado) или трёхмерными (3D) — каждая конфигурация обладает своими гемодинамическими преимуществами и направлена на создание оптимальных условий для тромбообразования и надёжной окклюзии. По диаметру спирали делятся на макро- (0,035") и микроспирали (0,018-0,010"): первые применяются в сосудах среднего и крупного калибра, вторые — в условиях суперселективного вмешательства на мелких и витиеватых артериях. Диапазон длины — от 1 мм до 60 см — позволяет варьировать объём эмболизирующего материала в зависимости от протяжённости патологического сегмента. Выбор конкретной спирали определяется диаметром, анатомией и геометрией эмболизируемого сосуда, а также клинической целью — будь то немедленная остановка кровотечения или создание стабильной окклюзии с минимальным количеством имплантатов.
Исторический экскурс
История применения эндоваскулярных спиралей для эмболизации периферических сосудов начинается с начала 1970-х годов, когда Чарльз Доттер и Йозеф Рёш ввели идею селективной артериальной окклюзии для контроля желудочно-кишечного кровотечения. В 1970г Рёш впервые описал успешную эмболизацию гастроэпиплоической артерии свернувшейся кровью у пациентки с коагулопатией, продемонстрировав практическую значимость метода. В 1972г они вместе с Майклом Брауном опубликовали подробный отчёт о селективной артериальной эмболизации при остром желудочном кровотечении, который стал одним из первых системных случаев применения спиралей для периферических артерий [8]. Его практика эмболизации желудочно-кишечных артерий проложила путь к широкому использованию спиралей для остановки кровотечений при травмах, псевдоаневризмах и других не неврологических показаниях. С тех пор технология развивалась: появились макро- и микроспирали, толкаемые и отсоединяемые конструкции, спирали с покрытием, способные плотно закупоривать сосуды — даже небольшого диаметра — и обеспечивающие длительную окклюзию.
Принцип "работы" эндоваскулярной спирали
При введении в целевой сосудистый сегмент спирали обеспечивают постоянную эмболизацию, вызывая тромбоз и полную окклюзию целевого сосуда. Это достигается главным образом благодаря трем синергичным механизмам: (1) замедление кровотока через сосуд за счет механической блокировки, (2) создание тромбогенного каркаса для формирования тромба, и (3) повреждение сосудистой стенки, что приводит к высвобождению тромбогенных факторов. Обычно тромбоз происходит в течение 5 мин после установки спирали, хотя этот временной промежуток может варьироваться в зависимости от типа использованной спирали, размера эмболизируемого сосуда и степени кровотока через эмболизированную структуру. Со временем острый комплекс спираль-тромб превращается в организованный тромб с развитием неоинтимальной гиперплазии и фиброза в стенке сосудов.
Эндоваскулярные спирали обладают рядом важных характеристик, которые влияют на их эффективность и безопасность при эмболизации сосудов. Кроме того, спирали различаются по способу доставки к месту назначения, что также играет важную роль в их использовании. В следующих разделах мы подробно рассмотрим основные свойства спиралей, включая материалы, биосовместимость и тромбогенность, чтобы лучше понять, как эти параметры влияют на работу устройства и его клиническое применение.
Биосовместимость эндоваскулярных спиралей
Биосовместимость является одной из наиболее важной характеристик эндоваскулярных спиралей. Материалы, из которых изготовлены спирали, должны быть биоинертными, чтобы избежать развития местной или системной неблагоприятной реакции со стороны организма.
В большинстве случаев спирали изготавливаются из биоинертных металлических материалов, таких как нержавеющая сталь, платина или нитинол, и могут иметь дополнительное покрытие. Предыдущие исследования по лечению артериовенозных мальформаций показали, что эффективность спиралей из платины и нержавеющей стали не отличается [9]. С теоретической точки зрения, металлический сердечник должен обладать высокой продольной прочностью при минимальном радиальном давлении, чтобы не вызывать избыточную нагрузку на сосудистую стенку. Эти плотные металлы обладают естественной рентгеноконтрастностью, что обеспечивает возможность точного выполнения эмболизации под контролем флюороскопии.
Спирали из нержавеющей стали
Нержавеющая сталь долгое время оставалась одним из основных материалов в области биомедицинских технологий благодаря своей биоинертности, коррозионной стойкости и превосходным механическим свойствам. В 1975г Gianturco C, et al. впервые представили спираль из нержавеющей стали, примененную для постоянной артериальной эмболизации у пациентов через катетеры калибра 6F и 7F (рис. 1 А) [10]. Спирали из нержавеющей стали обладают рентгеноконтрастностью, хотя и в меньшей степени по сравнению с современными металлическими сплавами, такими как платина. Эти спирали относительно жёсткие из-за высокой радиальной прочности, что может затруднять плотную упаковку в сосуде. Ввиду указанных характеристик, спирали из нержавеющей стали в основном применяются для окклюзии сосудов крупного калибра. В отличие от них, спирали из более гибких материалов, например, платины, подходят для эмболизации более мелких сосудов. Эффективность спиралей из нержавеющей стали была подтверждена при лечении артериовенозных мальформаций, гиперспленизма и кровотечений [11, 12].
Спирали из платины
Для улучшения плотности упаковки были разработаны более мягкие платиновые спирали, которые в настоящее время являются одними из самых широко используемых в современной клинической практике (рис. 1 B-D). Спирали из платины обладают высокой биосовместимостью, более податливы, рентгеноконтрастны и мягче спиралей из нержавеющей стали [12]. Благодаря своей податливости, спирали из платины хорошо адаптируются к форме часто неравномерных по форме аневризм при их размещении. Поскольку платиновые спирали не обладают такой высокой радиальной силой, как спирали из нержавеющей стали, их можно плотно упаковывать, не создавая избыточного давления на просвет аневризмального мешка или сосудистой стенки. Более того, в отличие от нержавеющей стали, платина не подвержена электролизу и является в 3-4 раза более тромбогенной, чем нержавеющая сталь [13].
Спирали из нитинола
Нитинол с памятью формы является относительно новым материалом для сердцевины спиралей, несмотря на его широкое применение в производстве стентов. Это интерметаллический (состоящий из двух металлов) сплав, состоящий почти из равных количеств никеля и титана, который обладает способностью восстанавливать свою форму после деформации (т.е. самораскрывающийся). Нитинол обладает более низким коэффициентом упругости и большей прочностью по сравнению с нержавеющей сталью [14]. Он в 10-20 раз более гибок, чем нержавеющая сталь, что указывает на отличную управляемость при введении. Нитинол также обладает отличной биосовместимостью и более устойчив к коррозии по сравнению с нержавеющей сталью, благодаря наличию пассивного титаново-оксидного слоя. Этот слой защищает токсичный компонент никеля от утечек в окружающую среду, тем самым защищая основной материал от коррозии. Кроме того, было показано, что спирали из нитинола, армированные нержавеющей сталью, повышают внутрисосудистую стабильность за счет более высоких радиальных сил по сравнению со стандартными спиралями из нержавеющей стали, при этом не ухудшая манипуляции с ними (рис. 1 E) [15].
Однако биоинертные металлические спирали останавливают кровоток за счёт механического воздействия и в своей эффективности зависят от индивидуальных особенностей гемостаза пациента. Образование тромба при этом инициируется изменениями в гемодинамике, вызванными присутствием спирали. Таким образом, тромб, формирующийся на поверхности биоинертной металлической спирали, как правило, бывает тонким и может существенно варьироваться по толщине в различных участках спирали, между витками, а также у разных пациентов. Более того, новообразованный тромб в основном состоит из эритроцитов и тонких фибриновых волокон, и, следовательно, может не выдерживать артериального давления. Кроме того, физиологическое разрушение тромба может привести к уплотнению спирали и её миграции. Попытки модификации поверхности существующих металлических спиралей привели к разработке нового класса спиралей — биоактивных спиралей.
Тромбогенность
Важным свойством спиралей также является тромбогенность их поверхности, от которой зависят формирование фибрина и адгезия тромбоцитов. Так как механизм функционирования спирали основывается на тромботической окклюзии целевого сегмента, основной акцент в их разработке был сделан на улучшение методов индукции тромбообразования. Для усиления тромбогенного эффекта эндоваскулярных спиралей в их конструкцию часто добавляют волокна, способствующие ускоренной индукции тромбообразования. Первым этот принцип применил Gianturco C, et al., добавив к металлической спирали шерстяные волокна. Впоследствии это привело к широкому распространению "волокнистых" (fibered) спиралей, особенно в ситуациях, где требуется быстрое прекращение кровотока. Trerotola SO, et al. в серии in vivo-экспериментов продемонстрировали, что наличие волокон увеличивает тромбогенность, позволяя добиться окклюзии с меньшим количеством имплантированных спиралей [16].
Спирали с волокнистым покрытием
Первые эндоваскулярные спирали Gianturco C, et al. представляли собой стальную проволоку длиной ~5 см и диаметром примерно 0,89 мм, на которую были намотаны хлопковые волокна длиной ~3 см. Эти хлопковые нити образовывали пористое, шероховатое покрытие, значительно усиливающее тромбогенность спирали за счёт активного взаимодействия с кровью и стимулирования свертывания. Формирование тромба на таких спиралях занимало примерно 10 мин. Однако, несмотря на высокую эффективность в достижении сосудистой окклюзии, спирали с хлопковыми волокнами имели ограничения в безопасности: они могли вызывать локальное воспаление и в редких случаях приводить к реканализации или миграции фрагментов волокон [17]. Для повышения эффективности и безопасности продолжался поиск более совершенных материалов и конструкций. В качестве следующего этапа появились синтетические волокна, призванные повысить безопасность и эффективность устройств (рис. 1 F, G). Одними из первых были дакроновые волокна — прочные и стабильные, но не биоразлагаемые полиэфиры, которые обеспечивали долговременную механическую поддержку тромбированной области, однако могли вызывать длительное раздражение тканей. Для усиления тромбогенного эффекта стали использовать ивалон (поли-виниловый спирт, PVA) — гидрофильный полимер, способный набухать и создавать гелевую структуру, что улучшало заполнение сосуда и активацию свертывающей системы крови. Спирали с прикреплёнными синтетическими волокнами из дакрона, ивалона продемонстрировали снижение воспаления, сохраняя при этом свойства агрегации тромбоцитов [17]. Спирали из платины с нейлоновым покрытием улучшили показатели окклюзии по сравнению с обычными платиновыми спиралями, увеличив их эффективность с 85% до 96% [18].
Спирали с гидрогелевым покрытием
Помимо добавления тромбогенных волокон, как это реализовано в спиралях ранних поколений, таких как Nester и Tornado (Cook Medical), в последние годы были разработаны спирали с гидрогелевым покрытием, которое расширяется и заполняет промежутки в сосуде после установки спирали. Ярким примером таких технологий являются спирали Azur CX HydroCoil (Terumo) (рис. 1 H, I). Гидрогель, нанесённый на поверхность спирали, обладает способностью впитывать влагу и увеличиваться в объёме при контакте с сывороткой или кровью. В процессе набухания гидрогель значительно расширяется, что приводит к увеличению площади поверхности спирали и повышению плотности заполнения просвета сосуда. Это, в свою очередь, существенно усиливает способность устройства задерживать форменные элементы крови и способствует более активному тромбообразованию по сравнению с непокрытыми металлическими спиралями. После стабилизации сгустка сосуд остаётся устойчиво окклюзированным, исключая возможность реканализации и обеспечивая долговременный лечебный эффект.
В исследовании с участием 37 пациентов и 57 артериовенозных мальформаций лёгких эмболизация с использованием 0,018-дюймовых гидрогелевых спиралей была технически успешной в 98% случаев (56 из 57). За медианный период наблюдения 19 мес. (от 2 до 47 мес.) не зарегистрировано ни одного случая реканализации, а также серьёзных осложнений [19].

Рис. 1. Различные типы и модификации эмболизационных спиралей. А. Спираль из нержавеющей стали. B. Платиновая спираль Optima (Balt). C. Платиновая спираль Axium Prime (Medtronic). D. Платиновая спираль Packing coil (Penumbra, Inc.). E. Спираль Nexus с нитиноловой сердцевиной (Micro Therapeutics, Inc.). F. Платиновая спираль с нейлоновыми волокнами Nester (Cook Medical). G. Спираль с синтетическими волокнами MReye Flipper (Cook Medical). H. Спираль с гидрогелевым покрытием Azur CX HydroCoil (Terumo). I. Спираль с гидрогелевым покрытием HydroFrame (MicroVention, Inc.).
Клиническое применение эндоваскулярных спиралей
Эмболизация внутренней подвздошной артерии
Изолированные аневризмы внутренней подвздошной артерии (ВПА) (гипогастральной артерии) являются редкой формой аорто-подвздошной аневризматической патологии и встречаются примерно в 0,04% всех аорто-подвздошных аневризм. Благодаря глубокому расположению в малом тазу эти аневризмы часто диагностируются на поздних стадиях и достигают значительных размеров (рис. 2). Риск разрыва таких аневризм высок и достигает до 38% при первичной постановке диагноза, при этом смертность от разрыва достигает 58%, что подчёркивает необходимость своевременного выявления и лечения данной патологии. Ввиду отсутствия проспективных рандомизированных исследованиях, сравнивающих эффективность и безопасность открытой хирургии против эндоваскулярного исключения аневризмы, однозначно ответить на вопрос какая из стратегий предпочтительнее невозможно. Так, в ретроспективном исследовании Choi E, et al. сравнили исходы у 58 пациентов с изолированными аневризмами подвздошной артерии (25 — открытая хирургия, 33 — эндоваскулярная хирургия) [20]. В группе эндоваскулярной хирургии чаще встречались поздние осложнения (15,2% vs 0%, p=0,04) и повторные вмешательства (9,1% vs 4,0%, p=0,44), при этом смертность и частота MACE не различались между группами. Авторы приходят к выводу, что у пациентов с низким операционным риском и более молодым возрастом (66,0±8,2 года vs 73,1±8,6 лет, p=0,003) открытая хирургия предпочтительнее. С целью улучшения результатов эндоваскулярного лечения аневризм подвздошных артерий были предложены комбинированные методы, когда в дополнение к эндоваскулярному закрытию ВПА эндоваскулярными спиралями, выполняется имплантация стент-графта с перекрытием устья ВПА. Так, в исследовании Yang M, et al. были включены 42 пациента (средний возраст 71 год) с изолированными аневризмами ВПА, из которых 12 случаев были разорвавшимися [21]. Применялись различные методы: открытая резекция (n=6), эмболизация (n=12), стент-графт (n=8) и их комбинация (n=16), при этом наименьшие показатели эндоликов (6%) и повторных вмешательств (6%) отмечены при комбинированном подходе. Общая 30-дневная смертность составила 5%, но достигала 17% у пациентов с разрывом, а наиболее частым осложнением у выживших стала перемежающаяся боль в ягодице (18%). Тем не менее эндоваскулярная эмболизация изолированной аневризмы подвздошной артерии спиралями на сегодняшний день представляет собой жизнеспособный вариант лечения и может быть успешно реализована в условиях опытных специализированных центров (рис. 3, 4).
Другим, и наиболее частым, показанием для эмболизации ВПА является профилактика эндолика при стентировании аневризм брюшной аорты (АБА). С момента разработки эндоваскулярного протезирования аорты в 1991г данная технология прочно вошла в клиническую практику в роли общепринятого метода лечения АБА. По мере накопления опыта и совершенствования эндопротезов показания к эндопротезированию АБА значительно расширились. В частности, при распространении аневризматического процесса на подвздошные артерии для достижения адекватной дистальной зоны фиксации и профилактики развития эндоликов нередко требуется эмболизация ВПА [22][23]. Эффективность применения эндоваскулярных спиралей для эмболизации ВПА перед плановым эндопротезированием АБА описана в ряде зарубежных работ. В работе Kim WC, et al. технический успех вмешательства (13 случаев) составил 100%, а за 3-мес. период наблюдения не было отмечено ни одного случая развития эндолика II типа. Клинически значимые нежелательные явления (в частности, ягодичная боль) были зарегистрированы лишь у 2 из 13 пациентов, однако эти симптомы полностью регрессировали в ходе дальнейшего наблюдения [24]. В другой работе Chun JY, et al. эндоваскулярные спирали для эмболизации ВПА перед эндопротезированием АБА были применены в 70 из 111 случаев, технический успех в общей популяции пациентов составил 95,7%. Эндолик 2 типа из ранее эмболизированных ВПА был отмечен в 4 случаях в срок между первой неделей и вторым месяцем после эндопротезирования, один из которых привел к увеличению диаметра аневризматического мешка и потребовал повторного вмешательства. В серии наблюдений сообщалось о частоте ягодичной хромоты в 38%, которая длилась <12 мес. у 26% пациентов и ограничивала образ жизни у 17% [25]. Таким образом, на сегодняшний день стандартная техника эмболизации спиралями перед эндопротезированием брюшного отдела аорты описана как безопасная и эффективная процедура. Хотя анатомия аорто-подвздошных аневризм может быть технически сложна для навигации во время эмболизации ВПА, процедура выполнима с высокими техническими показателями успеха, приближающимися к 100% [26][27].
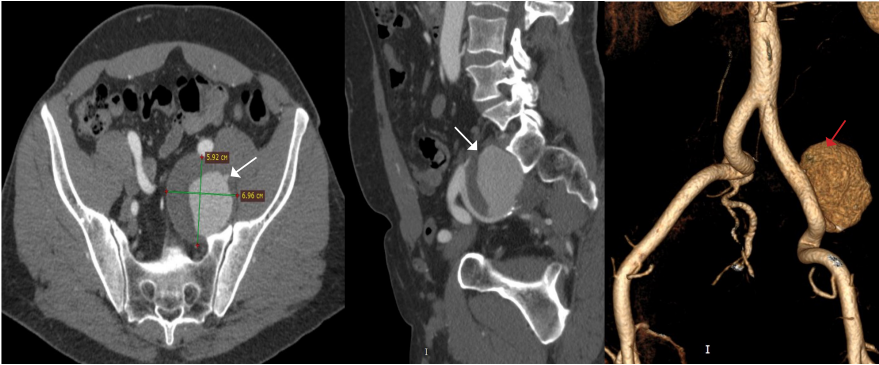
Рис. 2. Аневризма левой ВПА (стрелки).
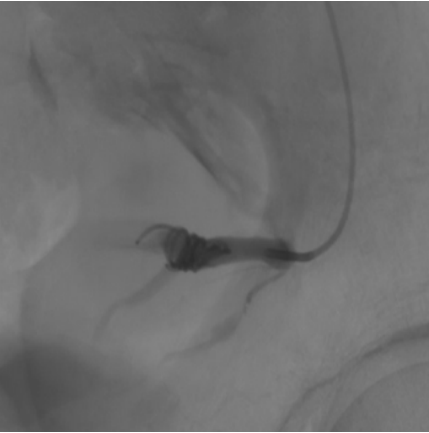
Рис. 3. Эндоваскулярная спираль в ВПА.
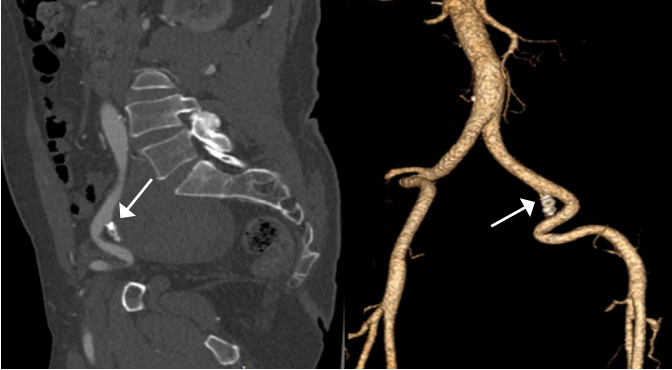
Рис. 4. Окклюзированная ВПА по данным мультиспиральной компьютерной томографии (стрелки).
Лечение осложнений после эндопротезирования аорты
В настоящее время эндоваскулярное лечение аневризмы аорты широко применяется как менее травматичная замена открытой хирургии. Тем не менее эта процедура может сопровождаться осложнениями, такими как эндолики — продолжающееся поступление крови в полость аневризмы после вмешательства. Это состояние опасно тем, что может привести к увеличению аневризматического мешка и повысить риск его разрыва. Выделяют пять основных типов эндоликов. Тип 1 может быть проксимальным (1А) или дистальным (1B) относительно места установки протеза. При типе 1A эндопротез не полностью герметизирует проксимальную часть аневризмы, и кровь проникает между стенкой аорты и материалом протеза. При типе 1B утечка происходит между стенкой дистального отдела аорты и протезом. Тип 2 возникает из-за ретроградного кровотока через ветви аорты, заполняющего мешок аневризмы. Тип 3 связан с разрывом или разъединением компонентов эндопротеза. Тип 4 обычно наблюдается во время установки имплантата у пациентов на антикоагулянтной терапии и вызван пористостью материала протеза. Тип 5 (эндотензия) — это увеличение аневризматического мешка без видимого эндолика [28]. Каждый тип эндолика требует особого подхода к диагностике и лечению, т.к. представляет разную степень риска для пациента. Эндолики 1 типа встречаются в 9% случаев [29] и являются показанием к повторному вмешательству из-за высокого риска разрыва в 52% случаев после эндопротезирования АБА [30] и от 3% до 16% случаев после эндопротезирования аневризмы грудной аорты [31][32]. Fabre D, et al. продемонстрировали высокий 100% технический успех эндоваскулярной эмболизации эндолика у 83 пациентов с эндопротезированием аневризмы аорты. Размеры аневризматического мешка были значимо уменьшены через 6, 12 и 24 мес. (p=0,001) [33]. Таким образом, эндоваскулярная эмболизация эндоликов может быть рекомендована у пациентов после эндопротезирования аневризмы аорты с осложнившим эндоликом с целью снижения рисков увеличения размеров аневризматического мешка и уменьшения рисков разрыва аорты.
С развитием методов эндопротезирования грудной аорты все чаще применяется техника in-situ фенестрации подключичной артерии, позволяющая сохранить её проходимость при необходимости расширения проксимальной зоны фиксации стент-графта. Такая стратегия обеспечивает адекватное закрытие аневризмы при сохранении кровотока по важным артериальным ветвям. Однако данная техника сопряжена с риском возникновения эндолика типа 1C — краевой утечки крови через устье ветви, что может быть обнаружено как на мультиспиральной компьютерной томографии, так и на аортографии (рис. 5, 6). В случае с подключичной артерией, именно она может стать источником ретроградного кровотока в исключённый аневризматический мешок, что сохраняет давление внутри аневризмы и угрожает её дальнейшему прогрессированию. С расширением метода стентирования грудной при лечении сложной патологии дуги аорты всё более актуальным становится развитие эффективных методов устранения технических и процедурных неудач с целью повышения безопасности и улучшения результатов лечения (рис. 7). Ряд авторов демонстрируют успешное применение эндоваскулярных спиралей при таких сценариях [34][35].
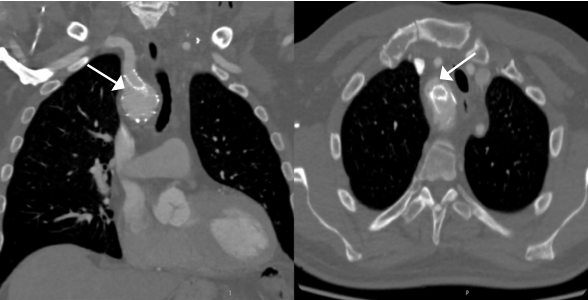
Рис. 5. Эндолик 1C типа из правой подключичной артерии (стрелки) после стентирования грудной аорты.
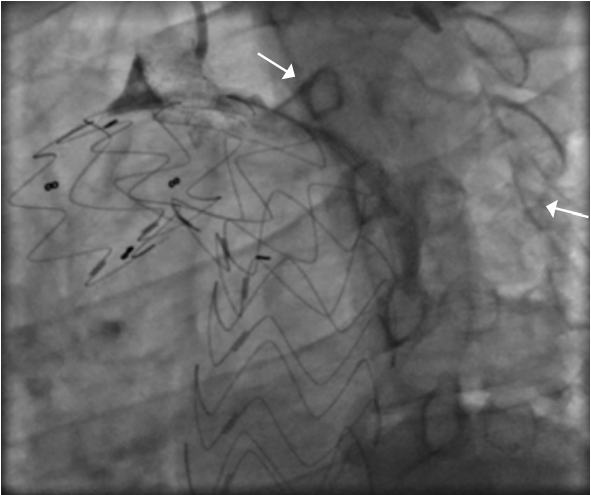
Рис. 6. Ангиография правой подключичной артерии. Эндолик 1C и заполнение полости аневризмы (стрелки).
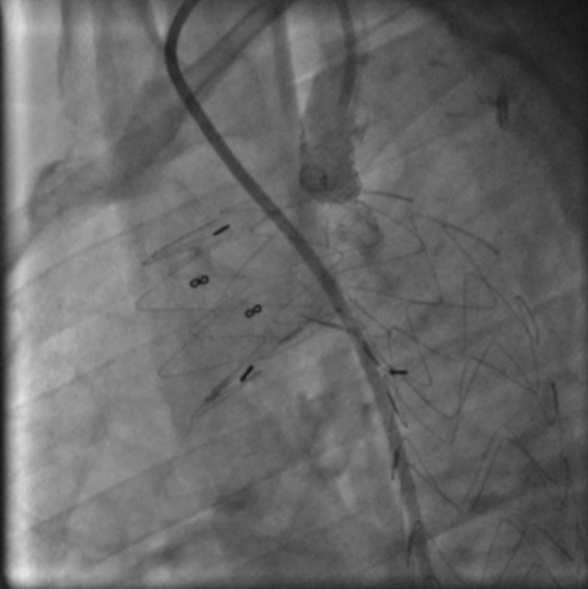
Рис. 7. Исключенный источник эндолика эндоваскулярной спиралью.
Эндоваскулярная эмболизация при кровотечениях
Эндоваскулярная эмболизация с применением спиралей является широко признанным методом при плановом лечении различных сосудистых заболеваний, включая аневризмы и патологические артериовенозные мальформации. Однако применение этого малоинвазивного метода также эффективно и в ургентных, неотложных состояниях, когда необходимо быстро контролировать, например, массивное кровотечение и стабилизировать пациента. Кровотечения могут быть вызваны травмой, сопутствующим заболеванием или их сочетанием, приводя к тяжелым осложнениям, таким как кардиогенный шок и летальный исход; общая смертность достигает 40% [36]. До появления эндоваскулярных технологий единственным способом остановки кровотечения оставалось открытое хирургическое вмешательство. Однако в современной клинической практике всё чаще предпочтение отдается эндоваскулярной эмболизации, которая в ряде случаев вытеснила хирургический подход. Это связано с её способностью быстро и эффективно контролировать кровотечение с минимальной инвазивностью для пациента, а в ряде клинических ситуаций — и с её уникальной возможностью достигать источников кровотечения, недоступных для открытой хирургии. Так, при некоторых вариантах легочного кровотечения, особенно при повреждении мелких ветвей легочной артерии, традиционная хирургическая коррекция может быть технически невозможна или сопряжена с чрезмерно высоким риском, в то время как эндоваскулярная эмболизация становится единственным жизнеспасающим методом лечения (рис. 8, 9).
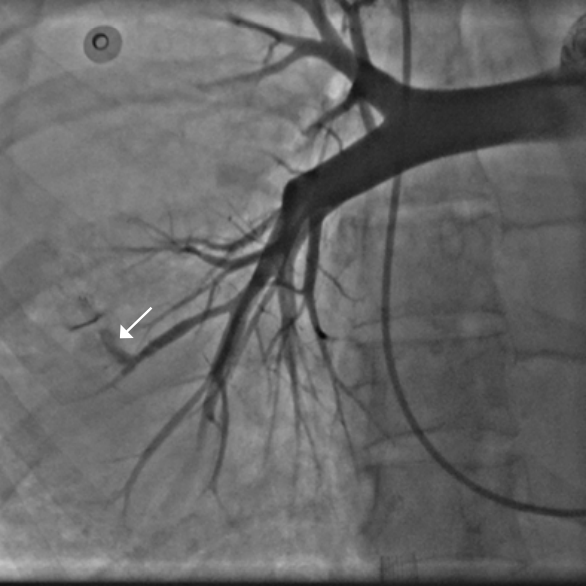
Рис. 8. Источник кровотечения из субсегментарной ветви правой нижнедолевой легочной артерии (стрелка).
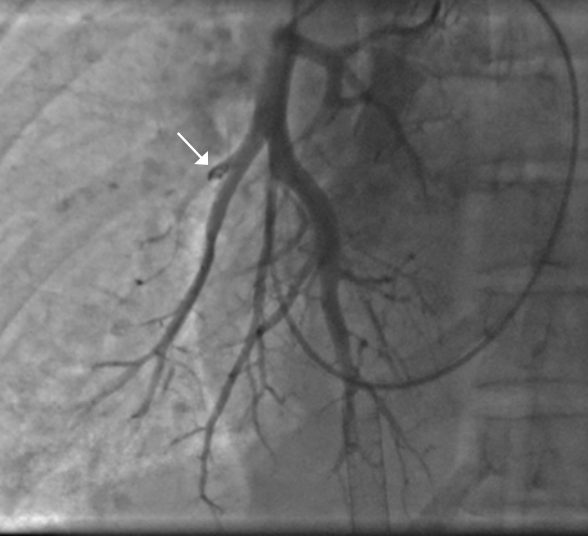
Рис. 9. Ангиопульмонография субсегментарной ветви правой нижнедолевой легочной артерии. Исключение источника кровотечения спиралью (стрелка).
Травматические кровотечения, например, при повреждениях тазовых сосудов вследствие ДТП или переломов таза, часто требуют экстренного вмешательства. В таких случаях эндоваскулярная эмболизация, включая использование спиралей и окклюдеров, позволяет эффективно остановить кровотечение, избегая открытой операции, что особенно важно у гемодинамически нестабильных пациентов.
Нетравматические кровотечения включают широкий спектр патологий, среди которых особое место занимают гинекологические и желудочно-кишечные кровотечения. В акушерской практике, например, послеродовые кровотечения могут быть причиной высокой материнской смертности. Эмболизация маточных артерий с помощью спиралей доказала свою высокую эффективность и безопасность, позволяя контролировать кровотечение и сохранять репродуктивную функцию у женщин. Клиническая успешность такого лечения колеблется от 79 до 100%, при этом уровень осложнений остаётся низким и в основном связан с непреднамеренной эмболизацией смежных сосудов [37].
В лечении желудочно-кишечных кровотечений эндоваскулярная эмболизация становится следующим этапом при неудаче консервативной терапии и эндоскопии. Суперселективная катетеризация позволяет точно локализовать источник кровотечения и применить спирали для окклюзии поражённого сосуда, что уменьшает риск ишемии тканей. Техническая успешность процедуры достигает почти 100%, а клиническая эффективность — около 70-83% в зависимости от локализации кровотечения [38][39]. В исследовании Extrat C, et al. эндоваскулярная эмболизация брыжеечной артерии была проведена у 15 пациентов [40]. Технический успех был достигнут в 93,3% случаев (14 из 15). При этом наиболее частым эмболизирующим материалом были эндоваскулярные спирали — 8 (53,3%). Раннее повторное кровотечение возникло у 20% пациентов (3 из 15), при этом 2 пациентам было повторно выполнена эмболизация целевой артерии; 30-дневная смертность составила 6,7% (1 пациент), а поздняя смертность — 13,3% (2 пациента). Средняя продолжительность госпитализации — 12,8±7 дней, при этом ишемических осложнений, связанных с эмболизацией, не было зарегистрировано. Эти данные подтверждают безопасность и высокую эффективность эндоваскулярной эмболизации, в т.ч. с помощью эндоваскулярных спиралей, как метода первой линии при брыжеечном кровотечении.
Еще одним важным направлением применения эмболизации при кровотечениях является лечение кровотечений, связанных с опухолевыми процессами, как первичными, так и возникающими на фоне противоопухолевой терапии. Около 10% онкологических пациентов сталкиваются с эпизодами кровотечения, степень выраженности которых варьирует от незначительных до катастрофических, угрожающих жизни [41]. Причиной может выступать как сам опухолевый процесс (инвазия сосудов, разрыв атипичных сосудов, травма), так и сопутствующие состояния, включая тромбоцитопению, печёночную недостаточность и антикоагулянтную терапию. Для контроля значимых кровотечений всё более важную роль занимает эндоваскулярная эмболизация, особенно в условиях, когда хирургия или другие методы невозможны, однако данные о её применении при опухолевых кровотечениях ограничены и разрознены. Интересный анализ проведен Minici R, et al. в рамках многоцентрового ретроспективного исследования, включившего 92 пациента с солидными новообразованиями, которым выполнялась эндоваскулярная эмболизация по поводу кровотечения в период с января 2020г по май 2023г [42]. Технический успех достигнут в 89,1% случаев, а клинический — в 84,8%, при этом наиболее частой локализацией кровотечения была печень (21,7%), а основным эмболизирующим агентом выступали частицы поливинилспирта (30,4%). Однако в подгруппе пациентов, которым эмболизация проводилась с использованием эндоваскулярных спиралей, отмечались худшие показатели: технический успех составил всего 55,6% vs 97,3% в контрольной группе (p<0,0001), клинический успех был ниже — 44,4% vs 94,6% (p<0,0001). При этом частота проксимальной эмболизации была значительно выше — 50% vs 13,5% (p=0,0019), а риск повторного кровотечения в течение 30 дней вырос до 55,6% по сравнению с 5,4% в группе без спиралей (p<0,0001). Учитывая разнородный характер данных, необходимы дальнейшие исследования роли эндоваскулярных спиралей у данной категории пациентов с проспективным дизайном и более крупной выборкой.
Заключение
На основании как клинического опыта, так и литературных данных, можно утверждать, что эндоваскулярные спирали являются важным инструментом в арсенале современной интервенционной радиологии. Их универсальность, предсказуемость и эффективность делают их применимыми в самых разных ангиографических сценариях — от экстренных вмешательств до плановых процедур. Современные разработки продолжают расширять возможности этой технологии, повышая точность доставки, управляемость и безопасность. В дальнейшем спирали будут и дальше совершенствоваться, соответствуя растущим требованиям клинической практики и индивидуализации подходов к лечению.
Список литературы
1. Sheth RA, Sabir S, Krishnamurthy S, et al. Endovascular embolization by transcatheter delivery of particles: past, present, and future. J Funct Biomater. 2017;8(2):12. doi:10.3390/jfb8020012.
2. Халтурин И., Сергеев С., Ахметзянов Р. Успешный результат лечения пациента с ложной аневризмой селезеночной артерии, осложненной кровотечением в псевдокисту поджелудочной железы. Патология кровообращения и кардиохирургия. 2017;21(4):92-6. doi:10.21688/1681-3472-2017-4-92-96.
3. Абугов С. А., Чарчян Э. Р., Пурецкий М. В. и др. Эндоваскулярное лечение аневризм висцеральных артерий. Кардиология и сердечно-сосудистая хирургия. 2022;15(1):6-12. doi:10.17116/kardio2022150116.
4. Шарафутдинов Б. М., Рыжкин С. А., Газиев Э. А. и др. Успешный опыт транскатетерной артериальной эмболизации при гонартрозе у пациентов с выраженным болевым синдромом и при неэффективности консервативной терапии. Регионарное кровообращение и микроциркуляция. 2021;20(3):54-60. doi:10.24884/1682-6655-2021-20-3-54-60.
5. Ситкин И. И. Эмболизация маточных артерий — эффективный и безопасный метод лечения миомы матки. Вестник репродуктивного здоровья. 2011;(2):11-7. doi:10.14341/brh2011211-17.
6. Карпов В. К., Капранов С. А., Шапаров Б. А. и др. Суперселективная эмболизация артерий мочевого пузыря в лечении рецидивирующей макрогематурии при опухолях мочевого пузыря. Урология. 2020;(5):133-8. doi:10.18565/urology.2019.3.134-141.
7. Яковлев В. Н., Хайрутдинов Е. Р., Араблинский А. В. и др. Современные возможности эндоваскулярных методов в диагностике и лечении легочных кровотечений. Пульмонология. 2015;25(2):217-23. doi:10.18093/0869-0189-2015-25-2-217-223.
8. Rosch J, Dotter CT, Brown MJ. Selective arterial embolization. A new method for control of acute gastrointestinal bleeding. Radiology. 1972;102:303-6. doi:10.1148/102.2.303.
9. Prasad V, Chan RP, Faughnan ME. Embolotherapy of pulmonary arteriovenous malformations: efficacy of platinum versus stainless steel coils. J Vasc Interv Radiol. 2004;15(2 Pt 1):153-60. doi:10.1097/01.rvi.0000106390.63463.05.
10. Gianturco C, Anderson JH, Wallace S. Mechanical devices for arterial occlusion. Am J Roentgenol Radium Ther Nucl Med. 1975;124(3):428-35. doi:10.2214/ajr.124.3.428.
11. Kobeiter H, Lapeyre M, Becquemin JP, et al. Percutaneous coil embolization of postcatheterization arterial femoral pseudoaneurysms. J Vasc Surg. 2002;36(1):127-31. doi:10.1067/mva.2002.124372.
12. Yoshioka H, Kuroda C, Hori S, et al. Splenic embolization for hypersplenism using steel coils. AJR Am J Roentgenol. 1985;144(6):1269-74. doi:10.2214/ajr.144.6.1269.
13. Cowley A, Woodward B. A healthy future: platinum in medical applications. Platin Met Rev. 2011;55:98-107. doi:10.1595/147106711X566816.
14. Thompson SA. An overview of nickel-titanium alloys used in dentistry. Int Endod J. 2000;33(4):297-310. doi:10.1046/j.1365-2591.2000.00339.x.
15. Kónya A, Maxin M, Wright KC. New embolization coil containing a nitinol wire core: preliminary in vitro and in vivo experiences. J Vasc Interv Radiol. 2001;12(7):869-77. doi:10.1016/s1051-0443(07)61513-9.
16. Trerotola SO, Pressler GA, Premanandan C. Nylon Fibered Versus Non-Fibered Embolization Coils: Comparison in a Swine Model. J Vasc Interv Radiol. 2019;30(6):949-55. doi:10.1016/j.jvir.2018.10.004.
17. Barth KH, Strandberg JD, Kaufman SL, et al. Chronic vascular reactions to steel coil occlusion devices. AJR Am J Roentgenol. 1978;131(3):455-8. doi:10.2214/ajr.131.3.455.
18. Liebig T, Henkes H, Fischer S, et al. Fibered electrolytically detachable platinum coils used for the endovascular treatment of intracranial aneurysms. Interv Neuroradiol. 2004;10(1):5-26. doi:10.1177/159101990401000101.
19. Shimohira M, Kawai T, Hashizume T, et al. Usefulness of hydrogel-coated coils in embolization of pulmonary arteriovenous malformations. Cardiovasc Intervent Radiol. 2018;41(6):848-55. doi:10.1007/s00270-018-1876-5. Erratum in: Cardiovasc Intervent Radiol. 2018;41(7):1140. doi:10.1007/s00270-018-1928-x.
20. Choi E, Kwon TW. Endovascular Treatment versus Open Surgical Repair for Isolated Iliac Artery Aneurysms. Vasc Specialist Int. 2024;40:31. doi:10.5758/vsi.240041.
21. Yang M, Li L, Liu Y, et al. Therapeutic management of isolated internal iliac artery aneurysms. J Vasc Surg. 2020;72(6):1968-75. doi:10.1016/j.jvs.2020.02.038.
22. Bosanquet DC, Wilcox C, Whitehurst L, et al Systematic Review and Meta-analysis of the Effect of Internal Iliac Artery Exclusion for Patients Undergoing EVAR. Eur J Vasc Endovasc Surg. 2017;53(4):534-48. doi:10.1016/j.ejvs.2017.01.009.
23. Kurose S, Matsubara Y, Yoshino S, et al. Influence of Internal Iliac Artery Embolization during Endovascular Aortic Repair Regarding Postoperative Sarcopenia and Midterm Survival. Ann Vasc Surg. 2021;74:148-57. doi:10.1016/j.avsg.2020.10.024.
24. Kim WC, Jeon YS, Hong KC, et al. Internal iliac artery embolization during an endovascu- lar aneurysm repair with detachable interlock Microcoils. Korean J Radiol. 2014;15:613-21.
25. Chun JY, Mailli L, Abbasi MA, et al. Embolization of the internal iliac artery before EVAR: is it effective? Is it safe? Which technique should be used? Cardiovasc Intervent Radiol. 2014;37(2):329-36. doi:10.1007/s00270-013-0659-2.
26. Schoder M, Zaunbauer L, Hölzenbein T, et al. Internal iliac artery embolization before endovascular repair of abdominal aortic aneurysms: frequency, efficacy, and clinical results. AJR Am J Roentgenol. 2001;177(3):599-605. doi:10.2214/ajr.177.3.1770599.
27. Maleux G, Willems E, Vaninbroukx J, et al. Outcome of proximal internal iliac artery coil embolization prior to stent-graft extension in patients previously treated by endovascular aortic repair. J Vasc Interv Radiol. 2010;21(7):990-4. doi:10.1016/j.jvir.2010.02.041.
28. Ameli-Renani S, Morgan RA. Secondary interventions after endovascular aneurysm sac sealing: endoleak embolization and limb-related interventions. Semin Vasc Surg. 2016;29(1-2):61-7. doi:10.1053/j.semvascsurg.2016.07.001.
29. Faries PL, Cadot H, Agarwal G, et al. Management of endoleak after endovascular aneurysm repair: cuffs, coils, and conversion. J Vasc Surg. 2003;37(6):1155-61. doi:10.1016/s0741-5214(03)00084-3.
30. Antoniou GA, Georgiadis GS, Antoniou SA, et al. Late Rupture of Abdominal Aortic Aneurysm After Previous Endovascular Repair: A Systematic Review and Meta-analysis. J Endovasc Ther. 2015;22(5):734-44. doi:10.1177/1526602815601405.
31. Shah AA, Barfield ME, Andersen ND, et al. Results of thoracic endovascular aortic repair 6 years after United States Food and Drug Administration approval. Ann Thorac Surg. 2012;94(5):1394-9. doi:10.1016/j.athoracsur.2012.05.072.
32. Fairman RM, Tuchek JM, Lee WA, et al. Pivotal results for the Medtronic Valiant Thoracic Stent Graft System in the VALOR II trial. J Vasc Surg. 2012;56(5):1222-31.e1. doi:10.1016/j.jvs.2012.04.062.
33. Fabre D, Fadel E, Brenot P, et al. Type II endoleak prevention with coil embolization during endovascular aneurysm repair in high-risk patients. J Vasc Surg. 2015;62(1):1-7. doi:10.1016/j.jvs.2015.02.030.
34. Glorion M, Coscas R, McWilliams RG, et al. A comprehensive review of in situ fenestration of aortic endografts. Semin Vasc Surg. 2016;29(6):787-800. doi:10.1053/j.semvascsurg.2016.10.006.
35. Tariq M, Eudailey KW, Beck AW. Coil embolization for type 1a endoleak after thoracic branched endoprosthesis placement in type B dissection. J Vasc Surg. 2025;81(5):S63-S64. doi:10.1016/j.jvs.2025.01.150.
36. Kauvar DS, Lefering R, Wade CE. Impact of hemorrhage on trauma outcome: an overview of epidemiology, clinical presentations, and therapeutic considerations. Journal of Trauma. 2006;60(6):S3-S11. doi:10.1097/01.ta.0000199961.02677.19.
37. Banovac F, Lin R, Shah D, et al. Angiographic and interventional options in obstetric and gynecologic emergencies. Obstet Gynecol Clin North Am. 2007;34(3):599-616, xiii. doi:10.1016/j.ogc.2007.06.004.
38. Loffroy R, Guiu B. Role of transcatheter arterial embolization for massive bleeding from gastroduodenal ulcers. World J Gastroenterol. 2009;15(47):5889-97. doi:10.3748/wjg.15.5889.
39. Wu W, Peng J, Zhou G, et al. Efficacy of transcatheter arterial embolization in treating nonvariceal gastric remnant bleeding: a retrospective 5-year study. BMC Gastroenterol. 2024;24(1):92. doi:10.1186/s12876-024-03179-x.
40. Extrat C, Grange S, Chevalier C, et al. Safety and efficacy of emergency transarterial embolization for mesenteric bleeding. CVIR Endovasc. 2022;5(1):5. doi:10.1186/s42155-021-00281-z.
41. Johnstone C, Rich SE. Bleeding in cancer patients and its treatment: a review. Ann Palliat Med. 2018;7(2):265-73. doi:10.21037/apm.2017.11.01.
42. Minici R, Guzzardi G, Venturini M, et al. Transcatheter Arterial Embolization (TAE) of Cancer-Related Bleeding. Medicina (Kaunas). 2023;59(7):1323. doi:10.3390/medicina59071323
Об авторах
А. Г. БадоянРоссия
Арам Гозоевич Бадоян — н.с. научно-исследовательского отдела эндоваскулярной хирургии, врач по рентгенэндоваскулярным диагностике и лечению
Новосибирск
А. А. Баранов
Россия
м.н.с. научно-исследовательского отдела эндоваскулярной хирургии, врач по рентгенэндоваскулярным диагностике и лечению
Новосибирск
М. А. Махмудов
Россия
м.н.с. научно-исследовательского отдела эндоваскулярной хирургии, врач по рентгенэндоваскулярным диагностике и лечению
Новосибирск
О. В. Крестьянинов
Россия
д.м.н., зав. научно-исследовательским отделом эндоваскулярной хирургии, врач по рентген-эндоваскулярным диагностике и лечению; профессор кафедры сердечно-сосудистой хирургии (ФПК и ППВ)
Новосибирск
В. П Бородин
инженер лаборатории биопротезирования Института экспериментальной биологии и медицины
Новосибирск
Е. В. Чепелева
Россия
к.б.н., с.н.с. лаборатории экспериментальной хирургии и морфологии Института экспериментальной биологии и медицины
Новосибирск
К. В. Козырь
Россия
м.н.с. лаборатории экспериментальной хирургии и морфологии Института экспериментальной биологии и медицины
Новосибирск
В. В. Хахалкин
Россия
к.т.н., зав. лаборатории биопротезирования Института экспериментальной биологии и медицины
Новосибирск
А. Б. Мочалова
Россия
м.н.с. лаборатории биопротезирования Института экспериментальной биологии и медицины
Новосибирск
С. В. Владимиров
Россия
м.н.с. лаборатории биопротезирования Института экспериментальной биологии и медицины
Новосибирск
А. А. Докучаева
Россия
м.н.с. лаборатории экспериментальной хирургии и морфологии Института экспериментальной биологии и медицины
Новосибирск
Дополнительные файлы
- Диагностика "диссинхронической" кардиомиопатии у пациентов с феноменом Вольфа-Паркинсона-Уайта (ВПУ) традиционно основана на данных стандартного протокола трансторакальной эхокардиографии с определением объемов и размеров камер сердца и фракции выброса левого желудочка.
- Появление результатов новых исследований показало роль глобальной продольной деформации по данным Speckle tracking в диагностике диссинхронии и "субклинических" нарушений контрактильности миокарда.
- Обобщение опыта в этой области будет способствовать определению предикторов формирования нарушения систолической функции левого желудочка у пациентов с феноменом ВПУ и разработке оптимальных показаний для проведения радиочастотной аблации дополнительного предсердно-желудочкового соединения у детей.
Рецензия
Для цитирования:
Бадоян А.Г., Баранов А.А., Махмудов М.А., Крестьянинов О.В., Бородин В.П., Чепелева Е.В., Козырь К.В., Хахалкин В.В., Мочалова А.Б., Владимиров С.В., Докучаева А.А. Эмболизирующие спирали: от истории к современной клинической практике. Российский кардиологический журнал. 2025;30(9S):6502. https://doi.org/10.15829/1560-4071-2025-6502. EDN: BKFLLO
For citation:
Badoyan A.G., Baranov A.A., Makhmudov M.A., Krestyaninov O.V., Borodin V.P., Chepeleva E.V., Kozyr K.V., Khakhalkin V.V., Mochalova A.B., Vladimirov S.V., Dokuchaeva A.A. Embolization coils: from history to modern clinical practice. Russian Journal of Cardiology. 2025;30(9S):6502. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6502. EDN: BKFLLO
JATS XML

















































