Перейти к:
Миокардиты. Клинические рекомендации 2025
https://doi.org/10.15829/1560-4071-2025-6458
EDN: YDUWYZ
Аннотация
Российское кардиологическое общество
При участии: Евразийского общества терапевтов, Общества специалистов по сердечной недостаточности, Российского научного медицинского общества терапевтов (РНМОТ), Российского общества патологоанатомов, Российского Общества Рентгенологов и Радиологов (РОРР), Национальной ассоциации экспертов по санаторно-курортному лечению.
Одобрено Научно-практическим Советом Минздрава Российской Федерации.
Для цитирования:
Арутюнов Г.П., Драгунов Д.О., Жиров И.B., Моисеева О.М., Палеев Ф.Н., Соколова А.В., Апханова Т.В., Арутюнов А.Г., Благова О.В., Габрусенко С.А., Гарганеева А.А., Гендлин Г.Е., Гиляревский С.Р., Дупляков Д.В., Зайратьянц О.В., Каратеев Д.Е., Козиолова Н.А., Космачева Е.Д., Кочетов А.Г., Лопатин Ю.М., Мелехов А.В., Митрофанова Л.Б., Нарусов О.Ю., Насонова С.Н., Недоступ А.В., Никулина С.Ю., Орлова Я.А., Потешкина Н.Г., Привалова Е.В., Ребров А.П., Саидова М.А., Седов В.П., Синицын В.Е., Ситникова М.Ю., Скворцов А.А., Скибицкий В.В., Стукалова О.В., Тарловская Е.И., Терещенко С.Н., Усов В.Ю., Фомин И.В., Чесникова А.И., Шапошник И.И., Шостак Н.А., Шляхто Е.В. Миокардиты. Клинические рекомендации 2025. Российский кардиологический журнал. 2025;30(8):6458. https://doi.org/10.15829/1560-4071-2025-6458. EDN: YDUWYZ
For citation:
Arutyunov G.P., Dragunov D.O., Zhirov I.V., Moiseeva O.M., Paleev F.N., Sokolova A.V., Apkhanova T.V., Arutyunov A.G., Blagova O.V., Gabrusenko S.A., Garganeeva A.A., Gendlin G.E., Gilyarevsky S.R., Duplyakov D.V., Zairatyants O.V., Karateev D.E., Koziolova N.A., Kosmacheva E.D., Kochetov A.G., Lopatin Yu.M., Melekhov A.V., Mitrofanova L.B., Narusov O.Yu., Nasonova S.N., Nedostup A.V., Nikulina S.Yu., Orlova Ya.A., Poteshkina N.G., Privalova E.V., Rebrov A.P., Saidova M.A., Sedov V.P., Sinitsyn V.E., Sitnikova M.Yu., Skvortsov A.A., Skibitsky V.V., Stukalova O.V., Tarlovskaya E.I., Tereshchenko S.N., Usov V.Yu., Fomin I.V., Chesnikova A.I., Shaposhnik I.I., Shostak N.A., Shlyakhto E.V. 2025 Clinical practice guidelines for Myocarditises. Russian Journal of Cardiology. 2025;30(8):6458. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6458. EDN: YDUWYZ
asd
-
Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
1.1. Определение заболевания или состояния (группы заболеваний, состояний)
Миокардит — это групповое понятие (группа самостоятельных нозологических единиц или проявление других заболеваний), поражение миокарда воспалительной природы, инфекционной, токсической (в т.ч. лекарственной), аллергической, аутоиммунной или неясной этиологии, с широким спектром клинических симптомов: от бессимптомного течения, легкой одышки и невыраженных болей в грудной клетке, проходящих самостоятельно, до СН, кардиогенного шока, жизнеугрожающих нарушений ритма и внезапной сердечной смерти.
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний, состояний)
В реальной практике этиологическая причина развития миокардита в абсолютном большинстве случаев остается на уровне наиболее вероятного врачебного предположения (табл. 1).
Таблица 1
Основные этиологические факторы развития миокардитов/воспалительных кардиомиопатий
|
Этиология миокардита |
Возбудитель |
|
Бактериальные |
Staphylococcus, Streptococcus, Pneumococcus, Meningococcus, Gonococcus, Salmonella, Corynebacterium diphtheriae, Haemophilus influenzae, Mycobacterium (tuberculosis), Mycoplasma pneumoniae, Brucella |
|
Спирохетозные |
Borrelia (Lyme disease), Leptospira (Weil disease) |
|
Грибковые |
Aspergillus, Actinomyces, Blastomyces, Candida, Coccidioides, Cryptococcus, Histoplasma, Mucormycoses, Nocardia, Sporothrix |
|
Протозойные |
Trypanosoma cruzi, Toxoplasma gondii, Entamoeba, Leishmania |
|
Паразитарные |
Trichinella spiralis, Echinococcus granulosus, Taenia solium |
|
Риккетсиозные |
Сoxiella burnetii (Q fever), R. rickettsii (Rocky Mountain spotted fever), R. tsutsugamuschi |
|
Вирусные |
РНК (рибонуклеиновая кислота)-вирусы: Coxsackie viruses A and B, echoviruses, polioviruses, influenza A and B viruses, respiratory syncytial virus, mumps virus, measles virus, rubella virus, hepatitis C virus, dengue virus, yellow fever virus, Chikungunya virus, Junin virus, Lassa fever virus, rabies virus, human immunodeficiency virus-1 ДНК-вирусы: adenoviruses, parvovirus B19, cytomegalovirus, human herpes virus-6, Epstein-Barr virus, varicella-zoster virus, herpes simplex virus, variola virus, vaccinia virus SARS-Cov-2 |
|
Аллергические |
Вакцины АДС** (анатоксин дифтерийно-столбнячный**), иммунные сыворотки Лекарственные средства: пенициллины широкого спектра действия (J01CA), безвременника осеннего семян экстракт*, фуросемид**, изониазид**, лидокаин**, тетрациклин, сульфаниламиды, фенитоин**, фенилбутазон, метилдопа**, тиазидные диуретики, амитриптилин** |
|
Аллоантигенные |
Реакция отторжения трансплантата после трансплантации сердца |
|
Аутоантигенные |
Гигантоклеточный миокардит Синдром Чарга-Стросса Неспецифический язвенный колит Гигантоклеточный миокардит Сахарный диабет 1 типа Болезнь Кавасаки Рассеянный склероз Системная склеродермия Системная красная волчанка Болезнь Грейвса Гранулематоз Вегенера Болезнь Такаясу Дерматополимиозит Ревматоидный артрит |
|
Лекарственные препараты |
Амфетамин и его производные (Симпатомиметики центрального действия N06BA), антрациклины и родственные соединения, кокаин, циклофосфамид**, этанол**, фторурацил**, лития карбонат (N05AN препараты лития), катехоламины (Адренергические и дофаминергические средства C01CA), интерлейкин-2, трастузумаб**, клозапин |
|
Тяжелые металлы |
Медь, железо, свинец (редко) |
|
Яды |
Укусы скорпиона, змеи, паука, пчел Воздействие окиси углерода, фосфора, мышьяка, азида натрия |
|
Гормоны |
Феохромоцитома |
|
Витамины |
Болезнь бери-бери |
|
Физические агенты |
Радиация, поражение электрическим током |
Примечание: — Безвременника осеннего семян экстракт — источник алкалоида колхицина.
Вирусная причина
Внедрение молекулярных технологий в клиническую практику — метода полимеразной цепной реакции (ПЦР) с обратной транскрипцией — позволяет не только выявить присутствие вирусного генома, но и определить клинический порог, позволяющий дифференцировать активную вирусную инфекцию от латентной. Частота выявления геномов различных вирусов разнится в географических регионах мира. В Marburg Registry [1], крупнейшем анализе биопсийного материала за последнее десятилетие, наиболее частой причиной развития миокардита в Европе и Северной Америке является вирусная инфекция. В ЭМБ идентифицировался геном энтеровирусов, аденовирусов, вирусов гриппа, вируса герпеса человека 6 типа (HHV-6), вируса Эпштейна-Барр, цитомегаловируса, вируса гепатита С, парвовируса. Частота выявления геномов различных вирусов разнится в географических регионах мира. В европейской популяции самым частым вирусным геномом был парвовирус B19 и вирус герпеса человека 6 типа, а частота встречаемости цитомегаловируса, вируса простого герпеса и вируса Эпштейна-Барр как причины развития миокардита снизилась. Важно, что на этом фоне возросла частота выявления геномов двух и более вирусов. Ассоциация вирусов встречалась в 25% случаев [2-9].
Возможность развития миокардита в острый период новой коронавирусной инфекции (COVID-19) доказана как аутопсийными исследованиями [1-3], так и с помощью прижизненной ЭМБ [4, 5]. В большинстве случаев острый коронавирусный миокардит поставлен без морфологической верификации диагноза, а нередко и без данных магнитно-резонансной томографии (МРТ) сердца, только на основании клинической картины, данных электрокардиографии (ЭКГ) и ЭхоКГ.
Бактериальная причина
Бактериальная причина развития миокардита в современном мире встречается намного реже, чем в первой половине XXв. Однако и сегодня любой бактериальный агент может вызвать развитие миокардита. Чаще всего выявляются различные виды Chlamydia, Corynebacterium diphtheria, Haemophilus influenzae, Legionella pneumophila, Mycobacterium tuberculosis, Streptococcus A. Особенностью бактериального миокардита является то, что он является только одним из проявлений заболевания, т.е. его "вторичность", развитие специфической для миокардита клиники на фоне основного заболевания [10].
Прямое токсическое действие на миокард лекарственными препаратами
Реакция гиперчувствительности к некоторым препаратам (гидрохлоротиазид** (C03AA03), фуросемид**, пенициллинам широкого спектра действия (J01CA), ампициллин**, азитромицин**, сульфаниламиды, тетрациклин, метилдопа**, аминофиллин**, фенитоин**, производные бензодиазепина (анксиолитики N05B)) реализуется в эозинофильный миокардит. Частота таких миокардитов невысокая. Дебют болезни начинается в первые часы/дни после начала терапии, но может быть и отсроченным (описано для препарата Клозапин). Вакцинации против столбняка и оспы приводят к развитию миокардита в 6 случаях на 104 вакцинаций. Для лекарственных миокардитов характерен быстрый рост уровня эозинофилов, сочетающийся с картиной поражения миокарда.
В современной клинике внутренних болезней описано большое количество случаев кардиологических осложнений (с токсическим повреждением миокарда или развитием миокардита), развивающихся на фоне введения антрациклиновых антибиотиков (Противоопухолевые антибиотики и родственные соединения L01D) доксорубицина** (в т.ч. с активным веществом доксорубицина гидрохлорид пегилированного липосомального), даунорубицина** и идарубицина** (дозозависимое побочное действие противоопухолевых препаратов из группы антрациклины и родственные соединения), что связано с их широким применением в различных схемах химиотерапевтического лечения, учитывая высокую противоопухолевую активность [11]. Считается, что причиной поражения миокарда является связывание препарата с кардиолипином и другими мембранными молекулами, в результате которого повреждается клеточная мембрана кардиомиоцитов. Ключевым медиатором индуцированной антрациклинами (L01D Противоопухолевые антибиотики и родственные соединения) кардиотоксичности является топоизомераза 2b.
Топоизомераза второго типа осуществляет раскручивание цепочек ДНК в период ее репликации, транскрипции или рекомбинации. У человека имеется 2 вида изомеразы 2 типа: топоизомераза 2а (Top2a) и топоизомераза 2b (Тор2b). Считается, что Top2a находится преимущественно в пролиферирующих клетках, участвует в репликации ДНК и является основной молекулярной целью противоопухолевой активности антрациклина (L01D Противоопухолевые антибиотики и родственные соединения). Top2b находится в покоящихся клетках, в т.ч. в кардиомиоцитах. Ингибиция топоизомеразы 2 антрациклинами приводит к разрывам в обеих цепочках ДНК, что и приводит к гибели клеток миокарда и, нередко, развитию воспаления. Воздействие антрациклина (L01D Противоопухолевые антибиотики и родственные соединения) на Top2b является ключевым фактором развития кардиотоксичности.
Для антрациклиновой кардиотоксичности принято разделение по срокам ее возникновения на острую, подострую, хроническую и позднюю хроническую. В рекомендациях ESMO 2012г (Европейское общество медицинской онкологии (European Society for Medical Oncology)) представлена следующая классификация кардиотоксичности, возникающей при лечении антрациклиновыми антибиотиками (L01D Противоопухолевые антибиотики и родственные соединения):
- острая — возникает менее чем у 1% пациентов сразу после введения препарата, обратима;
- остро начавшаяся хроническая прогрессирующая — возникает в 1,6-2,1% случаев во время химиотерапии или в первый год после нее;
- поздно начавшаяся хроническая прогрессирующая — возникает в 1,6-5,0% случаев через 1 год после окончания химиотерапии;
- отдаленная (поздно возникающая) — возникает через 20-30 лет после окончания химиотерапии [12].
Кардиотоксичность, связанная с применением доксорубицина** и других препаратов из группы антрациклины и родственные соединения, дозозависима: при применении суммарной дозы доксорубицина**, равной 300 мг/м2, вероятность развития ХСН — 1,7%, при дозе до 400 мг/м2 — 4,7%, при дозе 500 мг/м2 — 15,7%, при дозе 650 мг/м2 — 48% [13].
К числу неинфекционных причин развития миокардита относятся:
- миокардиты при системных заболеваниях соединительной ткани с иммунными нарушениями и системных васкулитах (системная красная волчанка, дерматомиозит, полимиозит, системный склероз (системная склеродермия), ревматоидный артрит, гранулематоз с полиангиитом (гранулематоз Вегенера) и др.) [14];
- гиперэозинофильный синдром, глистная инвазия, паразитарные инфекции, приводящие к развитию эозинофильного миокардита.
К числу редких аутоиммунных и идиопатических миокардитов относятся:
- некротизирующий эозинофильный миокардит, причиной развития которого может быть синдром гиперчувствительности и системный васкулит Чарга-Стросса. Нельзя исключить роль вирусной инфекции, вызванной герпесвирусом 6 типа, как причины фульминантного течения заболевания с быстрым нарастанием симптомов СН и высокой ранней смертностью;
- идиопатический гигантоклеточный миокардит, характеризующийся крайне тяжелым прогнозом. Чаще всего заболевают подростки. 20% пациентов с верифицированным гигантоклеточным миокардитом имеют еще какое-либо аутоиммунное заболевание и аллергические реакции, в т.ч. на лекарственные препараты;
- саркоидоз сердца (один из видов гранулематозного миокардита) может развиваться в рамках идиопатического системного заболевания, а может носить изолированный характер. В качестве изолированного варианта в реальной практике встречается крайне редко. Однако ремоделирование миокарда с развитием клиники СН — вторая по значимости причина смерти при системном саркоидозе (25%). Редкие случаи изолированного саркоидоза сердца требуют проведения дифференциального диагноза с аритмогенной кардиомиопатией или первичными кардиомиопатиями, протекающими с дилатационным или гипертрофическим фенотипами. Встречается также инфарктоподобное течение саркоидоза сердца, а также вовлечение в процесс перикарда.
Патогенез миокардитов
Современные представления о патогенезе развития миокардита схематически можно представить в виде трехфазной модели [15], сформированной в ходе экспериментальных работ, выполненных на лабораторных мышах, зараженных вирусом Коксаки В [16]. В организм человека вирус Коксаки В проникает через желудочно-кишечный тракт или дыхательную систему. Пусковым механизмом развития воспалительного процесса является прикрепление вируса к эндотелиальному рецептору (CAR-рецептор — химерный антигенный рецептор) [17]. Для проникновения в клетку вирусы используют различные биологические факторы, в т.ч. и молекулы адгезии вирусного агента к клеточной мембране кардиомиоцита, ускоряющие повреждение клеточных мембран и способствующие проникновению вирусов в клетку. Проникнув в кардиомиоциты, вирусы реплицируются и вызывают миоцитолиз и активизацию синтеза микро-РНК, что в свою очередь приводит к апоптозу и некрозу. Эти процессы в миокарде принято описывать как первую фазу развития миокардита [15]. Измененные кардиомиоциты запускают иммунные реакции, приводящие к развитию воспаления в миокарде и формированию воспалительной клеточной инфильтрации. Анализ воспалительного инфильтрата показал, что он состоит на 70% из мононуклеаров: моноцитов, макрофагов и Т-лимфоцитов. Первая фаза заболевания может завершиться либо элиминацией вирусов при адекватном иммунном ответе, либо переходом во вторую фазу — вторичное аутоиммунное повреждение кардиомиоцитов [15]. Аутоиммунный процесс, характеризующийся выработкой антител к мембранам кардиомиоцитов, приобретает ведущую роль на втором этапе болезни [15].
Таким образом, роль вируса, внедрившегося в клетку, очевидна: репликация — повреждение кардиомиоцита, его гибель и запуск аутоиммунной реакции.
Вторая фаза аутоиммунного миокардиального повреждения сопровождается развитием аутоиммунных реакций. Этот процесс реализуется через ряд механизмов: 1) выделение аутоантигенных белков вследствие некроза клеток; 2) поликлональную активацию лимфоцитов; 3) активацию Т-лимфоцитов вследствие действия ряда факторов, в т.ч. цитокинов; 4) феномен молекулярной мимикрии [18, 19]. Реализация аутоиммунного процесса происходит также при участии ряда гуморальных факторов, а именно иммуноглобулинов, компонентов комплемента и аутореактивных антител [20].
Для третьей фазы характерно развитие ремоделирования миокарда. Такое деление условно, четко разделить процесс на 3 фазы не представляется возможным, т.к. описанные процессы могут проходить синхронно.
1.3. Эпидемиология заболевания или состояния (группы заболеваний, состояний)
Современные представления об эпидемиологии миокардита носят разрозненный характер и не позволяют сформировать целостную картину. Вариабельность клинических проявлений в дебюте болезни, множество стертых форм, остающихся не замеченными врачом и пациентом [2], большая частота спонтанного выздоровления (в среднем составляет 57%) [21] делают учет этого заболевания в реальной клинической практике трудновыполнимой задачей [22-24]. Крайне редкое применение на практике "золотого стандарта диагностики" [22] — ЭМБ — также затрудняет верификацию диагноза.
Известно, что в ходе анализа патолого-анатомического исследования биопсионного материалов пациентов, исходно наблюдавшихся по поводу ДКМП, только в 9-16% случаев у взрослых пациентов и в 46% случаев у детей не были выявлены морфологические признаки миокардита [24-26].
Несмотря на разрозненность анализируемых групп, главным явлением современного этапа изучения проблемы стал бесспорный рост числа новых случаев заболевания. Частота миокардитов составляет от 20 до 30% всех некоронарогенных заболеваний сердца [27].
В крупном популяционном исследовании, выполненном в период с 1990г по 2013гг в 188 странах, анализ 301 нозологической единицы позволил определить, что встречаемость миокардита составляет примерно 22 случая на 100 тыс. населения в год [28]. Что позволяет предположить, что в мире в год диагностируется примерно 1,5×106 случаев острого миокардита.
В популяции спортсменов-профессионалов внезапная сердечная смерть регистрируется с частотой примерно 1 случай на 80-200 тыс. спортсменов, при этом миокардит встречается в каждом третьем случае [29].
20-летнее наблюдение за призывниками в армию, в котором суммарно проанализировано >670 тыс. мужчин, имевших признаки возможного миокардита, позволило выявить 98 случаев острого миокардита, 1 случай внезапной сердечной смерти и 9 случаев дебюта ДКМП [30].
По данным Павловского регистра [31], миокардит как причина декомпенсации кровообращения, потребовавшая госпитализации, отмечен в 3 случаях из 1001 госпитализации/год.
В таком же по продолжительности исследовании аутопсийного материала в Японии определено, что миокардит встречается с частотой 0,11% от всех вскрытий вне зависимости от основного заболевания — первоначальной причины смерти [32].
По данным патологоанатомических вскрытий в Европе воспалительное поражение миокарда определяется в 3-5% случаев [22], причем у лиц, умерших в возрасте до 35 лет внезапной сердечной смертью, миокардит при вскрытии выявляют примерно в 42% случаев.
Анализ результатов посмертных исследований позволил выявить значимую клиническую проблему — прижизненную гиподиагностику миокардитов. Из 17162 вскрытий в 91 случае выявлен не диагностированный при жизни миокардит, причем чаще всего в возрастной группе от 20 до 39 лет [33]. Гиподиагностика миокардитов во многом объясняется многогранностью клинического дебюта и последующих проявлений миокардитов. Анализ клинической картины у 3055 пациентов с подозрением на миокардит, включенных в исследование European Study of Epidemiology and Treatment of Inflammatory Heart Disease, показал, что в 72% случаев доминирующей жалобой была одышка, в 32% случаев — разлитая загрудинная боль, в 18% случаев — перебои в работе сердца. Такой манифест болезни в реальной клинической практике существенно затруднял диагностику миокардитов [34], поскольку врачом, в абсолютном большинстве случаев, клиническая картина объяснялась проявлением ИБС. Таким образом, распространенность миокардита серьезно недооценивается из-за неспецифических симптомов его дебюта и часто бессимптомного течения заболевания.
Распространенность миокардита среди мужчин и женщин изучалась среди госпитализированных пациентов в стационар по поводу верифицированного миокардита. Из 3274 госпитализированных пациентов миокардит достоверно чаще встречался у мужчин, а более тяжелое течение болезни было характерно для женщин [36, 37].
Мужчины молодого возраста заболевают миокардитом чаще, чем женщины, что объясняется влиянием половых гормонов на выраженность иммунного ответа у женщин [9, 38].
У детей, в т.ч. и новорожденных, чаще встречается молниеносная форма миокардита вирусного генеза [37]. Анализ патолого-анатомического исследования биопсионного материала показал, что в европейской популяции чаще всего обнаруживается парвовирус В19 [38], в США — аденовирус 9 [19], в Японии — вирус гепатита С [20]. Такая динамика для европейской популяции стойко прослеживается в последние 20 лет. О достоверно большей частоте, достигающей 60-80%, идентификации парвовирус В19 в биоптатах миокарда больных миокардитом сообщается в работах [38-42].
С другой стороны, исходя из того, что парвовирус В19 довольно часто обнаруживается в биоптатах миокарда пациентов с неизмененной ФВ ЛЖ, диагностическое значение этого факта стало предметом дискуссии [43]. Нельзя не согласиться с тем, что кроме факта присутствия вируса в ткани миокарда имеет значение вирусная нагрузка, выраженность процесса репликации, исходный статус пациента [44], а эпидемиологические данные, ориентированные только на частоту нахождения вирусов в миокарде, не позволяют сформировать истинные эпидемиологические представления. Однако анализ данных Марбургского регистра [45] (12500 пациентов) показал, что PV B19 в 2 раза чаще обнаруживается в ткани миокарда у пациентов с признаками воспаления миокарда и сниженной ФВ ЛЖ, нежели у пациентов без признаков воспаления миокарда и сниженной ФВ ЛЖ (33,3% по сравнению с 17,6%, соответственно) [1].
В связи со сложностями верификации диагноза истинная частота острого коронавирусного миокардита не известна и по данным разных авторов варьирует от 0,011 до 0,2% случаев от всех ПЦР позитивных пациентов [46], а по данным аутопсии до 14% [6]. На основании анализа данных почти 57 тыс. госпитализированных с COVID-19 пациентов миокардит диагностирован (по данным биопсии у 17 больных, у остальных — на основании данных МРТ и повышения уровня тропонина) у 112 больных, что составило <1%, летальность среди пациентов с миокардитом на протяжении 120 дней достигла 6,6%, [47].
Таким образом, анализ эпидемиологических исследований позволяет предполагать, что количество острых миокардитов в реальной клинической практике гораздо больше, чем уровень диагностируемых случаев.
1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
В международной классификации болезней 10 пересмотра (МКБ-10) (в русскоязычных версиях как 1996, так и 2019гг) миокардитам соответствуют рубрики I40, I41* и I51.4.
I40 Острый миокардит.
I40.0 Инфекционный миокардит.
Включено: септический миокардит. При необходимости идентифицировать инфекционный агент используют дополнительные коды B95-B98 (примечание: в Российской Федерации (РФ) при летальных исходах, оформлении диагноза и медицинского свидетельства о смерти, такие вторые дополнительные коды не используются).
I40.1 Изолированный миокардит.
I40.8 Другие виды острого миокардита.
I40.9 Острый миокардит неуточненный.
I41* Миокардит при болезнях, классифицированных в других рубриках
(примечание: МКБ-10 для специальных разработок, но не оформления диагноза и медицинского свидетельства о смерти, допускает двойное кодирование некоторых состояний, в частности с использованием знаков крестик (†) и звездочка (*). В РФ в диагнозах и медицинских свидетельствах о смерти использование подрубрик [кодов] со звездочкой (*) как самостоятельных категорически запрещается).
I41.0* Миокардит при бактериальных болезнях, классифицированных в других рубриках.
Миокардит:
- дифтерийный (A36.8†)
- гонококковый (A54.8†)
- менингококковый (A39.5†)
- сифилитический (A52.0†)
- туберкулезный (A18.8†)
I41.1* Миокардит при вирусных болезнях, классифицированных в других рубриках.
Гриппозный миокардит (острый):
- сезонный вирус идентифицирован (J10.8†)
- вирус не идентифицирован (J11.8†)
- зоонозный или пандемический вирус идентифицирован (J09†)
- паротитный миокардит (B26.8†)
I41.2* Миокардит при других инфекционных и паразитарных болезнях, классифицированных в других рубриках.
Миокардит при:
- болезни Шагаса хронической (B57.2†)
- болезни Шагаса острой (B57.0†)
- токсоплазмозе (B58.8†)
I41.8* Миокардит при других болезнях, классифицированных в других рубриках.
- ревматоидный миокардит (M05.3†)
- саркоидный миокардит (D86.8†)
I51.4 Миокардит неуточненный.
Включено: фиброз миокарда, миокардит (без дополнительных указаний) хронический (интерстициальный).
В этой связи возможно применение любой доступной для лечебного учреждения классификации параллельно с МКБ-10. Однако при оформлении диагноза или медицинского свидетельства о смерти и кодировании миокардита требуется применять термины и коды МКБ-10 (в диагнозе — с последующей расшифровкой, согласно применяемой классификации).
Для удобства формулирования диагноза в условиях терапевтического, кардиологического и иного неспециализированного стационара следует отдать предпочтение классификации Mayo clinic.
1.5. Классификация заболевания или состояния (группы заболеваний, состояний)
В клинико-морфологической классификации E. B. Lieberman (1991г), наряду с Далласскими морфологическими критериями, учитываются особенности течения воспалительных заболеваний миокарда. В авторском варианте классификации выделены следующие клинические варианты миокардитов: фульминантный (молниеносный), подострый, хронический активный и хронический персистирующий миокардит (табл. ПА3-1, Приложение А3).
В последующие варианты этой классификации, дополненные другими экспертами, были внесены 2 дополнительных клинических варианта: гигантоклеточный и эозинофильный миокардиты. В современной клинической практике эта классификация используется чаще, чем другие.
Молниеносный (фульминантный) миокардит — тяжелая форма воспалительного поражения миокарда, развивающаяся стремительно в виде острой СН, кардиогенного шока или жизнеугрожающих нарушений ритма сердца. Дебют болезни всегда внезапный. Характерно быстрое развитие симптомов недостаточности кровообращения, лихорадка с температурой тела >38 C. При расспросе пациента удается установить четкую временную связь с перенесенным простудным заболеванием/острой вирусной инфекцией, имевшей место примерно за 2 нед. до манифеста миокардита. При ЭхоКГ определяется выраженное снижение сократительной способности, отсутствие выраженной дилатации камер сердца, отек миокарда. Анализ патолого-анатомического исследование биопсийного (операционного) материала тканей миокарда позволяет выявить множественные очаги воспалительной инфильтрации, возможно наличие очагов некроза. В течение 2 нед. эта форма миокардита может завершиться либо полным выздоровлением и восстановлением функции ЛЖ, либо (значительно реже) быстрым прогрессированием СН, стойкой гипотонией и летальным исходом. При таком варианте течения заболевания требуется максимально раннее применение вспомогательного кровообращения в условиях реанимационных отделений.
Подострый миокардит — дебют болезни, как правило, стерт. Пациент затрудняется с хронологией начала заболевания и связью с предшествующим острым инфекционным (респираторным или кишечным) заболеванием, но всегда четко сообщает о манифесте болезни с проявлений СН или болевого синдрома ("маска" ОКС). Анализ патолого-анатомического исследования биопсийного (операционного) материала тканей миокарда позволяет выявить умеренно выраженные воспалительные инфильтраты. При ЭхоКГ определяется выраженное расширение полостей сердца и снижение сократительной способности миокарда. Переход в ДКМП характерен для подострой формы миокардита.
Хронический активный миокардит — дебют болезни остается не замеченным пациентом, даже тщательный расспрос пациента не позволяет определиться с продолжительностью заболевания. Доминируют жалобы, типичные для ХСН. Анализ гистологической картины ЭМБ сердца позволяет выявить сочетание воспалительных инфильтратов различной степени выраженности с полями выраженного фиброза. При ЭхоКГ определяется умеренное снижение сократительной способности миокарда. В клинической картине доминирует ХСН II-III ФК. Часто происходит переход в ДКМП. Для типичной клинической картины характерны рецидивы миокардита.
Хронический персистирующий миокардит — дебют болезни остается не замеченным пациентом, о продолжительности заболевания высказаться трудно. В клинической картине доминирует длительный болевой синдром или клинические проявления ремоделирования миокарда с дилатационным или рестриктивным фенотипом. Анализ патолого-анатомического исследование биопсийного (операционного) материала тканей миокарда позволяет выявить сочетание воспалительных инфильтратов различной степени выраженности с некротическими изменениями и полями фиброза. Типично длительное сосуществование таких изменений. При ЭхоКГ определяется умеренное снижение сократительной способности миокарда. Значимой дилатации полостей сердца, снижения ФВ ЛЖ не отмечается. Исход заболевания благоприятный.
Гигантоклеточный миокардит — дебют болезни острый. Типично быстрое развитие выраженной недостаточности кровообращения с доминированием в последующем прогрессирующей рефрактерной СН. Вторая особенность клинической картины — устойчивые желудочковые нарушения ритма и нарушения проводимости сердца. При сборе анамнеза необходимо обратить особое внимание на выявление аутоиммунных заболеваний. Прогноз заболевания крайне тяжелый. Наиболее эффективный метод лечения — трансплантация сердца. Анализ патолого-анатомического исследования биопсийного (операционного) материала тканей миокарда позволяет выявить в воспалительном инфильтрате гигантские многоядерные клетки — результат трансформации макрофагов, содержащие фагоцитированные фрагменты разрушенных кардиомиоцитов. Определяются зоны воспалительных инфильтратов с признаками активного воспаления и очаги некроза кардиомиоцитов. Характерно обнаружение рубцовой ткани. При ЭхоКГ определяется выраженное снижение сократительной способности миокарда.
Эозинофильный миокардит — дебют болезни острый. Доминируют проявления недостаточности кровообращения. При сборе анамнеза необходимо уделить особое внимание анализу аллергоанамнеза, лекарственной терапии, указаниям на вакцинацию, глистную инвазию, в ряде ситуаций удается предположить связь с приемом нового препарата или продукта питания. Чаще всего острые эозинофильные аллергические миокардиты развиваются на фоне приема сульфаниламидных препаратов (Сульфаниламиды и триметоприм), антиконвульсантов (противоэпилептические препараты) и психотропных препаратов (Психолептики) [48].
При ЭхоКГ выявляются незначительное снижение сократительной способности сердца и пристеночные тромбы в полостях сердца. Таким образом, для эозинофильного миокардита характерно образование тромбов, приводящих к тромбоэмболическим осложнениям. Анализ патолого-анатомического исследования биопсийного (операционного) материала тканей миокарда позволяет выявить наряду с очагами некроза эозинофильное доминирование в воспалительном инфильтрате и вовлечение в патологический процесс эндокарда, что приводит к формированию пристеночных тромбов. В общем (клиническом) анализе крови может быть выявлена эозинофилия. В редких случаях финалом болезни может быть формирование эндомиокардиального фиброза, приводящего к тяжелой, рефрактерной ХСН.
Основной критерий клинико-морфологической классификации Lieberman — это гистологическая картина биоптата миокарда. Важно помнить, что класс доказанности I для проведения биопсии миокарда (рекомендации АСС/АНА и ЕSHF) имеют только пациенты, имеющие следующие клинические фенотипы.
Во всех остальных ситуациях ЭМБ может только обсуждаться, в т.ч. и при дифференциальном диагнозе причин СН, развившейся >3 мес. назад при обоснованном подозрении на гранулематозный процесс (табл. 2).
Таблица 2
Абсолютные показания для проведения ЭМБ [49]
|
Клинический фенотип |
|
Гемодинамически нестабильные пациенты с клиникой сердечной недостаточности <2 нед. с нормальным или дилатированным ЛЖ |
|
Пациенты с клиникой впервые возникшей сердечной недостаточности продолжительностью от 2 нед. до 3 мес. с дилатированным ЛЖ, рецидивирующими желудочковыми аритмиями, AV-блокадами (атриовентрикулярная блокада) II, III степени или отсутствием ответа на проводимую рекомендованную терапию в течение 1-2 нед. |
Сокращения: ЛЖ — левый желудочек, AV — атриовентрикулярный.
Попытки применения на практике клинико-морфологических классификаций упираются в необходимость иметь в наличии инструментарий, высококвалифицированных специалистов для проведения ЭМБ, квалифицированных врачей-патологоанатомов для оценки гистологического материала, а также проведения и оценки результатов иммуногистохимического исследования (Патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов), молекулярно-биологическую лабораторию для выявления вирусного генома, что делает маловероятным применение этих классификаций на практике (в случае невозможности выполнения ЭМБ в конкретном стационаре пациент должен направляться в стационар более высокого уровня). Неясным остается во- прос применения ЭМБ у пациентов с субклиническим течением заболевания, когда риск развития ДКМП очень высок, а сам переход в эту клиническую форму остается незамеченным.
Поэтому, в интересах реальной клинической практики, наравне с морфологической и клинико-морфологической классификациями продолжают разрабатываться клинические классификации, основанные на этиопатогенетическом принципе.
В 2016г была предложена простая и удобная классификация миокардитов, основанная на оценке исходного состояния пациентов, — классификация клиники Мэйо (Mayo clinic classification) [39], позволяющая определиться с прогнозом и выбором тактики лечения. На основе трех ведущих симптомов: боли в грудной клетке, аритмии, проявления СН различают пациентов высокого риска, умеренного риска и низкого риска (табл. ПА3-2, Приложение А3).
- Пациенты низкого риска: прогноз у таких пациентов благоприятный. Болезнь начинается с типичных болей в грудной клетке и суправентрикулярных аритмий. Сократительная функция ЛЖ сохранена. Типичен быстрый ответ на проводимую терапию и нормализация ЭКГ и ЭхоКГ в течение 1-4 нед.
- Пациенты высокого риска:прогноз тяжелый, но во многом зависит от раннего ответа на проводимую терапию, динамики клинических симптомов (симптомы недостаточности кровообращения, жизнеугрожающие аритмии, атриовентрикулярные блокады, синкопальные состояния) и параметров ЭхоКГ (ФВ ЛЖ).
- Промежуточный риск:прогноз неопределённый. У пациентов отмечаются умеренно выраженные структурные и функциональные изменения, определяемые при расшифровке, описании и интерпретации ЭКГ (Расшифровка, описание и интерпретация ЭКГ-данных) и ЭхоКГ. Жизнеугрожающие нарушения ритма и проводимости не регистрируются. Синкопальных состояний нет. Характерны нестойкие желудочковые аритмии. Типична регистрация позднего накопления гадолиния в миокарде в отсутствие ремоделирования камер сердца и выраженного снижения сократительной способности ЛЖ.
Для удобства формулирования диагноза в условиях терапевтического, кардиологического и иного неспециализированного стационара классификация клиники Мэйо представляется наиболее удобной и простой (табл. ПА3-2, Приложение А3).
Миокардиты по этиологическому фактору могут быть классифицируемы на инфекционные и неинфекционные.
К инфекционным миокардитам относятся:
— вирусные (энтеровирусы, вирусы Коксаки, ECHO- вирусы (эховирусы), вирусы гриппа, парвовирус В-19, герпесвирусы, аденовирусы, вирусы краснухи, кори, гепатита В и С, цитомегаловирус, вирус иммунодефицита человека (ВИЧ);
— бактериальные (Chlamydia, Corynebacterium diphtheria, Legionella, Mycobacterium tuberculosis, Mycoplasma, Staphylococcus, Streptococcus A, Streptococcus pneumoniae);
— миокардиты, вызванные:
- грибами (Actinomyces, Aspergillus, Candida, Cryptococcus);
- глистной инвазией (Echinococcus granulosus, Trichinella spiralis);
- простейшими (Toxoplasma gondii, Trypanosoma cruzi— болезнь Шагаса);
- риккетсиями (Coxiella burnetti, Rickettsia typhi);
- спирохетами (Borrelia burgdorferi, Leptospira, Treponema pallidum).
К неинфекционным миокардитам относятся:
— миокардиты при системных болезнях соединительной ткани с иммунными нарушениями (системная красная волчанка, дерматомиозит, полимиозит, системный склероз (системная склеродермия), ревматоидный артрит);
— миокардиты при системных заболеваниях (саркоидоз, гранулематоз с полиангиитом (гранулематоз Вегенера), болезнь Кавасаки, болезнь Крона, язвенный колит, узелковый периартериит);
— миокардиты, вызванные гиперчувствительностью к некоторым препаратам (пенициллины широкого спектра действия (J01CA), сульфаниламиды (Сульфаниламиды и триметоприм), тетрациклин, метилдопа**);
— миокардиты, вызванные применением средств, обладающих кардиотоксическим действием (амфетамин и его производные, катехоламины (адренергические и дофаминергические средства), кокаин, стрептомицин**, противоопухолевые препараты);
— миокардиты, вызванные воздействием различных ядов (мышьяк, железо, свинец, кобальт, талий);
— миокардиты на фоне тиреотоксикоза, курсов лучевой терапии, ионизирующего облучения.
1.6. Клиническая картина заболевания или состояния (группы заболеваний, состояний)
Анализ клинической картины и первое клиническое предположение о дебюте миокардита формируется врачом-терапевтом или врачом общей практики (семейный врач) на уровне первичного звена медицинской помощи. От правильности интерпретации жалоб и трактовки симптомов зависит своевременное начало лечения и определение объёма необходимой специализированной помощи.
Миокардит поражает в основном лица молодого и среднего возраста.
Исход острого миокардита во многом определяется этиологией заболевания, выраженностью недостаточности кровообращения и скорости прогрессии симптомов [2, 50, 51]. Дебют болезни с бивентрикулярной недостаточности всегда прогностически неблагоприятен и свидетельствует о высоком риске летального исхода [2, 22, 24, 25, 50, 52, 53].
Клиническая картина манифеста болезни варьируется в широком диапазоне: от легкого недомогания, незначительных болей в грудной клетке, невыраженного чувства нехватки воздуха — до молниеносного течения болезни, завершающегося острой СН и летальным исходом. Первым проявлением миокардита может быть внезапная смерть, обусловленная желудочковой тахикардией, фибрилляцией желудочков вследствие очагового воспалительного поражения миокарда (табл. 3).
Таблица 3
Диагностически значимые критерии при предполагаемом миокардите
|
Клинические признаки |
|
• Острая боль в груди, в т.ч. по типу перикардита, или псевдоишемическая боль • Вновь возникшая (от нескольких дней до 3 мес.) или ухудшение имевшейся ранее одышки в покое или нагрузке, и/или утомляемость, с/без признаков лево- и/или правожелудочковой недостаточности • Подострое/хроническое (>3 мес.) наличие одышки в покое или нагрузке, и/или утомляемости, с/без признаков лево- и/или правожелудочковой недостаточности, или ухудшение этих симптомов • Сердцебиение и/или аритмия неясного генеза, и/или синкопальные состояния, и/или предотвращенная внезапная смерть (успешная реанимация) • Кардиогенный шок, причина развития которого неясна* |
Примечание: * — отсутствие поражения коронарных артерий и других сердечно-сосудистых и экстракардиальных заболеваний (пороки сердца, артериальная гипертония), которые могли вызвать данное состояние).
Нередко миокардит может дебютировать тромбоэмболиями в малый (чаще) и (реже) в большой круги кровообращения.
Дебют болезни с быстрого прогрессирования СН всегда обусловлен тяжелым диффузным миокардитом и указывает на высокий риск летального исхода.
В ряде случаев, на начальных стадиях, клиническая манифестация полностью отсутствует, диагноз устанавливается ретроспективно. Ухудшение состояния, вызванное дебютом миокардита, у пациентов, исходно имеющих сердечно-сосудистые заболевания и проявления ХСН, ошибочно трактуется как декомпенсация основного заболевания.
Анализируя дебют болезни, важно помнить, что первые клинические проявления миокардита — жалобы на ощущение сердцебиения и перебои в работе сердца, одышку при небольшой физической нагрузке и в покое — пациенты начинают предъявлять либо на фоне, либо через 1-2 нед. после начала острой респираторной вирусной инфекции.
Практически у всех пациентов появляются длительные разлитые боли в левой половине грудной клетки, в области сердца, тупого, ноющего, колющего характера, не связанные с физической нагрузкой и не купирующиеся приемом органических нитратов. Чаще всего боли в сердце обусловлены сопутствующим перикардитом, реже — ишемией миокарда, обусловленной прямым поражением кардиомиоцитов инфекционным или токсическим агентом, а также эндотелиальной дисфункцией коронарных артерий.
Характерны миалгии — проявление миозитов, вызванных миотропными вирусами Коксаки А.
Картину дебюта миокардита дополняют лихорадка, слабость, быстрая утомляемость (выраженность которых не меняется, несмотря на уменьшение объёма нагрузок), артралгии, гастроэнтерит.
Данные наблюдательных и эпидемиологических исследований [35, 54] позволили установить, что в дебюте болезни чувство нехватки воздуха испытывает 68,6% пациентов, боли в области сердца — 34,1%, сердцебиение — 32,8%, лихорадку — 29,8%, нарушения ритма — 16,4%, кровохарканье — 11,9%, кашель — 8,9%, приступы удушья — 5,97%, головокружение — 2,9%, синкопальные состояния — 1,5%, артралгии — 1,5% пациентов.
Интерпретация вновь возникших симптомов, характерных для дебюта миокардита, требует тщательного расспроса пациента о предшествующих заболеванию событиях — острая респираторная вирусная инфекция, вакцинации, начале приема нового препарата, любом токсическом воздействии.
Тяжесть клинического течения миокардитов зависит от выраженности воспалительного процесса и вовлечения в воспалительный процесс преимущественно левого, преимущественно правого или одномоментно обоих желудочков сердца.
На этапе полномасштабного манифеста болезни клиническая картина миокардитов характеризуется в первую очередь проявлениями СН, либо возникшей впервые, либо усилением/декомпенсацией имевшейся ранее. Для этого периода типично сочетание симптомов СН с нарушениями ритма и проводимости, чаще всего на фоне синусовой тахикардии.
Период выздоровления характеризуется ослаблением симптомов недостаточности кровообращения. В большинстве случаев они исчезают полностью. При миокардитах средней тяжести полное выздоровление может наступить в интервале 1-6 мес. от начала болезни. В трети случаев симптомы недостаточности кровообращения сохраняются и имеют тенденцию к прогрессированию и последующему доминированию.
В период выздоровления для всех пациентов характерна астения разной степени выраженности.
Клинические сценарии дебюта миокардита
Дебют миокардита под маской ОКС
Дифференциальный диагноз ОКС и острого миокардита относится к трудным вопросам внутренней медицины. Трудность принятия диагностического решения обусловлена тем, что подъём сегмента ST в 2 последовательных отведениях регистрируется в 54% случаев; отрицательный зубец Т — в 27% случаев; депрессия сегмента ST — в 18% случаев; патологический зубец Q — в 27% случаев [55, 56], а повышение уровня тропонина в той или иной степени — в абсолютном большинстве случаев (табл. 4). В ситуациях, когда сегмент ST находится выше изолинии, пациенту стандартно выполняется коронарография или МРТ с контрастированием и по результатам исследования принимается диагностическое решение [57-59]. При отсутствии коронарной патологии резко возрастает вероятность наличия миокардита, перикардита или, с учетом продолжительности, выраженности и локализации болевого синдрома — расслаивающей аневризмы аорты [60, 61].
Таблица 4
Диагностически значимые критерии дебюта миокардита под маской ОКС
|
Клинический сценарий |
Типичная клиническая картина |
|
Миокардит под маской ОКС |
Острая боль в груди: — часто начинается через 1-4 нед. после возникновения респираторной или кишечной инфекции — часто ассоциируется с выраженными и рецидивирующими симптомами миокардита — отсутствует ангиографическое подтверждение КБС |
|
Изменение интервала ST и зубца T на ЭКГ: — подъем или депрессия сегмента ST — инверсия зубца T |
|
|
Изменение на ЭхоКГ или МРТ: — с/без нарушения глобальной или очаговой сократимости или дисфункцией левого/правого желудочка по данным ЭхоКГ или МРТ |
|
|
Изменение уровня тропонинов T и I в крови: — с/без повышения уровня тропонинов T и I в крови — повышение уровня тропонинов T и I может быть как временным (как при остром инфаркте миокарда), так и длительным, в течение нескольких недель или месяцев |
Сокращения: КБС — коронарная болезнь сердца, МРТ — магнитно-резонансная томография, ОКС — острый коронарный синдром, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
В случае диагностики острого миокардита важно помнить, что клиническая картина с доминирующим болевым синдромом типична для парвовируса В19. Для этого вируса характерно поражение клеток эндотелия коронарных артерий, приводящее к спазму коронарных артерий и ишемии миокарда. Клинической особенностью таких миокардитов является отсутствие параллелизма между выражен- ностью болевого синдрома и выраженностью недостаточности кровообращения [62, 63].
Следует признать, что при различных сочетаниях выраженного болевого синдрома, различной степени повышения уровня тропонина, наличия или отсутствия нарушений локальной сократимости на ЭхоКГ и отсутствия подъёма сегмента ST диагноз "миокардит" может рассматриваться в дифференциальном ряду только как один из вероятных. Максимально раннее проведение коронарографии или МРТ, бесспорно, решит эту проблему.
При невозможности выполнения этих диагностических процедур ряд авторов [60] предлагает оценивать динамику снижения уровня тропонина. В большинстве случаев для миокардитов, в отличие от ОКС, характерно замедленное снижение уровня тропонина, что позволяет ретроспективно высказаться о вероятности миокардита. В сложных ситуациях предметом обсуждения является ЭМБ.
Дебют миокардита под маской СН
Самым частым клиническим симптомом в дебюте миокардита является недостаточность кровообращения. В ситуациях, когда у пациента отсутствует коронарная недостаточность и/или другие известные причины развития СН, миокардит выходит на первые позиции в дифференциально-диагностическом ряду. С целью упростить диагностический поиск принято выделять 2 клинические ситуации:
1) дебют или прогрессирование СН в период от 2 нед. до 3 мес. от момента начала заболевания;
2) проявление ХСН в сроки более 3 мес. от момента начала заболевания.
Для первой ситуации важен углубленный анализ анамнеза пациента, т.к. возможное появление симптомов после респираторной или желудочно-кишечной инфекции, либо во время беременности имеет решающее диагностическое значение. Следует помнить, что клиническая картина может развиться на фоне нарушения систолической функции ЛЖ и/или правого желудочка с/без утолщения стенок, с/без развития дилатации желудочков на ЭхоКГ, а также на фоне неспецифических изменений на ЭКГ. Отсутствие ответа на проводимую рекомендованную терапию миокардита в течение короткого периода, рецидивирующие желудочковые аритмии, атриовентрикулярной (AV)-блокады II-III ст. позволяют поставить на повестку дня вопрос о проведении повторного анализа коронарограммы пациента и заборе ЭМБ (табл. 5).
Во второй ситуации (табл. 6) важно обратить внимание на то, что у амбулаторного пациента на протяжении более 3 мес. на фоне выраженной утомляемости, сердцебиения, одышки, длительной атипичной боли в грудной клетке, аритмий отмечаются частые эпизоды декомпенсации кровообращения и повторные госпитализации на фоне традиционной терапии ХСН. И в этой ситуации диагностическое предположение требует морфологического подтверждения.
При всей условности такого деления следует признать, что этот подход позволяет интернисту обратить внимание на два диагностически важных момента: причинно-следственную связь миокардита с предшествующей инфекцией и факт отсутствия эффекта от проводимого рекомендованного лечения.
Таблица 5
Диагностически значимые клинические признаки дебюта миокардита под маской дебюта или прогрессирования СН при отсутствии коронарной болезни сердца или иных причин развития недостаточности кровообращения (сроки проявления — от 2 нед. до 3 мес.)
|
Клинический сценарий (клинический фенотип) |
Типичная клиническая картина |
|
Дебют или прогрессирование сердечной недостаточности (у пациента отсутствует КБС или иные причины развития недостаточности кровообращения) |
Начало или прогрессирование СН от 2 нед. до 3 мес.: одышка, периферические отеки, неприятные ощущения в грудной клетке, утомляемость, нарушение систолической функции левого и/или правого желудочка с/без утолщения стенок, с/без развития дилатации желудочков на ЭхоКГ или МРТ |
|
Возможное появление симптомов после: респираторной или желудочно-кишечной инфекции, либо во время беременности |
|
|
Неспецифические ЭКГ-признаки: блокада ножек пучка Гиса, атриовентрикулярная блокада и/или желудочковые аритмии |
Сокращения: КБС — коронарная болезнь сердца, МРТ — магнитно-резонансная томография, СН — сердечная недостаточность, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
Таблица 7
Диагностически значимые клинические признаки дебюта миокардита под маской жизнеугрожающих нарушений ритма и проводимости [38]
|
Клинический сценарий (клинический фенотип) |
Типичная клиническая картина |
|
Опасные для жизни состояния У пациента отсутствует коронарная недостаточность И/или другие известные причины развития сердечной недостаточности |
Жизнеугрожающие аритмии или внезапная сердечная смерть Кардиогенный шок Тяжелые нарушения функции левого желудочка |
Таблица 6
Диагностически значимые клинические признаки дебюта миокардита под маской ХСН в отсутствие коронарной недостаточности и других известных причин СН (сроки проявления — >3 мес.) [38]
|
Клинический сценарий (клинический фенотип) |
Типичная клиническая картина |
|
Хроническая СН более 3 мес. (у пациента отсутствует коронарная недостаточность и/или другие известные причины развития СН) |
Симптомы СН (с рецидивирующими обострениями) на протяжении более 3 мес.: утомляемость, сердцебиение, одышка, атипичная боль в грудной клетке, аритмия у амбулаторных пациентов |
|
Нарушение систолической функции левого и/или правого желудочка на ЭхоКГ или МРТ, позволяющее предположить ДКМП или другую неишемическую кардиомиопатию |
|
|
Неспецифические ЭКГ-признаки: блокада ножек пучка Гиса, атриовентрикулярная блокада и/или желудочковая аритмия |
Сокращения: ДКМП — дилатационная кардиомиопатия, МРТ — магнитно-резонансная томография, СН — сердечная недостаточность, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
Дебют миокардита под маской жизнеугрожающих нарушений ритма и проводимости
Для вирусного миокардита характерно наличие аритмий, что объясняется прямым повреждающим действием вируса на кардиомиоциты и клетки проводящей системы, развитием отека миокарда, воспалительной инфильтрацией миокарда. Эти процессы приводят к неоднородности реполяризации, нестабильности трансмембранного потенциала и формируют очаги патологического автоматизма, что клинически проявляется желудочковыми тахиаритмиями. В редких случаях тахиаритмии приводят к внезапным смертям. Дебют миокардита с пируэтной тахиаритмией является клинической редкостью. Ключевым для клинициста является факт развития аритмий без предшествующих ишемических изменений миокарда и наличия очевидной коронарной болезни сердца (табл. 7).
Фибрилляция предсердий — устойчивая форма или пароксизмы при отсутствии верифицированной коронарной болезни сердца, патологии клапанного аппарата и щитовидной железы — позволяет с высокой вероятностью предполагать миокардит. К числу редких проявлений дебюта миокардита относится кардиогенный шок.
Дебют миокардита при дифтерии
Миокардит в той или иной степени тяжести развивается у каждого десятого пациента, заболевшего дифтерией [64, 65]. Характерно одновременное развитие поражения зева и миокарда. Миокардит развивается либо в первые дни болезни, либо через несколько недель. Миокардит у пациентов с дифтерией возникает вследствие влияния экзотоксина Corynebacterium diphtheriae, обладающего высокой тропностью к проводящей системе сердца. У пациентов с дифтерийными миокардитами довольно часто встречаются различные нарушения проводимости. Клинически и прогностически неблагоприятными считаются бифасцикулярная блокада и полная AV-блокада, которые требуют постановки пациенту временного электрокардиостимулятора*** (ЭКС), хотя влияние этой процедуры на отдалённый прогноз не изучалось [65, 66]. Помимо нарушений проводимости развивается клинически значимая недостаточность кровообращения. Высокий уровень смертности характерен для невакцинированных детей. Снижение уровня охвата вакцинацией в декретированные сроки привело к росту числа новых случаев заболеваний. Только охват 95% детского населения иммунизации против дифтерии предупреждает эпидемическое распространение дифтерии. В случаях развившегося заболевания у взрослых ЭКГ-мониторинг (регистрация электрокардиограммы) является обязательной процедурой на фоне лечения основного заболевания.
Дебют миокардита при стрептококковой инфекции
Стрептококковый токсин обладает высоким тропизмом к мембранам кардиомиоцитов, приводит к развитию некроза, болевого синдрома и играет ключевую роль в клиническом манифесте болезни. Важно отметить клиническую особенность этой болезни — одновременность развития тонзиллита и миокардита. Другой особенностью является несоответствие выраженных жалоб благоприятному течению болезни. Ключевой особенностью этого миокардита является быстрое и полное выздоровление.
Ревматический миокардит
Главная особенность течения этого миокардита — вовлечение в патологический процесс эндокарда, миокарда и перикарда. Ревматический миокардит — составная часть ревматического кардита, который развивается в реальной практике редко и преимущественно у молодых. При анализе результатов ЭМБ выявляют воспалительные инфильтраты и ашофф-талалаевские гранулёмы. Выраженные некрозы, как правило, отсутствуют. Поражение клапанного аппарата присутствует практически в каждом клиническом случае, что позволяет считать изолированную дисфункцию миокарда без поражения клапанного аппарата нехарактерной для этого процесса.
Типичные клинические фенотипы дебюта миокардита
- Остро возникшие разлитые, длительные (идентичные по характеристикам болям при перикардитах), различной интенсивности боли в грудной клетке, часто загрудинной локализации, сопровождающиеся лихорадкой (субфебрильная/фебрильная), нарушениями ритма, одышкой, тахикардией и аритмиями, преимущественно у молодых людей без очевидных признаков коронарной патологии. В этой ситуации исключение коронарной патологии — неотложное мероприятие.
- Одышка, утомляемость, разлитые, длительные боли в грудной клетке, аритмии или иные признаки недостаточности кровообращения, присутствующие у пациента в интервале дни — месяц после перенесенной, или наличия анамнестических указаний на перенесённую респираторную инфекцию или гастроинтестинальную инфекции, либо указаний на эпизоды ознобов, головной боли, мышечных болей, общего недомогания, либо беременность.
- Впервые выявленная (от нескольких дней до 3 мес. от начала болезни) одышка в покое или при нагрузке, и/или утомляемость, с/без признаков лево- и/или правожелудочковой недостаточности в ситуации, когда отсутствует коронарная недостаточность и/или другие известные причины развития СН.
- Усиление существовавшей ранее одышки в покое или нагрузке, или хроническое (>3 мес.) наличие одышки, и/или усиление утомляемости, или хроническое (>3 мес.) наличие отеков и других признаков ХСН, в ситуации, когда отсутствует декомпенсация коронарной недостаточности и/или других известных причин прогрессии СН.
- Постоянная тахикардия и/или аритмии неясного генеза, и/или синкопальные состояния, и/или успешная сердечно-легочная реанимация в сроки от нескольких дней до 3 мес. от начала болезни, в ситуации, когда отсутствует коронарная недостаточность.
- Кардиогенный шок в ситуации, когда отсутствует коронарная недостаточность и/или другие известные причины развития острой ЛЖ недостаточности.
- В дифференциально-диагностическом ряду вероятность развития миокардита должна анализироваться во всех ситуациях, когда в анамнезе есть указания на бронхиальную астму или иные аллергические заболевания, аутоиммунные заболевания, ДКМП, перенесенный ранее миокардит, воздействие токсических, в т.ч. лекарственных, агентов.
Миокардит у больных с острой COVID-19
Характерными особенностями коронавирусного миокардита являются его сочетания с перикардитом, развитием коронариита и эндотелиита с тромбозом микрососудов и вторичным ишемическим повреждением кардиомиоцитов, пристеночным тромбозом эндокарда. По данным гистологического исследования (патолого-анатомического исследования биопсионного материала) выявляется преимущественно лимфоцитарная инфильтрация в мио-, эндо- и перикарде, а также повышение экспрессии маркеров врожденного противовирусного иммунитета (toll-like рецепторов 4 и 9 типов), что подтверждает вирусно-иммунную природу воспаления [67, 68]. Типичным считают также обнаружение макрофагов [69], увеличение соотношения CD4/CD8.
Дифференциальную диагностику необходимо проводить с иными вариантами повреждения миокарда: синдромом такоцубо [70], острой ишемией миокарда вследствие микроваскулярных тромбозов [71], инфарктом миокарда 2 типа. Острый коронавирусный миокардит, который протекает чаще всего в инфарктоподобной форме (с ангинозными болями, ишемическими изменениями на ЭКГ и значительным повышением уровня тропонина), может сопровождаться тяжелой систолической дисфункцией, угрожающими жизни нарушениями ритма и проводимости и становиться одной из причин смерти [72-74]. Описаны фульминантные формы [75-77]. Возможно развитие коронавирусного миокардита у больных без пневмонии [78, 79], а также с отрицательными результатами ПЦР-исследования назофарингеальных смывов (Определение РНК коронавирусов 229E, OC43, NL63, HKUI (Human Coronavirus) в мазках со слизистой оболочки носоглотки методом ПЦР) [68].
Постковидный миокардит
К июню 2021г в VAERS (Vaccine Adverse Event Reporting System) зарегистрировано 1226 случаев подозрения на вакциноассоциированный перикардит и миокардит, при этом 40% случаев приходилось на лиц в возрасте до 30 лет (VAERS — Guide to Interpreting VAERS Data). Из них 323 сообщения были подтверждены Центрами по контролю и профилактике заболеваний. Предполагаемая частота развития миокардита/перикардита у лиц в возрасте <30 лет после получения второй дозы мРНК-вакцины (вакцины) составила примерно 40 случаев на миллион среди мужчин и 4,2 случая на миллион среди женщин. При рассмотрении возрастной группы ≥30 лет эти показатели были значительно ниже: 2,4 и 1,0 на миллион у мужчин и женщин, соответственно [80]. Истинная частота миокардита, связанного с вакцинацией, неизвестна, поскольку имеющиеся сообщения относятся только к пациентам с симптомами. Сообщения о миокардите после вакцинации против SARS-CoV-2 неоднородны из-за разных критериев включения в исследования, разных характеристик (возраст, пол и т.д.) субъектов, разных критериев диагностики поствакцинального миокардита, разных типов и доз вакцин, а также различных периодов наблюдения после вакцинации. По мнению ряда авторов, поствакцинальный миокардит является достаточно редким явлением: 0,58 на 100 тыс. человек, вакцинированных второй дозой [81]. У большинства субъектов миокардит возник после введения второй дозы, со средним интервалом от введения последней дозы до появления симптомов — 3 дня. Эти результаты позволяют предположить наличие иммуноопосредованной реакции на введение вакцины. В качестве предлагаемых механизмов, с помощью которых вакцина для профилактики COVID-19** может вызывать миокардит, прежде всего следует назвать активацию как врожденного, так и адаптивного иммунного ответа против гликопротеина спайка SARS-CoV-2, а также распознавание самой мРНК как антигена иммунной системой. Как и другие вирусные миокардиты, поствакцинальный миокардит встречается преимущественно у генетически предрасположенных молодых мужчин, что указывает на возможную роль половых гормонов [82-84].
Поствакцинальный миокардит (индуцированный вакцинами против SARS-CoV-2)
Первое описание поствакцинального миокардита появилось в апреле 2021 г. Вскоре описаны случаи перикардита после вакцинации [85]. Миокардит называют среди 4 основных причин смерти после вакцинации, наряду с тромботической тромбоцитопенией, инфарктом миокарда и рабдомиолизом [86]. Есть сообщения о применении вспомогательного кровообращения и трансплантации сердца по поводу фульминантного поствакцинального миокардита [87, 88]. В объединенный регистр Vaccine Adverse Event Reporting System (VAERS, США, Европа и Великобритания) вошло 18204 случаев мио- и перикардита, 40% больных были старше 40 лет [89]. В целом частоту поствакцинального миокардита расценивают на уровне 7,64/миллион доз вакцины, для перикардита — 5,32/миллион; летальность — на уровне 0,102/миллион доз вакцины и 0,017/миллион, соответственно [90].
Большинство случаев поствакцинального миокардита развилось после применения мРНК-содержащих вакцин (Pfizer-BioNTech and Moderna). Однако возможен миокардит и после введения векторных вакцин [91], к которым относятся и созданные в РФ препараты. Механизм поствакцинального миокардита может быть связан с активным компонентом вакцины, последовательностью мРНК, кодирующей Spike-белок SARS-CoV-2, или с иммунным ответом, который следует за вакцинацией. Заболевание регистрируется чаще у мужчин, после введения второй дозы вакцины. Факторами риска являются аутоиммунные заболевания в анамнезе (например, бронхиальная астма).
Диагностика поствакцинального миокардита в боль- шинстве случаев проводится без применения биопсии миокарда. При использовании биопсии миокарда у больных с подозрением на поствакцинальный миокардит острый лимфоцитарный миокардит (через 1-6 дней после вакцинации) выявлен в 10% случаев, хронический — в 24% [92]. Биопсия миокарда показывает высокую частоту эозинофильных форм [93, 94], наличие белков коронавируса в миокарде, повышение соотношения CD4/CD8 лимфоцитов [95]. Характерно сходство ковидного, постковидного и пост- вакцинального миокардитов — от спектра клинических проявлений, осложнений, причин смерти до специфических морфологических признаков.
Случаи развития поствакцинального миокардита (аритмического, декомпенсированного) как в первые часы, так и спустя 2-4 нед. после введения отечественных вакцин нам также известны; чаще такая реакция на вакцину развивалась у больных, ранее перенесших COVID-19, что подтверждается данными литературы [96-98]. Тяжелый постковидный миокардит требует назначения кортикостероидов (кортикостероиды системного действия) по схемам, аналогичным лечению острого ковидного или постковидного миокардита. Повторная вакцинация подобным больным противопоказана.
COVID-19 у больных с хроническим миокардитом иной этиологии
Инфекция SARS-CoV-2 может оказывать влияние на течение хронического нековидного миокардита, которое зависит от объема базисной терапии миокардита. Поддерживающая иммуносупрессивная терапия в определенной степени позволяет избежать SARS-CoV-2-индуцированных обострений, однако на период инфекции необходима отмена цитостатика (противоопухолевого препарата). Отсутствие базисной терапии является фактором риска обострения миокардита, для купирования которого следует в первую очередь использовать кортикостероиды системного действия.
Базисная иммуносупрессивная терапия существенно не меняет серологический ответ на коронавирусную инфекцию/вакцинацию; статистики относительно безопасности вакцинации у больных с хроническим миокардитом на сегодняшний день нет. Отсутствуют также доказательства целесообразности вакцинации против COVID-19 у ранее переболевших ей пациентов с миокардитом. С учетом риска обострения миокардита и недоказанной пользы вакцинации у таких больных лучше от нее воздержаться.
-
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии постановки диагноза миокардита:
- Острая боль в груди, в т.ч. по типу перикардита, или псевдоишемическая боль. Вновь возникшая (от нескольких дней до 3 мес.) или ухудшение имевшейся ранее одышки в покое или нагрузке, и/или утомляемость, с/без признаков лево- и/или правожелудочковой недостаточности;
- Подострое/хроническое (>3 мес.) наличие одыш- ки в покое или нагрузке, и/или утомляемости, с/без признаков лево- и/или правожелудочковой недостаточности, или ухудшение этих симптомов;
- Сердцебиение и/или аритмия неясного генеза, и/или синкопальные состояния, и/или предотвращенная внезапная смерть (успешная реанимация);
- Кардиогенный шок, причина развития которого неясна.
2.1. Жалобы и анамнез
В настоящее время не существует проспективных клинических исследований, доказавших важность и обязательность определённого перечня вопросов при первичном осмотре. Тем не менее многолетний клинический опыт [15, 35, 54, 67, 68] позволил вычленить обязательные вопросы, имеющие диагностическую ценность.
С учетом того, что миокардит следует подозревать во всех случаях необъясненной (рутинные методы кардиологического обследования не выявляют причину) недостаточности кровообращения, необъясненной тахикардии и аритмий, особенно желудочковых, необходимо обратить внимание на наличие у пациента [15, 35, 54, 67, 68]:
— жалоб на одышку, сердцебиение, эпизоды потери сознания, повышенную утомляемость, пароксизмальную ночную одышку;
— анамнестических указаний на перенесённую респираторную инфекцию или гастроинтестинальную инфекцию;
— эпизодов ознобов, головной боли, мышечных болей, общего недомогания (следует помнить, что, как правило, симптомы миокардита развиваются спустя 1-2 нед. от дебюта вирусного заболевания);
— беременности.
Ряд состояний увеличивает вероятность развития миокардита [101].
При сборе анамнеза необходимо уточнить, есть ли указания на:
— бронхиальную астму или иные аллергические заболевания, аутоиммунные заболевания;
— ДКМП;
— перенесенный ранее миокардит;
— воздействие токсических, в т.ч. лекарственных, агентов.
При осмотре пациента необходимо установить:
— положение пациента в кровати (ортопноэ);
— наличие отеков нижних конечностей;
— наличие акроцианоза, набухания шейных вен.
2.2. Физикальное обследование
Ключевым при проведении физикального осмотра является поиск признаков недостаточности кровообращения. Специфичных для миокардита признаков не существует, в ряде ситуаций данные физикального обследования не выявляют никаких патологических отклонений, в ряде ситуаций выявленные изменения имеют минимальный уровень. Примерно у трети пациентов проявления заболевания носят очевидный характер.
- Измерение температуры тела: может регистрироваться лихорадка различной степени выраженности, но чаще всего субфебрильная.
- Для миокардита нехарактерно повышение температуры. Лихорадка фебрильная или субфебрильная — это проявление инфекционного заболевания, в рамках которого развиваются миокардит или его осложнения — например, тромбоэмболия легочной артерии, острая пневмония.
- Измерение частоты сердечных сокращений (ЧСС): типична постоянная тахикардия, выраженность которой не коррелирует с повышением температуры тела. При развитии нарушений проводимости может быть брадикардия или брадиаритмии.
- Измерение артериального давления (АД) (на периферических артериях): артериальная гипотензия расценивается как абсолютное показание для госпитализации в реанимационное отделение [100]. В дебюте болезни встречается редко, является признаком тяжелого прогноза.
- Для правильной интерпретации полученных данных необходимо выяснить, принимает ли пациент лекарственные препараты, которые влияют на эти гемодинамические параметры.
- Пальпация и перкуссия сердца (перкуссия при патологии сердца и перикарда): положение верхушечного толчка зависит от выраженности ремоделирования камеры ЛЖ сердца. Перкуторно может определяться расширение границ относительной и абсолютной сердечной тупости.
- Пальпация брюшной полости (пальпация при патологии брюшной стенки): гепатомегалия возможна как проявление развивающейся тяжелой СН. Асцит, как правило, присоединяется в тяжелых ситуациях при развитии рефрактерной к лечению СН (это же относится и к развитию гидроторакса).
- Аускультация легких и сердца(аускультация при патологии сердца и перикарда, аускультация при заболеваниях легких и бронхов): тахипноэ — очень частый симптом. В легких могут выслушиваться влажные мелкопузырчатые симметричные хрипы, как проявление застоя в малом круге кровообращения.
- При аускультации сердца (аускультация при патологии сердца и перикарда) ключевым моментом является определение амплитуды первого тона. Амплитуда первого тона всегда обратно пропорциональна объёму крови в ЛЖ. Следовательно, уменьшение амплитуды первого тона свидетельствует о начавшемся ремоделировании ЛЖ. Появление ритма галопа (III тон) — признак тяжелой недостаточности кровообращения. Систолический шум на верхушке с иррадиацией в аксиллярную зону свидетельствует о формировании относительной недостаточности митрального клапана [27, 67, 68].
2.3. Лабораторные диагностические исследования
Неспецифические маркеры воспаления и количество эозинофилии в периферической крови
Ускорение скорости оседания эритроцитов (СОЭ) и рост уровня С-реактивного белка (СРБ) часто регистрируются при остром миокардите. Эти изменения не носят специфический для миокардита характер и свидетельствуют о выраженности системной воспалительной реакции. Ускорение СОЭ и рост уровня СРБ позволяют врачу только заподозрить миокардит, но не могут подтвердить диагноз. Нормализация измененных значений носит индивидуальный характер. Длительное отсутствие положительной динамики может свидетельствовать о хронизации процесса. Уровень циркулирующих цитокинов не носит специфический для миокардита характер и свидетельствует о выраженности системной воспалительной реакции [102]. При остром миокардите диагностически значимо определение уровня эозинофилов в общем (клиническом) анализе крови развернутом. Высокая исходная эозинофилия позволяет предполагать эозинофильный миокардит.
- Рекомендовано выполнение общего (клинического) анализа крови развернутого для оценки количества эозинофилов и воспалительной реакции, исследование СОЭ, уровня СРБ в сыворотке крови у всех пациентов с миокардитом в рамках первичного обследования и в процессе динамического наблюдения [38].
ЕОК IC (УУР С, УДД 5)
Биомаркеры некроза
Специфичных только для миокардита маркеров некроза нет. При подозрении на острый миокардит целесообразнее определять концентрацию в сыворотке тропонина T или I в крови (исследование уровня тропонинов I, T в крови) [38], т.к. эти маркеры более чувствительны к повреждению кардиомиоцитов, чем динамика уровня МВ-фракции креатинфосфокиназы. Нормальный уровень тропонина T и I не исключает миокардит. Высокие уровни тропонина Т имеют также и негативное прогностическое значение [71, 72, 105]. В последние годы описаны новые маркеры повреждения миокарда, которые также возможно использовать в качестве дополнительных при диагностике миокардита: маркеры, связанные с деградацией экстрацеллюлярного матрикса [106], пентраксин 3, галектин 3, фактор дифференциации роста 15 [107].
- Рекомендовано проведение исследования уровня тропонина Т, I в крови у всех пациентов с миокардитом в рамках первичного обследования и в процессе динамического наблюдения [40, 71, 72].
ЕОК IC (УУР С, УДД 4)
Сывороточные кардиальные аутоантитела
У пациентов с миокардитом выявлено >20 сывороточных кардиальных аутоантител к различным кардиальным и мышечным антигенам [2, 40, 52, 76, 77]: AFA, anti-fibrillary Ab; AHA, organ-specific and partially organ-specific anti-heart aabs; AIDA, anti-intercalated disks-aabs; Anti B-1-AR; Anti B-2-AR; Anti Alpha-MNC; Anti-non-myofibrillar; Anti ANT, adenine nucleotide translocator; AMLA, anti-myolemmal aabs; AR, adrenergic receptor; ASA, anti-sarcolemmal aabs; IFA, anti-interfibrillary aabs; BCKD, branched chain alpha-ketoacid dehydrogenase dihydrolipoyl transacylase; HSP, heat shock protein.
Повышенный титр кардиальных аутоантител свидетельствует об аутоиммунном характере процесса, однако отсутствие повышенного титра не исключает миокардита, т.к. наличие воспалительного процесса в миокарде может развиваться без формирования аутоантител. Динамика титра аутоантител позволяет оценить эффективность проводимой иммуносупрессивной или иммуномодулирующей терапии.
В ситуациях:
- когда по данным ЭМБ присутствуют гистологические и иммуногистохимические критерии миокардита, в ткани биоптата миокарда отсутствует вирусный геном, а в сыворотке крови обнаруживаются кардиальные аутоантитела, можно предположить, что произошла элиминация вируса, но сохраняется аутоиммунный миокардит [2, 52, 78, 79];
- когда у пациента отсутствует инфекционный генез развития миокардита, следует использовать исходный уровень антител класса IgG, высокоспецифичных для миокардитов, в качестве аутоиммунных маркеров прогноза заболевания и эффективности иммуносупрессивной терапии или иммуномодуляция [2, 52, 76, 78, 79];
- при обнаружении кардиодепрессивных антител в сыворотке пациента, страдающего миокардитом, проведение иммуносорбции позволит добиться стабилизации и улучшения показателей гемодинамики [111].
В современной клинике известны сывороточные кардиальные аутоантитела, которые рассматриваются как предикторы развития миокардита или ДКМП [81, 82]; клиническое значение этих данных уточняется.
В настоящее время в реальной клинической практике нет дешевых и доступных тестов для выявления кардиальных аутоантител. Такие исследования проводятся только в диагностических центрах, контролируемых исследованиях и научных лабораториях [114].
- Рекомендовано определение уровня одного или нескольких сывороточных кардиальных аутоантител (Определение содержания антител к антигенам миокарда в крови), специфичных для ткани миокарда, у всех пациентов с миокардитом при наличии в медицинской организации лабораторной базы и поставленных методик исследования. При невозможности выполнить эту процедуру в лечебном учреждении целесообразно направлять образцы крови в лабораторию, обладающую указанными технологиями [38].
ЕОК нет (УУР С, УДД 5)
Вирусные антитела
Серологические маркеры вирусной инфекции, верифицированные в периферической крови пациента, не являются основанием для диагностического суждения о наличии вирусного миокардита. Диагностическая значимость серологических методов лимитирована из-за высокой распространенности в популяции вирусов, вызывающих миокардит, а реактивация или вирусная реинфекция, или перекрестные реакции с вирусом Эпштейна-Барр/энтеровирусами делают интерпретацию лабораторных данных крайне трудной и неоднозначной. В общей популяции, в т.ч. и у здоровых людей, циркуляция IgG-антител к кардиотропным вирусам встречается часто и не сопровождается манифестом клиники вирусного миокардита.
В реальной практике инфицирование некардиотропными энтеровирусами может вызвать появление антител, лабораторно неотличимых от ответа на кардиотропные вирусы. Следовательно, определение титра вирусных антител имеет ограниченную ценность в диагностике вирусного миокардита [22, 43, 52, 115-118].
Сопоставление результатов анализа ЭМБ с уровнем титра циркулирующих IgG-антител к кардиотропным вирусам не выявило их корреляции [2, 3, 7, 88, 89]. Персистенция вируса в миокарде ассоциировалась с дисфункцией желудочков, элиминация вирусного генома из ткани миокарда — с улучшением сократительной функции сердца и лучшим 10-летним прогнозом [7]. Известны и другие, противоречащие приведенным выше результаты: так, установлено, что иммуногистохимически верифицированное в биоптате миокарда воспаление, а не факт персистенции вируса в ткани миокарда, было независимым предиктором прогноза относительно жизни [3]. К сожалению, до настоящего времени остается неясным, какой процент спонтанно выздоровевших пациентов имел вирусную этиологию миокардита. Неясны также механизмы, ответственные за реактивацию латентной вирусной инфекции и процессы вирусной репликации при хронических миокардитах [5].
Целесообразность проведения вирусологических исследований высока при подозрении на миокардит у пациента с гепатитом С, риккетсиозом, болезнью Лайма (только в эндемичных районах) и вирус иммунодефицита человека.
- Не рекомендовано проведение вирусологических исследований в качестве рутинных с целью верификации вирусных миокардитов или дифференциальной этиологической диагностики миокардитов [22, 43, 52, 115-118].
ЕОК IIIВ (УУР С, УДД 2)
Маркеры СН
Повышение уровня натрийуретического пептида не носит специфического для миокардита характера, но позволяет врачу оценить выраженность изменений внутрисердечной гемодинамики, степень изменения давления заполнения ЛЖ. Повышение уровня натрийуретического пептида свидетельствует о дебюте СН и позволяет оценить её выраженность у пациентов с миокардитом.
Нормальные значения N-концевого промозгового натрийуретического пептида (NT-proBNP) не исключают наличия миокардита. Динамика уровня NT-proBNP позволяет высказаться об эффективности лечения и прогнозе пациента. Сохранение высокого уровня позволяет предполагать наличие активного воспаления и хронизацию процесса.
- Рекомендовано всем пациентам с клиническим подозрением на миокардит исследование исходного уровня NT-proBNP в крови и в динамике [6, 102, 184].
ЕОК IC (УУР С, УДД 5)
- Рекомендовано всем пациентам подозрением для диагностики постковидного миокардита определять уровень СРБ, антикардиальных антител (Определение содержания антител к антигенам миокарда в крови) [220].
ЕОК IC (УУР С, УДД 5)
2.4. Инструментальные диагностические исследования
ЭКГ
При подозрении на миокардит регистрируемые на ЭКГ изменения имеют низкую чувствительность и специфичность. Чувствительность метода составляет всего 47% [121]. Специфических ЭКГ изменений, характерных только для миокардита, не существует. Самые частые изменения, регистрируемые на ЭКГ — синусовая тахикардия, отрицательный зубец Т, изменения сегмента ST, AV-блокады, блокада левой ножки пучка Гиса. В ряде ситуаций регистрируется инфарктоподобная ЭКГ (элевация или депрессия сегмента ST и патологический зубец Q [73, 91]), что свидетельствует о плохом прогнозе [2, 27]. Таким образом, самым ценным ЭКГ параметром у пациентов, страдающих миокардитом, является ширина комплекса QRS.
- Рекомендовано выполнение рутинной регистрации ЭКГ (12 отведений) и 24-часовое мониторирование ЭКГ данных всем пациентам с подозрением на миокардит с целью выявления нарушений ритма, проводимости, фибрилляции предсердий и блокад ножек пучка Гиса [40, 73, 90, 91, 227]. Ширина комплекса QRS может использоваться в прогностической оценке [121].
ЕОК IC (УУР С, УДД 4)
Рентгенография органов грудной клетки
Рекомендовано проведение рентгенографии органов грудной клетки в качестве базового обследования. Результаты рентгенографии сердца и легких у большинства пациентов с миокардитом неспецифичны. В рамках комплексного обследования пациента с миокардитом рентгенография органов грудной клетки может выявить признаки кардиомегалии, венозного застоя в малом круге, перикардиального выпота или гидроторакса при наличии у пациентов выраженных нарушений сократительной функции миокарда [184].
ЕОК IC (УУР С, УДД 5)
Трансторакальная ЭхоКГ
Метод уже на первом этапе диагностического поиска позволяет определить причины, приведшие к развитию СН, исключив клапанные пороки сердца, гипертрофическую и рестриктивную кардиопатии, наличие выпота в полости перикарда [122]. Обнаружение зоны нарушенной локальной сократимости требует обязательного дифференциального диагноза с ИБС [123]. В 25% случаев у пациентов с миокардитом верифицируются внутриполостные тромбы, что требует оценки риска/пользы от начала терапии прямыми пероральными антикоагулянтами.
Анализ исходного состояния и последующей динамики систолической и диастолической функций желудочков, величины ФВ, размеров ЛЖ и правого желудочка, толщины их стенок, размеров левого предсердия, давления заполнения ЛЖ и давления в легочной артерии позволяет с высокой вероятностью оценить прогноз заболевания и эффект от проводимого лечения [123].
В типичных ситуациях при остром миокардите могут быть минимальная дилатация ЛЖ, утолщение стенок за счет отека миокарда, а также глобальные или региональные нарушения сократительной способности. У пациентов с острым миокардитом дополнительная оценка показателей продольной систолической деформации миокарда ЛЖ с помощью технологии спекл-трекинг ЭхоКГ позволяет выявлять дисфункцию ЛЖ и ее выраженность, особенно у пациентов с сохранной ФВ [124, 125], прогнозировать риск развития неустойчивых желудочковых тахикардий [126] и суправентрикулярных аритмий [127].
Для фульминантной (молниеносной) формы миокардита характерно выраженное снижение ФВ, но нормальные размеры камер сердца. При этом глобальная продольная систолическая деформация ЛЖ при спекл-трекинг ЭхоКГ может быть очень важным индикатором воспаления миокарда, а изначально низкие её значения не свидетельствуют о плохом восстановлении функции миокарда на протяжении госпитализации у пациентов с молниеносной формой мио- кардита [128].
При хронизации процесса более характерно наличие значительной дилатации камер сердца и снижение ФВ.
У пациентов с подозреваемым миокардитом дополнительным ЭхоКГ показателем дисфункции ЛЖ может быть индекс Тей (Приложение Г1), особенно при нормальных значениях традиционных ЭхоКГ показателей (табл. ПА3-3, Приложение А3) [129, 130].
Проведение ЭхоКГ обязательно перед процедурой ЭМБ.
- Рекомендовано при подозрении на миокардит проведение трансторакальной ЭхоКГ. Оценка параметров ЭхоКГ в динамике обязательна, т.к. позволяет оценить эффект от проводимой терапии [38, 228]. Проведение ЭхоКГ обязательно перед процедурой ЭМБ.
ЕОК IC (УУР А, УДД 5)
Радионуклидная диагностика
Для диагностики воспаления миокарда при миокардитах радионуклидные методы диагностики нецелесообразно использовать для первичного выявления заболевания, т.к. имеют низкую специфичность [40, 92].
Применение методов радионуклидной визуализации может быть оправдано в случае подозрения на саркоидный миокардит (если данные МРТ сердца не позволяют это сделать). При подозрении на миокардит у пациента с саркоидозом может применяться сцинтиграфия миокарда с использованием таллия хлорида 199Tl и технеция [99mTс] сестамиби [94, 95, 133].
Позитронно-эмиссионная томография всего тела с применением флудезоксиглюкозы [18F] в редких случаях может применяться для диагностики саркоидоза сердца и системного саркоидоза (в неясных случаях) [134].
- Радионуклидные методы диагностики не рекомендуются для первичной диагностики миокардитов, т.к. обладают низкой специфичностью и меньшей доступностью, в отличие от МРТ сердца [38, 95, 226].
ЕОК IIIC (УУР С, УДД 5)
- Рекомендовано применение метода радионуклидной визуализации в случае диагностики саркоидного миокардита, если в этом есть необходимость [38, 95, 226].
ЕОК нет (УУР С, УДД 4)
МРТ
В современной практике метод МРТ парамагнитным контрастным средством (ПМКС) (препараты гадолиния) и картированием миокарда широко применяется в практике и позволяет существенно улучшить диагностику острого миокардита. На сегодняшний день она является самым информативным методом томографической визуализации очагов воспаления в миокарде, повреждения и некроза миоцитов, а также инструментом дифференциальной диагностики миокардитов от других болезней миокарда.
МРТ сердца с отсроченным контрастированием ПМКС позволяет определить участки миокарда, из которых целесообразно осуществить ЭМБ [55, 98]. Здоровый миокард в отсроченную фазу контрастирования (через 15-20 мин после введения ПМКС) уже не копит контрастное средство и имеет низкоинтенсивный сигнал на специальных МР-программах (импульсных последовательностях), с помощью которых обнуляется МР-сигнал от нормальной сердечной мышцы. Очаги острого воспаления, некроза и фиброза миокарда при миокардитах копят и длительно удерживают ПМКС [136]. В этом случае они видны при МРТ как очаги с высокой интенсивностью сигнала. Важной чертой этих очагов является определённый тип (паттерн) их расположения в миокарде: для них характерна субэпикардиальная, интрамиокардиальная или множественная локализация. При остром миокардите МРТ сердца с контрастированием может также выявлять признаки гиперемии пораженных участков миокарда, их отек или изменение в них величин времен магнитной релаксации Т1 и Т2, которые могут оцениваться с помощью программ картирования при МРТ.
Для диагностики миокардитов по данным МРТ были предложены специальные критерии "Озера Лейк-Луизы" (Lake-Louise Lake Criteria) [4, 100]. Ими являются:
- Локальный или диффузный отек миокарда, видимый на Т2-взвешенных изображениях (интенсивность сигнала считается увеличенной, если соотношение сигнала от миокарда к интенсивности сигнала от скелетных мышц ≥2,0) [99, 101, 102].
- Удлинение времени релаксации миокарда Т2 (по данным МР-картирования времен релаксации миокарда).
- Раннее контрастирование миокарда, визуализируемое на Т1-взвешенных изображениях после внутривенного введения ПМКС. Оно оценивается на основании соотношения интенсивности сигнала от сегментов миокарда к интенсивности сигнала от скелетных мышц. Его превышение ≥4 или усиление сигнала от миокарда более чем на ≥45% указывает на гиперемию и отек пораженного участка миокарда в острый период воспаления и свидетельствет о миокардите.
- Как минимум, один очаг отсроченного контрастирования в миокарде, видимый на Т1-взвешенных изображениях с подавлением сигнала от нормального миокарда через 15-20 мин введения ПМКС. В типичных случаях при миокардитах очаги отсроченного контрастирования множественные, имеют субэпикардиальную или интрамуральную локализацию. Субэпикардиальные и трансмуральные очаги контрастирования более характерны для острого инфаркта миокарда и рубцовых поражений, они соответствуют бассейнам пораженных коронарных артерий. При миокардитах распределение и протяженность очагов отсроченного контрастирования не соответствуют сосудистым бассейнам коронарных артерий.
- Удлинение времени релаксации миокарда Т1 или увеличение параметра рассчитанного внеклеточного объема (ECV), определенных по данным МР-картирования времен релаксации миокарда.
Дополнительными критериями являются признаки дисфункции миокарда и наличие экссудативного перикардита.
При наличии ≥2 критериев результаты МРТ свидетельствуют о наличии воспаления, характерного для миокардита.
При наличии 2 положительных критериев чувствительность и специфичность метода составляют 67% и 91%, соответственно.
При наличии только отсроченного контрастирования с ПМКС чувствительность и специфичность метода составляют 59% и 86%, соответственно [98, 100, 103-105].
Чувствительность метода снижается у пациентов с длительным течением заболевания и хроническим миокардитом, в особенности вне обострения [59, 106, 107].
Отсроченное контрастирование миокарда при МРТ обычно не позволяет дифференцировать острую и хроническую фазы воспаления, интерпретация данных в значительной степени будет зависеть от клинического состояния пациента [137]. Однако для острого миокардита характерно наличие признаков отека миокарда и его гиперваскуляризации (см. выше).
МРТ позволяет с высокой точностью количественно оценивать степень дилатации камер сердца, локальную или общую дисфункцию миокарда.
Прямое сравнение результатов ЭМБ и результатов МРТ сердца у 82 пациентов с положительным тропониновым тестом (исследование уровня тропонинов I, Т в крови), но отсутствием изменений в коронарных артериях показало, что отсроченное контрастирование миокарда соответствовало гистологически верифицированному активному миокардиту. ЭМБ была более информативна в случаях стертого течения миокардита. Комбинация 2 методов (ЭМБ и МРТ сердца с контрастированием) диагностически более значима, чем каждый из методов в отдельности.
Таким образом, МРТ с ПМКС является высокоинформативным методом визуализации при миокардитах [55]. Повторная МРТ сердца с контрастированием имеет смысл в тех случаях, когда клиническая картина соответствует миокардиту, но на первой МРТ патологические изменения либо не выявлены, либо зарегистрирован только один патологический признак. МРТ также целесообразна для оценки эффективности терапии при миокардите, т.к. позволяет одновременно оценить состояние миокарда, общую и локальную сократимость, и динамику прекардиальной экссудации.
- Рекомендованопроводить МРТ сердца с контрастированием ПМКС всем пациентам с целью подтверждения диагноза миокардита и дифференциальной диагностики [4, 59, 99-101,104-107].
ЕОК IIaC (УУР С, УДД 3)
Комментарии. МРТ сердца с контрастированием позволяет оптимизировать диагностику острого миокардита, а также определить участки миокарда, из которых целесообразно осуществить ЭМБ (при технической невозможности выполнения данного исследования в условиях медицинского учреждения обсуждена возможность госпитализации пациента в другое медицинское учреждение для выполнения данного исследования) [51, 94].
- Рекомендовано врачам-рентгенологам для верификации диагноза миокардита оценивать полученные при проведении МРТ сердца с контрастированием данные и вероятность миокардита по критериям "Lake-Louise Criteria" [4, 99-101, 104, 105, 107].
ЕОК IC УУР С, УДД 5
- Рекомендованорассмотреть возможностьпри тяжелом состоянии пациента (острая СН, жизнеугрожающие аритмии) с целью диагностики миокардита проведение МРТ сердца с участием врача-анестезиолога-реаниматолога [99, 100, 104, 105, 107].
ЕОК IIbC (УУР C, УДД 5)
МРТ сердца с контрастированием не заменяет диагностическую ценность ЭМБ, особенно у пациентов, находящихся в критически тяжелом состоянии. Выполнение МРТ сердца с контрастированием, как правило, должно предшествовать ЭМБ [99, 100, 104, 105, 107].
Компьютерная томография сердца и коронарных артерий
Компьютерная томография (КТ) сердца уступает МРТ в выявлении очагов поражения миокарда при миокардитах. В настоящее время изучаются методики КТ для диагностики воспалительных болезней миокарда (двухэнергетическая КТ, КТ с отсроченным контрастированием миокарда рентгеноконтрастными средствами), однако их применение пока ограничено экспертными центрами, имеющими опыт их проведения и трактовки.
В то же время КТ сердца и коронарных артерий может применяться как альтернатива инвазивной коронарной ангиографии для исключения ИБС и ОКС [94] — при необходимости. КТ сердца и коронарных артерий позволяет оценивать объемы камер сердца, общую и локальную сократимость миокарда.
Коронарография
- Рекомендовано выполнение коронарографии в рамках дифференциальной диагностики у пациента с подозрением на миокардит с целью исключения ОКС или ИБС как причину развития ХСН (при технической невозможности выполнения данного исследования в условиях медицинского учреждения должна быть обсуждена возможность госпитализации пациента в другое медицинское учреждение для выполнения данного исследования) [184].
ЕОК IIaC (УУР С, УДД 5)
2.5. Иные диагностические исследования
ЭМБ
ЭМБ миокарда соответствует уровню "золотого стандарта" диагностики миокардита [49]. Внедрение в практику Далласских критериев морфологической диагностики миокардитов позволило стандартизировать диагностические критерии и определить этиологическую причину развития миокардита — в частности, идентифицировать гигантоклеточный и некротизирующий эозинофильный миокардиты [22, 50, 51]. Точность диагностики зависит от количества биоптатов и их размера, однако отсутствие возможности в большинстве случаев осуществить прицельную биопсию миокарда при исходной мозаичности поражения миокарда снижает чувствительность и ценность этого метода. Чувствительность метода составляет 50% при получении и последующем анализе 4-5 образцов, а при анализе 17 биоптатов — 79% [144]. Рекомендуемый размер биоптатов составляет 1-2 мм. Минимальное количество биоптатов, позволяющее сформулировать диагностическое заключение — 3 [123]. ЭМБ осуществляется доступом через правую или левую яремные вены, подключичную вену, правую или левую бедренные артерии и вены. Место забора ЭМБ из ЛЖ или правого желудочков определяется по данным МРТ, представляющей врачу более точную информацию о локализации патологического процесса, чем решение, основанное на анализе клинической картины, позволяющее предполагать преимущественную локализацию воспалительного процесса по выраженности застоя в кругах кровообращения. Помимо окраски гистологических срезов гемотоксилином и эозином и анализа структуры ткани в световом микроскопе (патолого-анатомического исследования биопсионного материала), обязательно выполнение иммуногистохимического исследования биоптатов миокарда (патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов) с использованием антител к маркерам Т-лимфоцитов (CD3), клеткам моноцитарного происхождения (CD68), к HLA-DR (Определение HLA-антигенов) и др. Такой подход позволяет осуществить полноценное определение характеристики воспалительного инфильтрата. Обнаружение экспрессии HLA-DR (Определение HLA-антигенов) является маркером отсутствия инфекционного генеза развития миокардита и позволяет рассматривать аутоиммунный генез как основной. Эти данные позволяют рассмотреть начало иммуносупрессивной терапии [22, 78]. Выявление отложений фракций комплемента C3d и C4d в биоптатах миокарда используется для идентификации реакции отторжения при трансплантации сердца. В настоящее время это используется для верификации активации иммунной системы у пациентов с воспалительной кардиопатией [52, 108].
Диагностическая ценность ЭМБ ранее основывалась только на морфологических критериях. Далласские морфологические критерии основываются на трех патоморфологических изменениях в ткани миокарда: инфильтрации, миоцитолизе и отеке. В инфильтрате идентифицируются Т-лимфоциты и Т-лимфоциты-хелперы (≥7 CD3+ на 1 мм2 или 2 в поле зрения, CD4+), Т-супрессоры (CD8+), активированные Т-лимфоциты (CD45RO), моноциты и макрофаги (CD68+).
Наличие >14 лимфоцитов и моноцитов/макрофагов на 1 мм2 свидетельствует об активном воспалительном процессе в миокарде. Миокардит считается исключенным, если количество инфильтрирующих миокард клеток <14 на 1 мм2. Острый миокардит считается верифицированным при наличии ≥14 клеток инфильтрата на 1 мм2 биоптата миокарда в сочетании с признаками некроза и дистрофии кардиомиоцитов; хронический миокардит верифицируется при наличии ≥14 клеток инфильтрата на 1 мм2 биоптата, наличии фиброза, но отсутствии признаков некроза и дистрофии кардиомиоцитов [141, 142]. Принято выделять 4 степени выраженности фиброза (склероза) миокарда: 0 — отсутствие фиброза, 1 степень — незначительный, 2 степень — умеренный, 3 степень — выраженный фиброз [141]. Выраженность фиброза — прогностический критерий развития недостаточности кровообращения.
Далласские критерии не требовали проведения иммуногистохимического исследования (патолого-анатомического исследования биопсийного (операционного) материала с применением иммуногистохимических методов) и определения генома вируса. В настоящее время обязательно проведение молекулярного анализа с извлечением ДНК (дезоксирибонуклеиновая кислота), РНК и ПЦР-амплификацией вирусного генома, количественным определением вирусной нагрузки и темпов репликации вируса, позволяющего определить этиологию миокардита, [2, 5, 22, 52, 108].
Ранее при проведении ЭМБ в 6% случаев возникали осложнения, из них в 0,1-0,5% случаев — перфорация и тампонада сердца [109, 110]. Выполнение процедуры опытными специалистами в настоящее время позволяет снизить этот показатель до уровня 0-0,8% [2, 3, 107, 111].
Определение клинического фенотипа пациента позволяет врачу определиться с показаниями к проведению ЭМБ.
Повторные проведения ЭМБ не являются рутинной практикой. Их целесообразность должна обсуждаться, если возникли обоснованные предположения о несоблюдении требований к ЭМБ, отсутствии единого мнения у врачей-патологоанатомов, отсутствии эффекта от проводимой этиотропной терапии или отсутствия эффекта от лечения у пациента с прогрессирующей СН неизвестной этиологии.
Рекомендовано при наличии показаний (табл. 8) проводить ЭМБ с последующим патологоанатомическим исследованием биопсийного материала с обязательным применением иммуногистохимических методов (Патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов) и проведением реакции ПЦР при технической невозможности выполнения данного исследования в условиях медицинского учреждения обсуждена возможность госпитализации пациента в другое медицинское учреждение для выполнения данного исследования [2, 5, 22, 52, 108].
Таблица 8
Показания к проведению ЭМБ
|
Клинические ситуации |
|
Гемодинамически нестабильные пациенты с клиникой СН <2 нед. с нормальным или дилатированным ЛЖ |
|
Пациенты с клиникой впервые возникшей СН продолжительностью от 2 нед. до 3 мес. с дилатированным ЛЖ, рецидивирующими желудочковыми аритмиями, AV-блокадами II-III степени или отсутствием ответа на проводимую рекомендованную терапию в течение 1-2 нед. |
|
Пациенты с клиникой впервые возникшей СН продолжительностью >3 мес. с дилатированным ЛЖ, рецидивирующими желудочковыми аритмиями, AV-блокадами II-III степени или отсутствием ответа на проводимую рекомендованную терапию в течение 1-2 нед. |
|
Клиника СН у пациентов с дилатацией полостей сердца, ассоциированная с аллергическими реакциями и/или эозинофилией |
|
Клиника СН у пациентов с указанием в анамнезе на терапию антрациклиновыми препаратами (Антрациклины и родственные соединения) |
|
СН, ассоциированная с неустановленными причинами развития рестриктивной кардиомиопатии |
|
Подозрение на опухоль сердца |
|
Неустановленные причины кардиомиопатии у детей |
|
Пациенты с клиникой впервые возникшей СН продолжительностью от 2 нед. до 3 мес. с дилатированным ЛЖ, без желудочковых аритмий, без AV-блокад II-III степени и имеющие положительную динамику в ответ на проводимую рекомендованную терапию в течение 1-2 нед. |
|
Пациенты с клиникой впервые возникшей СН продолжительностью >3 мес. с дилатированным ЛЖ, без желудочковых аритмий, без AV-блокад II-III степени и имеющие положительную динамику в ответ на проводимую рекомендованную терапию в течение 1-2 нед. |
|
Недостаточность кровообращения, ассоциированная с неустановленными причинами развития гипертрофической кардиомиопатии |
|
Клинически обоснованное предположение о возможной аритмогенной правожелудочковой дисплазии/кардиопатии |
|
Неустановленные причины желудочковых аритмий |
|
Неустановленные причины фибрилляции предсердий |
Сокращения: ЛЖ — левый желудочек, СН — сердечная недостаточность, AV — атриовентрикулярный.
ЕОК нет (УУР С, УДД 4)
- Рекомендовано врачам формировать диагностическое заключение для диагностики миокардита на основании исследования ЭМБ только при наличии не менее 3 образцов размером 1-2 мм [145].
ЕОК IC (УУР С, УДД 4)
- Рекомендовано проведение реакции ПЦР как в образцах ткани миокарда, так и в образцах периферической крови, с целью выявления ДНК вируса. Для проведения ПЦР необходимо обработать образцы ткани жидким азотом и хранить при температуре –80 °C [22].
ЕОК нет (УУР С, УДД 5)
Для диагностики постковидного миокардита следует использовать МРТ сердца с контрастированием и в случаях стойкой систолической дисфункции миокарда — ЭМБ в экспертных центрах.
-
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Проспективные, контролируемые полномасштабные исследования по оценке эффективности лечения миокардитов и влиянию на прогноз не проводились. Существующие рекомендации основаны только на мнении экспертов [40, 112, 113]. Современный основополагающий принцип в лечении миокардитов: "лечение миокардитов должно проводиться в соответствии с текущими рекомендациями по лечению острой и хронической сердечной недостаточности" [146]. Лечение миокардитов направлено на:
— неотложную коррекцию жизнеугрожающих состояний (рефрактерная недостаточность кровообращения, нарушения ритма и проводимости сердца);
— коррекцию хронических проявлений недостаточности кровообращения, обусловленной дисфункцией миокарда и нейрогуморальной активацией;
— специфическое этиопатогенетическое воздействие на вирусную инфекцию и иммунное воспаление.
3.1. Консервативное лечение миокардитов
Лечение миокардита у пациентов с нестабильной гемодинамикой
Госпитализация таких пациентов должна осуществляться в крупные стационары, где есть возможность наблюдения за пациентом в условиях реанимационного отделения, оснащенного аппаратами для сердечно-легочной реанимации (Аппарат для непрямого массажа сердца LUCAS 2 с принадлежностями) и проведения искусственной вентиляции легких (ИВЛ) (Аппарат искусственной вентиляции легких). В дебюте миокардита нестабильная гемодинамика может развиться при любой его форме, но чаще всего резкое ухудшение гемодинамических показателей, развитие кардиогенного шока, несмотря на проводимую симптоматическую медикаментозную терапию, сопровождает молниеносный (фульминантный) миокардит. Правильность принятия решения о месте наблюдения такого пациента (в первую очередь с учетом оснащенности отделения) приобретает жизнеспасающий характер, т.к. подключение аппарата вспомогательного кровообращения или проведение процедуры экстракорпоральной мембранной оксигенации (ЭКМО) позволяет спасти жизнь или выиграть время, необходимое для решения вопросов, связанных с трансплантацией сердца [114, 115].
Смертность при молниеносных миокардитах в различных клинических группах составляет 20-40%. У большинства пациентов, оставшихся в живых после острой фазы молниеносного миокардита, наблюдается восстановление сократительной функции желудочков. Следовательно, комбинация симптоматической медикаментозной терапии и использования устройств для механической поддержки гемодинамики (Аппарат внутриаортальной баллонной контрпульсации) (при неэффективности только медикаментозной терапии) является базовым принципом лечения пациентов в дебюте острого миокардита с нестабильной гемодинамикой или кардиогенным шоком [114, 115].
Организация оказания медицинской помощи пациентам с молниеносным (фульминантным) острым миокардитом и нестабильными гемодинамическими показателями — см. Раздел 6.
Общие принципы и тактика ведения пациентов с острым миокардитом, госпитализированных с нестабильной гемодинамикой
- При верификации у пациентов с острым миокардитом признаков кардиогенного шока/дыхательной недостаточности необходимо немедленно начать мероприятия по гемодинамической или респираторной поддержке. Для стабилизации гемодинамических параметров или обеспечения адекватной вентиляции, что предотвращает дальнейшее ухудшение состояния и развитие осложнений [116, 117].
Дальнейшая тактика лечения и выбор препаратов основывается на определении гемодинамического профиля пациента (классификация J. S. Forrester и L. W. Stevenson) "влажный — холодный"/"сухой — теплый" (Приложение Б) [116, 117].
- Катетеризация магистральных сосудов (Катетеризация подключичной и других центральных вен) и инвазивный контроль параметров гемодинамики показаны пациентам с острым миокардитом только при кардиогенном шоке или рефрактерной к терапии недостаточности кровообращения и невозможности устранения симптомов [116, 117].
Определение уровня натрийуретических пептидов (Исследования уровня NT-proBNP) и анализ последующей динамики обязательны. При уровне NT-proBNP <300 пг/мл недостаточность кровообращения, обусловленная острым миокардитом, практически невероятна. Однако следует помнить, что низкий уровень NT-proBNP может свидетельствовать о крайне тяжелом (терминальном) состоянии пациента с острым миокардитом либо присоединении правожелудочковой недостаточности, например после тромбоэмболии легочной артерии.
- Рекомендованапульсоксиметрия (чрескожное мониторирование насыщения крови кислородом) для контроля состояния пациента [184, 118, 119].
ЕОК нет (УУР С, УДД 4)
- Рекомендуется проводить ингаляторное введение кислорода (оксигенотерапию) у пациентов с миокардитом при SpO2<90% или PaO2<60 мм рт.ст. с целью коррекции гипоксемии [184, 118, 119].
ЕОК нет (УУР С, УДД 5)
- Не рекомендовано проведение оксигенотерапии всем пациентам рутинно, т.к. приводит к развитию вазоконстрикции и снижению сердечного выброса при отсутствии гипоксемии [184, 118, 119].
ЕОК нет (УУР С, УДД 5)
- Рекомендовано у пациентов с развившимся респираторным дистресс-синдромом (частота дыхательных движений >25 в минуту, SpO2<90%) неинвазивную ИВЛ с положительным давлением (CPAP-терапия и BiPAP-терапия) начать в обязательном по- рядке в максимально ранние сроки от момента гос- питализации с целью уменьшения выраженности респираторного дистресса [184]. На фоне проводимой неинвазивной вентиляции возрастает риск развития гипотонии.
ЕОК нет (УУР С, УДД 5)
- Рекомендуется проводить интубацию трахеи и перевод на ИВЛ у пациентов с миокардитом при дыхательной недостаточности, сопровождающейся гипоксемией (PaO2<60 мм рт.ст.), гиперкапнией (PaCO2>50 мм рт.ст.) и ацидозом (pH <7,35) [184].
ЕОК нет (УУР С, УДД 5)
Принципы назначения диуретической терапии пациенту с острым миокардитом и нестабильной гемодинамикой
- Рекомендовано начать диуретическую терапию только при очевидных признаках гипергидратации у пациентов с острым миокардитом при наличии периферических отеков или отеке легких [150-152].
ЕОК нет (УУР С, УДД 5)
Диуретическая терапия подразумевает выбор одной из двух тактик введения петлевого диуретика: болюсного или непрерывного внутривенного капельного введения. В исследовании DOSE [153] сравнивалась эффективность двух тактик при использовании высоких (200 мг) и низких (80 мг) доз петлевых диуретиков. Высокие дозы фуросемида** в сравнении с низкими дозами были более эффективны и позволяли быстрее добиваться увеличения диуреза и уменьшения дыхательной недостаточности, но достоверно чаще вызывали транзиторное повреждение почек. Не найдено клинического различия между тактиками болюсного или непрерывного внутривенного капельного введения петлевого диуретика. В исследовании ROSE-AHF (Renal Optimization Strategies Evaluation in Acute Heart Failure) [154] анализ динамики маркеров повреждения канальцев почек (N-ацетил-β-d-глюкозаминидаза; липокалин, ассоциированный с нейтрофильной желатиназой и молекулы повреждения почек 1 типа) у 283 пациентов с декомпенсацией кровообращения в течение 72 ч на фоне высоких доз фуросемида** (медиана доз 560 мг в/в, индивидуальные колебания от 300 до 815 мг) не выявил ухудшения канальцевой фильтрации, хотя ухудшение функции почек произошло у 21,2% пациентов. Это исследование показало, что короткая и агрессивная мочегонная терапия не приводит к необратимым изменениям в канальцах.
Применение торасемида предпочтительней применения фуросемида** у пациентов с декомпенсацией ХСН [124, 125, 155], т.к. на фоне применения торасемида повышение уровня креатинина и снижение фильтрационной функции почек регистрировались достоверно реже. Анализ отдаленных результатов показал, что терапия торасемидом, но не фуросемидом** приводила к снижению риска повторных госпитализаций из-за декомпенсации ХСН [124, 125, 155]. Клинический опыт, полученный в ходе анализа тактик мочегонной терапии [150], данные субанализа исследования ASCEND-HF [151] и оценка долгосрочного прогноза [150] показывают, что "плавная и продолжительная" тактика мочегонной терапии по сравнению с тактикой "интенсивная и короткая" в отдаленном периоде приводит к снижению повторных госпитализаций [167] и меньшему повреждению функции почек.
Развитие рефрактерности к петлевым диуретикам — нередкое явление при старте мочегонной терапии.
- Рекомендовано для преодоления рефрактерности к петлевым диуретикам пациентам с миокардитом использовать следующие тактики [184, 156]:
а) Комбинированное назначение петлевого диуретика и ингибитора карбоангидразы (ацетазоламида**).
Применение ацетазоламида** приводит к:
- смещению pH мочи в кислую сторону. Снижение pH мочи усиливает мочегонный эффект петлевых диуретиков [156];
- снижает реабсорбцию Na+в проксимальных канальцах; следовательно, увеличивает концентрацию катионов Na+в восходящей зоне петли Генле, что позволяет петлевым диуретикам усилить натрийурез и, соответственно, объём выводимой жидкости [156].
Важно помнить, что увеличение концентрации катионов Na+ в первичной моче приведет к влиянию на macula densa и активации канальцево-клубочкового механизма обратной связи, т.е. уменьшит внутриклубочковую гипертензию и гиперфильтрацию клубочков. Этот механизм защиты почек важен в период нестабильной гемодинамики пациента.
б) Рекомендовано комбинированное назначение петлевого диуретика и антагонистов минералокортикоидных рецепторов (АМКР) у пациентов с признаками задержки жидкости.
ЕОК нет (УУР С, УДД 2)
- Рекомендовано применять высокие дозы АМКР 150-300 мг у пациентов с острым миокардитом для преодоления рефрактерности к диуретикам, хотя это и сопряжено с высоким риском развития гиперкалиемии и требует постоянного мониторинга электролитов крови и уровня креатинина [129, 184].
ЕОК нет (УУР С, УДД 5)
в) Рекомендовано пациентам с острым миокардитом при неэффективности медикаментозных методов применять ультрафильтрацию крови [184, 160].
ЕОК нет (УУР С, УДД 5)
Принцип назначения вазодилататоров для лечения заболеваний сердца пациенту с острым миокардитом и нестабильной гемодинамикой
Венодилатация снижает преднагрузку и давление в малом круге кровообращения, купируя симптомы отека легких. Дилатация артериол снижает постнагрузку. Вазодилататоры для лечения заболеваний сердца (C01D) (далее — вазодилататоры) позволяют осуществить одномоментное воздействие на вены и артериолы, улучшая сократительную функцию пораженного воспалением миокарда.
Следует придерживаться следующих доз и схем вве- дения препаратов:
— Нитроглицерин**: стартовая доза 8-16 мкг/мин с последующим увеличением до 166 мкг/мин;
— Изосорбида динитрат**: стартовая доза 1 мг/ч с последующим увеличением до 10 мг/ч;
— Нитропруссид натрия дигидрат: стартовая доза 0,3 мкг/кг/мин с последующим увеличением до 5 мкг/кг/мин.
- Рекомендуется проводить терапию вазодилататорами (нитроглицерин**, изосорбида динитрат**, нитропруссид натрия дигидрат) у пациентов с миокардитом только при наличии застоя в малом круге кровообращения, отека легких и исходном уровне систолического АД >90 мм рт.ст. [184].
ЕОК нет (УУР С, УДД 5)
Принцип назначения препаратов с положительным инотропным влиянием пациенту с острым миокардитом и нестабильной гемодинамикой
В реальной клинической практике при нестабильной гемодинамике применяются: адренергические и дофаминергические средства (катехоламины) (C01CA) (допамин** (C01CA04), добутамин** (C01CA07)); инотропные препараты с вазодилатирующим эффектом (левосимендан** (Другие кардиотонические средства)), сердечные гликозиды.
- Рекомендовано начинать инотропную терапию у пациентов с острым миокардитом и нестабильной гемодинамикой при верифицированном низком сердечном выбросе, стойкой гипотонии, явлениях застоя, рефрактерных к терапии вазодилататорами или диуретиками, очевидных признаках гипоперфузии периферических тканей и органов, не купируемых препаратами других классов. Исключение гиповолемии — обязательное условие начала терапии [184, 163].
ЕОК нет (УУР B, УДД 2)
Продолжительность применения препаратов с положительным инотропным эффектом строго ограничена периодом гипоперфузии и стойкой гипотонии (исключением из правила является препарат диго- ксин**), т.к. длительное применение препаратов с положительным инотропным эффектом ухудшает прогноз пациента с недостаточностью кровообращения [139, 140].
- Рекомендуется начинать внутривенное введение негликозидных инотропных препаратов (адренергические и дофаминергические средства C01CA) у пациентов с миокардитом с низких доз, постепенно повышая их под контролем ЧСС, ЭКГ и АД, поскольку развитие тахикардии, аритмий и ишемии миокарда является частым осложнением данной терапии [166].
ЕОК нет (УУР B, УДД 2)
Комментарии. В отечественной практике чаще других назначаются допамин** и эпинефрин** (Адренергические и дофаминергические средства C01CA), применение эпинефрина** часто обусловлено развитием гипотонии и шоком у пациентов с миокардитом. Стратегия выбора доз допамина** основана на следующем: допамин** в малых дозах (1-3 мкг/кг/мин) оказывает допаминергический эффект и стимулирует диурез, допамин** в больших дозах (>5 мкг/кг/мин) стимулирует бета- и альфа-адренорецепторы, что приводит к развитию тахикардии и вазоконстрикции. Добутамин** имеет те же показания и используется в следующих дозировках: 2-20 мкг/кг/мин. Эпинефрин** имеет те же показания и используется в следующих дозировках: 0,2-1,0 мкг/кг/мин. Назначение эпинефрина** в дозе 1 мг целесообразно в случае реанимационных мероприятий. Повторные инъекции возможны через 3-5 мин. В обычных ситуациях препарат вводится в дозе 0,05-0,5 мкг/кг/мин.
Анализ отдалённых исходов у пациентов, находившихся на длительной терапии допамином** из-за рефрактерной к терапии гипотонии и гиперволемии, показал, что применение низких доз допамина** не сопряжено с улучшением функции почек, но не ухудшает отдалённый прогноз у выживших в остром периоде пациентов [142, 143, 167].
В остром периоде вирусного миокардита применение дигоксина** не желательно [50], т.к. терапия дигоксином** увеличивает синтез провоспалительных цитокинов в миокарде и возможно усиление воспаления миокарда (данные получены в эксперименте на мышах) [168].
Терапия инотропным препаратом с вазодилатирующим эффектом левосименданом** (Другие кардиотонические средства) в исследовании SURVIVE [169] не выявила преимуществ по сравнению с добутамином**, а в серии исследований REVIVE I и II клинический эффект препарата, оцененный по влиянию на риск развития летального исхода, не отличался от плацебо. Кроме этого, результаты субанализа выявили рост риска смерти на терапии левосименданом** у пациентов с исходно низким систолическим давлением (<100 мм рт.ст.). Эти данные требуют особо тщательного подхода к выбору препарата для коррекции гипоперфузии у пациента с нестабильной гемодинамикой [170].
Целесообразность применения глюкокортикоидов (ГКС) в остром периоде миокардита при нестабильной гемодинамике
В реальной клинической практике ошибочное назначение ГКС-терапии (ГКС H02AB) пациентам с нестабильной гемодинамикой происходит часто и может представлять угрозу их жизни.
Следует различать 2 клинических фенотипа пациентов с острым миокардитом:
- вирус-негативный— вирус-негативная воспалительная кардиомиопатия (эозинофильный, гранулематозный, гигантоклеточный миокардит и лимфоцитарный миокардит, ассоциирующийся с системными заболеваниями соединительной ткани, миокардит при реакции отторжения трансплантированного сердца);
- вирус-позитивный— вирус-ассоциированная воспалительная кардиомиопатия.
Назначение ГКС (H02AB) пациентам с острым мио- кардитом не показано, за исключением аутоиммунного, эозинофильного, гранулематозного и гигантоклеточного миокардитов.
В рандомизированном проспективном двойном слепом одноцентровом исследовании TIMIC [171] применение преднизолона** и азатиоприна** у пациентов с вирус-негативной воспалительной кардиомиопатией привело к увеличению ФВ ЛЖ и уменьшению конечно-диастолического размера и конечно-систолического размера (КСР) ЛЖ у 88% пациентов (38 из 43 леченных) по сравнению с ухудшением сократительной функции сердца у 83% пациентов, получавших плацебо (35 из 42 получавших плацебо). Отсутствие эффекта в 100% случаев можно объяснить либо наличием невыявленных вирусов, либо присутствием механизмов повреждения и воспаления, нечувствительных к иммуносупрессии.
Эти данные подтверждаются результатами системного обзора (Cochrane Database of Systematic Reviews 2013) [172]. Применение ГКС у 719 пациентов с вирусным миокардитом (только у 38% верифицировалось наличие вирусной инфекции) не привело к достоверному снижению смертности по сравнению с пациентами, не получавшими это лечение (относительный риск =0,93, 95% доверительный интервал (ДИ): 0,70-1,24); однако уровень МВ-фракции креатинфосфокиназы был ниже на 10 U/L (MD =10,35 U/L, 95% ДИ: 8,92-11,78). Через 3 мес. ФВ ЛЖ была на 7% выше у получавших лечение ГКС (MD =7,36%, 95% ДИ: 4,94-9,79). ФК недостаточности кровообращения и КСР ЛЖ не различались у пациентов, получавших и не получавших лечение ГКС (H02AB). Наибольший эффект от лечения отмечался в детском возрасте.
Приведенные данные показывают трудность принятия решения о начале терапии ГКС (H02AB) в период дебюта болезни, когда этиология миокардита неясна.
ГКС (H02AB) пациенту в остром периоде миокардита с нестабильной гемодинамикой могут быть назначены при наличии морфологически подтвержденного гигантоклеточного, эозинофильного и гранулематозного миокардита, а также критериально доказанного аутоиммунного миокардита при смешанном заболевании соединительной ткани [172].
Во всех остальных случаях решение о назначении иммуносупрессивной терапии должно приниматься при неэффективности стандартной терапии у пациентов с умеренной или тяжелой СН, жизнеопасными нарушениями ритма и/или проводимости только при наличии гистологического и иммуногистохимического подтверждения воспалительного заболевания миокарда, а также при отсутствии вирусного генома в биоптатах миокарда.
Абсолютными данными могут быть только результаты гистохимического анализа биоптатного материала (Патолого-анатомическое исследование биопсийного (операционного) материала почки с применением гистохимических методов).
В отсутствие этих данных только консилиум может учесть анамнестические или иные данные (количество эозинофилов, молниеносность развития симптомов и т.д.) для принятия решения о начале ГКС-терапии (H02AB).
Тактика коррекции нарушений ритма и проводимости в остром периоде миокардита
Неблагоприятный прогноз у пациентов с миокардитом как в остром, так и в отдаленном периоде болезни во многом обусловлен развитием рефрактерных, злокачественных желудочковых тахиаритмий (градации III и выше по классификации Lown-Wolf).
Каких-либо специальных исследований по лечению жизнеугрожающих аритмий при миокардитах нет. Мнение экспертов по этой проблеме сформировано на основании экспериментальных работ.
В повседневной клинической практике целесообразно руководствоваться текущими рекомендациями Европейского общества кардиологов (European Society of Cardiology) по лечению аритмий и профилактике внезапной смерти [173]. Опыт, полученный в реальной клинической практике, позволил выделить следующие прогностически неблагоприятные ситуации, характерные для дебюта миокардита и предшествующие возникновению угрожающих аритмий:
- синусовая брадикардия,
- увеличение продолжительности комплекса QRS,
- увеличение площади зон гипокинеза ЛЖ,
- постоянно повышенный или колеблющийся уровень тропонина [173].
Важно помнить, что улучшение параметров гемодинамики не исключает высокой вероятности развития опасных аритмий из-за сформировавшихся и необратимых зон фиброза в миокарде. Риск развития аритмий у пациента с миокардитом как в остром периоде болезни, так и в последующие периоды остается очень высоким и требует специального лечения.
- Рекомендовано применение антиаритмической терапиитолько у пациентов с опасными для жизни и симптомными желудочковыми нарушениями ритма сердца [113, 147, 175].
ЕОК нет (УУР С, УДД 5)
- Рекомендовано избегать у пациентов с СН назначения антиаритмических препаратов I класса (блокаторов натриевых каналов) (Антиаритмические препараты, класс IC, C01BC) и антиаритмических средств IV класса (блокаторов кальциевых каналов, C08)[184].
ЕОК нет (УУР C, УДД 5)
Назначение антиаритмической терапии у пациентов с острым миокардитом имеет ряд существенных отличий и целесообразно в первую очередь пациентам с симптомной неустойчивой желудочковой тахикардией в острой фазе миокардита [91, 145].
Назначение бета-адреноблокаторов, которые являются средством выбора в лечении пациентов с ХСН, пациентам в дебюте острого миокардита с желудочковыми нарушениями сердечного ритма, ассоциировано с неблагоприятным прогнозом [3, 176, 177].
- Не рекомендуетсяприменение бета-адреноблокаторов (С07AB) для лечения пациентов в раннюю фазу фульминантного миокардита[176].
ЕОК нет (УУР С, УДД 4)
- Рекомендуется для антиаритмического лечения рассмотреть возможность применения амиодарона** [147, 149, 184], а при его противопоказанности — соталола**.
ЕОК нет (УУР С, УДД 5)
Комментарии. Известно, что амиодарон** — препарат первой линии в лечении жизнеугрожающих нарушений ритма сердца, приводящий к снижению риска внезапной смерти, в постинфарктном периоде у пациентов с очевидными симптомами недостаточности кровообращения. Анализ эффективности амиодарона** у пациентов в период декомпенсации кровообращения показал, что риск внезапной смерти у пациентов со стойкими желудочковыми аритмиями снизился на 28,4%, а риск сердечно-сосудистой смертности — на 18,2%, при этом амиодарон** не оказал влияния на общую смертность [178]. В аспекте лечения пациентов с острым миокардитом важно помнить, что амиодарон** продемонстрировал свое влияние на снижение риска внезапной смерти только в сочетании с бета-адреноблокаторами [179]. При длительной терапии поддерживающая доза амиодарона** составляет 100-200 мг/сут. per os, а контроль длины интервала QT и функции щитовидной железы обязательны. В остром периоде миокардита индивидуальная оценка соотношения "польза/риск" должна предшествовать началу терапии:
- назначение препарата пациенту без жизнеугрожающей аритмии с целью первичной профилактики внезапной смерти бессмысленно;
- при прогрессировании симптомов недостаточности кровообращения амиодарон** может увеличить риск развития летального исхода, что требует непрерывного мониторинга ЭКГ (Суточное прикроватное мониторирование жизненных функций и параметров) пациента, т.е. наблюдения в условиях реанимационного отделения [174].
При непереносимости амиодарона** или невозможности его назначения в качестве альтернативы рассматривается соталол**. Соталол** — антиаритмический препарат III класса (Антиаритмические препараты, классы III C01BD), имеющий свойства бета-адреноблокаторов (помнить при начале лечения миокардита) [180], который практически идентичен по клинической эффективности амиодарону**, но обладает большим проаритмогенным эффектом у пациентов со сниженной сократительной функцией миокарда [181]. Старт терапии соталолом** требует знания скорости клубочковой фильтрации, т.к. препарат противопоказан при клиренсе креатинина <40 мл/мин. Стартовая доза соталола** — 40 мг 2 раза/сут. Максимальная доза — 160 мг 2 раза/сут. С увеличением дозы препарата и тяжести недостаточности кровообращения возрастает проаритмогенный риск [181]. В настоящее время нет контролируемых проспективных клинических исследований по оценке безопасности и эффективности соталола** у пациентов с ХСН, что приравнивает рекомендации к уровню "мнение экспертов".
При молниеносных миокардитах не следует использовать постоянные ЭКС***, имплантируемые кардиовертеры-дефибрилляторы*** (ИКД) и проведение сердечной ресинхронизирующей терапии до разрешения острой ситуации и повторной оценки необходимости этих манипуляций и их применения [173].
- Рекомендуется при молниеносных миокардитах использование временного ЭКС*** и носимых ИКД*** [173].
ЕОК нет (УУР С, УДД 5)
- Использование носимых ИКД*** рекомендуется сохранять либо до полного исчезновения аритмий и восстановления сократительной функции миокарда, либо до имплантации постоянного ИКД*** в период через 1-3 мес. после завершения острого периода миокардита [173].
ЕОК нет (УУР С, УДД 5)
Комментарии. Имплантация кардиостимулятора постоянного ИКД*** целесообразна только в том случае, когда сохраняются нарушения гемодинамики и устойчивые желудочковые жизнеугрожающие нарушения ритма, а ожидаемая продолжительность жизни пациента больше одного года. Важно учесть, что процедура должна сохранить или улучшить качество жизни пациента [173].
- Имплантация кардиостимулятора ИКД*** или ЭКС*** у пациентов с воспалительной кардиомиопатией рекомендуется после разрешения острой стадии миокардита[146].
ЕОК нет (УУР С, УДД 5)
Комментарии. Прогноз относительно жизни у пациентов с гигантоклеточным миокардитом и саркоидозом сердца из-за высокой вероятности развития ре-фрактерного электрического шторма с устойчивой желудочковой тахикардией и фибрилляцией желудочков всегда тяжелый. Этот факт требует проведения постоянной агрессивной антиаритмической терапии и имплантации кардиостимулятора ИКД*** в максимально ранние сроки [182].
Пациентам с гигантоклеточным миокардитом и саркоидозом, у которых зафиксированы гемодинамически значимые устойчивые желудочковые нарушения ритма сердца или успешная реанимация по поводу остановки кровообращения, имплантация кардиостимулятора ИКД*** возможна в более ранние сроки, если ожидаемая продолжительность жизни пациента больше одного года.
При принятии решения об имплантация кардиостимулятора постоянного ИКД*** важно учесть, что у пациента, перенесшего острую фазу миокардита, наличие персистирующих воспалительных инфильтратов в миокарде, выявленных при исследовании ЭМБ, наличие больших зон фиброза, "аномально" расположенных полей фиброза в зонах проводящих путей, выявленных при проведении МРТ, риск развития внезапной смерти остается высоким [183].
Имплантация кардиостимулятора для ресинхронизирующей терапии с функцией дефибриллятора показана при недостаточности кровообращения >II ФК NYHA с ФВ ЛЖ ≤35% в сочетании с блокадой левой ножки пучка Гиса и должна проводиться в соответствии с рекомендациями по лечению ХСН [184].
Применение нестероидных противовоспалительных (НПВП) и противоревматических препаратов у пациентов с острым миокардитом
Каких-либо специальных исследований по применению НПВП в лечении миокардитов нет. Мнение экспертов по этой проблеме сформировано на основании экспериментальных работ [185]. Вопрос о применении НПВП становится актуальным только при присоединении перикардита, сопровождающегося болевым симптомом. В такой ситуации, при отсутствии выраженных нарушений сократительной способности миокарда, возможно рассмотреть вопрос о применении минимальных доз максимально коротким курсом.
- Применение НПВП не рекомендовано для лечения миокардита, за исключением случаев острого миокардита в сочетании с сухим/экссудативным перикардитом: в этом случае может быть показано назначение НПВП (ибупрофен** per os1200 мг/сут. на 2-4 нед.) [185].
ЕОК нет (УУР С, УДД 5)
Тактика применения антикоагулянтов (Антитромботических средств) в остром периоде миокардита
При остром миокардите из-за дилатации желудочков, вынужденного резкого ограничения объёма нагрузок, обязательного постельного режима, интенсивной дегидратационной терапии развивается стаз крови в полостях сердца, периферических венах и возрастает риск как периферического венозного, так и внутрисердечного тромбоза. Сформировавшиеся тромбы становятся источником многочисленных венозных и артериальных тромбоэмболий. Специальных исследований по изучению частоты развития тромбозов у пациентов с острым миокардитом не проводилось, но известно, что примерно у трети пациентов с выраженной симптоматикой недостаточности кровообращения имеются признаки тромбоза глубоких вен голени, а у каждого двадцатого была эмболия легочной артерии. Опыт повседневной практики позволяет считать справедливым следующее утверждение: чем ниже ФВ и тяжелее недостаточность кровообращения, тем более вероятен тромбоз и эмболии. Следовательно, острый миокардит с нестабильной гемодинамикой должен рассматриваться как состояние, при котором возрастает риск тромбозов и тромбоэмболий, а применение антикоагулянтов (Антитромботических средств) должно являться обязательным компонентом лечения пациента [158, 159].
Данные исследования MEDINOX позволяют считать, что у пациентов, находящихся на постельном режиме, риск развития тромбозов и эмболий достоверно снижается на фоне терапии низкомолекулярным гепарином — Эноксапарином натрия** (Группа гепарина B01AB) в дозе 40 мг в сут. подкожно в течение 2 нед. [160, 161]. Наблюдение за пациентами в течение 4 мес. показало, что риск тромбозов и эмболий у них был на 60% ниже по сравнению с группой пациентов, не получавших лечение. Положительный эффект, но менее выраженный, чем у Эноксапарина натрия** (B01AB05), описан у далтепарина натрия [160, 162].
Пациентам с острым миокардитом, осложненным недостаточностью кровообращения, и развитием низкой ФВ ЛЖ (<35%), получающим интенсивную диуретическую терапию, целесообразно рассмотреть: возможность соблюдения постельного режима в течение не менее 3 сут., а также терапию группой гепарина (низкомолекулярными гепаринами) (B01АВ) в течение 1-2 нед. [160, 162].
- Пациентам с тромбозом глубоких вен голени, развившимся в остром периоде миокардита, рекомендован перевод на терапию варфарином** на срок до 3 мес., а при повторных венозных тромбозах — осуществлять такую терапию неограниченно долго [186].
ЕОК нет (УУР С, УДД 5)
Из-за высокого риска развития кровотечения в современной клинике вместо схемы "низкомолекулярный гепарин (группа гепарина) с последующим переводом на варфарин**" используются альтернативные схемы, исключающие как низкомолекулярный гепарин (группа гепарина), так и варфарин**. Это терапия одним из ингибиторов Xа фактора (прямые ингибиторы фактора Ха B01AF): либо ривароксабаном** (15 мг 2 раза/сут. в течение 21 дня с переводом на 20 мг 1 раз/сут. до 3 мес.), либо апиксабаном** (10 мг 2 раза/сут. в течение 7 дней с переводом на 5 мг 2 раза/сут. до 3 мес.).
Описанная тактика позволяет достигать такой же клинической эффективности в лечении тромбозов при достоверно меньшем риске развития кровотечения [164, 165, 187].
Каждый пятый пациент с выраженными клиническими проявлениями СН имеет тромбы в полости ЛЖ. Количество пациентов с наличием тромбов в полостях желудочков сердца достоверно возрастает (примерно в 2 раза) при снижении ФВ ЛЖ <40% [186]. Таким пациентам показано применение варфарина**. Хотя эти исследования и выполнены у пациентов с синусовым ритмом, наличием постинфарктного кардиосклероза и аневризмы ЛЖ, они могут быть транслированы на пациентов с острым миокардитом и сформировавшимся тромбом в полости желудочков сердца.
- Рекомендованоприменение варфарина** у пациентов с острым миокардитом и сформировавшимся тромбом в полости желудочков сердца[186].
ЕОК нет (УУР С, УДД 5)
Комментарии. Назначение варфарина** с профилактической целью пациентам с синусовым ритмом, симптомами СН и низкой ФВ ЛЖ, но без выявленных внутрисердечных тромбов, является сложным вопросом, который не имеет однозначного ответа относительно эффективности снижения риска развития тромбов в полостях сердца. В исследовании WARCEF [188] варфарин** не имел преимуществ в снижении риска смерти у пациентов с ХСН и синусовым ритмом по сравнению с ацетилсалициловой кислотой**, но приводил к снижению риска развития инсульта на 48% и к такому же росту риска развития тяжелого кровотечения. Анализ эффективности варфарина** в различных возрастных группах показал, что эффект от лечения варфарином** зависит от возраста пациента. В возрастной группе моложе 60 лет варфарин** в сравнении с ацетилсалициловой кислотой** достоверно на 37% снижал риск развития комбинированной первичной точки: риск летального исхода или ишемического инсульта. Эти данные могут быть учтены при принятии решения о целесообразности начала терапии варфарином** у пациентов с острым миокардитом моложе 60 лет с выраженной симптоматикой недостаточности кровообращения и высоким рис- ком образования тромба в полости желудочков [188].
- Не рекомендовано применение варфарина** у пациентов с синусовым ритмом без признаков наличия тромбов в полости сердца, т.к. он увеличивает риск кровотечений при отсутствии влияния на смертность [188].
ЕОК нет (УУР B, УДД 2)
Комментарии. Развитие любой формы фибрилляции предсердий у пациента с острым миокардитом — постоянной, персистирующей или пароксизмальной — подразумевает расчет риска тромбоэмболических осложнений по шкале CHA2DS2-VASc (Приложение Г3) и при уровне риска ≥2 баллов автоматическое начало терапии прямыми пероральными антикоагулянтами.
3.2. Лечение пациента с острым миокардитом и стабильной гемодинамикой
Базовые препараты в лечении острого миокардита у пациента со стабильной гемодинамикой
Пациентам со стабильной недостаточностью кровообращения, в остром периоде миокардита, целесообразно проведение терапии в соответствии с клиническими рекомендациями по лечению ХСН [184].
Базовыми, обязательными препаратами являются: ингибиторы ангиотензинпревращающего фермента (иАПФ); антагонисты ангиотензина II (АРА) (лозартан**, валсартан, кандесартан) при непереносимости иАПФ; АРА в комбинации с другими средствами (ангиотензиновых рецепторов и неприлизина ингибитор) может рассматриваться как стартовый препарат начальной терапии ХСН, как препарат выбора при переводе с иАПФ при стабилизации состояния пациента с ХСН II-III ФК с систолическим АД >100 мм рт.ст., как препарат, превосходящий клиническую эффективность иАПФ в снижении риска смерти пациента с ХСН; бета-адреноблокаторы сразу же по нормализации маркеров воспаления под контролем уровня ЧСС (Исследование пульса); ивабрадин** при непереносимости бета-адреноблокаторов или синусовом ритме с ЧСС >70 уд./мин у пациента с оттитрованными, максимально переносимыми дозами бета-адреноблокаторов; АМКР (антагонисты альдостерона).
- Рекомендовано проводить лечение пациентов с острым миокардитом и стабильной гемодинамикой в соответствие с рекомендациями по ХСН [184].
ЕОК нет (УУР С, УДД 5)
Объем физической нагрузки у пациента с острым миокардитом
Физическая активность в остром периоде миокардита радикально ограничена. Ограничения действуют до полного излечения или нормализации уровня маркеров воспаления [166, 167]. Увеличение объёма нагрузок должно происходить постепенно в течение длительного времени. Верифицированный миокардит требует категорического отстранения спортсменов от любого вида соревнований как минимум на 6 мес. с последующим постепенным увеличением объёма нагрузок. Вопрос о возобновлении нагрузок решается на основании результатов холтеровского мониторирования (Холтеровское мониторирование сердечного ритма) (исключение аритмий высоких градаций), анализа динамики размеров камер сердца и состояния сократительной функции миокарда [166, 167].
У пациентов со стабильной ХСН, после ранее перенесённого миокардита, возобновление физических нагрузок в режиме умеренных нагрузок, не требующих чрезмерного напряжения, следует рекомендовать в рамках рутинной реабилитационной программы пациента с ХСН.
Целесообразно ограничивать физические нагрузки во время острой фазы миокардита, по крайней мере 6 мес., у спортсменов и лиц, не занимающихся спортом [166, 167].
Противовирусная терапия в лечении острого миокардита
В настоящий момент нет больших проспективных клинических исследований по оценке влияния антивирусной терапии на жесткие конечные точки. Наше представление о проблеме сформировано небольшими по численности исследованиями.
В рандомизированном двойном слепом плацебо-контролируемом исследовании BICC (Betaferon in patients with chronic viral cardiomyopathy; ClinicalTrials.gov identifier: NCT001185250) [189] 143 пациента с выраженной клиникой недостаточности кровообращения и верифицированным ПЦР-реакцией в биоптатах миокарда наличием геномов энтеровирусов, аденовирусов и/или парвовируса В19 были рандомизированы в 3 группы: плацебо — 24 нед. (n=48); терапии интерфероном бета-1b** 4×106 IU — 24 нед. (n=49); терапии интерфероном бета-1b** 8×106 IU — 24 нед. (n=46). Обе дозы интерферона бета-1b** приводили либо к снижению вирусной нагрузки, либо полной элиминации вирусного генома в сравнении с группой плацебо (отношение шансов =2,33, p=0,048), однако добиться элиминации вирусного генома в 100% случаев не удалось. В основном продолжалась персистенция парвовируса В19. На фоне терапии интерфероном бета-1b** произошло снижение ФК недостаточности кровообращения в течение 12 нед. наблюдения (p=0,013), улучшение качества жизни по Миннесотскому опроснику (Приложение Г2) качества жизни у пациентов с ХСН в течение 24 нед. наблюдения (p=0,032) и улучшение глобальной самооценки (p=0,039). Таким образом, терапия интерферона бета-1b** оказала положительное влияние на течение вирусного миокардита.
Персистенция вируса рассматривается как самостоятельный негативный прогностический фактор, повышающий риск летального исхода. 5-летнее наблюдение [190] за пациентами с персистенцией вируса в миокарде (подтверждённой ПЦР-реакцией эндомиокардиального биоптата) и пациентами со 100% элиминацией вируса из ткани миокарда после острого вирусного миокардита показало, что:
- через 60 мес. наблюдения 92% пациентов со 100% элиминацией вируса были живы, а их ФВ ЛЖ за 5 лет достоверно возросла (исходный уровень 53±16%, через 60 мес. 58±1%, p=0,001);
- через 60 мес. наблюдения только 69% пациентов с персистенцией вируса были живы, а их ФВ ЛЖ достоверно не изменилась (исходный уровень 39±18%, через 60 мес. у оставшихся в живых 41±16%, p=0,37).
Оценка эффективности длительной терапии интерфероном бета-1b** в элиминации вируса из ткани миокарда была проведена в длительном (120 мес. наблюдения) исследовании. Результаты лечения сравнивали с выживаемостью в группе со 100% элиминацией вируса сразу же после острого периода миокардита. Всего в исследование включено 96 пациентов с верифицированной вирусной инвазией и симптомами недостаточности кровообращения. Через 9,5±7,6 мес. после повторной биопсии миокарда персистенция вируса была верифицирована у 49 пациентов. У 28 из них через 4 мес. после повторной биопсии миокарда была начата терапия интерфероном бета-1b** 8×106 IU/через день в течение 6 мес. на фоне базовой терапии недостаточности кровообращения. Через 95,8±36 мес. 52,5% пациентов с персистенцией вируса в группе контроля, не получавших лечения интерфероном бета-1b**, умерли, в то время как в группе получивших лечение интерфероном бета-1b** смертность была идентичной смертности в группе со 100% элиминацией вируса. Таким образом, длительная терапия интерфероном бета-1b** достоверно улучшает долгосрочные исходы острого миокардита.
В реальной практике, где получение данных о наличии вирусного генома в миокарде маловероятно, консилиум с врачами-инфекционистами позволит оптимизировать принятие диагностического решения и определиться с целесообразностью начала противовирусной терапии.
- Рекомендуется рассмотреть возможность назначения интерферона бета-1b** (2×106МЕ подкожно каждые 48 ч в течение недели, в дальнейшем 4×106МЕ подкожно каждые 48 ч в течение 2-24 нед.) у пациентов с миокардитом при подтверждении пролиферации вирусов в биоптатах миокарда с помощью количественной ПЦР с обратной транскрипцией [189, 190].
ЕОК нет (УУР B, УДД 2)
3.3. Применение иммуноглобулинов и метода иммуносорбции в лечении острого миокардита
Внутривенное применение высоких доз иммуноглобулинов
Вводимые внутривенно иммуноглобулины (J06B) обладают антивирусным и иммуномодулирующим действием, что позволило предположить положительный эффект в лечении острого миокардита при применении иммуноглобулинов [191]. В единственном плацебо-контролируемом исследовании по оценке влияния иммуноглобулинов на течение ХСН 40 пациентам с ДКМП или ишемическим генезом развития ХСН и ФВ ЛЖ <40% в течение 26 нед. осуществляли внутривенное введение иммуноглобулинов [192]. В группе лечения отмечено достоверное повышение уровня IL-10, растворимых рецепторов IL-1 и растворимых рецепторов TNF-α. На фоне выраженного противовоспалительного эффекта в группе лечения отмечено достоверное увеличение ФВ ЛЖ с 26±2% до 31±3% и снижение уровня NT-proBNP. Эти данные позволяли надеяться на успех в лечении миокардитов, однако результаты, полученные в клинических исследованиях, были противоречивы.
Так, применение иммуноглобулинов для лечения миокардита у детей в рамках нерандомизированного исследования привело к улучшению сократительной способности миокарда и снижению смертности в течение 12 мес. наблюдения [193]. Напротив, результаты применения иммуноглобулинов в дозе 2 г/кг веса внутривенно для лечения недостаточности кровообращения у 62 пациентов с ДКМП в возрасте 43±12 лет и ФВ ЛЖ <40% (по данным рандомизированного плацебо-контролируемого исследования) не подтвердили предположение о влиянии иммуноглобулинов на исход болезни. Необходимо отметить, что всем пациентам проводили ЭМБ, но только у 16% из них была выявлена воспалительная инфильтрация миокарда. Сократительная способность ЛЖ в группе активного лечения и группе плацебо не различались. За 12 мес. ФВ ЛЖ возросла в группе лечения на 16±12%, а в группе плацебо — на 15±0,16%. Через 2 года наблюдения не было показаний для трансплантации сердца в группе лечения у 92% и в группе плацебо у 88% пациентов [230].
- Рекомендовано рассмотреть возможность применения высоких доз иммуноглобулинов для лечения острого миокардита у взрослых [194].
ЕОК нет (УУР С, УДД 5)
Применение метода иммуносорбции
Метод основан на удалении антикардиальных антител, титр которых повышен у пациентов с аутоиммунными заболеваниями и острым аутоиммунным миокардитом. В настоящее время нет ни одного большого проспективного клинического исследования по оценке влияния этого метода на жесткие конечные точки. В небольших по численности контролируемых исследованиях иммуносорбция приводила к улучшению гемодинамических показателей и выраженности воспалительной реакции у пациентов с ДКМП [172, 173].
60 пациентов с ДКМП, II-III ФК по NYHA, ФВ ЛЖ <45% были включены в одноцентровое исследование, построенное по дизайну "случай-контроль" [195]. 30 пациентам проводили иммуносорбцию с последующей заменой IgG и оценивали влияние этой процедуры на объём выполняемой физической нагрузки на стресс-системе с газоанализом (Стресс-система кардиологическая для проведения нагрузочных тестов ЭКГ) и результаты ЭхоКГ исследования исходно и через 3 мес., сравнивая полученные данные с результатами группы без иммуносорбции. В группе лечения ФВ ЛЖ возросла с 33,0±1,2% до 40,1±1,5% (p<0,001). Продолжительность выполнения нагрузки возросла с 812±29 до 919±30 сек (p<0,05), пиковое потребление кислорода возросло с 17,3±0,9 до 21,8±1,0 мл/(мин×кг) (p<0,01).
Влияние иммуносорбции кардиотоксичных антител на гемодинамические параметры и активацию Т-клеток исследовали у 10 пациентов с ДКМП, выраженной воспалительной реакцией в миокарде по данным ЭМБ и ФВ ЛЖ <35% в течение 6 мес. наблюдения [196]. Через 6 мес. после иммуносорбции кардиотоксичных антител ФВ ЛЖ возросла с 25,6±4,9 до 37,3±10,1% (p<0,05), конечно-диастолический размер уменьшился с 63,3±3,1 до 57,1±4,1 мм (p<0,05) и возросла активность Т-клеток CD4(+), CD25(+) и CD127.
Влияние иммуносорбции с последующей заменой IgG (0,5 г/кг поликлонального IgG) на гемодинамические параметры, определяемые инвазивно катетером Swan-Ganz (Катетер медицинский Swan-Ganz), было оценено в небольшом по численности исследовании у 9 пациентов с ДКМП ФК III-IV по NYHA с ФВ ЛЖ <30% [197]. После первой процедуры иммуносорбции и на протяжении 3 мес. отмечено, что сердечный индекс возрос с 2,1±0,1 до 2,8±0,1 л/мин/м2 (p<0,01); индекс ударного объема возрос с 27,8±2,3 до 36,2±2,5 мл/м2 (p<0,01); общее сосудистое сопротивление снизилось с 1,428±74 до 997±55 дин × сек × см-5 (p<0,01). Иммуносорбция антител к β1-рецепторам у 22 пациентов с ДКМП III-IV по NYHA и ФВ ЛЖ <30% [198] не продемонстрировала влияния на гемодинамические параметры. ФВ после проведения иммуносорбции у пациентов с повышенным титром антител к β1-рецепторам не отличалась от ФВ ЛЖ у пациентов, исходно не имевших повышенного титра антител к β1-рецепторам.
В реальной практике определение циркулирующих аутоантител — трудновыполнимая задача, что предопределяет использование этой технологии только в крупных центрах, имеющих возможность идентифицировать аутоантитела и динамику их уровня. Современный уровень знаний, сформированный в отсутствие крупных проспективных исследований, не позволяет советовать метод иммуносорбции как базовый метод в лечении острого миокардита.
- Не рекомендовано использование иммуносорбции для лечения острого миокардита в качестве обязательного базового метода лечения в настоящий период [195].
ЕОК нет (УУР С, УДД 4)
Иммуносупрессивная терапия острого миокардита
Известный в настоящее время клинический опыт иммуносупрессивной терапии пациентов с острым миокардитом основан на применении препаратов: ГКС в монорежиме или в комбинации с цитостатиками (противоопухолевые препараты и иммуномодуляторы) [177]. В настоящих рекомендациях сделан акцент на исследования, использовавшие иммуногистохимические методы исследования эндомиокардиальных биоптатов (Патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов) в верификации этиологии миокардита. Отсутствие методов иммуногистохимической и молекулярно-генетической верификации биоптатного материала (Патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов) или дизайн исследования, не предполагающий группу контроля (высокая вероятность спонтанного выздоровления пациента с миокардитом), делает интерпретацию результатов неприемлемой для нужд практического здравоохранения. Так, в исследовании Myocarditis Treatment Trial — МТТ (111 пациентов с неустановленной этиологией миокардита) оценивалась эффективность влияния иммуносупрессивной терапии (преднизолоном** в комбинации с #азатиоприном** или #циклоспорином** vs плацебо) на смертность пациентов и сократительную функцию миокарда. Добавление иммуносупрессивной терапии к стандартному лечению через 1 год наблюдения не привело к снижению смертности или улучшению сократительной функции сердца, что объясняется, по-видимому, разнородностью включенных пациентов. Эффект от иммуносупрессивной терапии следовало ожидать только при аутоиммунных миокардитах, а у пациентов с возможным исходным вирусным поражением миокарда на фоне иммуносупрессивной терапии произошло усиление репликации вирусов, что привело к большему повреждению миокарда и ухудшению прогноза.
Эти недостатки в планировании исследования удалось избежать в исследовании TIMIC (Immunosuppressive Therapy in Patients With Virus Negative Inflammatory Cardiomyopathy) [199], спланированном как рандомизированное двойное слепое плацебо-контролируемое исследование. При включении пациента (включено 85 пациентов) в исследование проводили забор эндомиокардиального биоптата с гистологическим и иммуногистохимическим исследованием ткани миокарда (Патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов). Такой подход позволил исключить вирусные миокардиты и сформировать однородную группу пациентов с вирус-негативной воспалительной кардиомиопатией. Все 85 пациентов имели выраженные признаки недостаточности кровообращения в течение 6 мес., которые не удавалось купировать базовой терапией ХСН [171].
В исследовании ESETCID (European Study of Epidemiology and Treatment of Inflammatory Heart Disease) (мультицентровое, двойное слепое, плацебо-контролируемое, рандомизированное) были сформированы 3 ветви: лечение преднизолоном** и азатиоприном** вирус-негативной воспалительной кардиомиопатии у пациентов с ФВ ЛЖ <45%; лечение интерфероном альфа-2b** энтеровирусных миокардитов; лечение внутривенно иммуноглобулинами цитомегаловирусного, аденовирусного и парвовирусного В19 миокардитов. Эффект лечения в каждой группе сравнивался с плацебо и оценивался по способности препарата увеличить исходную ФВ ЛЖ на 5% и повлиять на выраженность воспаления в миокарде. Всего в исследовании проанализировано 3055 эндомиокардиальных биоптатов. Иммуносупрессивная терапия привела к исчезновению через 6 мес. признаков воспаления у 59% пациентов vs 40% в группе плацебо. Данные по изменению ФВ ЛЖ не приведены [200]. Эти данные также подтверждают эффективность адресной иммуносупрессивной терапии.
Персонифицированный подход к лечению миокардитов позволяет выделить особую группу пациентов с доказанными аутоиммунными формами миокардита, где применение иммуносупрессии обязательно:
- Гигантоклеточный миокардит— использование комбинированной иммуносупрессивной терапии (двойной — #метилпреднизолон** и #циклоспорин**, или тройной — #метилпреднизолон**, #циклоспорин** и #азатиоприн**) имеет доказанное положительное влияние на прогноз относительно жизни [151, 177, 222, 223]. Доза #метилпреднизолона** составляет 1 мг/кг/сут. (при тяжелом состоянии пациента возможно введение до 1000 мг/сут.), с последующим постепенным снижением дозы до поддерживающей (5-10 мг) через несколько месяцев терапии на неопределенно долгий временной интервал; доза #азатиоприна** — 2 мг/кг/сут.; доза #циклоспорина** определяется по его концентрации в крови, длительность терапии не определена, но составляет не менее 1 года. Вопрос отмены иммуносупрессивной терапии — сложный вопрос, требующий коллегиального решения. Отмена терапии может привести к рецидиву миокардита, довольно часто в более тяжелой форме и с более тяжелым прогнозом относительно жизни.
- Саркоидоз сердца— применение высоких доз ГКС сопровождается улучшением сократительной функции сердца. Прогноз относительно жизни всегда тяжелый в течение 5 лет, летальный исход отмечается у каждого 6 пациента. Стартовая доза #преднизолона** варьирует от 30-60 мг/сут., необходимо постепенное ее снижение в течение 8-12 нед. до дозы 10-20 мг/сут., которую пациент принимает не менее 6-12 мес. [177, 222, 223]. Несмотря на отсутствие убедительных доказательств преимущества больших доз ГКС перед умеренными, важным фактором прогноза, несомненно, является длительность иммуносупрессивной терапии. Поэтому для минимизации риска, связанного с назначением ГКС, используются стероид-сберегающие режимы.
- Эозинофильный миокардит— чаще всего развивается в возрасте 30-40 лет и в 34,1% случаев ассоциируется с реакцией гиперчувствительности, эозинофильным гранулематозом и полиангиитом. В 65% случаев удается выявить сочетанные состояния. Идиопатический эозинофильный миокардит развивается в 35,7% случаев. В 77,7% случаев лечение начинается со ГКС (H02AB) [201]. Эозинофилез всегда требует проведения диагностического поиска в рамках паранеопластического синдрома. Прогноз эозинофильного миокардита из-за угрожающих желудочковых нарушений ритма и прогрессирующей недостаточности кровообращения всегда тяжелый, риск летального исхода в остром периоде миокардита высокий [201, 202].
Эозинофильный миокардит может быть проявлением гетерогенной группы гематологических заболеваний, объединённой под названием "идиопатический гиперэозинофильный синдром". Это редкое состояние следует подозревать при необъясненном эозинофилезе в периферической крови, превышающем 1500 в 1 мм3 как минимум 6 мес. У каждого 5 пациента с таким состоянием разовьётся эозинофильный миокардит, который в абсолютном большинстве случаев будет сочетаться с поражением кожи, легких и кишечника [203, 204].
Лечение эозинофильного миокардита зависит от этиологической причины. При гиперчувствительности следует в первую очередь исключить вызвавшую её причину, при подозрении на наличие паразитарной инвазии — начать специфическую терапию (Прием (осмотр, консультация) врача-инфекциониста первичный обязательно); при миелопролиферативных заболеваниях специфическая терапия (ингибиторы тирозинкиназы (по АТХ: L01E ингибиторы протеинкиназы)) определяется врачом-гематологом; у пациентов с синдромом Чарга-Стросса требуется терапия с применением ГКС. Абсолютное большинство пациентов с эозинофильным миокардитом получает иммуносупрессивную терапию. Наше мнение о способах применения такой терапии и её сроках основано на результатах малых по численности исследований или отдельных клинических наблюдений [204]. Стартовая доза #преднизолона** — 1 мг/кг/сут. в течение 4 нед. с последующим постепенным снижением дозы до поддерживающей (5-10 мг) через несколько месяцев терапии [177, 205, 222, 223]. Длительность терапии составляет 6-9 мес. В случаях тяжелого течения заболевания целесообразно применять комбинированную терапию "#преднизолон** плюс #циклоспорин**/#азатиоприн**". Такая терапия приводит к достоверному снижению риска прогрессии СН. Наибольшие перспективы в лечении эозинофильного миокардита связывают с применением препарата #меполизумаба** 300 мг однократно, который ингибирует биоактивность IL-5 на эозинофилах [177, 206, 222-225, 229].
- Миокардиты, ассоциированные с экстракардиальными аутоиммунными заболеваниями — показана комбинированная иммуносупрессивная терапия по схемам, принятым для лечения основного заболевания.
- Рекомендовано иммуносупрессивную терапию (ГКС (H02AB) и/или иммунодепрессантами (LA04)) начинать только после исключения вирусной инфекции в миокарде путем выявления вирусного генома с помощью ПЦР-диагностики ЭМБ [38].
ЕОК нет (УУР С, УДД 5)
- Иммуносупрессивная терапия (ГКС (H02AB) и/или иммунодепрессантами (LA04)) рекомендуется при доказанных аутоиммунных (вирус-негативных) формах миокардита, включая гигантоклеточный, эозинофильный и токсический миокардиты, саркоидоз сердца и миокардиты, ассоциированные с экстракардиальными аутоиммунными заболеваниями, при отсутствии противопоказаний к иммуносупрессии [38].
ЕОК нет (УУР С, УДД 5)
Иммуносупрессивная терапия может рассматриваться у пациентов с умеренной или тяжелой СН, жизнеопасными нарушениями ритма и/или проводимости при неэффективности стандартной терапии только при наличии гистологического и иммуногистохимического подтверждения воспалительного заболевания миокарда, а также при отсутствии вирусного генома в биоптатах миокарда.
- Рекомендуется проводить повторную ЭМБ у пациентов с миокардитом с целью оценки интенсивности и длительности иммуносупрессивной терапии [38].
ЕОК нет (УУР С, УДД 5)
Лечение пациента со стабильной недостаточностью кровообращения, развившейся в результате миокардита
В настоящее время проспективных контролируемых исследований по лечению ХСН именно у пациентов, перенесших миокардит, нет.
Пациентам со стабильной недостаточностью кровообращения, развившейся в результате перенесенного миокардита, возможно проведение терапии в соответствии с клиническими рекомендациями по лечению ХСН [184]. Настоящие рекомендации не ставят целью анализ лечения пациентов с сохраненной, промежуточной и сниженной ФВ после перенесенного миокардита. Экспертная группа подчеркивает, что назначение основных препаратов, доказавших способность снижать риски развития летального исхода, повторных госпитализаций и заболеваемости именно при ХСН, обязательно пациентам, перенесшим миокардит и имеющим признаки ХСН.
- Рекомендованопациентам со стабильной недостаточностью кровообращения, развившейся в результате миокардита,с целью уменьшения вероятности прогрессирования заболевания применения терапии с соответствие с рекомендациями по ХСН [184].
ЕОК нет (УУР С, УДД 5)
Лечение миокардита у больных с острой COVID-19
Всем пациентам с вероятным коронавирусным миокардитом должна быть инициирована или продолжена стандартная терапия СН [76, 207, 208].
Комментарии. Клиническая польза ГКС у госпитализированных пациентов с COVID-19 в настоящее время показана в ряде исследований, но в конкретном контексте острого миокардита данные отсутствуют [46]. Некоторые иммуносупрессивные препараты, такие как антагонисты интерлейкина-1 (L04AC Ингибиторы интерлейкина) (анакинра** и канакинумаб**) и интерлейкина-6 (L04AC Ингибиторы интерлейкина) (тоцилизумаб**, левилимаб**), продемонстрировали многообещающие результаты у пациентов, госпитализированных по поводу COVID-19 [76, 207, 208]. Однако ни один из этих препаратов не исследовался специально для лечения миокардита, связанного с COVID-19. Таким образом, ГКС могут рассматриваться в качестве препарата выбора у тяжелых пациентов с миокардитом и COVID-19, независимо от пневмонии и гипоксемии, но их следует избегать при менее тяжелых формах.
Лечение постковидного миокардита
Объем иммуносупрессивной терапии и ее длительность регламентируются в соответствии с доказательной базой при классическом миокардите. Показано достоверное возрастание ФВ, уменьшение размеров камер сердца и улучшение функционального статуса в результате такой терапии в сочетании с комплексным лечением ХСН [209]. В условиях пандемии любая неясная дисфункция миокарда требует проведения серодиагностики COVID-19 (Определение РНК коронавирусов 229E, OC43, NL63, HKUI (Human Coronavirus) в мазках со слизистой оболочки носоглотки методом ПЦР), оценки анамнестической связи симптомов с перенесенной COVID-19. Изолированное (без клинических симптомов) повышение титра антикардиальных антител и/или выявление "поствоспалительных" изменений при МРТ сердца не является основанием для диагностики постковидного миокардита и его лечения. У больных с высокими титрами антикардиальных антител возможно появление симптомов в более поздние сроки, что требует динамического наблюдения.
Хирургическое лечение
Вопрос о трансплантации сердца в остром периоде миокардита у пациента с подключенным оборудованием для механической поддержки гемодинамики (Аппарат внутриаортальной баллонной контрпульсации) или ЭКМО может быть рассмотрен только в той ситуации, когда, несмотря на оптимальную фармакологическую терапию и механическую поддержку, не удается стабилизировать гемодинамические параметры [38].
Важно помнить, что у большинства пациентов, вы- шедших из острой фазы миокардита, произойдет спонтанное восстановление сократительной функции сердца.
- Рекомендовано:вопрос о необходимости трансплантации сердца рассматривать только после разрешения острой фазы дебюта миокардита[38].
ЕОК нет (УУР С, УДД 5)
Обезболивание
Пациентам с миокардитом специального обезболивания не требуется.
Диетотерапия
Пациентам с миокардитом специальной диетотерапии не требуется.
-
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Методы физической реабилитации у пациентов с миокардитом не разработаны. Острый миокардит является абсолютным противопоказанием для проведения физических тренировок. По-видимому, речь может вестись только о реабилитации пациентов со стабильной недостаточностью кровообращения, развившейся в результате миокардита. В основу реабилитационных мероприятий положены принципы физической реабилитации пациентов с ХСН.
При манифесте ХСН в поперечно-полосатых мышцах и диафрагме развиваются морфологические и функциональные нарушения, увеличивается количество мышечных волокон II типа, снижается толерантность к физической нагрузке, что делает проведение физических нагрузок трудной задачей в повседневной практике [210]. Особую роль в прогрессии заболевания играет дыхательная мускулатура, что усугубляет быструю утомляемость и одышку [211]. У пациентов со сниженной ФВ ЛЖ аэробные физические тренировки умеренной интенсивности повышают качество жизни и достоверно снижают риск повторных госпитализаций, у пациентов с сохраненной ФВ ЛЖ приводят к уменьшению симптоматики и улучшению ФК ХСН [212, 213].
- Рекомендованыаэробные физические тренировки умеренной интенсивности у пациентов со сниженной ФВ ЛЖ, для повышения качества жизни и снижения риска повторных госпитализаций [212, 213].
ЕОК нет (УУР А, УДД 1)
- Рекомендованов условиях клиники проведение кардиопульмонального нагрузочного тестирования (ЭКГ с физической нагрузкой), в рамках персонифицированного подхода к проведению реабилитации, для определения исходной толерантности к физической нагрузке — обязательная процедура. При пиковом потреблении кислорода VО2<10 мл/кг/мин пациент расценивается как пациент высокого риска, что требует от врача либо отложить начало проведения тренировок, либо выбрать только упражнения для дыхательной мускулатуры [214]. В условиях поликлиники целесообразно проведение теста с многократной физической нагрузкой неменяющейся интенсивности (6-мин тест), позволяющего врачу оценить исходный статус пациента перед началом реабилитации [215].
ЕОК нет (УУР B, УДД 2)
Комментарии. Расстояние <150 м за 6 мин исключает любые нагрузки кроме упражнений для дыхательной мускулатуры [216], расстояние >300 м за 6 мин позволяет назначать ходьбу. Регулярные физические нагрузки в форме дыхательных упражнений с затрудненным выдохом приводят к системному влиянию на организм, увеличивая толерантность к физическим нагрузкам и улучшая качество жизни [217].
Методики назначения тренировок, пути улучшения приверженности пациентов, назначение физических тренировок в различных клинических ситуациях и другие аспекты физической реабилитации пациентов с ХСН подробно описаны в документе "Рекомендации по назначению физических тренировок пациентам с хронической сердечной недостаточностью" [11]. На сегодняшний день наиболее изученными видами нагрузок у пациентов с ХСН являются ходьба и дыхательные упражнения; поиск новых видов (плавание) пока не привел к включению их в рекомендации [218]. Обеспечение безопасного начала тренировок требует от врача знания:
— относительных противопоказаний (увеличение веса >1,8 кг в предыдущие 1-3 дня; снижение систолического АД во время тренировок; IV ФК СН; желудочковые аритмии в покое или появляющиеся во время физических нагрузок; тяжелые сопутствующие заболевания);
— абсолютных противопоказаний (прогрессивное ухудшение переносимости физических нагрузок или одышка в покое в предыдущие несколько дней; ишемия при физической нагрузке низкой интенсивности (<2 МЕТ); неконтролируемый сахарный диабет; острое системное заболевание или лихорадка; недавние тромбозы/эмболии; тромбофлебит; острый перикардит или миокардит; аортальный стеноз средней или умеренной степени тяжести; другие пороки, требующие хирургического вмешательства; инфаркт миокарда в предыдущие 3 нед.; недавно возникшая фибрилляция предсердий).
Приведенные выше данные относятся к пациентам, не занимавшимся спортом. Возобновление занятий спортом возможно только через 6 мес., при условии нормализации объёма полости ЛЖ и отсутствии угрожающих аритмий при холтеровском мониторировании.
- Рекомендовано в острую фазу миокардита избегать аэробных физических нагрузок. В период стабилизации состояния пациента (с исчезновением лабораторных признаков воспаления или воспалительных инфильтратов при ЭМБ) рекомендуется физическая активность от низкой до умеренной интенсивности [214].
ЕОК нет (УУР С, УДД 5)
Медицинская реабилитация и санаторно-курортное лечение
Медицинская реабилитация включает комплекс мероприятий, направленных на восстановление функциональных возможностей пациентов после перенесённых заболеваний, в т.ч. миокардита. Реабилитационные программы помогают улучшить состояние сердечно-сосудистой системы, снизить риски повторных сердечно-сосудистых событий и повысить качество жизни пациентов. Для этого используются методы физической реабилитации, психосоциальные вмешательства и индивидуально подобранные программы физической активности.
Кардиореабилитация для пациентов с миокардитом представляет собой последовательный процесс, который проводится под наблюдением многопрофильной команды специалистов, включающей кардиологов, врачей физической и реабилитационной медицины, специалистов по лечебной физкультуре и диетологов. Основной целью кардиореабилитации является безопасное повышение уровня физической активности, улучшение сердечно-сосудистых показателей и общее восстановление физического состояния.
В начале реабилитации, особенно для пациентов с подострым миокардитом или миокардитом в анамнезе, рекомендовано начинать с низкоинтенсивных физических нагрузок (шкала BORG 6-8/20). Это позволяет избежать перенапряжения сердца и постепенно улучшить общую толерантность к физическим нагрузкам. По мере восстановления физическое воздействие увеличивается, а тренировки становятся более структурированными, с переходом на умеренную интенсивность (шкала BORG 10-12/20). Такой подход позволяет эффективно адаптировать сердце к возрастающим нагрузкам, не вызывая избыточного стресса.
Психосоциальные вмешательства являются важным компонентом медицинской реабилитации для пациентов с миокардитом. Когнитивно-поведенческая терапия, управление стрессом и релаксация помогают снизить психологический дистресс, что в свою очередь улучшает общую реакцию организма на лечение. Включение таких методов способствует укреплению психоэмоционального состояния и повышению качества жизни.
Санаторно-курортное лечение является важным этапом восстановления пациентов с миокардитом. Оно рекомендуется пациентам без признаков застойной СН и тяжелых нарушений сердечного ритма, обычно спустя 6 мес. после острого периода. Климатотерапия на приморских и горных курортах, талассотерапия и лечебная ходьба позволяют использовать природные факторы для укрепления сердечно-сосудистой системы. Терренкуры (лечебные прогулки по специально разработанным маршрутам) проводятся в живописных, защищённых от ветра местностях с чистым воздухом, насыщенным природными аэроионами и фитонцидами.
В курортных условиях лечебная ходьба осуществляется в утренние и вечерние часы, в щадящем режиме с индивидуальной дозировкой нагрузки (по дистанции, углу подъема, темпу и продолжительности остановок), что способствует безопасной адаптации сердечно-сосудистой системы к физической активности. Кроме того, санаторно-курортное лечение включает аэроионотерапию, гелиотерапию и терренкурные прогулки в условиях низкогорных, равнинных и приморских курортов.
На кардиологических курортах пациенты с миокардитом могут проходить полноценные программы кардиореабилитации, которые включают консультирование по питанию, управлению весом и составом тела, коррекцию сердечно-сосудистых факторов риска, психосоциальные вмешательства и аэробные тренировки. Это позволяет добиться значительного улучшения клинико-функционального состояния пациентов, стабилизации АД, нормализации липидного и углеводного обмена, а также повышения толерантности к физической нагрузке.
-
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Наблюдение за пациентом, перенесшим острый миокардит. Общие положения.
— Острый миокардит может закончиться либо пол- ным выздоровлением и исчезновением симптомов недостаточности кровообращения, либо формированием стабильной недостаточности кровообращения различных ФК по NYHA, либо прогрессией выраженности недостаточности кровообращения и переходом в ДКМП.
— Удовлетворительное самочувствие и отсутствие симптомов недостаточности кровообращения не исключают возникновения рецидивов.
— Сохраняющийся повышенный уровень тропонина Т в крови в течение недель/месяцев после нормализации симптомов острого миокардита требует исключения лабораторной ошибки (возможно взаимодействие кардиальных аутоантител с лабораторными наборами; в этой ситуации необходимо определение уровня тропонина I в крови), повторного исследования коронарных артерий (коронарография) и в случае окончательного исключения коронарной болезни решения вопроса о ЭМБ.
— Все пациенты, перенесшие острый миокардит, должны находиться на диспансерном наблюдении. Длительность наблюдения и частота визитов зависят от исхода миокардита. Полное выздоровление после острого миокардита также требует диспансерного наблюдения не менее 1 года.
— Объём обследования в ходе диспансерного визита включает в себя ЭКГ, ЭхоКГ, холтеровское мониторирование сердечного ритма, тест с многократной физической нагрузкой неменяющейся интенсивности (6-минутный тест), общий (клинический) анализ крови, исследование уровня C-реактивного белка в сыворотке крови, исследование уровня NT-proBNP. Проведенное обследование должно оценить динамику недостаточности кровообращения и выраженность процесса ремоделирования сердца.
— В случае рецидива пациент должен госпитализироваться. Объем проводимого лечения — как при первом эпизоде острого миокардита. Всегда обсуждается вопрос о проведении ЭМБ.
— Вакцинация против кори, краснухи, паротита, гриппа и полиомиелита обязательна.
— Вакцинация против пневмококка (с использованием вакцины для профилактики пневмококковых инфекций**) обязательна.
-
Организация оказания медицинской помощи
Состояние пациента, страдающего миокардитом в дебюте болезни, независимо от выраженности симптомов, должно оцениваться как тяжелое и нестабильное.
В реальной практике, даже при исходно сохранной систолической функции ЛЖ, может наступить молниеносное и непредсказуемое ухудшение состояния из-за развития жизнеугрожающих аритмий и AV-блокад.
Следовательно, во всех случаях подозрения на острый миокардит вопрос о госпитализации должен решаться положительно. Следует предпочесть многопрофильные стационары, обладающие полноценным реанимационным отделением.
Показания для госпитализации в медицинскую организацию
Абсолютные показания для госпитализации:
— подозрение на миокардит у гемодинамически нестабильного пациента [38];
— подозрение на миокардит у гемодинамически стабильного пациента, имеющего клинические проявления СН на уровне II-IV ФК и документированную систолическую дисфункцию ЛЖ по ЭхоКГ [38, 228].
Показания для госпитализации в отделение реанимации включают: жизнеугрожающую аритмию, тромбоэмболический синдром, признаки гипоперфузии периферических органов, кардиогенный шок и отек легких.
- Больные с СН и подтверждённым/высоким риском COVID-19 требуют госпитализации независимо от тяжести течения инфекционного процесса.
Пациенты с молниеносным (фульминантным) острым миокардитом и нестабильными гемодинамическими показателями должны наблюдаться в реанимационных отделениях, оснащенных необходимым оборудованием для проведения ИВЛ, ЭКМО, вспомогательного кровообращения и ЭМБ. Оборудование для механической поддержки гемодинамики или ЭКМО необходимо использовать либо до момента стабилизации состояния пациента, либо до момента трансплантации сердца [114, 115]. Подключение аппарата вспомогательного кровообращения или проведение процедуры ЭКМО позволяет спасти жизнь или выиграть время, необходимое для решения вопросов, связанных с трансплантацией сердца [114, 115].
Врачу первичного звена при выявлении пациента с подозрением на наличие миокардита, независимо от выраженности симптоматики, в т.ч. и при отсутствии симптомов миокардита, необходимо направлять пациента на госпитализацию в стационар для динамического наблюдения, мониторирования гемодинамических параметров и проведения диагностических процедур [38].
-
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Прогноз пациента всегда зависит от ряда факторов: этиологической причины развития миокардита, гистологической картины ЭМБ, результатов гистохимического исследования ткани биоптата (Патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов), уровня кардиальных аутоантител, выраженности недостаточности кровообращения, наличия или отсутствия персистенции вируса в ткани миокарда и ряда других параметров.
Как правило, прогноз благоприятен у госпитализированных пациентов при остром молниеносном миокардите.
Прогноз миокардитов, развившихся в рамках инфекционных заболеваний, зависит от ранней диагностики и времени начала патогенетической терапии и мониторинга нарушений ритма и проводимости, особенно при дифтерийном миокардите. При соблю- дении этих условий прогноз благоприятный.
Прогноз крайне неблагоприятен при гигантоклеточном миокардите.
Продолжительность жизни при гигантоклеточном миокардите составляет примерно 5,5 мес. с момента появления первых симптомов.
Прогноз всегда тяжелый при эозинофильном миокардите и саркоидозе сердца.
Хронизация воспалительного процесса, персистенция вируса в миокарде делает прогноз неблагоприятным, т.к. у каждого пятого пациента разовьется ДКМП и возрастет риск потребности в трансплантации сердца.
Значимые факторы неблагоприятного прогноза — стойкие угрожающие нарушения ритма, расширение комплекса QRS >120 мс и синкопальные состояния. Синкопальные состояния должны рассматриваться у пациентов с острым миокардитом как предвестники тяжелого прогноза и в первую очередь как фактор риска внезапной смерти. Своевременное выявление этих факторов риска и их коррекция, в т.ч. имплантацией ИКД*** или устройств для ресинхронизирующей терапии, позволяют радикально улучшить прогноз.
В период диспансерного наблюдения за пациентом к факторам неблагоприятного прогноза следует отнести прогрессию симптомов недостаточности кровообращения, стойкое снижение систолического АД, прогрессирующую легочную гипертензию. Эти состояния требуют коррекции базового лечения. Подбор новых доз целесообразно выполнять только в стационаре, и необходимо коллегиальное обсуждение во- проса о целесообразности проведения ЭМБ, т.к. одной из возможных причин быстрой прогрессии недостаточности кровообращения может быть персистенция вируса в миокарде. У пациентов с неблагоприятным прогнозом всегда высокий риск потребности в трансплантации сердца. Следует помнить, что риск отторжения донорского сердца всегда высокий у пациентов с исходным гигантоклеточным миокардитом. У пациентов со стабильной недостаточностью кровообращения прогноз зависит от приверженности к назначенной полноценной базовой терапии ХСН.
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи взрослым при миокардитах (коды по МКБ-10: I40, I41, I51.4)
|
№ п/п |
Критерии оценки качества |
Оценка выполнения |
|
1. |
Выполнен прием (осмотр, консультация) врача-терапевта или врача-кардиолога со сбором жалоб, анамнеза, проведено физикальное обследование пациента |
Да/Нет |
|
2. |
Выполнено исследование скорости оседания эритроцитов |
Да/Нет |
|
3. |
Выполнено определение уровня С-реактивного белка в сыворотке крови |
Да/Нет |
|
4. |
Выполнено исследование уровня тропонина Т или тропонина I в крови |
Да/Нет |
|
5. |
Выполнено определение концентрации N-концевого промозгового натрийуретического пептида |
Да/Нет |
|
6. |
Выполнена трансторакальная эхокардиография или пациент направлен в специализированную медицинскую организацию для проведения исследования |
Да/Нет |
|
7. |
Выполнена прицельная рентгенография органов грудной клетки |
Да/Нет |
|
8. |
Выполнена регистрация электрокардиограммы в 12 отведениях |
Да/Нет |
|
9. |
Выполнено 24-ч мониторирование электрокардиограммы |
Да/Нет |
|
10. |
Выполнена магнитно-резонансная томография сердца с контрастным усилением или пациент направлен в специализированную медицинскую организацию для выполнения исследования |
Да/Нет |
|
11. |
Назначена иммуносупрессивная терапия глюкокортикоидами или иммунодепрессантами (при доказанных аутоиммунных (вирус-негативных) формах миокардита) |
Да/Нет |
|
12. |
Выполнена постановка на диспансерное наблюдение при установленном диагнозе "перенесенный острый миокардит" или "подострый миокардит" или "хронический активный миокардит" |
Да/Нет |
Критерии оценки качества специализированной медицинской помощи взрослым при миокардитах (коды по МКБ-10: I40, I41, I51.4)
|
№ п/п |
Критерии оценки качества |
Оценка выполнения |
|
1. |
Выполнен прием (осмотр, консультация) врача-терапевта или врача-кардиолога осмотр со сбором жалоб, анамнеза, проведено физикальное обследование пациента |
Да/Нет |
|
2. |
Выполнено исследование скорости оседания эритроцитов |
Да/Нет |
|
3. |
Выполнено определение уровня С-реактивного белка в сыворотке крови |
Да/Нет |
|
4. |
Выполнено исследование уровня тропонина Т или тропонина I в крови |
Да/Нет |
|
5. |
Выполнено определение концентрации N-концевого промозгового натрийуретического пептида |
Да/Нет |
|
6. |
Выполнена трансторакальная эхокардиография или пациент направлен в специализированную медицинскую организацию для проведения исследования |
Да/Нет |
|
7. |
Выполнена прицельная рентгенография органов грудной клетки |
Да/Нет |
|
8. |
Выполнена регистрация электрокардиограммы в 12 отведениях |
Да/Нет |
|
9. |
Выполнено 24-ч мониторирование электрокардиограммы |
Да/Нет |
|
10. |
Выполнена коронароангиография для исключения ишемической болезни сердца или пациент направлен в специализированную медицинскую организацию для выполнения исследования |
Да/Нет |
|
11. |
Выполнена магнитно-резонансная томография сердца с контрастным усилением или пациент направлен в специализированную медицинскую организацию для выполнения исследования |
Да/Нет |
|
12. |
Выполнена эндомиокардиальная биопсия с патолого-анатомическим исследованием биопсийного материала с применением иммуногистохимических методов и вирусологического метода гемодинамически нестабильному пациенту с симптомами сердечной недостаточности продолжительностью менее 2 нед. с нормальным или расширенным левым желудочком сердца, пациенту с впервые возникшими симптомами сердечной недостаточности продолжительностью от 2 нед. до 3 мес. с расширенным левым желудочком сердца, пациенту с рецидивирующими желудочковыми аритмиями, пациенту с атриовентрикулярной блокадой II-III степени, пациенту с отсутствием эффективности проводимого лечения в течение 1-2 нед. или пациент направлен в специализированную медицинскую организацию для выполнения данного исследования |
Да/Нет |
|
13. |
Выполнена иммуносупрессивная терапия глюкокортикоидами или иммунодепрессантами (при доказанных аутоиммунных (вирус-негативных) формах миокардита) |
Да/Нет |
Приложение А1. Состав Рабочей группы по разработке и пересмотру клинических рекомендаций
Президиум Рабочей группы:
Арутюнов Г. П. — д.м.н., профессор, член-корр. РАН, главный терапевт ДЗМ, заслуженный врач РФ, зав. кафедрой ФГАОУ ВО РНИМУ им. Н. И. Пирогова.
Драгунов Д. О. — к.м.н., доцент ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России.
Жиров И. В. — д.м.н., в.н.с. НИИ клинической кардиологии им. А. Л. Мясникова.
Рабочая группа:
Моисеева О. М. — д.м.н., зав. научно-исследовательским отделом некоронарогенных заболеваний сердца ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России.
Палеев Ф. Н. — д.м.н., профессор, член-корр. РАН, зам. генерального директора по научно-аналитической работе НИИ клинической кардиологии им. А. Л. Мясникова.
Соколова А. В. — к.м.н., доцент ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России.
Апханова Т. В. — д.м.н., г.н.с. отдела физиотерапии и рефлексотерапии ФГБУ "Национальный медицинский исследовательский центр реабилитации и курортологии" Минздрава России.
Арутюнов А. Г. — д.м.н., профессор ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России.
Благова О. В. — д.м.н., профессор кафедры факультетской терапии № 1 лечебного факультета, Первый МГМУ им. И. М. Сеченова.
Габрусенко С. А. — д.м.н., с.н.с. Национальный медицинский исследовательский центр кардиологии Минздрава РФ.
Гарганеева А. А. — д.м.н., профессор, зав. отделением общеклинической кардиологии и эпидемиологии сердечно-сосудистых заболеваний НИИ кардиологии ФГБНУ "Томский национальный исследовательский медицинский центр Российской академии наук".
Гендлин Г. Е. — д.м.н., профессор, профессор ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России.
Гиляревский С. Р. — д.м.н., профессор кафедры клинической фармакологии и терапии РМАНПО Минздрава России.
Дупляков Д. В. — д.м.н., зам. главного врача по медицинской части Самарского областного клинического кардиологического диспансера, главный кардиолог Самарской области, профессор кафедры кардиологии и кардиохирургии ИПО СамГМУ.
Зайратьянц О. В. — профессор, д.м.н., зав. кафедрой ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России.
Каратеев Д. Е. — зам. директора по научной работе, зав. отделом ранних артритов ФГБНУ Научно-исследовательский институт ревматологии им. В. А. Насоновой.
Козиолова Н. А. — д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней № 2 ФГБУЗ ВО "Пермский государственный медицинский университет им. акад. Е. А. Вагнера" Минздрава России.
Космачева Е. Д. — зав. кафедрой терапии, д.м.н., главный кардиолог Южного федерального округа, главный кардиолог Краснодарского края.
Кочетов А. Г. — д.м.н., профессор кафедры госпитальной терапии с курсом клинической лабораторной диагностики РУДН.
Лопатин Ю. М. — д.м.н., профессор, зав. кафедрой кардиологии с функциональной диагностикой ФУВ Волгоградского государственного медицинского университета.
Мелехов А. В. — д.м.н., доцент ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России.
Митрофанова Л. Б. — д.м.н., зав. НИЛ патоморфологии ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России.
Нарусов О. Ю. — к.м.н., с.н.с. НИИ клинической кардиологии им. А. Л. Мясникова.
Насонова С. Н. — к.м.н., с.н.с. НИИ клинической кардиологии им. А. Л. Мясникова.
Недоступ А. В. — д.м.н., профессор кафедры факультетской терапии № 1 лечебного факультета ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России.
Никулина С. Ю. — д.м.н., профессор, проректор КрасГМУ.
Орлова Я. А. — д.м.н., профессор, зав. отделом возраст-ассоциированных заболеваний МГУ им. М. В. Ломоносова Медицинский научно-образовательный центр.
Потешкина Н. Г. — д.м.н., профессор, зав. кафедрой ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России.
Привалова Е. В. — д.м.н., профессор кафедры госпитальной терапии № 1 лечебного факультета ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России.
Ребров А. П. — д.м.н., профессор, зав. кафедрой госпитальной терапии Саратовского государственного медицинского университета им. В. И. Разумовского.
Саидова М. А. — д.м.н., профессор, руководитель отдела, зав. отделением НИИ клинической кардиологии им. А. Л. Мясникова.
Седов В. П. — д.м.н., профессор кафедры лучевой диагностики лечебного факультета ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России.
Синицын В. Е. — д.м.н., профессор, зав. кафедрой лучевой диагностики и терапии Факультета Фундаментальной Медицины МГУ им. М. В. Ломоносова, зав. отделом лучевой диагностики МНОЦ МГУ им. М. В. Ломоносова, президент Российского Общества Рентгенологов и Радиологов.
Ситникова М. Ю. — д.м.н., г.н.с., руководитель НИО сердечной недостаточности, профессор кафедры терапии ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России.
Скворцов А. А. — д.м.н., в.н.с. НИИ клинической кардиологии им. А. Л. Мясникова.
Скибицкий В. В. — д.м.н., профессор, зав. кафедрой госпитальной терапии ФГБОУ ВО КубГМУ Минздрава России.
Стукалова О. В. — к.м.н.с.н.с. НИИ клинической кардиологии им. А. Л. Мясникова.
Тарловская Е. И. — д.м.н., профессор, зав. кафедрой внутренних болезней НижГМА.
Терещенко С. Н. — д.м.н., профессор, первый зам. генерального директора, зам. генерального директора по научной работе, генеральный директор ФГБУ "НМИЦ Кардиологии" Минздрава России.
Усов В. Ю. — д.м.н., профессор, зав. отделением рентгеновских и томографических методов диагностики Томского НИМЦ НИИ кардиологии.
Фомин И. В. — д.м.н., профессор кафедры внутренних болезней Нижегородской государственной медицинской академии, главный специалист по терапии приволжского окружного медицинского центра.
Чесникова А. И. — д.м.н., профессор кафедры внутренних болезней № 1 ФГБОУ ВО "Ростовский ГМУ".
Шапошник И. И. — д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней Южно-Уральского государственного медицинского университета, главный кардиолог г. Челябинска.
Шостак Н. А. — д.м.н., профессор, зав. кафедрой ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России.
Шляхто Е. В. — д.м.н., профессор, академик РАН, генеральный директор ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России, президент Российского кардиологического общества.
Члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) Рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врач-кардиолог.
- Врач-терапевт.
- Врач общей практики (семейный врач).
- Врач-терапевт участковый.
Вследствие того, что Российское кардиологическое общество (РКО) входит в состав Европейского общества кардиологов (ЕОК), и члены РКО также являются членами ЕОК, все европейские рекомендации формируются с участием российских экспертов, которые являются соавторами рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов.
В связи с этим формирование национальных рекомендаций проводилось на основе рекомендаций ЕОК с учетом национальной специфики, особенностей обследования, лечения, доступности той или иной медицинской помощи. По этой причине в ходе разработки российских клинических рекомендаций РКО использованы международные классы показаний рекомендаций, позволяющие оценить необходимость выполнения тезиса рекомендаций и уровни достоверности доказательств данных классов (табл. 1/А2 и 2/А2).
В тех случаях, когда в европейских рекомендациях отсутствовали классы и уровни доказательности, но, по мнению экспертов РКО, данные тезисы являлись крайне необходимыми для выполнения или, наоборот, абсолютно не рекомендованы к применению, эксперты РКО, основываясь на правилах формирования классов показаний согласно рекомендациям Европейского общества кардиологов, сами проставляли классы и уровни. В данной ситуации обозначение ЕОК заменено на РКО-классы и уровни, проставленные экспертами РКО.
Кроме того, добавлена новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (табл. 3/А2 и 4/А2), введенная в 2018г ФГБУ ЦЭККМП Минздрава РФ. Таким образом, в тексте клинических рекомендаций, разрабатываемых экспертами РКО, одновременно использованы две шкалы (табл. 1/А2, 2/А2, 3/А2, 4/А2).
Таблица 1/А2
Классы показаний согласно рекомендациям ЕОК
|
Класс рекомендаций ЕОК |
Определение |
Предлагаемая формулировка |
|
I |
Доказано или общепризнанно, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными |
Рекомендовано/показано |
|
II IIa |
Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения |
Целесообразно применять |
|
IIb |
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно |
Можно применять |
|
III |
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/неэффективны, а в ряде случаев могут приносить вред |
Не рекомендуется применять |
Сокращение: ЕОК — Европейское общество кардиологов.
Таблица 2/А2
Уровни достоверности доказательств согласно рекомендациям ЕОК
|
Уровни достоверности доказательств ЕОК |
|
|
A |
Данные многочисленных рандомизированных клинических исследований или метаанализов |
|
B |
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований |
|
C |
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров |
Сокращение: ЕОК — Европейское общество кардиологов.
Таблица 3/А2
Шкала оценки УДД для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Сокращение: УДД — уровни достоверности доказательств.
Таблица 4/А2
Шкала оценки УУР для методов профилактики, лечения, медицинской реабилитации, в т.ч. основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
|
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения, медицинской реабилитации, в т.ч. основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств), Приказ Минздрава России от 28.02.2019 № 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации" (Зарегистрирован 08.05.2019 № 54588) |
|
|
А |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
В |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
С |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
- Приказ Минздрава России от 15 ноября 2012г № 918н "Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями".
- Приказ Минздрава России от 10 мая 2017г № 203н "Об утверждении критериев оценки качества медицинской помощи".
- Приказ Минздрава России от 28.02.2019 № 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации" (зарегистрирован 08.05.2019 № 54588).
Таблица ПА3-1
Клинико-морфологическая классификация миокардита E. B. Lieberman, et al. (1991)
|
Клиническая характеристика |
Клиническая форма миокардита |
|||
|
Молниеносные |
Подострые |
Хронически активные |
Хронически персистирующие |
|
|
Начало заболевания |
Четко очерченное начало заболевания в течение 2 нед. |
Менее отчетливое начало заболевания по сравнению с молниеносной формой миокардита |
Нечетко очерченное начало заболевания |
Нечетко очерченное начало заболевания |
|
Данные эндомиокардиальной биопсии |
Множественные очаги активного воспаления |
У большинства пациентов слабовыраженное воспаление. Активный и пограничный миокардит у 80% и 20% пациентов, соответственно |
Активный или пограничный миокардит |
Длительное сохранение воспалительной инфильтрации в миокарде в сочетании с некрозом миоцитов |
|
Выраженность дисфункции ЛЖ |
Снижение ФВ ЛЖ в отсутствие дилатации ЛЖ |
Снижение ФВ ЛЖ и дилатация ЛЖ |
Умеренное снижение функции ЛЖ |
Отсутствие дисфункции желудочков |
|
Исход |
В течение 2 нед. или наступает смерть, или полное выздоровление с восстановлением структуры и функции миокарда |
Высокая частота трансформации в ДКМП |
Формирование рестриктивной КМП обычно в течение 2-4 лет от начала заболевания |
В целом прогноз благоприятный |
Сокращения: ДКМП — дилатационная кардиомиопатия, КМП — кардиомиопатия, ЛЖ — левый желудочек, ФВ — фракция выброса.
Таблица ПА3-2
Клинические варианты дебюта миокардита (классификация клиники Mayo)
|
Миокардит |
||
|
Низкий риск |
Промежуточный риск ("серая зона") |
Высокий риск |
|
Боль в грудной клетке Суправентрикулярные нарушения ритма АV-блокады Сохранённая сократительная функция сердца Быстрый ответ на проводимую терапию (1-4 нед.) |
Умеренно выраженные сохраняющиеся структурные и функциональные изменения миокарда Нестойкие желудочковые аритмии Позднее накопление гадолиния в миокарде в отсутствие ремоделирования камер сердца Жизнеугрожающие нарушения ритма и проводимости не регистрируются Синкопальных состояний нет |
Стойкая декомпенсация кровообращения Выраженная стойкая дисфункция ЛЖ Жизнеугрожающие аритмии Стойкие AV-блокады на фоне выраженной дисфункции ЛЖ Рецидивирующие синкопальные состояния |
|
Прогноз благоприятный |
Прогноз неопределённый |
Прогноз неблагоприятный |
Сокращения: ЛЖ — левый желудочек, AV-блокада — атриовентрикулярная блокада.
Таблица ПА3-3
Клинические варианты дебюта миокардита. Нормальные значения и градации выраженности увеличения размеров и объемов, снижения ФВ ЛЖ [219][228]
|
Женщины |
Мужчины |
|||||||
|
Показатель |
Нормальные значения |
Небольшое нарушение |
Умеренное нарушение |
Выраженное нарушение |
Нормальные значения |
Небольшое нарушение |
Умеренное нарушение |
Выраженное нарушение |
|
КДР, см |
3,8-5,2 |
5,3-5,6 |
5,7-6,1 |
>6,1 |
4,2-5,8 |
5,9-6,3 |
6,4-6,8 |
>6,8 |
|
КДР/ППТ, см/м2 |
2,3-3,1 |
3,2-3,4 |
3,5-3,7 |
>3,7 |
2,2-3,0 |
3,1-3,3 |
3,4-3,6 |
>3,6 |
|
КСР, см |
2,2-3,5 |
3,6-3,8 |
3,9-4,1 |
>4,1 |
2,5-4,0 |
4,1-4,3 |
4,4-4,5 |
>4,5 |
|
КСР/ППТ, см/м2 |
1,3-2,1 |
2,2-2,3 |
2,4-2,6 |
>2,6 |
1,3-2,1 |
2,2-2,3 |
2,4-2,5 |
>2,5 |
|
КДО, мл |
46-106 |
107-120 |
121-130 |
>130 |
62-150 |
151-174 |
175-200 |
>200 |
|
КДO/ППТ, мл/м2 |
29-61 |
62-70 |
71-80 |
>80 |
34-74 |
75-89 |
90-100 |
>100 |
|
КCО, мл |
14-42 |
43-55 |
56-67 |
>67 |
21-61 |
62-73 |
74-85 |
>85 |
|
КCO/ППТ, мл/м2 |
8-24 |
25-32 |
33-40 |
>40 |
11-31 |
32-38 |
39-45 |
>45 |
|
ФВ,% |
54-74 |
41-53 |
30-40 |
<30 |
52-72 |
41-51 |
30-40 |
<30 |
Сокращения: КДО — конечный диастолический объем, КДР — конечный диастолический размер, КСО — конечный систолический объем, КСР — конечный систолический размер, ППТ — площадь поверхности тела, ФВ — фракция выброса.
Приложение Б. Алгоритмы действий врача
Алгоритм выбора тактики лечения пациента с острым миокардитом на основании исходного гемодинамического профиля
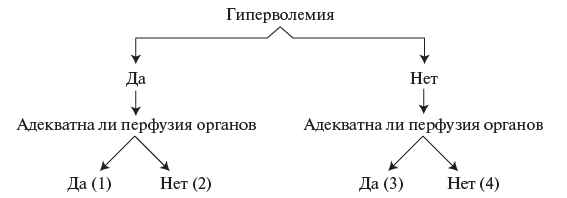
Ситуация (1). У пациента очевидна гиперволемия, но перфузия органов адекватна, такой фенотип по классификации J. S. Forrester и L. W. Stevenson характеризуется как "влажный — теплый". Показано назначение диуретиков, вазодилататоров для лечения заболеваний сердца и при их неэффективности — ультрафильтрации крови.
Ситуация (2). У пациента очевидна гиперволемия, но перфузия органов неадекватна, такой фенотип по классификации J. S. Forrester и L. W. Stevenson характеризуется как "влажный — холодный". При уровне систолического давления <90 мм рт.ст. показаны: препараты с положительным инотропным эффектом — адренергические и дофаминергические средства (C01CA), вазопрессоры, диуретики, и при неэффективности — методы механической поддержки кровообращения.
При уровне систолического давления >90 мм рт.ст. показаны: вазодилататоры для лечения заболеваний сердца, диуретики, и при неэффективности мочегонной терапии — препараты с положительным инотропным эффектом — адренергические и дофаминергические средства (C01CA).
Ситуация (3). У пациента нет гиперволемии и перфузия органов неадекватна, такой фенотип по классификации J. S. Forrester и L. W. Stevenson характеризуется как "сухой — холодный". В этой ситуации показаны препараты с положительным инотропным эффектом — адренергические и дофаминергические средства (C01CA).
Ситуация (4). У пациента нет гиперволемии и перфузия органов адекватна, такой фенотип по классификации J. S. Forrester и L. W. Stevenson характеризуется как "сухой — теплый". В этой ситуации показана обычная терапия.
Приложение В. Информация для пациента
Миокардит — это групповое понятие (группа самостоятельных нозологических единиц или проявление других заболеваний), поражение миокарда воспалительной природы, инфекционной, токсической (в т.ч. лекарственной), аллергической, аутоиммунной или неясной этиологии, с широким спектром клинических симптомов: от бессимптомного течения, легкой одышки и невыраженных болей в грудной клетке, проходящих самостоятельно, до сердечной недостаточности, кардиогенного шока, жизнеугрожающих нарушений ритма и внезапной сердечной смерти.
Советы пациенту и его семье
Удовлетворительное самочувствие и отсутствие симптомов недостаточности кровообращения не исключают возникновения рецидивов. В связи с этим необходимо регулярное диспансерное наблюдение у врача (не менее 1 года).
Необходима регулярная профилактика инфекционных заболеваний.
— Вакцинация против кори, краснухи, паротита, гриппа и полиомиелита.
— Вакцинация против пневмококка (с использованием вакцины для профилактики пневмококковых инфекций).
В остром периоде миокардита необходимо избегать интенсивных физических нагрузок.
В период реабилитации показана физическая активность от низкой до умеренной интенсивности, под наблюдением врача-специалиста.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Индекс Тей (Tei index (Myocardial Performance Index) [129, 130]
Тип: индекс
Индекс Тей эхокардиографический показатель относительной количественной оценки систолической и диастолической функции ЛЖ.
Индекс Тей рассчитывается по следующей формуле:
Индекс Тей = ИВС + ИВР / ПИК,
где: ИВС — время изоволюмического сокращения ЛЖ; ИВР — время изоволюмического расслабления ЛЖ; ПИК — период изгнания крови в аорту.
Ключ (интерпретация): Нормальные значения индекса Тей варьируют, обычно ≤0,39 считается нормой. Повышенные значения индекса (≥0,40) указывают на нарушение функции миокарда, отражая ухудшение общей производительности сердца.
Пояснения: Индекс Тей позволяет комплексно оценивать сердечную функцию, объединяя показатели систолической и диастолической активности миокарда.
Приложение Г2. Миннесотский опросник качества жизни больных хронической сердечной недостаточностью
Оригинальное название: Minnesota Living with Heart Failure Questionnaire (MLHFQ) [221].
Тип: вопросник.
|
№ |
Вопрос: "Мешала ли вам сердечная недостаточность жить так, как вы хотели, в течение последнего месяца (4 нед.) из-за: — "? |
Нет |
Незначительно |
Очень сильно |
Очень сильно |
||
|
1 |
Отечности стоп, голеней и т.д.? |
0 |
1 |
2 |
3 |
4 |
5 |
|
2 |
Необходимости отдыхать сидя или лёжа в течение дня? |
0 |
1 |
2 |
3 |
4 |
5 |
|
3 |
Трудностей при ходьбе или при подъеме по лестнице? |
0 |
1 |
2 |
3 |
4 |
5 |
|
4 |
Ограничений во время работы по дому или на дачном участке? |
0 |
1 |
2 |
3 |
4 |
5 |
|
5 |
Невозможности дальних поездок? |
0 |
1 |
2 |
3 |
4 |
5 |
|
6 |
Нарушения полноценного сна в ночное время? |
0 |
1 |
2 |
3 |
4 |
5 |
|
7 |
Трудностей во взаимоотношениях с членами семьи или друзьями? |
0 |
1 |
2 |
3 |
4 |
5 |
|
8 |
Ограниченной возможности зарабатывать на жизнь? |
0 |
1 |
2 |
3 |
4 |
5 |
|
9 |
Невозможности полноценного активного отдыха, занятий спортом? |
0 |
1 |
2 |
3 |
4 |
5 |
|
10 |
Невозможности полноценной половой жизни? |
0 |
1 |
2 |
3 |
4 |
5 |
|
11 |
Особенностей питания, ограничивающих количество и разнообразие потребляемых продуктов? |
0 |
1 |
2 |
3 |
4 |
5 |
|
12 |
Ощущения нехватки воздуха? |
0 |
1 |
2 |
3 |
4 |
5 |
|
13 |
Ощущения усталости, утомления, отсутствия энергии? |
0 |
1 |
2 |
3 |
4 |
5 |
|
14 |
Необходимости периодически находиться в больнице? |
0 |
1 |
2 |
3 |
4 |
5 |
|
15 |
Затрат на лекарства? |
0 |
1 |
2 |
3 |
4 |
5 |
|
16 |
Побочного действия лекарств? |
0 |
1 |
2 |
3 |
4 |
5 |
|
17 |
Ощущения, что вы являетесь обузой для семьи? |
0 |
1 |
2 |
3 |
4 |
5 |
|
18 |
Ощущения беспомощности? |
0 |
1 |
2 |
3 |
4 |
5 |
|
19 |
Ощущения беспокойства? |
0 |
1 |
2 |
3 |
4 |
5 |
|
20 |
Неспособность сконцентрироваться и ухудшения памяти? |
0 |
1 |
2 |
3 |
4 |
5 |
|
21 |
Депрессии? |
0 |
1 |
2 |
3 |
4 |
5 |
Ключ (интерпретация): 0 баллов — отличное качество жизни, 105 баллов — максимально плохое качество жизни.
Пояснения: этот опросник предназначен для оценки того, как сердечная недостаточность ограничивала ваши возможности в этом месяце. Представленные ниже вопросы отражают различные выражения влияния сердечной недостаточности на жизнь страдающих ею больных. Если вы уверены, что данного симптома у вас нет, или он не оказывал существенного влияния на вашу жизнь в этом месяце, обведите знак "0" (Нет). Если же указанный симптом имеется и мешает вам жить так, как бы вы хотели, обведите цифру от 1 до 5 в соответствии с тяжестью симптома по возрастающей.
Приложение Г3. Шкала оценки риска тромбоэмболических осложнений CHA2DS2-VASс
Название на русском языке: CHA2DS2-VASс. Шкала оценки риска тромбоэмболических осложнений у пациентов с фибрилляцией/трепетанием предсердий.
Оригинальное название (если есть): CHA2DS2-VASс.
Источник (официальный сайт разработчиков, публикация с валидацией):
Olesen JB, Lip GY, Hansen ML, et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ. 2011;342: d124. doi:10.1136/bmj.d124.
Тип (подчеркнуть):
— шкала оценки
Назначение: клинический инструмент для прогнозирования риска ишемического инсульта и системного тромбоэмболизма при фибрилляции и трепетании предсердий.
Содержание (шаблон):
|
Факторы риска |
Баллы |
|
С — хроническая сердечная недостаточность/дисфункция левого желудочка |
1 |
|
H — артериальная гипертония |
1 |
|
А — возраст ≥75 лет |
2 |
|
D — диабет |
1 |
|
S — ишемический инсульт/транзиторная ишемическая атака/системные эмболии в анамнезе |
2 |
|
VASc — сосудистое заболевание (инфаркт миокарда в анамнезе, атеросклероз периферических артерий нижних конечностей, атеросклеротическая бляшка в аорте) |
1 |
|
Возраст 65-74 года |
1 |
|
Женский пол |
1 |
Ключ (интерпретация):
|
Сумма баллов по шкале CHA2DS2-VASc |
Ожидаемая частота инсультов за год |
|
0 |
0% |
|
1 |
1,3% |
|
2 |
2,2% |
|
3 |
3,2% |
|
4 |
4,0% |
|
5 |
6,7% |
|
6 |
9,8% |
|
7 |
9,6% |
|
8 |
12,5% |
|
9 |
15,2% |
Пояснения: нет.
Список литературы
1. Maisch B, Pankuweit S. Current treatment options in (peri)myocarditis and inflammatory cardiomyopathy. Herz. 2012;37(6):644-56. doi:10.1007/s00059-012-3679-9.
2. Caforio AL, Calabrese F, Angelini A, et al. A prospective study of biopsy-proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur Heart J. 2007;28(11):1326-33. doi:10.1093/eurheartj/ehm076.
3. Kindermann I, Kindermann M, Kandolf R, et al. Predictors of outcome in patients with suspected myocarditis. Circulation. 2008;118(6):639-48. doi:10.1161/CIRCULATIONAHA. 108.769489.
4. Mahrholdt H, Goedecke C, Wagner A, et al. Cardiovascular magnetic resonance assessment of human myocarditis: a comparison to histology and molecular pathology. Circulation. 2004;109(10):1250-8. doi:10.1161/01.CIR.0000118493.13323.81.
5. Bock CT, Klingel K, Kandolf R. Human parvovirus B19-associated myocarditis. N Engl J Med. 2010;362(13):1248-9. doi:10.1056/NEJMc0911362.
6. Schultheiss HP, Kühl U, Cooper LT. The management of myocarditis. Eur Heart J. 2011;32(21):2616-25. doi:10.1093/eurheartj/ehr165.
7. Kühl U, Pauschinger M, Seeberg B, et al. Viral persistence in the myocardium is associated with progressive cardiac dysfunction. Circulation. 2005;112(13):1965-70. doi:10.1161/CIRCULATIONAHA.105.548156.
8. Bowles NE, Ni J, Kearney DL, et al. Detection of viruses in myocardial tissues by polymerase chain reaction. Evidence of adenovirus as a common cause of myocarditis in children and adults. J Am Coll Cardiol. 2003;42(3):466-72. doi:10.1016/s0735-1097(03)00648-x.
9. Magnani JW, Danik HJ, Dec GW Jr, et al. Survival in biopsy-proven myocarditis: a longterm retrospective analysis of the histopathologic, clinical, and hemodynamic predictors. Am Heart J. 2006;151(2):463-70. doi:10.1016/j.ahj.2005.03.037.
10. Curigliano G, Cardinale D, Suter T, et al. ESMO Guidelines Working Group. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncol. 2012;23(Suppl 7):vii155-66. doi:10.1093/annonc/mds293.
11. Арутюнов Г. П., Колесникова Е. А., Беграмбекова Ю. Л. и др. Рекомендации по назначению физических тренировок пациентам с хронической сердечной недостаточностью. Журнал Сердечная Недостаточность. 2017;18(1):41-66. doi:10.18087/rhfj.2017.1.2339.
12. Curigliano G, Cardinale D, Suter T, et al. ESMO Guidelines Working Group. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncol. 2020;31(2):171-90.
13. Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials. Cancer. 2003;97(11):2869-79. doi:10.1002/cncr.11407.
14. Zawadowski GM, Klarich KW, Moder KG, et al. A contemporary case series of lupus myocarditis. Lupus. 2012;21(13):1378-84. doi:10.1177/0961203312456752.
15. Mason JW. Myocarditis and dilated cardiomyopathy: an inflammatory link. Cardiovasc Res. 2003;60(1):5-10. doi:10.1016/s0008-6363(03)00437-1.
16. Gauntt C, Huber S. Coxsackievirus experimental heart diseases. Front Biosci. 2003;8: e23-35. doi:10.2741/928.
17. Engler RJ, Nelson MR, Collins LC Jr, et al. A prospective study of the incidence of myocarditis/pericarditis and new onset cardiac symptoms following smallpox and influenza vaccination. PLoS One. 2015;10(3):e0118283. doi:10.1371/journal.pone.0118283.
18. Pankuweit S, Ruppert V, Maisch B. Inflammation in dilated cardiomyopathy. Herz. 2004;29(8):788-93. doi:10.1007/s00059-004-2626-9.
19. Pankuweit S, Portig I, Maisch B. Pathophysiology of cardiac inflammation: molecular mechanisms. Herz. 2002;27(7):669-76. doi:10.1007/s00059-002-2421-4.
20. Maisch B, Ristić AD, Hufnagel G, et al. Pathophysiology of viral myocarditis: the role of humoral immune response. Cardiovasc Pathol. 2002;11(2):112-22. doi:10.1016/s10548807(01)00113-2.
21. D’Ambrosio A, Patti G, Manzoli A, et al. The fate of acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart. 2001;85(5):499504. doi:10.1136/heart.85.5.499.
22. Leone O, Veinot JP, Angelini A, et al. 2011 consensus statement on endomyocardial biopsy from the Association for European Cardiovascular Pathology and the Society for Cardiovascular Pathology. Cardiovasc Pathol. 2012;21(4):245-74. doi:10.1016/j.carpath.2011.10.001.
23. Richardson P, McKenna W, Bristow M, et al. Report of the 1995 World Health Organization/ International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation. 1996;93(5):841-2. doi:10.1161/01.cir.93.5.841.
24. Mason JW, O’Connell JB, Herskowitz A, et al. The Myocarditis Treatment Trial Investigators. A clinical trial of immunosuppressive therapy for myocarditis. N Engl J Med. 1995;333(5):26975. doi:10.1056/NEJM199508033330501.
25. Felker GM, Hu W, Hare JM, et al. The spectrum of dilated cardiomyopathy. The Johns Hopkins experience with 1,278 patients. Medicine (Baltimore). 1999;78(4):270-83. doi:10.1097/00005792-199907000-00005.
26. Towbin JA, Lowe AM, Colan SD, et al. Incidence, causes, and outcomes of dilated cardiomyopathy in children. JAMA. 2006;296(15):1867-76. doi:10.1001/jama.296.15.1867.
27. Cooper LT Jr. Myocarditis. N Engl J Med. 2009;360(15):1526-38. doi:10.1056/NEJMra0800028.
28. Global Burden of Disease Study 2013 Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2015;386(9995):743-800. doi:10.1016/S01406736(15)60692-4.
29. Maron BJ, Udelson JE, Bonow RO, et al. American Heart Association Electrocardiography and Arrhythmias Committee of Council on Clinical Cardiology, Council on Cardiovascular Disease in Young, Council on Cardiovascular and Stroke Nursing, Council on Functional Genomics and Translational Biology, and American College of Cardiology. Eligibility and Disqualification Recommendations for Competitive Athletes With Cardiovascular Abnormalities: Task Force 3: Hypertrophic Cardiomyopathy, Arrhythmogenic Right Ventricular Cardiomyopathy and Other Cardiomyopathies, and Myocarditis: A Scientific Statement From the American Heart Association and American College of Cardiology. Circulation. 2015;132(22):e273-80. doi:10.1161/CIR.0000000000000239.
30. Karjalainen J, Heikkilä J. Incidence of three presentations of acute myocarditis in young men in military service. A 20-year experience. Eur Heart J. 1999;20(15):1120-5. doi:10.1053/euhj.1998.1444.
31. Арутюнов А. Г., Рылова А. К., Арутюнов Г. П. Регистр госпитализированных пациентов с декомпенсацией кровообращения (Павловский регистр). Сообщение 1. Современная клиническая характеристика пациента с декомпенсацией кровообращения. Клинические фенотипы пациентов. Журнал Сердечная Недостаточность. 2014;15(1):23-32.
32. Wakafuji S, Okada R. Twenty year autopsy statistics of myocarditis incidence in Japan. Jpn Circ J. 1986;50(12):1288-93. doi:10.1253/jcj.50.1288.
33. Passarino G, Burlo P, Ciccone G, et al. Prevalence of myocarditis at autopsy in Turin, Italy. Arch Pathol Lab Med. 1997;121(6):619-22.
34. Hufnagel G, Pankuweit S, Richter A, et al. The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID). First epidemiological results. Herz. 2000;25(3):279-85. doi:10.1007/s000590050021.
35. Kytö V, Sipilä J, Rautava P. The effects of gender and age on occurrence of clinically suspected myocarditis in adulthood. Heart. 2013;99(22):1681-4. doi:10.1136/heartjnl-2013-304449.
36. Fairweather D, Cooper LT Jr, Blauwet LA. Sex and gender differences in myocarditis and dilated cardiomyopathy. Curr Probl Cardiol. 2013;38(1):7-46. doi:10.1016/j.cpcardiol.2012.07.003.
37. Saji T, Matsuura H, Hasegawa K, et al. Comparison of the clinical presentation, treatment, and outcome of fulminant and acute myocarditis in children. Circ J. 2012;76(5):1222-8. doi:10.1253/circj.cj-11-1032.
38. Caforio AL, Pankuweit S, Arbustini E, et al. European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(33):2636-48, 2648a-2648d. doi:10.1093/eurheartj/eht210.
39. Schultz JC, Hilliard AA, Cooper LT Jr, et al. Diagnosis and treatment of viral myocarditis. Mayo Clin Proc. 2009;84(11):1001-9. doi:10.1016/S0025-6196(11)60670-8.
40. Klein RM, Jiang H, Niederacher D, et al. Frequency and quantity of the parvovirus B19 genome in endomyocardial biopsies from patients with suspected myocarditis or idiopathic left ventricular dysfunction. Z Kardiol. 2004;93(4):300-9. doi:10.1007/s00392-004-0079-z.
41. Kühl U, Pauschinger M, Noutsias M, et al. High Prevalence of Viral Genomes and Multiple Viral Infections in the Myocardium of Adults With "Idiopathic" Left Ventricular Dysfunction. Circulation. 2005;111(7):887-93.
42. Kuethe F, Lindner J, Matschke K, et al. Prevalence of parvovirus B19 and human bocavirus DNA in the heart of patients with no evidence of dilated cardiomyopathy or myocarditis. Clin Infect Dis. 2009;49(11):1660-6. doi:10.1086/648074.
43. Stewart GC, Lopez-Molina J, Gottumukkala RV, et al. Myocardial parvovirus B19 persistence: lack of association with clinicopathologic phenotype in adults with heart failure. Circ Heart Fail. 2011;4(1):71-8. doi:10.1161/CIRCHEARTFAILURE.110.958249.
44. Lassner D, Rohde M, Siegismund C, et al. Myocarditis — Personalized Medicine by Expanded Endomyocardial Biopsy Diagnostics. World J. Cardiovasc. Dis. 2014;04(06):325-40. doi:10.4236/wjcd.2014.46042.
45. Pankuweit S, Moll R, Baandrup U, et al. Prevalence of the parvovirus B19 genome in endomyocardial biopsy specimens. Hum Pathol. 2003;34(5):497-503. doi:10.1016/s0046-8177(03)00078-9.
46. Dequin P-F, Heming N, Meziani F, et al. CAPE COVID Trial Group and the CRICS-TriGGERSep Network. Effect of Hydrocortisone on 21-Day Mortality or Respiratory Support Among Critically Ill Patients With COVID-19: A Randomized Clinical Trial. JAMA. 2020;324(13):1298306. doi:10.1001/jama.2020.16761.
47. Ammirati E, Lupi L, Palazzini M, et al. Prevalence, Characteristics, and Outcomes of COVID-19-Associated Acute Myocarditis. Circulation. 2022;145(15):1123-39. doi:10.1161/CIRCULATIONAHA.121.056817.
48. Sabatine M, Poh KK, Mega, Jessica S, et al. Case records of the Massachusetts General Hospital. Case 36-2007. A 31-year-old woman with rash, fever, and hypotension. The New England journal of medicine. 2007;357(21):2167-78. doi:10.1056/NEJMcpc079030.
49. Cooper LT, Baughman KL, Feldman AM, et al. American Heart Association; American College of Cardiology; European Society of Cardiology; Heart Failure Society of America; Heart Failure Association of the European Society of Cardiology. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol. 2007;50(19):1914-31. doi:10.1016/j.jacc.2007.09.008.
50. Kindermann I, Barth C, Mahfoud F, et al. Update on myocarditis. J Am Coll Cardiol. 2012;59(9):779-92. doi:10.1016/j.jacc.2011.09.074.
51. Sagar S, Liu PP, Cooper LT Jr. Myocarditis. Lancet. 2012;379(9817):738-47. doi:10.1016/S0140-6736(11)60648-X.
52. Dennert R, Crijns HJ, Heymans S. Acute viral myocarditis. Eur Heart J. 2008;29(17):2073-82. doi:10.1093/eurheartj/ehn296.
53. McCarthy RE 3rd, Boehmer JP, Hruban RH, et al. Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis. N Engl J Med. 2000;342(10):690-5. doi:10.1056/NEJM200003093421003.
54. William Dec G. Introduction to Clinical Myocarditis. Myocarditis: From Bench to Bedside/ ed. Cooper L. T. Totowa, NJ: Humana Press. 2003:257-81.
55. Baccouche H, Mahrholdt H, Meinhardt G, et al. Diagnostic synergy of non-invasive cardiovascular magnetic resonance and invasive endomyocardial biopsy in troponin-positive patients without coronary artery disease. Eur Heart J. 2009;30(23):2869-79. doi:10.1093/eurheartj/ehp328.
56. Frustaci A, Verardo R, Caldarulo M, et al. Myocarditis in hypertrophic cardiomyopathy patients presenting acute clinical deterioration. Eur Heart J. 2007;28(6):733-40. doi:10.1093/eurheartj/ehl525.
57. Dec GW Jr, Waldman H, Southern J, et al. Viral myocarditis mimicking acute myocardial infarction. J Am Coll Cardiol. 1992;20(1):85-9. doi:10.1016/0735-1097(92)90141-9.
58. Ferreira VM, Piechnik SK, Dall’Armellina E, et al. T(1) mapping for the diagnosis of acute myocarditis using CMR: comparison to T2-weighted and late gadolinium enhanced imaging. JACC Cardiovasc Imaging. 2013;6(10):1048-58. doi:10.1016/j.jcmg.2013.03.008.
59. Abdel-Aty H, Boyé P, Zagrosek A, et al. Diagnostic performance of cardiovascular magnetic resonance in patients with suspected acute myocarditis: comparison of different approaches. J Am Coll Cardiol. 2005;45(11):1815-22. doi:10.1016/j.jacc.2004.11.069.
60. van Nierop J, Limburg A, van Ofwegen-Hanekamp CEE. Myocarditis mimicking acute myocardial infarction. Neth Heart J. 2015;23(10):502-4. doi:10.1007/s12471-015-0732-3.
61. Basman C, Agrawal PR, McRee C, et al. Diagnostic Approach to Myocarditis Mimicking Myocardial Infarction at Initial Presentation. Cardiol Res. 2016;7(6):209-13. doi:10.14740/cr485w.
62. Kühl U, Pauschinger M, Bock T, et al. Parvovirus B19 infection mimicking acute myocardial infarction. Circulation. 2003;108(8):945-50. doi:10.1161/01.CIR.0000085168.02782.2C.
63. Basic D, Gupta S, Kwong RY. Parvovirus B19-Induced Myocarditis Mimicking Acute Myocardial Infarction: Clarification of Diagnosis by Cardiac Magnetic Resonance Imaging. Circulation. 2010;121(7):e40-2. doi:10.1161/CIR.0b013e3181d310ea.
64. Collier RJ. Diphtheria toxin: mode of action and structure. Bacteriol Rev. 1975;39(1):5485. doi:10.1128/br.39.1.54-85.1975.
65. Stockins BA, Lanas FT, Saavedra JG, et al. Prognosis in patients with diphtheric myocarditis and bradyarrhythmias: assessment of results of ventricular pacing. Br Heart J. 1994;72(2):190-1. doi:10.1136/hrt.72.2.190.
66. Bethell DB, Nguyen MD, Ha TL, et al. Prognostic value of electrocardiographic monitoring of patients with severe diphtheria. Clin Infect Dis. 1995;20(5):1259-65. doi:10.1093/clinids/20.5.1259.
67. Escher F, Pietsch H, Aleshcheva G, et al. Detection of viral SARS-CoV-2 genomes and histopathological changes in endomyocardial biopsies. ESC Heart Fail. 2020;7(5):2440-7. doi:10.1002/ehf2.12805.
68. Wenzel P, Kopp S, Göbel S, et al. Evidence of SARS-CoV-2 mRNA in endomyocardial biopsies of patients with clinically suspected myocarditis tested negative for COVID-19 in nasopharyngeal swab. Cardiovasc Res. 2020;116(10):1661-3. doi:10.1093/cvr/cvaa160.
69. Basso C, Leone O, Rizzo S, et al. Pathological features of COVID-19-associated myocardial injury: a multicentre cardiovascular pathology study. Eur Heart J. 2020;41(39):3827-35. doi:10.1093/eurheartj/ehaa664.
70. Sala S, Peretto G, Gramegna M, et al. Acute myocarditis presenting as a reverse Tako-Tsubo syndrome in a patient with SARS-CoV-2 respiratory infection. Eur Heart J. 2020;41(19):1861-2. doi:10.1093/eurheartj/ehaa286.
71. Nakatani S, Ohta-Ogo K, Nishio M, et al. Microthrombosis as a cause of fulminant myocarditis-like presentation with COVID-19 proven by endomyocardial biopsy. Cardiovasc Pathol. 2022;60:107435. doi:10.1016/j.carpath.2022.107435.
72. Inciardi RM, Lupi L, Zaccone G, et al. Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020;5(7):819-24. doi:10.1001/jamacardio.2020.1096.
73. Irabien-Ortiz Á, Carreras-Mora J, Sionis A, et al. Miocarditis fulminante por COVID-19 [Fulminant myocarditis due to COVID-19]. Rev Esp Cardiol. 2020;73(6):503-4. Spanish. doi:10.1016/j.recesp.2020.04.001.
74. Roshdy A, Zaher S, Fayed H, et al. COVID-19 and the Heart: A Systematic Review of Cardiac Autopsies. Front Cardiovasc Med. 2021;7:626975. doi:10.3389/fcvm.2020.626975.
75. Craver R, Huber S, Sandomirsky M, et al. Fatal Eosinophilic Myocarditis in a Healthy 17-YearOld Male with Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2c). Fetal Pediatr Pathol. 2020;39(3):263-8. doi:10.1080/15513815.2020.1761491.
76. Cavalli G, De Luca G, Campochiaro C, et al. Interleukin-1 blockade with high-dose anakinra in patients with COVID-19, acute respiratory distress syndrome, and hyperinflammation: a retrospective cohort study. Lancet Rheumatol. 2020;2(6):e325-e331. doi:10.1016/S2665-9913(20)30127-2.
77. Yeleti R, Guglin M, Saleem K, et al. Fulminant myocarditis: COVID or not COVID? Reinfection or co-infection? Future Cardiol. 2021;17(8):1307-11. doi:10.2217/fca-2020-0237.
78. Kim IC, Kim JY, Kim HA, et al. COVID-19-related myocarditis in a 21-year-old female patient. Eur Heart J. 2020;41(19):1859. doi:10.1093/eurheartj/ehaa288.
79. Paul JF, Charles P, Richaud C, et al. Myocarditis revealing COVID-19 infection in a young patient. Eur Heart J Cardiovasc Imaging. 2020;21(7):776. doi:10.1093/ehjci/jeaa107.
80. Sinagra G, Porcari A, Merlo M, et al. Myocarditis and pericarditis following mRNA COVID-19 vaccination. Expert opinion of the Italian Society of Cardiology. G. Ital. Cardiol. 2021;22:894-9. doi:10.1714/3689.36747.
81. Sinagra G, Porcari A, Merlo M, et al. 2022 Update on myocarditis and pericarditis following COVID-19 vaccination. Expert Opinion of the Italian Society of Cardiology. G. Ital. Cardiol. (2006) 2022;23:408-13.
82. Mistrulli R, Ferrera A, Muthukkattil ML, et al. SARS-CoV-2 Related Myocarditis: What We Know So Far. J Clin Med. 2023;12(14):4700.
83. Благова О. В., Коган Е. А., Лутохина Ю. А. и др. Постковидный миоэндокардит подострого и хронического течения: клинические формы, роль персистенции коронавируса и аутоиммунных механизмов. Кардиология. 2021;61(6):11-27. doi:10.18087/cardio.2021.6.n1659.
84. Blagova O, Lutokhina Y, Kogan E, et al. Chronic biopsy proven post-COVID myoendocarditis with SARS-Cov-2 persistence and high level of antiheart antibodies. Clin Cardiol. 2022;45(9):952-9. doi:10.1002/clc.23886.
85. Ramírez-García A, Lozano Jiménez S, Darnaude Ximénez I, et al. Pericarditis tras la administración de la vacuna de ARNm BNT162b2 contra la COVID-19 [Pericarditis after administration of the BNT162b2 mRNA COVID-19 vaccine]. Rev Esp Cardiol. 2021;74(12):11213. Spanish. doi:10.1016/j.recesp.2021.06.006.
86. Maiese A, Baronti A, Manetti AC, et al. Death after the Administration of COVID-19 Vaccines Approved by EMA: Has a Causal Relationship Been Demonstrated? Vaccines (Basel). 2022;10(2):308. doi:10.3390/vaccines10020308.
87. Kim SH, Lee SY, Kim GY, et al. A Case of Heart Transplantation for Fulminant Myocarditis After ChAdOx1 nCoV-19 Vaccination. J Korean Med Sci. 2022;37(13):e104. doi:10.3346/jkms.2022.37.e104.
88. Khan MZ, Janus S, Franklin S, et al. COVID-19 Vaccination-Induced Cardiomyopathy Requiring Permanent Left Ventricular Assist Device. Cureus. 2022;14(4):e24477. doi:10.7759/cureus.24477.
89. Lane S, Yeomans A, Shakir S. Reports of myocarditis and pericarditis following mRNA COVID-19 vaccination: a systematic review of spontaneously reported data from the UK, Europe and the USA and of the scientific literature. BMJ Open. 2022;12(5):e059223.
90. Hatziantoniou S, Anastassopoulou C, Lazaros G, et al. Comparative assessment of myocarditis and pericarditis reporting rates related to mRNA COVID-19 vaccines in Europe and the United States. Expert Rev Vaccines. 2022;21(11):1691-6. doi:10.1080/1476058 4.2022.2100765.
91. Tschöpe C, Ammirati E, Bozkurt B, et al. Myocarditis and inflammatory cardiomyopathy: current evidence and future directions. Nat Rev Cardiol. 2021;18(3):169-93. doi:10.1038/s41569-020-00435-x.
92. Kiblboeck D, Klingel K, Genger M, et al. Myocarditis following mRNA COVID-19 vaccination: call for endomyocardial biopsy. ESC Heart Fail. 2022;9(3):1996-2002. doi:10.1002/ehf2.13791.
93. Kounis NG, Koniari I, Mplani V, et al. Hypersensitivity Myocarditis and the Pathogenetic Conundrum of COVID-19 Vaccine-Related Myocarditis. Cardiology. 2022;147(4):413-5. doi:10.1159/000524224.
94. Frustaci A, Verardo R, Galea N, et al. Hypersensitivity Myocarditis after COVID-19 mRNA Vaccination. J Clin Med. 2022;11(6):1660. doi:10.3390/jcm11061660.
95. Okayama K. Comparison of 18F-FDG PET and 67Ga scintigraphy in patients with cardiac sarcoidosis. J Nucl Med. 2015;56(3):343-8.
96. Horiuchi K, Kosugi S, Abe H, et al. Fulminant myocarditis after the first dose of mRNA-1273 vaccination in a patient with previous COVID-19: a case report. Eur Heart J Case Rep. 2022;6(7):ytac290. doi:10.1093/ehjcr/ytac290.
97. Ammirati E, Cavalotti C, Milazzo A, et al. Temporal relation between second dose BNT162b2 mRNA Covid-19 vaccine and cardiac involvement in a patient with previous SARS-COV-2 infection. Int J Cardiol Heart Vasc. 2021;34:100774. doi:10.1016/j.ijcha.2021.100774.
98. Cиницын В. Е., Стукалова О. В., Ларина О. М. и др. Новые возможности диагностики некоронарогенных поражений миокарда: роль магнитнорезонансной томографии. Креативная кардиология. 2008;(1):66-73.
99. Mestroni L, Maisch B, McKenna WJ, et al. Guidelines for the study of familial dilated cardiomyopathies. Collaborative Research Group of the European Human and Capital Mobility Project on Familial Dilated Cardiomyopathy. Eur Heart J. 1999;20(2):93-102. doi:10.1053/euhj.1998.1145.
100. Ferreira V, Schulz-Menger J, Holmvang G, et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. JACC. 2018;72(24): 3158-76.
101. Brown CA, OʼConnell JB. Implications of the Myocarditis Treatment Trial for clinical practice. Curr. Opin. Cardiol. 1996;11(3):332-6.
102. Deswal A, Petersen NJ, Feldman AM, et al. Cytokines and cytokine receptors in advanced heart failure: an analysis of the cytokine database from the Vesnarinone trial (VEST). Circulation. 2001;103(16):2055-9. doi:10.1161/01.cir.103.16.2055.
103. Lauer B, Schannwell M, Kühl U, et al. Antimyosin autoantibodies are associated with deterioration of systolic and diastolic left ventricular function in patients with chronic myocarditis. J Am Coll Cardiol. 2000;35(1):11-8. doi:10.1016/s0735-1097(99)00485-4.
104. Heymans S. Myocarditis and heart failure: need for better diagnostic, predictive, and therapeutic tools. 2007;28(11):1279-80. doi:10.1093/eurheartj/ehm111.
105. deFilippi CR, de Lemos JA, Christenson RH, et al. Association of serial measures of cardiac troponin T using a sensitive assay with incident heart failure and cardiovascular mortality in older adults. JAMA. 2010;304(22):2494-502. doi:10.1001/jama.2010.1708.
106. Deardorff R, Spinale FG. Cytokines and matrix metalloproteinases as potential biomarkers in chronic heart failure. Biomark Med. 2009;3(5):513-23. doi:10.2217/bmm.09.60.
107. Emdin M, Vittorini S, Passino C, et al. Old and new biomarkers of heart failure. Eur J Heart Fail. 2009;11(4):331-5. doi:10.1093/eurjhf/hfp035.
108. Zhang L, Hu D, Li J, et al. Autoantibodies against the myocardial beta1-adrenergic and M2-muscarinic receptors in patients with congestive heart failure. Chin Med J (Engl). 2002;115(8):1127-31.
109. Maisch B, Richter A, Sandmöller A, et al. BMBF-Heart Failure Network. Inflammatory dilated cardiomyopathy (DCMI). Herz. 2005;30(6):535-44. doi:10.1007/s00059-005-2730-5.
110. Frustaci A, Chimenti C, Calabrese F, et al. Immunosuppressive therapy for active lymphocytic myocarditis: virological and immunologic profile of responders versus nonresponders. Circulation. 2003;107(6):857-63. doi:10.1161/01.cir.0000048147.15962.31.
111. Staudt A, Staudt Y, Dörr M, et al. Potential role of humoral immunity in cardiac dysfunction of patients suffering from dilated cardiomyopathy. J. Am. Coll. Cardiol. 2004;44(4):829-36. doi:10.1016/j.jacc.2004.04.055.
112. Störk S, Boivin V, Horf R, et al. Stimulating autoantibodies directed against the cardiac beta1-adrenergic receptor predict increased mortality in idiopathic cardiomyopathy. Am Heart J. 2006;152(4):697-704. doi:10.1016/j.ahj.2006.05.004.
113. Warraich RS, Noutsias M, Kazak I, et al. Immunoglobulin G3 cardiac myosin autoantibodies correlate with left ventricular dysfunction in patients with dilated cardiomyopathy: immunoglobulin G3 and clinical correlates. Am Heart J. 2002;143(6):1076-84. doi:10.1067/mhj.2002.124406. Erratum in: Am Heart J. 2003;145(2):213. Kasac Ilkay [corrected to Kazak Ilkay].
114. Deubner N, Berliner D, Schlipp A, et al. Cardiac beta1-adrenoceptor autoantibodies in human heart disease: rationale and design of the Etiology, Titre-Course, and Survival (ETiCS) Study. Eur J Heart Fail. 2010;12(7):753-62. doi:10.1093/eurjhf/hfq072.
115. Mahfoud F, Gärtner B, Kindermann M, et al. Virus serology in patients with suspected myocarditis: utility or futility? Eur Heart J. 2011;32(7):897-903. doi:10.1093/eurheartj/ehq493.
116. Liu P, Martino T, Opavsky MA, et al. Viral myocarditis: balance between viral infection and immune response. Can J Cardiol. 1996;12(10):935-43.
117. Klingel K, Hohenadl C, Canu A, et al. Ongoing enterovirus-induced myocarditis is associated with persistent heart muscle infection: quantitative analysis of virus replication, tissue damage, and inflammation. Proc Natl Acad Sci U S A. 1992;89(1):314-8. doi:10.1073/pnas.89.1.314.
118. Baboonian C, Treasure T. Meta-analysis of the association of enteroviruses with human heart disease. Heart. 1997;78(6):539-43. doi:10.1136/hrt.78.6.539.
119. Mahrholdt H, Wagner A, Deluigi CC, et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation. 2006;114(15):1581-90. doi:10.1161/CIRCULATIONAHA.105.606509.
120. Grün S, Schumm J, Greulich S, et al. Long-term follow-up of biopsy-proven viral myocarditis: predictors of mortality and incomplete recovery. J Am Coll Cardiol. 2012;59(18):160415. doi:10.1016/j.jacc.2012.01.007.
121. Ukena C, Mahfoud F, Kindermann I, et al. Prognostic electrocardiographic parameters in patients with suspected myocarditis. Eur J Heart Fail. 2011;13(4):398-405. doi:10.1093/eurjhf/hfq229.
122. Yilmaz A. Imaging in inflammatory heart disease: from the past to current clinical practice. Hell. J. Cardiol. HJC Hell. Kardiologike Epitheorese. 2009;50(6):449-60.
123. Felker GM, Boehmer JP, Hruban RH, et al. Echocardiographic findings in fulminant and acute myocarditis. J Am Coll Cardiol. 2000;36(1):227-32. doi:10.1016/s0735-1097(00)00690-2.
124. Meindl C, Paulus M, Poschenrieder F, et al. Patients with acute myocarditis and preserved systolic left ventricular function: comparison of global and regional longitudinal strain imaging by echocardiography with quantification of late gadolinium enhancement by CMR. Clin Res Cardiol. 2021;110(11):1792-800. doi:10.1007/s00392-021-01885-0.
125. Løgstrup BB, Nielsen JM, Kim WY, et al. Myocardial oedema in acute myocarditis detected by echocardiographic 2D myocardial deformation analysis. Eur Heart J Cardiovasc Imaging. 2016;17(9):1018-26. doi:10.1093/ehjci/jev302.
126. Sperlongano S, D’Amato A, Tagliamonte E, et al. Acute myocarditis: prognostic role of speckle tracking echocardiography and comparison with cardiac magnetic resonance features. Heart Vessels. 2022;37(1):121-31. doi:10.1007/s00380-021-01893-0.
127. Novo G, Di Lisi D, La Franca E, et al. Usefulness of longitudinal systolic strain and delayed enhancement cardiac magnetic resonance in depicting risk of supraventricular arrhythmias in patients with acute myocarditis and preserved left ventricular function. Echocardiography. 2022;39(2):294-301. doi:10.1111/echo.15306.
128. Zuo H, Li H, Li R, et al. Myocardial strain features by 2D-STE during the course of fulminant myocarditis: Correlation with characteristics by CMR and clinical implications. Medicine (Baltimore). 2021;100(15):e25050. doi:10.1097/MD.0000000000025050.
129. Yadav DK, Choudhary S, Gupta PK, et al. The Tei index and asymptomatic myocarditis in children with severe dengue. Pediatr Cardiol. 2013;34(6):1307-13. doi:10.1007/s00246-013-0639-y.
130. Mirna M, Schmutzler L, Vogl F, et al. Tei Index Is a Useful Adjunctive Tool in the Diagnostic Workup of Patients with Acute Myocarditis. J Cardiovasc Dev Dis. 2022;9(8):283. doi:10.3390/jcdd9080283.
131. Fields CL, Ossorio MA, Roy TM, et al. Thallium-201 scintigraphy in the diagnosis and management of myocardial sarcoidosis. South Med J. 1990;83(3):339-42. doi:10.1097/00007611-199003000-00022.
132. Le Guludec D, Menad F, Faraggi M, et al. Myocardial sarcoidosis. Clinical value of technetium-99m sestamibi tomoscintigraphy. Chest. 1994;106(6):1675-82. doi:10.1378/chest.106.6.1675.
133. O’Connell JB, Henkin RE, Robinson JA, et al. Gallium-67 imaging in patients with dilated cardiomyopathy and biopsy-proven myocarditis. Circulation. 1984;70(1):58-62. doi:10.1161/01.cir.70.1.58.
134. Ohira H, Tsujino I, Yoshinaga K. 18F-Fluoro-2-deoxyglucose positron emission tomography in cardiac sarcoidosis. Eur. J. Nucl. Med. Mol. Imaging. 2011;38(9):1773-83.
135. Нарусов О. Ю., Алаева Е. Н., Терещенко С. Н. Диагностические возможности магнитно-резонансной томографии сердца у больных с воспалительной кардиомиопатией: сопоставление результатов с данными эндомиокардиальной биопсии и клинической картиной. Терапевтический архив. 2013;85(4):22-8.
136. Синицын В. Е., Мершина Е. А., Коробкова И. З. и др. Магнитно-резонансная томография в диагностике миокардитов и кардиомиопатий. Методика проведения исследования: учебно-методическое пособие. М.: "КДУ", 2024. 65 с. doi:10.31453/kdu.ru.978-5-00247-010-52024-65.
137. Voigt A, Elgeti T, Durmus T, et al. Cardiac magnetic resonance imaging in dilated cardiomyopathy in adults–towards identification of myocardial inflammation. Eur Radiol. 2011;21(5):925-35. doi:10.1007/s00330-010-1985-2.
138. Friedrich MG, Sechtem U, Schulz-Menger J, et al. International Consensus Group on Cardiovascular Magnetic Resonance in Myocarditis. Cardiovascular magnetic resonance in myocarditis: A JACC White Paper. J Am Coll Cardiol. 2009;53(17):1475-87. doi:10.1016/j.jacc.2009.02.007.
139. Kellman P, Wilson JR, Xue H, et al. Extracellular volume fraction mapping in the myocardium, part 1: evaluation of an automated method. J Cardiovasc Magn Reson. 2012;14(1):63. doi:10.1186/1532-429X-14-63.
140. Safiullina AA, Narusov OYu, Shariya MA, et al. The role of magnetic resonance imaging in the diagnosis of inflammatory myocardial diseases. Kardiologicheskii Vestnik. 2012;7(1):41-6. (In Russ.) Сафиуллина А. А., Нарусов О. Ю., Шария М. А. и др. Роль магнитно-резонансной томографии в диагностике воспалительных заболеваний миокарда. Кардиологический вестник. 2012;7(1):41-6.
141. Luetkens JA, Homsi R, Dabir D, et al. Comprehensive Cardiac Magnetic Resonance for Short-Term Follow-Up in Acute Myocarditis. J Am Heart Assoc. 2016;5(7):e003603. doi:10.1161/JAHA.116.003603.
142. Gutberlet M, Spors B, Thoma T, et al. Suspected chronic myocarditis at cardiac MR: diagnostic accuracy and association with immunohistologically detected inflammation and viral persistence. Radiology. 2008;246(2):401-9. doi:10.1148/radiol.2461062179.
143. Yilmaz A, Kindermann I, Kindermann M, et al. Comparative evaluation of left and right ventricular endomyocardial biopsy: differences in complication rate and diagnostic performance. Circulation. 2010;122(9):900-9. doi:10.1161/CIRCULATIONAHA.109.924167.
144. Chow LH, Radio SJ, Sears TD, et al. Insensitivity of right ventricular endomyocardial biopsy in the diagnosis of myocarditis. J Am Coll Cardiol. 1989;14(4):915-20. doi:10.1016/07351097(89)90465-8.
145. Parrillo JE, Aretz HT, Palacios I, et al. The results of transvenous endomyocardial biopsy can frequently be used to diagnose myocardial diseases in patients with idiopathic heart failure. Endomyocardial biopsies in 100 consecutive patients revealed a substantial incidence of myocarditis. Circulation. 1984;69(1):93-101. doi:10.1161/01.cir.69.1.93.
146. Ponikowski P, Voors AA, Anker SD, et al. ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37(27):2129-200. doi:10.1093/eurheartj/ehw128.
147. Mirabel M, Luyt CE, Leprince P, et al. Outcomes, long-term quality of life, and psychologic assessment of fulminant myocarditis patients rescued by mechanical circulatory support. Crit Care Med. 2011;39(5):1029-35. doi:10.1097/CCM.0b013e31820ead45.
148. Hsu KH, Chi NH, Yu HY, et al. Extracorporeal membranous oxygenation support for acute fulminant myocarditis: analysis of a single center’s experience. Eur. J. Cardio-Thorac. Surg. Off. J. Eur. Assoc. Cardio-Thorac. Surg. 2011;40(3):682-8. doi:10.1016/j.ejcts.2010.12.050.
149. Rawles JM, Kenmure AC. Controlled trial of oxygen in uncomplicated myocardial infarction. BMJ. 1976;1(6018):1121-3. doi:10.1136/bmj.1.6018.1121.
150. Мареев Ю. В., Мареев В. Ю. Характеристика и лечение пациентов с ХСН, госпитализированных в стационар. Кардиология. 2017;57(4S):19-30. doi:10.18087/cardio.2433.
151. Eapen ZJ, Reed SD, Li Y, et al. Do countries or hospitals with longer hospital stays for acute heart failure have lower readmission rates?: Findings from ASCEND-HF. Circ Heart Fail. 2013;6(4):727-32. doi:10.1161/CIRCHEARTFAILURE.112.000265.
152. Hernandez AF, Greiner MA, Fonarow GC, et al. Relationship between early physician follow-up and 30-day readmission among Medicare beneficiaries hospitalized for heart failure. JAMA. 2010;303(17):1716-22. doi:10.1001/jama.2010.533.
153. Felker GM, Lee KL, Bull DA, et al. Diuretic strategies in patients with acute decompensated heart failure. N. Engl. J. Med. 2011;364(9):797-805. doi:10.1056/NEJMoa1005419.
154. Ahmad T, Jackson K, Rao VS, et al. Worsening Renal Function in Patients With Acute Heart Failure Undergoing Aggressive Diuresis Is Not Associated With Tubular Injury. Circulation. 2018;137(19):2016-28. doi:10.1161/CIRCULATIONAHA.117.030112.
155. Мареев В. Ю., Выгодин В. А., Беленков Ю. Н. Диуретическая терапия эффективными дозами пероральных диуретиков торасемида (Диувер®) и фуросемида в лечении больных с обострением хронической сердечной недостаточности (ДУЭЛЬ-ХСН). Журнал Сердечная Недостаточность. 2011;12(1):3-10.
156. Knauf H, Mutschler E. Sequential nephron blockade breaks resistance to diuretics in edematous states. J. Cardiovasc. Pharmacol. 1997;29(3):367-72. doi:10.1097/00005344199703000-00010.
157. Martens P, Nijst P, Mullens W. Current Approach to Decongestive Therapy in Acute Heart Failure. Curr. Heart Fail. Rep. 2015;12(6):367-78. doi:10.1007/s11897-015-0273-5.
158. van Vliet AA, Donker AJ, Nauta JJ, et al. Spironolactone in congestive heart failure refractory to high-dose loop diuretic and low-dose angiotensin-converting enzyme inhibitor. Am. J. Cardiol. 1993;71(3):21A-28A. doi:10.1016/0002-9149(93)90241-4.
159. Butler J, Hernandez AF, Anstrom KJ, et al. Rationale and Design of the ATHENA-HF Trial: Aldosterone Targeted Neurohormonal Combined With Natriuresis Therapy in Heart Failure. JACC Heart Fail. 2016;4(9):726-35. doi:10.1016/j.jchf.2016.06.003.
160. Bart BA, Goldsmith SR, Lee KL, et al. Ultrafiltration in decompensated heart failure with cardiorenal syndrome. N. Engl. J. Med. 2012;367(24):2296-304. doi:10.1056/NEJMoa1210357.
161. Wakai A, McCabe A, Kidney R, et al. Nitrates for acute heart failure syndromes. Cochrane Database Syst Rev. 2013;2013(8):CD005151. doi:10.1002/14651858.CD005151.
162. Cotter G, Metzkor E, Kaluski E, et al. Randomised trial of high-dose isosorbide dinitrate plus low-dose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. Lancet Lond. Engl. 1998;351(9100):389-93. doi:10.1016/S0140-6736(97)08417-1.
163. Belletti A, Castro ML, Silvetti S, et al. The Effect of inotropes and vasopressors on mortality: a meta-analysis of randomized clinical trials. Br. J. Anaesth. 2015;115(5):656-75. doi:10.1093/bja/aev284.
164. Mebazaa A, Parissis J, Porcher R, et al. Short-term survival by treatment among patients hospitalized with acute heart failure: the global ALARM-HF registry using propensity scoring methods. Intensive Care Med. 2011;37(2):290-301. doi:10.1007/s00134-010-2073-4.
165. Elkayam U, Tasissa G, Binanay C, et al. Use and impact of inotropes and vasodilator therapy in hospitalized patients with severe heart failure. Am. Heart J. 2007;153(1):98-104. doi:10.1016/j.ahj.2006.09.005.
166. De Backer D, Biston P, Devriendt J, et al. Comparison of Dopamine and Norepinephrine in the Treatment of Shock. N. Engl. J. Med. 2010;362(9):779-89. doi:10.1056/NEJMoa0907118.
167. Giamouzis G, Butler J, Starling RC, et al. Impact of dopamine infusion on renal function in hospitalized heart failure patients: results of the Dopamine in Acute Decompensated Heart Failure (DAD-HF) Trial. J. Card. Fail. 2010;16(12):922-30. doi:10.1016/j.cardfail.2010.07.246.
168. Matsumori A, Igata H, Ono K, et al. High doses of digitalis increase the myocardial production of proinflammatory cytokines and worsen myocardial injury in viral myocarditis: a possible mechanism of digitalis toxicity. Jpn. Circ. J. 1999;63(12):934-40. doi:10.1253/jcj.63.934.
169. Kivikko M, Pollesello P, Tarvasmäki T, et al. Effect of baseline characteristics on mortality in the SURVIVE trial on the effect of levosimendan vs dobutamine in acute heart failure: Sub-analysis of the Finnish patients. Int. J. Cardiol. 2016;215:26-31. doi:10.1016/j.ijcard.2016.04.064.
170. Packer M, Colucci W, Fisher L, et al. Effect of levosimendan on the short-term clinical course of patients with acutely decompensated heart failure. JACC Heart Fail. 2013;1(2):103-11. doi:10.1016/j.jchf.2012.12.004.
171. Frustaci A, Russo MA, Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur. Heart J. 2009;30(16):1995-2002. doi:10.1093/eurheartj/ehp249.
172. Chen HS, Wang W, Wu SN, et al. Corticosteroids for viral myocarditis. Cochrane Database Syst Rev. 2013;2013(10):CD004471. doi:10.1002/14651858.CD004471.
173. Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur. Heart J. 2015;36(41):2793-867. doi:10.1093/eurheartj/ehv316.
174. Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an Implantable Cardioverter– Defibrillator for Congestive Heart Failure. N. Engl. J. Med. 2005;352(3):225-37. doi:10.1056/NEJMoa043399.
175. Heart Failure Society Of America. Executive summary: HFSA 2006 Comprehensive Heart Failure Practice Guideline. J Card Fail. 2006;12(1):10-38. doi:10.1016/j.cardfail.2005.12.001.
176. Tara S, Yamamoto T, Kanaoka K, et al. Japanese Registry of Fulminant Myocarditis Investigators. Effects of Cardioprotective Drugs on 90-Day Mortality or Heart Transplantation in Patients With Fulminant Myocarditis. Circ Rep. 2024;6(8):322-32. doi:10.1253/circrep. CR-24-0059.
177. McDonagh TA, Metra M, Adamo M, et al.; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force of the European Society of Cardiology (ESC) with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022;24(1): 4-131. doi:10.1002/ejhf.2333.
178. Piccini JP, Berger JS, O’Connor CM. Amiodarone for the prevention of sudden cardiac death: a meta-analysis of randomized controlled trials. Eur. Heart J. 2009;30(10):1245-53. doi:10.1093/eurheartj/ehp100.
179. Boutitie F, Boissel JP, Connolly SJ, et al. Amiodarone Interaction With β-Blockers: Analysis of the Merged EMIAT (European Myocardial Infarct Amiodarone Trial) and CAMIAT (Canadian Amiodarone Myocardial Infarction Trial) Databases. Circulation. 1999;99(17):2268-75. doi:10.1161/01.cir.99.17.2268.
180. Kovoor P, Eipper V, Byth K, et al. Comparison of sotalol with amiodarone for long-term treatment of spontaneous sustained ventricular tachyarrhythmia based on coronary artery disease. Eur. Heart J. 1999;20(5):364-74. doi:10.1053/euhj.1998.1279.
181. MacNeil DJ, Davies RO, Deitchman D. Clinical safety profile of sotalol in the treatment of arrhythmias. Am. J. Cardiol. 1993;72(4):44A-50A. doi:10.1016/0002-9149(93) 90024-7.
182. Kandolin R, Lehtonen J, Salmenkivi K, et al. Diagnosis, treatment, and outcome of giant-cell myocarditis in the era of combined immunosuppression. Circ. Heart Fail. 2013;6(1):15-22. doi:10.1161/CIRCHEARTFAILURE.112.969261.
183. Schumm J, Greulich S, Wagner A, et al. Cardiovascular magnetic resonance risk stratification in patients with clinically suspected myocarditis. J. Cardiovasc. Magn. Reson. Off. J. Soc. Cardiovasc. Magn. Reson. 2014;16(1):14. doi:10.1186/1532-429X-16-14.
184. Галявич А. С., Терещенко С. Н., Ускач Т. М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. doi:10.15829/1560-4071-2024-6162. EDN: WKIDLJ.
185. Терещенко С. Н., Жиров И. В., Масенко В. П. и др. Диагностика и лечение миокардитов. Евразийский Кардиологический Журнал.-33. doi:10.38109/2225-1685-2019-3-4-33.
186. Konstantinides SV, Torbicki A, Agnelli G, et al. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolismThe Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS). Eur. Heart J. 2014;35(43):3033-80. doi:10.1093/eurheartj/ehu283.
187. Büller HR, Prins MH, Lensin AW, et al. EINSTEIN–PE Investigators. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med. 2012;366(14):1287-97. doi:10.1056/NEJMoa1113572.
188. Homma S, Thompson JL, Pullicino PM, et al. Warfarin and Aspirin in Patients with Heart Failure and Sinus Rhythm. N. Engl. J. Med. 2012;366(20):1859-69. doi:10.1056/NEJMoa1202299.
189. Schultheiss HP, Piper C, Sowade O, et al. Betaferon in chronic viral cardiomyopathy (BICC) trial: Effects of interferon-β treatment in patients with chronic viral cardiomyopathy. Clin. Res. Cardiol. Off. J. Ger. Card. Soc. 2016;105(9):763-73. doi:10.1007/s00392-016-0986-9.
190. Kühl U, Lassner D, von Schlippenbach J, et al. Interferon-Beta improves survival in enterovirus-associated cardiomyopathy. J. Am. Coll. Cardiol. 2012;60(14):1295-6. doi:10.1016/j.jacc.2012.06.026.
191. Orange JS, Hossny EM, Weiler CR, et al. Use of intravenous immunoglobulin in human disease: a review of evidence by members of the Primary Immunodeficiency Committee of the American Academy of Allergy, Asthma and Immunology. J. Allergy Clin. Immunol. 2006;117(4 Suppl):S525-53. doi:10.1016/j.jaci.2006.01.015.
192. Gullestad L, Aass H, Fjeld JG, et al. Immunomodulating therapy with intravenous immunoglobulin in patients with chronic heart failure. Circulation. 2001;103(2):220-5. doi:10.1161/01.cir.103.2.220.
193. Drucker NA, Colan SD, Lewis AB, et al. Gamma-globulin treatment of acute myocarditis in the pediatric population. Circulation. 1994;89(1):252-7. doi:10.1161/01.cir.89.1.252.
194. Maisch B, Alter P. Treatment options in myocarditis and inflammatory cardiomyopathy: Focus on i.v. immunoglobulins. Herz. 2018;43(5):423-30. doi:10.1007/s00059-018-4719-x.
195. Herda LR, Trimpert C, Nauke U, et al. Effects of immunoadsorption and subsequent immunoglobulin G substitution on cardiopulmonary exercise capacity in patients with dilated cardiomyopathy. Am. Heart J. 2010;159(5):809-16. doi:10.1016/j.ahj.2010.01.012.
196. Bulut D, Scheeler M, Wichmann T, et al. Effect of protein A immunoadsorption on T cell activation in patients with inflammatory dilated cardiomyopathy. Clin. Res. Cardiol. Off. J. Ger. Card. Soc. 2010;99(10):633-8. doi:10.1007/s00392-010-0162-6.
197. Felix SB, Staudt A, Dörffel WV, et al. Hemodynamic effects of immunoadsorption and subsequent immunoglobulin substitution in dilated cardiomyopathy: three-month results from a randomized study. J. Am. Coll. Cardiol. 2000;35(6):1590-8. doi:10.1016/s0735-1097(00)00568-4.
198. Mobini R, Staudt A, Felix SB, et al. Hemodynamic improvement and removal of autoantibodies against beta1-adrenergic receptor by immunoadsorption therapy in dilated cardiomyopathy. J Autoimmun. 2003;20(4):345-50. doi:10.1016/s0896-8411(03)00042-8.
199. Legrand F, Klion A. Biologic Therapies Targeting Eosinophils: Current Status and Future Prospects. J. Allergy Clin. Immunol. Pract. 2015;3(2):167-74. doi:10.1016/j.jaip.2015.01.013.
200. Maisch B. Cardio-Immunology of Myocarditis: Focus on Immune Mechanisms and Treatment Options. Front Cardiovasc Med. 2019;6:48. doi:10.3389/fcvm.2019.00048.
201. Brambatti M, Matassini MV, Adler ED, et al. Eosinophilic Myocarditis: Characteristics, Treatment, and Outcomes. J Am Coll Cardiol. 2017;70(19):2363-75. doi:10.1016/j.jacc.2017.09.023.
202. Ammirati E, Stucchi M, Brambatti M, et al. Eosinophilic myocarditis: a paraneoplastic event. Lancet. 2015;385(9986):2546. doi:10.1016/S0140-6736(15)60903-5. PMID: 26122067.
203. Akuthota P, Weller PF. Spectrum of Eosinophilic End-Organ Manifestations. Immunol. Allergy Clin. North Am. 2015;35(3):403-11. doi:10.1016/j.iac.2015.04.002.
204. Ogbogu PU, Bochner BS, Butterfield JH, et al. Hypereosinophilic syndrome: a multicenter, retrospective analysis of clinical characteristics and response to therapy. J. Allergy Clin. Immunol. 2009;124(6):1319-25.
205. Masi AT, Hunder GG, Lie JT, et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum. 1990;33(8):1094-100. doi:10.1002/art.1780330806.
206. Rothenberg ME, Klion AD, Roufosse FE, et al. Treatment of patients with the hypereosinophilic syndrome with mepolizumab. N Engl J Med. 2008;358(12):1215-28. doi:10.1056/NEJMoa070812.
207. Gordon AC, Mouncey PR, Al-Beidh F, et al. Interleukin-6 receptor antagonists in critically ill patients with COVID-19. N Engl J Med. 2021;384:1491-502. doi:10.1056/NEJMoa2100433.
208. Gupta S, Wang W, Hayek SS, et al. Association Between Early Treatment With Tocilizumab and Mortality Among Critically Ill Patients With COVID-19. JAMA Intern. Med. 2021;181:41-51.
209. Blagova O, Yuliya L, Savina P, et al. Corticosteroids are effective in the treatment of viruspositive post-COVID myoendocarditis with high autoimmune activity. Clin Cardiol. 2023;46(3):352-4. doi:10.1002/clc.23978.
210. Piepoli MF, Crisafulli A. Pathophysiology of human heart failure: importance of skeletal muscle myopathy and reflexes. Exp. Physiol. 2014;99(4):609-15.
211. Ribeiro JP, Chiappa GR, Callegaro CC. The contribution of inspiratory muscles function to exercise limitation in heart failure: pathophysiological mechanisms. Rev. Bras. Fisioter. Sao Carlos Sao Paulo Braz. 2012;16(4):261-7.
212. Davies EJ, Moxham T, Rees K, et al. Exercise training for systolic heart failure: Cochrane systematic review and meta-analysis. Eur J Heart Fail. 2010;12(7):706-15. doi:10.1093/eurjhf/hfq056.
213. Pandey A, Parashar A, Kumbhani D, et al. Exercise training in patients with heart failure and preserved ejection fraction: meta-analysis of randomized control trials. Circ Heart Fail. 2015;8(1):33-40. doi:10.1161/CIRCHEARTFAILURE.114.001615.
214. Corrà U, Agostoni PG, Anker SD, et al. Role of cardiopulmonary exercise testing in clinical stratification in heart failure. A position paper from the Committee on Exercise Physiology and Training of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2018;20(1):3-15. doi:10.1002/ejhf.979.
215. Bellet RN, Adams L, Morris NR. The 6-minute walk test in outpatient cardiac rehabilitation: validity, reliability and responsiveness — a systematic review. Physiotherapy. 2012;98(4):277-86. doi:10.1016/j.physio.2011.11.003.
216. Арутюнов Г. П. Вопросы немедикаментозного лечения пациентов, страдающих сердечной недостаточностью. Журнал Сердечная Недостаточность. 2001;2(1):35-6.
217. Callegaro CC, Martinez D, Ribeiro PA, et al. Augmented peripheral chemoreflex in patients with heart failure and inspiratory muscle weakness. Respir Physiol Neurobiol. 2010;171(1):31-5. doi:10.1016/j.resp.2010.01.009.
218. Shah P, Pellicori P, Macnamara A, et al. Is Swimming Safe in Heart Failure? A Systematic Review. Cardiol Rev. 2017;25(6):321-5. doi:10.1097/CRD.0000000000000154.
219. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2015;28(1):1-39.e14.
220. Савина П. О., Благова О. В., Айнетдинова Д. Х. и др. Подострый и хронический постковидный миокардит: диагностика, клинические варианты, подходы к лечению. Российский кардиологический журнал. 2024;29(11):6089. doi:10.15829/15604071-2024-6089. EDN: EYNACD.
221. Rector TS, Kubo SH, Cohn JN. Patients’ self-assessment of their congestive heart failure: content, reliability and validity of a new measure — the Minnesota Living with Heart Failure questionnaire. Heart Fail. 1987;3:198-209.
222. Ammirati E, Frigerio M, Adler ED, et al. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020;13(11): e007405. doi:10.1161/CIRCHEARTFAILURE.120.007405.
223. Kociol RD, Cooper LT, Fang JC, et al. American Heart Association Heart Failure and Transplantation Committee of the Council on Clinical Cardiology. Recognition and Initial Management of Fulminant Myocarditis: A Scientific Statement From the American Heart Association. Circulation. 2020;141(6):e69-e92. doi:10.1161/CIR.0000000000000745.
224. Truong K, Kelly S, Bayly A, Smith A. Successful mepolizumab treatment for DRESSinduced refractory eosinophilic myocarditis and concurrent thyroiditis. BMJ Case Rep. 2021;14(7):e242240. doi:10.1136/bcr-2021-242240.
225. Higashitani K, Yoshimi R, Sato Y, et al. Rituximab and mepolizumab combination therapy for glucocorticoid-resistant myocarditis related to eosinophilic granulomatosis with polyangiitis. Mod Rheumatol Case Rep. 2022;6(1):87-92. doi:10.1093/mrcr/rxab022.
226. Chabior A, Tymińska A, Pawlak A, et al. Advances in myocarditis management in the light of the latest research and recent guidelines of the European Society of Cardiology. Cardiol J. 2024;31(2):342-51. doi:10.5603/cj.95175.
227. Дроздов Д. В., Макаров Л. М., Баркан В. С. и др. Регистрация электрокардиограммы покоя в 12 общепринятых отведениях взрослым и детям 2023. Методические рекомендации. Российский кардиологический журнал. 2023;28(10):5631. doi:10.15829/1560-4071-2023-5631.
228. Мацкеплишвили С. Т., Саидова М. А., Мироненко М. Ю. и др. Выполнение стандартной трансторакальной эхокардиографии. Методические рекомендации 2024. Российский кардиологический журнал. 2025;30(2):6271. doi:10.15829/1560-4071-2025-6271.
229. Asada AM, Kahwash R, Trovato V. Eosinophilic myocarditis: a concise review. Curr Cardiol Rep. 2025;27(1):38. doi:10.1007/s11886-024-02184-6.
Об авторах
Г. П, АрутюновРоссия
д.м.н., профессор, член-корр. РАН, главный терапевт ДЗМ, заслуженный врач РФ, зав. кафедрой
Д. О. Драгунов
Россия
к.м.н., доцент ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России. Жиров И. В. — д.м.н., в.н.с
И. B. Жиров
Россия
О. М. Моисеева
Россия
д.м.н., зав. научно-исследовательским отделом некоронарогенных заболеваний сердца
Ф. Н. Палеев
Россия
д.м.н., профессор, член-корр. РАН, зам. генерального директора по научно-аналитической работе
А. В. Соколова
Россия
к.м.н., доцент
Т. В. Апханова
Россия
д.м.н., г.н.с. отдела физиотерапии и рефлексотерапии
А. Г. Арутюнов
Россия
д.м.н., профессор
О. В. Благова
Россия
д.м.н., профессор кафедры факультетской терапии № 1 лечебного факультета
С. А. Габрусенко
Россия
д.м.н., с.н.с.
А. А. Гарганеева
Россия
д.м.н., профессор, зав. отделением общеклинической кардиологии и эпидемиологии сердечно-сосудистых заболеваний
Г. Е. Гендлин
Россия
д.м.н., профессор
С. Р. Гиляревский
Россия
д.м.н., профессор кафедры клинической фармакологии и терапии
Д. В. Дупляков
Россия
д.м.н., зам. главного врача по медицинской части Самарского областного клинического кардиологического диспансера, главный кардиолог Самарской области, профессор кафедры кардиологии и кардиохирургии ИПО
О. В. Зайратьянц
Россия
профессор, д.м.н., зав. кафедрой
Д. Е. Каратеев
Россия
зам. директора по научной работе, зав. отделом ранних артритов
Н. А. Козиолова
Россия
д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней № 2
Е. Д. Космачева
Россия
зав. кафедрой терапии, д.м.н., главный кардиолог Южного федерального округа, главный кардиолог Краснодарского края
А. Г. Кочетов
Россия
д.м.н., профессор кафедры госпитальной терапии с курсом клинической лабораторной диагностики
Ю. М. Лопатин
Россия
д.м.н., профессор, зав. кафедрой кардиологии с функциональной диагностикой
А. В. Мелехов
Россия
д.м.н., доцент
Л. Б. Митрофанова
Россия
д.м.н., зав. НИЛ патоморфологии
О. Ю. Нарусов
Россия
к.м.н., с.н.с.
С. Н. Насонова
Россия
к.м.н., с.н.с.
А. В. Недоступ
Россия
д.м.н., профессор кафедры факультетской терапии № 1 лечебного факультета
С. Ю. Никулина
Россия
д.м.н., профессор, проректор
Я. А. Орлова
Россия
д.м.н., профессор, зав. отделом возраст-ассоциированных заболеваний, Медицинский научно-образовательный центр
Н. Г. Потешкина
Россия
д.м.н., профессор, зав. кафедрой
Е. В. Привалова
Россия
д.м.н., профессор кафедры госпитальной терапии № 1 лечебного факультета
А. П. Ребров
Россия
д.м.н., профессор, зав. кафедрой госпитальной терапии
М. А. Саидова
Россия
д.м.н., профессор, руководитель отдела, зав. отделением
В. П. Седов
Россия
.м.н., профессор кафедры лучевой диагностики лечебного факультета
В. Е. Синицын
Россия
д.м.н., профессор, зав. кафедрой лучевой диагностики и терапии Факультета Фундаментальной Медицины МГУ им. М. В. Ломоносова, зав. отделом лучевой диагностики МНОЦ МГУ им. М. В. Ломоносова, президент Российского Общества Рентгенологов и Радиологов
М. Ю. Ситникова
Россия
д.м.н., г.н.с., руководитель НИО сердечной недостаточности, профессор кафедры терапии
А. А. Скворцов
Россия
д.м.н., в.н.с.
В. В. Скибицкий
Россия
д.м.н., профессор, зав. кафедрой госпитальной терапии
О. В. Стукалова
Россия
к.м.н.,с.н.с.
Е. И. Тарловская
Россия
д.м.н., профессор, зав. кафедрой внутренних болезней
С. Н. Терещенко
Россия
д.м.н., профессор, первый зам. генерального директора, зам. генерального директора по научной работе, генеральный директор
В. Ю. Усов
Россия
д.м.н., профессор, зав. отделением рентгеновских и томографических методов диагностики
И. В. Фомин
Россия
д.м.н., профессор кафедры внутренних болезней Нижегородской государственной медицинской академии, главный специалист по терапии Приволжского окружного медицинского центра
А. И. Чесникова
Россия
.м.н., профессор кафедры внутренних болезней № 1
И. И. Шапошник
Россия
д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней Южно-Уральского государственного медицинского университета, главный кардиолог г. Челябинска
Н. А. Шостак
Россия
д.м.н., профессор, зав. кафедрой
Е. В. Шляхто
Россия
д.м.н., профессор, академик РАН, генеральный директор ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России, президент Российского кардиологического общества
Рецензия
Для цитирования:
Арутюнов Г.П., Драгунов Д.О., Жиров И.B., Моисеева О.М., Палеев Ф.Н., Соколова А.В., Апханова Т.В., Арутюнов А.Г., Благова О.В., Габрусенко С.А., Гарганеева А.А., Гендлин Г.Е., Гиляревский С.Р., Дупляков Д.В., Зайратьянц О.В., Каратеев Д.Е., Козиолова Н.А., Космачева Е.Д., Кочетов А.Г., Лопатин Ю.М., Мелехов А.В., Митрофанова Л.Б., Нарусов О.Ю., Насонова С.Н., Недоступ А.В., Никулина С.Ю., Орлова Я.А., Потешкина Н.Г., Привалова Е.В., Ребров А.П., Саидова М.А., Седов В.П., Синицын В.Е., Ситникова М.Ю., Скворцов А.А., Скибицкий В.В., Стукалова О.В., Тарловская Е.И., Терещенко С.Н., Усов В.Ю., Фомин И.В., Чесникова А.И., Шапошник И.И., Шостак Н.А., Шляхто Е.В. Миокардиты. Клинические рекомендации 2025. Российский кардиологический журнал. 2025;30(8):6458. https://doi.org/10.15829/1560-4071-2025-6458. EDN: YDUWYZ
For citation:
Arutyunov G.P., Dragunov D.O., Zhirov I.V., Moiseeva O.M., Paleev F.N., Sokolova A.V., Apkhanova T.V., Arutyunov A.G., Blagova O.V., Gabrusenko S.A., Garganeeva A.A., Gendlin G.E., Gilyarevsky S.R., Duplyakov D.V., Zairatyants O.V., Karateev D.E., Koziolova N.A., Kosmacheva E.D., Kochetov A.G., Lopatin Yu.M., Melekhov A.V., Mitrofanova L.B., Narusov O.Yu., Nasonova S.N., Nedostup A.V., Nikulina S.Yu., Orlova Ya.A., Poteshkina N.G., Privalova E.V., Rebrov A.P., Saidova M.A., Sedov V.P., Sinitsyn V.E., Sitnikova M.Yu., Skvortsov A.A., Skibitsky V.V., Stukalova O.V., Tarlovskaya E.I., Tereshchenko S.N., Usov V.Yu., Fomin I.V., Chesnikova A.I., Shaposhnik I.I., Shostak N.A., Shlyakhto E.V. 2025 Clinical practice guidelines for Myocarditises. Russian Journal of Cardiology. 2025;30(8):6458. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6458. EDN: YDUWYZ
JATS XML
















































