Перейти к:
Новый взгляд на процессы фиброза миокарда: «холодный» и «горячий» фенотипы. Особенности патогенеза и потенциальные терапевтические стратегии
https://doi.org/10.15829/1560-4071-2025-6397
EDN: DSTJOD
Аннотация
Фиброз — это процесс, характеризующийся чрезмерным накоплением компонентов внеклеточного матрикса в ответ травму, ишемию, хроническое метаболическое и иммунное воспаление. В норме гомеостаз внеклеточного матрикса регулируется за счет поддержания баланса между интенсивностью фиброгенеза и фибролиза. В данном обзоре впервые в отечественной литературе освещается новая концепция «холодного» и «горячего» фиброза, основанная на особенностях взаимодействия внеклеточного матрикса и иммунной системы. Наряду с этим обсуждается роль целого ряда биологически активных веществ, выступающих в роли биомаркеров-кандидатов фиброза и антифибротического ответа. Разработка подобной биомаркерной концепции может рассматриваться как основа для создания стратегий антифибротической терапии, актуальной для лечения различных кардиологических заболеваний
Ключевые слова
Для цитирования:
Драгомирецкая Н.А., Волчков И.И., Белов А.К., Гонцова Л.А., Ветлужская М.В., Подзолков В.И. Новый взгляд на процессы фиброза миокарда: «холодный» и «горячий» фенотипы. Особенности патогенеза и потенциальные терапевтические стратегии. Российский кардиологический журнал. 2025;30(9S):6397. https://doi.org/10.15829/1560-4071-2025-6397. EDN: DSTJOD
For citation:
Dragomiretskaya N.A., Volchkov I.I., Belov A.K., Gontsova L.A., Vetluzhskaya M.V., Podzolkov V.I. A fresh angle on myocardial fibrosis processes: cold and hot phenotypes. Pathogenesis features and potential therapeutic strategies. Russian Journal of Cardiology. 2025;30(9S):6397. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6397. EDN: DSTJOD
Несмотря на значительный прогресс в понимании молекулярных механизмов фиброза, до настоящего времени разработка подходов к профилактике фибротических процессов в органах и тканях, а также их обратному развитию, остается одной из актуальных проблем медицины и биологии в целом.
Фиброз — это типовой патологический процесс, характеризующийся чрезмерным накоплением компонентов внеклеточного матрикса в ответ на стимулы, связанные с травмами и хроническим воспалением в ходе метаболических, сосудистых и аутоиммунных заболеваний [1]. При нормальных условиях гомеостаз внеклеточного матрикса регулируется за счет поддержания баланса между интенсивностью фиброгенеза и фибролиза, т.е. процессов образования и разрушения фибриллярных структур, которые обеспечивают структурную поддержку и многочисленные биологические функции тканей.
В последние несколько лет появились публикации зарубежных авторов о выделении особых типов фиброза — "холодного" и "горячего" [1][2], русскоязычные работы по данной проблеме в поисковых системах eLibrary и Cyberleninka отсутствуют. Таким образом, целью данной работы явилось освещение современных представлений о процессах фиброза, протекающих в различных органах и тканях при различных нозологических формах.
Методология исследования
В работе (несистематический обзор литературы) были использованы основные данные и выводы из отечественных и иностранных источников, посвященных вопросам патогенеза, морфологическим и метаболическим особенностям фиброза как типового патологического процесса, в т.ч. фиброза миокарда как морфофункциональной основы хронической сердечной недостаточности (ХСН). Поиск литературных данных проводился на русском и английском языках в системах индексирования научных публикаций PubMed, Google Scholar, Web of Science, E-library, Cyberleninka. Поиск проводили по заголовкам и ключевым словам. В качестве поисковых запросов использовались следующие слова и словосочетания: "фиброз миокарда", "миофибробласты", "холодный и горячий фиброз", "ремоделирование интерстициального матрикса", "хроническая сердечная недостаточность", "myocardial fibrosis", "myofibroblasts", "cold and hot fibrosis", "interstitial matrix remodeling", "chronic heart failure". Поиск проводили по заголовкам и ключевым словам. Глубина поиска составила 10 лет, за исключением более ранних фундаментальных работ, посвященных изучению морфологических основ фиброза. Всего отобрано 39 публикаций.
Результаты
Понятие фиброза. Гистологические типы фиброза
Фиброзные изменения могут развиваться в различных органах (миокарде, почках, печени, легких), приводя к изменению нормальной структуры органа и закономерному нарушению его функционирования, вплоть до прогрессирующей органной недостаточности [2-4]. Фиброз миокарда развивается при различных формах сердечно-сосудистой патологии, таких как инфаркт миокарда (ИМ) и постинфарктный крупноочаговый кардиосклероз, хронические формы ишемической болезни сердца, гипертоническая болезнь и ХСН [5][6].
Многочисленные опыты и наблюдения показали, что миокардиофиброз является неизбежным исходом воздействия различных повреждающих факторов лишь у взрослых млекопитающих. Он отсутствует у новорожденных мышей и свиней из-за регенеративного потенциала молодого сердца [7-9]. В настоящее время вопросы профилактики и регресса фиброза представляют собой актуальную медицинскую проблему, т.к., среди прочего, процессы фиброза представляют собой морфологический субстрат возраст-ассоциированных состояний, сопровождающих процессы как естественного, так и раннего старения [3-5]. Поэтому стратегии, позволяющие уменьшить выраженность фибротических процессов, могут рассматриваться как средства борьбы со старением [10].
В течение нескольких столетий фиброз миокарда изучался преимущественно на основе морфологических исследований [6]. В норме гистологически миокард представлен тремя основными структурными компонентами, находящимися в тесных анатомических и функциональных взаимосвязях — кардиомиоцитами (75%), сосудами микроциркуляторного русла и экстрацеллюлярным матриксом (25%) [11], образующим периваскулярный и интерстициальный каркас [12]. Основными белками экстрацеллюлярного матрикса являются фибриллярный коллаген I типа (>50%), III типа (10-45%), в меньшей степени — коллагены IV, V и VI типов, а также эластин [6].
Гистологически различают периваскулярный фиброз (А), существующий в норме и формирующий муфты вокруг сосудисто-нервных пучков (рис. 1 А), интерстициальный фиброз (В), сопровождающийся гипертрофией кардиомиоцитов, и заместительный фиброз (С), при котором значительное разрастание соединительной ткани протекает параллельно с потерей кардиомиоцитов [6][13] (рис. 1 В, С).
В физиологических условиях сеть фибриллярного коллагена интимно прилежит ко всем клеткам миокарда и имеет определяющее значение в поддержании размеров, формы и функции камер сердца [6]. Избыточное количество фибриллярного коллагена рассматривается как одно из важных звеньев формирования "жесткого сердца", характерного для ХСН с сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ) (ХСНсФВ), а дальнейшее прогрессирование фиброза служит важнейшим фактором потери сократительной способности миокарда и формирования систолической дисфункции — ХСН с умеренно сниженной (ХСНунФВ) и низкой ФВ (ХСНнФВ) [13].

Рис. 1. Нормальная структура кардиомиоцитов и физиологический периваскулярный фиброз (А). Изменение экстрацеллюлярного матрикса при интерстициальном (В) и заместительном (С) фиброзе (адаптировано из [6][13] с использованием нейросети ChatGPT, модель о3).
Фиброз как компонент репаративных систем
Следует понимать, что фиброз миокарда представляет собой сложный биологический процесс, обусловленный взаимодействием множества типов клеток и сигнальных молекул [14]. Структурный компонент патологии — рубцовая ткань, рубец, состоит из белков внеклеточного матрикса, откладываемых в основном активированными фибробластами — миофибробластами [15]. Миофибробласты взаимодействуют с другими типами клеток, в т.ч. с макрофагами, имеющими моноцитарное происхождение [16], которые в большом количестве мигрируют в места повреждений и поддерживают процессы фиброза [17].
В целом исход восстановления ткани — заживление с восстановлением гомеостаза или развитие фиброза — в первую очередь определяется продолжительностью и интенсивностью повреждения, а также изменением характера воспалительного ответа. Существует критически важный временной промежуток, в течение которого координация между клетками поврежденной ткани и иммунным ответом способствует восстановлению целостности ткани до начала развития фиброза [1][2][5]. Продолжительность этого периода зависит от конкретных условий, особенностей повреждающего фактора и длительности его воздействия. Своевременное и адекватное медицинское вмешательство, а также индивидуальные факторы (генетическая предрасположенность, общее состояние здоровья, сопутствующие заболевания) играют решающую роль в определении конечных исходов [2]. Как правило, длительные или повторяющиеся повреждения вызывают хроническое воспаление, тогда как кратковременные и незначительные повреждения приводят к восстановлению. Большинство заболеваний, характеризующихся непрерывным или повторяющимся повреждением тканей и хроническим воспалением, с высокой вероятностью приводят к развитию выраженного фиброза [2][5][11].
Концепция "холодного" и "горячего" фиброза
В 2020г на основании различных типов взаимодействия между основными клеточными элементами, участвующими в формировании рубцовой ткани, многонациональной группой исследователей была предложена новая концепция, в которой для описания фиброза используются 2 новых эпитета — "холодный" и "горячий" [18]. На основании большого количества экспериментальных данных, полученных при изучении животных моделей (мыши, свиньи, нечеловекообразные приматы), авторам удалось доказать, что ответ организма на повреждение тканей может развиваться по трем сценариям, а именно формирования "холодного" фиброза, "горячего" фиброза или нормального заживления [18].
По данным Adler M, et al. (2020), Miyara S, et al. (2025), "горячий" фиброз характеризуется большим количеством как миофибробластов, так и макрофагов, которые поддерживают рост и пролиферацию друг друга. "Холодный" фиброз, напротив, состоит из большого количества миофибробластов без активированных макрофагов. Заживление же сопровождается коллапсом двух популяций клеток и возвращением к исходному уровню — восстановлению тканевого гомеостаза [2][18].
Термин "горячий" происходит от классического острого воспалительного состояния, ключевыми признаками которого являются покраснение, отек и повышение температуры, обусловленные усиленным кровотоком, экстравазацией иммунных клеток и плазмы, что приводит к локальному повышению температуры и ощущению жара [19]. Иммунный ответ при "горячем" фиброзе может оказывать как положительное, так и отрицательное воздействие. С одной стороны, иммунные клетки очищают поврежденную ткань и способствуют ее восстановлению [20]. С другой стороны, хроническое воспаление приводит к формированию "незаживающих ран", что характерно для прогрессирующего фиброза и микроокружения большинства солидных опухолей [21-23]. В обоих случаях моноциты-макрофаги считаются наиболее значимыми иммунными клетками, участвующими в развитии "горячего" фиброза, поскольку их пластичность позволяет им менять свой фенотип. В связи с этим в последнее время особое внимание уделяется терапевтическим стратегиям, направленным на переключение макрофагов при "горячем" фиброзе, поскольку он характеризуется высокой численностью и активностью иммунных клеток. Исследуются способы стимуляции макрофагов для достижения повышенного разрушения избыточного внеклеточного матрикса и трансформации в клетки, обладающие противовоспалительными и антифибротическими свойствами [1].
Напротив, "холодный" фиброз характеризуется отсутствием иммунных клеток, что приводит к снижению воспалительной активности и относительной стабильности фиброзной ткани. Отсутствие или низкое количество иммунных клеток способствует устойчивости фиброза и нарушению процессов регенерации тканей [24], в связи с чем "холодный" фиброз характеризуется неблагоприятным прогнозом и низкой эффективностью антифибротической терапии [25][26].
В современной литературе термины "горячий" и "холодный" фиброз встречаются редко и в основном используются для описания сложных математических моделей динамических процессов межклеточного взаимодействия [2][16][18]. Эти модели учитывают количество макрофагов и миофибробластов в очаге повреждения, их пролиферацию, элиминацию через эндоцитоз и апоптоз, а также секрецию факторов роста. На основе этих данных может быть построен график контурной диаграммы, описывающей три различных сценария репарации ткани — "заживление", "горячий" или "холодный" фиброз (рис. 2).
В этой модели концентрации макрофагов и миофибробластов отображаются по осям абсцисс и ординат соответственно, а разделительная линия, называемая сепаратриссой, обозначает границы между различными состояниями. Сепаратрисса определяет границу перехода между заживлением и фиброзом, позволяя прогнозировать условия, способствующие восстановлению тканей, а также те, при которых вероятно развитие фиброза. Кроме того, она помогает определить, будет ли фиброз сопровождаться активным воспалительным микроокружением ("горячий" фиброз) или же характеризоваться малой воспалительной активностью ("холодный" фиброз) [1][2][18].
Патофизиологическая роль и клиническое значение "холодного" и "горячего" фиброза миокарда при различной кардиальной патологии
В связи с тем, что патофизиологическая и клиническая значимость горячего и холодного фиброза в сердце не была достоверно установлена, для доказательства данной теории группой исследователей из Израиля, США, Австрии и Германии было проведено исследование с тщательно спланированным дизайном и четкой методологической концепцией, результаты которого были опубликованы в марте 2025г [2]. Так, изучение "горячего" и "холодного" фиброза в клинически значимых условиях авторы начали с сопоставления двух классических моделей острого повреждения миокарда (острый ИМ, вызванный перевязкой левой передней нисходящей артерии у мышей и свиней) и хронической перегрузки объемом (частичное пережатие аорты). Исследование динамики клеточных популяций после индуцированного ИМ позволило авторам выявить пиковое увеличение численности макрофагов и миофибробластов на 3-7-е сут. со снижением количества макрофагов к 14-м сут. и сохранением "персистирующих" миофибробластов на 14-е и 28-е сут. (соотношение миофибробластов и макрофагов 6:1), что соответствует "холодному" фиброзу. Анализ экспрессии генов различных клеточных типов (макрофагов и фибробластов) показал, что при "холодном" фиброзе макрофаги возвращались к гомеостатическим функциям, тогда как фибробласты приобретали устойчивый профиброзный фенотип [2]. Эти изменения согласуются с предыдущим исследованием Fu X, et al. (2018), в котором подчеркивался переход сердечных миофибробластов в матрифиброциты [27] — клетки, формирующие внеклеточный матрикс в зрелом рубце [28]. Авторы пришли к выводу, что начальный транзиторный период инфаркта, протекающий в условиях высокого содержания в тканях миокарда макрофагов и миофибробластов, сопряжен с усилением иммунного взаимодействия клеток, тогда как поздний "холодный" фиброз характеризуется высоким содержанием фибробластов, основная функция которых заключается в продукции экстрацеллюлярного матрикса, что важно для формирования состоятельного рубца [2].
В эксперименте на животных частичное пережатие аорты с постоянным увеличением градиента давления ожидаемо приводило к гипертрофии ЛЖ с увеличением индекса массы миокарда и незначительным снижением ФВ ЛЖ. При окрашивании пикросириусом красным были идентифицированы три морфологических паттерна, соответствующих периваскулярному, интерстициальному и замещающему фиброзу. Увеличение числа миофибробластов со снижением количества кардиомиоцитов было максимальным при заместительном фиброзе, но отмечалось при всех его типах. Также при всех типах фиброза наблюдалось увеличение числа макрофагов (соотношение миофибробластов и макрофагов 1:1), что соответствует характеристикам "горячего" фиброза [2].
Авторами подчеркивается, что восстановление тканей является защитной реакцией после травмы, но повторяющаяся или длительная травма может привести к фиброзу, т.е. патологическому состоянию чрезмерного образования рубцовой ткани [2, 18]. При этом для определения динамических механизмов, лежащих в основе фиброза, важно понимать принципы межклеточных взаимодействий, обеспечивающих репаративные процессы, а именно взаимодействия миофибробластов и макрофагов при заживлении ран, включая накопление образующего рубец внеклеточного матрикса [3][14].
Возможности воздействия на "холодный" и "горячий" фиброз
Отвечая на вопрос о регулирующих механизмах при разных типах фиброза, Miyara S, et al. показали, что миофибробласты, приобретшие профиброзный фенотип при холодовом фиброзе после ИМ, в отсутствие макрофагов поддерживают собственную пролиферацию с помощью аутокринной петли фактора роста (рис. 2) [2]. В качестве аутокринного фактора роста фибробластов был идентифицирован тканевой ингибитор матриксной металлопротеиназы 1 типа (TIMP1), инактивация которого с помощью антител приводила к уменьшению фиброза у взрослых мышей после ИМ [2].
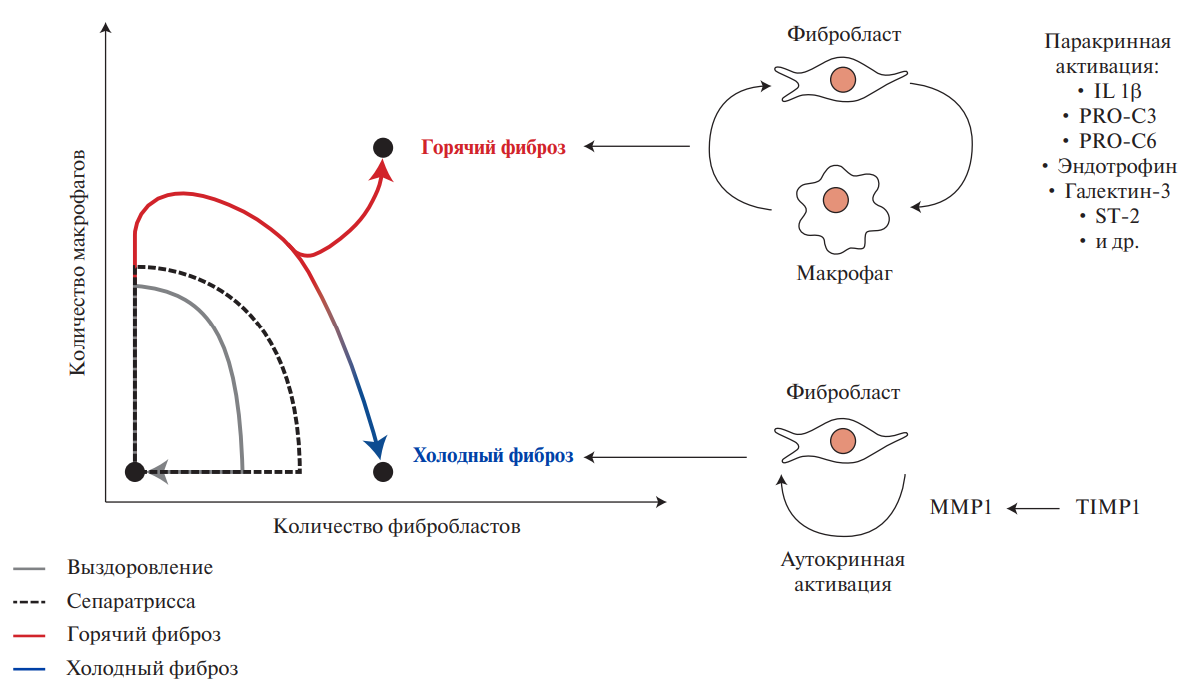
Рис. 2. Математическая модель клеточной цепи миофибробласт-макрофаг при заживлении, "холодном" и "горячем" фиброзе [адаптировано из 2].
Сокращения: IL 1β — интерлейкин 1β, PRO-C3 — N-концевой пропептид коллагена III типа, PRO-C6 — N-концевой пропептид коллагена VI типа, ST-2 — стимулирующий фактор туморогенности, кодируемый геном 2, ММP1 — матриксная металлопротеиназа 1, TIMP1 — тканевой ингибитор матриксной металлопротеиназы 1.
Первоначально TIMP1 был идентифицирован как фактор роста, а теперь рассматривается как мощный провоспалительный цитокин, рецепторы к которому были обнаружены во всех интерстициальных клетках миокарда, что предполагает более широкие эффекты TIMP1, не ограничивающиеся сердечными миофибробластами [29].
В контексте рассмотрения фиброза как типового патологического процесса, не ограничивающегося одним только миокардом, проведен ряд исследований по изучению горячего и холодного фиброза в печени, в т.ч. с разработкой стратегии ингибирования аутокринной петли при поздних стадиях цирроза печени [30]. Таким образом, ингибирование аутокринной сигнальной петли фибробластов — ключевой популяции профиброзных клеток, может быть общей стратегией для борьбы с фиброзом во всех органах.
В то время как "холодный" фиброз зависит от аутокринной сигнальной петли миофибробластов, "горячий" фиброз требует паракринной сигнализации между макрофагами и миофибробластами. Ключевые паракринные сигналы, поддерживающие "горячий" фиброз при хронических повреждениях сердца, были описаны в недавних исследованиях, показывающих, что активированные макрофаги секретируют интерлейкин-1β, который способствует активации фибробластов и последующему фиброзу у мышей и людей с хронической перегрузкой давлением [31, 32].
В качестве потенциального биомаркера "горячего" фиброза в печени в настоящее время рассматриваются N-концевой пропептид коллагена III типа, описанный как системный маркер для оценки синтеза коллагена III и активации звездчатых клеток печени, пропептид коллагена VI типа, и эндотрофин — продукт, образующийся при формировании коллагена VI типа [1].
Исследования, посвященные изучению маркеров-кандидатов "холодного" и "горячего" фиброза в других органах, до настоящего времени не проводились, хотя феномен "горячего" и "холодного" фиброза был недавно обнаружен в гистологическом анализе трансплантированных человеческих почек [33].
Не исключается также роль других биологически активных молекул, таких как галектин-3, стимулирующий фактор роста, кодируемый геном 2 (ST2), виментин, некоторые члены семейства матричных металлопротеиназ, нейтрофильная эластаза, растворимый урокиназный рецептор активации плазминогена, растворимый триггерный рецептор, экспрессируемый на миелоидных клетках 2, и других потенциальных сигнальных молекул — регуляторов активности "горячего" фиброза [2][29][30][34].
Перспективы использования положений о "горячем" и "холодном" фиброзе в клинической практике
Фибротические и склеротические процессы представляют собой типичный исход различных заболеваний большинства органов и систем, приводя к структурным и функциональным нарушениям вплоть до ор- ганной недостаточности и смертности.
Недавние экспериментальные исследования продемонстрировали эффективность ряда вмешательств, в частности, применение иммунотерапевтических методик, в уменьшении фиброза на животных моделях [35-37]. Показанная в эксперименте способность к регрессу рубцовой ткани и восстановление утраченной функции после повреждения миокарда у мышей, изменяет давние представления о необратимости фиброза. Однако подобного рода вмешательства еще не вошли в клиническую практику и приходится констатировать, что клинические возможности и методы лечения, направленные на устранение фиброза, остаются весьма ограниченными.
Появление и разработка концепции "горячего" и "холодного" фиброза может рассматриваться как один из шагов к более персонализированному подходу в оценке процессов ремоделирования миокарда у разных групп пациентов и механизм разработки таргетных терапевтических стратегий.
По результатам наших собственных наблюдений [38], у пациентов с ХСНсФВ и ХСНунФВ в разных фенотипических группах, выделенных с применением алгоритмов машинного обучения методом неконтролируемой кластеризации, были выявлены особенности профиля провоспалительных и профибротических биомаркеров (рис. 3).
Так, больные ишемического фенотипа, значимо чаще имевшие перенесенный ИМ и, соответственно, потенциально более обширные рубцовые изменения в миокарде, отличались невысокими концентрациями провоспалительных и профибротических маркеров — галектина-3 и ST2, по сравнению с пациентами фенотипа дезадаптивный с полиорганной дисфункцией [38]. Этот факт, вероятно, можно объяснить преобладанием в данных фенотипических группах разных типов фиброза, отличающихся патофизиологическими механизмами развития и биологической активностью.
Отсутствие значимых различий уровней галектина-3 и ST2 — маркеров воспаления и фиброза в разных фенотипических кластерах может быть обусловлено большой давностью перенесенного ИМ у наших пациентов (не менее 6 мес. до включения в исследование в соответствии с критериями включения/невключения), в отличие от условий в эксперименте Miyara S, et al. (2025). Можно предположить, что у обследованных нами пациентов к "холодному" фиброзу, развившемуся в раннем постинфарктном периоде, под влиянием хронических гемодинамических расстройств в виде увеличенной пред- и постнагрузки, впоследствии присоединился фиброз "горячего" типа. Однако для доказательств возможности существования смешанных вариантов фиброза у одного и того же пациента требуется проведение дополнительных исследований.
Таким образом, можно констатировать, что выявление различных патогенетических типов фиброза в клинической практике, в отличие от животных моделей, сопряжено с объективными трудностями. Более детальная диагностика различных типов фиброза, в т.ч. смешанных, в популяции пациентов с ХСН представляется возможной после проведения дополнительных исследований и разработки конкретных диагностических алгоритмов.
Полученные экспериментальные данные о возможной патогенетической роли различных медиаторов аутокринной и паракринной регуляции при "холодном" и "горячем" фиброзе могут рассматриваться как теоретическая база для разработки новых медикаментозных стратегий терапии и создания препаратов, способных потенцировать регресс рубцовых изменений в миокарде и других органах. Также требует дальнейшего изучения эффективность препаратов с уже известным антифибротическим действием, таких как, например, антагонисты минералокортикоидных рецепторов, у пациентов с "холодным" и "горячим" типами фиброза [39]. Появление доказательств клинической эффективности антагонистов альдостерона у пациентов с "горячим" фиброзом позволит расширить показания к применению препаратов данной группы, не ограничиваясь лишь постинфарктным кардиосклерозом.
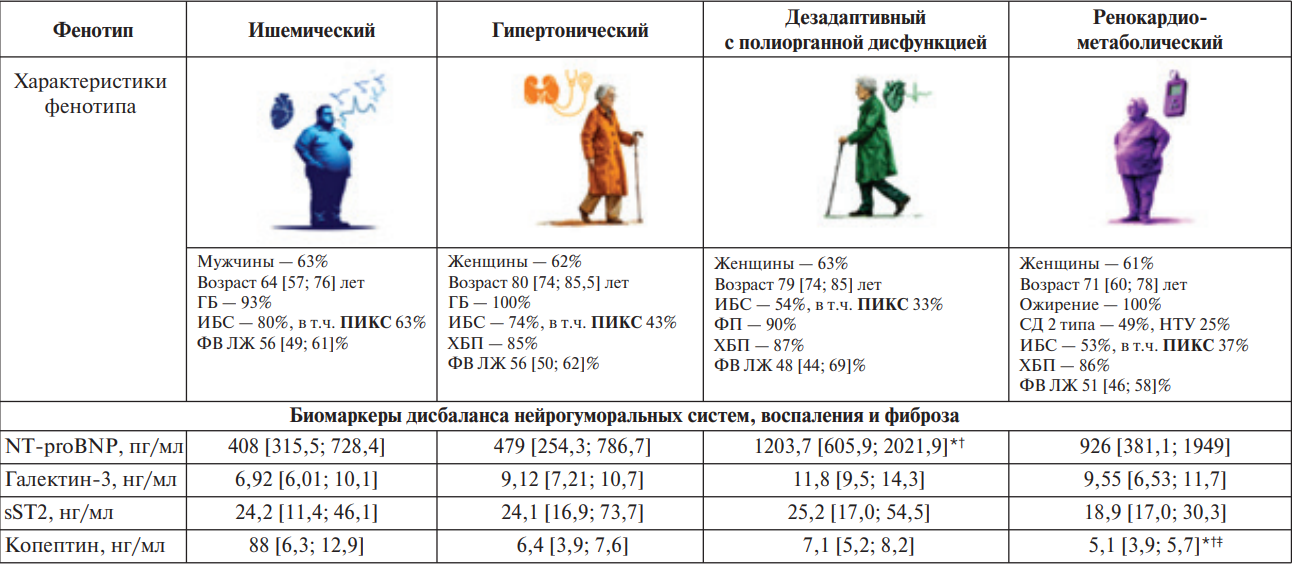
Рис. 3. Уровни медиаторов нейрогуморальных систем, маркеров воспаления и фиброза у больных ХСНсФВ и ХСНунФВ разных фенотипических групп (адаптировано из [38]).
Примечание: * — р<0,05 при сравнении с ишемическим фенотипом, † — р<0,05 при сравнении с гипертоническим фенотипом, ‡ — р<0,05 при сравнении с дезадаптивным фенотипом с полиорганной дисфункцией.
Сокращения: ГБ — гипертоническая болезнь, ИБС — ишемическая болезнь сердца, НТУ — нарушение толерантности к углеводам, ПИКС — постинфарктный кардиосклероз, СД 2 — сахарный диабет 2 типа, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, NT-proBNP — N-концевой промозговой натрийуретический пептид, sST2 — растворимая фракция стимулирующего фактора роста, кодируемого геном 2.
Заключение
У больных с различными заболеваниями сердечно-сосудистой системы можно предполагать развитие разных типов фиброза. Острый ИМ способствует формированию "холодного" фиброза, представленного преимущественно фибробластами, тогда как под влиянием хронически действующих гемодинамических факторов развивается "горячий" фиброз, основными клеточными элементами и эффекторами которого являются фибробласты и макрофаги. Конкретные алгоритмы диагностики разных типов фиброза, применимые в клинической практике, до настоящего времени не разработаны. Гипотеза о различной эффективности терапевтических стратегий разных типов фиброзов требует дальнейшей разработки.
Список литературы
1. Zawadzki A, Leeming DJ, Sanyal AJ, et al. Hot and Cold Fibrosis: The Role of Serum Biomarkers to assess the Immune Mechanisms and ECM-Cell Interactions in Human Fibrosis. J Hepatol. 2025: S0168-8278(25)00148-5. doi:10.1016/j.jhep.2025.02.039.
2. Miyara S, Adler M, Umansky KB, et al. Cold and hot fibrosis define clinically distinct cardiac pathologies. Cell Syst. 2025;16(3):101198. doi:10.1016/j.cels.2025.101198.
3. Henderson NC, Rieder F, Wynn TA. Fibrosis: from mechanisms to medicines. Nature. 2020;587(7835):555-66. doi:10.1038/s41586-020-2938-9.
4. Alon U. Systems Medicine, Physiological Circuits and the Dynamics of Disease (1st ed.) Chapman and Hall/CRC. 2023;270. doi:10.1201/9781003356929.
5. Jiang W, Xiong Y, Li X, Yang Y. Cardiac Fibrosis: Cellular Effectors, Molecular Pathways, and Exosomal Roles. Front Cardiovasc Med. 2021;8:715258. doi:10.3389/fcvm.2021.715258.
6. Соломахина Н. И., Беленков Ю. Н., Варшавский В. А. Фиброз миокарда при систолической и диастолической хронической сердечной недостаточности: монография. М.: ИД "Медпрактика-М", 2014, 64 с. ISBN: 978-5-98803-315-8.
7. Ye L, D’Agostino G, Loo SJ, et al. Early regenerative capacity in the porcine heart. Circulation 2018;138:2798-808. doi:10.1161/circulationaha.117.031542.
8. Haubner BJ, Schneider J, Schweigmann U, et al. Functional recovery of a human neonatal heart after severe myocardial infarction. Circ. Res. 2016;118:216-21. doi:10.1161/circresaha.115.307017.
9. Tzahor E, Poss KD. Cardiac regeneration strategies: Staying young at heart. Science. 2017;356:1035-9. doi:10.1126/science.aam5894.
10. O’Reilly S, Tsou PS, Varga J. Senescence and tissue fibrosis: opportunities for therapeutic targeting. Trends Mol Med. 2024;30(12):1113-25. doi:10.1016/j.molmed.2024.05.012.
11. Maruyama K, Imanaka-Yoshida K. The pathogenesis of cardiac fibrosis: a review of recent progress. Int J Mol Sci. 2022;23(5):2617. doi:10.3390/ijms23052617.
12. de Castro Brás LE, Frangogiannis NG. Extracellular matrix-derived peptides in tissue remodeling and fibrosis. Matrix Biol. 2020;91-2:176-87. doi:10.1016/j.matbio.2020.04.006.
13. Espeland T, Lunde IG, H Amundsen B, et al. Myocardial fibrosis. Tiedsskr Nor Laegeforen. 2018;138(16). English, Norwegian. doi:10.4045/tidsskr.17.1027.
14. Hilgendorf I, Frantz S, Frangogiannis NG. Repair of the Infarcted Heart: Cellular Effectors, Molecular Mechanisms and Therapeutic Opportunities. Circ Res. 2024;134(12):1718-51. doi:10.1161/CIRCRESAHA.124.323658.
15. Pakshir P, Hinz B. The big five in fibrosis: Macrophages, myofibroblasts, matrix, mechanics, and miscommunication. Matrix Biol. 2018;68:81-93. doi:10.1016/j.matbio.2018.01.019.
16. Buechler MB, FuW, Turley SJ. Fibroblast-macrophage reciprocal interactions in health, fibrosis, and cancer. Immunity. 2021;54:903-15. doi:10.1016/j.immuni.2021.04.021.
17. Rao W, Li D, Zhang Q, et al. Complex regulation of cardiac fibrosis: insights from immune cells and signaling pathways. J Transl Med. 2025;23(1):242. doi:10.1186/s12967-025-06260-5.
18. Adler M, Mayo A, Zhou X, et al. Principles of cell circuits for tissue repair and fibrosis. iScience. 2020;23(2):100841. doi:10.10.16/j.isci.2020.100841.
19. Adhyatmika A, Putri KS, Beljaars L, Melgert BN. The elusive antifibrotic macrophage. Front Med (Lausanne). 2015;2:81. doi:10.3389/fmed.2015.00081.
20. Kokubo K, Onodera A, Kiuchi M, et al. Conventional and pathogenic Th2 cells in inflammation, tissue repair, and fibrosis. Front Immunol. 2022;13:945063. doi:10.3389/fimmu.2022.945063.
21. Hesketh M, Sahin KB, West ZE, Murray RZ. Macrophage phenotypes regulate scar formation and chronic wound healing. Int J Mol Sci. 2017;18(7):1545. doi:10.3390/ijms18071545.
22. Yan L, Wang J, Cai X, et al. Macrophage plasticity: signaling pathways, tissue repair, and regeneration. MedComm 2024;5(8):e658. doi:10.1002/mco2.658.
23. Calcagno DM, Taghdiri N, Ninh VK, et al. Single-cell and spatial transcriptomics of the infarcted heart define the dynamic onset of the border zone in response to mechanical destabilization. Nat CardioVasc Res. 2022;1:1039-55. doi:10.1038/s44161-022-00160-3.
24. Walraven M, Hinz B. Therapeutic approaches to control tissue repair and fibrosis: Extracellular matrix as a game changer. Matrix Biol. 2018;71-72:205-24. doi:10.1016/j.matbio.2018.02.020.
25. Sharma N, Kumar P, Shukla KS, et al. AGE RAGE Pathways: cardiovascular disease and oxidative stress. Drug Res (Stuttg). 2023;73(7):408-11. doi:10.1055/a-2047-3896.
26. Ke D, Cao M, Ni J, et al. Macrophage and fibroblast trajectory inference and crosstalk analysis during myocardial infarction using integrated single-cell transcriptomic datasets. J Transl Med. 2024;22(1):560. doi:10.1186/s12967-024-05353-x.
27. Fu X, Khalil H, Kanisicak O, et al. Specialized fibroblast differentiated states underlie scar formation in the infarcted mouse heart. J Clin Invest. 2018;128(5):2127-43. doi:10.1172/JCI98215.
28. Patrick R, Janbandhu V, Tallapragada V, et al. Integration mapping of cardiac fibroblast single-cell transcriptomes elucidates cellular principles of fibrosis in diverse pathologies. Sci Adv. 2024;10(25):eadk8501. doi:10.1126/sciadv.adk8501.
29. Bastos JM, Scala N, Perpétuo L, et al. Integrative bioinformatic analysis of prognostic biomarkers in heart failure: Insights from clinical trials. Eur J Clin Invest. 2025;55(4):e70010. doi:10.1111/eci.70010.
30. Wang S, Li K, Pickholz E, et al. An autocrine signaling circuit in hepatic stellate cells underlies advanced fibrosis in nonalcoholic steatohepatitis. Sci Transl Med. 2023;15:eadd3949. doi:10.1126/scitranslmed.add3949.
31. Higashikuni Y, Liu W, Numata G, et al. NLRP3 inflammasome activation through heart-brain interaction initiates cardiac inflammation and hypertrophy during pressure overload. Circulation. 2023;147(4):338-55. doi:10.1161/CIRCULATIONAHA.122.060860.
32. Bomb R, Heckle MR, Sun Y, et al. Myofibroblast secretome and its auto-/paracrine signaling. Expert Rev Cardiovasc Ther. 2016;14(5):591-8. doi:10.1586/14779072.2016.1147348.
33. Setten E, Castagna A, Nava-Sedeño JM, et al. Understanding fibrosis pathogenesis via modeling macrophage-fibroblast interplay in immune-metabolic context. Nat. Commun. 2022;13:6499. doi.10.1038/s41467-022-34241-5.
34. Подзолков В. И., Драгомирецкая Н. А., Казадаева А. В. и др. Взаимосвязи активности нейрогормональных систем и параметров внутрисердечной гемодинамики у больных хронической сердечной недостаточностью: фокус на галектин-3. Российский кардиологический журнал. 2022;27(4):4957. doi:10.15829/1560-4071-2022-4957.
35. Aghajanian H, Kimura T, Rurik JG, et al. Targeting cardiac fibrosis with engineered T cells. Nature. 2019;573:430-3. doi:10.1038/s41586-019-1546-z.
36. Vagnozzi RJ, Maillet M, Sargent MA, et al. An acute immune response underlies the benefit of cardiac stem cell therapy. Nature. 2020;577:405-9. doi:10.1038/s41586-019-1802-2.
37. Alexanian M, Przytycki PF, Micheletti R, et al. A transcriptional switch governs fibroblast activation in heart disease. Nature. 2021;595:438-43. doi:10.1038/s41586-021-03674-1.
38. Драгомирецкая Н. А., Толмачева А. В., Иванников А. А. и др. Фенотипические кластеры и профиль биомаркеров у больных с хронической сердечной недостаточностью с сохраненной и умеренно сниженной фракцией выброса левого желудочка. Терапевтический архив. 2024;96(12):1137-43. doi:10.26442/00403660.2024.12.203003.
39. Sethi R, Vishwakarma P, Pradhan A. Evidence for aldosterone antagonism in heart failure. Card Fail Rev. 2024;10:e15. doi:10.15420/cfr.2024.10.
Об авторах
Н. А. ДрагомирецкаяРоссия
Наталья Александровна Драгомирецкая — д.м.н., доцент кафедры факультетской терапии № 2ИКМ им. Н. В. Склифосовского
Москва
И. И. Волчков
Россия
Иван Игоревич Волчков —студент ИКМ им. Н. В. Склифосовского
Москва
А. К. Белов
Россия
Андрей Константинович Белов — студент ИКМ им. Н. В. Склифосовского
Москва
Л. А. Гонцова
Россия
Лилия Александровна Гонцова — врач отделения терапии УКБ № 4 Клинического центра
Москва
М. В. Ветлужская
Россия
Лилия Александровна Гонцова — врач отделения терапии УКБ № 4 Клинического центра
Москва
В. И. Подзолков
Россия
Валерий Иванович Подзолков — д.м.н., профессор, зав. кафедрой факультетской терапии № 2 ИКМ им. Н. В. Склифосовского
Москва
Дополнительные файлы
- На основании анализа животных моделей выдвинута гипотеза о существовании разных типов фиброза — "горячего" и "холодного".
- "Горячий" фенотип характерен для ситуаций с хроническим воздействием повреждающего фактора — артериальной гипертензии, хронической ишемической болезни сердца и т.п.
- "Холодный" фиброз развивается после однократного воздействия интенсивного повреждающего фактора (например, при инфаркте миокарда) и представлен почти исключительно миофибробластами при минимальном участии иммунных клеток.
Рецензия
Для цитирования:
Драгомирецкая Н.А., Волчков И.И., Белов А.К., Гонцова Л.А., Ветлужская М.В., Подзолков В.И. Новый взгляд на процессы фиброза миокарда: «холодный» и «горячий» фенотипы. Особенности патогенеза и потенциальные терапевтические стратегии. Российский кардиологический журнал. 2025;30(9S):6397. https://doi.org/10.15829/1560-4071-2025-6397. EDN: DSTJOD
For citation:
Dragomiretskaya N.A., Volchkov I.I., Belov A.K., Gontsova L.A., Vetluzhskaya M.V., Podzolkov V.I. A fresh angle on myocardial fibrosis processes: cold and hot phenotypes. Pathogenesis features and potential therapeutic strategies. Russian Journal of Cardiology. 2025;30(9S):6397. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6397. EDN: DSTJOD
JATS XML

















































