Перейти к:
Виды чрескожных коронарных вмешательств при инфаркте миокарда с подъемом сегмента ST
https://doi.org/10.15829/1560-4071-2025-6369
EDN: ECNBUU
Аннотация
При инфаркте миокарда с подъемом сегмента ST (ИМпST) выполняются различные виды чрескожного коронарного вмешательства (ЧКВ) в зависимости от сроков заболевания, сохраняющейся симптоматики болезни и предварительного использования тромболитической терапии (ТЛТ).
Целью обзора является представить все виды ЧКВ, которые могут быть выполнены при лечении пациентов с ИМпST, обосновать показания для их применения и оптимальный вариант эндоваскулярного вмешательства.
Принципиально выделены три вида ЧКВ, используемые у больных ИМпST: первичное ЧКВ (пЧКВ), позднее ЧКВ (после 48 ч от начала заболевания) и ЧКВ после ТЛТ. Различные виды ЧКВ при ИМпST имеют не одинаковую пользу. Современные рекомендации обосновывают абсолютные показания для стентирования с наивысшим уровнем доказательности для пЧКВ в течение 12 ч, спасительного ЧКВ и рутинного раннего ЧКВ после ТЛТ. При этом приоритетная роль в реперфузии при ИМпST закреплена за пЧКВ в течение 12 ч. Именно поэтому данный показатель является целевым в рамках европейской инициативы Stent for Life (SFL) — национальный/региональный показатель пЧКВ в течение 12 ч должен быть 70% и выше от числа больных, госпитализированных с ИМпST.
Для цитирования:
Барбараш О.Л., Тарасов Р.С., Данилович А.И., Ганюков В.И. Виды чрескожных коронарных вмешательств при инфаркте миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2025;30(9S):6369. https://doi.org/10.15829/1560-4071-2025-6369. EDN: ECNBUU
For citation:
Barbarash O.L., Tarasov R.S., Danilovich A.I., Ganyukov V.I. Types of percutaneous coronary interventions in ST-segment elevation myocardial infarction. Russian Journal of Cardiology. 2025;30(9S):6369. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6369. EDN: ECNBUU
Ключевые моменты
- В обзоре представлены все виды чрескожного коронарного вмешательства (ЧКВ), используемые у больных с инфарктом миокарда с подъемом сегмента ST (ИМпST).
- Эндоваскулярные вмешательства при ИМпST разделяются в зависимости от сроков заболевания, сохраняющейся симптоматики болезни и предварительного использования тромболитической терапии.
- Различные виды ЧКВ при ИМпST имеют не оди- наковую пользу.
- В обзоре на основе доказательной базы обосновывается приоритетная роль первичного ЧКВ в течение 12 ч от начала симптомов среди всех видов реперфузии больных ИМпST, которая закреплена в современных рекомендациях с 2003г.
Key messages
- The review presents all types of percutaneous coronary intervention (PCI) used in patients with ST-segment elevation myocardial infarction (STEMI).
- Endovascular interventions for STEMI are divided depending on the disease duration, persistent symptoms of the disease, and the preliminary use of thrombolytic therapy.
- Different types of PCI for STEMI have different benefits.
- The review, based on the evidence base, substantiates the priority role of primary PCI within 12 hours from the symptom onset among all types of reperfusion in patients with STEMI, which has been enshrined in modern guidelines since 2003.
Восстановление кровотока в инфаркт-связанной коронарной артерии (ИСА) — реперфузия, является основой современного лечения инфаркта миокарда (ИМ) с подъемом сегмента ST (ИМпST). Главными методами реперфузии при ИМпST являются чрескожное коронарное вмешательство (ЧКВ) и тромболитическая терапия (ТЛТ). На современном уровне знаний обоснованы и рекомендуются такие стратегии реперфузии, как стратегия первичного ЧКВ (пЧКВ) и фармако-инвазивная стратегия (ФИС). Стратегия пЧКВ как приоритетная методология реперфузии при ИМпST закреплена в современных рекомендациях с 2003г. Именно поэтому европейская инициатива Stent for Life (SFL), стартовавшая с доклада Widimsky P в 2009г в Париже на конгрессе "EuroPCR", и продолжающая свою работу по настоящее время, целевым показателем реперфузии при ИМпST утвердила число случаев пЧКВ ≥70% от общего количества ИМпST в стране/регионе. ЧКВ при ИМпST не в рамках стратегии пЧКВ также показано в отдельных группах пациентов и должно выполняться, но необходимо понимать, что их эффективность и влияние на прогноз ниже. В этой связи именно показатель доступности пЧКВ в первые 12 ч является самым важным для учета и достижения в рамках национальной системы здравоохранения.
Целью настоящего обзора является представить все виды ЧКВ, которые могут быть выполнены при лечении пациентов с ИМпST, обосновать показания для их применения и оптимальный вариант эндоваскулярного вмешательства.
Методология исследования
Поиск источников проводился в ведущих международных библиографических базах данных: Springer (https://link.springer.com), Oxford Medicine Online (https://academic.oup.com), PubMed (https://pubmed.ncbi.nlm.nih.gov), eLIBRARY.ru (https://www.elibrary.ru/defaultx.asp). Временной диапазон охватывал период с 1 января 2003г по 1 ноября 2024г. Последнее обновление поиска произведено в ноябре 2024г.
В качестве поисковых терминов использовались ключевые слова и их комбинации: "ST segment elevation myocardial infarction", "STEMI", "percutaneous coronary intervention", "primary percutaneous coronary intervention", "pPCI", "инфаркт миокарда с подъемом сегмента ST", "ИМпST", "чрескожное коронарное вмешательство", "ЧКВ", "первичное чрескожное коронарное вмешательство", "пЧКВ". Были применены логические операторы AND/OR и фильтры по языку публикации (английский, русский), типу источников (обзоры, рандомизированные исследования, регистры, клинические рекомендации), а также полнотекстовому доступу.
В обзор включались только рецензируемые статьи, метаанализы, систематические обзоры, клинические руководства, результаты многоцентровых рандомизированных исследований и регистров, имеющие клиническую значимость и методологическую обоснованность. Исключались единичные клинические случаи, дублирующие публикации, статьи без описания методики, а также устаревшие данные, утратившие актуальность.
Результаты
Определения
пЧКВ. Выполняется в рамках стратегии пЧКВ, которая определяется как экстренное проведение коронарографии с последующим ЧКВ (при показаниях) на ИСА у пациента, госпитализированного с ИМпST [1]. Для полного понимания данной дефиниции необходимо дать ответ на вопрос, что означает "…экстренное…"? Ответ лежит на поверхности. По современным отечественным рекомендациям стратегия пЧКВ должна быть выполнена в течение 60 мин ("время от постановки/подтверждения диагноза в ЧКВ-центре до проведения проводника в ИСА — не более 60 мин) [2].
Дефиниция пЧКВ европейскими коллегами менялась с течением времени. В рекомендациях по ЧКВ от 2005г пЧКВ определялось как вмешательство на ИСА в течение 12 ч от начала симптомов у пациентов с ИМпST без предварительной ТЛТ [3]. В рекомендациях по реваскуляризации от 2010г из определения пЧКВ уходит упоминание о временных пределах пЧКВ и за пЧКВ принимается "вмешательство у пациентов с ИМпST без предварительной/сопутствующей ТЛТ" [4]. Начиная с 2012г [5] и по настоящее время стратегия пЧКВ показана не только во временной интервал до 12 ч, но и для пациентов с началом симптомов >12 ч при сохранении симптомов подозрительных в отношении ишемии миокарда [7], гемодинамической нестабильности или при наличии угрожающих жизни аритмий сердца. Причем время выполнения стратегии пЧКВ не ограничивается конкретным временным интервалом, если у больного имеются перечисленные симптомы. При отсутствии симптомов европейские рекомендации предлагают рассмотреть целесообразность выполнения пЧКВ в интервале 12-48 ч от начала симптомов ИМпST [5-7]. И если в 2012г этот интервал ограничивался 12-24 ч и носил формулировку "пЧКВ может быть рассмотрено" [5], то после 2014г интервал для вмешательства у бессимптомных/малосимптомных больных расширился до 12-48 ч и имеет формулировку "пЧКВ должно быть рассмотрено" [6], а в рекомендациях 2023г этот подход предлагается рассматривать рутинно [7].
Таким образом, Европейское общество кардиологов определяет пЧКВ как баллонную ангиопластику, стентирование или другой метод чрескожной коронарной интервенции на ИСА при ИМпST без предварительной ТЛТ, выполненные в рамках стратегии пЧКВ [1].
В отечественных рекомендациях нет специального раздела с определением пЧКВ и/или стратегии пЧКВ [2, 8], хотя термин часто применяется и подходы к лечению согласуются с европейскими предложениями.
В отечественных публикациях под руководством академиков РАН Алекяна Б. Г. и Бойцова С. Н. [9-12], в целях проводимого анализа реваскуляризации при остром коронарном синдроме в Российской Федерации вводится следующее определение пЧКВ: "пЧКВ — ЧКВ симптом-зависимого стеноза, выполненное в течение 12 ч от начала симптомов ИМпST у больного, не получавшего предварительно ТЛТ. Из группы пЧКВ в настоящих публикациях исключены больные с ИМпST, которым ЧКВ выполнено в промежуток времени >12 ч от начала симптомов заболевания. Выделение такой группы пациентов сложно, она малочисленна и анализ ее в мониторинге Минздрава России не представлен".
Сравнивая определение пЧКВ, предложенное европейскими кардиологами [1][7], с отечественной дефиницией, получившей отражение в работах академиков РАН Алекяна Б. Г. и Бойцова С. Н. [9-12], необходимо дать следующие комментарии. С одной стороны, необходимо отдать должное практической ценности европейского подхода с прецизионным выделением групп больных ИМпST при поступлении за пределами 12 ч от начала симптомов, где стратегия пЧКВ может сохранять свою пользу. Важно, что эффективность стратегии пЧКВ в различных временных группах больных ИМпST в большинстве своем имеет доказательную базу. С другой стороны, понятно, что стратегия пЧКВ, примененная после 12 ч от старта повреждения миокарда, однозначно глобально проигрывает пЧКВ в пределах 12 ч. И в понятие доступности пЧКВ, которое в европейской инициативе SFL определено как ≥70% пЧКВ от всех госпитализированных ИМпST на национальном уровне, входит как раз стентирование, выполненное в пределах 12 ч [13]. Соответственно, выделение этой группы (больные с пЧКВ в пределах 12 ч) отечественными авторами дает представление об эффективности/доступности эндоваскулярного подхода при ИМпST в регионе/стране. С учетом сказанного представляется, что оба определения (европейское и отечественное) дополняют друг друга, но имеют разные цели применения. В то время как европейский подход помогает в практическом использовании стратегии пЧКВ, отечественное определение может применяться для анализа доступности пЧКВ и поиску путей оптимизации доступности данного приоритетного способа реперфузии при ИМпST.
ЧКВ после 48 ч от начала ИМпST (позднее ЧКВ). Если у больных с ИМпST в промежуток времени >48 ч от начала ИМпST имеют место симптомы ишемии, сердечной недостаточности (СН), аритмии угрожающей жизни, то больному проводится стратегия пЧКВ (описана выше). Но в случае отсутствия симптомов и/или выявления при ангиографии окклюзии ИСА рутинно ЧКВ не выполняется. Тем не менее позднее ЧКВ окклюзированной артерии может быть выполнено не рутинно, когда имеется наличие объективных признаков жизнеспособного/ишемизированного миокарда при инструментальном обследовании [1][7]. Рекомендации умалчивают еще об одном клиническом состоянии, при котором возможно выполнение позднего ЧКВ. Это бессимптомные пациенты со значимым стенозом ИСА, и, соответственно, с сохраненным антеградным кровотоком. Протоколы ведения подобных пациентов должны предусматривать рутинное стентирование ИСА для предотвращения рецидива ИМ.
Таким образом, позднее ЧКВ (ЧКВ после 48 ч от начала ИМпST) может быть выполнено в трех группах пациентов: 1) при сохранении симптомов заболевания — ЧКВ на ИСА в рамках стратегии пЧКВ; 2) у бессимптомных больных — ЧКВ окклюзированной ИСА при объективизации жизнеспособного/ишемизированного миокарда; 3) у бессимптомных больных — ЧКВ стенозированной ИСА. Отличительной организационной особенностью (1) варианта позднего ЧКВ от (2) и (3) является то, что операция выполняется незамедлительно после экстренной коронарографии, в то время как ЧКВ в вариантах (2) и (3) не требует такой срочности действий.
Спасительное ЧКВ (ЧКВ в рамках ФИС). ФИС — ТЛТ в сочетании со спасительным ЧКВ (в случае не успешной ТЛТ) или рутинной ранней ЧКВ стратегией (в случае успешной ТЛТ).
Спасительное ЧКВ — это экстренное ЧКВ на ИСА выполненное настолько быстро, насколько это возможно при не эффективной ТЛТ [1, 7]. Не эффективная ТЛТ определяется как отсутствие динамики электрокардиограммы (через 60-90 мин от начала внутривенного введения тромболитика, когда отсутствует резолюция сегмента ST на ≥50% от исходного подъема сегмента ST) или при рецидиве болевого синдрома и подъема сегмента ST после введения тромболитического средства [2][7].
Рутинная ранняя стратегия ЧКВ (ЧКВ в рамках ФИС). Рутинная ранняя стратегия ЧКВ — рутинная коронарография и ЧКВ (при необходимости) в течении 2-24 ч после эффективной ТЛТ (когда через 60-90 мин от начала внутривенного введения тромболитика имеется снижение подъема сегмента ST на ≥50% от исходного подъема ST; типичная реперфузионная аритмия; купирование болевого синдрома).
Таким образом, если перечислить одобренные/рекомендованные варианты ЧКВ, которые могут быть выполнены у пациентов, госпитализированных с ИМпST, получится следующий перечень (табл. 1).
Необходимо отметить, что только вариант 1а — "пЧКВ в течение 12 ч от начала ИМпST" начиная с 2003г и по настоящее время фигурирует в рекомендациях как приоритетный способ реперфузии у больных ИМпST. Важно отметить, что как в европейских [7], так и в отечественных [2] регламентирующих документах подчеркивается, что необходимым условием преимущества пЧКВ, выполненного в пределах 12 ч от начала симптомов над остальными способами реперфузии, должно быть соблюдение времени "первый медицинский контакт — баллон" <120 мин. Тем не менее если данный временной интервал при проведении пЧКВ не соблюдается, это не должно подталкивать региональную/национальную систему здравоохранения на расширение показаний к ФИС. Усилия клиницистов, организаторов здравоохранения и представителей власти должны быть направлены на вскрытие проблем и устранение барьеров задержки пЧКВ. Главной задачей европейской инициативы SFL является помощь в настройке национальных систем здравоохранения для обеспечения максимальной доступности приоритетного способа реперфузии — пЧКВ в течение 12 ч от начала ИМпST.
Далее мы остановимся на доказательной базе, обосновывающей тот или иной вариант ЧКВ при ИМпST.
Таблица 1
Класс рекомендаций для ЧКВ при ИМпST и их уровень достоверности (уровень доказательной базы)
|
№ |
Вид ЧКВ |
Описание |
Класс |
УД |
|
1 |
пЧКВ |
a. пЧКВ в течение 12 ч от начала ИМпST |
I |
А |
|
b. пЧКВ после 12 ч от начала ИМпST при сохранении симптомов |
I |
C |
||
|
c. пЧКВ в интервале 12-48 ч от начала ИМпST у малосимптомных/бессимптомных пациентов |
IIa |
В |
||
|
2 |
Позднее ЧКВ |
a. пЧКВ после 48 ч от начала ИМпST при сохранении симптомов* |
I |
C |
|
b. ЧКВ после 48 ч от начала ИМпST у бессимптомных больных с окклюзированной ИСА при объективизации жизнеспособного/ишемизированного миокарда** |
** |
С |
||
|
c. ЧКВ после 48 ч от начала ИМпST у бессимптомных больных со стенозированной ИСА*** |
*** |
С |
||
|
3 |
ЧКВ после ТЛТ |
a. спасительное ЧКВ |
I |
A |
|
b. ЧКВ выполненное в рамках рутинной ранней стратегии ЧКВ |
I |
А |
Примечание: * — позднее ЧКВ — вариант 2a является разновидностью пЧКВ — вариант 1b; ** — не классифицировано европейскими рекомендациями, хотя описано в текстовом сопровождении как возможный вариант ЧКВ [7]; *** — вариант 2с одобрен локальным протоколом ведения больных ИМпST в ГБУЗ Кузбасском клиническом кардиологическом диспансере им. акад. Л. С. Барбараша; не классифицировано европейскими рекомендациями.
УД А: основан на нескольких многоцентровых рандомизированных клинических исследованиях; УД В: основан на единственном рандомизированном исследовании или нерандомизированных исследованиях; УД С: основан на единстве мнений экспертов.
Сокращения: ИМпST — инфаркт миокарда с подъемом сегмента ST электрокардиограммы, ИСА — инфаркт-связанная коронарная артерия, пЧКВ — первичное чрескожное коронарное вмешательство, ТЛТ — тромболитическая терапия, УД — уровень достоверности, ЧКВ — чрескожное коронарное вмешательство.
Доказательная база необходимости применения различных видов ЧКВ при ИМпST
пЧКВ
пЧКВ в течение 12 ч от начала ИМпST. В настоящее время получены убедительные доказательства того, что пЧКВ в течение 12 ч от начала ИМпST — лучший метод реперфузии при ИМпST. Обосновывая данное положение, далее будут приведены доказательства на основе анализа исследований сравнения пЧКВ с ТЛТ, сравнения пЧКВ с ФИС, сравнения пЧКВ с ФИС у пациентов в ранние сроки ИМпST.
пЧКВ vs ТЛТ
пЧКВ эффективнее ТЛТ в лечении больных с ИМпST. Прежде всего, это обусловлено достоверно меньшим уровнем летальности у больных ИМпST после пЧКВ, нежели после ТЛТ.
Классическим исследованием, подтверждающим лидирующую роль пЧКВ, является метаанализ Keeley EC, et al., 2003 [14]. В анализ включены 23 рандомизированных исследования, сравнивающих результаты пЧКВ (n=3872) и ТЛТ (n=3867). Оценка объединенного показателя (смерть+нефатальный ИМ+инсульт) в ближайшие сроки (6-8 нед.) после реперфузии выявила преимущество эндоваскулярного вмешательства (8% vs 14%, p<0,0001), в т.ч. и по количеству летальных исходов (7% vs 9%, p=0,0002). Достоверно лучшие результаты катетерного лечения сохранялись и в отдаленном промежутке времени (6-18 мес.).
В самый крупный метаанализ сравнения пЧКВ и ТЛТ Huynh T, et al., 2009 [15] было включено 23 рандомизированных исследования (8140 больных ИМпST) и 32 наблюдательных исследования (185900 больных ИМпST). пЧКВ достоверно снижало летальность на 34% (отношение шансов (ОШ) 0,66, 95% доверительный интервал (ДИ): 0,51-0,82) по данным рандомизированных и на 23% (ОШ 0,77, 95% ДИ: 0,62-0,95) по данным обсервационных исследований. Число инсультов также было меньше в группе пЧКВ на 63/61%, соответственно. По данным рандомизированных исследований смертность к первому году наблюдения после пЧКВ была на 24% (ОШ 0,76, 95% ДИ: 0,58-0,95) меньше, чем при ТЛТ, а число повторных ИМ было ниже на 51% (ОШ 0,49, 95% ДИ: 0,32-0,66).
Полученные результаты позволили авторам сделать заключение: пЧКВ эффективнее ТЛТ в лечении больных с ИМпST [16].
пЧКВ vs ФИС
Идея ФИС достаточно проста, теоретически логична: проведение раннего тромболизиса (<2 ч от начала симптомов, лучше догоспитального) с целью легкого растворения "молодого" тромба, в результате чего быстро восстановленный антеградный кровоток в ИСА ограничит зону некроза миокарда, и, как следствие, снизит вероятность кардиогенного шока, уменьшит показатели ближайшей и отдаленной смертности. С другой стороны, последующая (спасительная/ранняя рутинная в течение 24 ч) ЧКВ устранит главный недостаток ТЛТ — вероятность рецидива ИМ в результате повторного тромбоза целевого сосуда.
На настоящем уровне знаний нет доказательств преимущества ФИС перед пЧКВ, если доступно выполнение пЧКВ в течение 120 мин от первого медицинского контакта (ПМК) с больным ИМпST. В то же время ФИС ассоциируется с худшим профилем безопасности в сравнении с пЧКВ с учетом большего числа интракраниальных геморрагий. В доказательство этого утверждения разберем результаты нескольких научных анализов: рандомизированное исследование STREAM [17], STREAM-2 [18], FAST-MI [19], Канадский [20], Австралийский [26] и Норвежский [27] регистры (табл. 2).
Таблица 2
Результаты исследований сопоставления стратегий пЧКВ и ФИС
|
Исследование |
Группы |
Время от начала симптомов до ТЛТ |
Время ПМК-баллон |
Число инсультов |
Число неблагоприятных исходов |
Принципиальный результат |
|
STREAM [17] |
пЧКВ (n=943) ФИС (n=939) |
100 мин |
117 мин |
через 30 дней геморрагический инсульт 1% при ФИС, 0,2% при пЧКВ, Р=0,04 |
через 30 дней число неблагоприятных исходов 12,4% при ФИС vs 14,3% при пЧКВ, Р=0,21 |
по неблагоприятным исходам ФИС=пЧКВ, но число инсультов достоверно выше при ФИС |
|
STREAM-2 [18] |
больные ИМпST 60 лет и старше + половинная доза тенектеплазы пЧКВ (n=200) ФИС (n=400) |
110 мин |
110 мин |
через 30 дней геморрагический 1,5% при ФИС vs 0% при пЧКВ (ОР 6,61, 95% ДИ: 0,81-53,89) |
через 30 дней число неблагоприятных исходов 12,8% при ФИС vs 13,3% при пЧКВ (ОР 0,96, 95% ДИ: 0,62-1,48) |
по неблагоприятным исходам ФИС=пЧКВ, но число инсультов достоверно выше при ФИС |
|
FAST-MI [19] |
пЧКВ (ПМК-баллон ≤120 мин) (n=1288) пЧКВ (ПМК-баллон >120 мин) (n=830) ФИС (n=824) |
– |
≤120 мин и >120 мин |
госпитальный геморрагический инсульт 0,5% при ФИС и 0,1% при пЧКВ, Р=0,105 |
через 5 лет выживаемость 89,8% при ФИС и 88,2% при пЧКВ (ПМК-баллон ≤120 мин), P=0,97, 89,8% при ФИС и 79,5% при пЧКВ (ПМК-баллон >120 мин), P=0,001 |
если время ПМК-баллон ≤120 мин при пЧКВ, то результаты пЧКВ сопоставимы с ФИС, при увеличении времени ПМК-баллон >120 мин пЧКВ имеет результаты хуже, чем ФИС |
|
Канадский регистр [20] |
пЧКВ (n=1312) ФИС (n=1805) |
128 мин |
133 мин |
через 12 мес. геморрагические инсульты 0,6% vs 0,6%, P=0,841 |
через 12 мес. 16,3% при ФИС vs 23,1% при пЧКВ, P=0,033 |
ФИС лучше пЧКВ, но в группе пЧКВ не соблюдалось утвержденное современными рекомендациями время ПМК-баллон (должно быть <120 мин, а в регистре 133 мин) |
|
Австралийский регистр [26] |
пЧКВ (n=1077) ФИС (n=1014) |
118 мин |
140 мин |
геморрагический инсульт через 3 года 0,2 при пЧКВ и 0,1 при ФИС, P=0,5 |
через 3 года смертность 6,2% при ФИС vs 11,1% при пЧКВ (P<0,01) |
ФИС лучше пЧКВ, но в группе пЧКВ не соблюдалось утвержденное современными рекомендациями время ПМК-баллон (должно быть <120 мин, а в регистре 140 мин) |
|
Норвежский регистр [27] |
пЧКВ-1 (ПМК-баллон ≤120 мин) (n=7238) пЧКВ-2 (ПМК-баллон =121-180 мин) (n=1537) пЧКВ-3 (ПМК-баллон >180 мин) (n=1012) ФИС (n=2338) |
144 мин |
пЧКВ-1 — 82 мин пЧКВ-2 — 140 мин пЧКВ-3 — 252 мин |
госпитальный геморрагический инсульт: пЧКВ-1 — 0,1% пЧКВ-2 — 0,4% пЧКВ-3 — 0,4% ФИС — 0,8% |
через 2,5 года композитное число случаев неблагоприятных исходов было: пЧКВ-1 — 14% пЧКВ-2 — 18,9% пЧКВ-3 — 20,4% ФИС — 13,7% |
результаты пЧКВ в пределах времени ПМК-баллон =120 мин сопоставимы с ФИС, но ФИС хуже по геморрагическим осложнениям. Если время ПМК-баллон при пЧКВ >120 мин, то ФИС лучше |
Сокращения: ДИ — доверительный интервал, ИМпST — инфаркт миокарда с подъемом сегмента ST электрокардиограммы, ОР — отношение рисков, ПМК — первый медицинский контакт, пЧКВ — первичное чрескожное коронарное вмешательство, ТЛТ — тромболитическая терапия, ФИС — фармако-инвазивная стратегия.
В STREAM сравнивались две рандомизировано сформированные группы пациентов с ИМпST [17]. В одну группу были отобраны 939 больных с ФИС, в другую — 943 пациента с пЧКВ. На наш взгляд, дизайн исследования был сформирован таким образом, чтобы продемонстрировать преимущества ФИС: 1) исключены пациенты с задержкой пЧКВ <60 мин; 2) в комбинированную первичную конечную точку (смерть+шок+застойная СН+повторный ИМ к 30 дню наблюдения) не включен инсульт; 3) критерием включения был срок от начала ИМпST — первые 3 ч заболевания. Несмотря на это достоверной разницы между группами по первичной конечной точке не зарегистрировано (12,4% при ФИС vs 14,3% при пЧКВ, Р=0,21), более того, разницы не было ни по одному из компонентов первичной конечной точки, а по количеству геморрагических инсультов группа ФИС имела в 5 раз более худшие результаты (1% vs 0,2%, Р=0,04, соответственно). Таким образом, даже в самой идеальной для ФИС группе пациентов (первые 3 ч от начала ИМпST) и наиболее благоприятном дизайне сравнения (комбинированная точка без включения результатов по инсульту, задержка пЧКВ >60 мин, что является неоптимальным временем задержки пЧКВ для раннего поступления больных ИМпST) ТЛТ с последующей рутинной ЧКВ не продемонстрировало преимущество перед пЧКВ.
Исследование STREAM-2 [18] имело аналогичный дизайн, как и в анализе STREAM. Отличие заключалось только в том, что в STREAM-2 тестировались больные ИМпST 60 лет и старше, которым применялась половинная доза тенектеплазы. Гипотеза исследования заключалась в обосновании эффективности и безопасности ФИС для лиц старшей возрастной группы при использовании уменьшенной дозы тромболитика в сравнении с пЧКВ. Несмотря на то, что зарегистрировано сопоставимое число событий комбинированной клинической конечной точки при анализе через 30 дней (12,8% при ФИС vs 13,3% при пЧКВ (отношение рисков (ОР) 0,96, 95% ДИ: 0,62-1,48)), что говорило о неплохой эффективности использованного подхода — ФИС, оценка безопасности применения половинной дозы тенектеплазы в группе лиц старшего возраста выявила неожиданный неблагоприятный результат. Число геморрагических инсультов было выше в группе ФИС (1,5% при ФИС vs 0% при пЧКВ (ОР 6,61, 95% ДИ: 0,81-53,89)), так же как и общее число нарушений мозгового кровообращения (2,3% при ФИС vs 0,5% при пЧКВ (ОР 4,57, 95% ДИ: 0,58-35,89)).
В регистре FAST-MI [19] представлены пятилетние результаты выживания трех групп пациентов. Изучались больные ИМпST после выполнения ФИС (n=824). Пациенты после пЧКВ с рекомендованным временем ПМК — баллон ≤120 мин (n=1288) вошли во вторую группу анализа. В третью группу включены больные, у которых пЧКВ выполнено в промежуток времени более чем 120 мин от ПМК (n=830). К 5 году наблюдения число выживших в группе ФИС было сопоставимо с группой пЧКВ ≤120 мин (89,8% и 88,2%, P=0,97, соответственно) и достоверно выше, чем в группе пЧКВ >120 мин (89,8% и 79,5%, P=0,001, соответственно). Традиционно анализом зарегистрировано пятикратное увеличение внутричерепных кровоизлияний в группе ФИС (0,5% при применении ТЛТ и 0,1% в группах ЧКВ). Таким образом, регистр FAST-MI подтвердил уже давно закрепленную в рекомендациях истину о том, что пЧКВ необходимо выполнять в строгом соответствии с методологией, в которой время ПМК-баллон не должно превышать 120 мин.
Канадский регистр представленный Bainey K, et al., 2019 [20] единственное исследование, в котором продемонстрировано безусловное преимущество ФИС (n=1805) над пЧКВ (n=1312) как по комбинированной конечной точке (смерть+шок+застойная СН+повторный ИМ к 12 мес. наблюдения — 16,3% vs 23,1% P=0,033, соответственно), так и даже отдельно по числу летальности (1,9% vs 5,2%, P<0,001, соответственно). При этом разницы по внутричерепным кровоизлияниям не зарегистрировано (0,6% vs 0,6%, P=0,841, соответственно). Цифры летальности при ФИС — 1,9%, конечно, выглядят очень привлекательными, особенно в сравнении с 30-дневной смертностью при ФИС в анализе STREAM — 4,6%. Также вызывают недоумение сопоставимые результаты в группах по геморрагическим инсультам, тогда как все предыдущие анализы по этому показателю однозначно показывали достоверную разницу в пользу пЧКВ. Авторы в качестве "оправдания" столь резко отличающихся результатов от исследования STREAM [17] и других регистров [21-25] говорят о несоответствии между группами по числу пациентов с началом реперфузии в срок более 3 ч. В группе ФИС таких больных было только 32,2% в сравнении с группой пЧКВ, где после 3 ч от начала симптомов включено большинство больных — 59,4%. Дополнительно, и это, на наш взгляд, главное, необходимо сказать, что среднее время ПМК-баллон в группе пЧКВ равнялось 133 мин. Таким образом, в Канадском регистре группа пЧКВ имела продолжительное время ишемии и стентирование выполнялось в среднем с нарушением современных рекомендаций по задержке пЧКВ, которое не должно превышать 120 мин. Соответственно результат был схож с группой пЧКВ >120 мин исследования FAST-MI, где ФИС также показало преимущество.
Более современные анализы клинической практики: Канадский регистр (Bainey K, et al., 2019 [20]), Австралийский регистр (Jamal J, et al., 2023 [26]) и Норвежский регистр (Jortveit J, et al., 2022 [27]), так же как и FAST-MI [19], подтверждают сопоставимые результаты ФИС с пЧКВ, если задержка стентирования не превышает 120 мин, и лучшие результаты ФИС при увеличении времени ПМК-баллон выше рекомендованных значений. Стандартно в анализах регистрируется большее число инсультов после применения ТЛТ, чем в группах стратегии пЧКВ.
пЧКВ с ФИС у пациентов в ранние сроки ИМпST
Необходимо принимать во внимание то, что все вышеприведенные исследования и регистры выполнены в наилучшее для действия тромболитических агентов время — <3 ч от начала заболевания. Минимальное среднее время "начало болевого синдрома — игла" зарегистрировано в исследовании STREAM — 100 мин [17], максимальное в Норвежском регистре — 144 мин [27]. И мы не знаем, какие результаты ФИС будут при задержке времени введения тромболитика >3 ч. Особенно этот результат интересен для российской действительности, где в 2022г только среднее время "начало болевого синдрома — звонок в скорую медицинскую помощь" было 119 мин в группе пЧКВ [8], а по данным регистра РЕГИОН-ИМ среднее время от появления симптомов до электрокардиографии в случае поступления пациента в РСЦ составляет 7,3 ч, а при поступлении в ПСО — 9,9 ч [28].
Таким образом, можно считать доказанным, что при проведении ТЛТ в промежуток времени до 3 ч от начала симптомов ИМпST ФИС имеет сопоставимые результаты в сравнении с пЧКВ, выполненной в пределах 120 мин от ПМК, и лучшие результаты в сравнении с пЧКВ, выполненной в пределах >120 мин от ПМК. При этом проведение ФИС достоверно увеличивает риск геморрагического инсульта в 3-5 раз. С учетом последнего становятся понятными настойчивые рекомендации Европейских кардиологов по обеспечению приоритетной роли пЧКВ в реперфузии у пациентов с ИМпST.
пЧКВ после 12 ч от начала ИМпST при сохранении симптомов
Несмотря на то, что больные ИМпST с началом заболевания >12 ч при сохранении симптомов подозрительных в отношении ишемии миокарда, гемодинамической нестабильности или при наличии угрожающих жизни аритмий сердца отнесены к классу I рекомендаций для выполнения реперфузии при помощи стратегии пЧКВ, уровень достоверности данного утверждения основан на мнении экспертов. В качестве доказательства данного подхода используются только данные не нового исследования Gierlotka M, et al., 2011 [29], базирующегося на ретроспективном анализе польского регистра острого коронарного синдрома. Авторы сравнили результаты лечения больных ИМпST, поступивших через 12-24 ч после начала симптомов. Сравнивались консервативное ведение пациентов (n=1126) и стратегия пЧКВ (n=910). Через год после госпитализации смертность была достоверно выше в группе консервативного лечения (17,9% vs 9,3% при пЧКВ, Р<0,0001). Результаты в пользу стратегии пЧКВ сохранились и после дополнительного propensity-score matching анализа. Авторы заключили, что до проведения рандомизированных контролируемых исследований больные с ИМпST при госпитализации в поздние сроки могут рассматриваться на предмет проведения у них стратегии пЧКВ.
Несмотря на то, что анализ Gierlotka M, et al., 2011 [29] приводится в европейских рекомендациях 2017 и 2023гг [1, 7] как обоснование показаний к стратегии пЧКВ для "симптомных" больных ИМпST при госпитализации после 12 ч от начала симптомов, в самом исследовании Gierlotka M, et al. изучали больных только со сроками госпитализации 12-24 ч от начала симптомов. Поэтому данное исследование, конечно, не вполне корректно использовать в качестве доказательства пользы пЧКВ после 12 ч от начала симптомов и в т.ч. за пределами 24 ч. Тем не менее с клинических позиций традиционной кардиологии рекомендации по применению стратегии пЧКВ у симптомных пациентов несмотря на поздние сроки госпитализации выглядят вполне логичными.
пЧКВ в интервале 12-48 ч от начала ИМпST у малосимптомных/бессимптомных пациентов
В исследовании BRAVE-2 Schömig A, et al., 2005 [30] включали больных ИМпST с госпитализацией в течение 12-48 ч от начала симптомов, у которых не было симптомов заболевания (боль, СН, аритмия). Пациенты рандомизировались в две группы. В первой выполнялась стратегия пЧКВ (n=182), во второй проводилось консервативное лечение (n=183). Первичными конечными точками были: 1) суррогатная — объем некроза миокарда на основании однофотонной эмиссионной компьютерной томографии; 2) твердая — комбинированная клиническая конечная точка в течение 30 дней (смерть, рецидив ИМ, инсульт). В результате размер некроза миокарда был достоверно меньше в группе пЧКВ (8% vs 13%, Р=0,001), а по комбинированной твердой конечной точке к 30 дню наблюдения различий между группами не было найдено, хотя в абсолютных величинах число неблагоприятных исходов в группе ЧКВ было меньшим (4,4% vs 6,6%, Р=0,37). Авторы сделали заключение о уменьшении размера некроза при стратегии пЧКВ и поздних сроках стентирования (12-48 ч от момента заболевания ИМпST) у бессимптомных пациентов. Продолжая исследование BRAVE-2, Ndrepepa G, et al., 2009 [31] продемонстрировали, что к 4 году наблюдения группа со стратегией пЧКВ имела меньшее число смертельных исходов (11,1% vs 18,9% в группе консервативного лечения, Р=0,047).
Исследование, основанное на анализе ретроспективных данных, полученных из французского регистра FAST-MI, продемонстрировало достоверно лучшие результаты стратегии пЧКВ, чем консервативного лечения для пациентов ИМпST, поступивших через 12-48 ч после начала заболевания. В группе пЧКВ зарегистрировано достоверно меньшее число случаев смерти от всех причин, как в ближайшие (к 30 сут. наблюдения 2,1% в группе пЧКВ vs 7,2% в группе консервативной терапии, Р<0,001), так и в отдаленные сроки лечения (к 58 мес. наблюдения 30,4% vs 78,7%, соответственно, Р<0,001) [32].
У бессимптомных больных, к сожалению, интервал времени >12 ч от начала ИМпST не является критерием окончательно полного некроза миокарда, и дополнительное спасение миокарда происходит и при пЧКВ за пределами 12 ч (например, в промежуток 12-72 ч) даже у больных с окклюзированной ИСА [33]. Хотя мы имеем европейские рекомендации о необходимости рутинного рассмотрения целесообразности пЧКВ у пациентов, госпитализированных через 12-48 ч от начала ИМпST, четких критериев отбора на механическую реваскуляризацию в этой группе больных нет. С учетом этого, и принимая во внимание доказанный риск развития синдрома невосстановленного коронарного кровотока (no-reflow) в группе позднего поступления больных ИМпST с окклюзированной ИСА [34], протоколы ведения больных ИМпST должны предусматривать рутинное стентирование ИСА у бессимптомных больных при госпитализации после 12 ч только в случае стенозированной (но не окклюзированной) ИСА.
Позднее ЧКВ
пЧКВ после 48 ч от начала ИМпST при сохранении симптомов
Стратегия пЧКВ после 48 ч от начала ИМпST при сохранении симптомов является разновидностью стратегии пЧКВ после 12 ч от начала ИМпST при сохранении симптомов, определение и доказательная база которой рассматривались выше в соответствующих разделах (табл. 1). Дополнительно хотелось бы повторить, что эта стратегия имеет абсолютные показания для использования при наличии симптомов, подозрительных в отношении ишемии миокарда, гемодинамической нестабильности или при наличии угрожающих жизни аритмий сердца, хотя уровень достоверности данных рекомендаций основан на мнении экспертов [1, 7].
ЧКВ после 48 ч от начала ИМпST у бессимптомных больных с окклюзированной ИСА при объективизации жизнеспособного/ишемизированного миокарда
Современные регламентирующие документы не рекомендуют рутинно выполнять реканализацию окклюзированной ИСА у бессимптомных больных при сроке от начала ИМпST >48 ч [1, 2, 7]. В качестве доказательной базы этого утверждения приводятся данные рандомизированного исследования OAT [35, 36] и метаанализа Ioannidis JP, et al., 2007 [37], которые показали отсутствие пользы рутинной ЧКВ окклюзированной ИСА по сравнению с медикаментозной терапией для снижения риска смерти, реинфаркта, СН. Приведенные аргументы признаны рабочей группой рекомендаций достаточно убедительными, чтобы дать им самый высокий статус достоверности — А. Дальнейшая лечебная стратегия ведения стабильных больных с окклюзией коронарных артерий, выявленной в срок >48 ч от начала ИМпST, предусматривает подход с определением показаний к реканализации на основании оценки объема жизнеспособного миокарда, как это закреплено в рекомендациях по ведению пациентов со стабильной ишемической болезнью сердца [38]. Сроки выполнения данной стратегии не определены, некоторые центры выполняют ее в течение индексной госпитализации, но в большинстве случаев центры переносят практическую реализацию этого подхода на отдельную отсроченную госпитализацию.
В заключение разбора этой отдельной группы пациентов с поздним ЧКВ при ИМпST (бессимптомных, госпитализированных после 48 ч от начала заболевания, с зарегистрированной окклюзией ИСА, имеющих объективные доказательства жизнеспособного/ишемизированного миокарда) необходимо сказать, что, конечно, их эффективность уступает пЧКВ, но данные вмешательства могут выполняться и выполняются, а отсутствие доказательств пользы такого вида эндоваскулярных операций открывает дополнительные возможности для реализации амбиций интервенционных кардиологов на ниве научной деятельности.
ЧКВ после 48 ч от начала ИМпST у бессимптомных больных со стенозированной ИСА
Выполнение позднего ЧКВ при ИМпST у бессимптомных пациентов со стенозированной ИСА не рассматривается в современных рекомендациях в качестве отдельной лечебной опции [1, 2, 7]. Тем не менее такие пациенты встречаются в практической работе. Несмотря на отсутствие рекомендаций и доказательной базы, рутинно стентирование стенозированных инфаркт-связанных сегментов ИСА выполняется в большинстве инфарктных центров. В данной ситуации можно пытаться объективизировать значимость стеноза ИСА, но в условиях острого тромботического процесса это вероятнее всего сопряжено с риском реокклюзии в течение периода времени получения дополнительных доказательств ишемии. В связи с этим большинство практических врачей предпочитают устранять стеноз ИСА. Протоколы ведения больных ИМпST должны предусматривать рутинное стентирование ИСА у бессимптомных больных при госпитализации после 48 ч в случае стенозированной ИСА.
ЧКВ после ТЛТ
Спасительное ЧКВ
Спасительное ЧКВ тестировалось в исследовании REACT, 2005 [39]. Пациентов после неуспешного тромболизиса1 разделили на 3 группы: 1) группу экстренного (спасительного) ЧКВ (n=144), группу повторного ТЛТ (n=142) и группу консервативной терапии (n=144). Результаты лечения сопоставлялись между группами по числу случаев комбинированной конечной точки. Комбинированная конечная точка объединяла число случаев смерти, реинфаркта, инсульта и тяжелой СН. Число выживших без неблагоприятных исходов к 6 мес. наблюдения составило 84,6% в группе спасительного ЧКВ, 70,1% в группе консервативного лечения и 68,7% в группе повторной ТЛТ (Р=0,004). Авторы заключили, что в группе больных ИМпST после неуспешной ТЛТ спасительное ЧКВ значимо улучшает результаты в сравнении с консервативным лечением или при повторном использовании тромболитика.
Результаты REACT [39] в совокупности с данными анализа, выполненного в исследовании STREAM [17], являются основанием для абсолютных показаний применения спасительного ЧКВ в качестве лечебной стратегии у больных ИМпST с неуспешным восстановлением коронарного кровотока после применения тромболитических средств [1, 2, 7]. Уровень достоверности этих рекомендаций наивысший — А.
ЧКВ, выполненное в рамках рутинной ранней стратегии
Несколько рандомизированных исследований показали, что рутинная ранняя стратегия ЧКВ2 снижает риск рецидива ИМ, суммарный риск рецидива ИМ и смерти, а также риск повторной ишемии миокарда [40-42]. Эти исследования тестировали наиболее выгодную тактику ведения пациента после ТЛТ. Сравнивались рутинное раннее ЧКВ и спасительное ЧКВ/ишемия-обусловленное ЧКВ/неинвазивное лечение.
В CARESS-in-AMI [41] после ТЛТ больных рандомизировали к рутинной ранней ЧКВ (n=299) и в группу, где ЧКВ выполнялось как спасительное лечение или при рецидиве ишемии (n=255). Результаты оценивались к 30 дню наблюдения в виде объединенного числа неблагоприятных исходов (смерть, реинфаркт, рецидив ишемии). К концу срока наблюдения ЧКВ было выполнено 85,6% больным в рамках рутинной ранней стратегии и у 30,3% пациентов, где стентирование выполнялось как спасительное/ишемия-обусловленное ЧКВ, при этом результаты достоверно лучше были в группе рутинной ранней ЧКВ. Число случаев комбинированной конечной точки было 4,4% vs 10,7%, Р=0,004, соответственно. В TRANSFER-AMI [40] и NORDISTEMI [42] при использовании комбинированной конечной точки в подобных рандомизировано сформированных группах пациентов также были получены достоверно лучшие результаты в пользу рутинной ранней ЧКВ (к 30 дню наблюдения число смерть, реинфаркт, рецидив ишемии в TRANSFER-AMI — 11% vs 17,2%, Р=0,004; к 12 мес. наблюдения число смерть, инсульт, ишемия в NORDISTEMI — 6% vs 16%, Р=0,01, соответственно). Таким образом, было доказано преимущество рутинной ранней ЧКВ стратегии, т.е. ТЛТ с последующим рутинным ЧКВ в ближайшие сроки (в фармакоинвазивных группах среднее время между ТЛТ и ЧКВ составило в CARESS-in-AMI — 125 мин, в NORDISTEMI — 162 мин, в TRANSFER-AMI — 168 мин).
Таким образом, в настоящее время мы имеем обоснование для фармакоинвазивного подхода: ЧКВ в ближайшие сроки (2-3 ч) после ТЛТ выполненного тенектеплазой. Стандартная выжидательная тактика с проведением ЧКВ в качестве спасительного или обусловленного ишемией подхода после ТЛТ не оправдана. В настоящее время стратегия раннего рутинного ЧКВ после успешной ТЛТ имеет абсолютные показания при наивысшем уровне достоверности — А.
Заключение
Стандартом реперфузионной терапии при ИМпST является механическая реканализация ИСА при помощи эндоваскулярных технологий — ЧКВ. Время от начала заболевания, сохраняющиеся симптомы (ишемии, СН, тяжелых аритмий) и предшествующее использование ТЛТ определяют применение различных видов ЧКВ при ИМпST. Принципиально выделяют три вида ЧКВ, используемых у больных ИМпST: пЧКВ, позднее ЧКВ (после 48 ч от начала заболевания) и ЧКВ после ТЛТ. Различные виды ЧКВ при ИМпST имеют не одинаковую пользу. Современные рекомендации обосновывают абсолютные показания для стентирования с наивысшим уровнем достоверности для пЧКВ в течение 12 ч, спасительным ЧКВ и рутинно ранним ЧКВ после ТЛТ. При этом приоритетная роль в реперфузии при ИМпST закреплена за пЧКВ в течение 12 ч. Именно поэтому данный показатель является целевым в рамках европейской инициативы SFL — национальный/региональный показатель пЧКВ в течение 12 ч должен быть 70% и выше от числа больных, госпитализированных с ИМпST.
Для организации доступности пЧКВ принципиально использовать определение, в котором этот метод реперфузии ограничен 12 ч от начала симптомов ИМпST. Именно в этот промежуток времени пЧКВ показывает свое преимущество перед ФИС при задержке <120 мин. После 12 ч ТЛТ и ФИС не используются в качестве стратегии реперфузии, а пЧКВ после 12 ч по эффективности значимо уступает пЧКВ до 12 ч [43]. Поэтому не так принципиально, хотя и важно стремиться к выполнению требования "интервал времени ПМК-баллон <120 мин" при пЧКВ, выполненной после 12 ч от момента заболевания. Именно так происходит в реальной жизни, когда больного с поздним обращением, перенесшего острейшую фазу ИМ, часто доставляют в ЧКВ-центр с задержкой по времени. Соответственно, если при анализе реперфузии на национальном/региональном уровне объединять всех больных со стратегией пЧКВ, выполненной до и после 12 ч, в одну группу, мы не только будем иметь неверное представление о доступности пЧКВ, но также получим неприемлемые цифры задержки пЧКВ, за счет увеличения интервала "ПМК-баллон" в группе пЧКВ после 12 ч от начала симптомов. Таким образом, время "ПМК-баллон" в общей группе пЧКВ неверно отражает показатель нашего действительного запроса на этот параметр.
1 Неуспешный тромболизис определялся как: отсутствие динамики электрокардиограммы (через 60-90 мин от начала внутривенного введения тромболитика нет снижения подъема сегмента ST <50% от исходного подъема ST) или рецидив болевого синдрома и подъема сегмента ST после введения тромболитического средства.
2 Рутинная ранняя стратегия ЧКВ — рутинная коронарография и ЧКВ (при необходимости) в течении 2-24 ч после эффективной ТЛТ (через 60-90 мин от начала внутривенного введения тромболитика снижение подъема сегмента ST на 50% и более от исходного подъема ST; типичная реперфузионная аритмия; купирование болевого синдрома).
Практические и методологические аспекты организации регистра для оценки качества медицинской помощи пациентам с хронической сердечной недостаточностью. Систематический обзор
Ключевые моменты
Что известно о предмете исследования?
- В клинических рекомендациях по хронической сердечной недостаточности представлены критерии качества медицинской помощи.
- Опубликованные результаты регистров дают усредненное представление о качестве медицинской помощи. Результаты отдельных центров могут значительно отличаться. При планировании улучшений в конкретной медицинской организации нужны более точные данные о существующих недостатках.
Что добавляют результаты исследования?
- Представлены характеристики 27 многоцентровых отечественных и зарубежных регистров хронической сердечной недостаточности.
- Изложены ключевые требования к регистру хронической сердечной недостаточности, предназначенному для мониторинга выполнения клинических рекомендаций в повседневной практике.
Key messages
What is already known about the subject?
- The clinical guidelines for heart failure present the criteria for healthcare quality.
- The published registry results provide an average idea of the quality of health care. The results of individual centers may differ significantly. When planning improvements in a specific health facility, more accurate data on existing deficiencies is needed.
What might this study add?
- The characteristics of 27 multicenter Russian and foreign registries of heart failure are presented.
- The key requirements for a heart failure registry designed to monitor the implementation of clinical guidelines in everyday practice are outlined.
Хроническая сердечная недостаточность (ХСН) — одна из самых фатальных и ресурсоемких сердечно-сосудистых кардиологических патологий вследствие высокой частоты госпитализаций. В клинических рекомендациях по ХСН приведены мероприятия медицинской помощи с доказанной эффективностью, цели терапии и критерии качества оказания медицинской помощи [1]. Для непрерывного мониторинга медицинской помощи пациентам с сердечно-сосудистыми заболеваниями (ССЗ) в рамках Единой государственной системы в сфере здравоохранения и ее подсистемы — вертикальной интегрированной медицинской информационной системы ССЗ (ВИМИС ССЗ) организован регистр ССЗ, включающий пациентов с установленным диагнозом ХСН. В ВИМИС ССЗ передаются в виде структурированных электронных медицинских документов следующие данные о пациентах с ХСН: стадия ХСН, вид ХСН по фракции выброса (ФВ) левого желудочка (ЛЖ), функциональный класс ХСН, дата и время возникновения первых клинических симптомов, дата и время госпитализации, дата установки диагноза, дата и время осмотра врача-специалиста, дата и время оказания медицинских услуг и лекарственных назначений, тип документированного события, дата и время появления жалоб в случае вызова скорой медицинской помощи, дата и время вызова скорой медицинской помощи, результат прогностической шкалы "Шкала реабилитационной маршрутизации" для пациента с ХСН1. Однако в настоящее время регулярная передача данных в ВИМИС ССЗ налажена не во всех медицинских организациях. Вместе с тем объем передаваемой информации достаточен как минимум для оценки качества медикаментозной терапии. Пока оперативная обратная связь с медицинскими организациями по результатам передаваемых структурированных электронных медицинских документов не полностью реализована, существует потребность в организации регистров ХСН, которые дают более полную информацию о диагностике и лечении ХСН в реальной клинической практике.
Публикуемые результаты регистров освещают различные аспекты медицинской помощи, их сложно сравнить из-за особенностей формирования выборки (разные критерии включения и исключения) и оцениваемых показателей, что затрудняет сравнение и выявление лучших практик [2]. Для повышения роли регистров ХСН в улучшении качества медицинской помощи на уровне конкретной медицинской организации необходимо выработать универсальные требования к составу и формату требуемой информации. Для этого целесообразно опираться на имеющиеся руководства по созданию медицинских регистров, отвечающих требованиям доказательной медицины [3-5]. Основываясь на базовых требованиях к созданию регистра (отличающих его от базы данных), необходимо дополнить их спецификой, связанной с профилем ХСН, в частности, критериями качества медицинской помощи, а также учесть перспективу автоматизации формирования регистра на основе данных электронной медицинской карты.
Цель — определить ключевые требования к регистру ХСН, предназначенному для контроля выполнения клинических рекомендаций в повседневной практике.
Методология исследования
Проведен систематический обзор литературы по методологии PRISMA для выявления регистров, содержащих данные о пациентах с сердечной недостаточностью (СН). Использованы базы данных PubMed и eLibrary. Глубина поиска 2015-2025 гг. Отобрано 46 источников по данным 27 регистров. Отбор осуществлялся с использованием ключевых слов: "сердечная недостаточность", "острая сердечная недостаточность", "декомпенсированная сердечная недостаточность", "хроническая сердечная недостаточность", "регистр", "систематический обзор", "метаанализ" и их сочетаний, а также их англоязычный перевод: heart failure, acute heart failure, decompensated heart failure, chronic heart failure, congenital heart failure, registry, systematic review, meta-analysis, а также по спискам литературы найденных публикаций. Критерии включения статей: оригинальные исследования, в которых представлены результаты многоцентровых регистров, включавших пациентов с ХСН. Исключались повторяющиеся статьи, обзоры литературы и метаанализы, клинические случаи, интервенционные исследования, одноцентровые исследования, эпидемиологические исследования, авторские мнения. Методология отбора литературных источников представлена на рисунке 1.
Данные о регистрах, отобранных для анализа, суммированы в таблице, включающей следующие параметры: название регистра, количество пациентов, период проведения, характеристики и организация работы, применение утвержденных критериев для оценки качества медицинской помощи, а также наличие опубликованного отчета о качестве медицинской помощи, т.е. о соответствии медицинской помощи утвержденным критериям качества. Одной из характеристик было также соответствие основным критериям оценки качества регистра, изложенным в методических рекомендациях "Медицинские регистры. Роль в доказательной медицине. Рекомендации по созданию", 2023г [5]. Подробные результаты оценки качества регистров по данным критериям приведены в Приложении.
Результаты
Данные отобранных регистров СН представлены в таблице 1.
Литературный поиск выявил 46 публикаций, в которых представлены результаты 27 многоцентровых зарубежных и отечественных регистров (19 — зарубежных, 8 — отечественных), в которые включались пациенты с ХСН. Большинство регистров за рубежом были проведены в США и странах Европы [6-8][10][19-37]. Преимущественно это были национальные многоцентровые исследовательские проспективные регистры с участием стационаров, реже — стационаров и амбулаторных учреждений. Среди отечественных регистров есть как крупные общероссийские проекты (федеральный регистр ХСН, ПРИОРИТЕТ ХСН, РИФ-ХСН) [41-43, 47, 53, 54], так и более локальные (РЕКВАЗА, RUS-HFR, регистр "Хроническая сердечная недостаточность" Санкт-Петербурга, Единый регистр больных с ХСН Тюменской области) [46][48-52]. Оценки исходов представлены для 11 регистров из 27 (41%), хотя проспективное наблюдение предусматривалось в 22 регистрах (82%). Оценки частоты назначения лекарственных препаратов с доказанной эффективностью опубликованы для всех регистров. Отчеты в терминах утвержденных критериев качества медицинской помощи опубликованы лишь для 5 регистров — Get With The Guidelines (GWTG)-HF registry [7], регистра PINACCLE [8], Swedish Heart Failure Registry [29], Российского регистра ХСН [43], Регистр "Хроническая сердечная недостаточность" Санкт-Петербурга [50]. По опубликованным данным невозможно достоверно судить о том, имелась ли у медицинских учреждений возможность самостоятельной работы с результатами оценки качества.
Согласно оценке по критериям методических рекомендаций "Медицинские регистры. Роль в доказательной медицине. Рекомендации по созданию", 2023г, [5] 22 из 27 регистров соответствовали 5 и более критериям из 8 возможных (см. Приложение). Только ESC Heart Failure Long-Term Registry [21][22] соответствовал всем критериям. Также всем критериям потенциально соответствует отечественный регистр Приоритет ХСН [53][54], учитывая, что еще не доступны данные об отклике при отдаленном наблюдении, поскольку сбор данных завершился только в 2025г.
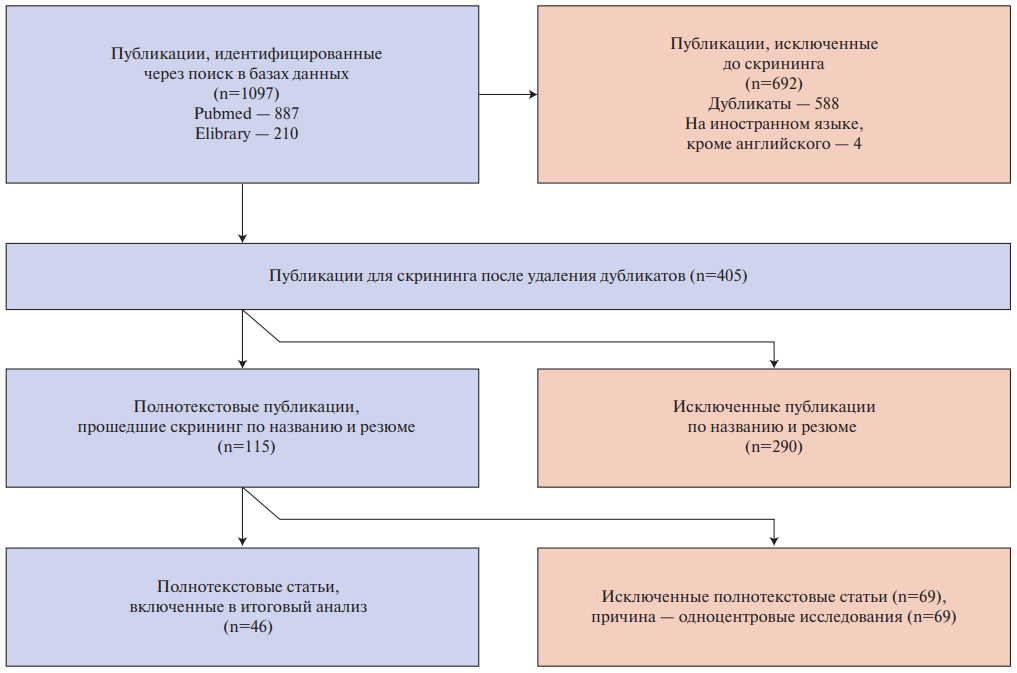
Рис. 1. Методология отбора литературных источников.
Таблица 1
Регистры СН и их характеристики
|
№ п/п |
Название регистра, страна, номер ссылки в списке источников |
Количество пациентов с ХСН (годы проведения) |
Характеристики, организация работы регистра |
Утвержденные критерии качества медицинской помощи, наличие опубликованного отчета о качестве медицинской помощи |
|
1 |
Get With The Guidelines (GWTG)-HF registry, США [6, 7] |
2005-н.вр. 66218 (2005-2007) 593053 (2017-2020) Всего ~3 млн |
Проспективный, госпитальный, национальный. Интегрирован с системой практического здравоохранения. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества имеются. Опубликованный отчет о качестве имеется [7] |
|
2 |
PINNACLE (NCDR), США [8] |
2009-н.вр. 212612 (2009-2012) |
Проспективный, амбулаторный, часть национального регистра сердечно-сосудистых заболеваний (National Cardiovascular Data Registry, NCDR) — интегрирован с системой практического здравоохранения. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества имеются. Отчет о качестве имеется [8] |
|
3 |
AMERICCAASS, страны Северной, Южной Америки и Карибского региона [9] |
Данные не представлены (2022-2025) |
Проспективный, стационары и амбулаторные учреждения, международный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
4 |
CHAMP-HF, США [10] |
4546 |
Проспективный, амбулаторный, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 4 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
5 |
CHART-2 (Chronic Heart Failure Analysis and Registry in the Tohoku District-2), Япония [11] |
4649 с манифестной ХСН, всего 10219 (2006-2010) |
Проспективный, госпитальный, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 6 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
6 |
Asian Sudden Cardiac Death Registry (ASIAN-HF), Страны Азии [12][13] |
6480 (2012-2015) |
Проспективный, госпитальный и амбулаторный, международный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 7 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
7 |
Heart Failure Registry of Patient Outcomes (HERO), Китай [14] |
5620 (2017-2018) |
Проспективный, госпитальный, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 7 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
8 |
China Cardiovascular Association Database — Heart Failure Registry, Китай [15] |
230637 (2017-2021) |
Проспективный, госпитальный, национальный, интегрирован с национальной системой мониторинга смертности — интегрирован с системой практического здравоохранения. Отдаленное наблюдение имеется. Соответствует 6 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Частично данные представлены в HF stats 2024 (эпидемиология и исходы СН в США [15]) |
|
9 |
Colombian Heart Failure Registry (RECOLFACA), Колумбия [16][17] |
2528 (2017-2019) |
Проспективный, стационары и амбулаторные учреждения, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Отчет о качестве отсутствует |
|
10 |
Trivandrum Heart Failure Registry, Индия [18] |
1205 (2013) |
Проспективный, госпитальный, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
11 |
Global Congestive Heart Failure Registry (G-CHF), страны Европы и Азии [19][20] |
23341 (2016-2020) |
Проспективный, стационары и амбулаторные учреждения, международный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
12 |
ESC Heart Failure Long-Term Registry, европейские страны [21][22] |
9138 (2011-2013) |
Проспективный, стационары и амбулаторные учреждения, международный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 8 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
13 |
ESC EORP Heart Failure III Registry, европейские и некоторые не европейские страны [23][24] |
10162 (2018-2020) |
Проспективный, стационары и амбулаторные учреждения, международный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 7 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
14 |
QUALIFY, европейские и некоторые не европейские страны [25][26] |
6669 (2013-2014) |
Проспективный, амбулаторный, международный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 7 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
15 |
Swedish Heart Failure Registry, Швеция [27-29] |
21888 (2006-2013) 43704 (2013-2018). Внедрен в 2003г |
Ретроспективный, стационары и амбулаторные учреждения, национальный, интегрирован с национальной системой мониторинга смертности, обращений за медицинской помощью и лекарственных назначений — интегрирован с системой практического здравоохранения. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества имеются (оценка качества помощи при ХСН с помощью показателей качества Европейского общества кардиологов [30]). Отчет о качестве имеется [29] |
|
16 |
Norwegian Heart Failure Registry, Норвегия [31] |
186297 (2008-2018) |
Ретроспективный, стационары и амбулаторные учреждения, на основе постоянно действующего национального регистра пациентов — интегрирован с системой практического здравоохранения. Соответствует 6 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
17 |
RICA, RICA-2, Испания [32-34] |
4752 (RICA, 2008-2018) 1000 (RICA-2, 2024) |
Проспективный, госпитальный, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 4 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
18 |
HELP-HF, Италия [35][36] |
1149 (2020-2021) |
Ретроспективный, госпитальный, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
19 |
Czech National Registry of Reimbursed Health Services, Чехия [37] |
285745 (2010-2018) |
Ретроспективный, стационары и амбулаторные учреждения, на основе общенационального регистра оплаченных медицинских услуг — интегрирован с системой практического здравоохранения. Соответствует 4 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
20 |
RUssian hoSpital Heart Failure Registry (RUS-HFR), Россия [38] |
254 (2012-2014) |
Проспективный, госпитальный, региональный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
21 |
ОРАКУЛ-РФ, Россия [39][40] |
2450 |
Проспективный, госпитальный, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
22 |
Российский регистр ХСН, Россия [41-43] |
35296 (2013-2020) |
Ретроспективный и проспективный, амбулаторные учреждения и стационары, национальный. Постоянный доступ для зарегистрированных пользователей через веб-браузер. Автоматизированный анализ вводимых данных в режиме реального времени. Исследовательский. Отдаленное наблюдение отсутствует. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества имеются (оценка качества помощи при ХСН с помощью специально разработанной на основе клинических рекомендаций системы индикаторов качества [44, 45]) Опубликованный отчет о качестве имеется [43] |
|
23 |
РЕКВАЗА, Россия [46] |
2726 (2012-2013) |
Проспективный, амбулаторный, региональный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
24 |
РИФ-ХСН, Россия [47] |
1003 (2015-2016) |
Проспективный, амбулаторные учреждения и стационары. Исследовательский. Отдаленное наблюдение имеется. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
|
25 |
Единый регистр больных с ХСН Тюменской области, Россия [48][49] |
7303 (2022-н.вр.) |
Проспективный, стационары и амбулаторные учреждения, региональный. Реализован на базе региональной медицинской информационной системы — интегрирован с системой практического здравоохранения. Соответствует 3 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует. Отдельные результаты доступны зарегистрированным пользователям на базе региональной медицинской информационной системы |
|
26 |
Регистр "Хроническая сердечная недостаточность" Санкт-Петербурга, Россия [50-52] |
73450 |
Ретроспективный, стационары и амбулаторные учреждения, городской. Реализован на базе региональной медицинской информационной системы — интегрирован с системой практического здравоохранения. Соответствует 5 из 8 критериев качества регистра |
Утвержденные критерии качества имеются (оценка по критериям качества медицинской помощи, перечисленным в клинических рекомендациях Минздрава России "Хроническая сердечная недостаточность", 2020г [1]. Опубликованный отчет о качестве имеется [50] |
|
27 |
ПРИОРИТЕТ-ХСН, Россия [53][54] |
6255 (включение 2023-2024, запланировано 20000 пациентов) |
Проспективный, амбулаторный, национальный. Исследовательский. Отдаленное наблюдение имеется. Соответствует 7 из 8 критериев качества регистра |
Утвержденные критерии качества отсутствуют. Опубликованный отчет о качестве отсутствует |
Обсуждение
На основе полученной информации представляется возможным определить требования, в т.ч. критерии качества для регистра ХСН, который предназначен для контроля выполнения клинических рекомендаций в повседневной практике. Значительная часть опубликованной информации касается регистров, специально организованных с исследовательской целью, ограниченных во времени, призванных полноценно описать все ключевые аспекты клиники, диагностики и лечения ХСН. В связи с этим объем регистрируемой информации был значительным, а возможности автоматизации процесса ограниченными. Лишь в 8 регистрах указано, что часть информации получена из административных систем или медицинской информационной системы [7, 8, 15, 29, 31, 37, 48, 50]. Опубликованные данные охватывают различные аспекты оказания медицинской помощи пациентам с ХСН с целью выявления новых результатов, при этом возможности сравнения данных различных регистров ограничены, о чем говорят ранее полученные данные [2]. Научная составляющая регистров превалирует над практической применимостью в повседневной практике. Полученные данные, безусловно, необходимы для принятия управленческих решений глобального уровня и стратегического характера. Однако, чтобы отследить их реализацию на местах, обеспечить полноценное внедрение принятых решений по улучшению качества медицинской помощи, каждая медицинская организация должна иметь инструмент для оценки собственной практики (так называемый implementation registry). Такая обратная связь позволит сравнить результаты работы организаций между собой, выделить лучшие практики, изучить их и адаптировать наиболее успешные решения для повсеместного применения. По данным Звартау Н. Э. и др. [55], в 70% регионов Российской Федерации, курируемых НМИЦ Алмазова, ведутся регистры ХСН, однако подробности их организации и результаты не представлены в открытом доступе. Как правило, в регистрах принимают участие передовые центры, в то время как большинство медицинских организаций не имеет возможности адекватно позиционировать свои результаты относительно других. Разрабатываемая в последние годы ВИМИС ССЗ на базе ЕГИСЗ, включающая нозологические регистры, может обеспечить получение достоверной, оперативной и полноценной информации о качестве медицинской помощи пациентам с ХСН. Такой вид регистра является постоянно действующим, необходимо лишь обеспечить медицинские организации возможностью в любой момент оценивать свои результаты. Эффективной опцией было бы добавление сравнения результатов учреждения с другими. При этом важно тщательно проработать единый аналитический аппарат, обеспечить его доступность для каждой медицинской организации, проверить связь оценок с исходами. При этом важно перенести фокус внимания с оценки процесса лечения на достижение запланированных клинических результатов. Обращает на себя внимание, что в критериях качества медицинской помощи, указанных в клинических рекомендациях по ХСН, отсутствуют оценки клинического статуса, которые могли бы рассматриваться как результат проводимой терапии. Перечень клинических данных, содержащихся в постоянно действующем регистре ХСН, должен основываться на организации аналитического аппарата. Таким образом, будет сведен к минимуму объем требуемой информации. Следовательно, основой совершенствования качества медицинской помощи пациентам с ХСН становятся не только разовые масштабные регистры как научно-исследовательские проекты, в задачи которых входит сбор полной информации о пациентах с ХСН и описание ситуации в целом, а наиболее простые, постоянно действующие, доступные на местах аналитические модули типового регистра на базе МИС. По данным проведенного обзора регистры, интегрированные с системой практического здравоохранения, соответствовали меньшему числу критериев, указанных в методических рекомендациях по организации регистров [5] — от 3 до 6 баллов, тогда как оценки регистров, созданных только с исследовательской целью, составили от 5 до 8 баллов. Вместе с тем регистры, интегрированные с системой здравоохранения, обеспечивали оценку качества медицинской помощи, т.е. выполнение мероприятий медицинской помощи с доказанным влиянием на клинический результат у всех пациентов, которым они показаны. Таким образом, выявлялись конкретные мероприятия, подлежащие совершенствованию у конкретной категории пациентов, что облегчало разработку решений по улучшению. Исходя из того, что в любой части генеральной совокупности медицинская помощь должна быть одинакового качества, базовым требованием к практическому регистру является оценка соответствия данных утвержденным критериям качества медицинской помощи больным с ХСН (отечественным, изложенным в клинических рекомендациях — в обязательном порядке и по желанию международным). Следовательно, изучение качества медицинской помощи отличается от классических наблюдательных исследований и требует соответствующей методологии, что должно отражаться в регистрах, предназначенных для оценки качества.
Минимально достаточный объеме данных регистра определяется объемом информации, необходимой для оценки критериев качества. Если использовать в качестве примера систему оценок для контроля лечения и результата медицинской помощи пациентам с ХСН, предложенных Посненковой О. М. и др. [56], для динамической оценки и внедрения лучших практик, то минимальный состав базы данных регистра можно определить следующим образом. Авторы указывают, что в реальной клинической практике при ХСН целесообразно оценивать: 1) долю пациентов с ХСН с низкой ФВ, кому назначена квадротерапия (ингибиторы ангиотензинпревращающего фермента/блокаторы рецепторов к ангиотензину/сакубитрил+валсартан + бета-блокаторы + антагонисты рецепторов к альдостерону + ингибиторы натрий-глюкозного котранспортера 2 типа); 2) долю пациентов с ХСН с сохраненной ФВ и ХСН с умеренно низкой ФВ, кому назначены ингибиторы натрий-глюкозного котранспортера 2 типа; 3) долю пациентов с ХСН с отсутствием нежелательных событий (госпитализаций по поводу ХСН и смерти) в течение последних 12 мес. Перечень данных регистра и требования к ним формируются, исходя из алгоритма вычисления показателя. Так, для определения доли пациентов с ХСН с низкой ФВ, получающих квадритерапию, необходимо вычислить отношение абсолютного количества пациентов с ХСН с низкой ФВ, которым назначены одновременно ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов к ангиотензину или сакубитрил+валсартан, бета-блокаторы, антагонисты рецепторов к альдостерону, ингибиторы натрий-глюкозного котранспортера 2 типа, при этом отсутствуют данные о наличии противопоказаний к каким-либо из этих классов препаратов, к абсолютному количеству пациентов с ХСН с низкой ФВ. Идентификация целевой группы пациентов для данного показателя проводится на основе одного параметра: ФВ ЛЖ <40% по данным эхокардиографии давностью не более 12 мес. Следовательно, для вычисления рассмотренного показателя требуются следующие данные: дата выполнения эхокардиографии, значение ФВ ЛЖ (%), дата и факт назначения ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов к ангиотензину, сакубитрила+валсартана, бета-блокаторов, антагонистов рецепторов к альдостерону, ингибиторов натрий-глюкозного котранспортера 2 типа, дата и факт наличия противопоказаний к указанным классам препаратов. Подобная логика применена при разработке базы данных регистра ХСН, предложенного Богдановой Т. М.2. При этом в качестве основы для разработки базы данных регистра использовались критерии качества медицинской помощи, перечисленные в клинических рекомендациях по ХСН 2024г [1], критерии качества медицинской помощи пациентам с ХСН Европейского общества кардиологов 2023г [30] и критерии качества медицинской помощи больным с ХСН, содержащиеся в приказе № 241н от 2017г.
Представляется, что ведение регистра ХСН, предназначенного для оценки качества, на уровне региона целесообразно организовать на базе медицинского информационно-аналитического центра с участием независимой команды аналитиков, например, регио- нального медицинского вуза и/или курирующего научно-медицинского исследовательского центра [50-52]. Данные регистра по основным критериям качества медицинской помощи, перечисленным в клинических рекомендациях, а также исходам пациентов (возможно, на первоначальном этапе в сокращенном и переработанном виде) целесообразно публиковать в открытых источниках в виде ежегодного отчета о качестве с указанием обобщенных данных по всем медицинским организациям на анализируемой территории, оказывающим медицинскую помощи пациентам с ХСН, с формированием периодического общероссийского отчета на уровне научного медицинского исследовательского центра.
Ограничения исследования. В проведенный систематический обзор литературы не включались результаты одноцентровых регистров ХСН, т.к., по мнению авторов, при проведении крупных многоцентровых, особенно международных регистров вопросы методологии прорабатываются более детально, осуществляется контроль качества получаемой информации, за счет участия нескольких центров повышается охват пациентов. Безусловно, крупный, качественно организованный и проведенный одноцентровый регистр может дать достоверную оценку качества медицинской помощи в данном центре, однако в ходе анализа литературы было выявлено, что опубликованные результаты одноцентровых исследований в большинстве своем не соответствуют требованиям к регистру как к источнику данных о реальной клинической практике. Одноцентровые регистры демонстрировали как правило малый размер группы, значительное сходство с когортными наблюдательными исследованиями, невозможность оценить последовательность включения пациентов, отсутствие внешнего контроля за ведением регистра.
Авторы осуществляли оценку отобранных регистров с применением отечественных критериев качества регистра, предложенных в 2023г [5], тогда как большинство регистров были проведены ранее. Однако первые зарубежные методические руководства по организации регистров существовали еще в 2007г3 и с течением времени основополагающие принципы не изменились.
Заключение
Выявлены единичные регистры ХСН, организация которых соответствует целям совершенствования качества медицинской помощи в повседневной клинической практике. Большинство многоцентровых регистров созданы с исследовательской целью и не оценивают качество медицинской помощи в терминах утвержденных критериев качества. Регистр ХСН для оценки качества (implementation registry), как и любой регистр, должен соответствовать требованиям доказательной медицины. Данные требования отражены в соответствующих руководствах по созданию регистров. Соблюдение этих требований обеспечит достоверность получаемой информации и сравнимость результатов в условиях реальной клинической практики. Однако имеющуюся методологию необходимо адаптировать для организации регистров, интегрированных с системой практического здравоохранения и направленных на мониторинг выполнения клинических рекомендаций. Регистр, предназначенный для рутинного мониторинга выполнения клинических рекомендаций, должен быть: 1) постоянно действующим; 2) доступным пользователям в режиме реального времени; 3) результаты представлены в терминах утвержденных критериев качества; 4) достигнутые результаты сравниваются с должным уровнем исполнения клинических рекомендаций, определенным на основе лучших практик; 5) организационная структура регистра и алгоритмы вычисления показателей универсальные и общедоступные; 6) организационная структура регистра и алгоритмы вычисления показателей основаны на критериях качества медицинской помощи, представленных в клинических рекомендациях, но данные критерии адаптированы (отобраны и детализированы) для целей ведения регистра. Применение технологий автоматизированного сбора информации позволит снизить нагрузку на персонал и сократит время для получения необходимых данных.
1 Информационный портал ВИМИС "Сердечно-сосудистые заболевания" https://vimis.almazovcentre.ru/pustayastranitsa_rarc/#b2309.
2 Богданова Т. М. База данных первичного ретроспективного анализа амбулаторных карт пациентов с хронической сердечной недостаточностью. Свидетельство о регистрации базы данных RU 2024624744, 30.10.2024. Заявка от 21.10.2024.
3 Gliklich R. E., Dreyer N. A., eds. Registries for Evaluating Patients Outcomes: A User’s Guide. Rockville, MD: Agency for Healthcare Research and Quality; April 2007.
Приложение
Соответствие регистров ХСН основным критериям качества, изложенным в методических рекомендациях «Медицинские регистры. Роль в доказательной медицине. Рекомендации по созданию», 2023г [5]
|
№ п/п |
Название регистра, страна, номер ссылки в списке источников |
Четкая формулировка цели исследования, критериев включения и невключения больных |
Соответствие дизайна исследования поставленным целям и задачам |
Рандомизированный отбор центров-участников исследования (для многоцентровых регистров) |
Соблюдение принципов последовательности включения больных |
Четкое обозначение даты начала и окончания включения больных |
Упоминание о полноте отклика больных при отдаленном наблюдении (не <85%), а также о частоте пропущенных данных и способах их замещения |
Аудит хотя бы части набранного материала |
Применение адекватных методов статистического анализа |
|
1 |
Get With The Guidelines (GWTG)-HF registry, США [6][7] |
+ |
+ |
Нет, участие добровольное |
Не указано |
+ |
Не указано |
+ |
+ |
|
2 |
PINNACLE (NCDR), США [8] |
+ |
+ |
Нет, участие добровольное |
Не указано |
+ |
Не указано |
+ |
+ |
|
3 |
AMERICCAASS, страны Северной, Южной Америки и Карибского региона [9] |
+ |
+ |
Нет, участие добровольное |
Не указано |
+ |
Не указано |
+ |
+ |
|
4 |
CHAMP-HF, США [10] |
+ |
+ |
Нет, участие добровольное |
Не указано |
+ |
Не указано |
Не указано |
+ |
|
5 |
CHART-2 (Chronic Heart Failure Analysis and Registry in the Tohoku District-2), Япония [11] |
+ |
+ |
Нет, участие добровольное |
+ |
+ |
Не указано |
+ |
+ |
|
6 |
Asian Sudden Cardiac Death Registry (ASIAN-HF), Страны Азии [12][13] |
+ |
+ |
+ |
+ |
+ |
Не указано |
+ |
+ |
|
7 |
Heart Failure Registry of Patient Outcomes (HERO), Китай [14] |
+ |
+ |
+ |
+ |
+ (дополнительно для каждого центра генерировался случайным образом свой период включения пациентов) |
Отклик 92%, частота пропусков данных и способы их замещения не указаны |
+ |
+ |
|
8 |
China Cardiovascular Association Database – Heart Failure Registry, Китай [15] |
+ |
+ |
Нет, участие добровольное |
+ |
+ |
Не указано |
+ |
+ |
|
9 |
Colombian Heart Failure Registry (RECOLFACA), Колумбия [16][17] |
+ |
+ |
Нет, часть центров участвовала добровольно |
Не указано |
+ |
Не указана полнота отклика |
+ |
+ |
|
10 |
Trivandrum Heart Failure Registry, Индия [18] |
+ |
+ |
Не применимо (участвовали все стационары) |
+ |
+ |
Отклик 96%, частота пропусков данных и способы их замещения не указаны |
Не указано |
+ |
|
11 |
Global Congestive Heart Failure Registry (G-CHF), страны Европы и Азии [19][20] |
+ |
+ |
+ |
Не указано |
+ |
± (не указана частота отклика при отдаленном наблюдении, наблюдение продолжается) |
Не указано |
+ |
|
12 |
ESC Heart Failure Long-Term Registry, европейские страны [21][22] |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
13 |
ESC EORP Heart Failure III Registry, европейские и некоторые не европейские страны [23][24] |
+ |
+ |
+ |
Не указано |
+ |
+ |
+ |
+ |
|
14 |
QUALIFY, европейские и некоторые не европейские страны [25][26] |
+ |
+ |
+ |
Не указано |
+ |
+ (отклик 94%) |
+ |
+ |
|
15 |
Swedish Heart Failure Registry, Швеция [27-29] |
+ |
+ |
Нет (участвуют 70 из 80 стационаров и 100 из 1000 амбулаторных учреждений) |
+ |
+ |
Нет |
Не указано |
+ |
|
16 |
Norwegian Heart Failure Registry, Норвегия [31] |
+ |
+ |
Не применимо (участвуют все учреждения) |
Не применимо (включаются все пациенты) |
+ |
Не применимо (ретроспективный анализ) |
Не применимо (ретроспективный анализ) |
+ |
|
17 |
RICA, RICA-2, Испания [32-34] |
+ |
+ |
Не указано |
Не указано |
+ |
Не указано |
Не указано |
+ |
|
18 |
HELP-HF, Италия [35, 36] |
+ |
+ |
Нет |
+ |
+ |
Не применимо (ретроспективный анализ) |
Не применимо (ретроспективный анализ) |
+ |
|
19 |
Czech National Registry of Reimbursed Health Services, Чехия [37] |
+ |
+ |
Не применимо (участвуют все учреждения) |
Не применимо (включаются все пациенты) |
+ |
Не применимо (ретроспективный анализ) |
Не применимо (ретроспективный анализ) |
+ |
|
20 |
RUssian hoSpital Heart Failure Registry (RUS-HFR), Россия [38] |
+ |
+ |
Нет |
Не указано |
+ |
+ |
Не указано |
+ |
|
21 |
ОРАКУЛ-РФ, Россия [39][40] |
+ |
+ |
Нет, участие добровольное |
Не указано |
+ |
+ |
Не указано |
+ |
|
22 |
Российский регистр ХСН, Россия [41-43]. |
+ |
+ |
Нет, участие добровольное |
+ |
+ |
Не применимо (отдаленное наблюдение не проводилось) |
Не указано |
+ |
|
23 |
РЕКВАЗА, Россия [46] |
+ |
+ |
Нет |
Не указано |
+ |
+ |
Не указано |
+ |
|
24 |
РИФ-ХСН, Россия [47] |
+ |
+ |
Не указано |
+ |
+ |
Не указано |
Не указано |
+ |
|
25 |
Единый регистр больных с ХСН Тюменской области, Россия [48][49] |
– |
Не применимо |
Не применимо. Участвуют все учреждения в рамках трехуровневой системы оказания медицинской помощи пациентам с ХСН |
+ (сплошное включение всех пациентов) |
+ |
Не применимо (отдаленное наблюдение не проводилось) |
Не указано |
+ |
|
26 |
Регистр "Хроническая сердечная недостаточность" Санкт-Петербурга, Россия [50-52] |
+ |
+ |
Не применимо. Участвуют все учреждения |
+ (сплошное включение всех пациентов) |
+ |
Не применимо (отдаленное наблюдение не проводилось) |
Не указано |
+ |
|
27 |
ПРИОРИТЕТ-ХСН, Россия [53][54] |
+ |
+ |
+ |
+ |
+ |
± (не указана частота отклика при отдаленном наблюдении, наблюдение продолжается) |
+ |
+ |
Новый взгляд на процессы фиброза миокарда: "холодный" и "горячий" фенотипы. Особенности патогенеза и потенциальные терапевтические стратегии
Ключевые моменты
- На основании анализа животных моделей выдвинута гипотеза о существовании разных типов фиброза — "горячего" и "холодного".
- "Горячий" фенотип характерен для ситуаций с хроническим воздействием повреждающего фактора — артериальной гипертензии, хронической ишемической болезни сердца и т.п.
- "Холодный" фиброз развивается после однократного воздействия интенсивного повреждающего фактора (например, при инфаркте миокарда) и представлен почти исключительно миофибробластами при минимальном участии иммунных клеток.
Key messages
- Based on the analysis of animal models, a hypothesis has been put forward on different types of fibrosis — hot and cold.
- The hot phenotype is characteristic of chronic exposure to a damaging factor — hypertension, chronic coronary artery disease, etc.
- Cold fibrosis develops after a single exposure to an intense damaging factor (for example, in myocardial infarction) and is represented almost exclusively by myofibroblasts with minimal participation of immune cells.
Несмотря на значительный прогресс в понимании молекулярных механизмов фиброза, до настоящего времени разработка подходов к профилактике фибротических процессов в органах и тканях, а также их обратному развитию, остается одной из актуальных проблем медицины и биологии в целом.
Фиброз — это типовой патологический процесс, характеризующийся чрезмерным накоплением компонентов внеклеточного матрикса в ответ на стимулы, связанные с травмами и хроническим воспалением в ходе метаболических, сосудистых и аутоиммунных заболеваний [1]. При нормальных условиях гомеостаз внеклеточного матрикса регулируется за счет поддержания баланса между интенсивностью фиброгенеза и фибролиза, т.е. процессов образования и разрушения фибриллярных структур, которые обеспечивают структурную поддержку и многочисленные биологические функции тканей.
В последние несколько лет появились публикации зарубежных авторов о выделении особых типов фиброза — "холодного" и "горячего" [1][2], русскоязычные работы по данной проблеме в поисковых системах eLibrary и Cyberleninka отсутствуют. Таким образом, целью данной работы явилось освещение современных представлений о процессах фиброза, протекающих в различных органах и тканях при различных нозологических формах.
Методология исследования
В работе (несистематический обзор литературы) были использованы основные данные и выводы из отечественных и иностранных источников, посвященных вопросам патогенеза, морфологическим и метаболическим особенностям фиброза как типового патологического процесса, в т.ч. фиброза миокарда как морфофункциональной основы хронической сердечной недостаточности (ХСН). Поиск литературных данных проводился на русском и английском языках в системах индексирования научных публикаций PubMed, Google Scholar, Web of Science, E-library, Cyberleninka. Поиск проводили по заголовкам и ключевым словам. В качестве поисковых запросов использовались следующие слова и словосочетания: "фиброз миокарда", "миофибробласты", "холодный и горячий фиброз", "ремоделирование интерстициального матрикса", "хроническая сердечная недостаточность", "myocardial fibrosis", "myofibroblasts", "cold and hot fibrosis", "interstitial matrix remodeling", "chronic heart failure". Поиск проводили по заголовкам и ключевым словам. Глубина поиска составила 10 лет, за исключением более ранних фундаментальных работ, посвященных изучению морфологических основ фиброза. Всего отобрано 39 публикаций.
Результаты
Понятие фиброза. Гистологические типы фиброза
Фиброзные изменения могут развиваться в различных органах (миокарде, почках, печени, легких), приводя к изменению нормальной структуры органа и закономерному нарушению его функционирования, вплоть до прогрессирующей органной недостаточности [2-4]. Фиброз миокарда развивается при различных формах сердечно-сосудистой патологии, таких как инфаркт миокарда (ИМ) и постинфарктный крупноочаговый кардиосклероз, хронические формы ишемической болезни сердца, гипертоническая болезнь и ХСН [5][6].
Многочисленные опыты и наблюдения показали, что миокардиофиброз является неизбежным исходом воздействия различных повреждающих факторов лишь у взрослых млекопитающих. Он отсутствует у новорожденных мышей и свиней из-за регенеративного потенциала молодого сердца [7-9]. В настоящее время вопросы профилактики и регресса фиброза представляют собой актуальную медицинскую проблему, т.к., среди прочего, процессы фиброза представляют собой морфологический субстрат возраст-ассоциированных состояний, сопровождающих процессы как естественного, так и раннего старения [3-5]. Поэтому стратегии, позволяющие уменьшить выраженность фибротических процессов, могут рассматриваться как средства борьбы со старением [10].
В течение нескольких столетий фиброз миокарда изучался преимущественно на основе морфологических исследований [6]. В норме гистологически миокард представлен тремя основными структурными компонентами, находящимися в тесных анатомических и функциональных взаимосвязях — кардиомиоцитами (75%), сосудами микроциркуляторного русла и экстрацеллюлярным матриксом (25%) [11], образующим периваскулярный и интерстициальный каркас [12]. Основными белками экстрацеллюлярного матрикса являются фибриллярный коллаген I типа (>50%), III типа (10-45%), в меньшей степени — коллагены IV, V и VI типов, а также эластин [6].
Гистологически различают периваскулярный фиброз (А), существующий в норме и формирующий муфты вокруг сосудисто-нервных пучков (рис. 1 А), интерстициальный фиброз (В), сопровождающийся гипертрофией кардиомиоцитов, и заместительный фиброз (С), при котором значительное разрастание соединительной ткани протекает параллельно с потерей кардиомиоцитов [6][13] (рис. 1 В, С).
В физиологических условиях сеть фибриллярного коллагена интимно прилежит ко всем клеткам миокарда и имеет определяющее значение в поддержании размеров, формы и функции камер сердца [6]. Избыточное количество фибриллярного коллагена рассматривается как одно из важных звеньев формирования "жесткого сердца", характерного для ХСН с сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ) (ХСНсФВ), а дальнейшее прогрессирование фиброза служит важнейшим фактором потери сократительной способности миокарда и формирования систолической дисфункции — ХСН с умеренно сниженной (ХСНунФВ) и низкой ФВ (ХСНнФВ) [13].

Рис. 1. Нормальная структура кардиомиоцитов и физиологический периваскулярный фиброз (А). Изменение экстрацеллюлярного матрикса при интерстициальном (В) и заместительном (С) фиброзе (адаптировано из [6][13] с использованием нейросети ChatGPT, модель о3).
Фиброз как компонент репаративных систем
Следует понимать, что фиброз миокарда представляет собой сложный биологический процесс, обусловленный взаимодействием множества типов клеток и сигнальных молекул [14]. Структурный компонент патологии — рубцовая ткань, рубец, состоит из белков внеклеточного матрикса, откладываемых в основном активированными фибробластами — миофибробластами [15]. Миофибробласты взаимодействуют с другими типами клеток, в т.ч. с макрофагами, имеющими моноцитарное происхождение [16], которые в большом количестве мигрируют в места повреждений и поддерживают процессы фиброза [17].
В целом исход восстановления ткани — заживление с восстановлением гомеостаза или развитие фиброза — в первую очередь определяется продолжительностью и интенсивностью повреждения, а также изменением характера воспалительного ответа. Существует критически важный временной промежуток, в течение которого координация между клетками поврежденной ткани и иммунным ответом способствует восстановлению целостности ткани до начала развития фиброза [1][2][5]. Продолжительность этого периода зависит от конкретных условий, особенностей повреждающего фактора и длительности его воздействия. Своевременное и адекватное медицинское вмешательство, а также индивидуальные факторы (генетическая предрасположенность, общее состояние здоровья, сопутствующие заболевания) играют решающую роль в определении конечных исходов [2]. Как правило, длительные или повторяющиеся повреждения вызывают хроническое воспаление, тогда как кратковременные и незначительные повреждения приводят к восстановлению. Большинство заболеваний, характеризующихся непрерывным или повторяющимся повреждением тканей и хроническим воспалением, с высокой вероятностью приводят к развитию выраженного фиброза [2][5][11].
Концепция "холодного" и "горячего" фиброза
В 2020г на основании различных типов взаимодействия между основными клеточными элементами, участвующими в формировании рубцовой ткани, многонациональной группой исследователей была предложена новая концепция, в которой для описания фиброза используются 2 новых эпитета — "холодный" и "горячий" [18]. На основании большого количества экспериментальных данных, полученных при изучении животных моделей (мыши, свиньи, нечеловекообразные приматы), авторам удалось доказать, что ответ организма на повреждение тканей может развиваться по трем сценариям, а именно формирования "холодного" фиброза, "горячего" фиброза или нормального заживления [18].
По данным Adler M, et al. (2020), Miyara S, et al. (2025), "горячий" фиброз характеризуется большим количеством как миофибробластов, так и макрофагов, которые поддерживают рост и пролиферацию друг друга. "Холодный" фиброз, напротив, состоит из большого количества миофибробластов без активированных макрофагов. Заживление же сопровождается коллапсом двух популяций клеток и возвращением к исходному уровню — восстановлению тканевого гомеостаза [2][18].
Термин "горячий" происходит от классического острого воспалительного состояния, ключевыми признаками которого являются покраснение, отек и повышение температуры, обусловленные усиленным кровотоком, экстравазацией иммунных клеток и плазмы, что приводит к локальному повышению температуры и ощущению жара [19]. Иммунный ответ при "горячем" фиброзе может оказывать как положительное, так и отрицательное воздействие. С одной стороны, иммунные клетки очищают поврежденную ткань и способствуют ее восстановлению [20]. С другой стороны, хроническое воспаление приводит к формированию "незаживающих ран", что характерно для прогрессирующего фиброза и микроокружения большинства солидных опухолей [21-23]. В обоих случаях моноциты-макрофаги считаются наиболее значимыми иммунными клетками, участвующими в развитии "горячего" фиброза, поскольку их пластичность позволяет им менять свой фенотип. В связи с этим в последнее время особое внимание уделяется терапевтическим стратегиям, направленным на переключение макрофагов при "горячем" фиброзе, поскольку он характеризуется высокой численностью и активностью иммунных клеток. Исследуются способы стимуляции макрофагов для достижения повышенного разрушения избыточного внеклеточного матрикса и трансформации в клетки, обладающие противовоспалительными и антифибротическими свойствами [1].
Напротив, "холодный" фиброз характеризуется отсутствием иммунных клеток, что приводит к снижению воспалительной активности и относительной стабильности фиброзной ткани. Отсутствие или низкое количество иммунных клеток способствует устойчивости фиброза и нарушению процессов регенерации тканей [24], в связи с чем "холодный" фиброз характеризуется неблагоприятным прогнозом и низкой эффективностью антифибротической терапии [25][26].
В современной литературе термины "горячий" и "холодный" фиброз встречаются редко и в основном используются для описания сложных математических моделей динамических процессов межклеточного взаимодействия [2][16][18]. Эти модели учитывают количество макрофагов и миофибробластов в очаге повреждения, их пролиферацию, элиминацию через эндоцитоз и апоптоз, а также секрецию факторов роста. На основе этих данных может быть построен график контурной диаграммы, описывающей три различных сценария репарации ткани — "заживление", "горячий" или "холодный" фиброз (рис. 2).
В этой модели концентрации макрофагов и миофибробластов отображаются по осям абсцисс и ординат соответственно, а разделительная линия, называемая сепаратриссой, обозначает границы между различными состояниями. Сепаратрисса определяет границу перехода между заживлением и фиброзом, позволяя прогнозировать условия, способствующие восстановлению тканей, а также те, при которых вероятно развитие фиброза. Кроме того, она помогает определить, будет ли фиброз сопровождаться активным воспалительным микроокружением ("горячий" фиброз) или же характеризоваться малой воспалительной активностью ("холодный" фиброз) [1][2][18].
Патофизиологическая роль и клиническое значение "холодного" и "горячего" фиброза миокарда при различной кардиальной патологии
В связи с тем, что патофизиологическая и клиническая значимость горячего и холодного фиброза в сердце не была достоверно установлена, для доказательства данной теории группой исследователей из Израиля, США, Австрии и Германии было проведено исследование с тщательно спланированным дизайном и четкой методологической концепцией, результаты которого были опубликованы в марте 2025г [2]. Так, изучение "горячего" и "холодного" фиброза в клинически значимых условиях авторы начали с сопоставления двух классических моделей острого повреждения миокарда (острый ИМ, вызванный перевязкой левой передней нисходящей артерии у мышей и свиней) и хронической перегрузки объемом (частичное пережатие аорты). Исследование динамики клеточных популяций после индуцированного ИМ позволило авторам выявить пиковое увеличение численности макрофагов и миофибробластов на 3-7-е сут. со снижением количества макрофагов к 14-м сут. и сохранением "персистирующих" миофибробластов на 14-е и 28-е сут. (соотношение миофибробластов и макрофагов 6:1), что соответствует "холодному" фиброзу. Анализ экспрессии генов различных клеточных типов (макрофагов и фибробластов) показал, что при "холодном" фиброзе макрофаги возвращались к гомеостатическим функциям, тогда как фибробласты приобретали устойчивый профиброзный фенотип [2]. Эти изменения согласуются с предыдущим исследованием Fu X, et al. (2018), в котором подчеркивался переход сердечных миофибробластов в матрифиброциты [27] — клетки, формирующие внеклеточный матрикс в зрелом рубце [28]. Авторы пришли к выводу, что начальный транзиторный период инфаркта, протекающий в условиях высокого содержания в тканях миокарда макрофагов и миофибробластов, сопряжен с усилением иммунного взаимодействия клеток, тогда как поздний "холодный" фиброз характеризуется высоким содержанием фибробластов, основная функция которых заключается в продукции экстрацеллюлярного матрикса, что важно для формирования состоятельного рубца [2].
В эксперименте на животных частичное пережатие аорты с постоянным увеличением градиента давления ожидаемо приводило к гипертрофии ЛЖ с увеличением индекса массы миокарда и незначительным снижением ФВ ЛЖ. При окрашивании пикросириусом красным были идентифицированы три морфологических паттерна, соответствующих периваскулярному, интерстициальному и замещающему фиброзу. Увеличение числа миофибробластов со снижением количества кардиомиоцитов было максимальным при заместительном фиброзе, но отмечалось при всех его типах. Также при всех типах фиброза наблюдалось увеличение числа макрофагов (соотношение миофибробластов и макрофагов 1:1), что соответствует характеристикам "горячего" фиброза [2].
Авторами подчеркивается, что восстановление тканей является защитной реакцией после травмы, но повторяющаяся или длительная травма может привести к фиброзу, т.е. патологическому состоянию чрезмерного образования рубцовой ткани [2, 18]. При этом для определения динамических механизмов, лежащих в основе фиброза, важно понимать принципы межклеточных взаимодействий, обеспечивающих репаративные процессы, а именно взаимодействия миофибробластов и макрофагов при заживлении ран, включая накопление образующего рубец внеклеточного матрикса [3][14].
Возможности воздействия на "холодный" и "горячий" фиброз
Отвечая на вопрос о регулирующих механизмах при разных типах фиброза, Miyara S, et al. показали, что миофибробласты, приобретшие профиброзный фенотип при холодовом фиброзе после ИМ, в отсутствие макрофагов поддерживают собственную пролиферацию с помощью аутокринной петли фактора роста (рис. 2) [2]. В качестве аутокринного фактора роста фибробластов был идентифицирован тканевой ингибитор матриксной металлопротеиназы 1 типа (TIMP1), инактивация которого с помощью антител приводила к уменьшению фиброза у взрослых мышей после ИМ [2].
Рис. 2. Математическая модель клеточной цепи миофибробласт-макрофаг при заживлении, "холодном" и "горячем" фиброзе [адаптировано из 2].
Сокращения: IL 1β — интерлейкин 1β, PRO-C3 — N-концевой пропептид коллагена III типа, PRO-C6 — N-концевой пропептид коллагена VI типа, ST-2 — стимулирующий фактор туморогенности, кодируемый геном 2, ММP1 — матриксная металлопротеиназа 1, TIMP1 — тканевой ингибитор матриксной металлопротеиназы 1.
Первоначально TIMP1 был идентифицирован как фактор роста, а теперь рассматривается как мощный провоспалительный цитокин, рецепторы к которому были обнаружены во всех интерстициальных клетках миокарда, что предполагает более широкие эффекты TIMP1, не ограничивающиеся сердечными миофибробластами [29].
В контексте рассмотрения фиброза как типового патологического процесса, не ограничивающегося одним только миокардом, проведен ряд исследований по изучению горячего и холодного фиброза в печени, в т.ч. с разработкой стратегии ингибирования аутокринной петли при поздних стадиях цирроза печени [30]. Таким образом, ингибирование аутокринной сигнальной петли фибробластов — ключевой популяции профиброзных клеток, может быть общей стратегией для борьбы с фиброзом во всех органах.
В то время как "холодный" фиброз зависит от аутокринной сигнальной петли миофибробластов, "горячий" фиброз требует паракринной сигнализации между макрофагами и миофибробластами. Ключевые паракринные сигналы, поддерживающие "горячий" фиброз при хронических повреждениях сердца, были описаны в недавних исследованиях, показывающих, что активированные макрофаги секретируют интерлейкин-1β, который способствует активации фибробластов и последующему фиброзу у мышей и людей с хронической перегрузкой давлением [31, 32].
В качестве потенциального биомаркера "горячего" фиброза в печени в настоящее время рассматриваются N-концевой пропептид коллагена III типа, описанный как системный маркер для оценки синтеза коллагена III и активации звездчатых клеток печени, пропептид коллагена VI типа, и эндотрофин — продукт, образующийся при формировании коллагена VI типа [1].
Исследования, посвященные изучению маркеров-кандидатов "холодного" и "горячего" фиброза в других органах, до настоящего времени не проводились, хотя феномен "горячего" и "холодного" фиброза был недавно обнаружен в гистологическом анализе трансплантированных человеческих почек [33].
Не исключается также роль других биологически активных молекул, таких как галектин-3, стимулирующий фактор роста, кодируемый геном 2 (ST2), виментин, некоторые члены семейства матричных металлопротеиназ, нейтрофильная эластаза, растворимый урокиназный рецептор активации плазминогена, растворимый триггерный рецептор, экспрессируемый на миелоидных клетках 2, и других потенциальных сигнальных молекул — регуляторов активности "горячего" фиброза [2][29][30][34].
Перспективы использования положений о "горячем" и "холодном" фиброзе в клинической практике
Фибротические и склеротические процессы представляют собой типичный исход различных заболеваний большинства органов и систем, приводя к структурным и функциональным нарушениям вплоть до ор- ганной недостаточности и смертности.
Недавние экспериментальные исследования продемонстрировали эффективность ряда вмешательств, в частности, применение иммунотерапевтических методик, в уменьшении фиброза на животных моделях [35-37]. Показанная в эксперименте способность к регрессу рубцовой ткани и восстановление утраченной функции после повреждения миокарда у мышей, изменяет давние представления о необратимости фиброза. Однако подобного рода вмешательства еще не вошли в клиническую практику и приходится констатировать, что клинические возможности и методы лечения, направленные на устранение фиброза, остаются весьма ограниченными.
Появление и разработка концепции "горячего" и "холодного" фиброза может рассматриваться как один из шагов к более персонализированному подходу в оценке процессов ремоделирования миокарда у разных групп пациентов и механизм разработки таргетных терапевтических стратегий.
По результатам наших собственных наблюдений [38], у пациентов с ХСНсФВ и ХСНунФВ в разных фенотипических группах, выделенных с применением алгоритмов машинного обучения методом неконтролируемой кластеризации, были выявлены особенности профиля провоспалительных и профибротических биомаркеров (рис. 3).
Так, больные ишемического фенотипа, значимо чаще имевшие перенесенный ИМ и, соответственно, потенциально более обширные рубцовые изменения в миокарде, отличались невысокими концентрациями провоспалительных и профибротических маркеров — галектина-3 и ST2, по сравнению с пациентами фенотипа дезадаптивный с полиорганной дисфункцией [38]. Этот факт, вероятно, можно объяснить преобладанием в данных фенотипических группах разных типов фиброза, отличающихся патофизиологическими механизмами развития и биологической активностью.
Отсутствие значимых различий уровней галектина-3 и ST2 — маркеров воспаления и фиброза в разных фенотипических кластерах может быть обусловлено большой давностью перенесенного ИМ у наших пациентов (не менее 6 мес. до включения в исследование в соответствии с критериями включения/невключения), в отличие от условий в эксперименте Miyara S, et al. (2025). Можно предположить, что у обследованных нами пациентов к "холодному" фиброзу, развившемуся в раннем постинфарктном периоде, под влиянием хронических гемодинамических расстройств в виде увеличенной пред- и постнагрузки, впоследствии присоединился фиброз "горячего" типа. Однако для доказательств возможности существования смешанных вариантов фиброза у одного и того же пациента требуется проведение дополнительных исследований.
Таким образом, можно констатировать, что выявление различных патогенетических типов фиброза в клинической практике, в отличие от животных моделей, сопряжено с объективными трудностями. Более детальная диагностика различных типов фиброза, в т.ч. смешанных, в популяции пациентов с ХСН представляется возможной после проведения дополнительных исследований и разработки конкретных диагностических алгоритмов.
Полученные экспериментальные данные о возможной патогенетической роли различных медиаторов аутокринной и паракринной регуляции при "холодном" и "горячем" фиброзе могут рассматриваться как теоретическая база для разработки новых медикаментозных стратегий терапии и создания препаратов, способных потенцировать регресс рубцовых изменений в миокарде и других органах. Также требует дальнейшего изучения эффективность препаратов с уже известным антифибротическим действием, таких как, например, антагонисты минералокортикоидных рецепторов, у пациентов с "холодным" и "горячим" типами фиброза [39]. Появление доказательств клинической эффективности антагонистов альдостерона у пациентов с "горячим" фиброзом позволит расширить показания к применению препаратов данной группы, не ограничиваясь лишь постинфарктным кардиосклерозом.
Рис. 3. Уровни медиаторов нейрогуморальных систем, маркеров воспаления и фиброза у больных ХСНсФВ и ХСНунФВ разных фенотипических групп (адаптировано из [38]).
Примечание: * — р<0,05 при сравнении с ишемическим фенотипом, † — р<0,05 при сравнении с гипертоническим фенотипом, ‡ — р<0,05 при сравнении с дезадаптивным фенотипом с полиорганной дисфункцией.
Сокращения: ГБ — гипертоническая болезнь, ИБС — ишемическая болезнь сердца, НТУ — нарушение толерантности к углеводам, ПИКС — постинфарктный кардиосклероз, СД 2 — сахарный диабет 2 типа, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, NT-proBNP — N-концевой промозговой натрийуретический пептид, sST2 — растворимая фракция стимулирующего фактора роста, кодируемого геном 2.
Заключение
У больных с различными заболеваниями сердечно-сосудистой системы можно предполагать развитие разных типов фиброза. Острый ИМ способствует формированию "холодного" фиброза, представленного преимущественно фибробластами, тогда как под влиянием хронически действующих гемодинамических факторов развивается "горячий" фиброз, основными клеточными элементами и эффекторами которого являются фибробласты и макрофаги. Конкретные алгоритмы диагностики разных типов фиброза, применимые в клинической практике, до настоящего времени не разработаны. Гипотеза о различной эффективности терапевтических стратегий разных типов фиброзов требует дальнейшей разработки.
Клиническая эффективность применения фотоплетизмографии и телемедицинских технологий для наблюдения за пациентами с неинфекционными заболеваниями: систематический обзор и метаанализ
Ключевые моменты
- Применение фотоплетизмографии (ФПГ) на амбулаторном этапе с целью дистанционного наблюдения и контроля частоты сердечных сокращений не уступает традиционным методам контроля показателей.
- Подчеркивается диагностическая ценность ФПГ с целью ранней диагностики фибрилляции предсердий, а также точность систем дистанционного мониторинга артериального давления.
Key messages
- The use of photoplethysmography (PPG) at the outpatient stage for remote heart rate monitoring is not inferior to traditional methods of monitoring indicators.
- The diagnostic value of PPG for the early diagnosis of atrial fibrillation, as well as the accuracy of remote blood pressure monitoring systems, are emphasized.
Графический абстракт
Сокращения: ДАД — диастолическое артериальное давление, ДИ — доверительный интервал, САД — систолическое артериальное давление, ФП — фибрилляция предсердий, ФПГ — фотоплетизмография, ЭКГ — электрокардиография.
Дистанционный и непрерывный мониторинг (ДНМ) зарекомендовал себя как перспективный метод профилактики, позволяющий снизить уровень смертности и нагрузку на систему здравоохранения [1]. Отслеживание любого процесса имеет решающее значение, поскольку требует обеспечение строгого соблюдения стандартных протоколов и процедур, следовательно, мониторинг клинических испытаний не является исключением. Возможность удаленного наблюдения за пациентами на предмет обострения различных заболеваний может обеспечить возможность проведения терапевтических вмешательств для предотвращения декомпенсации, госпитализации и риска летального исхода [2]. Однако дистанционный мониторинг гемодинамики требует инвазивной процедуры и может быть экономически неэффективным [3].
Одним из основных методов ДНМ, часто используемых для мониторинга состояния здоровья населения, является фотоплетизмография (ФПГ). В основе ФПГ положен метод облучения (обычно пальца, запястья, предплечья или уха) видимым светом и сбор проходящего или отраженного света с помощью детектора [3][4]. ФПГ как простой и недорогой оптический метод может быть использован для выявления изменений объема крови в микрососудистом русле. Часто используется неинвазивно для проведения измерений на поверхности кожи и включает базовую частоту с различными низкочастотными компонентами, связанными с дыханием, активностью симпатической нервной системы и терморегуляцией. Внимание практикующих врачей и исследователей к данной методике обусловлено доступной и портативной технологией при оказании первичной медицинской помощи.
Научная новизна проводимого исследования включает объединение нескольких работ, посвященных мониторингу показателей состояния здоровья пациентов с неинфекционными заболеваниями при активном образе жизни. Применение средств дистанционного наблюдения, в частности ФПГ, является более комфортным для пациента, менее трудозатратным с позиции возможности передачи информации с приборов удаленного мониторинга в телемедицинский центр с оценкой результатов специалистом узкого профиля или врачом-исследователем. Часть технологий демонстрирует более точные результаты при измерении в покое, без движения, что диктует необходимость дальнейшего поиска технологий и усовершенствование устройств для использования в повседневной деятельности. Детальный анализ возможности применения ФПГ в практической деятельности наряду с общепринятым физикальным исследованием определяет нишу использования данного метода.
Целью настоящего обзора является анализ литературных данных о возможности применения ФПГ на амбулаторном этапе с целью дистанционного наблюдения и контроля частоты сердечных сокращений (ЧСС), в т.ч. нарушений ритма, артериального давления (АД), температуры, частоты дыхательных движений.
Методология исследования
Авторами был произведен электронный поиск публикаций в базах данных PubMed/Medline, Web of Science, Scopus и Google Scholar. Поиск осуществлялся по следующим ключевым словам: "clinical aspects of photoplethysmography", "remote photoplethysmography", "imaging", "non-contact medicine", "telemedicine", "telemonitoring". Авторы независимо друг от друга осуществляли отбор релевантных исследований. В обзор включались исследования, опубликованные на русском и английском языке с 2015г по 16.02.2025. В обзор было включено 39 исследований (рис. 1). Авторы независимо друг от друга провели анализ заголовков и аннотаций статей, после чего извлекался полный текст релевантных исследований. Разногласия между авторами разрешались путем консенсуса.
Статистическая обработка данных осуществлялась в программах Review Manager (RevMan), версия 5.4.1 (The Cochrane Collaboration, 2020) и Comprehensive Meta-Analysis 3.0 (Biostat, США). Метаанализ выполнялся по модели случайных эффектов, с включением метода обратной дисперсии. Визуализация основных результатов представлена в виде древовидной диаграммы (forest plot). Проверка статистической неоднородности исследований осуществлялась с помощью Q-теста на основе χ2 и индекса гетерогенности I2. Обсуждение анализа статистической гетерогенности согласно индексу I2 проводилась по рекомендациям Кокрановского сообщества, где I2>75% соответствует высокой гетерогенности. Модель случайных эффектов учитывалась при Р=40%. Метаанализ различий средних значений систолического АД (САД) и диастолического АД (ДАД) в исследуемой и контрольной группах включал данные о средних значениях со стандартными отклонениями с приведением числа пациентов в указанных группах. Метаанализ различий встречаемости фибрилляции предсердий (ФП) как категориальный показатель учитывал абсолютное значение n в каждой выборке к числу объема выборки. Эффект считался статистически значимым при p<0,05. Оценка публикационного смещения сопровождалась визуальным осмотром воронкообразных диаграмм (Funnel plot).
Качество исследований выполнялось по шкале оценки качества когортных исследований Ньюкасл-Оттава [5]. Анализ включенных исследований проводился путем определения указанных критериев: отбор исследовательских групп; сопоставимость групп; и установка интересующего исхода. Все несоответствия снимались в ходе обсуждения авторами работы. Оценку риска систематической ошибки индивидуальных исследований, включенных в систематический обзор, проводили с помощью опросника кокрановского сотрудничества для оценки риска систематических ошибок (смещений) (The Cochrane Collaboration’s tool for assessing risk of bias). Общий риск систематической ошибки оценивали по 6 доменам: является ли экспонированная когорта репрезентативной, каким образом была сформирована неэкспонированная когорта, каким образом был установлен факт воздействия изучаемого фактора, было ли подтверждено отсутствие интересующего исхода в начале исследования, являются ли сравниваемые когорты сопоставимыми, какой источник информации об исходах использовался, была ли продолжительность наблюдения достаточной для возникновения интересующих исходов, каково было выбывание пациентов.
Рис. 1. Алгоритм отбора публикаций для написания систематического обзора.
Результаты
Содержание 14 проанализированных работ изложено в таблице 1.
Оценка САД и ДАД применением ФПГ или иного метода измерения
Средние значения САД и ДАД в зависимости от применяемого метода измерения (ФПГ или иной метод — ручной метод с применением манжеты или инвазивно) были представлены в двух исследованиях [8][18]. Нами произведен метаанализ разности средних значений САД и ДАД у пациентов в 2 изучаемых группах (рис. 2, 3). Как видно из рисунка, применение ФПГ демонстрирует результат не хуже по сравнению с другими методами. Так, средневзвешенная разница значений САД составила 2,44 мм рт.ст. (95% доверительный интервал (ДИ): -8,02; 12,89), данные различия были статистически незначимыми (р=0,65), средневзвешенная разница значений ДАД составила -0,94 мм рт.ст. (95% ДИ: -5,11; 6,99), данные различия были статистически незначимыми (р=0,76). Следует подчеркнуть, что при оценке однородности исследований с использованием критерия хи-квадрат Пирсона был получен статистически значимый результат (хи-квадрат Пирсона =9,01 при степени свободы 1, p=0,003 для САД и хи-квадрат Пирсона =12,80 при степени свободы 1, p=0,0003 для ДАД); а также индекс гетерогенности I2=89% для САД и I2=92% для ДАД, что подразумевает высокую несогласованность по представленным исследованиям и определяет необходимость взвешенной интерпретации объединенной оценки разности средних значений для этих исследований.
Для качественной оценки наличия систематической ошибки метаанализа необходимо включение ≥5 исследований для построения воронкообразной диаграммы (Funnel plot) (рис. 4, 5). Учитывая небольшое количество представленных исследований, говорить о значимой асимметрии воронкообразной диаграммы по САД и ДАД нет возможности.
Оценка возникновения ФП применением ФПГ или регистрацией электрокардиограммы
Абсолютные значения, определяющие частоту развития ФП, указаны в рамках четырех исследований (рис. 6). Общая частота развития ФП в данных исследованиях составила 5500/26766 (20,5%) пациентов в группе ФПГ и 8219/311930 (2,9%) в группе стандартной регистрации электрокардиограммы (ЭКГ). Так, относительный риск развития ФП составил 1,44 (95% ДИ: 0,11; 18,19), данные различия были статистически незначимыми (р=0,78). При оценке однородности исследований с помощью критерия хи-квадрат Пирсона был получен статистически значимый результат (хи-квадрат Пирсона =8385,44 при степени свободы 3, p<0,00001); а также индекс гетерогенности I2=100%, что обуславливает выраженную разноречивость исследований и демонстрирует значимость аккуратной интерпретации оценки регистрации ФП для всех исследований.
Для выявления систематической ошибки при регистрации ФП с помощью ФПГ или ЭКГ учитывались 4 исследования с формированием воронкообразной диаграммы (Funnel plot) (рис. 7). Мы видим асимметричность распределения данных, что требует проведения дальнейших работ с целью определения риска ошибки.
Оценка рисков систематической ошибки. Оценка рисков систематической ошибки в рандомизированных клинических исследованиях проведена в соответствии с опросником, предложенным кокрановским сотрудничеством (табл. 2-4). Необходимо отметить, что все исследования были наблюдательными. Это могло повлиять на систематическую ошибку исполнения (performance bias) и систематическую ошибку выявления исходов (detection bias). Оценка включенных исследований показала, что одна работа демонстрирует высокий риск систематических ошибок, но ввиду небольшого числа исследований по данной тематике, принято решение использовать для метаанализа. Для оставшихся исследований дизайн, методология их проведения и характеристики пациентов соответствовали цели настоящего исследования.
Обсуждение полученных результатов. Опыт НМИЦ ТПМ в рамках государственного задания Минздрава России № 121021100129-2 "Дистанционный мониторинг микроциркуляторного кровотока в стационарных и амбулаторных условиях у лиц с артериальной гипертензией" демонстрирует, что применение ФПГ позволяет подробно описать клинический статус мужчин с артериальной гипертензией (АГ) низкого и умеренного сердечно-сосудистого риска по сравнению с мужчинами с нормальным уровнем АД [20].
Таблица 1
Изложение результатов систематического обзора
|
Исследование |
Размер выборки (n) |
Группы сравнения (n) |
Возраст |
Пол |
Заболевание (ХОБЛ и т.д.) |
Сопутствующее заболевание |
Длительность мониторинга, дни |
Длительность наблюдения, дни |
|
Martin Manninger, et al., 2023 [6] |
n=382 |
n=119 (телемониторинг) n=263 (отказались от телемониторинга) |
1 группа — 58±10 лет 2 группа — 62±10 лет |
34% — женщины 66% — мужчины |
ФП |
Нет данных |
6 дней |
544 (53-883) дня |
|
Mintu P Turakhia, et al., 2021 [7] |
n=419093 |
n=419093 |
65+ лет |
50% — женщины 50% — мужчины |
ФП |
Нет данных |
7 дней |
90 дней |
|
Zhanna Sagirova, et al., 2021 [8] |
n=500 |
n=500 |
64±7,9 года |
56% — женщины 44% — мужчины |
АГ |
Нет данных |
1 день |
1 день |
|
Young Sang Cho, et al., 2023 [9] |
n=23 |
n=14 (+) n=9 (-) |
51,7 года |
35,7% — женщины 64,3% — мужчины |
Шум в ушах |
Нет данных |
28 дней |
90 дней |
|
Jonatan Fernstad, et al., 2024 [10] |
n=280 |
n=214 (прошли плановую процедуру DCCV) n=66 (процедуру в течение 48 ч после начала ФП/ТП) |
69,0 лет |
30,7% — женщины 69,3% — мужчины |
ФП, ТП |
Нет данных |
30 дней |
30 дней |
|
Rianne van Melzen, et al., 2024 [11] |
n=58 |
1 группа — 31 человек 2 группа — 27 человек |
55,5 лет |
43% — женщины 57% — мужчины |
Операционные пациенты |
Нет данных |
2 дня |
Более 2 дней |
|
Lynn Garvin, et al., 2024 [12] |
n=20 |
1 группа — 10 врачей 2 группа — 10 пациентов |
47 лет |
100% — мужчины |
Ветераны боевых действий |
СД, ХОБЛ, БА, ХБП, ХСН |
1 день |
1 день |
|
Thomas Vollmer, et al., 2023 [13] |
n=115 |
115 пациентов — 5 исследований |
– |
– |
ФП |
Нет данных |
8 дней |
365 дней |
|
Steven A, et al., 2021 [14] |
n=455669 |
455669 пациентов |
18+ |
– |
ФП |
Нет данных |
6 мая — 1 октября 2020г ФП — 7 дней |
6 мая — 1 октября 2020г |
|
Ramtanu Mukherjee, et al., 2018 [15] |
n=288 |
1 группа — 186 человек 2 группа — 102 человека |
10-92 года |
52% — женщины 48% — мужчины |
Без патологии |
Без патологии |
1 день |
1 год |
|
Edem Allado, et al., 2021 [16] |
n=1045 |
1045 пациентов |
18+ |
Нет данных |
Без патологии |
Без патологии |
1 день |
Январь 2021 — июль 2022 |
|
Perez MV, et al., 2019 [17] |
n=419297 |
1 группа — 419297 человек |
18+ |
Нет данных |
Без ФП |
Нет данных |
7 дней |
117 дней |
|
Juan C Ruiz-Rodríguez, et al., 2013 [18] |
n=707 |
135 человек исключены 525 человек — обучающая группа 47 человек — группа валидации |
1 группа — 59 лет 2 группа — 63,2 года |
53% — мужчины 47% — женщины |
Здоровые |
Нет данные |
4 дня |
Январь 2010 — март 2012 |
|
Alam S, et al., [19] |
n=70 |
35 человек — здоровых 35 человек — ССЗ |
21-65 лет |
Нет данных |
Здоровые ССЗ |
Нет данных |
13 дней |
Нет данных, длительно |
Сокращения: АГ — артериальная гипертензия, БА — бронхиальная астма, СД — сахарный диабет, ССЗ — сердечно-сосудистые заболевания, ТП — трепетание предсердий, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность.
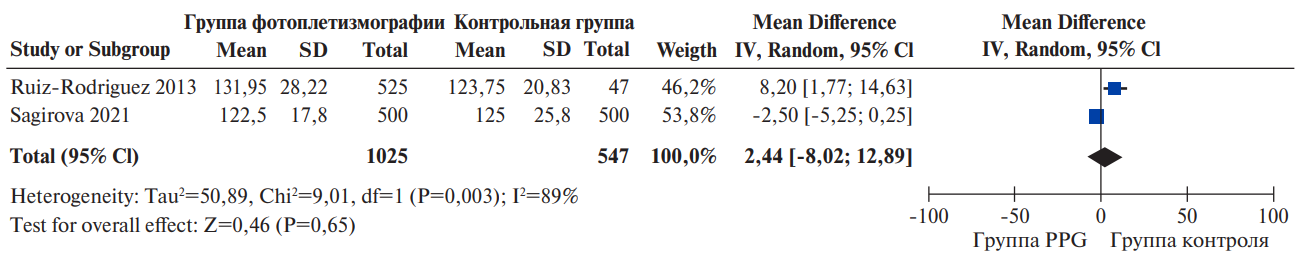
Рис. 2. Результаты метаанализа разности средних значений САД в группе с ФПГ (PPG) и без метода.
Примечание: синие квадраты показывают взвешенный размер эффекта для определенного исследования (размер синих квадратов соответствует весу исследований), черные отрезки — 95% ДИ, черный ромб отражает средневзвешенное значение разности средних значений САД.
Сокращения: ДИ (CI) — доверительный интервал, САД — систолическое артериальное давление, ФПГ (PPG) — фотоплетизмография.
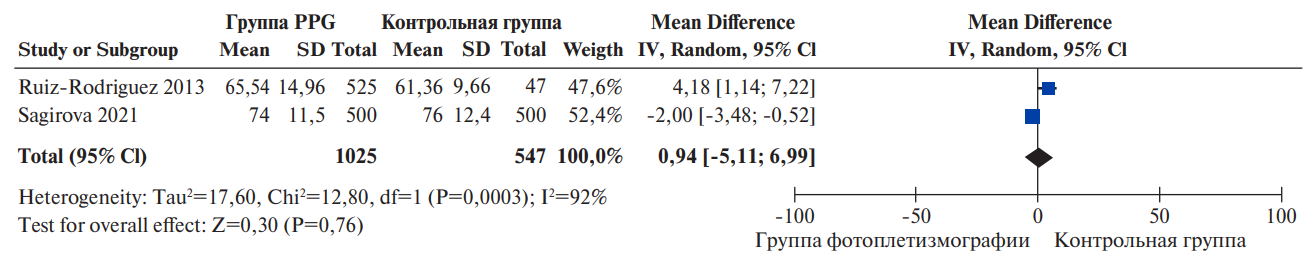
Рис. 3. Результаты метаанализа разности средних значений ДАД в группе с ФПГ (PPG) и без метода.
Примечание: синие квадраты показывают взвешенный размер эффекта для определенного исследования (размер синих квадратов соответствует весу исследований), черные отрезки — 95% ДИ, черный ромб отражает средневзвешенное значение разности средних значений ДАД.
Сокращения: ДАД — диастолическое артериальное давление, ДИ (CI) — доверительный интервал, ФПГ (PPG) — фотоплетизмография.
Рис. 4. Воронкообразная диаграмма (funnel plot) САД.
Рис. 5. Воронкообразная диаграмма (funnel plot) ДАД.
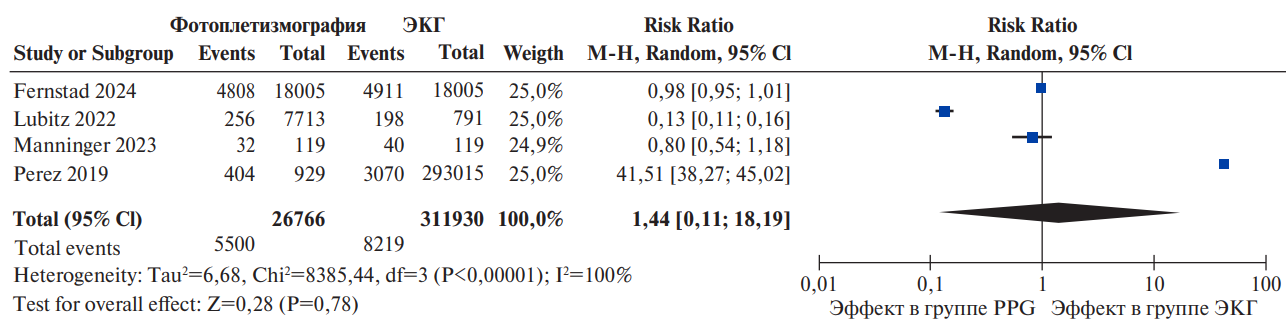
Рис. 6. Результаты метаанализа значений частоты ФП в группе с ФПГ (PPG) и без нее.
Рис. 7. Воронкообразная диаграмма (funnel plot) ФП.
Таблица 2
Сводная оценка риска систематической ошибки. Представлен обзор суждений авторов о каждом элементе риска систематической ошибки для каждого включенного клинического исследования
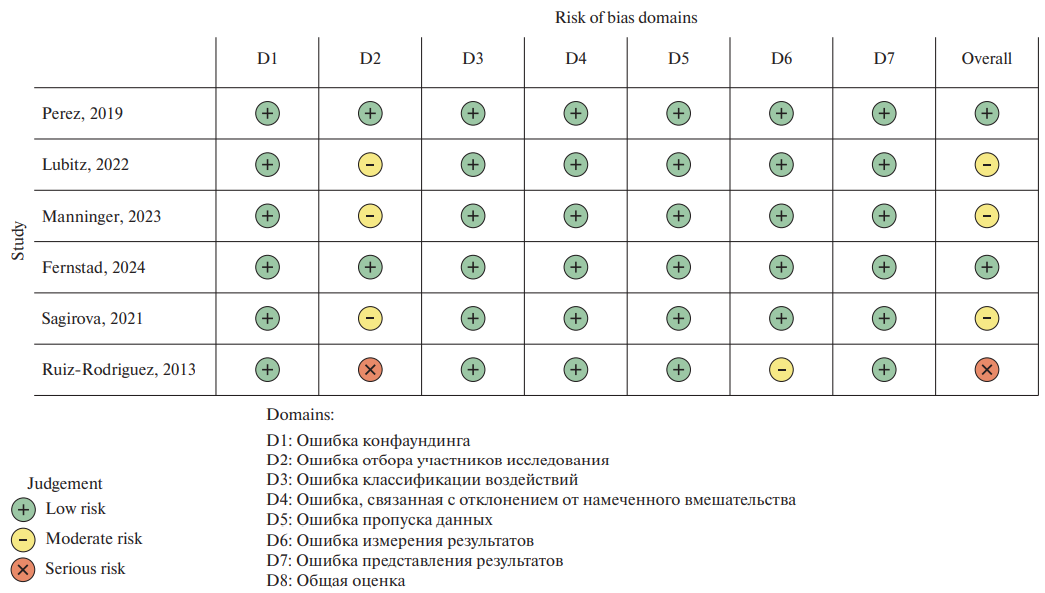
Таблица 3
Оценка рисков систематической ошибки включенных клинических исследований. Представлены суждения авторов о каждом элементе риска систематической ошибки в процентах по всем включенным клиническим исследованиям
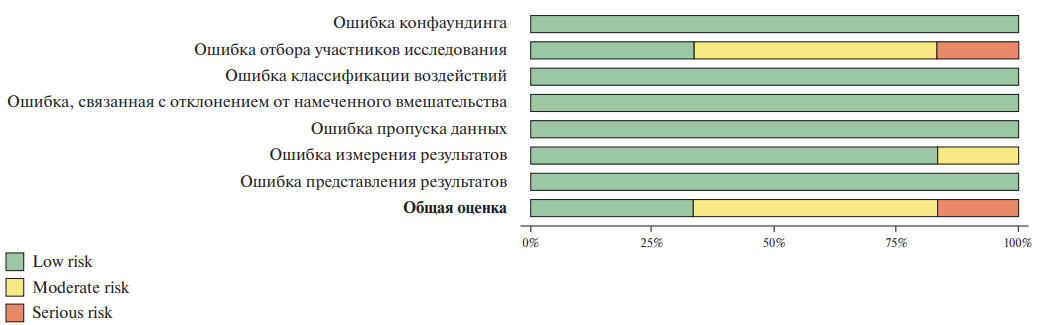
Таблица 4
Шкала для оценки риска систематических ошибок в когортных исследованиях
|
D1 |
Ошибка конфаундинга/Bias due to confounding |
|
D2 |
Ошибка отбора участников исследования/Bias due to selection of participants |
|
D3 |
Ошибка классификации воздействий/Bias classification of interventions |
|
D4 |
Ошибка, связанная с отклонением от намеченного вмешательства/Bias due to deviations from intended interventions |
|
D5 |
Ошибка пропуска данных/Bias due to missing data |
|
D6 |
Ошибка измерения результатов/Bias in measurement of outcomes |
|
D7 |
Ошибка представления результатов/Bias in selection of the reported result |
|
D8 |
Общая оценка/Overall risk of bias |
Наблюдение за пациентами с АГ по результатам работы сотрудников Сеченовского университета показывает, что метод измерения АД на основе анализа ЭКГ и ФПГ с помощью прибора CardioQVARK® продемонстрировал достоверные результаты измерения АД по сравнению с методом Короткова: выявлена статистически значимая корреляция для САД (r=0,976) и ДАД (r=0,817), по данным анализа Блэнда-Алтмана смещение составило -0,5 и -0,3 мм рт.ст. для САД и ДАД, соответственно. Чувствительность нового метода в выявлении АГ составила 77% (95% ДИ: 46; 95), специфичность 100% (95% ДИ: 91; 100), точность 94% (95% ДИ: 83; 99) [21].
Ограничения вышеуказанных отечественных исследований связаны с отсутствием анализа применения ФПГ для дистанционного мониторинга за базовыми клиническими показателями пациентов с неинфекционными заболеваниями, что послужило основанием для проведения данной научной работы.
Результаты проведенного нами систематического обзора и метаанализа продемонстрировали возможность проведения дистанционного наблюдения с применением ФПГ с оценкой не только физиологических параметров (АД, ЧСС, температура, частота дыхательных движений), но и нарушений ритма, в частности ФП. Наши данные согласуются с другими источниками [22-24].
Существует разнообразие методов регистрации показателей с помощью ФПГ. Смарт-часы и фитнес-браслеты представляют собой портативные устройства, способные отслеживать частоту пульса с использованием ФПГ. Выявление нарушений ритма на основании этих данных может способствовать обнаружению ФП или трепетания предсердий. Оценка эффективности ФПГ с помощью смартфона и одновременным анализом ЭКГ показала высокую чувствительность и специ- фичность такого подхода, следовательно, такой метод может быть использован пациентами для самостоятельного наблюдения за сердечным ритмом [7, 25]. Показана эффективность различных портативных устройств, таких как Apple Watch, в выявлении аритмий, что открывает возможность их широкого применения в клинической практике. Все эти направления подтверждают, что новые технологии в сфере мониторинга здоровья способны значительно улучшить качество диагностики и лечения, а также повысить уровень приверженности пациентов к лечению [11]. В рамках проекта "Индивидуальный биомониторинг сердечной недостаточности (Biomon-HF)" были созданы и успешно испытаны инновационные датчики и алгоритмы для мониторинга жизненно важных показателей сердечно-сосудистой системы, в т.ч. во время сна [13].
Mukherjee R, et al. разработали систему неинвазивного дистанционного мониторинга АД с применением ФПГ. В ходе исследования был предложен новый отражающий датчик, который устраняет погрешности при измерении АД и артефакты, связанные с движением пациента. Для повышения надежности измерений разработан алгоритм, учитывающий вариации оттенков кожи. Система демонстрирует высокий уровень эффективности и может быть использована для мониторинга АД у младенцев, пожилых людей и пациентов в отделениях реанимации и интенсивной терапии [15].
Garvin L, et al. (2024) предложил оценку системы "Vitals" на платформе VA Video Connect [12]. "Vitals" использует бесконтактную дистанционную ФПГ на основе видеозаписи с помощью инфракрасной камеры на смартфонах (и других устройствах) для автоматического сканирования лиц и предоставления в режиме реального времени результатов в базу данных, а также пациенту. Специалисты отметили гибкость системы в отношении различных клинических условий, что облегчает её интеграцию в рабочий процесс и позволяет экономить время, улучшая точность данных и снижая вероятность клинических ошибок.
Allado E, et al. (2021) провели исследование, в котором использовали стандартную компьютерную веб-камеру и камеру смартфона для проведения телеконсультаций с целью оценки текущего состояния пациента с сердечно-сосудистыми и респираторными заболеваниями с целью коррекции текущего лечения [12]. Данное исследование имеет информацию о точности измерений физиологических параметров, таких как ЧСС, частота дыхательных движений и уровень насыщения кислородом с помощью системы дистанционной ФПГ в реальных клинических условиях. Однако для оценки их применимости в домашних условиях необходимы дальнейшие исследования.
Согласно данным Ляпиной И. Н. и др. (2021), дистанционный мониторинг позволяет увеличить количество пациентов, участвующих в программах кардиореабилитации, обеспечивает более эффективный контроль статуса больных, тем самым повышая их приверженность физической активности в домашних условиях [25].
В рамках российского исследования под руководством Исаевой А. В. и др. (2024) наблюдение за состоянием пациентов с хронической сердечной недостаточностью продемонстрировало отсутствие статистически значимых различий по уровню САД, ДАД, ЧСС между 3 группами: группой телефонного диспансерного наблюдения (n=58), группой диспансерного наблюдения на российской медицинской платформе Medsenger (n=52), группой стандартного очного наблюдения у кардиолога поликлиники, что позволяет активно применять телемедицинские технологии в клинической практике [26].
Аналогичные результаты представлены в рамках пилотного дистанционного мониторинга пациентов с хронической сердечной недостаточностью, где наряду с качеством жизни проводилась оценка клинического профиля пациентов [27]. Разработанная авторами модель ведения пациентов с применением телемедицинских технологий, по сравнению с общепринятой терапевтической практикой, привела к повышению качества жизни, приверженности к лечению и способности к самопомощи больных.
Заключение
Комплексный систематический обзор, дополненный метаанализом, показал ценность инновационных технологий и систем мониторинга в управлении базовыми физиологическими параметрами, диагностике и профилактике сердечно-сосудистых заболеваний. Исследования демонстрируют диагностическую ценность ФПГ с целью ранней диагностики ФП, а также точность систем дистанционного мониторинга АД.
Патофизиологические механизмы сердечно-сосудистых нарушений при болезни Паркинсона
Ключевые моменты
- Болезнь Паркинсона сопровождается не только двигательными, но и выраженными сердечно-сосудистыми нарушениями.
- Нарушения в вегетативной нервной системе, особенно симпатическая денервация сердца, играют важную роль в патогенезе.
- Скопление альфа-синуклеина обнаруживается как в центральной, так и в периферической нервной системе.
- Ортостатическая гипотензия связана не только с поражением нервной системы, но и с внешними факторами — снижением объема жидкости и лекарственным воздействием.
- Сердечно-сосудистые симптомы существенно ухудшают качество жизни пациентов.
Key messages
- Parkinson’s disease is accompanied not only by motor but also by pronounced cardiovascular disorders.
- Disorders in the autonomic nervous system, especially cardiac sympathetic denervation, play an important role in pathogenesis.
- Accumulation of alpha-synuclein is found in both the central and peripheral nervous systems.
- Orthostatic hypotension is associated not only with nervous system damage, but also with external factors — a decrease in fluid volume and drug exposure.
- Cardiovascular symptoms significantly worsen the quality of life of patients.
Обзор направлен на всесторонний анализ и синтез современных научных данных о патофизиологических механизмах, лежащих в основе сердечно-сосудистых нарушений у пациентов с болезнью Паркинсона (БП). Особое внимание уделено исследованиям, опубликованным в период с 2020 по 2025гг. Обзор охватывает ключевые патофизиологические механизмы, включая дисфункцию вегетативной нервной системы, патологию альфа-синуклеина (α-syn), окислительный стресс и воспалительные процессы, а также их взаимосвязь с клиническими проявлениями и современными диагностическими подходами. Основная цель обзора заключается в систематизации и критической оценке опубликованных данных по патофизиологическим механизмам сердечно-сосудистых нарушений при БП, а также в выявлении наиболее распространённых осложнений, оценке их влияния на пациентов и определении перспективных направлений для будущих исследований и терапевтических вмешательств.
Методология исследования
Систематический электронный поиск проводился в основных медицинских и научных базах данных, таких как "PubMed", "Embase", "Elpub", "Cochrane Central Register of Controlled Trials" CENTRAL и "Scopus". Для обеспечения максимально полного охвата использовался также "Google Scholar". Дата последнего поиска информации была установлена с 2020 по 2025гг, что позволило охватить пятилетний период актуальных публикаций, за исключением отдельных источников, привлечённых при необходимости более полного раскрытия темы и включения значимых ранее опубликованных данных. По результатам поиска за указанный период было выявлено от 1700 до 2300 публикаций, в зависимости от вариации поисковых запросов и синтаксических операторов. Для широкого, но целенаправленного поиска использовались комбинации следующих ключевых слов и их синонимов: "Parkinson’s disease" (болезнь Паркинсона), "cardiac" (сердечный), "cardiovascular" (сердечно-сосудистый), "heart failure" (сердечная недостаточность), "myocardial infarction" (инфаркт миокарда), "coronary artery disease" (ишемическая болезнь сердца), "cerebrovascular" (цереброваскулярный), "stroke" (инсульт), "mortality" (смертность), "cardiovascular mortality" (сердечно-сосудистая смертность), "autonomic dysfunction" (дисфункция вегетативной нервной системы), "orthostatic hypotension" (ортостатическая гипотензия (ОГ)), "supine hypertension" (гипертензия в положении лежа), "postprandial hypotension" (постпрандиальная гипотензия), "arrhythmia" (аритмия), "atrial fibrillation" (фибрилляция предсердий), "cardiac remodeling" (кардиальное ремоделирование), "heart morphology" (морфология сердца), "alpha-synuclein" (альфа-синуклеин), "oxidative stress" (окислительный стресс), "inflammation" (воспаление), "neuroinflammation" (нейровоспаление), "mitochondrial dysfunction" (митохондриальная дисфункция), "biomarkers" (биомаркеры), "heart rate variability" (вариабельность сердечного ритма), "HRV" (вариабельность сердечного ритма), "MIBG scintigraphy" (сцинтиграфия с МИБГ), "cardiac denervation" (кардиальная денервация). Эти термины позволили охватить как клинические проявления, так и основные молекулярные и клеточные механизмы, связанные с сердечно-сосудистыми нарушениями при БП.
Результаты
Сердечно-сосудистые нарушения при БП
БП является вторым по распространённости прогрессирующим нейродегенеративным заболеванием после болезни Альцгеймера. "Подавляющее большинство случаев БП имеет спорадический характер, и лишь около 10% пациентов несут генетические мутации, вызывающие это заболевание" [1]. Основным патологическим признаком БП является избирательная утрата дофаминергических нейронов в компактной части черной субстанции [1, 2]. Нейродегенерация, приводящая к дефициту дофамина в стриатуме, клинически проявляется характерными моторными симптомами: тремором покоя, брадикинезией, ригидностью и постуральной нестабильностью [3, 4].
Помимо этих доминирующих моторных проявлений, БП ассоциируется с широким спектром немоторных симптомов, которые оказывают существенное влияние на качество жизни пациентов, являются частой причиной госпитализаций и могут способствовать ускоренному прогрессированию заболевания [5]. Среди немоторных проявлений особое место занимает вегетативная дисфункция (дисфункция автономной нервной системы), которая является одним из наиболее распространенных и клинически значимых признаков, наблюдаемых как на ранних, так и на поздних стадиях БП [6, 7]. Сердечно-сосудистые нарушения выступают наиболее выраженными и потенциально опасными проявлениями вегетативной дисфункции [6, 8]. Изначально БП воспринималась как преимущественно двигательное расстройство, однако современные исследования демонстрируют, что немоторные проявления, в частности нарушения сердечно-сосудистой системы, существенно ухудшают качество жизни пациентов и способствуют ускорению патогенетических процессов [9, 10]. С учётом того, что сердечно-сосудистые заболевания остаются основной причиной смертности во всём мире, разработка интегрированных диагностических и лечебных подходов приобретает особую актуальность. К примеру, вегетативную дисфункцию связывают с повышенным риском возникновения когнитивных нарушений, увеличением количества падений и, как следствие, сокращением продолжительности жизни [11, 12]. Такое понимание подчеркивает критическую важность комплексного, мультидисциплинарного подхода к ведению пациентов с БП, выходящего за рамки исключительно моторных проявлений.
Сердечно-сосудистые нарушения при БП являются сложными и многофакторными, обусловленными сочетанием нейродегенеративных процессов, системных изменений и побочных эффектов лечения. Нейрогенная ОГ (нОГ) является наиболее заметным сердечно-сосудистым проявлением вегетативной дисфункции при БП [13, 14]. Она определяется как стойкое снижение систолического артериального давления (АД) на ≥20 мм рт.ст. или диастолического АД на ≥10 мм рт.ст. в течение 3 мин после перехода в вертикальное положение [6]. Распространенность ОГ при БП оценивается примерно в 30% и увеличивается с возрастом и продолжительностью заболевания [6]. Симптомы нОГ могут варьироваться от легкого головокружения и помутнения зрения до обмороков, а также могут включать головную боль, одышку и чувство вялости [6]. Механизмы нОГ при БП обусловлены комплексным поражением как преганглионарных компонентов, так и постганглионарных структур. С одной стороны, нарушение работы барорефлекторных механизмов, выраженное в сниженной чувствительности кардиовагальных и симпато-нейронных цепей, приводит к дезадаптации регуляции АД. С другой стороны, выраженная симпатическая денервация сердца, отражающая утрату симпатической иннервации, детектируется с использованием I-123-мета-йодобензилгуанидиновой сцинтиграфии, 18-фтор-дофаминовой позитронно-эмиссионной томографии и подтверждается миокардиальной перфузионной сцинтиграфией [6]. Примечательно, что данный патологический процесс зачастую предшествует дегенерации дофаминергических нейронов полосатого тела, что свидетельствует о его ранней патогенетической роли в синуклеинопатии и дополнительно способствует ухудшению регуляции АД у пациентов [13]. Аутопсийные исследования подтвердили потерю сердечных симпатических нервных волокон у пациентов с БП [15]. Эта денервация может приводить к снижению частоты сердечных сокращений и сердечного выброса. Помимо сердца, денервация затрагивает и экстракардиальные органы, что приводит к снижению высвобождения норадреналина, уменьшению периферической вазоконстрикции и, как следствие, снижению АД [16]. Сниженный симпатический рефлекс во время стояния не может адекватно компенсировать уменьшение венозного возврата, что приводит к значительному падению АД. Это нарушение затрагивает центральные механизмы, включая ядро одиночного тракта и ростральный/каудальный вентролатеральные отделы продолговатого мозга. Отличительной чертой нОГ от не-нейрогенной ОГ является отсутствие или незначительное увеличение частоты сердечных сокращений при вставании (<15 уд./мин).
Помимо нейрогенных механизмов, существуют и не-нейрогенные факторы, способствующие развитию ОГ при БП. В их число входит снижение внутрисосудистого объёма, обусловленное недостаточным потреблением жидкости и выраженной дисфагией, что приводит к гиповолемии. Кроме того, сердечная недостаточность, особенно характерная для пожилых пациентов с БП, может развиваться как вследствие отложения телец Леви в миокарде, так и при применении препаратов, таких как прамипексол [13]. Необходимо подчеркнуть, что использование антипаркинсонических средств (например, леводопы и агонистов дофаминовых рецепторов) (табл. 1) часто сопровождается лекарственно-индуцированной гипотензией, что дополнительно способствует появлению и прогрессированию ОГ, а также может приводить к возникновению значительных сердечно-сосудистых побочных эффектов или обострению уже существующих нарушений.
Другие нарушения АД включают супинную гипертензию, определяемую как АД ≥140/90 мм рт.ст. после как минимум 5 мин отдыха в положении лежа на спине. Она наблюдается примерно у 50% лиц с нОГ и у 34-46% пациентов с БП [6]. Лечение супинной гипертензии при сопутствующей нОГ представляет собой клиническую дилемму, поскольку последствия нОГ (падения, обмороки) являются более непосредственными и опасными. Постпрандиальная гипотензия также может возникать у пациентов с БП, особенно после обильной, богатой углеводами пищи, развиваясь в течение 15 мин и сохраняясь до 3 ч; наиболее подвержены пожилые пациенты.
Пациенты с БП демонстрируют ослабленную реакцию АД и частоты сердечных сокращений на физическую нагрузку, что известно как хронотропная недостаточность [18]. Исследования с использованием сердечно-сосудистого магнитного резонанса показали наличие ремоделирования сердца у пациентов с БП. У них наблюдается увеличение индексированных конечных диастолических и систолических объемов левого и правого желудочков, а также увеличение массы миокарда по сравнению с контролем [8]. Кроме того, отмечена высокая распространенность фибрилляции предсердий у пациентов с БП, достигающая 26,7% в некоторых исследованиях [8]. Дисбаланс вегетативной нервной системы, характеризующийся снижением парасимпатической и увеличением симпатической активности, может способствовать повреждению сердца через тахикардию и вазоконстрикцию [19].
α-syn — ключевой белок, играющий важную роль в патогенезе БП. Его патологическое накопление и агрегация приводят к формированию телец Леви и нейритов Леви [22], которые являются характерными морфологическими маркерами заболевания [1, 3]. Поражённый α-syn обнаруживается не только в центральной нервной системе, но и в периферической вегетативной нервной системе, включая периферические симпатические нервы и нейроны, иннервирующие сердце, причем этот патологический процесс может начинаться уже на продромальной стадии [23]. Посмертные исследования показали, что фосфорилированный α-syn накапливается в дистальных аксонах сердечных симпатических нервов до нейрональных тел в паравертебральных симпатических ганглиях [24]. Это подтверждает, что сердечная симпатическая денервация может быть непосредственно вызвана патологией α-syn [25]. Более того, плотность α-syn в сердце значительно коррелирует с плотностью α-syn в мозге (P<0,001) [25], что указывает на системное распространение патологии α-syn. Тот факт, что патология α-syn выходит за рамки центральной нервной системы, напрямую затрагивая периферическую вегетативную нервную систему и вызывая кардиальную симпатическую денервацию, указывает на то, что это не просто сопутствующее явление, а фундаментальный патологический механизм, который напрямую связывает основную нейродегенерацию при БП с ее сердечно-сосудистыми проявлениями. Это приводит к пониманию того, что БП является системным заболеванием с мультиорганными проявлениями, а не исключительно церебральным расстройством. Эта системность также подкрепляет концепцию "body-first" БП, которая предполагает, что патология α-syn начинается в периферической нервной системе (например, в кишечной нервной системе) и затем распространяется в центральную нервную систему. В рамках этой гипотезы раннее вовлечение сердечной вегетативной нервной системы, обусловленное патологией α-syn, представляется логичным. Это означает, что сердечно-сосудистые нарушения могут быть одними из самых ранних, даже продромальных, признаков заболевания, предшествующих развитию классических моторных симптомов.
Одним из ключевых факторов, влияющих на эти патологические процессы, является окислительный стресс, определяемый как дисбаланс между производством активных форм кислорода и антиоксидантной защитой организма, играет ключевую роль в патогенезе БП и ассоциируется с нейродегенеративными и сосудистыми расстройствами [26]. Окислительный стресс тесно связан с митохондриальной дисфункцией, которая приводит к накоплению внутриклеточных активных форм кислорода, нарушению протеостаза α-syn и изменению убиквитин-протеасомной системы [27]. Накопление α-syn в митохондриях, как полагают, вызывает дефицит митохондриального комплекса I, что является критическим компонентом цепи переноса электронов и скомпрометировано в различных тканях пациентов с БП. Взаимосвязь между окислительным стрессом, митохондриальной дисфункцией и нарушением протеостаза α-syn указывает на общие молекулярные пути, которые могут способствовать развитию как нейродегенерации, так и системных, включая сердечно-сосудистые, нарушений. Это предполагает, что терапевтические стратегии, направленные на один из этих компонентов (например, антиоксиданты или модуляторы митохондриальной функции), могут иметь мультисистемный эффект, потенциально улучшая как неврологические, так и кардиологические исходы.
Хроническое воспаление, как центральное (микроглиоз, астроглиоз), так и периферическое, также вносит значительный вклад в прогрессирование БП [28]. Показано, что неправильно свернутый α-syn может напрямую играть роль в индукции воспаления. Хотя прямая причинно-следственная связь между окислительным стрессом/воспалением и специфическими сердечно-сосудистыми нарушениями при БП не всегда детально описана в доступных данных, общее участие этих процессов в сосудистых расстройствах и системных патологиях предполагает их более широкую роль. Отмечено, что сосудистые факторы риска могут играть роль в патофизиологии БП, а защитное поведение, такое как регулярная физическая активность, обратно коррелирует с развитием БП. Это указывает на потенциальную связь между системным воспалением, окислительным стрессом и сердечно-сосудистым здоровьем в контексте БП.
Патологическое накопление α-syn в центральной и периферической нервной системе приводит к компрометации симпатической иннервации сердца и барорефлекторных механизмов, что выражается в ОГ, аритмиях и структурном ремоделировании миокарда. Не-нейрогенные факторы, такие как гиповолемия, сердечная недостаточность и лекарственно-индуцированная гипотензия, усугубляют эти нарушения, повышая риск инсульта и других сердечно-сосудистых осложнений [29].
Помимо вышеописанных механизмов, значительное значение имеют психические аспекты немоторных проявлений, которые завершают обоснование системного характера патологии БП (табл. 2). Помимо двигательных нарушений и вегетативной дисрегуляции, БП характеризуется широким спектром психических и когнитивных немоторных симптомов, которые существенно снижают качество жизни пациентов и могут опосредованно способствовать развитию или усугублению сердечно-сосудистых нарушений [32]. Эти симптомы часто предшествуют моторным проявлениям и присутствуют на всех стадиях заболевания.
Депрессия и тревога относятся к числу наиболее распространённых немоторных симптомов при БП, затрагивая примерно 40-50% пациентов и зачастую проявляясь уже на ранних стадиях заболевания [33, 34]. Эти аффективные расстройства не только снижают качество жизни, но и могут быть связаны с вегетативной дисфункцией. Например, пациенты с нОГ чаще страдают от тревоги [35]. Хотя прямая причинно-следственная связь между депрессией/тревогой и специфическими сердечно-сосудистыми событиями при БП требует дальнейшего изучения, хронический стресс и дисбаланс вегетативной нервной системы, связанные с этими состояниями, могут усугублять существующие кардиологические проблемы.
Когнитивные нарушения являются еще одним значимым немоторным проявлением БП, варьирующимся от легких когнитивных расстройств до деменции при БП [36]. Примерно 25% пациентов имеют легкие когнитивные расстройства на момент постановки диагноза, а до 80% могут развить до деменции при БП в течение 15-20 лет [33]. Патофизиология когнитивных нарушений при БП включает накопление α-syn, отложение бета-амилоида, нейрофибриллярные клубки, микрососудистые повреждения, а также окислительный стресс, нейровоспаление и митохондриальную дисфункцию [36].
Психические аспекты немоторных проявлений БП могут вносить вклад в патогенез сердечно-сосудистых заболеваний несколькими путями:
- Через вегетативную дисфункцию:тревога и депрессия могут усугублять дисбаланс вегетативной нервной системы, который является основной причиной сердечно-сосудистых нарушений, таких как ОГ [35].
- Через общие патологические механизмы:когнитивные нарушения, связанные с окислительным стрессом, воспалением и патологией α-syn, указывают на системное вовлечение этих процессов, которые одновременно влияют на здоровье мозга и сердечно-сосудистой системы [36].
- Через влияние на образ жизни и лечение:тяжелые немоторные симптомы, включая психические, могут приводить к снижению физической активности, ухудшению соблюдения режима лечения и общему снижению функциональной независимости, что косвенно увеличивает сердечно-сосудистый риск [33].
Таким образом, психические аспекты немоторных проявлений БП не являются изолированными симптомами, а представляют собой часть сложного системного заболевания, которое через общие патофизиологические механизмы и влияние на вегетативную нервную систему может способствовать развитию и прогрессированию сердечно-сосудистых нарушений.
Таблица 1
Сердечно-сосудистые побочные эффекты и взаимодействия противопаркинсонических препаратов
|
Препараты |
Ключевые сердечно-сосудистые побочные эффекты |
Значимые лекарственные взаимодействия (с сердечно-сосудистой значимостью) |
|
Леводопа |
Ортостатическая гипотензия, изменения сердечного ритма (тахикардия, брадикардия, аритмии), повышение уровня гомоцистеина, гипертензия, диастолическая дисфункция левого желудочка [17] |
Симпатомиметические агенты (аддитивное повышение АД и ЧСС) [4] |
|
Эрголиновые (бромокриптин, перголид, каберголин) |
Рестриктивная клапанная болезнь сердца, легочные нарушения [4] |
Нет данных |
|
Неэрголиновые (прамипексол, ропинирол, ротиготин, апоморфин) |
Гипотензия, головокружение, внезапное засыпание, потенциальный риск сердечной недостаточности (особенно прамипексол) [4] |
Нет данных |
|
Ингибиторы МАО-Б (разагилин, селегилин, сафинамид) |
Повышенный риск гипотензии, может усугублять дискинезию, головные боли [4] |
Некоторые антидепрессанты, продукты богатые тирамином (риск гипертонического криза) [4] |
|
Антихолинергические средства (донепезил) |
Удлинение интервала QT, тахиаритмии (полиморфная желудочковая тахикардия) [17] |
Трициклические антидепрессанты (требуется тщательный мониторинг) [9] |
Сокращения: АД — артериальное давление, ЧСС — частота сердечных сокращений.
Таблица 2
Распространенные сердечно-сосудистые проявления при БП
|
Проявления |
Распространенность/ассоциация |
Ключевые клинические особенности |
|
Вегетативные дисфункции |
||
|
Ортостатическая гипотензия (ОГ и нОГ) |
30-78% пациентов с БП; симптоматическая у 16-20% [9] |
Головокружение, предобморочное состояние, обмороки, падения, утомляемость [31] |
|
Гипертензия в положении лежа |
Около 50% пациентов с вегетативной недостаточностью; часто сосуществует с ОГ [20] |
Повышенное АД в положении лежа; может усугублять дневную ОГ |
|
Постпрандиальная гипотензия |
Одно из самых ранних проявлений вегетативной дисфункции [20] |
Падение АД после еды; может быть ошибочно диагностирована как дискинезия |
|
Недиппинг АД |
Наблюдается у пациентов с БП [20] |
Ночное АД снижается менее чем на 10% или повышается; указывает на нарушение ночной регуляции АД |
|
Снижение вариабельности сердечного ритма |
Распространено при БП; может быть ранним немоторным симптомом [20] |
Индикатор измененного вегетативного баланса, сердечно-сосудистого риска [30] |
|
Аритмии |
||
|
Общие аритмии (брадикардия, тахикардия, нерегулярный ритм) |
Может напрямую влиять на частоту и ритм сердца |
Замедленный, учащенный или нерегулярный сердечный ритм |
|
Фибрилляция предсердий |
До 26-27% в одном исследовании [19] |
Риск тромбоэмболических осложнений |
|
Желудочковые аритмии |
Побочный эффект леводопы [21] |
Требует тщательного мониторинга, особенно при ишемии |
|
Структурные и ишемические заболевания сердца |
||
|
Ишемическая болезнь сердца |
Распространена, ассоциирована с атеросклеротическими факторами риска [19] |
Инфаркт |
|
Инфаркт миокарда |
Когортные исследования указывают на более высокий риск [19] |
Повреждение сердца, боль в груди |
|
Сердечная недостаточность |
Распространенность в 2,27 раза выше у пожилых пациентов с БП [19] |
Одышка, отеки, утомляемость, одна из ведущих причин смерти |
|
Цереброваскулярные изменения |
Вторая ведущая причина смерти при БП [21] |
Неврологические дефициты, может вызывать паркинсонизм |
Сокращения: АД — артериальное давление, БП — болезнь Паркинсона, нОГ — нейрогенная ортостатическая гипотензия, ОГ — ортостатическая гипотензия.
Заключение
БП характеризуется не только моторными нарушениями, но и значительными сердечно-сосудистыми дисфункциями. При этом доказательная база по таким исходам, как инфаркт миокарда и сердечно-сосудистая смертность, остаётся ограниченной, что подчеркивает необходимость дальнейших исследований.
Проблемы оценки клинической эффективности применения систем искусственного интеллекта в диагностике ишемического инсульта
Ключевые моменты
- Компьютерное зрение широко используется для маршрутизации пациентов с ишемическим инсультом.
- Точность моделей машинного обучения для диагностики ишемического инсульта по данным нейровизуализации сопоставима с точностью врачей-рентгенологов.
- В публикациях на тему точности систем искусственного интеллекта часто содержатся систематические ошибки.
- Системы искусственного интеллекта для диагностики ишемического инсульта не демонстрируют влияния на исходы пациентов в клинических исследованиях.
Key messages
- Computer vision is widely used for routing patients with ischemic stroke.
- The accuracy of machine learning models for diagnosing ischemic stroke based on neuroimaging is comparable to the accuracy of radiologists.
- Publications on the accuracy of AI systems often contain systematic bias.
- AI systems for ischemic stroke diagnosis do not show an impact on patient outcomes in clinical trials.
Основная область применения искусственного интеллекта (ИИ) в медицине — это анализ медицинских изображений. Нейронные сети позволяют ускорить интерпретацию исследования и повысить точность врача в постановке диагноза. В первую очередь ИИ в радиологии используется для диагностики патологий, требующих быстрого принятия решения.
Одна из таких патологий — ишемический инсульт. Скорость принятия решения играет важную роль в терапии острого ишемического инсульта, поскольку от времени начала симптомов до начала лечения зависит прогноз пациента. Согласно российским клиническим рекомендациям, опубликованным в 2024г, для проведения внутривенной тромболитической терапии у врача есть 4,5 ч от появления первых симптомов инсульта, а для проведения тромбэкстракции — 6 ч. Также в России действует приказ Минздрава России "Об утверждении Порядка оказания медицинской помощи больным с острыми нарушениями мозгового кровообращения", согласно которому время от поступления пациента с симптомами острого нарушения мозгового кровообращения (ОНМК) до интерпретации компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) головного мозга рентгенологом не должно превышать 40 мин.
Для более оперативного оказания помощи пациентам с ОНМК разрабатываются модели машинного обучения, автоматизирующие работу врачей на различных этапах оказания помощи. ИИ позволяет как оптимизировать процесс оказания помощи, так и увеличить точность в постановке диагноза и выборе лечения.
ИИ-сервисы для диагностики ишемического инсульта представляют собой медицинское программное обеспечение, предназначенное для автоматизации работы врача при помощи методов ИИ. Сервисы ИИ для диагностики ишемического инсульта используются в двух сценариях: сервис для "второго мнения" и инструмент для маршрутизации пациентов (рис. 1).
Рис. 1. ИИ для триажа пациентов с симптомами ОНМК.
Примечание: ИИ-сервисы для поддержки принятия врачебных решений автоматически интерпретируют данные визуализации и оценивают параметры, на основании которых лечащий врач выбирает дальнейшую тактику ведения пациента.
Сокращения: ИИ — искусственный интеллект, КТ — компьютерная томография, ОРИТ — отделение реанимации и интенсивной терапии.
В первом сценарии сервис ИИ анализирует данные визуализации и автоматически формирует заключение. Такое решение предназначено для снижения количества "пропущенных" патологий.
Во втором сценарии сервис ИИ автоматически анализирует данные визуализации и при нахождении патологии оповещает врача. Такие модели могут быть интегрированы в медицинскую информационную систему и маркировать пациентов в зависимости от вероятности патологии по данным КТ или КТ-ангиографии [1]. Врач, работающий на потоке, получает уведомление о пациенте с более вероятным наличием и рассматривает его исследование в приоритетном порядке. Такое решение даёт возможность в более короткие сроки провести тромболитическую терапию или тромбэкстракцию пациентам с острым ишемическим инсультом.
Большинство опубликованных клинических исследований показывают высокую диагностическую точность нейронных сетей, сравнимую с точностью врачей-рентгенологов. Сервисы маршрутизации пациентов с использованием ИИ многократно доказали способность сократить время от поступления в медицинское учреждение до проведения реканализации сосуда, однако в данный момент недостаточно доказательств положительного влияния ИИ на клинические исходы. Для оценки эффективности ИИ необходимы рандомизированные клинические исследования с клинически значимыми конечными точками. Более того, в исследованиях медицинского ИИ, в частности, для диагностики ишемического инсульта, встречаются систематические ошибки (bias), вызывающие опасения относительно безопасности и эффективности использования моделей ИИ.
Цель обзора — изучить доказательства клинической эффективности применения ИИ для диагностики ишемического инсульта и описать ограничения, влияющие на интерпретацию этих доказательств.
Что такое ИИ и машинное обучение?
ИИ — это область компьютерных наук, изучающая создание искусственных систем, способных выполнять задачи, традиционно требующие человеческого интеллекта. ИИ в медицине решает такие задачи, как распознавание образов, анализ данных и принятие решений на их основе. Термин "искусственный интеллект" был введён в 1950-е годы как новое направление в компьютерных науках [2].
Одним из ключевых подходов в ИИ является машинное обучение, которое позволяет алгоритмам автоматически обучаться на основе данных, выявляя в них закономерности [3]. Нейронные сети — это один из классов алгоритмов машинного обучения, вдохновлённых структурой нейронных связей человеческого мозга. Нейронные сети состоят из множества взаимосвязанных слоев, обрабатывающих входные данные, преобразуя их в сложные представления, что позволяет решать задачи высокой сложности, такие как классификация изображений или анализ медицинских данных.
Компьютерное зрение (computer vision) — это область ИИ, решающая задачи на основе анализа изображений и видео [4]. В области компьютерного зрения используются нейронные сети, осуществляющие детекцию и сегментацию объектов, а также классификацию изображений. Большая часть медицинских задач, в которых ИИ нашёл своё применение, относятся к анализу медицинских изображений. Модели машинного обучения используются в лучевой диагностике, офтальмологии, кардиологии, дерматологии, онкологии, патоморфологии, хирургии [5].
Методология исследования
Поиск публикаций на русском и английском языках производился по базам данных научной литературы PubMed и eLIBRARY. В анализ включались статьи, содержащие ключевые слова "ischemic stroke", "artificial intelligence", "radiology", "ишемический инсульт", "искусственный интеллект", "рентгенология", опубликованные с 2019 по 2025гг. Критерии исключения: статьи, опубликованные в "хищнических" журналах, согласно списку Билла. Дата последнего поиска — 21.03.2025.
В результате были получены 103 публикации. После скрининга статей по аннотациям были исключены 66 публикаций из-за несоответствия теме обзора. В финальный анализ были включены 39 обзоров, метаанализов и клинических исследований, изучающих тему эффективности ИИ для диагностики ишемического инсульта.
Результаты
Использование ИИ на каждом этапе диагностики ишемического инсульта
Нейронные сети используются как системы поддержки принятия решения для диагностики и выбора лечения при ОНМК рентгенологами, неврологами и сосудистыми хирургами. Чаще всего врачи в клинической практике сталкиваются с моделями ИИ для анализа изображений. Для автоматизированной диагностики острого ишемического инсульта разработаны сервисы, анализирующие данные бесконтрастной КТ, КТ-ангиографии, КТ-перфузии, МРТ.
Большая часть систем для диагностики ишемического инсульта детектируют и/или выделяют контуром зоны предполагаемой ишемии на бесконтрастных КТ. Примерами таких сервисов являются Rapid, Viz, qER, Avicenna, Brainomix, Deep01 и Annalise AI. Также эту задачу выполняют системы, разработанные российскими компаниями: Третье мнение КТ ГМ комплекс, NtechMed CT Brain, Sciberia Head, Цельс КС КТ ГМ и "КТ ГМ комплекс" от СберМедИИ. Помимо сегментации изображений, некоторые модели ИИ автоматически подсчитывают объём и размеры предполагаемой зоны ишемии.
Для принятия решения о проведении внутрисосудистой тромбоэкстракции при острейшей ишемии используется шкала Alberta Stroke Program Early CT Score (ASPECTS). Модели машинного обучения способны предсказывать локализацию зон ASPECTS и зоны ишемии на бесконтрастной КТ. При сопоставлении этих зон модель определяет балл по шкале ASPECTS, подобно врачу-рентгенологу. Примерами сервисов для оценки баллов ASPECTS являются Rapid-ASPECTS и e-ASPECTS [6, 7], получившие одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA). По данным метаанализа Adamou A, et al. [8], ИИ способен более точно оценивать балл по шкале ASPECT, чем врач-рентгенолог. При сравнении истинной оценки (ground truth) по шкале ASPECTS с оценкой врача-рентгенолога коэффициент межклассовой корреляции (ICC) в среднем составил 0,62, при сравнении с ИИ-сервисом — 0,72.
Помимо бесконтрастной КТ, в диагностике инсульта широко применяется КТ-ангиография, позволяющая определить локализацию поражения и выбрать тактику лечения. В практике уже используются сервисы Rapid LVO и Viz LVO [9, 10] для детектирования окклюзии больших сосудов по данным КТ-ангиографии. В исследовании Martinez JC, et al. [11] использование сервиса Viz LVO для автоматической диагностики окклюзии больших сосудов в сосудистых центрах позволило сократить время от поступления пациента до выполнения внутрисосудистой тромбэкстракции ("door-to-groin") на 11,2 мин по сравнению с центрами, в которых сервис не использовался. При прямом сравнении моделей Viz LVO и Rapid LVO на выборке из 360 исследований сервисы продемонстрировали специфичность 0,96 и 0,85, чувствительность 0,87 и 0,87, соответственно [12].
Одним из признаков острейшей ишемии является симптом гиперденсной средней мозговой артерии. Weyland CS, et al. [13] продемонстрировали способность нейронной сети детектировать симптом гиперденсной артерии с чувствительностью 0,77 и специфичностью 0,87, что сопоставимо с точностью врачей-рентгенологов.
Нейронные сети также используются для предсказания зоны пенумбры и ядра ишемии при КТ-перфузии. Одно из исследований продемонстрировало модель, определяющую зону ядра ишемии по данным КТ-перфузии со средней абсолютной ошибкой 13,8 мл при сравнении с диффузно-взвешенной МРТ [14].
Метод диффузно-взвешенной МРТ обладает 94% чувствительностью и 100% специфичностью при определении ишемического инсульта в первые 6 ч от начала развития симптомов, согласно Российским клиническим рекомендациям по лечению ишемического инсульта. Это наиболее эффективная модальность для проведения дифференциальной диагностики ишемического инсульта [15]. Для автоматической интерпретации МРТ-исследований также обучают новые модели ИИ. В метаанализ Bojsen JA, et al. [16] были включены 9 исследований, изучавших эффективность моделей машинного обучения для диагностики ишемии по данным МРТ. Чувствительность и специфичность детектирования ишемии на изображениях диффузионно-взвешенной МРТ составила 93% и 93%. По данным метаанализа Miceli G, et al. [17], ИИ-сервисы помогают определять класс инсульта по шкале TOAST по данным МРТ и КТ-ангиографии.
Помимо детектирования и сегментации зон ишемии, многие сервисы детектируют и сегментируют другие патологии, что помогает врачу-рентгенологу провести дифференциальную диагностику. Вазогенный отёк — одна из патологий, проявляющаяся на бесконтрастной КТ как гиподенсивная зона. В исследовании Newbury-Chaet I, et al. модель ИИ Annalise Enterprise CTB детектировала вазогенный отёк на КТ с чувствительностью 90,2% и специфичностью 93,5% [18]. Российский ИИ-сервис "Третье Мнение. КТ ГМ", помимо выделения зон ишемии, также определяет зоны кистозно-глиозной трансформации для дифференциации свежего ишемического инсульта вблизи участков хронических изменений.
Исследование нейровоспаления является перспективным направлением в диагностике ишемического инсульта и нейрореабилитации. Для исследования процесса нейровоспаления активно используется позитронно-эмиссионная томография с КТ с транслокационным белком 18 кДа (TSPO). Zatcepin A, et al. разработали метод количественной оценки с использованием алгоритма машинного обучения, позволяющий упростить и ускорить процесс интерпретации исследования на 10 мин по сравнению со стандартным протоколом [19].
Систематические ошибки в исследованиях ИИ для диагностики ишемического инсульта
Понятие "bias" в научных исследованиях представляет собой систематическую ошибку, приводящую к отклонению результатов от объективной истины. В контексте медицинского ИИ bias может проявляться на разных этапах разработки алгоритмов, включая сбор и обработку данных, выбор модели и интерпретацию результатов [20]. Основные источники bias в медицинском ИИ включают несбалансированные или нерепрезентативные выборки данных, методологические ошибки при обучении моделей, а также предвзятость исследователей. Такие искажения могут приводить к снижению точности диагностики и прогностических моделей для отдельных групп пациентов, что может усугублять существующие диспропорции в медицинской помощи. Выявление и минимизация bias являются критически важными задачами для обеспечения справедливости и надежности ИИ-решений в здравоохранении.
Для оценки эффективности ИИ-сервисов в клинических исследованиях необходимы новые структуры отчётов, учитывающие технические особенности моделей машинного обучения и связанные с ними риски. Для стандартизации отчетности и увеличения прозрачности данных в исследованиях ИИ были разработаны рекомендации MINIMAR (Minimum Information for Medical AI Reporting) [21], CONSORT-AI (Consolidated Standards of Reporting Trials–Artificial Intelligence) [22] и SPIRIT-AI (Standard Protocol Items: Recommendations for Interventional Trials–Artificial Intelligence) [21-23], а также специализированные рекомендации CLAIM для моделей ИИ, анализирующих изображения [24]. Все перечисленные рекомендации включают стандартные требования для исследования медицинских вмешательств и специфические требования, связанные с ИИ: описание модели, использованных данных для её разработки, процессов тестирования и валидации.
По данным систематического обзора Akay E, et al. [25], большинство исследований систем поддержки принятия врачебных решений с ИИ для диагностики ишемического инсульта не соответствуют стандартам отчётности. Только 58% исследований сообщили о разделении данных на обучающую и тестовую выборки, во многих исследованиях отсутствует информация о наличии отдельного набора данных для валидации модели. В 3% исследований информация о пациентах, чьи данные использовали для обучения модели, полностью отсутствовала. Многие исследования включали в себя неполные демографические данные пациентов в исследовании, в 8% исследований демографические данные отсутствовали.
Коммерческие нейронные сети, как правило, обучены на непубличных наборах данных. Фактически только компания-разработчик имеет информацию об алгоритмах обучения моделей, источниках данных для обучения и их количестве. Информация о частных наборах данных, приобретаемых компаниями-разработчиками, остаётся недоступной для научного и медицинского сообщества.
Использование публичных наборов данных не гарантирует высокую достоверность моделей, обученных на этих данных. Galanty M, et al. [26] выявили ряд проблем в публичных наборах данных с медицинскими изображениями и сигналами, используемых для обучения ИИ. Основные недостатки связаны с недостаточной документацией, в которой часто отсутствуют критерии включения данных, методы аннотирования, возможные ошибки и ограничения.
Разнообразие данных для обучения моделей машинного обучения — одна из наиболее распространённых проблем для медицинского ИИ [27-29]. Разработчики обязаны обеспечить не только адекватное распределение патологий, но и репрезентативную выборку по демографическим показателям. Недостаточное внимание к демографическим данным, таким как возраст, пол и раса, приводит к систематическим ошибкам в классификации и прогнозировании. Публичные наборы данных с исследованиями КТ головного мозга для обучения ИИ, такие как CQ500 [30], не содержат данных о расовой принадлежности и географическом распределении пациентов, чьи исследования вошли в набор данных.
Существуют разные подходы к распределению демографических параметров в наборе данных для обучения ИИ, и выбор правильного подхода неоднозначен. С одной стороны, тренировочный набор должен содержать достаточное количество данных, полученных от людей с разными демографическими показателями (пол, возраст, раса). С другой стороны, если распределение демографических данных будет соответствовать демографическому распределению в стране, использующей ИИ-сервис, ответы сервиса будут более достоверными.
Проблемы с аннотацией данных обусловлены отсутствием единых стандартов, что приводит к высокой вариативности разметки и ошибкам в обучении моделей. Также отмечается нехватка информации об источниках ошибок и их количественной оценке, что мешает разработчикам учитывать неопределенности при обучении. В документации часто отсутствует информация о сборе данных, включая условия их получения и личность сборщиков, что затрудняет воспроизводимость исследований.
Предвзятость публикации — один из типов bias, связанный со склонностью научных журналов и исследователей публиковать позитивные исследования чаще, чем негативные. Подавляющее большинство опубликованных исследований, изучающих эффективность ИИ в диагностике ишемического инсульта, оказываются положительными. Однако по данным систематического обзора [31] лишь 1% из всех клинических исследований медицинских ИИ-сервисов оказываются опубликованными. Поощрение публикации исследований с негативными результатами со стороны научных журналов может помочь преодолению предвзятости публикации в сфере ИИ.
Отсутствие опубликованных результатов работы не мешает сервису ИИ получить одобрение FDA или Европейского агентства медицинских средств (EMA). Leeuwen KG, et al. проанализировали 100 медицинских сервисов с ИИ, прошедших сертификацию Европейского соответствия (CE) и получивших разрешение к использованию в европейских странах [32]. 64 из 100 сервисов были одобрены на основании внутреннего анализа, проведённого разработчиками сервисов. 11 сервисов для диагностики ишемического инсульта, включённых в исследование, также вышли на рынок раньше, чем были опубликованы статьи с доказательствами их безопасности и эффективности.
Сложности оценки эффективности ИИ-сервисов
Для оценки качества работы ИИ необходима валидация на тестовой выборке исследований из источника, данные из которого не использовались для обучения модели. Благодаря внешней валидации можно определить генерализуемость модели ИИ. Kim DW, et al. [33] выявили лишь 31 исследование из 516 опубликованных исследований ИИ для анализа медицинских изображений, в которых использовался внешний набор данных для валидации моделей. При этом ни одно из исследований не включало 3 ключевых элемента дизайна: дизайн когортного исследования, многоцентровое исследование и проспективный сбор данных для валидации.
Исследования моделей ИИ, включающие валидацию на внешнем наборе данных, зачастую демонстрируют на нём более низкую точность. Анализ 83 публикаций, описывающих модели глубокого обучения для лучевой диагностики, показал, что 81% моделей имели более высокие метрики точности при внутреннем тестировании по сравнению с внешней валидацией [34].
По данным систематического обзора Mikhail P, et al. [35], большинство публикаций на тему ИИ-диагностики ишемического инсульта на бесконтрастной КТ содержали анализ чувствительности, специфичности и доли верных ответов моделей при сравнении с врачом-радиологом. Однако, чтобы оценить возможность использования ИИ в клинической практике, необходимы доказательства влияния ИИ на клинические исходы.
Самой распространённой конечной точкой в клинических исследованиях ИИ для диагностики ишемического инсульта является время "от двери до иглы" — от поступления пациента в стационар до проведения тромболитической терапии. По решению Национального симпозиума по быстрой идентификации и лечению острого инсульта (1996, Bethesda), этот показатель не должен превышать 60 мин. Большинство ИИ-сервисов, одобренных FDA и EMA, используются как инструмент маршрутизации пациентов в специализированных сосудистых центрах. Сервис автоматически анализирует исследование и при выявлении ишемического инсульта маркирует его в электронной медицинской карте. Маркировка сигнализирует врачу-рентгенологу, что исследование данного пациента необходимо рассмотреть в первую очередь, т.к. он с высокой вероятностью имеет патологию по данным КТ. Модель ИИ внутри подобной платформы для триажа пациента позволяет значимо уменьшить время до проведения тромболитической терапии и тромбэкстракции. Тем не менее в одном из исследований использование сервиса Rapid LVO для детектирования окклюзии больших сосудов по КТ-ангиографии, ранее одобренного FDA для использования в клинической практике, не позволило уменьшить время до лечения [36]. Изменение балла по шкале National Institutes of Health Stroke Scale (NIHSS) через 36 ч после тромболитической терапии оказалось выше в группе, для которой не использовалась маршрутизация с ИИ (медиана 7 для группы без ИИ и 3 с ИИ, p<0,03). Время описания исследования резидентами-рентгенологами без большого опыта было значительно ниже в группе ИИ (31,70 мин без ИИ и 20,13 мин с ИИ, p<0,0003), статистически значимых различий в группе опытных нейрорадиологов не было. В похожем исследовании сервиса Viz LVO [37], аналогичного Rapid LVO по функциональным свойствам, в качестве первичной конечной точки для оценки эффективности использовался показатель door-in-door-out (DIDO) — время нахождения пациента в первичном сосудистом центре. Медианное время DIDO в группе без использования ИИ-маршрутизации составило 210 мин, в группе с использованием ИИ — 133 мин. В качестве вторичной конечной точки исследователи использовали вероятность проведения внутрисосудистой тромбэкстракции (EVT) после перевода пациента из первичного инсультного центра в специализированный центр. В группе ИИ этот показатель оказался выше, однако увеличение не достигло статистической значимости (отношение шансов 2,13; 95% доверительный интервал: 0,88-5,13; p=0,093), что может быть связано с малым объёмом выборки. Таким образом, ведущие модели ИИ позволяют ускорить оказание медицинской помощи пациентам с ишемическим инсультом, однако пока отсутствуют убедительные доказательства их влияния на клинические исходы.
Westwood M, et al. [38] в систематическом обзоре, посвящённом клинической и экономической эффективности программного обеспечения для диагностики ишемического инсульта, отмечают, что дизайн исследований не позволяет сделать выводы об эффек- тивности в реальной клинической практике. Ни одно из 22 проанализированных исследований не оценивало программное обеспечение с ИИ в условиях, соответствующих заявленному применению — в связке с врачом, как предполагается производителями. Практически все исследования изучали эффективность ИИ как автономной системы, что не отражает его предполагаемое использование в клинической практике. В другом случае, исследования ИИ-систем для триажа пациентов являются наблюдательными исследованиями, оценивающими время оказания помощи до и после внедрения ИИ в процесс маршрутизации. В данных исследованиях отсутствовала информация о ложноотрицательных ответах ИИ-моделей. Таким образом, нельзя сделать выводы о количестве случаев ишемического инсульта, пропущенных моделью ИИ.
В данный момент в Российской Федерации зарегистрированы 5 медицинских изделий с ИИ для автоматизации диагностики ишемического инсульта: Третье мнение КТ ГМ комплекс, NtechMed CT Brain, Sciberia Head, Цельс КС КТ ГМ, КТ ГМ комплекс от СберМедИИ. Каждый из этих сервисов осуществляет сегментацию зоны ишемии. Также данные сервисы детектируют и сегментируют кровоизлияния, что позволяет дифференцировать геморрагический и ишемический инсульт и выявить противопоказания для проведения тромболитической терапии.
Комплексный сервис "КТ головного мозга" компании-разработчика "СберМедИИ" — единственный российский сервис ИИ для диагностики ишемического инсульта, опубликовавший результаты исследования эффективности [39]. В рамках исследования сервис обработал 703 бесконтрастных КТ из одного медицинского центра и при ретроспективном сравнении с заключениями рентгенологов продемонстрировал высокую диагностическую точность: чувствительность — 89%, специфичность — 98%, точность — 98%. Значительным ограничением данного исследования являются критерии исключения. Из анализа исключались КТ-исследования с наличием "нецелевой патологии", что делает выборку нерепрезентативной.
Несмотря на отсутствие публикаций, посвящённых другим российским ИИ-сервисам для диагностики ишемического инсульта, их точность регулярно оценивается в ходе "Эксперимента по использованию инновационных технологий в области компьютерного зрения для анализа медицинских изображений и дальнейшего применения в системе здравоохранения города Москвы", запущенного в 2019г Правительством Москвы [40]. В рамках данного эксперимента лучевые исследования (в частности, КТ головного мозга), выполняемые в медицинских учреждениях города Москва, автоматически направляются разработчикам ИИ-сервисов для обработки ИИ-сервисом. Результаты обработки исследования становятся доступны врачу-рентгенологу, предоставляя "второе мнение". Оценка сервисов проводится экспертами ежеквартально. Сервисы оцениваются на основании параметра площади под кривой (AUC), отражающей способность модели различать положительные и отрицательные случаи ишемического инсульта и внутричерепных кровоизлияний. Показатели AUC участников Эксперимента в период 4 квартала 2024г1 для сервисов Третье мнение КТ ГМ комплекс, Цельс КС КТ ГМ, NTechMedCT Brain Complex составили 0,92; 0,8907; 0,8637, соответственно. Таким образом, разработанные в России модели ИИ для диагностики патологий на бесконтрастной КТ головного мозга имеют высокую диагностическую точность.
Заключение
Применение ИИ в диагностике ишемического инсульта является перспективным направлением, способным повысить оперативность и точность выявления патологии. Современные ИИ-модели демонстрируют сопоставимую с врачами-рентгенологами диагностическую точность.
Публикации, доказывающие эффективность ИИ в реальной клинической практике, имеют ряд ограничений. В большинстве публикаций, посвящённых ИИ-сервисам для диагностики ишемического инсульта, недостаточно описаны данные, использованные для обучения моделей ИИ, процессы разработки и тестирования моделей. Несмотря на положительное влияние ИИ-сервисов для маршрутизации пациентов на сокращение времени до начала лечения, влияние на исходы не доказано клиническими исследованиями. Проблема оценки эффективности особенно актуальна для моделей ИИ, разработанных в России, т.к. научные данные о точности и безопасности этих моделей, за исключением сервиса "КТ головного мозга", отсутствуют на момент написания данного обзора.
В связи с указанными выше ограничениями, оценка пользы применения ИИ-сервисов для диагностики инсульта в клинической практике остаётся нерешённой задачей на текущий момент. Для её решения необходим анализ влияния ИИ на клинические исходы в исследованиях и увеличение прозрачности данных в публикациях, посвящённых моделям для диагностики ишемического инсульта.
1 https://mosmed.ai/media/Матрица_зрелости_ИИ_сервисов_4_кв_2024_v.1.pdf.
Периоперационная терапия комбинацией сакубитрил/валсартан у взрослых пациентов, подвергающихся кардиохирургическим вмешательствам: систематический обзор и метаанализ
Ключевые моменты
- Применение ангиотензиновых рецепторов и неприлизина ингибитора в периоперационном периоде при кардиохирургических вмешательствах изучено в ограниченной и гетерогенной серии исследований.
- Согласно проведенному систематическому обзору, терапия комбинацией сакубитрил/валсартан в периоперационном периоде продемонстрировала безопасность и эффективность.
Key messages
- The use of angiotensin receptor-neprilysin inhibitors in the perioperative period in cardiac surgery has been studied in a limited and heterogeneous series of studies.
- According to the conducted systematic review, therapy with a combination of sacubitril/valsartan in the perioperative period demonstrated safety and efficacy.
Графический абстракт
Сокращения: АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор, ИЖС — искусственный желудочек сердца, КДР — конечный диастолический размер, КШ — коронарное шунтирование, ЛЖ — левый желудочек, ФВ — фракция выброса.
Регуляция работы сердечно-сосудистой системы и ее ключевого показателя — сердечного выброса, остаются одной из самых актуальных проблем в изучении и лечении пациентов с хронической сердечной недостаточностью (СН). За последнее десятилетие значительно расширился арсенал врача-кардиолога в аспекте терапевтического ведения этой группы пациентов, и одним из препаратов, доказавших свою эффективность, является ангиотензиновых рецепторов и неприлизина ингибитор (АРНИ) [1, 2]. Вместе с тем продолжаются исследования, цель которых — определение его эффектов в более узких клинических ситуациях, одной из таких ситуаций является кардиохирургическое вмешательство [3]. Однако в настоящее время использование первого представителя АРНИ — комбинации сакубитрила и валсартана — в данной группе пациентов в периоперационном периоде ограничивается только единичными одноцентровыми обсервационными клиническими исследованиями с небольшими размерами выборки [4, 5]. В свете этих недостатков мы провели систематический обзор исследований, в которых изучались безопасность и эффективность терапии комбинацией сакубитрил/валсартан, в т.ч. его влияние на течение периоперационного периода у взрослых пациентов, подвергающихся кардиохирургическим вмешательствам.
Методология исследования
Поиск публикаций и отбор исследований. Алгоритм поиска информации был разработан в соответствии с требованиями и положениями отчетности для систематических обзоров и метаанализов (PRISMA) в базах данных PubMed (MEDLINE), Google Scholar и Cochrane library. Последний поиск данных для включения в данный анализ был проведен 1 августа 2024г. Для поиска исследований в базе данных PubMed (MEDLINE) и Cochrane library мы использовали следующие ключевые слова: ((sacubitril/valsartan) OR (ARNI)) AND (cardiac surgery)). Для поиска исследований в базах данных Google Scholar мы использовали следующие ключевые слова: ("sacubitril/valsartan" OR "ARNI") AND ("cardiac surgery" OR "perioperative therapy" OR "perioperative management" OR "perioperative period"). Для отбора подходящих исследований для включения в этот систематический обзор трое авторов (Д.П., Б.Б. и А.В.) независимо друг от друга изучили абстракты и полнотекстовые отчеты на соответствие критериям включения. Все разногласия относительно соответствия конкретных исследований для включения в окончательный перечень были разрешены путем обсуждения авторов.
Критерии включения и исключения. Основным критерием включения первичных исследований в систематический обзор было применение АРНИ в периоперационном периоде у взрослых пациентов, подвергшихся кардиохирургическим вмешательствам на "открытом сердце" с адекватно представленными исходными показателями и данными о клинических исходах. Статьи на других языках кроме английского, доклинические исследования, клинические случаи, обзоры и мнения экспертов исключались из систематического обзора.
Оценка методологического качества. Качество исследований определялось по шкале оценки качества когортных исследований Ньюкасл-Оттава [6]. Оценка исследований проводилась на основе определения следующих основных критериев: отбор исследовательских групп; сопоставимость групп; и установка интересующего исхода. Оценка систематической ошибки (risk of bias) в единственном рандомизированном клиническом исследовании проводилась в соответствии с Кокрановскими критериями оценки методологического качества (RoB 2 tool) [7].
Конечные точки исследований. Во включенных исследованиях определены гетерогенные конечные точки. Так, в двух исследованиях оценивалась терапия АРНИ при имплантации искусственного желудочка сердца (ИЖС) и пересадке сердца, общими конечными точками были летальность, необходимость проведения заместительной почечной терапии (ЗПТ). Также оценивалась частота развития вазоплегического синдрома и необходимость подключения экстракорпоральной мембранной оксигенации [8, 9]. В других двух исследованиях у пациентов с "ишемической кардиомиопатией", которым проводилось изолированное коронарное шунтирование (КШ), общими первичными конечными точками были развитие симптомной гипотонии, изменение уровней калия и креатинина [3, 5]. В трех исследованиях терапии АРНИ у пациентов с клапанной патологией общими конечными точками были изменение фракции выброса (ФВ) левого желудочка (ЛЖ), конечного диастолического размера (КДР) ЛЖ. Также оценивалась частота развития гипотонии, изменение концентрации натрийуретических пептидов (НУП) и изменение уровня креатинина, функция почек [4, 8, 9].
Статистический анализ. Статистическая обработка данных выполнялась в программе Review Manager (RevMan), версия 5.4.1 (The Cochrane Collaboration, 2020). Графически основные результаты представлены в виде "форест" диаграммы (forest plot). Проверка статистической неоднородности исследований осуществлялась с помощью Q-теста на основе χ2, а также индекса гетерогенности I2. Интерпретация оценки статистической гетерогенности, согласно индексу I2 проводилась по рекомендациям Кокрановского сообщества, согласно которому I2=0-40% соответствует незначительной гетерогенности; 30-60% — умеренной гетерогенности; 50-90% — значительной гетероген- ности; 75-100% — высокой гетерогенности. Модель случайных эффектов была принята при Р<0,1 в тесте χ2 и I2>40%, модель фиксированного эффекта при Р≥0,1 в тесте χ2 и I2≤40%. Выраженность эффекта оценивали с помощью относительного риска (RR) с указанием 95% доверительного интервала (ДИ). Эффект считался статистически значимым при p<0,05. Оценка публикационного смещения не проводилась, учитывая ограниченное число включенных в метаанализ исследований.
Результаты
Результаты поиска литературы. В результате поиска по ключевым словам в базе данных PubMed (MEDLINE), Google Scholar и Cochrane Library всего найдено 459 публикаций. Число публикаций после удаления дубликатов составило 425. После анализа заголовков и их аннотаций поставленной цели соответствовала 31 публикация. Полнотекстовый скрининг прошли 14 публикаций. Основной причиной невключения публикаций в окончательный анализ после полнотекстового скрининга являлось несоответствие поставленной цели и критериям включения. Таким образом, окончательно в данный систематический обзор были включены 7 исследований. Процесс отбора релевантных исследований показан на рисунке 1.
Общая характеристика исследований. Общее количество включенных в систематический обзор пациентов составило 707, из них 452 — мужчины (63,9%). Средний возраст пациентов составил 60,0 лет. Данные о дизайне исследования, конечных точках, исходных характеристиках пациентов, в т.ч. метода оперативного вмешательства, обобщены в таблицах 1 и 2.
Во всех исследованиях исходным показанием к назначению АРНИ была СН, при этом в большинстве исследований ФВ ЛЖ была <40%, в исследовании Peng W, et al. проводился сравнительный анализ подгрупп с ФВ ЛЖ ≥50% и <50% [9], а в исследовании Hoshino J, et al. ФВ ЛЖ в среднем составила 55% [8], однако в последней работе следует отметить, что большинство больных оперировались по поводу клапанной болезни сердца, в т.ч. по поводу тяжелой митральной регургитации.
В исследованиях, которые были включены в наш анализ, пациентов подвергали различным хирургическим вмешательствам. Учитывая крайне гетерогенные группы, с целью проведения дальнейшего анализа исследований мы разделили пациентов в зависимости от характера хирургического вмешательства. Так, в первой группе пациентов были выполнены имплантация ИЖС или пересадка сердца, во второй группе больных с ишемической кардиомиопатией — изолированное КШ, и, наконец, в третьей группе — хирургические вмешательства по поводу клапанной болезни сердца или сочетанное вмешательство по поводу клапанной болезни и ишемической болезни сердца (ИБС). Характеристики конечных точек в зависимости от типа оперативного вмешательства представлены в таблице 3.
Терапия АРНИ при имплантации ИЖС и пересадке сердца
Проанализированы исследования Dominguez JM, et al. [10] и Haider L, et al. [11], включившие 96 и 73 пациента, соответственно. В первую работу были включены пациенты, перенесшие ортотопическую трансплантацию сердца (ОТС), в т.ч. после имплантации ИЖС (8,3%) [10]. При этом 14 пациентов (14,6%) получали терапию комбинацией сакубитрил/валсартан. В другое исследование были включены 73 пациента с различными вариантами кардиомиопатий, которым выполнена ОТС (74,0%) или имплантация ИЖС (26,0%), при этом в данном исследовании 22 пациента (30,1%) получали терапию сакубитрил/валсартан [9]. В обоих исследованиях главной целью являлась оценка связи назначения АРНИ с развитием синдрома послеоперационной вазоплегии, который определялся как необходимость высокой дозы вазопрессорной поддержки (норэпинефрин >0,5 мкг/кг/мин) для поддержания среднего артериального давления (АД) >65 (70) мм рт.ст. длительностью >24 (48) ч после операции. В исследовании Haider L, et al. группа АРНИ сравнивалась как с общим количеством пациентов, принимавших другие препараты, так и с пациентами, не принимавшими медикаменты, влияющие на ренин-ангиотензин-альдостероновую систему (РААС). Последняя группа включена в наш метаанализ. Общее количество случаев развития вазоплегии в обоих исследованиях составило 30 пациентов (23,8%), при этом в группе АРНИ частота составила 36,1%, в контрольной группе — 18,9%. По результатам метаанализа продемонстрировано, что частота развития вазоплегии значимо не различалась между рассмотренными группами (RR 0,69; 95% ДИ: 0,40-2,30; р=0,92). Тест на неоднородность не был значимым, р=0,24, I2=29% (рис. 2).
Другими конечными точками в исследованиях являлись госпитальная (или 30-дневная) летальность, потребность в ЗПТ, экстракорпоральной поддержке кровообращения, которые статистически не различались между группами АРНИ и контрольной. Обе работы указывают на более высокие дозы норэпинефрина, характерные для группы АРНИ, достигающие 0,6-1,0 мкг/кг/мин (р>0,05). Также в обеих работах подчеркнута связь развития вазоплегии с неблагоприятными исходами. При этом Dominguez JM, et al. в результате многофакторного анализа выделили единственный независимый предиктор ее развития — повышенный уровень креатинина крови (р=0,04). Интерес представляет и другой вывод Haider L, et al. — применение блокаторов РААС ассоциировано со снижением смертности в общей группе (отношение шансов (ОШ) 0,11; 95% ДИ: 0,02-0,55; p=0,009 для АРНИ и ОШ 0,20; 95% ДИ: 0,06-0,69; p=0,011 для других блокаторов РААС) [11]. Таким образом, в представленных исследованиях продемонстрировано отсутствие влияния назначения АРНИ на развитие вазоплегии и других неблагоприятных событий, а также снижение госпитальной летальности на фоне терапии препаратами группы блокаторов РААС.
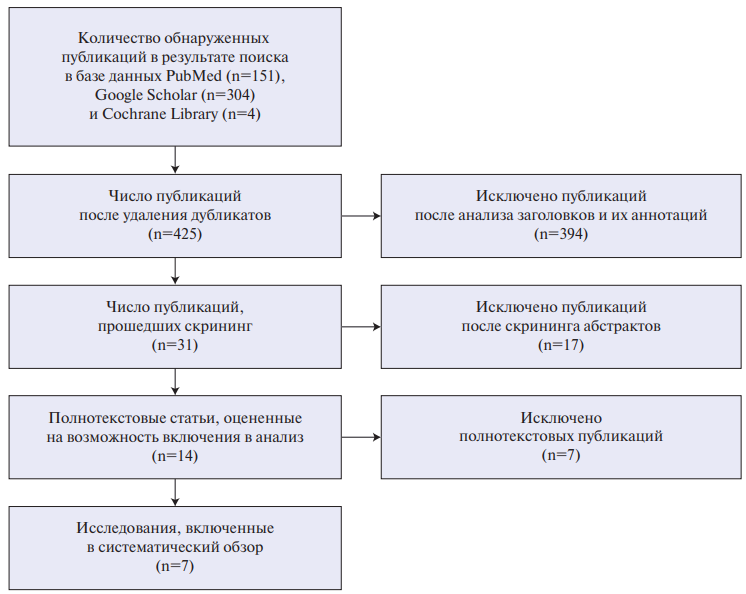
Рис. 1. Блок-схема отбора включенных в обзор исследований.
Таблица 1
Общая характеристика исследований, включенных в систематический обзор
|
Автор, год |
Дизайн |
Пациенты (n) |
Длительность наблюдения |
Критерии включения |
Критерии исключения |
Конечные точки |
|
Dominguez JM, 2020 [10] |
Ретроспективное исследование |
96 |
Госпитальный период (19-49 дней) |
Возраст старше 18 лет, выполнение ОТС |
Детский возраст, противопоказания к выполнению ОТС |
Госпитальная смертность, потребность в ЭКМО, ЗПТ, дисфункция трансплантата |
|
Haider L, 2021 [11] |
Ретроспективное исследование |
73 |
30 дней |
Возраст старше 18 лет, выполнение ОТС или имплантации ИЖС |
Детский возраст, противопоказания к выполнению ОТС и имплантации ИЖС |
30-дневная летальность, развитие вазоплегического синдрома, продолжительность пребывания в ОРИТ, ИВЛ, КТП норэпинефрином, необходимость проведения ЗПТ, мезентериальная или периферическая ишемия, кровотечение, инфекционные осложнения |
|
Peng W, 2022 [9] |
Обсервационное исследование |
59 |
28 дней |
Возраст >18 лет, начало терапии АРНИ в течение 7 дней до и 7 дней после операции, ФВ ЛЖ <50% или ФВ ЛЖ >50% и BNP >35 пг/мл и/или NT-proBNP >125 пг/мл, сопутствующее структурное заболевание сердца и/или диастолическая дисфункция, клиника СН |
Госпитальная смерть, терапия АРНИ <28 дней после операции, отсутствие ЭхоКГ до и после терапии АРНИ |
Первичные конечные точки: изменение ФВ ЛЖ и КДР ЛЖ; Вторичные конечные точки: изменение уровня креатинина, азота мочевины крови |
|
Narayan P, 2022 [5] |
Проспективное обсервационное исследование |
30 |
6 мес. |
Пациенты, перенесшие первичное, изолированное, плановое КШ без ИК с ФВ ЛЖ <40% |
Пациенты с известной почечной недостаточностью |
Первичные конечные точки: изменения уровней калия, креатинина и мочевины; возникновение гипотонии в течение периода наблюдения 6 мес. Вторичная конечная точка: улучшение ФВ ЛЖ |
|
Zheng J, 2023 [4] |
Ретроспективное одноцентровое исследование |
259 |
6 мес. |
Пациенты, не принимающие АРНИ, подвергшиеся операции по поводу клапанной патологии сердца с ХСН согласно рекомендациям ЕОК по СН от 2016г |
Клапанная патология на фоне ИБС, требующей реваскуляризации миокарда, тяжелая аритмия, ОСН, кардиогенный шок, ЗПТ, печеночная недостаточность |
Улучшение ФК СН по NYHA, возникновение гипотонии, изменение уровней NT-proBNP, креатинина. Изменение эхокардиографических показателей: СВ, ФВ ЛЖ, КДР ЛЖ, КСР ЛЖ, размеров ЛП |
|
Hoshino J, 2024 [8] |
Проспективное обсервационное исследование |
113 |
34 мес. |
Возраст >18 лет, прием иАПФ/БРА до операции, перенесенная операция по поводу клапанной патологии, патологии коронарных артерий |
Гипотония (САД <95 мм рт.ст.) и/или клинически значимая гипотония до операции, гиперкалиемия (К >5,4 ммоль/л), диализ, пациенты, потребность усиленной гипотермии во время ИК |
Первичные конечные точки: изменение концентрации ANP, активности ренина плазмы после начала приема АРНИ. Вторичные конечные точки: необходимость отмены АРНИ из-за побочных реакций, изменение концентраций NT-proBNP и BNP, нарушение функции почек и впервые возникшая ПОФП |
|
Nurzhanova M, 2024 [3] |
Рандомизированное открытое контролируемое исследование |
77 |
6 мес. |
Пациенты старше >40 лет с ФВ ЛЖ <45% и II-IV ФК по NYHA на ранней стадии после КШ |
Повышенная чувствительность к сакубитрилу, иАПФ, БРА или любому компоненту АРНИ; САД <100 мм рт.ст., СКФ <30 мл/мин/1,73 м2; уровень калия >5,4 ммоль/л; анамнез ангионевротического отека; тяжелое заболевание легких; анамнез перипартальной КМП или КМП, связанной с противоопухолевой терапией; тяжелое заболевание печени, цирроз, холестаз; двусторонний стеноз почечных артерий; гемодинамически значимые ВПС, за исключением вторичной МР |
Первичные конечные точки: ухудшение функции почек (снижение расчетной СКФ ≥25%), гиперкалиемия (≥5,5 ммоль/л), симптоматическая гипотензия (САД <100 мм рт.ст.) и ангионевротический отек или любое другое нежелательное явление, предположительно связанное с приемом АРНИ. Вторичные конечные точки: качество жизни по опроснику (MLHFQ), изменения уровня NT-proBNP и теста 6-минутной ходьбы |
Сокращения: АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор, БРА — блокатор рецепторов ангиотензина, ВПС — врожденный порок сердца, ЕОК — Европейское общество кардиологов, ЗПТ — заместительная почечная терапия, иАПФ — ингибитор ангиотензинпревращающего фактора, ИБС — ишемическая болезнь сердца, ИВЛ — искусственная вентиляция легких, ИЖС — искусственный желудочек сердца, ИК — искусственное кровообращение, КДР ЛЖ — конечный диастолический размер левого желудочка, КМП — кардиомиопатия, КСР ЛЖ — конечный систолический размер левого желудочка, КТП — кардиотоническая поддержка, КШ — коронарное шунтирование, ЛП — левое предсердие, МР — митральная регургитация, НД — нет данных, ОРИТ — отделение реанимации и интенсивной терапии, ОСН — острая сердечная недостаточность, ОТС — ортотопическая трансплантация сердца, ПОФП — послеоперационная фибрилляция предсердий, САД — систолическое артериальное давление, СВ — сердечный выброс, СКФ — скорость клубочковой фильтрации, СН — сердечная недостаточность, ФВ ЛЖ — фракция выброса левого желудочка, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, ЭКМО — экстракорпоральная мембранная оксигенация, ЭхоКГ — эхокардиография, ANP — предсердный натрийуретический пептид, BNP — мозговой натрийуретический пептид, NT-proBNP — N-концевой промозговой натрийуретический пептид, NYHA — New York Heart Association Functional Classification.
Таблица 3
Клиническая характеристика применения АРНИ
|
Автор, год |
Группы (N) |
Артериальная гипотензия |
НУП |
ФВ ЛЖ |
КДР ЛЖ |
Функция почек |
Отмена или снижение дозы АРНИ |
КТП |
|
Dominguez JM, 2020 [10] |
АРНИ (14) |
НД (развитие вазоплегии в 7%) |
НД |
НД |
НД |
ЗПТ — 1 (7%) |
НД |
Максимальная доза норэпинефрина 0,6 (0-0,29) мкг/кг/мин |
|
Контроль (82) |
НД (развитие вазоплегии в 17%) |
НД |
НД |
НД |
ЗПТ — 10 (12%) |
НД |
Максимальная доза норэпинефрина 0,34 (0,07-0,7) мкг/кг/мин |
|
|
Haider L, 2021 [11] |
Вазоплегия (+) (25) |
НД |
НД |
НД |
НД |
ЗПТ — 17 (68,0%) |
НД |
НД |
|
Вазоплегия (–) (48) |
НД |
НД |
НД |
НД |
ЗПТ — 14 (29,2%) |
НД |
НД |
|
|
Peng, 2022 [9] |
СНсФВ (28) |
НД |
НД |
Существенно не изменилась (p=1,0) |
Уменьшение на 10,4 мм (p=0,004) |
Концентрация креатинина значимо не изменилась за все время наблюдения в обеих группах (p=0,268) |
Не отменялся |
НД |
|
СНнФВ (31) |
НД |
НД |
Увеличение на 10,7% (p<0,001) |
Уменьшение на 10,8 мм (p=0,001) |
||||
|
Narayan P, 2022 [5] |
– |
4 (13,3%) |
НД |
30,8±5,2 (до операции), 41,6±9,6 (через 6 нед.), 44,0±8,5 (через 6 мес.), p1-2<0,0001, p2-3=0,001 |
НД |
Увеличение уровня креатинина и калия через 6 мес. в пределах референсных значений (р=0,02 и р=0,003) |
3 пациента (10%) снизили дозу АРНИ 24 26 мг из-за гипотензии; 2 пациента прекратили прием: 1 пациент из-за гипотензии и 1 пациент из-за финансовых ограничений |
НД |
|
Zheng J, 2023 [4] |
АРНИ (172) |
САД снизилось на 13,13±23,98 мм рт.ст. в группе АРНИ и на 1,81±10,89 мм рт.ст. в контрольной группе (р<0,001); ДАД снизилось на 8,28±17,79 мм рт.ст. в группе АРНИ и на 2,3±11,41 мм рт.ст. в контрольной группе (р=0,005) |
Снижение НУП на 902,0 (-2226,0, -269,5) пг/мл в группе АРНИ и на 535,0 (-1738, -7,0) пг/мл в контрольной (р=0,029) |
Увеличение ФВ ЛЖ на 11,14±0,16% в группе АРНИ и на 7,15±11,18% в контрольной (р=0,004) |
Уменьшение КДР ЛЖ на 3,58±9,21 мм в группе АРНИ и на 0,27±14,44 мм в контрольной (р=0,026) |
Концентрация креатинина и СКФ значимо не изменились за все время наблюдения в обеих группах (р=0,807) |
НД |
НД |
|
Контроль (87) |
НД |
|||||||
|
Hoshino J, 2024 [8] |
– |
Симптомная гипотензия у 10 (15,9) пациентов в группе АРНИ, в контрольной группе эпизодов симптомной гипотензии не было |
В группе АРНИ уровень ANP значимо увеличился к третьему дню (р=0,0142); BNP и NT-proBNP значимо не менялись |
НД |
НД |
Концентрация креатинина и СКФ значимо не изменились за все время наблюдения в обеих группах (p=0,146 и p=0,518, соответственно) |
Отмена АРНИ у 13 пациентов (20,6%), из них: 10 (15,9%) из-за гипотонии, 3 (4,7%) из-за почечной дисфункции, гиперкалиемии и головокружения |
НД |
|
Nurzhanova M, 2024 [3] |
Ранняя инициация АРНИ (37) |
1 (2,7%) |
NT-proBNP: 1439 пг/мл до операции; 554 пг/мл после операции (p<0,001) |
НД |
НД |
Ухудшение функции почек — 1 (2,7%), гиперкалиемия — 3 (8,1%) |
1 пациент (2,5%) сыпь |
НД |
|
Поздняя инициация АРНИ (36) |
1 (2,7%) |
NT-proBNP 1389 пг/мл до 1004 пг/мл после (p=0,7) |
НД |
НД |
Ухудшение функции почек — 3 (8,3%), гиперкалиемия — 3 (8,1%) |
2 пациента (5,2%) головокружение |
НД |
Сокращения: АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор, ДАД — диастолическое артериальное давление, ЗПТ — заместительная почечная терапия, КДР ЛЖ — конечный диастолический размер левого желудочка, КТП — кардиотоническая поддержка, НД — нет данных, НУП — натрийуретический пептид, САД — систолическое артериальное давление, СКФ — скорость клубочковой фильтрации, СНнФВ — сердечная недостаточность с низкой фракцией выброса, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, ФВ ЛЖ — фракция выброса левого желудочка, ANP — предсердный натрийуретический пептид, BNP — мозговой натрийуретический пептид, NT-proBNP — N-концевой промозговой натрийуретический пептид.
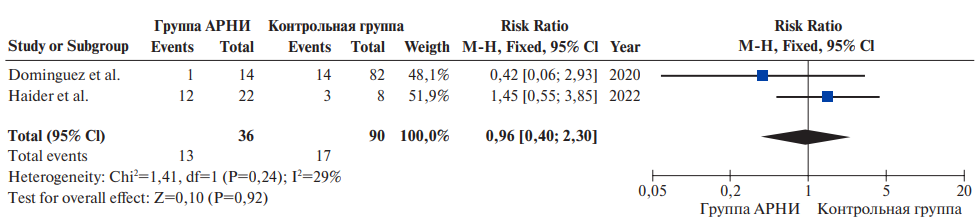
Рис. 2. "Форест" диаграмма RR развития синдрома вазоплегии при назначении АРНИ и в контрольной группе.
Сокращение: АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор.
АРНИ у пациентов при выполнении КШ
В двух исследованиях Narayan P, et al. [5] и Nurzhanova M, et al. [3] были включены пациенты с "ишемической кардиомиопатией", которым проводилось изолированное КШ. В исследование Narayan P, et al. было включено 30 пациентов, которые подверглись КШ без искусственного кровообращения, в то время как в работе Nurzhanova M, et al. в анализ было включено 80 пациентов, перенесших КШ. Исходные характеристики пациентов, включенных в исследования, представлены в таблице 2. В обоих исследованиях первичной конечной точкой являлся аспект безопасности и переносимости АРНИ после операции. В исследовании Narayan P, et al. терапия АРНИ в низких дозах (сакубитрил 24 мг/валсартан 26 мг) была инициирована в послеоперационном периоде сразу после гемодинамической стабилизации пациентов и в дальнейшем проводилась титрация дозы препарата в период амбулаторного наблюдения (6 мес.) до умеренной дозы препарата 100 мг (сакубитрил 49 мг/валсартан 51 мг перорально) два раза в день [5]. В течение 6 мес. артериальная гипотония, потребовавшая снижение дозы (сакубитрил 24 мг/валсартан 26 мг) возникла у трех больных (10%), у двоих пациентов АРНИ был отменен, основные причины отмены АРНИ представлены в таблице 3. Следует отметить, что несмотря на то, что уровни креатинина и калия к 6 мес. находились в пределах референсных значений, их уровни статистически значимо повысились по сравнению с исходным уровнем и сроком 6 нед. после операции (табл. 3).
В исследовании Nurzhanova M, et al. пациенты были рандомизированы в группу ранней (после стабилизации гемодинамики) и поздней (от 2 до 4 нед.) инициации АРНИ после КШ [3]. В целом частота артериальной гипотензии, в т.ч. частота отмены АРНИ вследствие нежелательных явлений, частота ухудшения функции почек и гиперкалиемия в обеих группах была низкой и статистически значимо не различалась между группами ранней и поздней инициации АРНИ (табл. 3).
В обоих исследованиях вторичной конечной точкой являлся аспект эффективности терапии АРНИ на течение хронической СН после КШ. Так, в работе Narayan P, et al. выявлено значительное улучшение ФВ ЛЖ как через 6 нед. после КШ (с 30,8±5,2% до 41,6±9,3%), так и к 6 мес. после операции (44,0±8,47%). В исследовании Nurzhanova M, et al. было показано снижение уровня N-концевого промозгового НУП (NT-proBNP) к 6 мес. в обеих группах, однако статистически значимое снижение уровня NT-proBNP отмечалась лишь в группе ранней инициации АРНИ (p<0,001). Кроме того, через 6 мес. в обеих группах отмечалось значительное улучшение качества жизни согласно опроснику MLHFQ, однако разница в улучшении показателей качества жизни снова была более выраженной также в группе ранней инициации (-16, p<0,001) по сравнению с поздней инициацией АРНИ (-9, p<0,026) после КШ. Наконец, в обеих группах отмечалось статистически значимое улучшение результатов теста 6-мин ходьбы (p<0,001). Таким образом, согласно результатам вышеуказанных исследований, у пациентов с ишемической кардиомиопатией, подвергшихся КШ, терапия АРНИ после операции, в т.ч. ее ранняя инициация после вмешательства, является безопасной, хорошо переносимой и эффективной стратегией терапии в дополнение к хирургическому лечению.
АРНИ при коррекции клапанной патологии (в том числе с ИБС)
В трех исследованиях Peng W, et al. [9], Zheng J, et al. [4] и Hoshino J, et al. [8] были включены пациенты, которым проводилось оперативное лечение по поводу клапанной патологии. В исследование Peng W, et al. [9] было включено 59 пациентов, получавших терапию сакубитрил/валсартаном в течение 7 дней до и минимум 28 дней после операции. Пациенты были разделены на 2 группы в зависимости от ФВ ЛЖ (≥50%, n=28, и <50%, n=31). В исследованиях Zheng J, et al. [4] и Hoshino J, et al. было включено 259 и 113 пациентов, соответственно. В обоих исследованиях пациенты были поделены на 2 группы — исследуемая и контрольная. Исследуемая группа получала терапию АРНИ (только в послеоперационном периоде), контрольная — нет. Пациентам исследования Hoshino J, et al. помимо операций по поводу клапанной патологии были выполнены также операции по поводу ИБС и патологии корня аорты [8].
Общими конечными точками трех исследований стали изменение концентрации креатинина крови, изменение эхокардиографических показателей (ФВ ЛЖ, КДР ЛЖ), изменение уровней НУП (табл. 1).
В исследовании Peng W, et al. терапия АРНИ была назначена всем 59 пациентам [9]. Доза препарата варь- ировалась в зависимости от переносимости, развития артериальной гипотонии (частота развития артериальной гипотонии не указывается). Помимо АРНИ пациенты получали петлевые диуретики, бета-блокаторы, дигоксин и спиронолактон. К концу периода наблюдения, который составил 28 дней, в группе пациентов с ФВ ЛЖ <50% отмечалось статистически значимое увеличение ФВ ЛЖ (p<0,001). Одновременно в двух исследованиях (Peng W, et al. [9], Zheng J, et al. [4]) наблюдалось статистически значимое уменьшение КДР ЛЖ у пациентов, принимавших АРНИ. В работе Zheng J, et al. также продемонстрировано значимое увеличение ФВ ЛЖ (р=0,004) и снижение концентрации НУП в исследуемой группе по сравнению с контрольной (р=0,029) [4].
В двух исследованиях Zheng J, et al. [4] и Hoshino J, et al. [8] было отмечено статистически значимое снижение АД в исследуемых группах. В работе Zheng J, et al. на фоне значимого снижения систолического АД и диастолического АД (р<0,001 и р=0,005, соответственно) клинических проявлений гипотонии не отмечалось, соответственно, препарат не отменялся [4]. Тогда как в работе Hoshino J, et al. в 15,9% случаев АРНИ был отменен в исследуемой группе из-за развития клинически значимой гипотонии (р=0,0142) [8]. Во всех трех исследованиях не было отмечено статистически значимых изменений уровня креатинина и скорости клубочковой фильтрации (табл. 3) [4, 8, 9]. Таким образом, применение препарата АРНИ в периоперационном периоде по поводу клапанной патологии у взрослых пациентов с СН оказалось безопасным и эффективным.
Обсуждение
В 2024г отметили 10 лет появления в кардиологический практике препарата АРНИ, а именно, сакубитрил/валсартана. Тогда впервые за десятилетия в группе пациентов с СН с низкой ФВ (СНнФВ) новый препарат в исследовании PARADIGM-HF произвел настоящий триумф, поскольку превзошёл "золотой стандарт" сравнения, а именно эналаприл, в отношении жестких конечных точек [12]. Так, в течение медианы наблюдения 27 мес., терапия АРНИ ассоциировалась со значимым снижением риска первичной конечной точки в виде смерти от сердечно-сосудистых причин или госпитализации по поводу СН (RR 0,80; 95% ДИ: 0,73-0,87; р<0,001). Кроме того, по сравнению с эналаприлом, терапия АРНИ также снизила риск смерти от всех причин на 20% (р<0,001) и риск госпитализации по поводу СН на 21% (р<0,001).
С момента вхождения АРНИ в нашу рутинную практику лечения больных с СНнФВ исследователи не оставляют попыток расширить его показания. Данный препарат изучался у пациентов с СН с сохраненной ФВ (СНсФВ) ЛЖ [13], с острой СН, с СН после инфаркта миокарда, при артериальной гипертензии и в детском возрасте [14]. Однако в большинстве случаев ожидаемого положительного результата так и не произошло, поскольку в вышеуказанных когортах больных не удалось продемонстрировать положительное влияние АРНИ на развитие жестких конечных точек. Так, в крупном рандомизированном клиническом исследовании PARAGON-HF, включавшем 4822 пациентов с хронической СНсФВ ЛЖ, несмотря на улучшение функционального класса СН по Нью-Йоркской ассоциации сердца (NYHA) в 15% случаев в группе сакубитрил/валсартана vs 12,6% в группе валсартана, не получено разницы в отношении сердечно-сосудистой смертности (RR 0,95; 95% ДИ: 0,79-1,16) [13].
Вместе с тем продолжаются исследования, целью которых является определение эффекта терапии АРНИ в более узких клинических ситуациях, одной из которых является периоперационный период кардиохирургических пациентов [15]. В ряде ранних работ были описаны негативные эффекты непрерывного применения ингибиторов ангиотензинпревращающего фермента (иАПФ)/блокаторов ангиотензиновых рецепторов (БРА) у пациентов, подвергающихся КШ и клапанной хирургии. Так, в исследовании Tuman KJ, et al., 1995г было продемонстрировано статистически значимое снижение общего периферического сосудистого сопротивления (р=0,0002) и более массивная вазопрессорная терапия (р=0,0001) у пациентов после операции, исходно принимавших иАПФ. Однако в числе других независимых факторов риска назначения двух и более вазопрессоров выделены застойная СН, снижение ФВ ЛЖ, продолжительность искусственного кровообращения, возраст, повторный характер операции и опиоидная анестезия [16]. Позже, в работе Arora Р, et al., 2008 было показано повышение риска развития острого почечного повреждения после операции у пациентов, длительное время принимавших иАПФ или БРА (p=0,0006). Вместе с тем общая распространенность острого почечного повреждения составляла >40%, что не является характерным для более современных исследований [17]. В ряде других работ также присутствуют указания на более высокую частоту развития послеоперационной гипотонии, вазоплегии, общей морбидности и летальности у пациентов, непрерывно принимавших иАПФ [18, 19]. В связи с этим в рекомендациях EACTS (European Association for Cardio-Thoracic surgery) от 2017г по периоперационной медикаментозной терапии у взрослых пациентов, подвергающихся кардиохирургическим вмешательствам, отмечена необходимость прекращения приема блокаторов РААС перед кардиохирургическими операциями [20]. Однако по данным последних крупных обсервационных исследований периоперационный прием блокаторов РААС не ассоциирован с развитием неблагоприятных событий, кроме того, может быть связан с улучшением выживаемости в раннем послеоперационном периоде [21, 22]. В недавних рекомендациях EACTS 2024г отмечено, что прием иАПФ/БРА должен быть рассмотрен в периоперационном периоде у взрослых пациентов, подвергающихся кардиохирургическим вмешательствам. Пациентам с СН должна быть рассмотрена терапия блокаторами РААС в низких дозах после операции в зависимости от стабильности гемодинамики и почечной функции [23].
Всего в мире накоплено небольшое количество работ, посвященных оценке СН в периоперационном периоде [24, 25]. Была отмечена роль СНнФВ в развитии неблагоприятных исходов после вмешательства, в других исследованиях была обнаружена связь между наличием исходной диастолической дисфункции и развитием острой послеоперационной СН и повышением госпитальной летальности. Степень тяжести СН может меняться в течение всего периоперационного периода, в т.ч. во время операции, поэтому оценка как диастолической, так и систолической функции на всех этапах периоперационного периода имеет важное значение. С другой стороны, назначение АРНИ при СНнФВ регламентировано действующими клиническими рекомендациями [25], в то время как использование препарата (как и других блокаторов РААС) при СНсФВ остается предметом изучения.
Мы провели систематический обзор всех существующих на данный момент работ, посвященных применению АРНИ в периоперационном периоде. Всего в наш анализ было включено 7 исследований, которые характеризовались крайней гетерогенностью критериев включения, методов хирургического лечения и конечных точек. С целью проведения дальнейшего анализа и обсуждения, мы разделили пациентов в зависимости от характера хирургического вмешательства. В целом в исследованиях с включением пациентов, перенесших ОТС или имплантацию ИЖС, продемонстрировано отсутствие влияния назначения АРНИ на развитие вазоплегии и других неблагоприятных событий. В 2024г был опубликован систематический обзор Gilón L, et al., в данный анализ было включено лишь 3 небольших обсервационных исследования [26]. При анализе не было выявлено различий между группой отмены АРНИ перед операцией (ОТС или имплантация ИЖС) и группой инициации или продолжения терапии АРНИ перед операцией в отношении частоты госпитальной и 30-дневной смертности. Кроме того, не было выявлено разницы в частоте послеоперационной вазоплегии (ОШ 0,77; 95% ДИ: 0,23-2,98). В нашем исследовании также проведен метаанализ, по результатам которого не обнаружена статистически значимая разница в частоте развития вазоплегии (RR 0,69; 95% ДИ: 0,40-2,30; р=0,92).
В группе пациентов с ишемической СНнФВ показано, что терапия АРНИ после операции, в т.ч. ее ранняя инициация после вмешательства, является безопасной (в отношении влияния на функцию почек), хорошо переносимой (в отношении частоты симптомной гипотензии) и эффективной (в отношении улучшения ФВ ЛЖ, уменьшения НУП и улучшения качества жизни) стратегией терапии в дополнение к хирургическому лечению. Наконец, в группе пациентов, подвергшихся клапанной хирургии сердца, терапия АРНИ продемонстрировала свою эффективность и безопасность в периоперационном периоде.
Ограничения исследования. Во-первых, в наш систематический обзор и метаанализ включено ограниченное число небольших исследований. Во-вторых, критерии включения и исключения исследований в большинстве случаев различались, кроме того, отличался и тип хирургического вмешательства. Наконец, включенные обсервационные исследования восприимчивы к влиянию конфаундеров и систематической ошибке отбора. Все вышеуказанные данные не позволяют сформулировать полноценные рекомендации относительно применения АРНИ в периоперационном периоде и требуют проведение в дальнейшем крупных контролируемых клинических исследований.
Заключение
В соответствии с проведенным систематическим обзором на основании небольших обсервационных исследований показано, что терапия АРНИ после операции, в т.ч. ее ранняя инициация после вмешательства, является безопасной, хорошо переносимой стратегией терапии СН в периоперационном периоде, кроме того, в ряде исследований она была ассоциирована с уменьшением объема ЛЖ и улучшением ФВ ЛЖ, что, несомненно, приводило к улучшению результатов хирургического лечения.
Роль пальце-плечевого индекса в оценке клинического статуса пациента
Ключевые моменты
- Доказательная база в отношении лодыжечно-плечевого индекса формируется несколько десятилетий, необходимость его измерения освещена во многих клинических рекомендациях. Однако он оказался малоинформативен у пациентов с выраженной артериальной жёсткостью, поскольку не позволяет обнаружить артериосклероз на ранней стадии развития, кроме того, даже в конечностях с нормальным индексом возможно развитие микрососудистой дисфункции.
- Назрела необходимость поиска нового инструмента для оценки кровотока в артериях нижних конечностей. Сосуды пальцев ног менее восприимчивы к формированию сосудистой ригидности, что делает пальце-плечевой индекс доступной альтернативой в подобной ситуации.
- В связи с вероятностью значительного уплотнения артерий нижних конечностей предиктивная значимость лодыжечно-плечевого индекса может быть снижена, в то время как оценка пальце-плечевого индекса подобных ограничений практически не имеет.
Key messages
- The evidence base for the ankle-brachial index has been forming for several decades, and the need for its measurement is covered in many clinical guidelines. However, it turned out to be uninformative in patients with severe arterial stiffness, since it does not allow to detect early arteriosclerosis; in addition, even in limbs with a normal index, microvascular dysfunction may develop.
- There is a pressing need to find a new tool for assessing blood flow in lower limb arteries. Toe vessels are less susceptible to vascular stiffness, which makes the toe-brachial index an accessible alternative in such a situation.
- Due to the likelihood of the significant compaction of lower limb arteries, the predictive value of ankle-brachial index may be reduced, while the assessment of toe-brachial index has virtually no such limitations.
Сердечно-сосудистые заболевания (ССЗ) остаются серьёзным бременем среди хронической неинфекционной патологии, представляя значительную опасность для жизни и здоровья населения развитых стран, ухудшая качество и снижая продолжительность жизни. Хотя понятие "поражение органов-мишеней" употребляется, прежде всего, относительно диагностики артериальной гипертензии, очевидно, что сосуды страдают при более широком спектре заболеваний. Главным интегральным показателем, характеризующим состояние сосудистой стенки, считают ее жесткость. За последние 30 лет артериальная ригидность переместилась из области чисто научных интересов в клинические рекомендации [1, 2].
Было показано, что сосудистая жесткость возрастает у пациентов с сахарным диабетом (СД) 1 и 2 типа, по сравнению со здоровыми людьми того же возраста; более того, ригидность повышается уже на стадии нарушения толерантности к глюкозе, раньше появления симптомов ССЗ [3].
В терапевтической практике для оценки поражения органов-мишеней, преимущественно при артериальной гипертензии, наибольшее внимание уделяется оценке скорости пульсовой волны (СПВ), однако для диагностики заболеваний артерий нижних конечностей (ЗАНК), в частности синдрома диабетической стопы (СДС), широко используется лодыжечно-плечевой индекс (ЛПИ)1. Одним из самых доступных методов для его измерения является ультразвуковая допплерография артерий нижних конечностей, но при поражении ди- стальной формы изменения типа кровотока с помощью этой методики не фиксируются [4]. Поэтому предложен ряд дополнительных неинвазивных методик для оценки кровотока в дистальных отделах нижних конечностей, в первую очередь измерение пальце-плечевого индекса (ППИ). Он представляет собой отношение систолического артериального давления на большом пальце ноги к давлению, измеренному на плечевой артерии. Одним из наиболее простых методов оценки является осциллометрия, например, в приборах для проведения объёмной сфигмографии [5]. Поскольку ППИ не внедрён в рутинную клиническую практику, в обзоре рассматриваются основные аспекты его применения и диагностическая ценность.
История развития ППИ как метода исследования
Все методы диагностики ЗАНК можно разделить на неинвазивные и инвазивные. Использование компьютерной томографической ангиографии (КТА) или магнитно-резонансной ангиографии, безусловно, позволяет визуализировать пораженный участок, однако данные методики имеют ряд существенных ограничений как организационного характера, так и связанных с наличием у пациентов противопоказаний для проведения исследований. Напротив, неинвазивные методики более широко распространены и активно используются, в частности, при проведении скрининга [6].
Доказательная база в отношении ЛПИ формируется несколько десятилетий, необходимость его измерения освещена во многих клинических рекомендациях [1, 7, 8]. Учитывая высокую клиническую ценность его оценки, очевидно, что он широко используется в реальной практике. Однако ЛПИ оказался малоинформативен у пациентов с выраженной артериальной жёсткостью, он не позволяет обнаружить артериосклероз на ранней стадии развития, кроме того, даже в конечностях с нормальным ЛПИ возможно развитие микрососудистой дисфункции [9, 10]. Кроме того, у ряда пациентов с СД, хронической болезнью почек (ХБП), особенно в терминальную стадию почечной недостаточности и при проведении программного гемодиализа, развивается выраженный медиакальциноз стенок артерий. В результате этого артерии становятся некомпрессируемыми, что приводит к ложно завышенным значениям ЛПИ (>1,4) [11].
В связи с этим назрела необходимость поиска нового инструмента для оценки кровотока в артериях нижних конечностей. Сосуды пальцев ног менее восприимчивы к формированию сосудистой ригидности, что делает ППИ доступной альтернативой в подобной ситуации [4]. Ухудшение кровоснабжения нижней конечности закономерно приводит к снижению систолического давления в большом пальце стопы, вследствие чего при ЗАНК регистрируются сниженные значения ППИ по сравнению с общей популяцией [12]. Считается, что ППИ отражает давление на капиллярном уровне, поэтому он обладает большей точностью при сочетании ЗАНК и СД, чем ЛПИ.
В доступной литературе нормальные значения ППИ варьируют от 0,49 до 1,22 со средними величинами 0,71-0,95 в зависимости от метода оценки (допплеровское сканирование, осциллометрическая плетизмография, фотоплетизмография, тензометрическая плетизмография) [13]. Существенным недостатком ранних исследований является отсутствие данных визуализирующих методик, которые позволили бы с полной уверенностью исключить атеросклеротическое поражение нижних конечностей и выделить абсолютно здоровых лиц в группу контроля, поскольку у большого количества пациентов ЗАНК может протекать бессимптомно. Кроме того, некоторые авторы использовали предварительное нагревание конечностей. Отсутствие предварительного нагрева может частично объяснить относительно низкие показатели ППИ [13].
В пилотных исследованиях предпринимались попытки провести переоценку нормальных показателей у молодых лиц (в выборке из 73 здоровых молодых добровольцев в возрасте 24,3±2,0 лет средний показатель ППИ составил 0,97 для мужчин и 0,95 для женщин) [14]. Поскольку в большинстве исследований референтное значение 0,71 было оценено как нижний предел нормы на основе взвешенного среднего, величина показателя ≤0,70 является основанием для постановки диагноза ЗАНК [4, 13]. Однако очевидно, что оценка должна проводиться комплексно, поскольку установлено, что даже у молодых людей ППИ <0,7 не всегда указывает на сосудистые нарушения [15].
Внедрение любой новой методики неизменно сопряжено с выявлением диагностической точности полученных результатов, их чувствительности и специфичности. Так, по данным крупного метаанализа (44 исследования, 1612 пациентов), чувствительность ЛПИ при обнаружении стеноза ≥50% составила 61% (95% доверительный интервал (ДИ): 55-69), специфичность — 92% (95% ДИ: 89-95). ППИ продемонстрировал чувствительность 81% (95% ДИ: 70-94), специфичность 77% (95% ДИ: 66-90). При прямом сравнении семи исследований, совместно анализирующих ЛПИ и ППИ, ППИ показал лучшую общую диагностическую точность за счет чувствительности (82% vs 52%), в то время как специфичность (77% vs 94%) была хуже для ППИ, чем для ЛПИ [16].
Пилотное исследование с участием 175 пациентов, страдающих СД 2 типа (измерения проводились с помощью сосудистого допплера), продемонстрировало более низкую чувствительность ЛПИ — 35,29% (95% ДИ: 0,21-0,52) по сравнению с ППИ, составившую 82,35% (95% ДИ: 0,66-0,92). Однако специфичность оказалась схожей. При сравнении результатов с данными КТА (за критерий диагноза ЗАНК принимали наличие стеноза >50%) с использованием каппы Коэна надежность ЛПИ относительно КТА показала удовлетворительное согласие (K=0,225, p=0,001), тогда как надежность ППИ показала существенное согласие (K=0,759, p<0,0001) [17]. Это позволило авторам сделать вывод, что наличие ЗАНК у пациентов с нормальным ЛПИ (0,9-1,3) может быть подтверждено с помощью ППИ, который сильно коррелирует с результатами КТА. В уже упоминавшемся исследовании также были показаны корреляции ППИ с ангиографическими результатами [15].
В клинической практике методика может быть интересна не только в качестве скринингового метода. Рядом исследователей оценивалась взаимосвязь ППИ и степени выраженности перемежающейся хромоты с выявлением сильной положительной корреляции с дистанцией в тесте 6-мин ходьбы [12].
Предиктивная значимость ППИ
Не менее интересной является оценка прогностической ценности получаемых результатов. Давно доказана связь артериальной ригидности с неблагоприятными исходами среди различных популяций пациентов, в частности, при артериальной гипертензии и СД [18, 19]. Однако в связи с вероятностью значительного уплотнения артерий нижних конечностей при СД предиктивная значимость ЛПИ может быть снижена, в то время как оценка ППИ подобных ограничений практически не имеет.
В проспективном наблюдательном когортном исследовании CARDIPP показано, что низкий показатель ППИ прогнозирует повышенный риск крупных неблагоприятных сердечно-сосудистых событий (MACE) независимо от артериальной жесткости у пациентов с СД 2 типа [20]. Более того, в отношении ППИ показана линейная связь со смертностью от ССЗ независимо от статуса диабета [21]. В исследовании, проведённом среди 1697 пациентов с острым нарушением мозгового кровообращения, ППИ по данным многофакторной логистической регрессии продемонстрировал обратную связь с неблагоприятным исходом у всех пациентов (отношение шансов (ОШ) 0,294, 95% ДИ: 0,114-0,759), в т.ч. у лиц с нормальным ЛПИ (ОШ 0,293, 95% ДИ: 0,095-0,906). В многофакторной регрессии Кокса ППИ <0,6 был связан с рецидивом инсульта (отношение рисков (ОР) 1,651, 95% ДИ: 1,135-2,400), смертностью от всех причин (ОР 2,105, 95% ДИ: 1,343-3,298) и MACE (ОР 1,838, 95% ДИ: 1,396-2,419) у всех пациентов. ППИ <0,6 также ассоциировался с рецидивом острого нарушения мозгового кровообращения (ОР 1,681, 95% ДИ: 1,080-2,618), смертностью от всех причин (ОР 2,075, 95% ДИ: 1,180-3,651) и MACE (ОР 1,619, 95% ДИ: 1,149-2,281) у пациентов с нормальным ЛПИ [22].
Ретроспективное когортное исследование у пациентов с ЗАНК показало, что давление в артериях пальцев ног и ППИ являются сильными предикторами сердечно-сосудистой смертности и должны регулярно измеряться, несмотря на преобладающую локализацию заболевания или клиническую картину [23].
Поскольку изучение ППИ как метода исследования было тесно связано с ХБП, то, несомненно, интересны перспективы его применения у этой категории больных. В проспективном исследовании с участием 200 человек, наблюдавшихся в течение 6 лет, было выявлено, что снижение ППИ и ЛПИ ассоциировалось с повышенным риском ССЗ и смертности от всех причин, независимо от традиционных факторов риска при СД 2 типа и микроальбуминурии [24]. Ещё одно проспективное когортное исследование, включавшее 471 пациента с клиническим подозрением на ЗАНК, продемонстрировало, что высокое значение разницы ЛПИ-ППИ может быть связано с более высоким риском смертности у лиц с ХБП и нормальным ЛПИ. Хотя на эту связь оказал влияние возраст, авторы сочли данное направление перспективным для дальнейшего изучения в более крупных группах больных [25]. ППИ продемонстрировал более сильную ассоциацию, чем ЛПИ, с альбуминурией и скоростью клубочковой фильтрации у 390 пациентов с СД 2 типа [26]. Как уже указывалось ранее, у пациентов, подвергающихся процедуре программного гемодиализа, ЛПИ может быть недостаточно информативен из-за высокой распространенности кальцификации артериальной медии. Исследование 37 гемодиализных пациентов показало самую высокую смертность у пациентов с низкими ЛПИ и ППИ. У лиц с ППИ <0,7 был повышен риск смертности от всех причин. При этом разница ЛПИ-ППИ и сам ЛПИ не были значимо связаны со смертностью от всех причин [27].
Распространенной проблемой среди пациентов с СДС является ишемическая болезнь сердца (ИБС). В связи с этим проводилось изучение возможностей ППИ для диагностики (в частности, скрининговой) поражения коронарных сосудов. Оценивали взаимосвязь между параметрами эхокардиографии и ППИ [28]. У 62 пациентов с СДС проводилось исследование глобальной продольной деформации левого желудочка для подтверждения ИБС. ППИ показал значительную связь с ИБС: каждое его увеличение на 0,01 ассоциировалось с 15%-м снижением шансов развития ИБС (ОШ 0,85, 95% ДИ: 0,72-0,99, p=0,039). Кроме того, при оценке диагностической ценности методом ROC-анализа ППИ продемонстрировал площадь под кривой 0,854, чувствительность 80,0% и специфичность 66,7% при пороговом значении 0,69. Несомненное ограничение данного наблюдения — отсутствие визуализирующих методик для детализации состояния коронарных артерий. Авторы сочли возможным использовать результаты Alaika О, et al., которые продемонстрировали более низкие показатели глобальной продольной деформации у пациентов со стенозом 70% (группа ИБС+) и более по результатам коронарографии у лиц с СД, поскольку у ряда подобных пациентов даже при наличии гемодинамически значимых стенозов может отсутствовать клиническая симптоматика [29].
Учитывая большую клиническую значимость изучения артериальной ригидности у широкого спектра лиц, роль ППИ исследуется не только при ЗАНК и СДС. Так, показано, что среди эутиреоидных пациентов в возрасте от 18 до 65 лет без диагностированного заболевания щитовидной железы существуют некоторые значимые корреляции между объемом щитовидной железы и признаками субклинической сердечно-сосудистой дисфункции, такими как ЛПИ и ППИ [30]. При ряде васкулитов (например, гигантоклеточном артериите) также может развиваться ишемия нижних конечностей. В подобных случаях оценка СПВ, ЛПИ и ППИ, как часть неинвазивной диагностики, может сыграть значительную роль в дифференциации атеросклеротического поражения и васкулита [31].
Ещё одна группа пациентов, находящихся на острие внимания врачей различных специальностей, — лица, получающие химиотерапию. На примере ограниченной популяции пациентов (147 человек) было показано, что периферическая нейропатия, вызванная химиотерапией, с большей вероятностью приведет к появлению аномальных пульсовых волн, определяемых с помощью фотоплетизмографии (в комплексное исследование входила оценка ЛПИ и ППИ), чем ЗАНК [32].
Перспективы дальнейшего применения ППИ
Какие же методы определения ППИ в настоящее время доступны в нашей стране? На отечественном рынке представлен прибор VaSera-2000 ("Fukuda Denshi", Япония), который позволяет проводить оценку ППИ вместе с другими параметрами артериальной ригидности: сердечно-сосудистый индекс, ЛПИ. Для расчёта СПВ по артериям различного типа, которые оценивались в предыдущих версиях VaSera, предложены специальные формулы [33, 34]. Модель с опцией определения ППИ недавно стала доступной в нашей стране, однако, учитывая дистрибьюцию в России, перспективы её использования обнадёживают [35]. Технически исследование можно проводить с помощью фотоплетизмографии, лазерной допплерографии, непрерывной волновой допплерографии, сфигмоманометров (осциллометрически) [36]. Вокруг первого (чаще), второго или третьего пальца стопы оборачивают манжету для измерения систолического артериального давления. В большинстве международных публикаций рекомендуется его пороговое значение <30 до <50 мм рт.ст. в качестве индикатора тяжелой ишемии конечностей (ЗАНК, в частности прогрессирующая хроническая ишемия, угрожающая конечностям или способности к заживлению ран) [37-39]. Также на палец помещают датчик (фотоплетизмографический, допплеровский или лазерный) для детекции кровотока. В модели VaSera-2000 дополнительного наложения датчика не требуется. Фотоплетизмография как метод определения ППИ при ЛПИ на границе нормального значения (0,91 или 1,30), а также выше нормального (>1,30), также указана в национальном руководстве Российской Федерации по функциональной диагностике [40].
К сожалению, в настоящее время оценка ППИ ограничивается преимущественно пациентами с ЗАНК различного генеза, не находя широкого применения в клинической практике. Однако дальнейшее изучение параметров, которые характеризуют ремоделирование сосудов, невозможно переоценить. Так, у пациентов, получающих химиотерапию, широко описывается кардиотоксичность и крайне мало исследований, изучающих васкулотоксические эффекты лечения. В их основе лежат окислительное повреждение эндотелиальных клеток, апоптоз эндотелиоцитов и дисфункция эндотелия, ведущие к артериальной ригидности и дальнейшему каскаду сердечно-сосудистой патологии [41-43].
Ещё одна возможная сфера использования ППИ как компонента оценки сосудистой ригидности — это выявление степени поражения артерий при системных васкулитах. В действующих клинических рекомендациях диагностический алгоритм крайне мало описывает изучение собственно артерий и их изменений, хотя в ряде случаев указывается важность проведения дуплексного ультразвукового сканирования и других методов, которые позволяют установить диагноз на ранней стадии заболевания, когда наблюдается лишь утолщение сосудистой стенки2.
Одна из областей terra incognita современной медицины, требующая мультидисциплинарного подхода, — синдром капиллярной утечки [44, 45]. В настоящее время его определяют как прогрессирующее патологическое нарастание капиллярной проницаемости, ведущее к потере жидкой части крови в интерстициальный сектор внеклеточного водного пространства, с дальнейшим развитием гиповолемии, гипоперфузии органов и тканей, затруднением транспорта кислорода и быстрым формированием полиорганной дисфункции. Чаще всего синдром развивается в условиях критических состояний (сепсис, шок, ожоги, респираторный дистресс-синдром). Возникновение капиллярной утечки непосредственно связано с нарушением функции сосудистого эндотелия, ассоциированным с иммунными реакциями и рядом медиаторов воспаления (цитокины, активные протеазы, свободные радикалы). Иммунные механизмы реализуются через цитолиз, опосредованный комплементом, вовлекающий клетки и иммунные комплексы, которые фиксированы на эндотелии или базальной мембране стенок сосудов. В итоге развивается генерализованный септический васкулит.
Заключение
Имеющиеся диагностические методы направлены в основном на выявление органических изменений в сосудах, в то время как оценка эндотелиальной дисфункции и артериальной ригидности (и ППИ в их числе) может быть использована для раннего выявления структурно-функциональных изменений артерий при многих не ССЗ. Это открывает возможности для углубления и расширения представлений о патогенезе широкого спектра заболеваний, поиска и апробации методов коррекции и разработки эффективных способов профилактики.
1 Национальные рекомендации по диагностике и лечению заболеваний артерий нижних конечностей, 2019. https://www.angiolsurgery.org/library/recommendations/2019/ recommendations_LLA_2019.pdf.
2 Системные васкулиты. Клинические рекомендации РФ 2013-2017 (Россия). https://diseases. medelement.com/disease.
"Диссинхроническая" кардиомиопатия у пациентов с феноменом Вольфа-Паркинсона-Уайта: решенные и нерешенные проблемы
Ключевые моменты
- Диагностика "диссинхронической" кардиомиопатии у пациентов с феноменом Вольфа-Паркинсона-Уайта (ВПУ) традиционно основана на данных стандартного протокола трансторакальной эхокардиографии с определением объемов и размеров камер сердца и фракции выброса левого желудочка.
- Появление результатов новых исследований показало роль глобальной продольной деформации по данным Speckle tracking в диагностике диссинхронии и "субклинических" нарушений контрактильности миокарда.
- Обобщение опыта в этой области будет способствовать определению предикторов формирования нарушения систолической функции левого желудочка у пациентов с феноменом ВПУ и разработке оптимальных показаний для проведения радиочастотной аблации дополнительного предсердно-желудочкового соединения у детей.
Key messages
- Diagnosis of dyssynchrony cardiomyopathy in patients with the Wolff-Parkinson-White (WPW) syndrome is traditionally based on the data of the standard transthoracic echocardiography with determination of heart chamber volumes and sizes and left ventricle ejection fraction.
- New research data has shown the role of global longitudinal strain according to Speckle tracking in the diagnosis of dyssynchrony and subclinical myocardial contractility disorders.
- Generalization of experience in this area will help to identify predictors left ventricular systolic dysfunction in patients with the WPW syndrome and optimal indications for radiofrequency ablation of accessory atrioventricular pathways in children.
История изучения синдрома Вольфа-Паркинсона-Уайта (ВПУ) насчитывает более сотни лет. Впервые электрокардиографический феномен предвозбуждения желудочков был описал A. Hoffman в 1909г. Далее последовал ряд публикаций отдельных клинических случаев: A. Cohn и F. Fraser (1913г), F. Wilson (1915г), A. Wedd (1921г), A. Gilchrist (1926г), S. Levine и A. Curtiss (1926г), F. Bach (1929г), W. Hamburger (1929г) [1]. Однако широкую популярность получила статья, написанная L. Wolff, J. Parkinson и P. White в 1930г. Авторы на основании интерпретации электрокардиограмм (ЭКГ) описали синдром функциональной блокады ножки пучка Гиса и короткого интервала P-R, который они наблюдали у 11 молодых, физически здоровых людей, страдающих от приступов тахикардии или фибрилляции предсердий [2].
На момент первых публикаций ЭКГ с феноменом предвозбуждением желудочков считалось, что причиной подобных изменений комплекса QRS является блокада ножки пучка Гиса. Но доказательства существования дополнительных предсердно-желудочковых соединений (ДПЖС) привели к появлению миогенной теории врожденного происхождения синдрома ВПУ. ДПЖС — это экстранодальные пути (мышечные пучки), проходящие вне атриовентрикулярного узла (АВУ) и соединяющие миокард предсердий и желудочков. Окончательное признание этой теории произошло после успешно проведенных хирургических операций, когда при разрушении ДПЖС исчезали признаки предвозбуждения желудочков на ЭКГ [3].
Официально термин "синдром Вольфа-Паркинсона-Уайта", который в настоящее время используется в практике, был предложен в 1941г S. A. Levin и R. B. Beenson. По мере накопления сведений о данном заболевании, стали выделять два понятия "феномен" и "синдром". Под феноменом ВПУ подразумевают наличие характерных электрокардиографических признаков предвозбуждения желудочков, возникающие за счет антеградного проведения возбуждения по ДПЖС, без клинических проявлений (пароксизмы суправентрикулярной тахикардии (СВТ)). Для синдрома ВПУ характерно возникновение приступов атриовентрикулярной реципрокной тахикардии (АВРТ). Возможность возникновения пароксизмов СВТ обусловлена способностью ДПЖС ретроградно проводить возбуждение из желудочка в предсердие.
Прежде всего, значимость синдрома ВПУ обусловлена риском развития внезапной смерти, которая варь- ирует от 0,15 до 0,39%. АВРТ с участием ДПЖС занимают первое место в структуре СВТ у пациентов всех возрастных групп. Так, у пациентов в возрасте до 1 года доля АВРТ составляет до 80%, в более старшем возрасте — 60-70% [4]. Этим обусловлено определение тактики ведения пациентов с феноменом/синдромом ВПУ. Учитывая риск возможных осложнений в детском возрасте, проведение радиочастотной аблации (РЧА) в первую очередь показано пациентам, у которых были зарегистрированы эпизоды АВРТ или эпизоды остановки кровообращения.
С 2004г в литературе начали появляться публикации, описывающие формирование дилатационной кардиомиопатии (ДКМП) у четырех пациентов детского возраста с предвозбуждением желудочков [5]. Авторы предполагают, что у пациентов с феноменом ВПУ нарушение хода возбуждения в результате функционирования ДПЖС приводит к нарушению систоло-диастолической функции сердца и является фактором риска развития кардиомиопатии с дилатационным фенотипом.
При наличии в сердце ДПЖС, возбуждение желудочков происходит по двум путям: нормальное проведение импульса по АВУ и системе Гиса-Пуркинье и параллельно через ДПЖС. Электрическая и механическая эксцентрическая активация желудочков через ДПЖС приводит к ранней активации в базальной части межжелудочковой перегородки (МЖП) с относительно синхронной активацией остального миокарда. Поскольку часть стенки МЖП, находящейся в состоянии раннего возбуждения, совершает систолическое движение до того, как остальной миокард полностью расслабится, предварительная нагрузка на стенку желудочка и сопротивление сердечному сокращению уменьшается. Это приводит к снижению коронарного кровоснабжения, истончению и парадоксальному движению МЖП. При проведении эхокардиографии (ЭхоКГ) визуализируется аневризма и сегментарная дискинезия МЖП. Проведение возбуждения по ДПЖС приводит к отклонению МЖП во время сокращения в сторону правого желудочка (ПЖ), тем самым МЖП участвует в сокращении ПЖ. Это приводит к более быстрому повышению давления в ПЖ и относительно раннему открытию клапана легочной артерии. В противоположность этому левый желудочек (ЛЖ) не успевает наполниться в полном объеме, что приводит к задержке открытия аортального клапана. Возникает раннее сокращение ПЖ с последующим сокращением ЛЖ, формируется порочный круг между нормальным движением стенок желудочков и МЖП, что ускоряет нарушение функции миокарда. Аномальное движение МЖП в данных ситуациях напоминает картину, возникающую при блокаде левой ножки пучка Гиса или постоянной правожелудочковой кардиостимуляции [6-8].
Считается, что формирование кардиомиопатии наблюдается чаще у детей раннего возраста с феноменом ВПУ, с наиболее выраженной преэкзитацией на ЭКГ и правой септальной или правой боковой локализацией ДПЖС [9]. Однако данное состояние может возникнуть и у взрослых. Кроме того, другие локализации ДПЖС не исключают возможность развития кардиомиопатии, но встречаются реже [10]. Abdelmohsen G, et al. (2023) объясняли это тем, что из-за более продолжительного времени проведения импульса от синусового узла к левому предсердию вклад левостороннего ДПЖС в сокращение миокарда ЛЖ незначителен [6]. Сокращение ЛЖ в таких случаях преимущественно происходит через АВУ по нормальным проводящим путям.
Преимущественно литература по данной проблеме представлена описанием отдельных клинических случаев. Miyazaki A, et al. (2021) опубликовали обзор клинических случаев пациентов с желудочковой диссинхронией, обусловленной функционированием ДПЖС [9]. Проведя анализ литературы, авторами были выделены 63 пациента с феноменом (67%) и синдромом (32%) ВПУ, соответствующих критериям кардиомиопатии. Средний возраст у данных пациентов на момент выявления заболевания составлял 4 (0,1-59) года. Большая часть представленных пациентов — это дети (87%, n=55), в т.ч. 16 детей в возрасте до 1 года (25%). Диагноз "кардиомиопатия, индуцированная преэкзитацией" был поставлен на основании данных эхокардиографического исследования (фракция выброса (ФВ) ЛЖ <55%, dS ЛЖ <25%) и клинических проявлений сердечной недостаточности (СН).
Однако не у всех пациентов, имеющих клинику СН, наличие систолической дисфункции можно диагностировать по снижению ФВ ЛЖ. Прежде всего, это связано с особенностями строения стенки миокарда. Основной вклад в величину показателя ФВ ЛЖ вносит средний слой миокарда, который обеспечивает сокращение сердца по короткой поперечной оси. Однако первоначально повреждение миокарда затрагивает наиболее чувствительные наружный и внутренний (эпи- и эндокардиальные) слои миокарда, ответственные за продольное укорочение и ротационное движение сердца и не сопровождающиеся снижением ФВ ЛЖ. Дальнейшее прогрессирование заболевания приводит к нарушению сокращения миокарда по длинной оси и компенсаторно происходит усиление сокращения по короткой оси, которое обеспечивается "здоровым" средним мышечным слоем. Таким образом, ориентируясь только на ФВ ЛЖ, не всегда можно выявить ранние стадии развития СН. С точки зрения клинической значимости данных событий, стоит сказать, что по данным литературы прогноз больных с СН и нормальным значением ФВ ЛЖ может быть так же неблагоприятным, как и при СН и сниженным значением ФВ. Кроме того, наличие у пациента диссинхронии может привести к ошибкам при измерении значения ФВ [11].
Снижение глобальной деформации ЛЖ в продольном направлении (GLS ЛЖ), выявленное по данным Speckle-tracking ЭхоКГ, обладает более высокой чувствительностью в отношении диагностики систолической дисфункции ЛЖ, чем ФВ и позволяет выявить "субклинические" нарушения контрактильности миокарда [12-15]. К преимуществам Speckle-tracking ЭхоКГ относят возможность недопплеровского, угол-независимого измерения объективной количественной деформации миокарда, систолической и диастолической функции ЛЖ, благодаря чему возможна не только визуальная, но и количественная оценка сократимости миокарда ЛЖ [13]. GLS ЛЖ более воспроизводима, чем другие формы деформации (по окружности, радиальная). Кроме того, анализ продольной деформации теперь доступен и встроен в большинство современных эхокардиографических аппаратов, и его можно измерять напрямую, без передачи изображений в компьютерное программное обеспечение для автономного анализа.
В исследование Cheng Z, et al. (2023) было включено 55 пациентов с феноменом ВПУ и 50 здоровых детей. У 20 человек из основной группы был диагностирован ВПУ тип А, обусловленный функционированием левостороннего ДПЖС, у 35 человек — тип В, для которого характерен правосторонний ДПЖС. Предоперационное ультразвуковое исследование показало снижение ФВ ЛЖ (ВПУ тип В) и повышение GLS ЛЖ (ВПУ тип А и В). При этом у пациентов с правосторонним расположением ДПЖС данные показатели были ниже, чем в контрольной группе. Среди пациентов с правосторонними ДПЖС у 14 пациентов было выявлено парадоксальное движение базального сегмента МЖП относительно других стенок, у 13 пациентов — истончение МЖП. Ещё 10 пациентам с ВПУ тип В был поставлен диагноз ДКМП. В раннем послеоперационном периоде наблюдалось нормализация ФВ ЛЖ (с 57,1±9,1% до 63,5±2,4%, p<0,001) и GLS ЛЖ (с -18,7±2,2% до -21,1±0,8, p<0,001), а спустя 3 мес. после операции показатели ФВ ЛЖ и GLS ЛЖ значимо не отличались от показателей контрольной группы [7]. В другом исследовании авторы получили только улучшение продольной деформации отдельных сегментов, располагавшихся вблизи ДПЖС (от -7,6% до -18,4%, p=0,0001) и ФВ ЛЖ (от 58% до 63%, p=0,003) без нормализации GLS (от -16,9% до -17,6%, p=0,722). Но в данном исследовании не было проведено отдаленное проспективное наблюдение за пациентами [6].
Внутрисердечное электрофизиологическое исследование остается золотым стандартом для определения локализации ДПЖС. Дооперационное определение локализации ДПЖС происходит при помощи ЭКГ [16]. В настоящее время разными авторами предложены классификации, отображающие анатомическое расположение ДПЖС (Anderson R. H., Cosio S., Gallagher J., Arruda M. S., модифицированный алгоритм Arruda и др.). Применение методики Speckle-tracking ЭхоКГ может выявить региональную дисфункцию ЛЖ, ассоциированную с функционированием ДПЖС. Это связано с тем, что в сегментах миокарда, которые располагаются рядом с ДПЖС, или в соседних сегментах наблюдается повышение показателя GLS ЛЖ. В данных сегментах также регистрируется более ранний пик деформации, поскольку импульсы приходят к этим сегментам раньше, вызывая раннюю пиковую деформацию по сравнению с другими сегментами. Теоретически использование методики Speckle-tracking ЭхоКГ до операции поможет исходно определить локализацию ДПЖС, что приведет к снижению рентгенологической нагрузки на пациента. Однако клиническая роль неинвазивной диагностики локализации ДПЖС с помощью Speckle-tracking ЭхоКГ остается ограниченной, т.к. она не изменяет план лечения, а проведение РЧА осуществляется после выполнения внутрисердечного электрофизиологического исследования [6]. Тем не менее представленные результаты демонстрируют возможность топической диагностики ДПЖС с помощью методики Speckle-tracking ЭхоКГ посредством оценки пресистолических сокращений и продольной деформации для отдельных сегментов.
Ремоделирование миокарда ЛЖ в результате функционирования ДПЖС имеет обратимый характер. Нормальная электрофизиология сердца восстанавливается после проведения РЧА ДПЖС. Восстановление сердечной функции после РЧА ДПЖС происходит в различные сроки: от нескольких дней, до нескольких лет [9, 12]. По данным литературы описаны случаи, когда на восстановление функции ЛЖ потребовалось более 3 лет [9]. К факторам, которые коррелируют со временем и степенью восстановления функции ЛЖ после РЧА, относят степень исходной дисфункции ЛЖ (тяжелая СН), а также возраст пациента (старше 6 лет) [9]. В литературе описаны клинические случаи пациентов c феноменом ВПУ и ДКМП, у которых произошло естественное прекращение функционирования ДПЖС с дальнейшей нормализацией ЭхоКГ показателей [5, 9, 17]. Наличие преэкзитации на ЭКГ, а также обратное ремоделирование и восстановление функции ЛЖ после РЧА ДПЖС отличает дисфункцию ЛЖ, связанную с диссинхронией, от идиопатической ДКМП [9].
РЧА ДПЖС является методом выбора для лечения синдрома ВПУ. Однако применение РЧА в детской популяции остается спорным вопросом, особенно это касается возрастной категории детей с весом менее 15 кг. Сообщения, демонстрирующие улучшение функции ЛЖ после РЧА у пациентов с асимптомным ВПУ и диссинхронией, способствовали пересмотру показаний к РЧА и трансформации Класса IIB в IIA (уровень В), в т.ч. у детей с массой тела менее 15 кг (уровень В) [18].
В литературе описаны случаи использования медикаментозной антиаритмической терапии (амиодарон, флекаинид, пропафенон) как альтернативного способа ведения маленьких детей, пока пациент не достигнет оптимальных показателей физического развития для проведения РЧА ДПЖС. Однако медикаментозная терапия только временно прерывает проведение по ДПЖС и в дальнейшем таким пациентам необходимо проведение РЧА [19-24]. Несмотря на случаи эффективного применения флекаинида у детей с феноменом ВПУ и диссинхронией, имеются отдельные сообщения о случаях передозировки данным препаратом. Причиной передозировки флекаинида может быть не только ошибки в расчете необходимой дозировки (узкий терапевтический диапазон) или случайный прием препарата, но и взаимодействие препарата с другими лекарственными и пищевыми продуктами, особенно с молочными продуктами (уменьшение объема молока без коррекции дозировки препарата может привести к усилению всасывания препарата в кишечнике). Поэтому с особой осторожностью стоит назначать данный препарат детям, которые находятся на грудном вскармливании [25].
Учитывая низкую осведомленность о возможности развития систолической дисфункции ЛЖ у пациентов с феномен ВПУ, в настоящее время частота встречаемости данного явления неизвестна. Отсутствие точных данных о распространенности данного заболевания некоторые авторы связывают с тем, что части пациентов выполнена успешная РЧА до развития кардиомиопатии, а некоторые пациенты наблюдаются с основным диагнозом ДКМП и сопутствующим — феномен ВПУ, и получают соответствующую медикаментозную терапию [12, 26]. Некоторые из этих детей находятся в листе ожидания на трансплантацию сердца с диагнозом ДКМП или им была проведена имплантация желудочковой вспомогательной системы (LVAD/RVAD/BiVAD) [9, 27]. В 2018г американскими кардиологами был опубликован клинический случай 20-месячной девочки с зарегистрированным феноменом преждевременного возбуждения желудочков, обусловленного функционированием правостороннего ДПЖС, и клиникой тяжелой СН. Учитывая тяжелое состояние пациентки, провести РЧА ДПЖС удалось только после имплантации бивентрикулярной желудочковой вспомогательной системы (BiVAD). После успешно проведенной РЧА состояние пациентки быстро улучшилось, причем первоначальное улучшение по данным ЭхоКГ было отмечено уже через 48 ч после аблации. В связи с полным восстановлением сердечной функции, через 30 дней после РЧА ДПЖС, этой пациентке была проведена эксплантация желудочковой вспомогательной системы [27].
В настоящее время нет единого определения, которое позволило бы систематизировать подобные клинические случаи. Это привело к появлению разных новых понятий: "кардиомиопатия, индуцированная преэкзитацией" (preexcitation induced cardiomyopathy), "симптомный манифестирующий феномен ВПУ" (symptomatic manifesting WPW phenomenon) [9, 26]. В 2013г была разработана классификация кардиомиопатий — MOGE (S), согласно которой их следует классифицировать по нескольким признакам: морфофункциональный фенотип, вовлечение других органов и систем, генетический или семейный характер наследования и этиологии (генетической или не генетической), и отдельно указывается дополнительная информация (функциональный класс, наличие нарушения ритма сердца и др.). Морфофункциональный фенотип, являясь высшей категорией в предложенной классификации, содержит обозначения только для 5 видов кардиомиопатий: ДКМП, гипертрофическая, рестриктивная кардиомиопатии, аритмогенная кардиомиопатия ПЖ и некомпактный миокард ЛЖ [28]. В данной классификации нет указаний на кардиомиопатии, связанные с нарушением ритма сердца. Возможно только дополнить морфофункциональный фенотип сопутствующим нарушением ритма сердца, в т.ч. феномен/синдром ВПУ [29]. В 2019г Американская коллегия кардиологов/Американская ассоциация сердца (ACC/AHA) предложила собственную классификацию кардиомиопатий у детей. В отдельную группу выделены кардиомиопатии, ассоциированные с нарушением ритма сердца (cardiomyopathy associated with arrhythmia substrate). К данной группе отнесены: аритмогенная желудочковая кардиомиопатия (предыдущее название аритмогенная дисплазия ПЖ), кардиомиопатия, вызванная каналопатиями (синдром удлиненного/укороченного интервала QT, синдром Бругада, катехоламинергическая полиморфная желудочковая тахикардия, болезнь Лева-Ленегра), а также тахииндуцированная и пейсмейкер-индуцированная кардиомиопатии (tachycardia- and pacing-induced cardiomyopathy) [30].
James T. N. назвал синдром ВПУ "Розеттским камнем электрокардиографии", поскольку полное понимание всех его особенностей и их возможных механизмов включает в себя множество фундаментально важных принципов [31].
Заключение
Описание синдрома ВПУ открыло глаза кардиологам и электрофизиологам всего мира на патогенез тахиаритмий на наджелудочковом и желудочковом уровне. До "открытия" синдрома ВПУ интерпретация соответствующих явлений была сродни чтению иероглифических знаков, а четкое понимание патофизиологии и определение практической клинической значимости были невозможны. Поэтому работу L. Wolff, J. Parkinson, P. D. White, результатом которой стала электрофизиологически правильная интерпретация распространения возбуждения по механизму re-entry как причины пароксизмальных тахиаритмий, можно сравнить с расшифровкой иероглифического письма Шампольоном в 1822г с помощью Розеттского камня. Если аритмогенная, тахииндуцированная кардиомиопатия — это достаточно изученная проблема в детской кардиологии, то причинно-следственная связь между функционированием ДПЖС и развитием диссинхронической кардиомиопатии — относительно новая тема, которая продолжает развиваться в настоящее время. Представленные данные подтверждают необходимость изучения данной темы. Учитывая распространенность данного нарушения ритма у детей, а также неспецифичность причин появления диссинхронической кардиомиопатии (правосторонняя локализация ДПЖС, возраст до 3 лет, расширение комплекса QRS за счёт преэкзитации), существует необходимость в поиске дополнительных причинных факторов развития дисфункции ЛЖ у пациентов с феноменом ВПУ. Обобщение опыта в этой области будет способствовать определению предикторов формирования нарушения систолической функции ЛЖ и диссинхронической кардиомиопатии у пациентов с ВПУ и разработке оптимальных показаний для проведения РЧА ДПЖС у детей.
Эмболизирующие спирали: от истории к современной клинической практике
Ключевые моменты
- На основании как клинического опыта, так и литературных данных можно утверждать, что эндоваскулярные спирали являются важным инструментом в арсенале современной интервенционной радиологии.
- Современные разработки продолжают расширять возможности этой технологии, повышая точность доставки, управляемость и безопасность.
Key messages
- Both clinical experience and literary data shows that endovascular coils are an important tool in modern interventional radiology.
- Modern developments continue to expand the capabilities of this technology, increasing the accuracy of delivery, controllability and safety.
За последние десятилетия в клинической практике наблюдается устойчивый переход от открытых хирургических вмешательств к минимально инвазивным процедурам, выполняемым под контролем визуализации в реальном времени. Минимально инвазивные вмешательства не только существенно расширили возможности лечения сосудистой патологии, но и в большинстве случаев сопровождаются меньшей частотой послеоперационных осложнений по сравнению с традиционной хирургией. Одной из таких процедур является эмболизация — методика, при которой с помощью катетера в целевой сосуд вводится агент, блокирующий кровоток. Процедуры эмболизации проводятся при различных заболеваниях, в т.ч. при аневризмах сосудов различной локализации, для остановки кровотечения или для лизиса опухоли путем блокирования ее кровоснабжения и пр. [1-3]. В настоящее время в клинической практике доступен разнообразный арсенал окклюзионных агентов, включая спирали, инъекционные клеи и эмболические частицы. Каждая категория эмболических агентов характеризуется своими сильными и слабыми сторонами и имеет несколько нишевых клинических сценариев, для которых они идеально подходят. Учитывая тенденцию увеличения количества региональных сосудистых центров в Российской Федерации, оказывающих малоинвазивную помощь пациентам как в экстренных, так и в плановых ситуациях, возрастает число эндоваскулярных эмболизирующих вмешательств [4-7]. В данной работе основное внимание уделяется внутрисосудистым спиралям — одному из наиболее широко используемых и активно развивающихся типов эмболизационных материалов.
Современные эндоваскулярные спирали отличаются широким разнообразием форм, размеров и длин, что позволяет точно адаптировать их к анатомическим особенностям сосудистого русла и клиническим задачам эмболизации. По форме спирали могут быть спиралевидными (helical), прямыми (straight), коническими (tornado) или трёхмерными (3D) — каждая конфигурация обладает своими гемодинамическими преимуществами и направлена на создание оптимальных условий для тромбообразования и надёжной окклюзии. По диаметру спирали делятся на макро- (0,035") и микроспирали (0,018-0,010"): первые применяются в сосудах среднего и крупного калибра, вторые — в условиях суперселективного вмешательства на мелких и витиеватых артериях. Диапазон длины — от 1 мм до 60 см — позволяет варьировать объём эмболизирующего материала в зависимости от протяжённости патологического сегмента. Выбор конкретной спирали определяется диаметром, анатомией и геометрией эмболизируемого сосуда, а также клинической целью — будь то немедленная остановка кровотечения или создание стабильной окклюзии с минимальным количеством имплантатов.
Исторический экскурс
История применения эндоваскулярных спиралей для эмболизации периферических сосудов начинается с начала 1970-х годов, когда Чарльз Доттер и Йозеф Рёш ввели идею селективной артериальной окклюзии для контроля желудочно-кишечного кровотечения. В 1970г Рёш впервые описал успешную эмболизацию гастроэпиплоической артерии свернувшейся кровью у пациентки с коагулопатией, продемонстрировав практическую значимость метода. В 1972г они вместе с Майклом Брауном опубликовали подробный отчёт о селективной артериальной эмболизации при остром желудочном кровотечении, который стал одним из первых системных случаев применения спиралей для периферических артерий [8]. Его практика эмболизации желудочно-кишечных артерий проложила путь к широкому использованию спиралей для остановки кровотечений при травмах, псевдоаневризмах и других не неврологических показаниях. С тех пор технология развивалась: появились макро- и микроспирали, толкаемые и отсоединяемые конструкции, спирали с покрытием, способные плотно закупоривать сосуды — даже небольшого диаметра — и обеспечивающие длительную окклюзию.
Принцип "работы" эндоваскулярной спирали
При введении в целевой сосудистый сегмент спирали обеспечивают постоянную эмболизацию, вызывая тромбоз и полную окклюзию целевого сосуда. Это достигается главным образом благодаря трем синергичным механизмам: (1) замедление кровотока через сосуд за счет механической блокировки, (2) создание тромбогенного каркаса для формирования тромба, и (3) повреждение сосудистой стенки, что приводит к высвобождению тромбогенных факторов. Обычно тромбоз происходит в течение 5 мин после установки спирали, хотя этот временной промежуток может варьироваться в зависимости от типа использованной спирали, размера эмболизируемого сосуда и степени кровотока через эмболизированную структуру. Со временем острый комплекс спираль-тромб превращается в организованный тромб с развитием неоинтимальной гиперплазии и фиброза в стенке сосудов.
Эндоваскулярные спирали обладают рядом важных характеристик, которые влияют на их эффективность и безопасность при эмболизации сосудов. Кроме того, спирали различаются по способу доставки к месту назначения, что также играет важную роль в их использовании. В следующих разделах мы подробно рассмотрим основные свойства спиралей, включая материалы, биосовместимость и тромбогенность, чтобы лучше понять, как эти параметры влияют на работу устройства и его клиническое применение.
Биосовместимость эндоваскулярных спиралей
Биосовместимость является одной из наиболее важной характеристик эндоваскулярных спиралей. Материалы, из которых изготовлены спирали, должны быть биоинертными, чтобы избежать развития местной или системной неблагоприятной реакции со стороны организма.
В большинстве случаев спирали изготавливаются из биоинертных металлических материалов, таких как нержавеющая сталь, платина или нитинол, и могут иметь дополнительное покрытие. Предыдущие исследования по лечению артериовенозных мальформаций показали, что эффективность спиралей из платины и нержавеющей стали не отличается [9]. С теоретической точки зрения, металлический сердечник должен обладать высокой продольной прочностью при минимальном радиальном давлении, чтобы не вызывать избыточную нагрузку на сосудистую стенку. Эти плотные металлы обладают естественной рентгеноконтрастностью, что обеспечивает возможность точного выполнения эмболизации под контролем флюороскопии.
Спирали из нержавеющей стали
Нержавеющая сталь долгое время оставалась одним из основных материалов в области биомедицинских технологий благодаря своей биоинертности, коррозионной стойкости и превосходным механическим свойствам. В 1975г Gianturco C, et al. впервые представили спираль из нержавеющей стали, примененную для постоянной артериальной эмболизации у пациентов через катетеры калибра 6F и 7F (рис. 1 А) [10]. Спирали из нержавеющей стали обладают рентгеноконтрастностью, хотя и в меньшей степени по сравнению с современными металлическими сплавами, такими как платина. Эти спирали относительно жёсткие из-за высокой радиальной прочности, что может затруднять плотную упаковку в сосуде. Ввиду указанных характеристик, спирали из нержавеющей стали в основном применяются для окклюзии сосудов крупного калибра. В отличие от них, спирали из более гибких материалов, например, платины, подходят для эмболизации более мелких сосудов. Эффективность спиралей из нержавеющей стали была подтверждена при лечении артериовенозных мальформаций, гиперспленизма и кровотечений [11, 12].
Спирали из платины
Для улучшения плотности упаковки были разработаны более мягкие платиновые спирали, которые в настоящее время являются одними из самых широко используемых в современной клинической практике (рис. 1 B-D). Спирали из платины обладают высокой биосовместимостью, более податливы, рентгеноконтрастны и мягче спиралей из нержавеющей стали [12]. Благодаря своей податливости, спирали из платины хорошо адаптируются к форме часто неравномерных по форме аневризм при их размещении. Поскольку платиновые спирали не обладают такой высокой радиальной силой, как спирали из нержавеющей стали, их можно плотно упаковывать, не создавая избыточного давления на просвет аневризмального мешка или сосудистой стенки. Более того, в отличие от нержавеющей стали, платина не подвержена электролизу и является в 3-4 раза более тромбогенной, чем нержавеющая сталь [13].
Спирали из нитинола
Нитинол с памятью формы является относительно новым материалом для сердцевины спиралей, несмотря на его широкое применение в производстве стентов. Это интерметаллический (состоящий из двух металлов) сплав, состоящий почти из равных количеств никеля и титана, который обладает способностью восстанавливать свою форму после деформации (т.е. самораскрывающийся). Нитинол обладает более низким коэффициентом упругости и большей прочностью по сравнению с нержавеющей сталью [14]. Он в 10-20 раз более гибок, чем нержавеющая сталь, что указывает на отличную управляемость при введении. Нитинол также обладает отличной биосовместимостью и более устойчив к коррозии по сравнению с нержавеющей сталью, благодаря наличию пассивного титаново-оксидного слоя. Этот слой защищает токсичный компонент никеля от утечек в окружающую среду, тем самым защищая основной материал от коррозии. Кроме того, было показано, что спирали из нитинола, армированные нержавеющей сталью, повышают внутрисосудистую стабильность за счет более высоких радиальных сил по сравнению со стандартными спиралями из нержавеющей стали, при этом не ухудшая манипуляции с ними (рис. 1 E) [15].
Однако биоинертные металлические спирали останавливают кровоток за счёт механического воздействия и в своей эффективности зависят от индивидуальных особенностей гемостаза пациента. Образование тромба при этом инициируется изменениями в гемодинамике, вызванными присутствием спирали. Таким образом, тромб, формирующийся на поверхности биоинертной металлической спирали, как правило, бывает тонким и может существенно варьироваться по толщине в различных участках спирали, между витками, а также у разных пациентов. Более того, новообразованный тромб в основном состоит из эритроцитов и тонких фибриновых волокон, и, следовательно, может не выдерживать артериального давления. Кроме того, физиологическое разрушение тромба может привести к уплотнению спирали и её миграции. Попытки модификации поверхности существующих металлических спиралей привели к разработке нового класса спиралей — биоактивных спиралей.
Тромбогенность
Важным свойством спиралей также является тромбогенность их поверхности, от которой зависят формирование фибрина и адгезия тромбоцитов. Так как механизм функционирования спирали основывается на тромботической окклюзии целевого сегмента, основной акцент в их разработке был сделан на улучшение методов индукции тромбообразования. Для усиления тромбогенного эффекта эндоваскулярных спиралей в их конструкцию часто добавляют волокна, способствующие ускоренной индукции тромбообразования. Первым этот принцип применил Gianturco C, et al., добавив к металлической спирали шерстяные волокна. Впоследствии это привело к широкому распространению "волокнистых" (fibered) спиралей, особенно в ситуациях, где требуется быстрое прекращение кровотока. Trerotola SO, et al. в серии in vivo-экспериментов продемонстрировали, что наличие волокон увеличивает тромбогенность, позволяя добиться окклюзии с меньшим количеством имплантированных спиралей [16].
Спирали с волокнистым покрытием
Первые эндоваскулярные спирали Gianturco C, et al. представляли собой стальную проволоку длиной ~5 см и диаметром примерно 0,89 мм, на которую были намотаны хлопковые волокна длиной ~3 см. Эти хлопковые нити образовывали пористое, шероховатое покрытие, значительно усиливающее тромбогенность спирали за счёт активного взаимодействия с кровью и стимулирования свертывания. Формирование тромба на таких спиралях занимало примерно 10 мин. Однако, несмотря на высокую эффективность в достижении сосудистой окклюзии, спирали с хлопковыми волокнами имели ограничения в безопасности: они могли вызывать локальное воспаление и в редких случаях приводить к реканализации или миграции фрагментов волокон [17]. Для повышения эффективности и безопасности продолжался поиск более совершенных материалов и конструкций. В качестве следующего этапа появились синтетические волокна, призванные повысить безопасность и эффективность устройств (рис. 1 F, G). Одними из первых были дакроновые волокна — прочные и стабильные, но не биоразлагаемые полиэфиры, которые обеспечивали долговременную механическую поддержку тромбированной области, однако могли вызывать длительное раздражение тканей. Для усиления тромбогенного эффекта стали использовать ивалон (поли-виниловый спирт, PVA) — гидрофильный полимер, способный набухать и создавать гелевую структуру, что улучшало заполнение сосуда и активацию свертывающей системы крови. Спирали с прикреплёнными синтетическими волокнами из дакрона, ивалона продемонстрировали снижение воспаления, сохраняя при этом свойства агрегации тромбоцитов [17]. Спирали из платины с нейлоновым покрытием улучшили показатели окклюзии по сравнению с обычными платиновыми спиралями, увеличив их эффективность с 85% до 96% [18].
Спирали с гидрогелевым покрытием
Помимо добавления тромбогенных волокон, как это реализовано в спиралях ранних поколений, таких как Nester и Tornado (Cook Medical), в последние годы были разработаны спирали с гидрогелевым покрытием, которое расширяется и заполняет промежутки в сосуде после установки спирали. Ярким примером таких технологий являются спирали Azur CX HydroCoil (Terumo) (рис. 1 H, I). Гидрогель, нанесённый на поверхность спирали, обладает способностью впитывать влагу и увеличиваться в объёме при контакте с сывороткой или кровью. В процессе набухания гидрогель значительно расширяется, что приводит к увеличению площади поверхности спирали и повышению плотности заполнения просвета сосуда. Это, в свою очередь, существенно усиливает способность устройства задерживать форменные элементы крови и способствует более активному тромбообразованию по сравнению с непокрытыми металлическими спиралями. После стабилизации сгустка сосуд остаётся устойчиво окклюзированным, исключая возможность реканализации и обеспечивая долговременный лечебный эффект.
В исследовании с участием 37 пациентов и 57 артериовенозных мальформаций лёгких эмболизация с использованием 0,018-дюймовых гидрогелевых спиралей была технически успешной в 98% случаев (56 из 57). За медианный период наблюдения 19 мес. (от 2 до 47 мес.) не зарегистрировано ни одного случая реканализации, а также серьёзных осложнений [19].

Рис. 1. Различные типы и модификации эмболизационных спиралей. А. Спираль из нержавеющей стали. B. Платиновая спираль Optima (Balt). C. Платиновая спираль Axium Prime (Medtronic). D. Платиновая спираль Packing coil (Penumbra, Inc.). E. Спираль Nexus с нитиноловой сердцевиной (Micro Therapeutics, Inc.). F. Платиновая спираль с нейлоновыми волокнами Nester (Cook Medical). G. Спираль с синтетическими волокнами MReye Flipper (Cook Medical). H. Спираль с гидрогелевым покрытием Azur CX HydroCoil (Terumo). I. Спираль с гидрогелевым покрытием HydroFrame (MicroVention, Inc.).
Клиническое применение эндоваскулярных спиралей
Эмболизация внутренней подвздошной артерии
Изолированные аневризмы внутренней подвздошной артерии (ВПА) (гипогастральной артерии) являются редкой формой аорто-подвздошной аневризматической патологии и встречаются примерно в 0,04% всех аорто-подвздошных аневризм. Благодаря глубокому расположению в малом тазу эти аневризмы часто диагностируются на поздних стадиях и достигают значительных размеров (рис. 2). Риск разрыва таких аневризм высок и достигает до 38% при первичной постановке диагноза, при этом смертность от разрыва достигает 58%, что подчёркивает необходимость своевременного выявления и лечения данной патологии. Ввиду отсутствия проспективных рандомизированных исследованиях, сравнивающих эффективность и безопасность открытой хирургии против эндоваскулярного исключения аневризмы, однозначно ответить на вопрос какая из стратегий предпочтительнее невозможно. Так, в ретроспективном исследовании Choi E, et al. сравнили исходы у 58 пациентов с изолированными аневризмами подвздошной артерии (25 — открытая хирургия, 33 — эндоваскулярная хирургия) [20]. В группе эндоваскулярной хирургии чаще встречались поздние осложнения (15,2% vs 0%, p=0,04) и повторные вмешательства (9,1% vs 4,0%, p=0,44), при этом смертность и частота MACE не различались между группами. Авторы приходят к выводу, что у пациентов с низким операционным риском и более молодым возрастом (66,0±8,2 года vs 73,1±8,6 лет, p=0,003) открытая хирургия предпочтительнее. С целью улучшения результатов эндоваскулярного лечения аневризм подвздошных артерий были предложены комбинированные методы, когда в дополнение к эндоваскулярному закрытию ВПА эндоваскулярными спиралями, выполняется имплантация стент-графта с перекрытием устья ВПА. Так, в исследовании Yang M, et al. были включены 42 пациента (средний возраст 71 год) с изолированными аневризмами ВПА, из которых 12 случаев были разорвавшимися [21]. Применялись различные методы: открытая резекция (n=6), эмболизация (n=12), стент-графт (n=8) и их комбинация (n=16), при этом наименьшие показатели эндоликов (6%) и повторных вмешательств (6%) отмечены при комбинированном подходе. Общая 30-дневная смертность составила 5%, но достигала 17% у пациентов с разрывом, а наиболее частым осложнением у выживших стала перемежающаяся боль в ягодице (18%). Тем не менее эндоваскулярная эмболизация изолированной аневризмы подвздошной артерии спиралями на сегодняшний день представляет собой жизнеспособный вариант лечения и может быть успешно реализована в условиях опытных специализированных центров (рис. 3, 4).
Другим, и наиболее частым, показанием для эмболизации ВПА является профилактика эндолика при стентировании аневризм брюшной аорты (АБА). С момента разработки эндоваскулярного протезирования аорты в 1991г данная технология прочно вошла в клиническую практику в роли общепринятого метода лечения АБА. По мере накопления опыта и совершенствования эндопротезов показания к эндопротезированию АБА значительно расширились. В частности, при распространении аневризматического процесса на подвздошные артерии для достижения адекватной дистальной зоны фиксации и профилактики развития эндоликов нередко требуется эмболизация ВПА [22][23]. Эффективность применения эндоваскулярных спиралей для эмболизации ВПА перед плановым эндопротезированием АБА описана в ряде зарубежных работ. В работе Kim WC, et al. технический успех вмешательства (13 случаев) составил 100%, а за 3-мес. период наблюдения не было отмечено ни одного случая развития эндолика II типа. Клинически значимые нежелательные явления (в частности, ягодичная боль) были зарегистрированы лишь у 2 из 13 пациентов, однако эти симптомы полностью регрессировали в ходе дальнейшего наблюдения [24]. В другой работе Chun JY, et al. эндоваскулярные спирали для эмболизации ВПА перед эндопротезированием АБА были применены в 70 из 111 случаев, технический успех в общей популяции пациентов составил 95,7%. Эндолик 2 типа из ранее эмболизированных ВПА был отмечен в 4 случаях в срок между первой неделей и вторым месяцем после эндопротезирования, один из которых привел к увеличению диаметра аневризматического мешка и потребовал повторного вмешательства. В серии наблюдений сообщалось о частоте ягодичной хромоты в 38%, которая длилась <12 мес. у 26% пациентов и ограничивала образ жизни у 17% [25]. Таким образом, на сегодняшний день стандартная техника эмболизации спиралями перед эндопротезированием брюшного отдела аорты описана как безопасная и эффективная процедура. Хотя анатомия аорто-подвздошных аневризм может быть технически сложна для навигации во время эмболизации ВПА, процедура выполнима с высокими техническими показателями успеха, приближающимися к 100% [26][27].
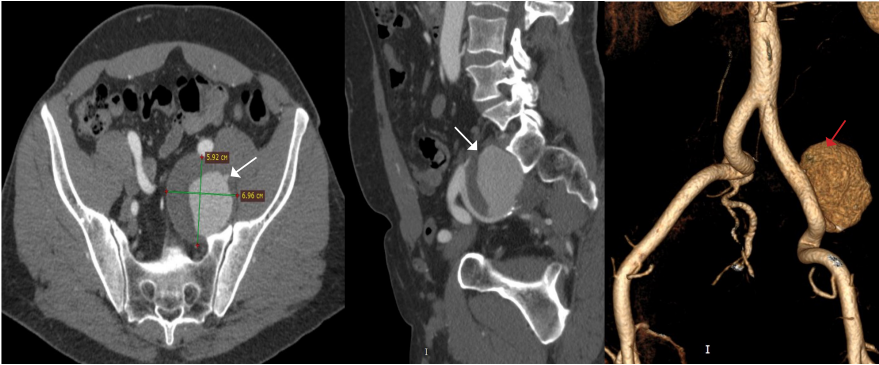
Рис. 2. Аневризма левой ВПА (стрелки).
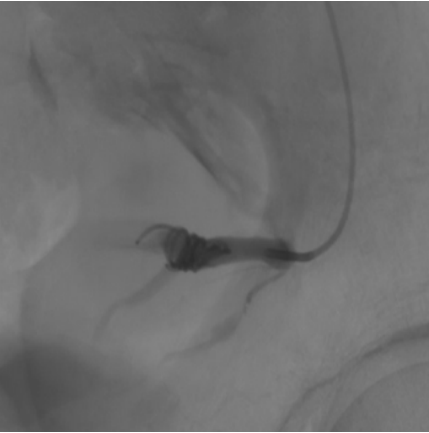
Рис. 3. Эндоваскулярная спираль в ВПА.
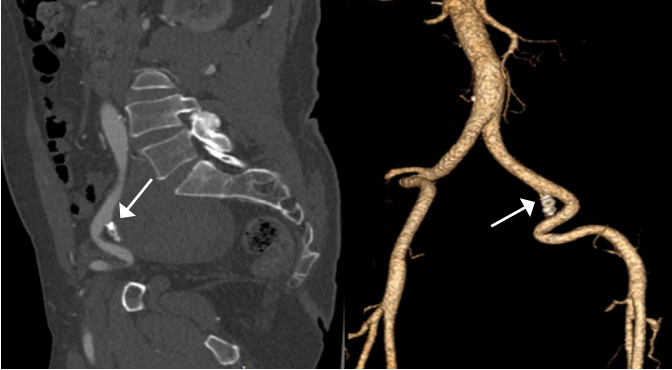
Рис. 4. Окклюзированная ВПА по данным мультиспиральной компьютерной томографии (стрелки).
Лечение осложнений после эндопротезирования аорты
В настоящее время эндоваскулярное лечение аневризмы аорты широко применяется как менее травматичная замена открытой хирургии. Тем не менее эта процедура может сопровождаться осложнениями, такими как эндолики — продолжающееся поступление крови в полость аневризмы после вмешательства. Это состояние опасно тем, что может привести к увеличению аневризматического мешка и повысить риск его разрыва. Выделяют пять основных типов эндоликов. Тип 1 может быть проксимальным (1А) или дистальным (1B) относительно места установки протеза. При типе 1A эндопротез не полностью герметизирует проксимальную часть аневризмы, и кровь проникает между стенкой аорты и материалом протеза. При типе 1B утечка происходит между стенкой дистального отдела аорты и протезом. Тип 2 возникает из-за ретроградного кровотока через ветви аорты, заполняющего мешок аневризмы. Тип 3 связан с разрывом или разъединением компонентов эндопротеза. Тип 4 обычно наблюдается во время установки имплантата у пациентов на антикоагулянтной терапии и вызван пористостью материала протеза. Тип 5 (эндотензия) — это увеличение аневризматического мешка без видимого эндолика [28]. Каждый тип эндолика требует особого подхода к диагностике и лечению, т.к. представляет разную степень риска для пациента. Эндолики 1 типа встречаются в 9% случаев [29] и являются показанием к повторному вмешательству из-за высокого риска разрыва в 52% случаев после эндопротезирования АБА [30] и от 3% до 16% случаев после эндопротезирования аневризмы грудной аорты [31][32]. Fabre D, et al. продемонстрировали высокий 100% технический успех эндоваскулярной эмболизации эндолика у 83 пациентов с эндопротезированием аневризмы аорты. Размеры аневризматического мешка были значимо уменьшены через 6, 12 и 24 мес. (p=0,001) [33]. Таким образом, эндоваскулярная эмболизация эндоликов может быть рекомендована у пациентов после эндопротезирования аневризмы аорты с осложнившим эндоликом с целью снижения рисков увеличения размеров аневризматического мешка и уменьшения рисков разрыва аорты.
С развитием методов эндопротезирования грудной аорты все чаще применяется техника in-situ фенестрации подключичной артерии, позволяющая сохранить её проходимость при необходимости расширения проксимальной зоны фиксации стент-графта. Такая стратегия обеспечивает адекватное закрытие аневризмы при сохранении кровотока по важным артериальным ветвям. Однако данная техника сопряжена с риском возникновения эндолика типа 1C — краевой утечки крови через устье ветви, что может быть обнаружено как на мультиспиральной компьютерной томографии, так и на аортографии (рис. 5, 6). В случае с подключичной артерией, именно она может стать источником ретроградного кровотока в исключённый аневризматический мешок, что сохраняет давление внутри аневризмы и угрожает её дальнейшему прогрессированию. С расширением метода стентирования грудной при лечении сложной патологии дуги аорты всё более актуальным становится развитие эффективных методов устранения технических и процедурных неудач с целью повышения безопасности и улучшения результатов лечения (рис. 7). Ряд авторов демонстрируют успешное применение эндоваскулярных спиралей при таких сценариях [34][35].
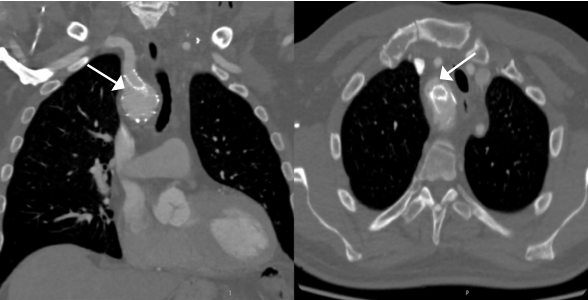
Рис. 5. Эндолик 1C типа из правой подключичной артерии (стрелки) после стентирования грудной аорты.
Рис. 6. Ангиография правой подключичной артерии. Эндолик 1C и заполнение полости аневризмы (стрелки).
Рис. 7. Исключенный источник эндолика эндоваскулярной спиралью.
Эндоваскулярная эмболизация при кровотечениях
Эндоваскулярная эмболизация с применением спиралей является широко признанным методом при плановом лечении различных сосудистых заболеваний, включая аневризмы и патологические артериовенозные мальформации. Однако применение этого малоинвазивного метода также эффективно и в ургентных, неотложных состояниях, когда необходимо быстро контролировать, например, массивное кровотечение и стабилизировать пациента. Кровотечения могут быть вызваны травмой, сопутствующим заболеванием или их сочетанием, приводя к тяжелым осложнениям, таким как кардиогенный шок и летальный исход; общая смертность достигает 40% [36]. До появления эндоваскулярных технологий единственным способом остановки кровотечения оставалось открытое хирургическое вмешательство. Однако в современной клинической практике всё чаще предпочтение отдается эндоваскулярной эмболизации, которая в ряде случаев вытеснила хирургический подход. Это связано с её способностью быстро и эффективно контролировать кровотечение с минимальной инвазивностью для пациента, а в ряде клинических ситуаций — и с её уникальной возможностью достигать источников кровотечения, недоступных для открытой хирургии. Так, при некоторых вариантах легочного кровотечения, особенно при повреждении мелких ветвей легочной артерии, традиционная хирургическая коррекция может быть технически невозможна или сопряжена с чрезмерно высоким риском, в то время как эндоваскулярная эмболизация становится единственным жизнеспасающим методом лечения (рис. 8, 9).
Рис. 8. Источник кровотечения из субсегментарной ветви правой нижнедолевой легочной артерии (стрелка).
Рис. 9. Ангиопульмонография субсегментарной ветви правой нижнедолевой легочной артерии. Исключение источника кровотечения спиралью (стрелка).
Травматические кровотечения, например, при повреждениях тазовых сосудов вследствие ДТП или переломов таза, часто требуют экстренного вмешательства. В таких случаях эндоваскулярная эмболизация, включая использование спиралей и окклюдеров, позволяет эффективно остановить кровотечение, избегая открытой операции, что особенно важно у гемодинамически нестабильных пациентов.
Нетравматические кровотечения включают широкий спектр патологий, среди которых особое место занимают гинекологические и желудочно-кишечные кровотечения. В акушерской практике, например, послеродовые кровотечения могут быть причиной высокой материнской смертности. Эмболизация маточных артерий с помощью спиралей доказала свою высокую эффективность и безопасность, позволяя контролировать кровотечение и сохранять репродуктивную функцию у женщин. Клиническая успешность такого лечения колеблется от 79 до 100%, при этом уровень осложнений остаётся низким и в основном связан с непреднамеренной эмболизацией смежных сосудов [37].
В лечении желудочно-кишечных кровотечений эндоваскулярная эмболизация становится следующим этапом при неудаче консервативной терапии и эндоскопии. Суперселективная катетеризация позволяет точно локализовать источник кровотечения и применить спирали для окклюзии поражённого сосуда, что уменьшает риск ишемии тканей. Техническая успешность процедуры достигает почти 100%, а клиническая эффективность — около 70-83% в зависимости от локализации кровотечения [38][39]. В исследовании Extrat C, et al. эндоваскулярная эмболизация брыжеечной артерии была проведена у 15 пациентов [40]. Технический успех был достигнут в 93,3% случаев (14 из 15). При этом наиболее частым эмболизирующим материалом были эндоваскулярные спирали — 8 (53,3%). Раннее повторное кровотечение возникло у 20% пациентов (3 из 15), при этом 2 пациентам было повторно выполнена эмболизация целевой артерии; 30-дневная смертность составила 6,7% (1 пациент), а поздняя смертность — 13,3% (2 пациента). Средняя продолжительность госпитализации — 12,8±7 дней, при этом ишемических осложнений, связанных с эмболизацией, не было зарегистрировано. Эти данные подтверждают безопасность и высокую эффективность эндоваскулярной эмболизации, в т.ч. с помощью эндоваскулярных спиралей, как метода первой линии при брыжеечном кровотечении.
Еще одним важным направлением применения эмболизации при кровотечениях является лечение кровотечений, связанных с опухолевыми процессами, как первичными, так и возникающими на фоне противоопухолевой терапии. Около 10% онкологических пациентов сталкиваются с эпизодами кровотечения, степень выраженности которых варьирует от незначительных до катастрофических, угрожающих жизни [41]. Причиной может выступать как сам опухолевый процесс (инвазия сосудов, разрыв атипичных сосудов, травма), так и сопутствующие состояния, включая тромбоцитопению, печёночную недостаточность и антикоагулянтную терапию. Для контроля значимых кровотечений всё более важную роль занимает эндоваскулярная эмболизация, особенно в условиях, когда хирургия или другие методы невозможны, однако данные о её применении при опухолевых кровотечениях ограничены и разрознены. Интересный анализ проведен Minici R, et al. в рамках многоцентрового ретроспективного исследования, включившего 92 пациента с солидными новообразованиями, которым выполнялась эндоваскулярная эмболизация по поводу кровотечения в период с января 2020г по май 2023г [42]. Технический успех достигнут в 89,1% случаев, а клинический — в 84,8%, при этом наиболее частой локализацией кровотечения была печень (21,7%), а основным эмболизирующим агентом выступали частицы поливинилспирта (30,4%). Однако в подгруппе пациентов, которым эмболизация проводилась с использованием эндоваскулярных спиралей, отмечались худшие показатели: технический успех составил всего 55,6% vs 97,3% в контрольной группе (p<0,0001), клинический успех был ниже — 44,4% vs 94,6% (p<0,0001). При этом частота проксимальной эмболизации была значительно выше — 50% vs 13,5% (p=0,0019), а риск повторного кровотечения в течение 30 дней вырос до 55,6% по сравнению с 5,4% в группе без спиралей (p<0,0001). Учитывая разнородный характер данных, необходимы дальнейшие исследования роли эндоваскулярных спиралей у данной категории пациентов с проспективным дизайном и более крупной выборкой.
Заключение
На основании как клинического опыта, так и литературных данных, можно утверждать, что эндоваскулярные спирали являются важным инструментом в арсенале современной интервенционной радиологии. Их универсальность, предсказуемость и эффективность делают их применимыми в самых разных ангиографических сценариях — от экстренных вмешательств до плановых процедур. Современные разработки продолжают расширять возможности этой технологии, повышая точность доставки, управляемость и безопасность. В дальнейшем спирали будут и дальше совершенствоваться, соответствуя растущим требованиям клинической практики и индивидуализации подходов к лечению.
Список литературы
1. Ibanez B, James S, Agewall S, et al.; ESC Scientific Document Group. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018;39(2):119-77. doi:10.1093/eurheartj/ehx393.
2. Аверков О. В., Арутюнян Г. К., Дупляков Д. В. и др. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2024. Российский кардиологический журнал. 2025;30(3):6306. doi:10.15829/1560-4071-2025-6306.
3. Silber S, Albertsson P, Avilés FF, et al. Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Guidelines for percutaneous coronary interventions. The Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Eur Heart J. 2005;26(8):804-47. doi:10.1093/eurheartj/ehi138.
4. Wijns W, Kolh P, Danchin N, et al. Guidelines on myocardial revascularization. Eur Heart J. 2010;31(20):2501-55. doi:10.1093/eurheartj/ehq277.
5. Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012;33(20):2569-619. doi:10.1093/eurheartj/ehs215.
6. Windecker S, Kolh P, Alfonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-¬Thoracic Surgery (EACTS) Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014;35(37):2541-619. doi:10.1093/eurheartj/ehu278.
7. Byrne RA, Rossello X, Coughlan JJ, et al. ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44(38):3720-826. doi:10.1093/eurheartj/ehad191.
8. Аверков О. В., Дупляков Д. В., Гиляров М. Ю. и др. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. doi:10.15829/1560-4071-2020-4103. EDN: KNQWWK.
9. Алекян Б. Г., Бойцов С. А., Маношкина Е. М., Ганюков В. И. Анализ Российских национальных показателей реваскуляризации миокарда у больных с острым коронарным синдромом в 2022 году. Эндоваскулярная хирургия. 2023;10(3):260-9.
10. Алекян Б. Г., Бойцов С. А., Ганюков В. И., Маношкина Е. М. Влияние пандемии COVID-19 на реваскуляризацию миокарда у пациентов с острым коронарным синдромом в Российской Федерации. Рациональная фармакотерапия в кардиологии. 2022;18(4):411-9. doi:10.20996/1819-6446-2022-08-03.
11. Алекян Б. Г., Бойцов С. А., Маношкина Е. М., Ганюков В. И. Реваскуляризация миокарда в Российской Федерации при остром коронарном синдроме в 2016-2020 гг. Кардиология. 2021;61(12):4-15.
12. Алекян Б. Г., Ганюков В. И., Маношкина Е. М. и др. Реваскуляризация при инфаркте миокарда с подъемом сегмента ST в Российской Федерации. Анализ результатов 2018 года. Эндоваскулярная хирургия. 2019;6(2):89-97.
13. Stent for life. How to guide. Stent for Life is a joint initiative between the European Association of Percutaneous Cardiovascular Interventions (EAPCI), a registered branch of the European Society of Cardiology (ESC), and EuroPCR. doi:10.13140/RG.2.1.2158.2801.
14. Keeley EC, Boura JA, Grines CL, et al. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction a quantitative review of 23 randomized trials. Lancet. 2003;361:13-20.
15. Huynh T, Perron S, O’Loughlin J, et al. Comparison of primary percutaneous coronary intervention and fibrinolytic therapy in ST-segment-elevation myocardial infarction: bayesian hierarchical meta-analyses of randomized controlled trials and observational studies. Circulation. 2009;119(24):3101-9. doi:10.1161/CIRCULATIONAHA.108.793745.
16. Барбараш Л. С., Ганюков В. И. Организация и тактика проведения чрескожного коронарного вмешательства при инфаркте миокарда с подъемом сегмента ST. Кемерово, 2012. 230 с.
17. Armstrong P, Gershlick A, Goldstein P, et al. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N Engl J Med. 2013;368:1379-87. doi:10.1056/NEJMoa1301092.
18. Van de Werf F, Ristić AD, Averkov OV, et al. STREAM-2 Investigators. STREAM-2: Half-Dose Tenecteplase or Primary Percutaneous Coronary Intervention in Older Patients With ST-Segment-Elevation Myocardial Infarction: A Randomized, Open-Label Trial. Circulation. 2023;148(9):753-64. doi:10.1161/CIRCULATIONAHA.123.064521.
19. Danchin N, Popovic B, Puymirat E, et al. FAST-MI Investigators. Five-year outcomes following timely primary percutaneous intervention, late primary percutaneous intervention, or a pharmaco-invasive strategy in ST-segment elevation myocardial infarction: the FAST-MI programme. Eur Heart J. 2020;41(7):858-66. doi:10.1093/eurheartj/ehz665.
20. Bainey K, Armstrong P, Zheng Y, et al. Pharmacoinvasive strategy versus primary percutaneous coronary intervention in ST-elevation myocardial infarction in clinical practice insights from the Vital Heart Response Registry. Circ Cardiovasc Interv. 2019;12:e008059. doi:10.1161/CIRCINTERVENTIONS.119.008059.
21. Danchin N, Coste P, Ferriиres J, et al.; FAST-MI Investigators. Comparison of thrombolysis followed by broad use of percutaneous coronary intervention with primary percutaneous coronary intervention for ST-segment-elevation acute myocardial infarction: data from the French registry on Acute ST-elevation Myocardial Infarction (FAST-MI). Circulation. 2008;118:268-76. doi:10.1161/CIRCULATIONAHA.107.762765.
22. Danchin N, Puymirat E, Steg PG, et al. FAST-MI 2005 Investigators. Five-year survival in patients with ST-segment-elevation myocardial infarction according to modalities of reperfusion therapy: the French Registry on Acute ST-Elevation and Non-ST-Elevation Myocardial Infarction (FAST-MI) 2005 Cohort. Circulation. 2014;129:1629-36. doi:10.1161/CIRCULATIONAHA.113.005874.
23. Rashid MK, Guron N, Bernick J, et al. Safety and efficacy of a pharmacoinvasive strategy in ST-segment elevation myocardial infarction. JACC Cardiovasc Interv. 2016;9:2014-2020. doi:10.1016/j.jcin.2016.07.004.
24. Siontis KC, Barsness GW, Lennon RJ, et al. Pharmacoinvasive and Primary Percutaneous Coronary Intervention Strategies in ST-Elevation Myocardial Infarction (from the Mayo Clinic STEMI Network). Am J Cardiol. 2016;117:1904-10. doi:10.1016/j.amjcard.2016.03.036.
25. Sim DS, Jeong MH, Ahn Y, et al. Korea Acute Myocardial Infarction Registry (KAMIR) Investigators. Pharmacoinvasive strategy versus primary percutaneous coronary intervention in patients with ST-segment–elevation myocardial infarction. Circ Cardiovasc Interv. 2016;9:e003508. doi:10.1161/CIRCINTERVENTIONS.115.003508.
26. Jamal J, Idris H, Faour A, et al. Late outcomes of ST-elevation myocardial infarction treated by pharmaco-¬invasive or primary percutaneous coronary intervention. European Heart Journal. 2023;44(6):516-28. doi:10.1093/eurheartj/ehac661.
27. Jortveit J, Pripp AH, Halvorsen S, et al. Outcomes after delayed primary percutaneous coronary intervention vs. pharmaco-invasive strategy in ST-segment elevation myocardial infarction in Norway. European Heart Journal. Cardiovascular Pharmacotherapy. 2022;8(5):442-51. doi:10.1093/ehjcvp/pvab041.
28. Бойцов С. А., Алекян Б. Г., Шахнович Р. М., Ганюков В. И. Что меняется в лечении острого коронарного синдрома в Российской Федерации? Рациональная фармакотерапия в кардиологии. 2022;18(6):703-9.
29. Gierlotka M, Gasior M, Wilczek K, et al. Reperfusion by primary percutaneous coronary intervention in patients with ST-segment elevation myocardial infarction within 12 to 24 hours of the onset of symptoms (from a prospective national observational study [PL-ACS]). Am J Cardiol. 2011;107:501-8. doi:10.1016/j.amjcard.2010.10.008.
30. Schömig A, Mehilli J, Antoniucci D, et al. Beyond 12 hours Reperfusion AlternatiVe Evaluation (BRAVE-2) Trial Investigators. Mechanical reperfusion in patients with acute myocardial infarction presenting more than 12 hours from symptom onset: a randomized controlled trial. JAMA. 2005;293(23):2865-72. doi:10.1001/jama.293.23.2865.
31. Ndrepepa G, Kastrati A, Mehilli J, et al. Mechanical reperfusion and long-term mortality in patients with acute myocardial infarction presenting 12 to 48 hours from onset of symptoms. JAMA. 2009;301(5):487-8.
32. Bouisset F, Gerbaud E, Bataille V, et al. Percutaneous myocardial revascularization in late-presenting patients with STEMI. J Am Coll Cardiol. 2021;78:1291-305. doi:10.1016/j.jacc.2021.07.039.
33. Busk M, Kaltoft A, Nielsen SS, et al. Infarct size and myocardial salvage after primary angioplasty in patients presenting with symptoms for <12 h vs. 12-72 h. Eur Heart J. 2009;30(11):1322-30. doi:10.1093/eurheartj/ehp113.
34. Aggarwal P, Rekwal L, Sinha SK, et al. Predictors of no-reflow phenomenon following percutaneous coronary intervention for ST-segment elevation myocardial infarction. Ann Cardiol Angeiol (Paris). 2021;70(3):136-42. doi:10.1016/j.ancard.2021.04.004.
35. Hochman JS, Lamas GA, Buller CE, et al. Occluded Artery Trial Investigators. Coronary intervention for persistent occlusion after myocardial infarction. N Engl J Med. 2006;355(23): 2395-407. doi:10.1056/NEJMoa066139.
36. Menon V, Pearte CA, Buller CE, et al. Lack of benefit from percutaneous intervention of persistently occluded infarct arteries after the acute phase of myocardial infarction is time independent: insights from Occluded Artery Trial. Eur Heart J. 2009;30:183-91. doi:10.1093/eurheartj/ehn486.
37. Ioannidis JP, Katritsis DG. Percutaneous coronary intervention for late reperfusion after myocardial infarction in stable patients. Am Heart J. 2007;154(6):1065-71. doi:10.1016/j.ahj.2007.07.049.
38. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-77. doi:10.1093/eurheartj/ehz425.
39. Gershlick AH, Stephens-Lloyd A, Hughes S, et al. REACT Trial Investigators. Rescue angioplasty after failed thrombolytic therapy for acute myocardial infarction. N Engl J Med. 2005;353(26):2758-68. doi:10.1056/NEJMoa050849.
40. Cantor WJ, Fitchett D, Borgundvaag B, et al. Routine early angioplasty after fibrinolysis for acute myocardial infarction. N Engl J Med. 2009;360:2705-18. doi:10.1056/NEJMoa0808276.
41. Di Mario C, Dudek D, Piscione F, et al. Immediate angioplasty versus standard therapy with rescue angioplasty after thrombolysis in the Combined Abciximab REteplase Stent Study in Acute Myocardial Infarction (CARESS-in-AMI): an open, prospective, randomised, multicentre trial. Lancet. 2008;371:559-68. doi:10.1016/s0140-6736(08)60268-8.
42. Bøhmer E, Hoffmann P, Abdelnoor M, et al. Efficacy and safety of immediate angioplasty versus ischemia-guided management after thrombolysis inacute myocardial infarction in areas with very long transfer distances results of the NORDISTEMI (NORwegian study on DIstrict treatment of ST-elevation myocardial infarction). J Am Coll Cardiol. 2010;55:102-10. doi:10.1016/j.jacc.2009.08.
43. Cho KH, Han X, Ahn JH, et al. Long-term outcomes of patients with late presentation of ST-segment elevation myocardial infarction. J Am Coll Cardiol. 2021;77:1859-70.
Об авторах
О. Л. БарбарашРоссия
Ольга Леонидовна Барбараш — академик РАН, д.м.н., профессор, директор
Кемерово
Р. С. Тарасов
Россия
Роман Сергеевич Тарасов — д.м.н., доцент, зав. лабораторией рентгенэндоваскулярной и реконструктивной хирургии сердца и сосудов
Кемерово
А. И. Данилович
Россия
Арина Игоревна Данилович — к.м.н., врач по рентгенэндоваскулярным диагностике и лечению
Кемерово
В. И. Ганюков
Россия
Владимир Иванович Ганюков — д.м.н., зав. отделом хирургии сердца и сосудов
Кемерово
Дополнительные файлы
- В обзоре представлены все виды чрескожного коронарного вмешательства (ЧКВ), используемые у больных с инфарктом миокарда с подъемом сегмента ST (ИМпST).
- Эндоваскулярные вмешательства при ИМпST разделяются в зависимости от сроков заболевания, сохраняющейся симптоматики болезни и предварительного использования тромболитической терапии.
- Различные виды ЧКВ при ИМпST имеют не оди- наковую пользу.
- В обзоре на основе доказательной базы обосновывается приоритетная роль первичного ЧКВ в течение 12 ч от начала симптомов среди всех видов реперфузии больных ИМпST, которая закреплена в современных рекомендациях с 2003г.
Рецензия
Для цитирования:
Барбараш О.Л., Тарасов Р.С., Данилович А.И., Ганюков В.И. Виды чрескожных коронарных вмешательств при инфаркте миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2025;30(9S):6369. https://doi.org/10.15829/1560-4071-2025-6369. EDN: ECNBUU
For citation:
Barbarash O.L., Tarasov R.S., Danilovich A.I., Ganyukov V.I. Types of percutaneous coronary interventions in ST-segment elevation myocardial infarction. Russian Journal of Cardiology. 2025;30(9S):6369. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6369. EDN: ECNBUU
JATS XML

















































