Перейти к:
Геометрические характеристики грудной аорты у пациентов с аневризмой восходящего отдела и разной анатомией брахиоцефального ствола
https://doi.org/10.15829/1560-4071-2025-6336
EDN: RXPFCO
Аннотация
Цель. Анализ геометрических параметров грудной аорты у пациентов с аневризмой восходящего отдела в сочетании с нормальной или вариантной анатомией брахиоцефального ствола (БЦС).
Материал и методы. В исследование включено 72 пациента с несиндромными аневризмами восходящей аорты, которые разделены на 2 группы в зависимости от анатомии БЦС: пациенты с единым устьем для БЦС и левой общей сонной артерией (CILCA, n=28) и пациенты с нормальной анатомией сосуда (No CILCA, n=44). На основании данных мультиспиральной компьютерной томографии у всех пациентов проанализированы геометрические особенности восходящего отдела и дуги аорты.
Результаты. По результатам анализа в группах No CILCA и CILCA дополнительно к аневризме тубулярного отдела восходящей аорты отмечена дилатация корня аорты без статистически значимых межгрупповых различий. Длина восходящей аорты в группе No CILCA составила 113 [89; 144] мм vs 108 [63; 143] мм в группе CILCA (p=0,021). При этом длина тубулярного отдела восходящей аорты в группах No CILCA и CILCA составила 86 [63; 123] мм и 82 [40; 103] мм, соответственно (p=0,018). Относительно пациентов группы CILCA у пациентов с нормальной анатомией БЦС чаще диагностировали III тип дуги аорты (27,3% vs 3,6%, p=0,017) и реже I тип дуги аорты (63,6% vs 89,3%, p=0,036).
Заключение. Вариантная анатомия БЦС ("бычья дуга") у пациентов с аневризмой восходящей аорты не обладает негативным профилем в отношении геометрических характеристик грудной аорты по сравнению с пациентами с нормальной анатомией БЦС.
Ключевые слова
Для цитирования:
Панфилов Д.С., Петракова Е.А., Саушкин В.В., Козлов Б.Н. Геометрические характеристики грудной аорты у пациентов с аневризмой восходящего отдела и разной анатомией брахиоцефального ствола. Российский кардиологический журнал. 2025;30(8):6336. https://doi.org/10.15829/1560-4071-2025-6336. EDN: RXPFCO
For citation:
Panfilov D.S., Petrakova E.A., Saushkin V.V., Kozlov B.N. Thoracic aortic geometry in patients with ascending aortic aneurysm and different anatomy of innominate artery. Russian Journal of Cardiology. 2025;30(8):6336. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6336. EDN: RXPFCO
Современное понимание этиологии и патогенеза аневризм грудной аорты значительным образом дополнилось новыми данными. Тем не менее алгоритм отбора пациентов для своевременного хирургического вмешательства в течение длительного периода времени остается без изменений. Традиционно размер аорты, оцениваемый при мультиспиральной компьютерной томографической аортографии (МСКТ-аортография), остается ведущим критерием в определении показаний к операции [1]. Однако, учитывая парадокс аортального размера ("aortic size paradox"), данный параметр не позволяет с высокой точностью прогнозировать риски развития острого расслоения аорты [2]. В последние годы возможности МСКТ-аортографии серьезно возросли, что позволило дополнительно анализировать целый ряд геометрических параметров, включая длину и кривизну разных отделов грудной аорты, а также анатомические варианты супрааортальных сосудов [2-4]. Некоторые авторы отводят этим характеристикам важную роль в качестве значимых предикторов аортальных событий [5]. С учетом этого становится все более востребованной мультифакторная модель оценки риска развития аорто-ассоциированных осложнений, которая включает установленные (антропометрические), вероятные (наследственные) и потенциальные (анатомические) факторы риска [2]. Между тем стоит отметить, что несмотря на возрастающий интерес к изучению анатомических особенностей аорты как к дополнительному фактору риска аорто-ассоциированных событий, недостаточная доказательная база опубликованных данных требует дополнительного детального анализа этих характеристик. Таким образом, целью исследования явился анализ геометрических параметров грудной аорты у пациентов с аневризмой восходящего отдела в сочетании с нормальной или вариантной анатомией брахиоцефального ствола (БЦС).
Материал и методы
В период с 2013 по 2023гг были проанализированы предоперационные данные компьютерной томографии пациентов с патологией восходящей аорты (n=259). Несиндромные аневризмы восходящей аорты были критерием включения в исследование. Критериями исключения стали острое и хроническое расслоение аорты, интрамуральная гематома, пенетрирующая атеросклеротическая язва, ложная аневризма любой части грудной аорты, синдромные аневризмы грудной аорты, а также аневризмы дуги аорты. Кроме этого, из исследования были исключены пациенты, которым МСКТ-аортография была проведена без электрокардиографической (ЭКГ) синхронизации ввиду недостаточной информативности такого исследования. Таким образом, 72 пациента соответствовали заданным критериям отбора. Включенные в исследование пациенты были разделены на 2 группы в зависимости от анатомии БЦС. Пациенты с вариантной анатомией БЦС — единым устьем для БЦС и левой общей сонной артерией (лОСА) (англ. common origin of the innominate and left carotid artery — CILCA) (CILCA, n=28) и пациенты с нормальной анатомией БЦС (No CILCA, n=44). У всех пациентов были проанализированы геометрические особенности: размеры и длины сегментов грудной аорты, а также проведена оценка кривизны дуги аорты.
Данное исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice), проведено в соответствии с этическими нормами, изложенными в Хельсинкской декларации 2013г, и одобрено локальным этическим комитетом (протокол № 260 от 7.02.2024). Исследование выполнено с использованием оборудования Центра коллективного пользования "Медицинская геномика".
Техника измерения аорты. МСКТ-аортографию проводили на аппарате Discovery NM/CT 570C (GE Healthcare). Обработка полученных изображений проводилась на рабочей станции Advantage Workstations 4.3 (GE Healthcare). Для контрастирования грудной аорты использовали йодсодержащий препарат с концентрацией йода 370-400 мг йода/мл в объеме 60-110 мл (в зависимости от массы тела пациента) со скоростью 4-5,5 мл/сек. Сканирование проводилось в ретроспективном режиме ЭКГ-синхронизации для последующего реформатирования изображений в 10 фазах сердечного цикла. Параметры записи исследования были следующими: напряжение на трубке 120 кВ, сила тока 300-600 мА с ЭКГ модуляцией, скорость вращения трубки 0,4 с, питч: 0,20-0,22 (в зависимости от частоты сердечных сокращений).
Максимальный диаметр аорты измеряли в диастолу по внешнему контуру сосуда. Аортальный индекс восходящей аорты рассчитывали как отношение максимального аортального размера на уровне бифуркации легочного ствола к площади поверхности тела.
Длину аорты измеряли перпендикулярно центральной линии просвета сосуда в следующих сегментах: (i) от уровня фиброзного кольца аортального клапана до сино-тубулярного соединения (корень аорты); (ii) от сино-тубулярного соединения до уровня БЦС (тубулярная часть восходящей аорты); (iii) от БЦС до истмуса аорты (дуга аорты); (iv) от истмуса аорты до устья чревного ствола (нисходящая аорта) (рис. 1).
Кроме этого, на основании данных МСКТ-аортографии определяли тип дуги аорты, ориентируясь на расстояние по вертикали от начала БЦС до вершины дуги аорты [6]. Так, к I типу относили дугу аорты, при которой расстояние по вертикали между устьем БЦС и вершиной дуги аорты составляло <1 диаметра лОСА. Ко II типу дуги аорты относили такую дугу, при которой расстояние по вертикали между БЦС и вершиной дуги составляло 1-2 диаметра лОСА. К III типу дуги аорты относили дугу, при которой расстояние по вертикали между БЦС и вершиной дуги аорты было >2 диаметров лОСА (рис. 2).
Статистический анализ. Статистическую обработку данных проводили в программе STASTICA 10.0. Нормальность распределения показателей проверяли с помощью критерия Шапиро-Уилка. Качественные данные описаны частотой встречаемости и процентами. Количественные параметры, подчиняющиеся нормальному закону распределения, описаны с помощью среднего значения (M) и стандартного отклонения (SD). Количественные параметры, не подчиняющиеся закону нормального распределения — с помощью медианы (Me) и интерквартильного интервала (Q25-Q75). При нормальном законе распределения данных для проверки статистической значимости различий количественных показателей в сравниваемых группах использовали t-критерий Стьюдента для независимых групп; критерий Манна-Уитни — при неизвестном законе распределения. Для сравнения категориальных переменных использовались точный критерий Фишера и критерий хи-квадрат. Границы статистической значимости результатов определяли как p<0,05.
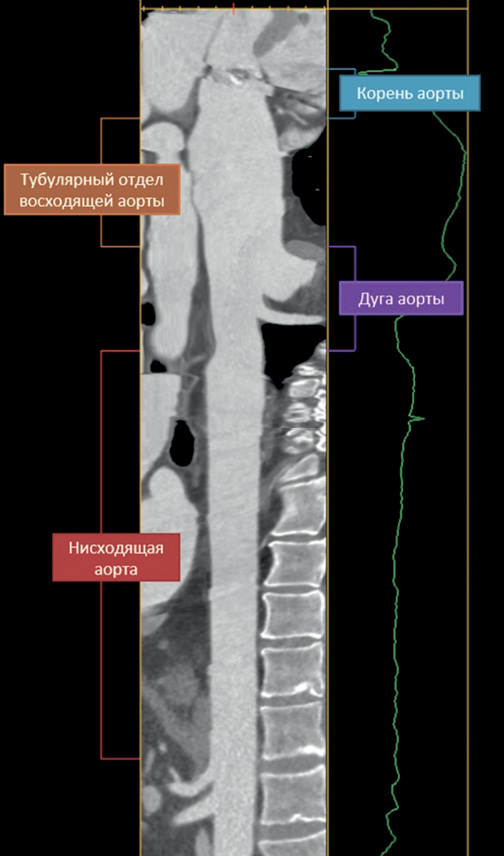
Рис. 1. Трек измерения длины сегментов грудной аорты.
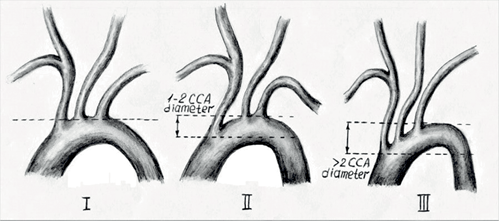
Рис. 2. Классификация типов дуги аорты (по Madhwal et al.).
Таблица 1
Клиническая характеристика пациентов
|
Показатели |
No CILCA (n=44) |
CILCA (n=28) |
P-уровень |
|
Возраст, годы |
63 [ 32; 75] |
59 [ 29; 72] |
0,040 |
|
Мужской пол, n (%) |
29 (65,9%) |
20 (71,4%) |
0,477 |
|
ППТ, м2 |
1,95 [ 1,54; 2,5] |
2,01 [ 1,58; 2,5] |
0,305 |
|
Атеросклероз аорты, n (%) |
5 (11,3%) |
1 (3,5%) |
0,266 |
|
Гипертоническая болезнь, n (%) |
32 (72,7%) |
25 (89,2%) |
0,041 |
|
Двустворчатый АоК, n (%) |
11 (25%) |
9 (32,1%) |
0,455 |
|
Аортальный стеноз (средний градиент >40 мм рт.ст.), n (%) |
7 (15,9%) |
3 (10,7%) |
0,579 |
|
Аортальная недостаточность 2+ степени, n (%) |
13 (29,5%) |
9 (32,1%) |
0,741 |
|
Другие аномалии сосудов дуги, n (%) |
0 |
0 |
<0,999 |
|
Кисты почек, n (%) |
9 (20,4%) |
5 (17,8%) |
0,844 |
Сокращения: АоК — аортальный клапан, ППТ — площадь поверхности тела, CILCA — common origin of the innominate and left carotid artery (единое устье для брахиоцефального ствола и левой общей сонной артерии).
Таблица 2
Данные компьютерно-томографической ангиографии у пациентов
|
Показатели |
No CILCA (n=44) |
CILCA (n=28) |
P-уровень |
|
Размеры грудной аорты |
|||
|
Корень аорты, мм |
44 [ 32; 65] |
45 [ 34; 70] |
0,319 |
|
Тубулярная часть восходящей аорты, мм |
51 [ 43; 70] |
49 [ 41; 69] |
0,266 |
|
Аортальный индекс, см/м2 |
2,6 [ 1,7; 3,5] |
2,5 [ 1,8; 4,05] |
0,086 |
|
Дуга аорты, мм |
32 [ 24; 41] |
32 [ 25; 39] |
0,842 |
|
Длина грудной аорты |
|||
|
Общая длина ВоА (от АоК до БЦС), мм |
113 [ 89; 144] |
108 [ 63; 143] |
0,021 |
|
Общая длина ВоА >115 мм, n (%) |
20 (45,5%) |
8 (28,5%) |
0,156 |
|
Общая длина ВоА <115 мм, n (%) |
24 (54,5%) |
20 (71,5%) |
0,154 |
|
Корень аорты, мм |
23 [ 13; 39] |
25 [ 13; 40] |
0,306 |
|
Тубулярная часть ВоА, мм |
86 [ 63; 123] |
82 [ 40; 103] |
0,018 |
|
Дуга аорты, мм |
54 [ 35; 81] |
58 [ 32; 88] |
0,355 |
|
Сегмент аорты корень-тубулярный отдел-дуга, мм |
168 [ 133; 218] |
161 [ 120; 202] |
0,113 |
Сокращения: АоК — аортальный клапан, ВоА — восходящая аорта, БЦС — брахиоцефальный ствол, CILCA — common origin of the innominate and left carotid artery (единое устье для брахиоцефального ствола и левой общей сонной артерии).
Таблица 3
Распределение пациентов по типу дуги аорты
|
Тип дуги |
No CILCA (n=44) |
CILCA (n=28) |
P-уровень |
|
I тип |
28 (63,6%) |
25 (89,3%) |
0,036 |
|
II тип |
4 (9,1%) |
2 (7,1%) |
0,774 |
|
III тип |
12 (27,3%) |
1 (3,6%) |
0,017 |
Сокращение: CILCA — common origin of the innominate and left carotid artery (единое устье для брахиоцефального ствола и левой общей сонной артерии).
Результаты
Согласно данным, представленным в таблице 1, средний возраст пациентов группы CILCA был ниже относительно группы No CILCA (p=0,040). Антропометрические характеристики пациентов обеих групп были сопоставимы. Частота патологического изменения аортального клапана (стеноз/недостаточность), как и частота встречаемости двустворчатого аортального клапана не различалась между анализируемыми группами. Среди всех включенных в исследование пациентов не было диагностировано других аномалий сосудов дуги аорты, кроме CILCA (например, arteria lusoria, изолированная позвоночная артерия и др.). Вместе с тем стоит отметить, что в группе CILCA статистически значимо чаще была диагностирована гипертоническая болезнь (p=0,041).
Учитывая данные МСКТ-ангиографии у пациентов обеих анализируемых групп, кроме аневризмы тубулярного отдела восходящей аорты была отмечена дилатация корня аорты. При этом размеры дуги аорты не превышали нормальные значения (табл. 2). Стоит отметить, что размеры грудной аорты на всех анализируемых уровнях не имели статистически значимых межгрупповых различий.
В ходе измерения длины сегментов грудной аорты были обнаружены следующие особенности. При сопоставимом между группами значении длины корня аорты общая длина восходящей аорты (от аортального клапана до БЦС) была значимо длиннее в группе No CILCA (113 [89; 144] мм vs 108 [63; 143] мм, p=0,021) за счет тубулярного отдела восходящей аорты (86 [ 63; 123] мм vs 82 [ 40; 103] мм, p=0,018). Длина дуги аорты была незначимо длиннее у пациентов с вариантной анатомией БЦС (p=0,355).
Анализируя тип дуги аорты, было отмечено, что у пациентов с CILCA превалировал I тип по сравнению с пациентами группы No CILCA (89,3% vs 63,6%, p=0,036) (табл. 3). Также было выявлено, что у пациентов с нормальной анатомией БЦС чаще диагностировали III тип дуги аорты (27,3% vs 3,6%, p=0,017). Распределение II типа дуги аорты было одинаковым у пациентов обеих групп.
Обсуждение
Несмотря на достигнутые в последние годы результаты по снижению летальности от таких аорто-ассоциированных событий, как острое расслоение/разрыв аорты, вопрос профилактики этих состояний до сих пор не решен [1]. В связи с этим рассматриваются разные подходы к преодолению этой проблемы. Одно из центральных мест в этом занимает многофакторная модель оценки рисков, в которой важная роль в определении показаний для хирургического вмешательства, как и прежде, отведена размеру аорты [7-9]. Согласно современных рекомендаций показанием для реконструктивных вмешательств на восходящем отделе и дуге аорты является ее диаметр >55 мм при отсутствии известных генетических синдромов [1][10]. В то же время в ряде работ было показано, что именно такой порог диаметра аорты может быть несовершенным предиктором аортальной катастрофы. По данным Mansour AM, et al. [11], >80% случаев расслоения восходящей аорты развиваются при меньшем размере ("aortic size paradox"). Также Tozzi P, et al. установили, что при пороге 55 мм возможность профилактического протезирования восходящей аорты исключается у 99% пациентов с состоявшимся расслоением аорты [12]. Учитывая эти данные и собственный опыт, Ziganshin BA, et al. [13] считают возможным использовать парадигму раннего вмешательства на восходящей аорте уже при диаметре 50 мм, особенно в центрах с большим опытом аортальной хирургии. Стоит отметить, что целесообразность данного подхода нашла отражение и в актуальных рекомендациях по ведению пациентов с аортальной патологией [1][10].
Несмотря на важность размера аорты как предиктора развития аорто-ассоциированных осложнений в последние годы все большее внимание уделяется такому параметру, как удлинение аорты — более чувствительного показателя относительно диаметра сосуда (28% vs 4%) [3][14][15]. При анализе степени удлинения аорты главный фокус современных исследований сосредоточен на поиске пороговых значений, после которого возрастают риски расслоения и разрыва аорты. На основании проведенных расчетов Wu J, et al. [16] обнаружили, что удлинение восходящей аорты (от аортального клапана до устья БЦС) >115 мм ассоциировано со значительным увеличением риска развития аортальных катастроф.
В поиске фундаментального обоснования высокой специфичности длины аорты в отношении острых аортальных состояний группа итальянских авторов провела анализ и выявила, что удлинение тубулярного сегмента восходящего отела аорты оказывает влияние и на геометрию дуги аорты, уменьшая угол между этими сегментами, т.е. изменяя анатомический тип дуги аорты [17]. Авторы полагают, что угол <130 градусов между тубулярной частью и дугой аорты может быть маркером развития острого расслоения аорты типа А [18]. Вместе с тем опубликованы данные о том, что элонгация корня аорты имеет наиболее важное значение при определении риска развития острого расслоения восходящей аорты. Механизм этого состоит в том, что при удлинении корня аорты, особенно в сочетании с элонгацией тубулярной части восходящего отдела, образуется острый угол между корнем и тубулярным сегментом восходящей аорты. Вследствие этого создается зона сниженной локальной стабильности за счет высокого напряжения на стенку аорты, что является провоцирующим фактором для ее повреждения [17][19]. Таким образом, кривизна разных сегментов грудной аорты является дополнительным диагностическим индикатором тяжести патологического процесса, который необходимо учитывать при оценке аортального статуса пациента [20].
Помимо указанных критериев в последние годы в качестве потенциального фактора развития аневризм и расслоения аорты все больше обсуждается влияние аномалий строения супрааортальных сосудов [7][21]. Согласно эпидемиологическим данным одним из наиболее частых вариантов аномалии сосудов дуги аорты считается CILCA или так называемая "бычья дуга" (до 26,8%) [21][22]. В одном из исследований было продемонстрировано, что частота встречаемости этого анатомического варианта у пациентов с аневризмой восходящей аорты выше относительно пациентов с нормальными размерами сосуда (24,6% vs 14%, p=0,001) [23]. Однако, недостаток убедительных данных о связи данной конфигурации сосудов дуги аорты с патологией грудной аорты побуждает к проведению дальнейших аналитических исследований.
Проведя собственный анализ геометрических параметров у пациентов с аневризмой восходящей аорты в сочетании с нормальной или вариантной анатомией БЦС, мы установили, что при сопоставимых значениях диаметра аорты на измеряемых уровнях длина некоторых аортальных сегментов различалась. Так, сегмент восходящей аорты от аортального клапана до устья БЦС был статистически значимо длиннее в группе с нормальной конфигурацией БЦС за счет тубулярного сегмента восходящего отдела. При этом превышение порогового значения длины восходящей аорты (115 мм) наблюдалось у 45,5% пациентов группы No CILCA и у 28,5% пациентов группы CILCA. Таким образом, потенциальный риск развития аорто-ассоциированных осложнений был на 17% выше у пациентов именно с нормальной анатомией БЦС. Вместе с тем стоит отметить, что у пациентов с вариантной конфигурацией БЦС наблюдалось увеличение размера и длины корня аорты, однако порог статистической значимости в нашем наблюдении не был достигнут. Della Corte A, et al. также обнаружили, что диаметр корня аорты у пациентов с вариантной анатомией БЦС был значимо больше относительно пациентов с нормальной конфигурацией БЦС. При этом авторы не отметили влияния "бычьей дуги" на длину тубулярной части и корня аорты [17].
В целом удлинение аорты обусловлено ее возрастными изменениями и половыми различиями [24][25]. При этом степень элонгации разных сегментов аорты неодинакова. Так, в течение жизни наблюдается незначительное удлинение восходящей аорты, в то время как дуга аорты претерпевает более выраженные изменения, особенно в ее дистальной части. Следствием этого является трансформация грудной аорты (извитость и ангуляция), в основном за счет дуги аорты [26]. Так, согласно наблюдениям у людей старшего возраста чаще регистрируется III тип дуги аорты (по классификации Madhwal S, et al.), который является независимым фактором риска расслоения аорты типа В [27]. Однако в доступной литературе отсутствуют данные об анатомических взаимоотношениях между кривизной дуги аорты и строением БЦС. В настоящем исследовании мы обнаружили, что несмотря на удлинение дуги аорты в группе CILCA (58 vs 54 мм, p=0,355), III тип дуги аорты диагностировали реже относительно группы No CILCA (3,6% vs 27,3%, p=0,017).
Одним из вероятных объяснений данного распределения может быть особенность количества "точек фиксации" дуги аорты у анализируемых пациентов. Так, у пациентов с "бычьей дугой" более мощное устье БЦС, вероятно, служит "якорем", препятствующим формированию ангуляции дуги аорты. В то время как у пациентов с нормальным строением БЦС наличие трех "точек фиксации" не обеспечивает необходимого совокупного контрусилия.
Не менее интересен и отмеченный нами следующий факт: несмотря на связь удлинения аорты с ее старением, элонгация дуги аорты наблюдается в более молодой группе, а именно у пациентов с "бычьей дугой". Вероятно, определенное взаимное влияние у этой категории пациентов имеет место, однако аргументированного объяснения этому факту пока не найдено. Таким образом, вследствие недостаточных и противоречивых данных о клинической роли вариантной анатомии БЦС в патогенезе аортальной патологии необходимо дальнейшее разностороннее изучение этой проблемы, главным образом с фундаментальных позиций.
Ограничения исследования. Одним из главных ограничений исследования является относительно малый объем выборки пациентов. Также выборка была ограничена только пациентами с аневризмой аорты без дополнительного анализа пациентов с нормальными размерами аорты.
Заключение
Вариантная анатомия БЦС ("бычья дуга") у пациентов с аневризмой восходящей аорты не обладает негативным профилем в отношении геометрических характеристик грудной аорты по сравнению с пациентами с нормальной анатомией БЦС.
Список литературы
1. Czerny M, Grabenwöger M, Berger T, et al.; EACTS/STS Scientific Document Group. EACTS/STS Guidelines for diagnosing and treating acute and chronic syndromes of the aortic organ. Eur J Cardiothorac Surg. 2024;65(2). doi:10.1093/ejcts/ezad426.
2. Czerny M, Rylski B, Della Corte A, Krüger T. Decision-making to perform elective surgery for patients with proximal thoracic aortic pathology: A European perspective. J Thorac Cardiovasc Surg. 2022;163(6):2025-30. doi:10.1016/j.jtcvs.2021.01.141.
3. Heuts S, Adriaans BP, Rylski B, et al. Evaluating the diagnostic accuracy of maximal aortic diameter, length and volume for prediction of aortic dissection. Heart. 2020;106(12):8927. doi:10.1136/heartjnl-2019-316251.
4. Малахова М. В., Галян Т. Н., Ховрина А. В. и др. Варианты снижения лучевой и йодной нагрузки при МСКТ-аортографии перед хирургическим вмешательством на аорте и аортальном клапане. Медицинская визуализация. 2022;26(2):81-90. doi:10.24835/1607-0763-1149.
5. Elefteriades JA, Sang A, Kuzmik G, Hornick M. Guilt by association: paradigm for detecting a silent killer (thoracic aortic aneurysm). Open Heart. 2015;2(1):e000169. doi:10.1136/openhrt-2014-000169.
6. Madhwal S, Rajagopal V, Bhatt DL, et al. Predictors of difficult carotid stenting as determined by aortic arch angiography. J Invasive Cardiol. 2008;20(5):200-4. doi:10.1007/9781-4614-7312-1_6.
7. Anfinogenova ND, Sinitsyn VE, Kozlov BN, et al. Existing and Emerging Approaches to Risk Assessment in Patients with Ascending Thoracic Aortic Dilatation. J Imaging. 2022;8(10):280. doi:10.3390/jimaging8100280.
8. Козлов Б. Н., Панфилов Д. С. Принятие решений при дилатации грудной аорты: состояние проблемы. Ангиология и сосудистая хирургия. 2023;29(2):157-60. doi:10.33029/10276661-2023-29-2-157-160.
9. Панфилов Д.С., Саушкин В.В., Сондуев Э.Л. и др. Хирургическое лечение аневризм восходящего отдела аорты у мужчин и женщин. Сибирский журнал клинической и экспериментальной медицины. 2022;37(3):108-13. doi:10.29001/2073-8552-2022-37-3-108-113.
10. Isselbacher EM, Preventza O, Hamilton Black Iii J, et al. 2022 ACC/AHA Guideline for the Diagnosis and Management of Aortic Disease: A Report of the American Heart Association/ American College of Cardiology Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022;80(24):223-393. doi:10.1016/j.jacc.2022.08.004.
11. Mansour AM, Peterss S, Zafar MA, et al. Prevention of Aortic Dissection Suggests a Diameter Shift to a Lower Aortic Size Threshold for Intervention. Cardiology. 2018;139(3):139-46. doi:10.1159/000481930.
12. Tozzi P, Gunga Z, Niclauss L, et al. Type A aortic dissection in aneurysms having modelled pre-dissection maximum diameter below 45 mm: should we implement current guidelines to improve the survival benefit of prophylactic surgery? Eur J Cardiothorac Surg. 2021;59(2):473-8. doi:10.1093/ejcts/ezaa351.
13. Ziganshin BA, Zafar MA, Elefteriades JA. Descending threshold for ascending aortic aneurysmectomy: Is it time for a "left-shift" in guidelines? J Thorac Cardiovasc Surg. 2019;157(1):37-42. doi:10.1016/j.jtcvs.2018.07.114.
14. Gulati A, Zamirpour S, Leach J, et al. Ascending thoracic aortic aneurysm elongation occurs in parallel with dilatation in a nonsurgical population. Eur J Cardiothorac Surg. 2023;63(6):ezad241. doi:10.1093/ejcts/ezad241.
15. Krüger T, Oikonomou A, Schibilsky D, et al. Aortic elongation and the risk for dissection: the Tübingen Aortic Pathoanatomy (TAIPAN) project†. Eur J Cardiothorac Surg. 2017;51(6):1119-26. doi:10.1093/ejcts/ezx005.
16. Wu J, Zafar MA, Li Y, et al. Ascending Aortic Length and Risk of Aortic Adverse Events: The Neglected Dimension. J Am Coll Cardiol. 2019;74(15):1883-94. doi:10.1016/j.jacc 2019.07.078.
17. Della Corte A, Rubino AS, Montella AP, et al. Implications of abnormal ascending aorta geometry for risk prediction of acute type A aortic dissection. Eur J Cardiothorac Surg. 2021;60(4):978-86. doi:10.1093/ejcts/ezab218.
18. Della Corte A, Lo Presti F, Saade W, et al. Acute type A aortic dissection in bicuspid versus tricuspid aortic valve patients: focus on geometrical features of the aorta. Eur J Cardiothorac Surg. 2023;63(2). doi:10.1093/ejcts/ezac576.
19. Toba T, Mori S, Izawa Y, et al. Ascending aortic elongation and correlative change in overall configuration of the proximal aorta in elderly patients with severe aortic stenosis. Clin Anat. 2020;33(8):1240-8. doi:10.1002/ca.23575.
20. Salmasi MY, Pirola S, Mahuttanatan S, et al. Geometry and flow in ascending aortic aneurysms are influenced by left ventricular outflow tract orientation: Detecting increased wall shear stress on the outer curve of proximal aortic aneurysms. J Thorac Cardiovasc Surg. 2023;166(1):11-21.e1. doi:10.1016/j.jtcvs.2021.06.014.
21. Mylonas SN, Barkans A, Ante M, et al. Prevalence of Bovine Aortic Arch Variant in Patients with Aortic Dissection and its Implications in the Outcome of Patients with Acute Type B Aortic Dissection. Eur J Vasc Endovasc Surg. 2018;55(3):385-91. doi:10.1016/j.ejvs.2017.12.005.
22. Козлов Б. Н., Панфилов Д. С., Петракова Е. А. Ассоциация вариантной анатомии дуги аорты с аортальными состояниями. Минимально инвазивная сердечно-сосудистая хирургия. 2023;2(1):18-23.
23. Dumfarth J, Chou AS, Ziganshin BA et al. Atypical aortic arch branching variants: A novel marker for thoracic aortic disease. J Thorac Cardiovasc Surg. 2015;149(6):1586-92. doi:10.1016/j.jtcvs.2015.02.019.
24. Adriaans BP, Heuts S, Gerretsen S, et al. Aortic elongation part I: the normal aortic ageing process. Heart. 2018;104(21):1772-7. doi:10.1136/heartjnl-2017-312866.
25. Rylski B, Desjardins B, Moser W, et al. Gender-related changes in aortic geometry throughout life. Eur J Cardiothorac Surg. 2014;45(5):805-11. doi:10.1093/ejcts/ezt597.
26. Marrocco-Trischitta MM, Rylski B, Schofer F, et al. Prevalence of type III arch configuration in patients with type B aortic dissection. Eur J Cardiothorac Surg. 2019;56(6):1075-80. doi:10.1093/ejcts/ezz137.
27. Sun L, Li X, Li Q, et al. Morphological Features of Aortic Arch Predicting the Risk for Acute Type B Aortic Dissection. World J Surg. 2021;45(11):3458-66. doi:10.1007/s00268-02106247-5.
Об авторах
Д. С. ПанфиловРоссия
Дмитрий Сергеевич Панфилов — д.м.н., с.н.с. отделения сердечно‑сосудистой хирургии
634012, Томск, ул. Киевская, 111а
Е. А. Петракова
Россия
Елизавета Анатольевна Петракова — аспирант отделения сердечно‑сосудистой хирургии, врач сердечно‑сосудистый хирург
634012, Томск, ул. Киевская, 111а
В. В. Саушкин
Россия
Виктор Вячеславович Саушкин. — к.м.н., с.н.с. лаборатории радионуклидных методов исследования
634012, Томск, ул. Киевская, 111а
Б. Н. Козлов
Россия
Борис Николаевич Козлов — д.м.н., руководитель отделением сердечно‑сосудистой хирургии
634012, Томск, ул. Киевская, 111а
Дополнительные файлы
- У пациентов группы с единым устьем для брахиоцефального ствола и левой общей сонной артерией относительно пациентов с нормальной анатомией сосуда группы наблюдается: укорочение тубулярной части восходящей аорты, удлинение корня и дуги аорты, преобладает I тип дуги и реже наблюдается III тип дуги аорты.
Рецензия
Для цитирования:
Панфилов Д.С., Петракова Е.А., Саушкин В.В., Козлов Б.Н. Геометрические характеристики грудной аорты у пациентов с аневризмой восходящего отдела и разной анатомией брахиоцефального ствола. Российский кардиологический журнал. 2025;30(8):6336. https://doi.org/10.15829/1560-4071-2025-6336. EDN: RXPFCO
For citation:
Panfilov D.S., Petrakova E.A., Saushkin V.V., Kozlov B.N. Thoracic aortic geometry in patients with ascending aortic aneurysm and different anatomy of innominate artery. Russian Journal of Cardiology. 2025;30(8):6336. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6336. EDN: RXPFCO
JATS XML

















































