Перейти к:
Диагностика и подходы к терапии острой сердечной недостаточности, обусловленной миокардитами различной этиологии: серия клинических случаев
https://doi.org/10.15829/1560-4071-2025-6311
EDN: FOWZRX
Аннотация
Миокардиты, ввиду гетерогенности проявлений и, достаточно часто, непредсказуемости течения, являются одной из самых сложных для своевременной диагностики групп заболеваний в современной кардиологии. При этом воспалительные заболевания миокарда часто имеют тяжелое течение, требующее госпитализации, мониторинга и лечения в отделении реанимации, протезирования витальных функций — применения механической поддержки кровообращения, временной электрокардиостимуляции, искусственной вентиляции легких, заместительной почечной терапии и т.д. В работе представлен опыт лечения пациентов, поступивших в ММКЦ "Коммунарка" с клиникой острой левожелудочковой недостаточности и нарушениями ритма, обусловленными развитием миокардита различной этиологии. Освещен подход к первоначальной терапии и дифференциальной диагностике основных причин данных состояний.
Ключевые слова
Для цитирования:
Лебедева А.Ю., Куренков Д.А., Ильченко Р.С., Дрогашевская Д.В., Балан В.М., Байдаев М.А. Диагностика и подходы к терапии острой сердечной недостаточности, обусловленной миокардитами различной этиологии: серия клинических случаев. Российский кардиологический журнал. 2025;30(10S):6311. https://doi.org/10.15829/1560-4071-2025-6311. EDN: FOWZRX
For citation:
Lebedeva A.Yu., Kurenkov D.A., Ilchenko R.S., Drogashevskaya D.V., Balan V.M., Baidaev M.A. Diagnostics and approaches to therapy of acute heart failure caused by myocarditis of various origin: a case series. Russian Journal of Cardiology. 2025;30(10S):6311. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6311. EDN: FOWZRX
Введение
Согласно определению Европейского общества кардиологов, миокардиты — воспалительные заболевания миокарда, обусловленные различными инфекционными и неинфекционными причинами и диагностируемые с помощью гистологических, иммунологических и иммуногистохимических критериев [1]. Вариабельность клинических проявлений в дебюте болезни, множество стертых форм, остающихся незамеченными врачом и пациентом, большая частота спонтанного выздоровления, а также крайне редкое применение на практике "Золотого стандарта диагностики" — эндомиокардиальной биопсии (ЭМБ) делают учет распространенности заболевания трудновыполнимой задачей. Клиническая картина данного заболевания может варьировать от бессимптомных случаев до тяжелого нарушения насосной функции сердца и фатальных аритмий [2].
По данным Marburg Registry, крупного регистра биопсийного материала, наиболее частой причиной развития миокардитов является вирусная инфекция, а самыми частыми выявляемыми вирусными геномами оказались парвовирус B19 и вирус герпеса человека 6 типа. По ясным причинам, бактериальные миокардиты в современном мире встречаются намного реже, чем столетие назад, однако и сегодня бактериальный агент может вызвать развитие миокардита. К наиболее частым возбудителям относят Chlamydia, Corynebacterium diphtheria, Haemophilus influenzae, Legionella pneumophila, Mycobacterium tuberculosis, Streptococcus A [2].
На сегодняшний день в связи с внедрением новых методов лечения злокачественных новообразований, в частности иммунной противоопухолевой терапии, растет число аутоиммунных миокардитов, возникающих на фоне терапии моноклональными антителами, ингибирующими контрольные точки иммунного ответа (ИКТ-ассоциированные миокардиты). В 2016г впервые были опубликованы клинические случаи развития фульминантного (молниеносного) миокардита при иммунотерапии препаратами ниволумаб и ипилимумаб [3], после чего группа ИКТ была включена в список кардиотоксических противоопухолевых средств. Механизм развития ИКТ-ассоциированного миокардита остается неясным, но предположительно он аналогичен развитию вирусопосредованных миокардитов, когда мишенью Т-клеток становятся антигены как опухоли, так и мышечной ткани сердца, а гистологически наблюдается инфильтрация миокарда преимущественно Т-лимфоцитами [4][5]. ИКТ-ассоциированные миокардиты относятся к жизнеугрожающим осложнениям с высоким процентом леталь-
ности [6][7]. Несмотря на увеличивающееся число публикаций, истинная их распространенность до конца не ясна.
В связи с вышеописанными данными представляется актуальным описание двух клинических случаев: бактериального миокардита, манифестировавшего пароксизмом фибрилляции предсердий (ФП), с дальнейшим развитием кардиогенного шока, а также ИКТ-ассоциированного миокардита, возникшего под маской острого коронарного синдрома.
Клинический случай 1
Пациент Г. 46 лет был госпитализирован в ММКЦ Коммунарка с направительным диагнозом "Аритмогенный шок, острая левожелудочковая недостаточность на фоне пароксизма фибрилляции предсердий". Из анамнеза было известно, что за 30 дней до госпитализации пациент перенес острую респираторную вирусную инфекцию, после чего отметил появление чувства перебоев в работе сердца, снижение толерантности к физическим нагрузкам. В связи с нарастанием симптомов была вызвана бригада скорой медицинской помощи, на зарегистрированной электрокардиограмме: ритм ФП, частота сокращений желудочков — 140 уд./мин, очаговых изменений нет (рис. 1). Доставлен в наш стационар. При объективном осмотре на момент поступления обращали на себя внимание признаки шока, в связи с чем, в условиях внутривенной седации, была выполнена электроимпульсная терапия и восстановлен синусовый ритм. При дообследовании по данным эхокардиографии (ЭхоКГ) выявлено снижение фракции выброса (ФВ) левого желудочка (ЛЖ) до 30%, диффузный гипокинез ЛЖ, признаки застойных явлений в малом круге кровообращения по данным рентгенографии органов грудной клетки. В анализах крови отмечался нейтрофильный лейкоцитоз до 19 тыс. в мкл, значимое повышение уровня Д-димера до 63 тыс. нгФЭЕ/мл, значимое повышение уровня тропонина I в динамике (0,21 нг/мл — 38 нг/мл). Несмотря на проводимую консервативную терапию, включающую инфузионную терапию и введение катехоламинов, течение шока имело резистентный характер и осложнилось развитием остановки сердечной деятельности. Реанимационные мероприятия в течение 10 мин привели к восстановлению спонтанного кровообращения. В связи с явлениями критической, потенциально обратимой острой сердечной недостаточности (СН), была инициирована процедура вено-артериальной экстракорпоральной мембранной оксигенации (ВА-ЭКМО). С целью исключения коронарной патологии проводилась коронароангиография, по результатам которой ангиографических признаков значимых стенозов выявлено не было, однако отмечался выраженный спазм коронарных артерий, купировавшийся после внутрикоронарного введения нитроглицерина.
В рамках дифференциальной диагностики, посредством мультиспиральной компьютерной томографии с внутривенным контрастированием были исключены тромбоэмболия легочной артерии, патология органов брюшной полости и забрюшинного пространства. Принимая во внимание данные анамнеза пациента, клиническую картину и повышение воспалительных маркеров в анализах крови, состояние было расценено как кардиогенный шок на фоне острого миокардита и был начат поиск этиологического агента. IgM к вирусам герпеса 1, 2, 6 типа, микоплазме, легионелле, токсоплазме, вирусам краснухи, цитомегаловирусу, вирусу Эпштейна-Барр и Парвовирусу В19 не были выявлены. По результатам ПЦР РНК вирусов гриппа А и В, парагриппа, коронавирусов, респираторно-синтициального вируса, метапневмовируса и ДНК аденовируса, бокавируса, парвовируса В19, цитомегаловируса не обнаружено. При проведении бактериологического исследования крови рост микроорганизмов не выявлен. При посеве мокроты отмечался рост B-гемолитического стрептококка группы А. Уровень антистрептолизина-О (АСЛО) не был повышен. Уровень прокальцитонина — 7 нг/мл (значимое повышение).
По данным КТ органов грудной клетки была обнаружена двусторонняя нижнедолевая пневмония. Была начата антибактериальная терапия амоксициллином/клавуланатом с последующей заменой на цефепим по результатам оценки чувствительности.
На фоне проводимой терапии кардиогенного шока, включавшей ЭКМО, катехоламины, отмечалась положительная динамика. В первые сутки ЭКМО ФВ ЛЖ cоставляла 30% с интегралом линейной скорости потока (velocity time integral, VTI) в выносящем тракте ЛЖ 4 см (рис. 2), отмечались признаки объемной перегрузки ЛЖ.
Проводилась фармакологическая разгрузка ЛЖ добутамином и левосименданом, на фоне чего отметилась положительная динамика в виде увеличения VTI до 10 см на 3 день и до 15 см на 5 день. На 6 день при минимальной вазопрессорной и инотропной поддержке и минимальной скорости потока ЭКМО, по данным контрольной ЭхоКГ ФВ ЛЖ составила 39%, VTI в выносящем тракте ЛЖ — 20 см, на фоне чего процедура ВА-ЭКМО была прекращена. Дальнейший восстановительный период осложнился развитием тромбоза в полости ЛЖ, обеих предсердий, кардиоэмболического инфаркта головного мозга, верифицированного по данным мультиспиральной компьютерной томографии головного мозга. Выполнена магнитно-резонансная томография (МРТ) сердца — картина расширения левых отделов сердца, диффузный гипокинез всех стенок ЛЖ, на фоне большого количества артефактов (частая желудочковая экстрасистолия, эпизоды ФП), достоверных признаков отека миокарда не определялось, однако в отсроченную фазу выявлено диффузное интрамуральное повышение сигнала (рис. 3). При дальнейшем наблюдении, на фоне инициации квадритерапии, проведения курса физической реабилитации отмечалась положительная динамика в виде улучшения эхо-картины (ФВ ЛЖ — 45%), полного регресса неврологических, дыхательных нарушений. Пациент был переведен в кардиологическое отделение, а на 24 сут. от начала госпитализации — выписан.
На амбулаторном этапе через 3 мес. по данным ЭхоКГ сохраняется снижение ФВ до 48% за счет диффузного гипокинеза, расширение ЛЖ.
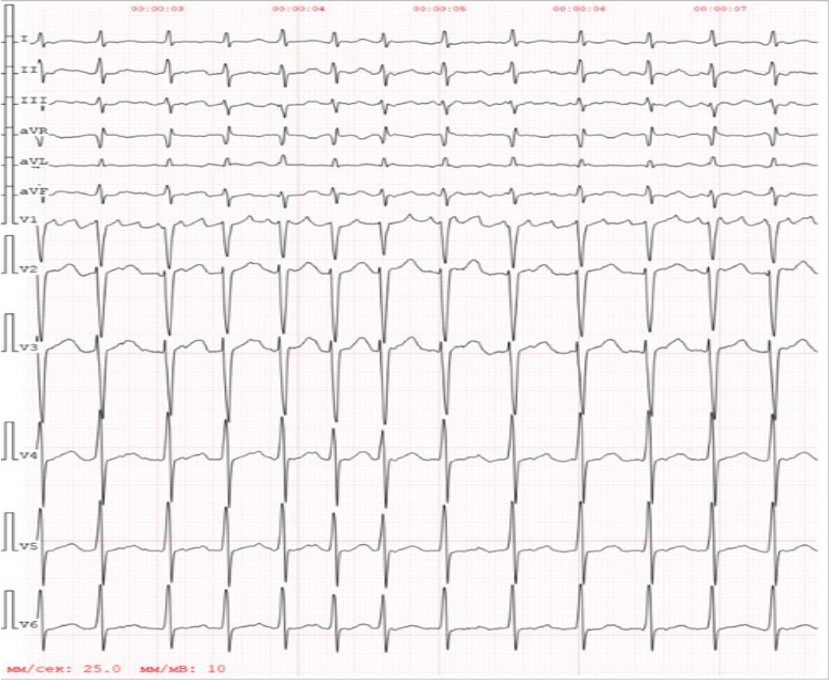
Рис. 1. ЭКГ, зарегистрированная бригадой скорой помощи.
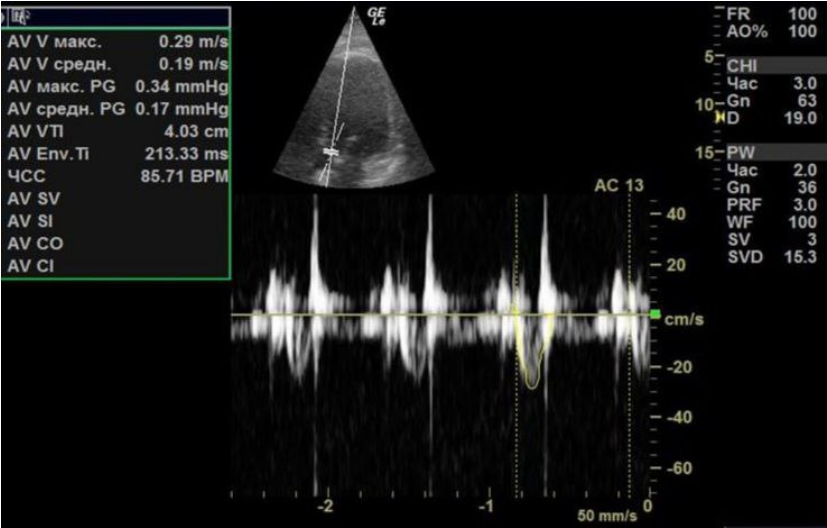
Рис. 2. В первые сутки ЭКМО.
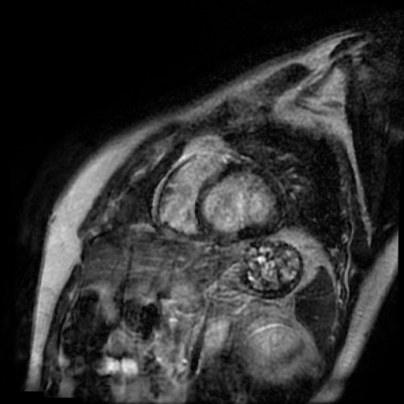
Рис. 3. МРТ сердца.
Клинический случай 2
Пациент 60 лет госпитализирован в ММКЦ Коммунарка с направительным диагнозом острый коронарный синдром без подъема сегмента ST. Из анамнеза известно, что за месяц до госпитализации проводилась иммунотерапия препаратом пембролизумаб по поводу рака почки сТ3N0M1 (lym, pul, adr). На снятой электрокардиографии (ЭКГ) при поступлении регистрировался синусовый ритм с частотой 74 уд./мин, атриовентрикулярная (АВ) блокада 1 степени, депрессия сегмента ST в отведении I, aVL, V3-V6, QS в отведении II, III, aVF (рис. 4). Лабораторно отмечалось повышение тропонина I до 6,37 нг/мл. На ЭхоКГ выявлены нарушения локальной сократимости: гипокинез межжелудочковой перегородки с асинергией, ФВ 40%. Учитывая анамнез, изменения на ЭКГ, а также повышение кардиоспецифических ферментов, пациенту с целью исключения обструктивного поражения коронарных артерий была выполнена коронароангиография — признаков гемодинамически значимого атеросклероза выявлено не было.
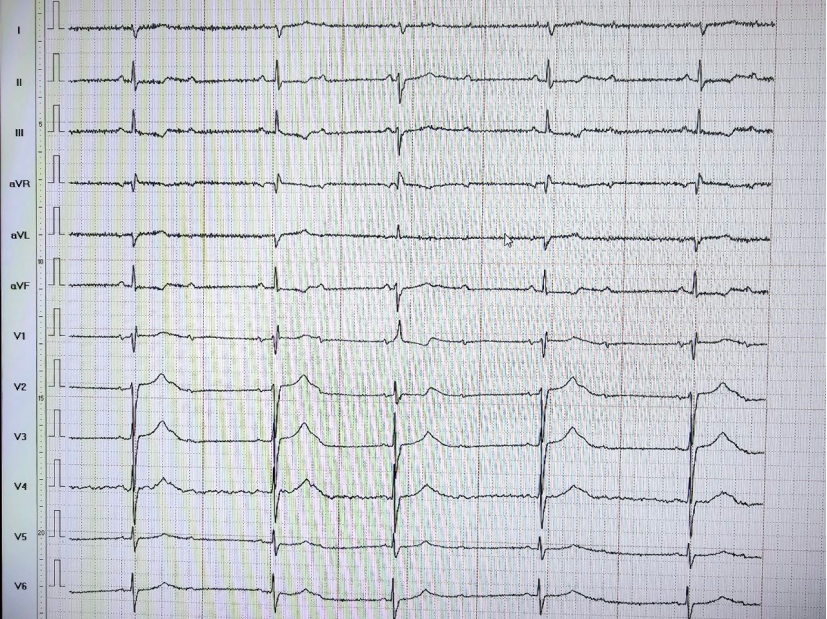
Рис. 4. ЭКГ при поступлении.
Через несколько часов у больного развилась АВ-блокада 3 степени, сопровождающаяся приступами потери сознания, в связи с чем была инициирована временная электрокардиостимуляция (ВЭКС). Лабораторно отмечалось нарастание уровня воспалительных маркеров, лейкоцитоза в динамике. Проведение МРТ сердца ввиду необходимости в ВЭКС было невозможно. Принимая во внимание данные анамнеза, исследований, исключение иных причин острого повреждения миокарда, в соответствии с рекомендациями ESC был установлен диагноз: острый миокардит. Учитывая отсутствие признаков системной инфекции (отрицательные результаты посевов крови, отсутствие других локусов инфекции по данным инструментальной диагностики), наиболее вероятной причиной миокардита являлась предшествующая терапия препаратом пембролизумаб. От предложенной ЭМБ больной отказался. Несмотря на отсутствие данных ЭМБ, с учетом высоких рисков прогрессирования СН, консилиумом было принято решение об инициации гормональной терапии — преднизолон 40 мг в/в 2 раза/сут. На фоне лечения была отмечена выраженная положительная динамика в виде снижения уровня воспалительных маркеров, лейкоцитоза, улучшения данных ЭхоКГ и общей клинической картины. В связи с отсутствием электрической активности желудочков при прекращении ВЭКС пациент был переведен в ГКБ им. В. М. Буянова, и, после имплантации постоянного электрокардиостимулятора, был выписан в удовлетворительном состоянии. По состоянию на февраль 2025г пациент в удовлетворительном состоянии, находится под наблюдением онколога амбулаторно, со стороны онкологического заболевания прогрессии не отмечается, признаков недостаточности кровообращения нет.
Обсуждение
Приведенные клинические наблюдения демонстрируют разнообразие клинических проявлений воспалительных заболеваний миокарда, в связи с чем дифференциальная диагностика данных состояний бывает затруднена. Миокардит в качестве причины неотложных состояний зачастую выставляется как диагноз исключения. Тщательный сбор анамнеза, физикальный осмотр и лабораторно-инструментальная диагностика являются ключом к определению потенциальной этиологии, а также к дальнейшей тактике ведения больного. При этом особое внимание следует уделять любым недавним инфекциям, аутоиммунным/воспалительным состояниям и воздействию потенциально токсичных веществ (определенных лекарственных препаратов, в т.ч. противоопухолевых).
Диагноз миокардита при отсутствии данных МРТ и ЭМБ может быть установлен на основании клинических и/или инструментальных признаков (1 клинический и 1 инструментальный, либо при бессимптомном течении — 2 инструментальных) [8].
К клиническим признакам относят:
- Острую боль в груди, в т.ч. по типу перикардита, или псевдоишемическая боль;
- Вновь возникшая (от нескольких дней до 3 мес.) или ухудшение имевшейся ранее одышки в покое или нагрузке, и/или утомляемость, с/без признаков лево- и/или правожелудочковой недостаточности;
- Подострое/хроническое (>3 мес.) наличие одыш-
ки в покое или нагрузке, и/или утомляемости, с/без признаков лево- и/или правожелудочковой недостаточности, или ухудшение этих симптомов; сердцебиение и/или аритмия неясного генеза, и/или синкопальные состояния, и/или предотвращенная внезапная смерть (успешная реанимация); - Кардиогенный шок, причина развития которого неясна.
К инструментальным критериям относят:
- Новые отклонения от нормы при ЭКГ и/или холтеровском мониторировании ЭКГ и/или стресс-тесте, к которым относятся АВ-блокада любой степени, блокада ножек пучка Гиса, изменения комплекса ST/Т, желудочковая тахикардия или фибрилляция желудочков, ФП, значительное снижение высоты зубца R, нарушение внутрижелудочковой проводимости, патологические зубцы Q, низкий воль-
таж, частая экстрасистолия или наджелудочковая та-
хикардия; - Повышенный уровень тропонина Т/I;
- Функциональные и структурные отклонения при визуализации сердца (ЭхоКГ, МРТ);
- Новые, необъяснимые по иным причинам нарушения функции ЛЖ и/или правого желудочка (нарушения локальной сократимости, глобальная систолическая либо диастолическая дисфункция, расширение полостей, увеличение толщины стенок, перикардиальный выпот, внутриполостной тромб);
- МРТ картина, соответствующая критериям Lake Louse.
В первом клиническом случае крайне тяжелое состояние пациента не позволяло провести МРТ и ЭМБ в остром периоде, в связи с чем диагноз миокардита был установлен после исключения других причин кардиогенного шока. Несмотря на широкий диагностический поиск, достоверно установить этиологию миокардита не представлялось возможным. Однако, учитывая результаты микробиологического исследования, повышенный уровень маркеров воспаления, нельзя было исключить бактериальную этиологию миокардита.
Во втором случае диагностика миокардита была затруднена в связи с невозможностью проведения МРТ сердца и отказом пациента от ЭМБ, а диагноз был установлен на основании исключения системной инфекции, предшествующего применения ИКТ.
Таким образом, диагноз миокардит в обоих случаях был установлен на основании вышеуказанных клинических и инструментальных критериев.
В первом случае на основании одного клинического критерия (впервые возникшая одышка, утомляемость с признаками левожелудочковой недостаточности) и одного инструментального критерия (нарушение ритма по типу ФП, частая экстрасистолия). Во втором случае на основании трех инструментальных критериев (нарушение проведения по типу АВ-блокады, структурные изменения по данным ЭхоКГ, повышение тропонина I).
В декабре 2024г эксперты Американской коллегии кардиологов (АСС) выпустили практически ориентированный консенсус, посвященный вопросам ведения пациентов с миокардитом [9]. Согласно данному документу, врачам необходимо знать о трех классических проявлениях миокардита: боль в груди, СН/шок и симптомы, связанные с аритмией (например, предобморочное состояние или обморок). Наличие в анамнезе предшествующей вирусной инфекции или других факторов риска миокардита, сопровождающихся любым из этих сердечно-сосудистых симптомов, должно вызывать подозрение на этот диагноз. В представленном выше клиническом наблюдении 1 острый миокардит манифестировал развитием острой СН, в то время как у пациента из клинического наблюдения 2 дебют миокардита имитировал острый коронарный синдром. Особое внимание в консенсусе уделено течению заболевания. Авторы предлагают относиться к миокардиту как к динамическому процессу, что предполагает использование классификации по стадиям аналогично рубрифицированию хронической СН:
- Стадия А — факторы риска (недавняя вакцинация, вирусная инфекция, тимома, гиперэозинофилия, аутоиммунные заболевания, генетическая пред-
расположенность, применение кардиотоксичных лекарств); - Стадия В — асимптомное течение (но есть типичные признаки миокардита по гистологии или МРТ или повышение в/ч тропонина);
- Стадия С — симптомный миокардит (как стадия В + типичные симптомы);
- Стадия D — тяжелый миокардит (критерии стадии С + признаки гемодинамической нестабильности, требующей инотропов или циркуляторной поддержки, либо признаки электрической нестабильности, требующей инвазивных вмешательств).
В обоих клинических случаях пик заболевания соответствовал стадии D, что потребовало применения средств механической поддержки кровообращения и применения искусственного водителя ритма.
МРТ сердца является наиболее информативным неинвазивным методом диагностики, и позволяет не только дифференцировать ишемическое и неишемическое поражение, но и определить стадию повреждения при воспалительных заболеваниях миокарда. Выделяют следующие МРТ-критерии, предложенные международной рабочей группой (Lake Louse Criteria — "Критерии озера Луизы") для диагностики миокардита: 1) локальное или диффузное усиление интенсивности Т2-сигнала; 2) увеличение отношения интенсивности раннего Т1-сигнала от миокарда к сигналу от скелетных мышц; 3) визуализация как минимум одной зоны с повышенным накоплением контрастного препарата, свидетельствующая о некротических или фибротических изменениях сердечной мышцы [10].
Необходимость биопсии миокарда должна рассматриваться во всех случаях снижения сократительной функции желудочков, нарушения гемодинамики и наличия электрической нестабильности миокарда, а польза исследования определяется выявлением некоторых "вирус-негативных" воспалительных кардиомиопатий, требующих этиотропной терапии системными глюкокортикоидами и/или другими иммунодепрессантами. К таким состояниям относят гигантоклеточный, эозинофильный и гранулематозный миокардиты, а также критериально доказанный аутоиммунный миокардит при смешанном заболевании соединительной ткани [11].
Следует отметь, что данные методы исследования не всегда доступны в рутинной клинической практике, в особенности при критическом состоянии пациента. В приведенных выше клинических наблюдениях для постановки диагноза данные методы не использовались, острый миокардит был выставлен на основании анамнеза, клинической картины и повышения уровня воспалительных маркеров. В рамках дифференциального диагноза ишемического и воспалительного повреждения миокарда пациентам выполнялась коронароангиография, которая не выявила атеросклеротического поражения коронарных артерий.
Отдельно стоит отметить развитие ИКТ-ассоциированных аутоиммунных миокардитов, которых в настоящее время в связи с активным применением данной группы препаратов в онкологической практике становится больше [12]. Хотя среди всех иммуноопосредованных нежелательных реакций при терапии ИКТ встречаемость миокардитов (выявленных) составляет всего ~1,14%, летальность при развитии этого осложнения высокая — 25-50% [13]. Отсроченная манифестация ИКТ-ассоциированных миокардитов (медиана времени по различным данным колеблется от 26,5 до 31 дней после первого введения препарата), а также крайняя гетерогенность и неспецифичность проявлений приводят к недооценке истинной распространенности ИКТ-ассоциированных миокардитов [11]. Онкологические сообщества, в частности американское общество клинической онкологии (ASCO) [12], выделяет четыре градации ИКТ-ассоциированного миокардита, где 1 степень тяжести проявляется бессимптомным течением и отклонением в уровне кардиальных биомаркеров, 2 степень тяжести — умеренно выраженными симптомами и отклонениями в биомаркерах, 3 и 4 степени — более значимыми, вплоть до крайне тяжелых, клиническими симптомами и проявлениями декомпенсации сердечной функции. При 1 степени тяжести достаточно прервать ИКТ-терапию, проводить кардиомониторинг и симптоматическое лечение. При 2-4 степени тяжести следует немедленно остановить иммунотерапию, проводить кардиомониторинг ЭКГ и ЭхоКГ, а также инициировать терапию глюкокортикостероидами. В случаях резистентности к терапии следует попытаться подключить другие иммуносупрессивные препараты (микофенолат мофетил или инфликсимаб, или препараты против отторжения трансплантата, такие как антитимоцитарный глобулин) [12].
На текущий момент отсутствует достоверная информации о факторах риска и предикторах развития ИКТ-ассоциированного миокардита. Также одним из важных вопросов является принятие решения о возобновлении терапии ИКТ после успешной иммуносупрессии. Это решение должно основываться на междисциплинарном заключении с учетом тяжести перенесенного миокардита, его осложнений, факторов риска и показаний к необходимости продолжения иммунотерапии онкологического заболевания [12].
Заключение
Таким образом, воспалительные заболевания миокарда являются одним из значимых разделов современной кардиологии, ввиду гетерогенности их проявлений. Тяжелое течение миокардита может приводить к развитию критических состояний, требующих применения всего арсенала реанимационной помощи, вплоть до механической поддержки кровообращения и трансплантации сердца. Принимая во внимание представленные клинические наблюдения, важно отметить необходимость большей клинической настороженности в диагностике миокардитов, более широкого применения визуализационных и биопсийных методов исследования. Улучшение диагностики миокардита будет способствовать накоплению опыта и расширению доказательной базы различных специфических методов лечения, улучшению прогноза таких пациентов. Дальнейшее развитие кардиоонкологии, совместное наблюдение пациентов онкологами и кардиологами, соблюдение алгоритмов профилактики и диагностики кардиотоксичности, в т.ч. и при ИКТ-терапии могут помочь предотвратить развитие тяжелых осложнений лечения злокачественных новообразований и продлить жизнь и качество жизни онкологических больных.
Список литературы
1. Frustaci A, Alfarano M, Verardo R, et al. Myocarditis-associated necrotizing coronary vasculitis: incidence, cause, and outcome. Eur Heart J. 2021;42(16):1609-17. doi:10.1093/eurheartj/ehaa973.
2. Арутюнов Г. П., Палеев Ф. Н., Моисеева О. М. и др. Миокардиты у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(11): 4790. doi:10.15829/1560-4071-2021-4790.
3. Johnson DB, Balko JM, Compton ML, et al. Fulminant Myocarditis with Combination Immune Checkpoint Blockade. N Engl J Med. 2016;375(18):1749-55. doi:10.1056/NEJMoa1609214.
4. Varricchi G, Galdiero MR, Marone G, et al. Cardiotoxicity of immune checkpoint inhibitors. ESMO Open. 2017;2(4):e000247. doi:10.1136/esmoopen-2017-000247.
5. Błyszczuk P. Myocarditis in Humans and in Experimental Animal Models. Front Cardiovasc Med. 2019;6:64. doi:10.3389/fcvm.2019.00064.
6. Palaskas N, Lopez-Mattei J, Durand JB, et al. Immune Checkpoint Inhibitor Myocarditis: Pathophysiological Characteristics, Diagnosis, and Treatment. J Am Heart Assoc. 2020;9(2): e013757. doi:10.1161/JAHA.119.013757.
7. Zotova L. Immune Checkpoint Inhibitors-Related Myocarditis: A Review of Reported Clinical Cases. Diagnostics (Basel). 2023;13(7):1243. doi:10.3390/diagnostics13071243.
8. Caforio AL, Pankuweit S, Arbustini E, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(33):2636-48. doi:10.1093/eurheartj/eht210.
9. Drazner MH, Bozkurt B, Cooper LT, et al. 2024 ACC Expert Consensus Decision Pathway on Strategies and Criteria for the Diagnosis and Management of Myocarditis: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2025;85(4):391-431. doi:10.1016/j.jacc.2024.10.080.
10. Буторова Е. А., Стукалова О. В. Возможности МРТ сердца в диагностике миокардита. Клинический случай. Евразийский Кардиологический Журнал. 2023;(3):90-4. doi:10.38109/22251685-2023-3-90-94.
11. Кушнарева Е. А., Моисеева О. М. Миокардиты, ассоциированные с терапией ингибиторами контрольных точек: систематический анализ клинических случаев. Российский кардиологический журнал. 2020;25(11):3910. doi:10.15829/29/1560-4071-2020-3910.
12. Jyothi Ramachandran Nair DP, Zachariah S, Scollan D, et al. Myocarditis: A Rare Complication of Immune Checkpoint Inhibitor Therapy. Cureus. 2024;16(5):e60459. doi:10.7759/cureus.60459.
13. Хидирова Л. Д., Лацвиева А. Е., Ведерин А. А. Механизмы кардиотоксичности противоопухолевой терапии ингибиторами иммунных контрольных точек: современные достижения. Рациональная Фармакотерапия в Кардиологии. 2024;20(2):265-74. doi:10.20996/1819-6446-2024-3022.
Об авторах
А. Ю. ЛебедеваРоссия
Анастасия Юрьевна Лебедева — д.м.н., профессор, руководитель регионального сосудистого центра, зав. кафедрой интервенционной кардиологии и кардиореабилитации.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Д. А. Куренков
Россия
, ORCID: 0000-0002-4060-0786
Дмитрий Александрович Куренков — зав. ОРИТ № 3.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Р. С. Ильченко
Россия
Роман Сергеевич Ильченко — врач кардиолог ОРИТ № 3, сотрудник кафедры госпитальной терапии им. акад. П. Е. Лукомского ИКМ.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Д. В. Дрогашевская
Россия
Дарья Валерьевна Дрогашевская — клинический ординатор кафедры кардиологии.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
В. М. Балан
Россия
Вероника Михайловна Балан — врач кардиолог ОРИТ № 3.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
М. А. Байдаев
Россия
Мухаммат Абдулкеримович Байдаев — врач анестезиологреаниматолог ОРИТ № 3, аспирант кафедры анестезиологии и реаниматологии с курсом медицинской реабилитации Медицинского института.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
- В первом случае у больного развился миокардит, предположительно бактериальный, осложненный фибрилляцией предсердий, кардиогенным шоком, остановкой кровообращения.
- Во втором случае миокардит у больного манифестировал под маской острого коронарного синдрома.
- В обоих случаях эндомиокардиальная биопсия не проводилась, а постановка диагноза и соответствующее лечение проводились на основании клинических данных и исключения других причин кардиомиопатии.
Рецензия
Для цитирования:
Лебедева А.Ю., Куренков Д.А., Ильченко Р.С., Дрогашевская Д.В., Балан В.М., Байдаев М.А. Диагностика и подходы к терапии острой сердечной недостаточности, обусловленной миокардитами различной этиологии: серия клинических случаев. Российский кардиологический журнал. 2025;30(10S):6311. https://doi.org/10.15829/1560-4071-2025-6311. EDN: FOWZRX
For citation:
Lebedeva A.Yu., Kurenkov D.A., Ilchenko R.S., Drogashevskaya D.V., Balan V.M., Baidaev M.A. Diagnostics and approaches to therapy of acute heart failure caused by myocarditis of various origin: a case series. Russian Journal of Cardiology. 2025;30(10S):6311. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6311. EDN: FOWZRX
JATS XML

















































