Перейти к:
Современные особенности визуализации тромбозов коронарных артерий при остром коронарном синдроме без подъема сегмента ST
https://doi.org/10.15829/1560-4071-2025-6298
EDN: NXMUNZ
Аннотация
Одной из основных причин смертности во всем мире все еще остаются сердечно-сосудистые заболевания, в частности, их острые формы: острый коронарный синдром с подъемом и без подъема сегмента ST. Опубликованные данные свидетельствуют, что у ряда пациентов причиной острого коронарного синдрома без подъема сегмента ST является окклюзирующее поражение инфаркт-ответственной артерии. В современной медицине существуют как инвазивные, так и неинвазивные методы визуализации тромбозов коронарных артерий. Цель исследования — анализ и систематизация литературных данных о применяемых методах визуализации острых тромбозов. При подготовке обзора использовались публикации, индексируемые в базах PubMed, Google Scholar, Web of Science и Cyberleninka. Глубина поиска составила 5 лет, начиная с 2020г. В основу обзора вошли обобщенные данные из наиболее актуальных клинических исследований, отчетов и систематических обзоров. Проведенный анализ литературы позволил сделать заключение о том, что методы как инвазивной, так и неинвазивной визуализации имеют ряд достоинств и недостатков. В связи с этим совершенствование данных методик остается актуальной исследовательской задачей.
Ключевые слова
Для цитирования:
Стрелкова А.В., Чащин М.Г., Горшков А.Ю., Драпкина О.М., Юрин А.В., Гагарина Е.В., Терещенко А.С. Современные особенности визуализации тромбозов коронарных артерий при остром коронарном синдроме без подъема сегмента ST. Российский кардиологический журнал. 2025;30(6S):6298. https://doi.org/10.15829/1560-4071-2025-6298. EDN: NXMUNZ
For citation:
Strelkova A.V., Chashchin M.G., Gorshkov A.Yu., Drapkina O.M., Yurin A.V., Gagarina E.V., Tereshchenko A.S. Modern features of coronary thrombosis imaging in non-ST-elevation acute coronary syndrome. Russian Journal of Cardiology. 2025;30(6S):6298. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6298. EDN: NXMUNZ
Сердечно-сосудистые заболевания являются основной причиной смертности. Согласно данным Всемирной организации здравоохранения, ежегодно >17 млн человек умирает от сердечно-сосудистых заболеваний. В частности, ишемическая болезнь сердца является причиной летального исхода >7 млн случаев каждый год1. По последним данным Федеральной службы государственной статистики распространенность острых форм ишемической болезни сердца в Российской Федерации варьируется в пределах 20% [1]. В настоящее время отмечается значительное увеличение доли пациентов, госпитализированных с диагнозом острого коронарного синдрома (ОКС) без подъема сегмента ST (ОКСбпST), по сравнению с долей пациентов с ОКС с подъемом сегмента ST. Согласно данным за 2022г в Российской Федерации с диагнозом ОКС было госпитализировано 438315 человек, из которых в 65,6% (n=287470) случаев был установлен диагноз ОКСбпST и только в 34,3% (n=150845) — инфаркт миокарда с подъемом сегмента ST. [2]. Этиология ОКСбпST, как правило, обусловлена прогрессированием стенозирующего атеросклероза коронарных артерий (КА) с последующим развитием неокклюзирующего тромбоза сосуда в области эрозии или надрыва покрышки атеросклеротической бляшки (АСБ) [3]. Тем не менее опубликованы данные, что в ряде случаев причиной ОКСбпST может являться острый тромбоз инфаркт-ответственной артерии (ИОА). Так, по данным метаанализа, включавшего 40777 пациентов с диагнозом ОКСбпST, у 25,5% (n=10415) визуализировалось острое окклюзирующее поражение ИОА [4]. Схожие данные были отмечены в работе Hung CS, et al. (2018), где острый тромбоз инфаркт-ответственного сосуда диагностировался у 34% (n=17212) пациентов с данным диагнозом [5]. Авторы сходятся во мнении, что наличие острого тромбоза ИОА у пациентов с ОКСбпST сопряжено с более высокими показателями госпитальной летальности, а также большей частотой развития крупных осложнений (MACE).
Согласно актуальным клиническим рекомендациям по ведению пациентов с диагнозом ОКСбпST, тактика лечения, в т. ч. определение сроков реваскуляризации КА, основывается на стратификации риска летального исхода на госпитальном этапе и в течение 6 мес., определяемом на основании подсчета баллов по шкале GRACE (Global registry of acute coronary events) [6]. Шкала GRACE была разработана на основе данных 69 тыс. пациентов, госпитализированных с диагнозом ОКС в 94 госпиталя 14 стран Северной и Южной Америки, Европы, Австралии и Новой Зеландии за период с 1999 по 2002гг, и включает в себя следующие параметры: возраст больного, класс острой сердечной недостаточности по классификации T. Killip, факт наличия или отсутствия остановки сердечной деятельности при поступлении в стационар, показатели систолического артериального давления, частоты сердечных сокращений, а также оценку изменения сегмента ST по данным электрокардиографии (ЭКГ), уровни креатина и маркеров некроза миокарда (тропонина I) по результатам лабораторной диагностики. На основании подсчета баллов определяется риск госпитальной летальности: риск считается низким при сумме баллов ≤108, средним (промежуточным) — при 109-140 баллах и высоким при сумме ≥141 баллов. Вероятность летального исхода пропорционально увеличивается при увеличении суммы баллов, так, у пациентов низкого риска показатели смертности составляют <1%, в группе среднего риска — от 1% до 3%, а в группе высокого риска превышают 3% [7]. Также были разработаны новые модификации данной шкалы: в 2014г была представлена обновленная версия шкалы GRACE 2.0, позволяющая оценивать риск летального исхода в отдаленном периоде (через 1 и 3 года после ОКСбпST) [8] и GRACE 3.0, учитывающая гендерные различия больных2. Тем не менее применение новых шкал в клинической практике все еще ограничено.
Так как структура шкалы GRACE основана на оценке параметров клинического состояния пациента, у больных низкого и промежуточного рисков состояние коронарного русла может оставаться недооцененным, что потенциально ухудшает прогноз. Так, Hung CS, et al. (2018) в рамках метаанализа установили, что не было отмечено достоверной разницы между риском летальности, стратифицированным по шкале GRACE, у пациентов как с острым тромбозом ИОА, так и у пациентов без тромботического поражения [5].
В связи с этим принятие решения о сроках проведения реваскуляризации требует индивидуального подхода в каждой клинической ситуации, что повышает актуальность изучения и совершенствования как инвазивных, так и неинвазивных методик визуализации поражений КА при ОКСбпST для определения наиболее верной тактики ведения пациента.
Методология исследования
При подготовке обзора использовались публикации, индексируемые в базах PubMed, Google Scholar, Web of Science и Cyberleninka. Глубина поиска составила 5 лет, начиная с 2020г. В основу обзора вошли обобщенные данные из наиболее актуальных клинических исследований, отчетов и систематических обзоров.
Результаты
Методы визуализации тромбозов КА при ОКСбпST
В современной медицинской практике оценить тяжесть поражения коронарного русла, а также определить тактику ведения пациента, возможно при помощи различных методов визуализации, которые можно разделить на инвазивные (коронароангиография (КАГ), внутрисосудистое ультразвуковое исследование (ВСУЗИ), оптическая когерентная томография (ОКТ)) и неинвазивные (мультиспиральная компьютерная томография (МСКТ) КА, магнитно-резонансная томография (МРТ) сердца) (табл. 1).
Таблица 1
Современные методы визуализации тромбозов КА
|
№ п/п |
Метод визуализации |
Визуализация тромбоза |
Ограничения метода |
|
Инвазивные методы визуализации |
|||
|
1 |
КАГ |
Нарушение контрастирования ИОА и/или наличие неровности контура сосуда |
— отсутствие визуализации слоев сосудистой стенки — невозможность оценки состояния просвета — использование рентгеновского облучения |
|
2 |
ВСУЗИ |
Гиперэхогенная масса без тени |
— визуализация ограничена при диаметре артерии ≤1,5 мм — выраженный кальциноз образует акустическую тень |
|
3 |
ОКТ |
Внутрипросветная или пристеночная масса с неровными контурами и высокой (красный тромб) или низкой (белый тромб) степенью затухания сигнала |
— низкая проникающая способность (2-3 мм) — остаточное количество крови (при недостаточном ее замещении контрастным препаратом) может имитировать тромботические массы |
|
Неинвазивные методы визуализации |
|||
|
4 |
МСКТ КА |
Участок низкой рентгеновской плотности в виде прерывания контрастного заполнения сосуда |
— оценка сосудистого просвета только в артериях диаметром ≥2 мм — обязательная ЭКГ-синхронизация — выраженная тахикардия — тахиаритмии (фибрилляция предсердий, частая экстрасистолия) — наличие выраженного кальциноза |
|
5 |
МРТ сердца |
"Размытый" след сигнала сосуда с включениями сигналов высокой интенсивности (метгемоглобин) |
— длительное время исследования для получения изображения — запрещено проводить исследование при наличии у пациента искусственного водителя ритма и/или металлических имплантов |
Сокращения: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ИОА — инфаркт-ответственная артерия, КАГ — коронароангиография, МРТ — магнитно-резонансная томография, МСКТ КА — мультиспиральная компьютерная томография коронарных артерий, ОКТ — оптическая когерентная томография, ЭКГ — электрокардиография.
Инвазивные методы визуализации тромбозов КА при ОКСбпST
КАГ
В настоящее время КАГ является золотым стандартом диагностики стенозирующего атеросклероза КА. Основной задачей КАГ является качественная визуализация каждого сегмента коронарного русла, что позволяет выявить наличие, локализацию и выраженность патологических изменений, а также определить дальнейшую тактику ведения больного [9].
При проведении КАГ тромбоз КА определяется при нарушении пристеночного контрастирования и/или неровности контура сосуда. Для оценки тяжести коронарного тромбоза была разработана шкала TIMI thrombus grade score (TTG), в основе которой лежит ангиографическая характеристика выраженности тромбоза ИОА после заведения коронарного проводника в дистальное русло сосуда через зону окклюзии. В зависимости от соотношения размера тромба относительно диаметра ИОА высчитывается индекс коронарного тромбоза в баллах от 0 до 5, где 0 — отсутствие ангиографических признаков тромбоза, а 5 — массивный тромбоз ИОА (табл. 2, рис. 1-3).
Таблица 2
Ангиографическая оценка коронарного тромбоза по шкале ТТG (TIMI thrombus grade score)
|
Степень |
Описание |
|
TTG 0 |
нет ангиографических признаков тромбоза |
|
TTG 1 |
вероятно наличие тромба нарушение пристеночного контрастирования, неровность контуров сосуда |
|
TTG 2 |
тромб размером не более 1/2 ИОА |
|
TTG 3 |
продольный размер тромба >1/2, но <2 диаметров ИОА |
|
TTG 4 |
продольный размер тромба >2 диаметров ИОА |
|
TTG 5 |
массивный тромбоз ИОА |
Сокращения: ИОА — инфаркт ответственная артерия, TТG — TIMI thrombus grade score.
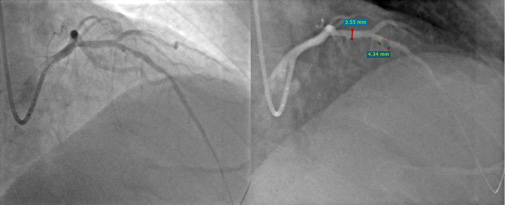
Рис. 1. КАГ: острый тромбоз среднего сегмента ПМЖВ, TTG 3.
Примечание: источник — архив РСЦ ГБУЗ МО Одинцовская ОБ.
Сокращения: КАГ — коронароангиография, ПМЖВ — передняя межжелудочковая ветвь, TTG — TIMI thrombus grade score.
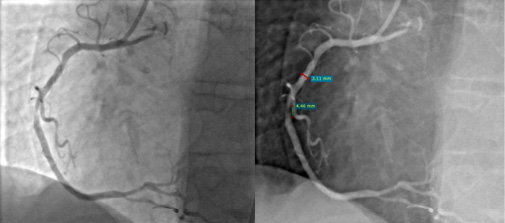
Рис. 2. КАГ: острый тромбоз среднего сегмента ПКА, TTG 3.
Примечание: источник — архив РСЦ ГБУЗ МО Одинцовская ОБ.
Сокращения: КАГ — коронароангиография, ПКА — правая коронарная артерия, TTG — TIMI thrombus grade score.
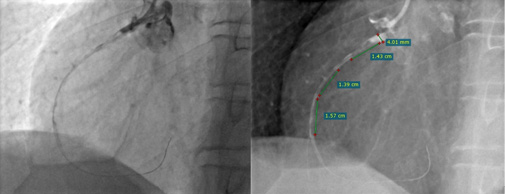
Рис. 3. КАГ: массивный острый тромбоз ПКА, TTG 5.
Примечание: источник — архив РСЦ ГБУЗ МО Одинцовская ОБ.
Сокращения: КАГ — коронароангиография, ПКА — правая коронарная артерия, TTG — TIMI thrombus grade score.
Однако несмотря на то, что КАГ является "золотым" стандартом диагностики поражений КА, данный метод обеспечивает визуализацию только проекции просвета коронарного сосуда, не позволяющую оценить непосредственно толщу сосудистой стенки и детальную геометрию просвета [10].
Для получения более детальной информации обо всех слоях сосудистой стенки, их структуре и определения наличия патологических субстратов и внутрипросветных включений в настоящее время используются методы внутрисосудистой визуализации [11]. Использование данных методов основано на получении внутрисосудистого изображения поперечного среза КА, что позволяет проводить анатомическую и морфологическую оценки сосуда [9][12].
ВСУЗИ
Одним из таких методов является ВСУЗИ, представляющее собой метод инвазивной визуализации, основанный на преобразовании отраженного от стенок сосуда ультразвукового сигнала в томографическое изображение [10][13]. Использование ВСУЗИ позволяет достоверно определить морфологические характеристики АСБ, а также идентифицировать признаки ее нестабильности, наличие надрывов и изъязвлений покрышки [14-16]. При выполнении ВСУЗИ острый тромбоз выглядит как гиперэхогенная структура, без тени, свободно находящаяся в просвете сосуда [17] (рис. 4, 5).
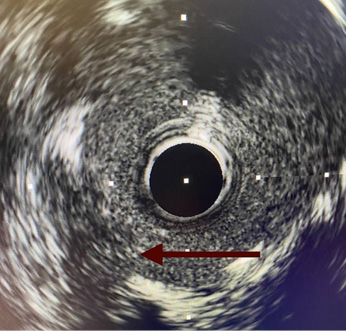
Рис. 4. ВСУЗИ-изображение красного тромба КА.
Примечание: красная стрелка указывает на локализацию красного тромба КА. Источник: архив ФГБУ НМИЦ кардиологии им. акад. Е. И. Чазова. Цветное изображение доступно в электронной версии журнала.
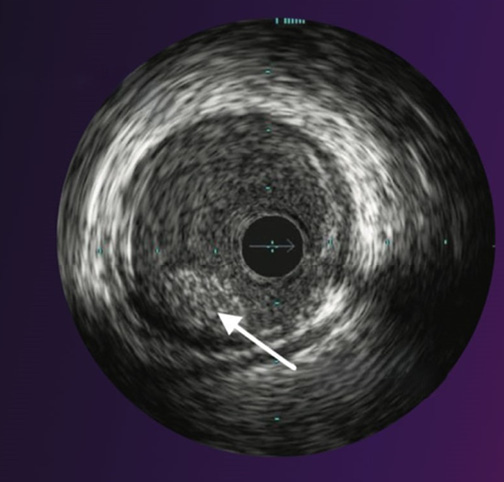
Рис. 5. ВСУЗИ-изображение белого тромба КА.
Примечание: белая стрелка указывает на локализацию белого тромба КА. Источник: https://www.sozocardiology.com/heart-treatments/intra-vascular-ultrasound-ivus-study. Цветное изображение доступно в электронной версии журнала.
Внутрипросветный тромб определяется как зернистая или мелкопятнистая эхо-структура с интенсивным отражением, а также мерцанием во время визуализации. В отличие от внутрипросветного, пристеночный тромбоз определяется как линейная плотная эхо-структура, располагающаяся по длине сосудистой стенки и расширяющаяся при пульсации сосуда [18]. Однако чувствительность данного метода при определении тромбозов составляет всего 33% [10]. В работе Jang IK, et al. (2002), проанализировав 42 изображения АСБ с результатами гистологического исследования, было доказано, что частота обнаружения тромботических масс при помощи ВСУЗИ значительно ниже, чем при использовании ОКТ [19]. Это обусловлено тем, что тромб при ВСУЗИ может быть распознан как фиброзная бляшка [18][20]. Помимо этого, еще одним ограничением метода является диаметр артерии — визуализация крайне ограничена при диаметре <1,5 мм, также на качество получаемого изображения может повлиять выраженный кальциноз сосудов, образующий акустическую тень.
ОКТ
Другим перспективным методом визуализации является ОКТ, основанная на измерении времени задержки отраженного оптического излучения инфракрасного диапазона от тканей [21]. При помощи ОКТ возможно более точно оценить интимальные и субинтимальные образования сосудистой стенки, а также различные морфологические изменения. В частности, при использовании данного метода лучше визуализируются диссекции, протрузии бляшек через стент, а также структуры тромба [13]. Чувствительность ОКТ для обнаружения тромба составляет 100% [10]. На изображениях ОКТ тромб может визуализироваться как масса, прикрепленная к сосудистой стенке, или же находящаяся в просвете сосуда [22]. В зависимости от степени рассеивания и затухания сигналов возможна визуализация тромбов 2 типов: красного и белого [22]. Красный тромб богат эритроцитами и визуализируется в виде выступа с неровными контурами, сильно рассеивающего свет и имеющего высокую степень затухания сигнала, напоминающего кровь [10][22] (рис. 6). Белый тромб, напротив, богат тромбоцитами и представляет собой гетерогенную массу с неровными контурами, которая меньше рассеивает сигнал и имеет более низкую степень затухания [10][22] (рис. 7).
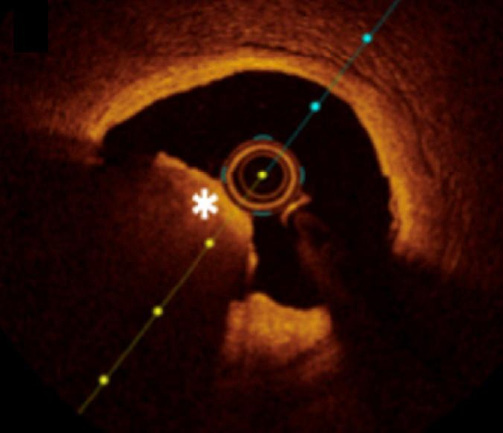
Рис. 6. ОКТ-изображение красного тромба КА.
Примечание: * — указывает на локализацию красного тромба КА. Источник: архив ФГБУ НМИЦ кардиологии им. акад. Е. И. Чазова.
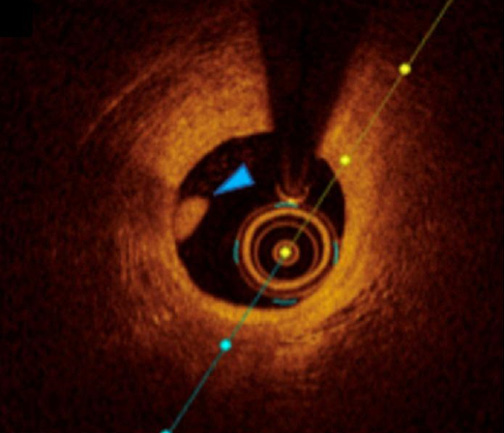
Рис. 7. ОКТ-изображение белого тромба КА.
Примечание: синяя стрелка указывает на локализацию белого тромба КА. Источник: архив ФГБУ НМИЦ кардиологии им. акад. Е. И. Чазова. Цветное изображение доступно в электронной версии журнала.
Необходимо учитывать, что для получения качественного ОКТ-изображения во время проведения исследования необходимо тугое наполнение сосуда контрастным препаратом, т. к. остаточное количество крови в просвете может имитировать тромбы на получаемом изображении. Также еще одним ограничением метода является его низкая проникающая способность в глубину сосудистой стенки (на 2-3 мм).
Стоит отметить, что несмотря на очевидную высокую информативность методов внутрисосудистой визуализации и положительное влияние на ближайшие и отдаленные прогнозы при проведении чрескожных коронарных вмешательств под контролем ВСУЗИ или ОКТ, их повсеместное использование все еще не распространено по ряду экономических и организационных причин. Согласно данным, опубликованным Алекяном Б. Г. и др. (2023) в 2023г в Российской Федерации при проведении чрескожного коронарного вмешательства ВСУЗИ использовалось лишь в 3,7% случаев, а ОКТ — в 0,3% случаев [23].
Неинвазивные методы визуализации тромбозов КА при ОКСбпST
МСКТ
С момента внедрения в клиническую практику МСКТ с высокой пространственной и временной разрешающей способностью, появилась возможность оценивать состояние КА неинвазивным способом, получая изображения, синхронизированные с сердечными сокращениями, регистрируемыми на ЭКГ. МСКТ позволяет оценивать не только состояние просвета КА, но также и состояние сосудистой стенки. В работе Osinalde EP, et al. (2023) при сравнении информативности МСКТ КА и КАГ в определении тромбозов КА, было установлено достоверное соответствие получаемых данных (K=0,554, p<0,001) [24].
Преимуществами данного метода визуализации являются неинвазивность, быстрота выполнения исследования (~10-15 мин), возможность выполнения без применения седативных препаратов, а также высокая информативность с возможностью построения трехмерных реконструкций и виртуальных проекций [25].
Тромбоз КА по данным МСКТ определяется как участок низкой рентгеновской плотности, визуализирующийся в виде прерывания контрастного заполнения сосуда, имеющим относительно низкое "затухание" [26][27] (рис. 8).
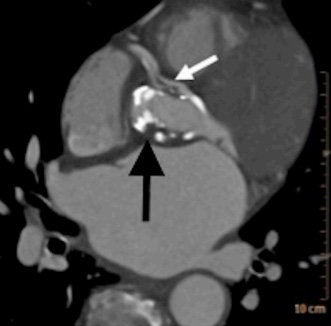
Рис. 8. МСКТ-изображение острого тромбоза устья ПКА (белая стрелка) и тромба на некоронарной створке биопротеза аортального клапана (черная стрелка).
Примечание: источник — Lam MC, Kanaganayagam G, Ahmad Y, et al. Acute myocardial infarction and stroke secondary to valve thrombosis following transcatheter aortic valve replacement-what can happen when antiplatelet agents are stopped. Quant Imaging Med Surg. 2017;7(5):605-607. doi:10.21037/qims.2017.10.04.
Сокращения: МСКТ — мультиспиральная компьютерная томография, ПКА — правая коронарная артерия.
Тромботический участок может быть окружен компонентами АСБ неправильной формы с более высокой рентгеновской плотностью, а также значительным внутрипросветным выступом бляшки [24].
Ограничением данного метода визуализации является то, что оценить состояние сосудистого просвета возможно лишь в артериях диаметром не менее 2 мм. Помимо этого, возможно формирование артефактов, вызванных колебаниями КА на фоне частоты сердечных сокращений >75-80 уд./мин, что делает исследование неинформативным у пациентов с имплантированными водителями ритма и ресинхронизирующими устройствами, а также у пациентов с фибрилляцией предсердий и/или частой экстрасистолией. Выраженный кальциноз также существенно ограничивает качество получаемого томографического изображения. Абсолютными противопоказаниями к проведению МСКТ-диагностики поражений КА являются наличие в анамнезе тяжелых аллергических реакций (анафилактический шок, остановка дыхания и/или сердечной деятельности, судороги) на йодсодержащие контрастные препараты, острой или хронической почечной недостаточности, гипертиреоза и/или бронхиальной астмы тяжелого течения.
В упомянутой выше работе Osinalde EP, et al. (2023) было отмечено, что несмотря на высокую информативность МСКТ в визуализации тромбозов КА, в определении размеров коронарного тромба, классифицируемого по шкале TTG, соответствие результатов МСКТ с данными КАГ было статистически значимо ниже (K=0,297, p=0,001) [24]. Стоит отметить, что, согласно действующим клиническим рекомендациям, рутинное применение МСКТ КА у пациентов с диагнозом ОКСбпST в настоящий момент не рекомендовано [6].
МРТ
МРТ сердца — неинвазивный метод исследования, который на основании физического явления ядерного магнитного резонанса позволяет трехмерно визуализировать структуры сердца. Исследование выполняется с обязательной синхронизацией с ЭКГ. Дополнительное использование контрастного вещества позволяет оценить морфологическое и функциональное состояние клапанного аппарата и миокарда, а именно уточнить локализацию и объем поражения сердечной мышцы. Использование данного радиоизотопного метода позволяет не только подтвердить наличие очага некроза в миокарде, но также дифференцировать ишемическую или воспалительную этиологии поражения и исключить синдром такоцубо.
Выявление тромбоза КА при помощи МРТ-визуализации основывается на оценке четкости сигнала сосуда, след которого визуализируется "размытым" при наличии тромботических компонентов. Более четко визуализировать структуру тромба возможно в режиме одновременного подавления сигналов воды и жира [28] (рис. 9).
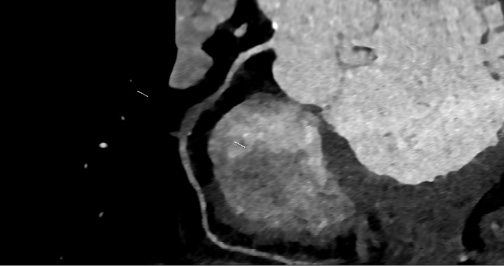
Рис. 9. МРТ-изображение острого тромбоза среднего сегмента ПКА.
Примечание: источник — архив Медицинского научно-образовательного центра ФГБОУ ВО МГУ им. М. В. Ломоносова.
Сокращения: МРТ — магнитно-резонансная томография, ПКА — правая коронарная артерия.
В опубликованном клиническом случае коронарного тромбоза у пациента 45 лет, Borelli C, et al. (1997) подчеркивают, что идентифицировать тромб по данным МРТ также возможно при анализе изображений, взвешенных по времени продольной и поперечной релаксаций (Т1 и Т2). При наличии внутрипросветного тромба в данных режимах отмечается формирование области с сигналами высокой интенсивности, соответствующих сигналу метгемоглобина [29]. Высокая интенсивность сигнала метгемоглобина обусловлена его парамагнитными свойствами, возникающими в процессе превращения гемоглобина в метгемоглобин. Последующее преобразование метгемоглобина в гемосидерин, напротив, приводит к снижению интенсивности сигнала [30].
Высокая чувствительность данного метода неинвазивной визуализации в определении коронарных тромбозов была подтверждена в ряде работ. Так, Lombardo P, et al. (2023), выполнив 200 посмертных МРТ КА, отметили 72% чувствительность и 97% специфичность в диагностике тромбоза [31]. Схожие данные были получены Jansen HC, et al., проанализировавших МРТ снимки 11 пациентов с коронарным тромбозом и 9 пациентов без признаков тромбоза. В результате чувствительность метода в данном случаев составила 91%, а специфичность — 100% [32].
Преимуществами использования МРТ-визуализации сердца и КА являются неинвазивность, отсутствие лучевой нагрузки, трехмерный характер полученного изображения, возможность оценки скорости и характера движения кровотока, а также возможность оценки перфузии миокарда с помощью парамагнитных контрастных веществ [33].
Тем не менее использование МРТ с контрастированием в качестве рутинного метода обследования у пациентов с ОКСбпST все еще не рекомендовано [6]. Также ограничениями использования МРТ-визуализации являются относительно большее время получения изображения по сравнению с другими методами визуализации и невозможность обследования пациентов с искусственными водителями ритма и/или металлическими имплантами [33].
Таким образом, несмотря на наличие различных инструментальных методов визуализации коронарного русла, каждый из них также имеет ряд ограничений и недостатков. В связи с этим актуальным вопросом современной медицины является поиск неинвазивных маркеров, позволяющих на основании исследований, используемых в рутинной практике, оценить наличие или отсутствие стенозирующего атеросклероза КА или острого коронарного тромбоза. Так, в работах Астрейко А. В. (2022) и Bilgin M, et al. (2024) была продемонстрирована взаимосвязь между увеличением уровней маркеров системного воспаления и тяжестью поражения коронарного русла по данным КАГ [34][35]. Также в литературе опубликованы данные, что на основании результатов ЭКГ и дуплексного сканирования сонных и бедренных артерий возможно провести предтестовую оценку наличия стенозирующего атеросклероза КА [36][37]. Все большую популярность для анализа влияния большого количества клинико-анамнестических факторов набирает метод машинного обучения. Использование алгоритмов искусственного интеллекта позволяет стратифицировать больных в зависимости от вероятности наличия не только стенозирующего поражения КА, но и острой окклюзий ИОА [38-40].
Заключение
В настоящее время тактика ведения пациентов с ОКСбпST варьирует от проведения немедленной КАГ с реваскуляризацией по показаниям до возможности вмешательства в плановом порядке в зависимости от стратифицированного риска по шкале GRACE. Однако в связи с тем, что данная шкала базируется на клинических показателях пациента, без учета предполагаемого объема и тяжести поражения коронарного русла, у ряда больных, по данным литературы, отмечается значительная недооценка риска. В особенности это сопряжено с более высоким риском неблагоприятного исхода у пациентов с ОКСбпST, обусловленным острым окклюзирующим поражением ИОА.
Несмотря на то, что для визуализации поражения коронарного русла были разработаны как инвазивные (КАГ, ВСУЗИ, ОКТ), так и неинвазивные (МСКТ и МРТ) методы исследования, каждый из методов имеет ряд преимуществ и недостатков. В связи с этим необходима модернизация существующих инструментальных методов исследования КА, а также широкое распространение высокотехнологичных внутрисосудистых методов визуализации.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. World Health Organization. Fact sheets: Cardiovascular diseases (CVDs). https://www.who.int/ru/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (11 June 2021).
2. Wenzl FA. Global Registry of Acute Coronary Events Score 3.0. Machine learning-based risk prediction with GRACE 3.0. https://www.grace-3.com (2023).
Список литературы
1. Вайсман Д. Ш., Енина Е. Н. Показатели смертности от ишемической болезни сердца в Российской Федерации и ряде регионов: особенности динамики и структуры. Кардиоваскулярная терапия и профилактика. 2024;23(7):3975. doi:10.15829/1728-8800-2024-3975.
2. Журавлева М. В., Зырянов С. К., Палеев Ф. Н. и др. Оценка влияния применения лекарственного препарата тикагрелор у пациентов с острым коронарным синдромом и пациентов с инфарктом миокарда в анамнезе на достижение целевых индикаторов Государственной программы "Развитие здравоохранения" Российской Федерации и субъектов Российской Федерации в 2023-2025 годах. Российский кардиологический журнал. 2024;29(1):5700. doi:10.15829/1560-4071-2024-5700.
3. Миленькин Б. И., Миленькина С. Г., Гаврилко А. Д. и др. Кардиоатлас. Клинические случаи острого коронарного синдрома. М.: Умный доктор, 2022. с. 152. ISBN: 978-5-6043769-6-6.
4. Khan AR, Golwala H, Tripathi A, et al. Impact of total occlusion of culprit artery in acute non-ST elevation myocardial infarction: a systematic review and meta-analysis. European Heart Journal. 2017;38(41):3082-9. doi:10.1093/eurheartj/ehx418.
5. Hung CS, Chen YH, Huang CC, et al. Prevalence and outcome of patients with non-ST segment elevation myocardial infarction with occluded "culprit" artery — a systemic review and meta-analysis. Critical Care. 2018;22:34. doi:10.1186/s13054-018-1944-x.
6. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021; 26(4):4449. doi:10.15829/1560-4071-2021-4449.
7. D'Ascenzo F, Biondi-Zoccai G, Moretti C, et al. TIMI, GRACE and alternative risk scores in Acute Coronary Syndromes: A meta-analysis of 40 derivation studies on 216,552 patients and of 42 validation studies on 31,625 patients. Contemporary clinical trials. 2012;33(3):507-14. doi:10.1016/j.cct.2012.01.001.
8. Fox KAA, FitzGerald G, Puymirat E, et al. Should patients with acute coronary disease be stratified for management according to their risk? Derivation, external validation and outcomes using the updated GRACE risk score. BMJ Open. 2014;4:e004425. doi:10.1136/bmjopen-2013-004425.
9. Чернявский А. М., Бессонов И. С., Бадоян А. Г. и др. Коронарная ангиография и стентирование. Руководство. Москва: ГЭОТАР-Медиа, 2022. с. 328. ISBN: 978-5-9704-7224-8.
10. Черняк А. А., Дешко М. С., Снежицкий В. А. и др. Чрескожные коронарные вмешательства: внутрисосудистые методы визуализации и измерение внутрикоронарной гемодинамики. Журнал Гродненского государственного медицинского университета. 2020;18(5):513-22. doi:10.25298/2221-8785-2020-18-5-513-522.
11. Endovascular surgery — technology and practices. Kokov LS, Bolomatov NV (eds). M.: RAS, 2021. p. 340. (In Russ.) Эндоваскулярная хирургия — технологии и практика. Коков Л. С., Боломатов Н. В. (ред.). М.: РАН, 2021. с. 340. ISBN: 978-5-907366-26-8.
12. Асадов Д. А. Сравнительная оценка методов внутрисосудистого ультразвука и оптической когерентной томографии при визуализации внутрисосудистых структур. Международный журнал интервенционной кардиоангиологии. 2014;36:42-7. EDN SMFXOR.
13. Миронов В. М., Меркулов Е. В., Терещенко А. С. и др. Клиническое применение внутрисосудистого ультразвукового исследования коронарных артерий. Вестник рентгенологии и радиологии. 2013;5:38-49. EDN RSXIYJ.
14. Ehara S, Kobayashi Y, Yoshiyama M, et al. Spotty calcification typifies the culprit plaque in patients with acute myocardial infarction: an intravascular ultrasound study. Circulation. 2004;110(22):3424-9. doi:10.1161/01.CIR.0000148131.41425.E9.
15. Сукманова И. А., Гордеева Д. С., Пинаева А. С. и др. Возможности применения визуализирующих методов рентгенэндоваскулярной хирургии у пациентов с ИБС. Бюллетень медицинской науки. 2021;4(24):67-80. doi:10.31684/25418475-2021-4-67.
16. Homorodean C, Leucuta D-C, Ober M, et al. Intravascular ultrasound insights into the unstable features of the coronary atherosclerotic plaques: A systematic review and meta-analysis. European Journal of Clinical Investigation. 2022;52:e13671. doi:10.1111/eci.13671.
17. Арутюнян Г. К., Меркулов Е. В., Терещенко А. С. Внутрисосудистое ультразвуковое исследование: Атлас и руководство по использованию в клинической практике. Москва: Типография "Зетапринт", 2024. с. 132. ISBN 978-5-93856-804-4.
18. Nasu K, Tsuchikane E, Katoh O, et al. Impact of intramural thrombus in coronary arteries on the accuracy of tissue characterization by in vivo intravascular ultrasound radiofrequency data analysis. The American journal of cardiology. 2008;101(8):1079-83. doi:10.1016/j.amjcard.2007.11.064.
19. Jang IK, Bouma BE, Kang DH, et al. Visualization of coronary atherosclerotic plaques in patients using optical coherence tomography: comparison with intravascular ultrasound. Journal of the American College of Cardiology. 2002;39(4):604-9. doi:10.1016/s0735-1097(01)01799-5.
20. Кочергин Н. А., Кочергина А. М. Внутрисосудистый ультразвук как метод выявления нестабильных атеросклеротических бляшек коронарных артерий (обзор литературы). Медицинская визуализация. 2017;21(4):82-7. doi:10.24835/1607-0763-2017-4-82-87.
21. Мустафина И. А., Загидуллин Н. Ш., Ишметов В. Ш. и др. Оптическая когерентная томография в диагностике ишемической болезни сердца. Креативная хирургия и онкология. 2017;7(1):54-7. doi:10.24060/2076-3093-2017-7-1-54-57.
22. Трусов И. С., Нифонтов Е. М., Бирюков А. В. и др. Применение оптической когерентной томографии в визуализации сосудистой стенки коронарных артерий до и после стентирования. Регионарное кровообращение и микроциркуляция. 2019;18(1):77-85. doi:10.24884/1682-6655-2019-18-1-77-85.
23. Алекян Б. Г., Бойцов С. А., Маношкина Е. М. и др. Российские национальные результаты реваскуляризации миокарда при остром коронарном синдроме за 2023 год. Кардиология. 2024;64(11):76-83. doi:10.18087/cardio.2024.11.n2733.
24. Osinalde EP, Bastante T, Cecconi A, et al. Intracoronary thrombus assessment with cardiac computed tomography angiography in a deferred stenting strategy: the MATURE prospective study (MSCT to Assess ThrombUs REsolution). Coronary Artery Disease. 2023;34(3):167-76. doi:10.1097/MCA.0000000000001225.
25. Морозов С. П., Насникова И. Ю., Терновой С. К. Мультиспиральная компьютерная томография в многопрофильном стационаре. Москва: Никомед Дистрибъюшн Сентэ, 2009. с. 97. EDN YMIRDN.
26. Achenbach S, Marwan M. Intracoronary thrombus. Journal of Cardiovascular Computed Tomography. 2009;3(5):344-5. doi:10.1016/j.jcct.2009.06.009.
27. Терновой С. К., Шабанова М. С., Гаман С. А. и др. Роль компьютерной томографии в выявлении нестабильных атеросклеротических бляшек коронарных артерий: сопоставление результатов компьютерной томографии и внутрисосудистого ультразвукового исследования. Российский электронный журнал лучевой диагностики. 2016;6(3):68-79. doi:10.21569/2222-7415-2016-6-3-68-79.
28. Анисимов Н. В., Батова С. С., Пирогов Ю. А. Магнитно-резонансная томография: управление контрастом и междисциплинарные приложения. Москва: МАКС Пресс, 2013. с. 243. ISBN 978-5-317-04542-5.
29. Borelli C, Berthezene Y, Olteanu B. Subacute Coronary Artery Thrombosis: MRI Findings. Journal of computer assisted tomography. 1997;21(6):962-4. doi:10.1097/00004728-199711000-00020.
30. Казакова С. С., Хазов П. Д. Магнитно-резонансная томография в диагностике инсультов мозжечка. Российский медико-биологический вестник имени академика И. П. Павлова. 2008;16(2):136-41. EDN JQPXZL.
31. Lombardo P, Lange-Herr N, Hoppe H, et al. Diagnostic accuracy of coronary artery stenosis and thrombosis assessment using unenhanced multiplanar 3D post-mortem cardiac magnetic resonance imaging. Forensic science international. 2023;353:111878. doi:10.1016/j.forsciint.2023.111878.
32. Jansen CH, Perera DD, Makowski MR, et al. Detection of intracoronary thrombus by magnetic resonance imaging in patients with acute coronary syndrome. Journal of Cardiovascular Magnetic Resonance. 2010;12(1):O87. doi:10.1186/1532-429X-12-S1-O87.
33. Бокерия Л. А., Голухова Е. З. Клиническая кардиология: диагностика и лечение: учебное пособие: в 3 томах. Том 1. Москва: НМИЦ ССХ им. А. Н. Бакулева, 2011. с. 662. ISBN: 978-5-7982-0278-2.
34. Астрейко А. В. Прогностическое значение маркеров системного воспалительного ответа в выявлении стенозирующего атеросклероза коронарных артерий у пациентов с хронической ишемической болезнью сердца. Медицинские новости. 2022;10(337):8-12. EDN FUWNBU.
35. Bilgin M, Akkaya E, Dokuyucu R. Evaluation of Inflammatory Markers in Predicting Coronary Complexity: Insights from the SYNTAX II Score in NSTEMI Patients. Journal of Clinical Medicine. 2024;13(19):5940. doi:10.3390/jcm13195940.
36. Жаткина М. В., Гаврилова Н. Е., Метельская В. А. и др. Визуальная шкала для неинвазивной диагностики атеросклероза коронарных артерий разной степени выраженности. Кардиология. 2021;61(4):46-52. doi:10.18087/cardio.2021.4.n1481.
37. Переверзева К. Г., Якушин С. С., Дубова Н. В. Электрокардиографические критерии окклюзирующих и прогностически неблагоприятных поражений коронарных артерий. Российский кардиологический журнал. 2024;29(3S):5699. doi:10.15829/1560-4071-2024-5699.
38. Циванюк М. М., Гельцер Б. И., Шахгельдян К. И. и др. Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST. Российский кардиологический журнал. 2022;27(8):5079. doi:10.15829/1560-4071-2022-5079.
39. Абдуалимов Т. П., Обрезан А. Г. Выявление поражения коронарных артерий при помощи алгоритмов глубокого обучения. Кардиология: новости, мнения, обучение. 2021; 9(2):9-13. doi:10.33029/2309-1908-2021-9-2-9-13.
40. Циванюк М. М., Гельцер Б. И., Шахгельдян К. И. и др. Электрокардиографические, эхокардиографические и липидные показатели в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST. Российский кардиологический журнал. 2022;27(6):5036. doi:10.15829/1560-4071-2022-5036.
Об авторах
А. В. СтрелковаРоссия
Анна Владиславовна Стрелкова — м. н. с. лаборатории цифровой медицины и искусственного интеллекта; врач по рентгенэндоваскулярным диагностике и лечению.
Москва, Одинцово
Конфликт интересов:
нет
М. Г. Чащин
Россия
Михаил Георгиевич Чащин — к. м. н., руководитель лаборатории цифровой медицины и искусственного интеллекта, зав. отделением Липидная клиника.
Москва
Конфликт интересов:
нет
А. Ю. Горшков
Россия
Александр Юрьевич Горшков — к. м. н., зам. директора по научной и амбулаторно-поликлинической работе.
Москва
Конфликт интересов:
нет
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — д. м. н., профессор, академик РАН, директор.
Москва
Конфликт интересов:
нет
А. В. Юрин
Россия
Алексей Владимирович Юрин — врач по рентгенэндоваскулярным диагностике и лечению.
Одинцово
Конфликт интересов:
нет
Е. В. Гагарина
Россия
Евгения Викторовна Гагарина — врач-рентгенолог, м. н. с. Медицинский научно-образовательный центр.
Москва
Конфликт интересов:
нет
А. С. Терещенко
Россия
Андрей Сергеевич Терещенко — к. м. н., с. н. с. отдела рентгенэндоваскулярных методов диагностики и лечения.
Москва
Конфликт интересов:
нет
Дополнительные файлы
- Современные методы визуализации позволяют выявлять острые тромбозы инфаркт-ответственной артерии у пациентов с острым коронарным синдромом без подъема сегмента ST.
- Совершенствование используемых инструментальных методов диагностики тромботических поражений позволяет повысить качество оказания медицинской помощи пациентам кардиологического профиля.
- Систематизация данных литературы о применяемых методах визуализации острого тромбоза инфаркт-ответственной артерии у пациентов с острым коронарным синдромом без подъема сегмента ST.
Рецензия
Для цитирования:
Стрелкова А.В., Чащин М.Г., Горшков А.Ю., Драпкина О.М., Юрин А.В., Гагарина Е.В., Терещенко А.С. Современные особенности визуализации тромбозов коронарных артерий при остром коронарном синдроме без подъема сегмента ST. Российский кардиологический журнал. 2025;30(6S):6298. https://doi.org/10.15829/1560-4071-2025-6298. EDN: NXMUNZ
For citation:
Strelkova A.V., Chashchin M.G., Gorshkov A.Yu., Drapkina O.M., Yurin A.V., Gagarina E.V., Tereshchenko A.S. Modern features of coronary thrombosis imaging in non-ST-elevation acute coronary syndrome. Russian Journal of Cardiology. 2025;30(6S):6298. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6298. EDN: NXMUNZ
JATS XML

















































