Перейти к:
Липопротеин(а) как фактор тяжести сосудистых катастроф у пациентов, перенесших ишемический инсульт, с артериальной гипертензией 3 стадии и мультифокальным атеросклерозом
https://doi.org/10.15829/1560-4071-2025-6279
EDN: BZPBVQ
Аннотация
Цель. Выявить особенности липидного спектра, системы коагуляционного гемостаза, маркеров воспаления и тяжести неврологического статуса у пациентов, перенесших ишемический инсульт (ИИ) и имеющих повышенный уровень липопротеина(а) (Лп(а)).
Материал и методы. В исследование включены 109 больных (средний возраст 53,7±7,76 года), перенесших ИИ, с мультифокальным атеросклерозом (МФА) и артериальной гипертензией (АГ) 3 стадии. В зависимости от уровня Лп(а) пациенты были распределены на 2 группы. В группе 1 у 85 пациентов (78%) уровень Лп(а) составил ≤50 мг/дл, в группе 2 у 24 пациентов (22%) — выше 50 мг/дл. Всем пациентам определяли показатели липидного спектра, гемостаза, уровень высокочувствительного С-реактивного белка и интерлейкина-6.
Результаты. Целевой уровень холестерина липопротеинов низкой плотности <1,4 ммоль/л не был достигнут ни в одной группе, при этом все показатели липидного спектра не отличались между группами. Параметры глобальных тестов системы гемостаза (скорость роста сгустка, размер сгустка) были значимо выше у пациентов с уровнем Лп(а) >50 мг/дл. В этой группе также выше был уровень интерлейкина-6 (119,9 пг/мл vs 7,4 пг/мл, p<0,01) и тяжесть инсульта по шкале инсульта Национального института здравоохранения (5,7 балла vs 3,3 балла, p<0,01).
Заключение. Повышенный уровень Лп(а) у пациентов с АГ и МФА, перенесших ИИ, является фактором риска, оказывающим влияние на тяжесть неврологических проявлений ИИ и связанным с развитием гиперкоагуляции и воспаления. Варианты лечения, направленные на повышенный уровень Лп(а), ограничены, поэтому необходимо раннее выявление и своевременная коррекция модифицируемых факторов риска.
Ключевые слова
Для цитирования:
Веденская С.С., Смоленская О.Г. Липопротеин(а) как фактор тяжести сосудистых катастроф у пациентов, перенесших ишемический инсульт, с артериальной гипертензией 3 стадии и мультифокальным атеросклерозом. Российский кардиологический журнал. 2025;30(2):6279. https://doi.org/10.15829/1560-4071-2025-6279. EDN: BZPBVQ
For citation:
Vedenskaya S.S., Smolenskaya O.G. Lipoprotein(a) as a factor in the severity of vascular events in patients with ischemic stroke, stage 3 hypertension and multifocal atherosclerosis. Russian Journal of Cardiology. 2025;30(2):6279. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6279. EDN: BZPBVQ
Инсульт является одной из основных причин инвалидности и смертности в Российской Федерации. Среди инсультов 25,5% составляют повторные инсульты [1], риск развития которых увеличивается до 11% в течение 1 года и 26% в течение 5 лет [2]. После перенесенного инсульта уровень смертности значительно выше, что подчеркивает важность выявления факторов риска и профилактики повторного инсульта. Среди факторов риска как первого, так и повторного церебрального события наиболее значимыми являются артериальная гипертензия (АГ), дислипидемия, атеросклероз, сахарный диабет, курение. Однако в последние годы появляется все больше данных о вкладе системы гемостаза в развитие повторных ишемических событий. Локальная гиперкоагуляция является одной из основных причин повторного ишемического инсульта (ИИ) [3]. При этом состояние протромботической готовности наблюдается еще до появления симптомов инсульта [4]. После перенесенного инсульта в окружающей неишемизированной ткани сохраняется высокая концентрация тромбина [5], который является ключевым фактором гемостаза, опосредуя превращение фибриногена в фибрин. Кроме того, при инсульте тромбин способствует прямой клеточной токсичности, окислительному стрессу и воспалительной реакции [6]. Еще одним фактором, который может приводить к возникновению или рецидиву ИИ, является повышенный уровень липопротеина(a) (Лп(а)) [7]. Как Лп(а), так и холестерин липопротеинов низкой плотности (ХС ЛНП) являются представителями семейства apoB-содержащих липопротеинов. Аpo(a), входящий в состав Лп(а), обладает протромботической или антифибринолитической активностью, а связанные с Лп(а) окисленные фосфолипиды являются ключевыми медиаторами провоспалительных эффектов этих частиц, а также оказывают дестабилизирующее влияние в отношении атеросклеротических бляшек [8]. Несмотря на высокую распространенность, вклад повышенного уровня Лп(а) в развитие сердечно-сосудистых осложнений остается недооцененным в клинической практике. В исследовании BIOSIGNAL установлено, что уровень Лп(a) >100 нмоль/л связан с повторным инсультом [9]. Анализ подгрупп из исследования ARIC показал более высокий риск ИИ после коррекции липидного профиля у пациентов с Лп(a) >50 мг/дл [10]. В другом исследовании не обнаружено связи между Лп(а) и ИИ у лиц, ранее перенесших сердечно-сосудистые события [11]. Повышенный Лп(a) может усиливать выработку цитокинов, таких как интерлейкины и фактор некроза опухоли, способствующих воспалению [12].
Цель: выявить особенности нарушения липидного спектра, системы коагуляционного гемостаза, маркеров воспаления и тяжести неврологического статуса у пациентов, перенесших ИИ и имеющих повышенный уровень Лп(а).
Материал и методы
В исследование включены 109 больных (средний возраст 61±7,5 года) после перенесенного ИИ с мультифокальным атеросклерозом (МФА) и АГ 3 стадии. Средний возраст развития инсульта составил 59±7,8 лет, при этом 17 человек (15,6%) перенесли инсульт в возрасте до 50 лет, повторные инсульты зарегистрированы у 5 человек (4,6%). Все пациенты подписали информированное согласие на участие в исследовании. Исследование было одобрено этическим комитетом УГМУ (протокол от 19.11.2021 № 10) и соответствовало принципам Хельсинкской декларации. Критерии невключения в исследование: пациенты с клиническими проявлениями атеросклеротического заболевания (ишемическая болезнь сердца и/или заболевания сосудов нижних конечностей). Кальцинированные атеросклеротические бляшки в коронарных артериях были случайной находкой при проведении мультиспиральной компьютерной томографии органов грудной полости по другим показаниям. У всех обследованных пациентов отсутствовали жалобы и симптомы, типичные для поражения коронарных артерий, всем пациентам проведена оценка предтестовой вероятности ишемической болезни сердца с полученным значением ≤5%, что предполагает отсрочку проведения дальнейших диагностических тестов. Также критерием невключения являлось наличие АГ 1-2 стадии, воспалительных заболеваний миокарда, сахарного диабета, фибрилляции предсердий, геморрагического инсульта в анамнезе. Не включались пациенты с другими тяжелыми и декомпенсированными заболеваниями сердца (сердечная недостаточность, врожденные и приобретенные пороки, кардиомиопатии), печени и почек, тяжелым и декомпенсированным течением эндокринных заболеваний, аутоиммунными заболеваниями, психическими заболевания, соматическими заболеваниями в острой стадии. Диагноз АГ устанавливали согласно клиническим рекомендациям Российского кардиологического общества (РКО, 2020) [13]. Все пациенты имели сопоставимые значения артериального давления и получали антигипертензивную терапию. Диагноз МФА устанавливался при наличии поражения двух и более артериальных бассейнов по данным ультразвукового дуплексного сканирования. В исследование включали пациентов с МФА с гемодинамически незначимыми стенозами (до 50%). Диагноз ИИ был установлен врачом-неврологом на основании жалоб, анамнеза заболевания, данных неврологического статуса, инструментальных методов исследования. Тяжесть и клинический исход у пациентов с ИИ оценивались по шкале инсульта Национального института здравоохранения (NIHSS) [14]. Интерпретация результатов данной шкалы по критериям Brott T, et al. [15]: 0 баллов — состояние удовлетворительное; 1-4 баллов — легкий инсульт; 5-15 баллов — инсульт средней степени тяжести; 16-20 баллов — состояние между среднетяжелым и тяжелым инсультом; 21-42 баллов — тяжелый инсульт. Анализ липидного спектра включал определение общего холестерина, ХС ЛНП, холестерина липопротеинов высокой плотности и триглицеридов. Для пациентов, включенных в наше исследование и соответствующих категории очень высокого риска [16], применяли целевой уровень ХС ЛНП <1,4 ммоль/л. Все пациенты получали гиполипидемическую терапию: 93 человека (85,3%) — в виде монотерапии, 16 человек (14,5%) — комбинацию статина и эзетимиба. На высокодозовой терапии статинами (розувастатин 20-40 мг, аторвастатин — 40-80 мг) находилось только 35 пациентов, что составило 32,1%. Уровень Лп(а) определяли иммунохемилюминесцентным методом с помощью автоматизированной модульной платформы Roche Cobas 8000 с биохимическим модулем c702, Roche Diagnostics, Швейцария (аналитическая чувствительность тест-системы: 0,83 мг/дл). В настоящее время целесообразно и возможно измерять уровень Лп(а) как в нмоль/л, так и в мг/дл [17]. В качестве нормального значения Лп(а) рассматривается уровень <30 мг/дл или <75 нмоль/л. Согласно рекомендациям "Нарушения липидного обмена" (РКО, 2023) уровень Лп(а) >50 мг/дл (ему соответствует уровень Лп(а) >125 нмоль/л) связан с повышенным сердечно-сосудистым риском (ССР). Значения 30-50 мг/дл (75-125 нмоль/л) трактуются как "серая зона". В зависимости от уровня Лп(а) все пациенты были распределены на 2 группы. У 85 пациентов (78%) (группа 1) уровень Лп(а) составил ≤50 мг/дл, у 24 пациентов (22%) (группа 2) Лп(а) — >50 мг/дл. Всем пациентам определяли уровень высокочувствительного С-реактивного белка и интерлейкина-6 (ИЛ-6). Для выявления нарушений гемостаза определяли стандартные показатели гемостазиограммы с помощью локальных (рутинных) тестов: протромбиновый индекс, международное нормализованное отношение, активированное частичное тромбопластиновое время, фибриноген, Д-димер, антитромбин III. Одновременно со стандартной коагулограммой выполнялся глобальный тест тромбодинамики с использованием лабораторной диагностической системы "Регистратор тромбодинамики Т-2" (OOO "ГемаКор", Москва, Россия). Все статистические анализы проводились с использованием программы IBM SPSS Statistics 27.0.1.0 версии. Нормальность распределения данных проверялась с помощью теста Шапиро-Уилка. При нормальном распределении данные представлены в виде среднего арифметического (М) и среднеквадратичного отклонения (σ), если данные не соответствовали нормальному распределению, они описывались с помощью медианы (Me), нижнего и верхнего квартилей [Q1-Q3]. Для сравнения частот категориальных переменных использовали χ-квадрат, для парного сравнения независимых выборок — U-критерий Манна-Уитни. Значение p<0,05 считалось значимым.
Результаты
Социально-демографические характеристики пациентов обеих групп представлены в таблице 1.
Разницы между исследуемыми группами не выявлено ни по одному параметру, однако возраст развития инсульта был ниже у пациентов группы 2. Также в этой группе была несколько выше частота развития инсульта у лиц молодого возраста.
Уровень Лп(а) <30 мг/дл регистрировался у 72 пациентов (66,1%), 30-50 мг/дл — у 13 пациентов (11,9%), 50-75 мг/дл — у 8 пациентов (7,3%), 75-100 мг/дл — у 14 (12,8%) и уровень Лп(а) >100 мг/дл — у 2 пациентов (1,8%).
Показатели липидного спектра у пациентов с АГ и МФА в зависимости от уровня Лп(а) представлены в таблице 2.
В исследуемой популяции все показатели липидного спектра не отличались между группами. Целевой уровень ХС ЛНП <1,4 ммоль/л не был достигнут ни в одной группе.
Показатели коагуляционного гемостаза, определенные с помощью локальных и глобальных тестов, представлены в таблице 3.
Такой показатель локальных тестов, как международное нормализованное отношение, был значимо ниже (в пределах нормальных значений), а параметры глобальных тестов системы гемостаза значимо выше у пациентов в группе 2, что свидетельствует о наличии гиперкоагуляции, несмотря на постоянный прием антиагрегантов. Скорость роста сгустка и стационарная скорость роста сгустка отражают фазу распространения свертывания, а размер сгустка — интегральную характеристику плазменного звена свертывания. Уровень антитромбина III был ниже у пациентов группы 1, не выходя за пределы референсных значений.
На рисунке 1 представлена средняя концентрация провоспалительного цитокина ИЛ-6 у пациентов в двух исследуемых группах.
Уровень ИЛ-6 был значимо выше у пациентов с повышенным уровнем Лп(а) (19,9 пг/мл (7,1;31,4), vs 7,4 пг/мл (1,7;10,6), p<0,01). По уровню высокочувствительного С-реактивного белка разницы между группами не зафиксировано.
В настоящее время шкала NIHSS является одним из наиболее часто используемых методов стратификации риска для пациентов с острым ИИ во всем мире. Баллы по шкале NIHSS у пациентов обеих групп представлены на рисунке 2.
У пациентов с повышенным уровнем Лп(а) регистрировалась более высокая балльная оценка по шкале NIHSS в сравнении с пациентами группы 1, что отражает тяжесть неврологической симптоматики.
Таблица 1
Социально-демографические характеристики пациентов
Параметр | Группа 1 (n=85) | Группа 2 (n=24) | Р |
Возраст (лет) | 61,5±7,4 | 59,2±7,8 | 0,29 |
Возраст развития инсульта (лет) | 60,4±7,8 | 58,5±8 | 0,18 |
Инсульт в возрасте до 50 лет, n (%) | 13 (15,3) | 4 (16,7) | 0,87 |
Пол: м/ж, n (%) | 36 (42,4)/49 (57,6) | 13 (54,2)/11 (45,8) | 0,30 |
Примечание: данные представлены в виде M±σ.
Таблица 2
Показатели липидного спектра у пациентов обеих групп
Параметр | Группа 1 (n=85) | Группа 2 (n=24) | Р |
ОХС, ммоль/л | 4,4 (3,4;5,3) | 4,5 (3,9;5,3) | 0,91 |
ХС ЛНП, ммоль/л | 2,6 (1,4;3,5) | 2,6 (2,1;3,1) | 0,67 |
ХС ЛВП, ммоль/л | 1,4 (1,1;1,6) | 1,5 (1,2;1,7) | 0,26 |
ТГ, ммоль/л | 1,4 (1;1,7) | 1,5 (1,1;1,8) | 0,57 |
Лп(а), мг/дл | 13,1 (4,1;19,1) | 79 (56,5;94) | <0,01** |
Примечание: данные представлены в виде Me (25%;75%), ** — р<0,01.
Сокращения: Лп(а) — липопротеин(а), ОХС — общий холестерин, ТГ — триглицериды, ХС ЛВП — холестерин липопротеинов высокой плотности, ХС ЛНП — холестерин липопротеинов низкой плотности.
Таблица 3
Локальные и глобальные тесты гемостаза у пациентов группы 1 и 2
Показатель | Группа 1 (n=85) | Группа 2 (n=24) | Р |
Локальные (рутинные) тесты | |||
ПТИ, % | 97,8 (89,4;108,4) | 101,8 (95,7;110) | 0,22 |
МНО, усл. ед. | 1 (0,96;1) | 0,95 (0,9;1) | 0,001** |
АЧТВ, сек | 26,5 (23,5;28,6) | 25,6 (22,7;28,3) | 0,36 |
Фибриноген, г/л | 3,4 (2,9;3,9) | 3,2 (2,6;3,6) | 0,19 |
Д-димер, мкг/мл | 0,38 (0,28;0,48) | 0,37 (0,26;0,49) | 0,75 |
Антитромбин III, % | 96,6 (90,8;103,8) | 103,6 (89,3;113,8) | 0,03* |
Глобальные (интегральные) тесты | |||
V, мкм/мин | 28,7 (26,3;31) | 30,6 (28,2;33,3) | 0,03* |
Tlag, мин | 0,99 (0,9;1,1) | 0,99 (0,83;1,1) | 0,90 |
Vi, мкм/мин | 55,8 (53,7;58,4) | 57,6 (54,9;60,1) | 0,72 |
VSt, мкм/мин | 28,7 (26,3;31) | 30,6 (28,2;33,3) | 0,03* |
CS, мкм | 1142,3 (1056;1218) | 1215,2 (1142;1289) | 0,01* |
D, усл. ед. | 23335,5 (21220;25186) | 23014,3 (21777;25021) | 0,57 |
Примечание: данные представлены в виде Me (25%;75%), * — р≤0,05; ** — р<0,01.
Сокращения: АЧТВ — активированное частичное тромбопластиновое время, МНО — международное нормализованное отношение, ПТИ — протромбиновый индекс, CS — размер фибринового сгустка, D — плотность сгустка, Tlag — время задержки роста сгустка, V — скорость роста сгустка, Vi — начальная скорость роста сгустка, VSt — стационарная скорость роста сгустка.
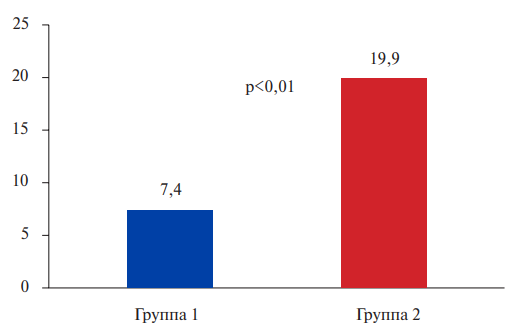
Рис. 1. Уровень ИЛ-6 в исследуемых группах (пг/мл).
Сокращение: ИЛ-6 — интерлейкин-6.

Рис. 2. Баллы по шкале NIHSS группы 1 и 2.
Обсуждение
Среди пациентов, включенных в исследование и перенесших ИИ, повышенный уровень Лп(а), который является генетически обусловленным независимым фактором риска ИИ, регистрировался в 22% случаях. Дислипидемия является ключевым фактором ССР у пациентов, перенесших инсульт. В представленном исследовании показатели липидного спектра значимо не отличались между группами. Другие авторы сообщали о более высоких уровнях общего холестерина и ХС ЛНП в группах с повышенным уровнем Лп(а) [18]. Лечение пациентов с перенесенным инсультом включает гиполипидемическую терапию. Приверженность к терапии статинами после перенесенного события, как правило, выше, чем у больных с неосложненным течением АГ. Однако, независимо от уровня Лп(а), пациенты не достигали целевых уровней ХС ЛНП, что согласуется с результатами, описанными в похожих работах [19]. Высокодозовую терапию статинами получала только треть пациентов, комбинированную терапию статин + эзетимиб — 14,5%. В настоящем исследовании выявлены нарушения системы гемостаза с тенденцией к гиперкоагуляции в группе 2, что подтверждается работами других авторов. Так, по данным Ugovšek S, et al. (2024), у пациентов с уровнем Лп(а) >50 мг/дл были выявлены значимые изменения, характеризующие гиперкоагуляцию, при использовании как локальных, так и глобальных тестов системы гемостаза [20]. Лп(a) связывается с ингибитором пути тканевого фактора и инактивирует его, а также стимулирует экспрессию тканевого фактора моноцитами. Из-за своего структурного сходства с плазминогеном, Лп(а) ингибирует превращение плазминогена в плазмин, а также увеличивает выработку ингибитора активатора плазминогена-1 [21]. Ингибирование фибринолиза, вызванное Лп(а), может повышать риск тромбоза, который в местах разрыва бляшки сопровождается повышенным риском ИИ [22]. Лп(a) приводит к изменению структуры фибриновой сети, делая ее менее проницаемой и более устойчивой к лизису [23]. При наличии повышенного уровня Лп(а) может усиливаться выработка цитокинов и прогрессировать воспалительная реакция [24], что соответствует полученным нами результатам в отношении ИЛ-6, который был значимо выше в группе 2. У пациентов с перенесенным инсультом высокие показатели ИЛ-6 сопровождаются плохим функциональным исходом [25]. ИИ приводит к гибели нейронов, что может сопровождаться выраженным неврологическим дефицитом. У пациентов с уровнем Лп(а) <50 мг/дл средний балл по шкале NIHSS при госпитализации составил 3,3 балла, что расценивается как легкая степень тяжести инсульта, в то время как средний балл по шкале NIHSS у пациентов с повышенным уровнем Лп(а) был значимо выше и составил 5,7 баллов. Эти данные согласуются с исследованием, в котором у пациентов с повышенным уровнем Лп(a) наблюдался более высокий балл по шкале NIHSS (5-25 баллов) [26]. Таким образом, частота встречаемости повышенного уровня Лп(а) у пациентов с перенесенным ИИ соответствовала среднепопуляционной (приблизительно, у 1 из 5 человек), при этом течение инсульта было более тяжелым у пациентов с уровнем Лп(а) >50 мг/дл, что могло быть обусловлено Лп(а)-опосредованным влиянием.
Заключение
Пациенты, перенесшие ИИ, относятся к категории очень высокого ССР. Этот риск определяется как традиционными, так и специфическими факторами, в частности, повышенным уровнем Лп(а). Повышенный уровень Лп(а) у пациентов с АГ и МФА, перенесших ИИ, является фактором риска, который может оказывать независимое влияние на тяжесть неврологических проявлений ИИ и связан с развитием гиперкоагуляции и воспаления. Учитывая разнообразные патогенетические эффекты, связанные с повышенным уровнем Лп(а), необходимо проводить исследование Лп(а) у всех пациентов после перенесенного ИИ и стремиться выявлять таких пациентов как можно раньше, чтобы обеспечить более интенсивную коррекцию других факторов ССР за счет изменения образа жизни и/или с помощью гиполипидемической терапии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Стаховская Л. В., Клочихина О. А., Богатырева М. Д. и др. Анализ эпидемиологических показателей повторных инсультов в регионах Российской Федерации (по итогам территориально-популяционного регистра 2009-2014 гг.). Consilium Medicum. 2016;18(9):8-11.
2. Mohan KM, Wolfe CD, Rudd AG, et al. Risk and cumulative risk of stroke recurrence: a systematic review and meta-analysis. Stroke. 2011;42(5):1489-94. doi:10.1161/STROKEAHA.110.602615.
3. de Lau LM, Leebeek FW, de Maat MP, et al. Screening for coagulation disorders in patients with ischemic stroke. Expert Rev Neurother. 2010;10(8):1321-9. doi:10.1586/ern.10.104.
4. Tanaka KA, Key NS, Levy JH. Blood coagulation: hemostasis and thrombin regulation. Anesthesia and analgesia. 2009;108(5):1433-46. doi:10.1213/ane.0b013e31819bcc9c.
5. De Luca C, Colangelo AM, Alberghina L, Papa M. Neuro-Immune Hemostasis: Homeostasis and Diseases in the Central Nervous System. Front Cell Neurosci. 2018;12:459. doi:10.3389/fncel.2018.00459.
6. Pleşeru AM, Mihailă RG. The role of thrombin in central nervous system activity and stroke. Clujul Med. 2018;91(4):368-71. doi:10.15386/cjmed-973.
7. Kosmas CE, Bousvarou MD, Papakonstantinou EJ, et al. Lipoprotein (a) and cerebrovascular disease. J Int Med Res. 2024;52(7):3000605241264182. doi:10.1177/03000605241264182.
8. Ciffone N, McNeal CJ, McGowan MP, et al. Lipoprotein(a): An important piece of the ASCVD risk factor puzzle across diverse populations. Am Heart J Plus. 2023;38:100350. doi:10.1016/j.ahjo.2023.100350.
9. Arnold M, Schweizer J, Nakas CT, et al. Lipoprotein(a) is associated with large artery atherosclerosis stroke aetiology and stroke recurrence among patients below the age of 60 years: results from the BIOSIGNAL study. Eur Heart J. 2021;42(22):2186-96. doi:10.1093/eurheartj/ehab081.
10. Aronis KN, Zhao D, Hoogeveen RC, et al. Associations of Lipoprotein(a) Levels With Incident Atrial Fibrillation and Ischemic Stroke: The ARIC (Atherosclerosis Risk in Communities) Study. J Am Heart Assoc. 2017;6(12):e007372. doi:10.1161/JAHA.117.007372.
11. Colantonio LD, Bittner V, Safford MM, et al. Lipoprotein(a) and the Risk for Coronary Heart Disease and Ischemic Stroke Events Among Black and White Adults With Cardiovascular Disease. J Am Heart Assoc. 2022;11(11):e025397. doi:10.1161/JAHA.121.025397.
12. van der Valk FM, Bekkering S, Kroon J, et al. Oxidized phospholipids on lipoprotein(a) elicit arterial wall inflammation and an inflammatory monocyte response in humans. Circulation. 2016;134:611-24. doi:10.1161/CIRCULATIONAHA.116.020838.
13. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
14. König IR, Ziegler A, Bluhmki E, et al. Virtual International Stroke Trials Archive (VISTA) Investigators. Predicting long-term outcome after acute ischemic stroke: a simple index works in patients from controlled clinical trials. Stroke. 2008;39(6):1821-6. doi:10.1161/STROKEAHA.107.505867.
15. Brott T, Adams HP, Olinger CP, et al. Measurements of acute cerebral infarction — a clinical examination scale. Stroke. 1989;20:864-70.
16. Ежов М. В., Кухарчук В. В., Сергиенко И. В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471.
17. Воевода М. И., Ежов М. В., Коновалов Г. А. и др. Новые возможности для реальной клинической практики при определении концентрации липопротеина(а) в крови. Резолюция экспертного совета. РМЖ. 2024;9:40-4. doi:10.32364/2225-2282-2024-9-7.
18. Шальнова С. А., Ежов М. В., Метельская В. А. и др. Ассоциации липопротеида(а) с факторами риска атеросклероза в российской популяции (данные наблюдательного исследования ЭССЕ-РФ). Рациональная Фармакотерапия в Кардиологии. 2019;15(5):612-21. doi:10.20996/1819-6446-2019-15-5-612-621.
19. Ratajczak J, Kubica A, Pietrzykowski Ł, et al. Lipoprotein (a) and the Occurrence of Lipid Disorders and Other Cardiovascular Risk Factors in Patients without Diagnosed Cardiovascular Disease. J Clin Med. 2024;13(16):4649. doi:10.3390/jcm13164649.
20. Ugovšek S, Rehberger Likozar A, Levstek T, et al. Haplotype of the Lipoprotein(a) Gene Variants rs10455872 and rs3798220 Is Associated with Parameters of Coagulation, Fibrinolysis, and Inflammation in Patients after Myocardial Infarction and Highly Elevated Lipoprotein(a) Values. Int J Mol Sci. 2024;25(2):736. doi:10.3390/ijms25020736.
21. Емельянчик В. С., Мариловцева О. В., Хомченков Р. В. и др. Липопротеин (а) в диагностике сердечно-сосудистого риска. Значения липопротеина (а) и аполипопротеина В во взрослой популяции г. Красноярска. Российский кардиологический журнал. 2023;28(7):5499.doi:10.15829/1560-4071-2023-5499.
22. Ward NC, Kostner KM, Sullivan DR, et al. Molecular, Population, and Clinical Aspects of Lipoprotein(a): A Bridge Too Far? J Clin Med. 2019;8(12):2073. doi:10.3390/jcm8122073.
23. Boffa MB. Beyond fibrinolysis: The confounding role of Lp(a) in thrombosis. Atherosclerosis. 2022;349:72-81. doi:10.1016/j.atherosclerosis.2022.04.009.
24. Полякова Е. А., Халимов Ю. Ш., Баженова Е. А. и др. Липопротеин(а), атеросклероз и сердечно-сосудистый риск. Рациональная Фармакотерапия в Кардиологии. 2024;20(5):559-65. doi:10.20996/1819-6446-2024-3080.
25. McCabe JJ, Walsh C, Gorey S, et al. C-Reactive Protein, Interleukin-6, and Vascular Recurrence After Stroke: An Individual Participant Data Meta-Analysis. Stroke. 2023;54(5):1289-99. doi:10.1161/STROKEAHA.122.040529.
26. Lange KS, Nave AH, Liman TG, et al. Lipoprotein(a) Levels and Recurrent Vascular Events After First Ischemic Stroke. Stroke. 2017;48:36-42. doi:10.1161/STROKEAHA.116.014436.
Об авторах
С. С. ВеденскаяРоссия
к. м. н., доцент кафедры факультетской терапии, эндокринологии, аллергологии и иммунологии.
Екатеринбург
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
О. Г. Смоленская
Россия
д.м.н., профессор, зав. кафедрой факультетской терапии, эндокринологии, аллергологии и иммунологии.
Екатеринбург
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
- У пациентов, перенесших ишемический инсульт и имеющих повышенный уровень липопротеина(а) (Лп(а)), наряду с традиционными факторами сердечно-сосудистого риска, важное значение имеют такие факторы, как нарушения гемостаза и повышение уровня маркеров воспаления.
- Выявление этих факторов и последующая коррекция терапии поможет снизить риск жизнеугрожающих осложнений у этих пациентов.
Рецензия
Для цитирования:
Веденская С.С., Смоленская О.Г. Липопротеин(а) как фактор тяжести сосудистых катастроф у пациентов, перенесших ишемический инсульт, с артериальной гипертензией 3 стадии и мультифокальным атеросклерозом. Российский кардиологический журнал. 2025;30(2):6279. https://doi.org/10.15829/1560-4071-2025-6279. EDN: BZPBVQ
For citation:
Vedenskaya S.S., Smolenskaya O.G. Lipoprotein(a) as a factor in the severity of vascular events in patients with ischemic stroke, stage 3 hypertension and multifocal atherosclerosis. Russian Journal of Cardiology. 2025;30(2):6279. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6279. EDN: BZPBVQ

















































