Перейти к:
Эффективность ацетилсалициловой кислоты с содержанием буфера и ацетилсалициловой кислоты в кишечнорастворимой оболочке по воздействию на агрегацию тромбоцитов у пациентов со стабильной ишемической болезнью сердца и сахарным диабетом 2 типа (КАСКАД): обоснование и дизайн одноцентрового наблюдательного сравнительного исследования
https://doi.org/10.15829/1560-4071-2025-6250
EDN: WESPME
Аннотация
Цель. Ацетилсалициловая кислота (АСК) в кишечнорастворимой оболочке высвобождается медленнее и всасывается в меньшем количестве и в течение длительного периода времени, что может привести к снижению биодоступности АСК и уменьшению антитромбоцитарного эффекта по сравнению с обычной АСК. Пациенты с сахарным диабетом (СД) характеризуются повышенной реактивностью тромбоцитов и сниженным фармакодинамическим ответом на АСК по сравнению с лицами без диабета. Представляется рациональным проверить гипотезу о том, что применение АСК, всасывающейся в желудке, может быть более эффективным у пациентов с СД 2 типа (СД2) и стабильной ишемической болезнью сердца (ИБС).
Материал и методы. В одноцентровое неинтервенционное сравнительное исследование будут отобраны случайным образом 200 взрослых пациентов обоего пола со стабильной ИБС и СД2, которым в рутинной практике до включения в исследование был назначен препарат желудочнорастворимой формы АСК (Кардиомагнил 75 мг/сут.) или кишечнорастворимой формы АСК (Аспирин® Кардио 100 мг/сут. или Тромбо АСС® 100 мг/сут.). В соответствии с назначенной рутинным образом терапией пациенты будут разделены на 2 группы: группа пациентов, принимающих Кардиомагнил 75 мг/сут., и группа пациентов, принимающих Аспирин® Кардио 100 мг/сут. или Тромбо АСС® 100 мг/сут. Первичная конечная точка — частота развития высокой остаточной реактивности тромбоцитов (ВОРТ) на фоне приема АСК (резистентности к АСК) по данным теста VerifyNow Aspirin Test.
Заключение. КАСКАД — это первое исследование, в котором оценивается частота развития ВОРТ (резистентности к АСК) по данным теста VerifyNow Aspirin Test у пациентов со стабильной ИБС и СД2.
Ключевые слова
Для цитирования:
Кобалава Ж.Д., Писарюк А.С., Филькова А.А., Тухсанбоев Ё.С., Амирова А.Н., Корнейчук А.Д., Павликов Г.С., Бурханова Л.Р., Мерай И.А., Пантелеев М.А., Свешникова А.Н. Эффективность ацетилсалициловой кислоты с содержанием буфера и ацетилсалициловой кислоты в кишечнорастворимой оболочке по воздействию на агрегацию тромбоцитов у пациентов со стабильной ишемической болезнью сердца и сахарным диабетом 2 типа (КАСКАД): обоснование и дизайн одноцентрового наблюдательного сравнительного исследования. Российский кардиологический журнал. 2025;30(1):6250. https://doi.org/10.15829/1560-4071-2025-6250. EDN: WESPME
For citation:
Kobalava Zh.D., Pisaryuk A.S., Filkova A.A., Tukhsanboev E.S., Amirova A.N., Korneichuk A.D., Pavlikov G.S., Burkhanova L.R., Meray I.A., Panteleev M.A., Sveshnikova A.N. Efficacy of buffered and enteric-coated acetylsalicylic acid on platelet aggregation in patients with stable coronary artery disease and type 2 diabetes (CASCADE): rationale and design of a single-center observational comparative study. Russian Journal of Cardiology. 2025;30(1):6250. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6250. EDN: WESPME
Низкие дозы ацетилсалициловой кислоты (АСК) эффективны для профилактики тромботических событий [1]. АСК ингибирует агрегацию тромбоцитов путем необратимого ацетилирования и инактивации фермента циклооксигеназы (ЦОГ). Это не позволяет тромбоцитам и эндотелию преобразовывать арахидоновую кислоту в простагландины и активирующий тромбоциты тромбоксан (ТХ) [2]. Известно, что АСК вызывает побочные эффекты со стороны желудочно-кишечного тракта, в первую очередь диспепсию или язвенный дефект слизистой желудка и двенадцатиперстной кишки [3]. Поэтому было разработано несколько разных форм АСК, которые должны были снизить риск желудочно-кишечных осложнений. Это форма в оболочке (кишечнорастворимая), с антацидом (буферная) и липидная форма с модифицированным высвобождением (PL2200). В некоторых ранних исследованиях было показано, что АСК с кишечнорастворимой оболочкой вызывает меньше незначительных бессимптомных поражений слизистой желудка по сравнению с простой формой АСК по данным эндоскопии после кратковременного курса лечения [4-10], однако кишечнорастворимое покрытие АСК не уменьшает побочные эффекты со стороны желудочно-кишечного тракта, такие как диспепсия [4][7][8] или желудочно-кишечные кровотечения [11]. Это подтверждает, что воздействие, достаточно серьезное, чтобы вызвать кровотечение, возникает из-за системного, а не местного влияния АСК [12]. При этом именно местным действием АСК авторы объясняли более частое незначительное бессимптомное поражение слизистой желудка, выявленное при эндоскопии при приеме простых форм АСК, и бессимптомное поражение слизистой тонкой кишки при приеме кишечнорастворимых форм АСК, также выявленное по данным эндоскопии [13][14]. В 2021г в систематическом обзоре Kedir HM, et al. [15] собрали данные 6 клинических исследований общей численностью >15 тыс. пациентов, по результатам анализа которых сделали вывод о том, что применение АСК в кишечнорастворимой оболочке не является эффективным механизмом защиты желудочно-кишечного тракта и даже ее кратковременный прием связан с повреждением слизистой тонкой кишки. Кроме того, есть многочисленные данные, оформленные в виде экспертного мнения [16][17], нашедшего отражение в российских клинических рекомендациях [18], что кишечнорастворимое покрытие может иметь негативные последствия для биодоступности и антитромбоцитарного действия АСК, особенно в определенных группах пациентов. Другой разработанный подход к снижению гастротоксичности — это использование буферных форм АСК, имеющих в своем составе небольшую дозу антацида. Использование буферных форм АСК по данным одних исследований снижало частоту развития незначительных бессимптомных поражений слизистой желудка, выявленной при эндоскопическом исследовании, по сравнению с простой АСК [19], но не отличалось по частоте развития язв и кровотечений [12]. Однако по сравнению с кишечнорастворимой формой было показано явное преимущество буферной формы АСК по безопасности: меньшая частота диспепсии и симптомного поражения слизистой желудка и двенадцатиперстной кишки [20-23], бессимптомного поражения тонкого кишечника [24] и скрытых кровотечений [25].
Пациенты с сахарным диабетом 2 типа (СД2) характеризуются повышенной реактивностью тромбоцитов и сниженной фармакодинамической реакцией на АСК по сравнению с лицами, не страдающими диабетом [26][27]. Это объясняется множественными механизмами, которые участвуют в различных профилях фармакодинамического ответа на антитромбоцитарную терапию у пациентов с СД2. Предполагается, что среди них важную роль играют сокращение продолжительности жизни и повышенная скорость смены тромбоцитов у пациентов с СД2, что приводит к усиленной регенерации тромбоцитов. Предпринимались различные подходы к решению проблемы резистентности к АСК в группе пациентов с ишемической болезнью сердца (ИБС) и СД2, проводились небольшие исследования со сменой режима дозирования с обнадеживающими результатами, однако крупных рандомизированных исследований, которые могли бы изменить существующую практику, не было. Существует заключение экспертов о том, что пациентам, у которых снижена биодоступность препарата (а именно люди с индексом массы тела >35 кг/м² или весом >120 кг), предпочтительнее назначение АСК без оболочки [16-18]. Из этого утверждения кажется рациональным проверить гипотезу о предпочтительном назначении АСК без оболочки пациентам в группе СД2 и стабильной ИБС, у которых также может быть снижена биодоступность к АСК.
Чаще всего для подтверждения резистентности к АСК используют определение активности ЦОГ (метаболиты ТХА2 — ТХВ2 в сыворотке крови или 11-дегидротромбоксана В2 в моче). В исследовании Gurbel PA, et al. [28] показали нелинейную связь между ингибированием тромбоксана B2 (TХB2) в сыворотке и показателями агрегометрии тромбоцитов. Агрегация тромбоцитов не наблюдалась, когда ингибирование TХB2 достигало >49%. Более того, авторы сделали вывод: определение ингибирования TХB2 в сыворотке >95% для указания уровня ингибирования ЦОГ-1 тромбоцитов, необходимого для оценки клинической эффективности, могут быть переоценены, и это должно быть пересмотрено в будущих трансляционных исследованиях, которые пытаются связать клиническую эффективность АСК с порогом лабораторных измерений. Таким образом, для оценки клинической эффективности препарата, по мнению авторов исследования [28], наиболее целесообразно использовать метод агрегометрии. Основываясь на изложенных данных, предлагается использовать метод агрегометрии в основе исследования КАСКАД для оценки состояния свертывания крови.
Исходя из всех описанных данных, было организовано одноцентровое наблюдательное сравнительное клиническое исследование КАСКАД, чтобы оценить эффективность и безопасность применения буферной формы АСК у пациентов со стабильной ИБС и СД2 по сравнению с кишечнорастворимой формой АСК на основании воздействия на агрегацию тромбоцитов.
Материал и методы
Дизайн исследования (рис. 1). Исследование КАСКАД — это проспективное одноцентровое наблюдательное сравнительное исследование в параллельных группах. Исследование будет выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice), принципами Хельсинской декларации и одобрено локальным этическим комитетом Университетской клинической больницы им. В. В. Виноградова (филиал) Российского университета дружбы народов им. Патриса Лумумбы (протокол № 2 от 29.02.2024) и зарегистрировано на сайте clinicaltrial.gov (NCT06716255). Участникам исследования будут выдаваться формы информированного согласия с подробным описанием процедур и рисков исследования, а перед началом процедур планируется получать письменное подтверждение информированного согласия.
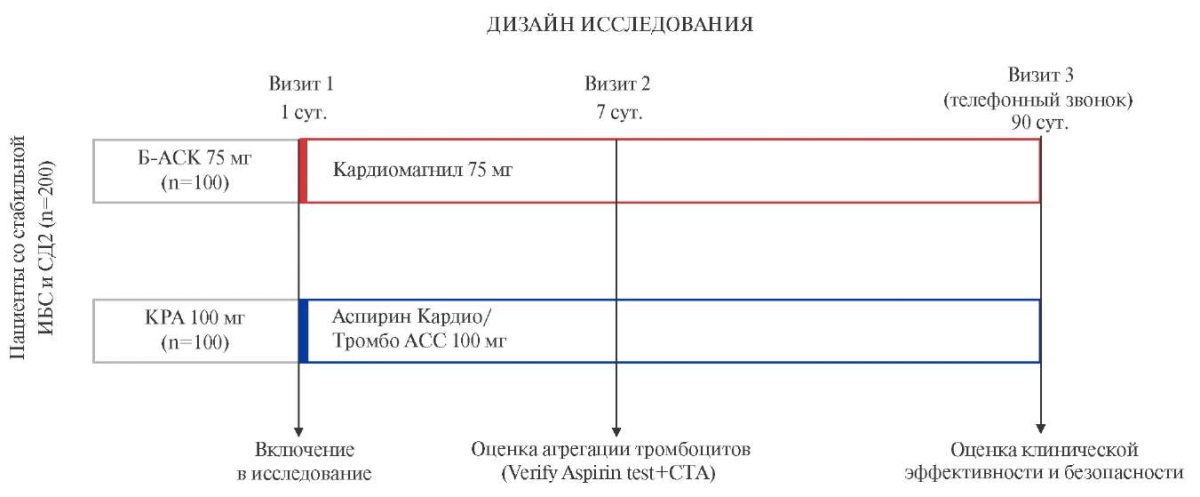
Рис. 1. Обзор дизайна исследования КАСКАД.
Сокращения: АСК — ацетилсалициловая кислота, Б-АСК — буферная форма ацетилсалициловой кислоты, ИБС — ишемическая болезнь сердца, КРА — кишечнорастворимая форма ацетилсалициловой кислоты, СД2 — сахарный диабет 2 типа, СТА — световая трансмиссионная агрегометрия.
Критерии включения/невключения/исключения. Представлены в таблице 1. Согласие на участие в исследовании планируется брать у пациентов, наблюдающихся в консультативно-диагностическом отделении по поводу СД2, имеющих в анамнезе диагностированную ИБС, которая на момент включения в исследование подходит под определение "стабильной" и не требует назначения двойной антитромбоцитарной терапии, получающих только монотерапию АСК (в качестве желудочнорастворимой АСК выбрана буферная форма — Кардиомагнил 75 мг/сут.; кишечнорастворимая форма АСК представлена 2 наиболее часто встречающимися в практике препаратами: Аспирин® Кардио 100 мг/сут., Тромбо АСС® 100 мг/сут.) и выбранных из общей базы случайным образом. После подписания информированного согласия пациенты в течение 7 дней будут продолжать принимать препараты АСК (Кардиомагнил 75 мг/сут., Аспирин® Кардио 100 мг/сут., Тромбо АСС® 100 мг/сут.) с оценкой комплаенса и при 100% комплаенсе будут включены в исследование. Таким образом, при соблюдении всех критериев включения/невключения/исключения и уверенности в 100% комплаенсе могут быть включены в исследование и может быть проведена лабораторная оценка эффективности АСК.
Таблица 1
Критерии включения, невключения и исключения в исследовании КАСКАД
|
Критерии включения |
Критерии невключения |
Критерии исключения |
|
1. Пациенты (мужчины и женщины) в возрасте от 18 лет и старше со стабильной ИБС и СД2 |
1. Пациенты с состояниями, при которых требуется антикоагулянтная терапия (например, фибрилляция предсердий, механические клапаны сердца и т. д.), или двойная антитромбоцитарная терапия (недавнее чрескожное коронарное вмешательство, коронарное шунтирование, инфаркт миокарда, инфаркт головного мозга и т. д.) |
1. Отзыв информированного согласия пациентом |
|
2. Пациент постоянно принимает Кардиомагнил (75 мг/сут.) или Аспирин® Кардио (100 мг/сут.) или Тромбо АСС® (100 мг/сут.) |
2. Пациенты с тяжелой почечной недостаточностью (креатинин сыворотки >2,5 мг/дл (221 мкмоль/л)) или расчетным клиренсом креатинина <30 мл/мин |
2. Ошибочное включение пациента в исследование с нарушением критериев включения/невключения |
|
3. Подписанное информированное согласие |
3. Пациенты с внутричерепными кровоизлияниями в анамнезе |
3. По мнению исследователя, продолжение участия субъекта в исследовании не отвечает интересам его здоровья и благополучия (например, развитие СНЯ) |
|
4. Пациенты с любыми противопоказаниями к АСК, в т. ч. известная аллергия или гиперчувствительность к АСК, вспомогательным веществам препаратов или другим нестероидным противовоспалительным препаратам |
4. Потеря контакта с пациентом и выход из-под наблюдения |
|
|
5. Пациенты с бронхиальной астмой, индуцированной приемом салицилатов и нестероидными противовоспалительными препаратами |
5. Досрочное прекращение терапии пациентом |
|
|
6. Пациенты с эрозивно-язвенным поражением желудочно-кишечного тракта (в фазе обострения) |
||
|
7. Пациенты с запланированным коронарным шунтированием, чрескожным коронарным вмешательством или любой другой реваскуляризацией, при которой необходимо назначать двойную антитромбоцитарную терапию |
||
|
8. Беременные, кормящие женщины |
||
|
9. Пациенты с продолжающимся кровотечением |
||
|
10. Пациенты с известными коагулопатиями, тромбоцитопатиями, тромбоцитопенией |
||
|
11. Пациенты с активными психиатрическими, инфекционными и онкологическими заболеваниями |
||
|
12. Пациенты с хронической сердечной недостаточностью III-IV функционального класса Нью-Йоркской ассоциации сердца |
||
|
13. Пациенты, имеющие врожденный дефицит лактазы, непереносимость лактозы, глюкозо-галактозную мальабсорбцию |
||
|
14. Пациенты принимающие метотрексат (>15 мг в нед.) |
Сокращения: ИБС — ишемическая болезнь сердца, СД2 — сахарный диабет 2 типа, СНЯ — серьезное нежелательное явление.
Определение высокой остаточной реактивности тромбоцитов на фоне приема АСК (резистентности к АСК). Пациенты, подписавшие информированное согласие, подходящие под критерии включения и не имеющие критериев невключения/исключения, со 100% комплаенсом в течение 7 дней будут включены в исследование и им будет проведена лабораторная оценка эффективности АСК (табл. 2).
Таблица 2
График визитов и процедур
|
№ п/п |
День |
День 1 |
День 7 |
День 90±3 дня |
|
Номер/название визита |
1 |
2 |
3 (телефонный звонок) |
|
|
1 |
Опрос пациента |
Х |
||
|
2 |
Демография |
Х |
||
|
3 |
Антропометрия |
Х |
||
|
4 |
Получение письменного Информированного согласия пациента на участие в исследовании |
Х |
||
|
5 |
Физикальное обследование |
Х |
Х |
|
|
6 |
Измерение жизненно важных показателей |
Х |
Х |
|
|
7 |
Лабораторные исследования |
Х |
Х |
|
|
8 |
Агрегация тромбоцитов (VerifyNow Aspirin test) |
Х |
||
|
9 |
Агрегация тромбоцитов методом световой трансмиссионной агрегометрии с различными индукторами |
Х |
||
|
10 |
ЭКГ в покое |
Х |
||
|
11 |
Оценка критериев включения/невключения |
Х |
||
|
12 |
Опрос пациента о самочувствии (сбор информации по безопасности — НЯ) |
Х |
Х |
Х |
|
13 |
Оценка критериев исключения |
Х |
Х |
|
|
14 |
Заполнение формы геморрагических событий |
Х |
||
|
15 |
Оценка комплаенса |
Х |
Х |
Сокращения: НЯ — нежелательное явление, ЭКГ — электрокардиография.
Определение высокой остаточной реактивности тромбоцитов (ВОРТ) на фоне АСК (резистентности к АСК) будет проводиться двумя тестами: клиническим тестом VerifyNow Aspirin Test (Werfen, США) и световой трансмиссионной агрегометрией (СТА) на приборе Solar AP 2110. VerifyNow Aspirin Test используется для изменения ответа тромбоцитов на АСК (реакцией активации арахидоновой кислотой). Взятие крови планируется проводить напрямую в вакуумную пробирку 2 мл пробирки Greiner Bio-One с концентрацией цитрата натрия 3,2%. Интерпретация значений теста представлена в таблице 3.
Таблица 3
Референсные значения теста VerifyNow Aspirin Test
|
Методика исследования |
Высокая (остаточная) реактивность тромбоцитов = резистентность к АСК |
Низкая реактивность тромбоцитов |
|
VerifyNow Aspirin Test |
≥550 ARU |
— |
Для экспериментов по исследованию агрегации тромбоцитов методом СТА на приборе Solar AP 2110 из цельной крови, взятой в 10 мл пробирки S-Monovette® с цитратом натрия 3,2%, будет выделяться богатая тромбоцитами плазма (БТП) при помощи центрифугирования 200 g 5 минут. Регистрация образования агрегатов из тромбоцитов будет проводиться при равномерном перемешивании 310 мкл БТП магнитным якорем со скоростью 800 оборотов в минуту. Тромбоциты будут активироваться арахидоновой кислотой в концентрации 1 ммоль/л, при ≥20% агрегации в ответ на стимуляцию арахидоновой кислотой будет считаться полной резистентностью к АСК (рис. 2 А), при агрегации от 10 до 20% в ответ на стимуляцию арахидоновой кислотой будет считаться неполной резистентностью к АСК (рис. 2 Б). По данным нескольких исследований была установлена диагностическая граница для определения резистентности к АСК по данным СТА — это ≥20% агрегации тромбоцитов в ответ на стимуляцию арахидоновой кислотой [29-35], а также связь между агрегацией ≥20% и увеличением риска сердечно-сосудистых и тромботических (ишемических) событий [36][37].
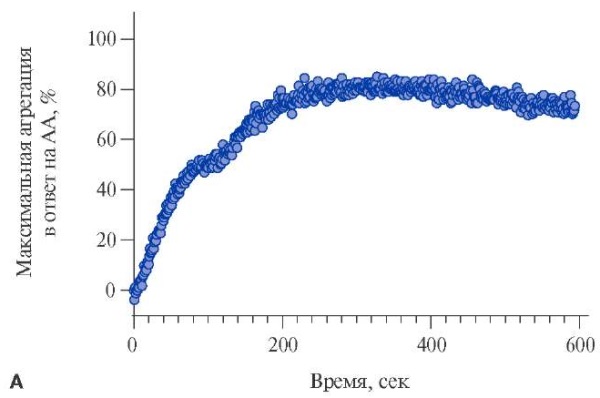
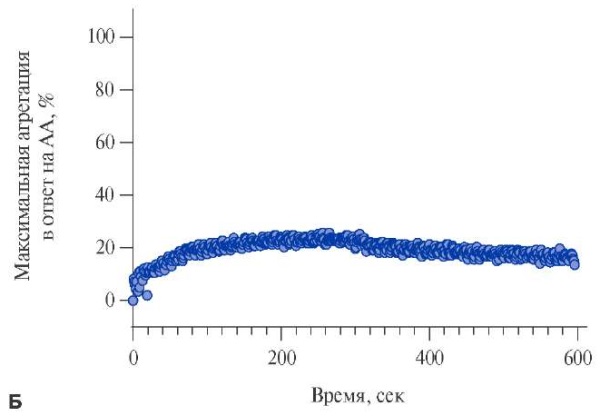
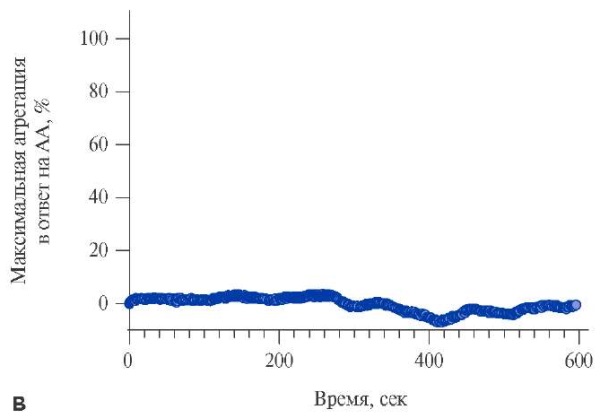
Рис. 2. Типичная агрегационная кривая в ответ на индуцирование агрегации тромбоцитов арахидоновой кислотой 1 ммоль/л.
Примечание: А — полная резистентность к АСК, Б — неполная резистентность к АСК, В — отсутствие резистентности к АСК.
Сокращения: АА — арахидоновая кислота, АСК — ацетилсалициловая кислота.
Кроме того, тромбоциты будут активироваться различными концентрациями аденозиндифосфата (АДФ) (1-20 мкмоль/л), либо добавлением смеси серотонина (20 мкмоль/л) и адреналина (200 нмоль/л), либо пептидом, активирующим рецептор тромбина PAR-1 (TRAP-6 — 10 мкмоль/л) в присутствии ингибитора рецептора к АДФ P2Y12 — ARC-69931MX, либо коллагеном в концентрации 1 мкг/мл (полный протокол агрегометрии в Приложении, таблица 1). В качестве референсного образца с полным светопропусканием будет использоваться плазма, обедненная тромбоцитами (центрифугирование цельной крови пациента проводится на скорости 2000 g в течение 15 мин). Хлорид кальция до финальной концентрации 2 мМ будет добавляться в суспензию тромбоцитов перед измерениями, в которых указано наличие ионов кальция. В измерениях, в которых не указано наличие ионов кальция, к БТП будет добавляться соответствующий объем дистиллированной воды для обеспечения контроля. Рекальцификация будет проводиться для более физиологичного исследования агрегации тромбоцитов, а также наблюдения обратимой агрегации тромбоцитов [38]. Наблюдение явления обратимой агрегации тромбоцитов (произвольного развала агрегатов после их формирования в присутствии ионов кальция в среде) позволит оценить такой параметр, как "индекс необратимости", показывающий, какая доля тромбоцитов осталась в агрегате через 600 сек после его формирования в ответ на добавление активатора. Для исключения наблюдения работы плазменного звена перед рекальцификацией суспензии тромбоцитов в неё будет добавляться гирудин в концентрации 10 ед./мкл. Сигнал будет регистрироваться каждую секунду.
День 90 — контакт с пациентом. С пациентами, включенными в исследование, будут связываться по телефону через 90 дней после проведения теста определения лабораторной эффективности АСК для оценки жизненного статуса, частоты госпитализаций, изменения в терапии. Будет регистрироваться возникновение любых нежелательных явлений (НЯ), включая госпитализацию по любому поводу, кровотечение по BARC (Bleeding Academic Research Consortium) 1-5 типов, любое тромботическое (ишемическое) событие или смерть, в период между датой проведения теста оценки лабораторной эффективности АСК и 90-м днем.
Первичная конечная точка. Первичной конечной точкой в исследовании КАСКАД будет частота развития ВОРТ (резистентности к АСК) при приеме АСК в буферной форме (Кардиомагнил) по сравнению с приемом АСК в кишечнорастворимой оболочке (Аспирин® Кардио/Тромбо АСС®) по данным клинического теста VerifyNow Aspirin Test.
Вторичные конечные точки. Вторичными целями исследования является оценка частоты развития резистентности к АСК по данным СТА и влияние наличия лабораторной резистентности к АСК на 90-дневную летальность от всех причин, 90-дневную госпитализацию по любому поводу и 90-дневное развитие тромботического (ишемического) события. Вторичными конечными точками, отвечающие этим целям, являются: определение резистентности к АСК по данным СТА в ответ на активацию арахидоновой кислотой, а также измерение степени агрегации тромбоцитов в ответ на другие различные индукторы в присутствии физиологической концентрации ионов кальция; количество и доля (%) пациентов, у которых за период наблюдения возникло любое тромботическое (ишемическое) событие любой локализации, госпитализация по любой причине, летальный исход.
Безопасность и переносимость. На каждом визите к врачу пациентам будет задаваться вопрос о возникновении любых НЯ и серьезных НЯ (СНЯ) и будут регистрироваться с момента подписания информированного согласия на участие в исследовании до даты визита 3 (90 дней после включения в исследование). Все СНЯ будут поданы и рассмотрены локальным этическим комитетом Университетской клинической больницы им. В. В. Виноградова (филиал) Российского университета дружбы народов им. Патриса Лумумбы, а при необходимости и вышестоящими инстанциями. Конечными точками безопасности и переносимости будут считаться: количество и частота (%) и тип любых НЯ у пациентов, принимающих Кардиомагнил 75 мг/сут. или Аспирин® Кардио/Тромбо АСС® 100 мг/сут.; количество и частота (%) и тип нежелательной реакции (т. е. НЯ, расцененных как связанные с препаратом) у пациентов, принимающих Кардиомагнил 75 мг/сут. или Аспирин® Кардио/Тромбо АСС® 100 мг/сут.; количество и доля (%) пациентов, прекративших прием (самостоятельно или по рекомендации врача) препарата Кардиомагнил или Аспирин® Кардио/Тромбо АСС® по причине НЯ.
Расчет размера выборки. Исследования, посвященные оценке ВОРТ (резистентности к АСК) при приеме кишечнорастворимых и буферных форм АСК у пациентов со стабильной ИБС и СД2, отсутствуют. Поэтому расчет размера выборки проводился на основании работы, опубликованной Rocca B, et al. [16], в которой у пациентов с СД оценивалась эффективность различных режимов и доз АСК в кишечнорастворимой оболочке по уровню ТХА2 через оценку его метаболитов: сывороточного ТХВ2, 11-дегидротромбоксана В2 в моче. Учитывая, что оценка метаболитов ТХА2 — параметр, по которому оценивают наличие резистентности к АСК, в определенной степени близкий значениям агрегометрии по данным теста VerifyNow Aspirin test и коррелирующий с ней, было принято допущение о возможности использования значений резистентности к терапии АСК по данным определения метаболитов ТХА2 для расчета выборки нашего исследования. Так, при 80% мощности при двустороннем уровне значимости 5% (α=0,05) для обнаружения схожих различий нам необходимо набрать 82 пациента в каждую группу. С учетом возможного выбывания 20% пациентов в ходе исследования нами запланирован набор 200 пациентов (по 100 пациентов в каждую группу).
Статистический анализ результатов. Статистическая оценка данных будет проведена с использованием программного обеспечения Stata/MP 16.0 (для Windows 64-bit), Prism (GraphPad, США) и Excel 2016 (Microsoft, США) с валидированными алгоритмами для применения статистических методов и надлежащим документальным оформлением.
Для описания количественных переменных будет использоваться среднее арифметическое значение (М) и стандартное отклонение среднего значения (SD) (для параметрических данных) или медиана (Me) и интерквантильный размах [IQR] (для непараметрических данных). С целью оценки нормальности распределения будет применяться тест Колмогорова-Смирнова и Skewness тест. Значимость различий между двумя группами по количественным переменным будет оцениваться при помощи U-критерия Манна-Уитни (для непараметрических данных) и t-тест Стьюдента (для параметрических данных). Качественные переменные будут описываться абсолютными (n) и относительными (%) значениями. Для определения значимости различий качественных показателей будут использованы критерии: хи-квадрат (χ²) и точный критерий Фишера. Статистическая значимость будет определяться при значении двустороннего р<0,05. Все переменные, для которых будет продемонстрирована значимость межгрупповых различий, будут включены в многофакторный регрессионный анализ, где при помощи логистической регрессии будет определяться отношение шансов и 95% доверительный интервал (ДИ). Пороговые значения для количественных предикторов будут устанавливаться на основе соотнесения маржинальных вероятностей с выбранным баллом отсечения. Балл отсечения будет выбран при оптимальном соотношении чувствительности и специфичности. Первичным критерием свободы от тромботических, геморрагических событий и развития резистентности к АСК будет установлена кумулятивная свобода от тромботических, геморрагических событий и развития резистентности к АСК — промежуток между датой начала приема АСК и датой окончания исследования. Оценка статистически значимых различий кривых выживаемости будет проводиться с помощью log-rank-теста. На основании показателей выживаемости по каждому исследованию будут построены графические изображения — кривые выживаемости. Промежуточный анализ планируется провести, когда примерно 100 пациентам будет выполнена лабораторная оценка эффективности АСК, и исследование либо будет прекращено из-за бесперспективности (если расчетная условная мощность для первичной конечной точки при условии, что эффект лечения, предполагаемый для размера выборки в протоколе, применяется к оставшейся части исследования, составляет <0,25), досрочно остановлено на основании более высокой эффективности или продолжено дальше.
Обсуждение
Исследование КАСКАД призвано сравнить влияние формы АСК на агрегацию тромбоцитов. Атеросклеротические сердечно-сосудистые заболевания (АССЗ) являются ведущей причиной смерти во всем мире и основным фактором развития инвалидности [39]. Факторы риска АССЗ хорошо известны и в значительной степени поддаются коррекции, включая сахарный диабет, артериальную гипертонию, дислипидемию и образ жизни (в т. ч. курение и низкую физическую активность) [40]. Также потенциальным фактором риска АССЗ являются "гиперреактивные" тромбоциты [41][42], а необходимость антитромбоцитарной терапии для вторичной профилактики на настоящий момент не вызывает сомнения, кроме того, последние годы даже обсуждается целесообразность использования антитромбоцитарных препаратов и для первичной профилактики сердечно-сосудистых событий в определенных группах пациентов [43]. Основными мишенями фармакологического воздействия являются повышенные цифры артериального давления, повышенный уровень липидов, глюкозы и "гиперреактивные" тромбоциты, при этом в рекомендательных документах четко обозначены "требуемые" уровни для снижения риска для всех мишеней (артериальное давление, гликированный гемоглобин, холестерин липопротеинов низкой плотности) кроме тромбоцитов. Несмотря на существующее большое количество тестов, которые помогают оценить функциональное состояние тромбоцитов, на сегодняшний момент нет однозначного понимания "до какого уровня" должны быть ингибированы тромбоциты и ингибируются ли они лекарственными препаратами вообще, особенно при монотерапии АСК в некоторых группах пациентов [41].
Деацитилирование АСК до неактивной салициловой кислоты происходит в кишечнике и печени, эффект первого прохождения через печень (пресистемный метаболизм) достаточно высокий, в то время как эффект первого прохождения через слизистую оболочку тонкого кишечника не определен [11], однако учитывая данные фармакокинетических исследований по биодоступности, этот эффект есть [14]. АСК в кишечнорастворимой форме высвобождается медленнее и абсорбируется при более низких концентрациях в течение более длительного периода времени, что может приводить к более низкой биодоступности АСК и сниженному антитромбоцитарному эффекту по сравнению с АСК в простой форме [43]. Фармакокинетика простой и буферной формы схожи, в исследованиях была показана биоэквивалентность фармакокинетики и фармакодинамики высоких доз буферной АСК [44][45], однако биоэквивалентность низких доз (81-100 мг) еще не изучалась [14].
В исследовании Cox D, et al. [46] c перекрестным дизайном изучали 3 стратегии: АСК в кишечнорастворимой форме 75 мг, АСК в простой форме 75 мг и комбинацию дипиридамола 200 мг с АСК в простой форме 25 мг (комбинация назначалась 2 раза в день). В исследовании принял участие 71 здоровый доброволец в возрасте 20-50 лет. У всех измеряли активность ЦОГ до лечения и через 2 нед. лечения. Через 2 нед. отмывочного периода исследование повторяли с новым препаратом для каждого участника исследования. Первичной конечной точкой являлось ингибирование TXA2 через 2 нед. лечения. Неэффективность лечения определялась как ингибирование TXA2 <95% и была обнаружена у 0% (95% ДИ: 0-13,3) пациентов, получавших АСК в простой форме, у 13% (95% ДИ: 7,8-21,0) в группе пациентов с АСК в кишечнорастворимой форме и у 8% (95% ДИ: 1,9-27,7) в группе комбинированного лечения. Команда исследователей на основании этих данных сделала заключение, что пациенты, которые принимают низкие дозы препаратов АСК в кишечнорастворимой форме, с меньшей вероятностью получат полную пользу от АСК.
В исследовании Peace A, et al. [47] сравнивали влияние АСК в простой форме и АСК в кишечнорастворимой форме по уровню TXB2 в сыворотке у пациентов с сердечно-сосудистыми заболеваниями. Пациенты получали лечение АСК не менее 3 мес. и обязательно в течение 36 ч до проведения теста. У 44 из 236 (19%) человек уровень TXB2 оказался слишком высоким (>10 нг/мл), что свидетельствовало о недостаточном антитромбоцитарном эффекте. Чтобы исключить несоблюдение режима приема таблеток, 20 пациентов с повышенным уровнем TXB2 принимали таблетки под наблюдением. После этого у 10 пациентов все еще был слишком высокий уровень TXB2. Все эти пациенты получали АСК в кишечнорастворимой форме 75 мг. Этим пациентам лечение было изменено на АСК в простой форме в дозе 75 мг и через 2 нед. лечения у 7 из 10 (70%) был адекватный ответ (низкий уровень ТХВ2). Три пациента, у которых оставался недостаточный эффект от АСК, имели средний вес 120 кг, и после того, как доза была увеличена до 150 мг АСК в простой форме, у всех троих наблюдалось адекватное снижение активности ЦОГ. Авторы пришли к выводу, что антитромбоцитарный эффект АСК в кишечнорастворимой форме может быть недостаточным даже после многократного регулярного приема. Это может быть связано с худшей абсорбцией, поскольку у большинства пациентов был достаточный ответ на прием АСК в простой форме. Кроме того, результаты исследования показывали, что у пациентов с ожирением могут потребоваться более высокие дозы АСК из-за увеличения объема распределения.
Maree AO, et al. [35] исследовали 131 стабильного пациента с сердечно-сосудистыми заболеваниями, которые получали АСК в кишечнорастворимой оболочке в дозе 75 мг. Повышенная активность ЦОГ (TXB2 >2,2 нг/мл) была обнаружена у 58 из 131 (44%) как признак недостаточного антитромбоцитарного эффекта. Авторы обнаружили, что неадекватное снижение активности ЦОГ в значительной степени связано с молодым возрастом, большим весом и перенесенным инфарктом миокарда. Таким образом, кишечнорастворимое покрытие может снижать антитромбоцитарный эффект АСК, что влечет за собой риск недостаточной антитромботической профилактики.
Исследование КАСКАД разработано с учетом всех данных и ограничений ранее проведенных исследований, но является лишь первым шагом в изучении проблемы резистентности к АСК у пациентов с СД2 и имеет свои важные ограничения. Исследование КАСКАД является обсервационным и даже при положительном результате его выводы должны будут проверяться в дальнейших интервенционных исследованиях, возможно, с перекрестным дизайном. Другим важным ограничением является само понятие резистентности к АСК и методах ее определения, для преодоления этого ограничения в исследовании запланировано использование двух лабораторных методов, однако оба метода имеют в своей основе схожий физический принцип (светопропускание), хоть и отражают такой важный биологический феномен, как "агрегация тромбоцитов" в отличие от методов исследования метаболитов ТХА2 в крови и моче, которые являются только "следами" данного феномена.
Заключение
КАСКАД — это первое исследование, в котором оценивается, может ли форма АСК, всасывающаяся в желудке и имеющая научное обоснование для более высокой биодоступности без потерь в безопасности, повлиять на снижение доли пациентов, резистентных к АСК.
Отношения и деятельность. Статья подготовлена при поддержке АО "Нижфарм". Мнение авторов может не совпадать с мнением компании.
Список литературы
1. Laferrière C, Moazzami C, Belley-Côté E, et al. Aspirin for the Primary Prevention of Vascular Ischemic Events: An Updated Systematic Review and Meta-analysis to Support Shared Decision-Making. CJC Open. 2023;5(12):881-90. doi:10.1016/j.cjco.2023.08.011.
2. Melchinger H, Jain K, Tyagi T, Hwa J. Role of Platelet Mitochondria: Life in a Nucleus-Free Zone. Front Cardiovasc Med. 2019;6:153. doi:10.3389/fcvm.2019.00153.
3. An H, Chen J, Li S, Chen A. Pantoprazole and Vonoprazan Performed Well in Preventing Peptic Ulcer Recurrence in Low-Dose Aspirin Users. Dig Dis Sci. 2024;69(3):670-82. doi:10.1007/s10620-023-08233-4.
4. Dammann HG, Burkhardt F, Wolf N. Enteric coating of aspirin significantly decreases gastroduodenal mucosal lesions. Aliment Pharmacol Ther. 1999;13(8):1109-14. doi:10.1046/j.1365-2036.1999.00588.x.
5. Lanza FL, Royer GL Jr, Nelson RS. Endoscopic evaluation of the effects of aspirin, buffered aspirin, and enteric-coated aspirin on gastric and duodenal mucosa. N Engl J Med. 1980;303(3):136-8. doi:10.1056/NEJM198007173030305.
6. Hawthorne AB, Mahida YR, Cole AT, Hawkey CJ. Aspirin-induced gastric mucosal damage: prevention by enteric-coating and relation to prostaglandin synthesis. Br J Clin Pharmacol. 1991;32(1):77-83. doi:10.1111/j.1365-2125.1991.tb05616.x.
7. Cole AT, Hudson N, Liew LC, et al. Protection of human gastric mucosa against aspirin-enteric coating or dose reduction? Aliment Pharmacol Ther. 1999;13(2):187-93. doi:10.1046/j.1365-2036.1999.00470.x.
8. Blondon H, Barbier JP, Mahé I, et al. Gastroduodenal tolerability of medium dose enteric-coated aspirin: a placebo controlled endoscopic study of a new enteric-coated formulation versus regular formulation in healthy volunteers. Fundam Clin Pharmacol. 2000;14(2):155-7. doi:10.1111/j.1472-8206.2000.tb00404.x.
9. Petroski D. Endoscopic comparison of three aspirin preparations and placebo. Clin Ther. 1993;15(2):314-20.
10. Hoftiezer JW, Silvoso GR, Burks M, Ivey KJ. Comparison of the effects of regular and enteric-coated aspirin on gastroduodenal mucosa of man. Lancet. 1980;2(8195 pt 1): 609-12. doi:10.1016/s0140-6736(80)90282-2.
11. García Rodríguez LA, Hernández-Díaz S, de Abajo FJ. Association between aspirin and upper gastrointestinal complications: systematic review of epidemiologic studies. Br J Clin Pharmacol. 2001;52(5):563-71. doi:10.1046/j.0306-5251.2001.01476.x.
12. van Oijen MG, Dieleman JP, Laheij RJ, et al. Peptic ulcerations are related to systemic rather than local effects of low-dose aspirin. Clin Gastroenterol Hepatol. 2008;6(3):309-13. doi:10.1016/j.cgh.2007.12.018.
13. Сидоров А. В. Антитромботический эффект препаратов ацетилсалициловой кислоты в разных лекарственных формах: есть ли разница? Российский кардиологический журнал. 2021;26(10):4734. doi:10.15829/1560-4071-2021-4734.
14. Clerici B, Cattaneo M. Pharmacological Efficacy and Gastrointestinal Safety of Different Aspirin Formulations for Cardiovascular Prevention: A Narrative Review. J Cardiovasc Dev Dis. 2023;10(4):137. doi:10.3390/jcdd10040137.
15. Kedir HM, Sisay EA, Abiye AA. Enteric-Coated Aspirin and the Risk of Gastrointestinal Side Effects: A Systematic Review. Int J Gen Med. 2021;14:4757-63. doi:10.2147/IJGM.S326929.
16. Rocca B, Fox KAA, Ajjan RA, et al. Antithrombotic therapy and body mass: an expert position paper of the ESC Working Group on Thrombosis. Eur Heart J. 2018;39(19):1672-86. doi:10.1093/eurheartj/ehy066.
17. Gigante B, Tamargo J, Agewall S, et al. Update on antithrombotic therapy and body mass: a clinical consensus statement of the European Society of Cardiology Working Group on Cardiovascular Pharmacotherapy and the European Society of Cardiology Working Group on Thrombosis. Eur Heart J Cardiovasc Pharmacother. 2024;10(7):614-45. doi:10.1093/ehjcvp/pvae064.
18. Барбараш О. Л., Карпов Ю. А., Панов А. В. и др. Стабильная ишемическая болезнь сердца. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(9):6110. doi:10.15829/1560-4071-2024-6110.
19. Murray FE, Hudson N, Atherton JC, et al. Comparison of effects of calcium carbasalate and aspirin on gastroduodenal mucosal damage in human volunteers. Gut. 1996;38(1):11-4. doi:10.1136/gut.38.1.11.
20. Баркаган З. С., Котовщикова Е. Ф. Сравнительный анализ основных и побочных эффектов различных форм ацетилсалициловой кислоты. Клин. фармакол. тер. 2004;13(3):40-3.
21. Яковенко Э. П., Краснолобова Л. П., Яковенко А. В. и др. Влияние препаратов ацетилсалициловой кислоты на морфофункциональное состояние слизистой оболочки желудка у кардиологических пациентов пожилого возраста. Сердце. 2013;12(3):145-50.
22. Верткин А. Л., Аристархова О. Ю., Адонина Е. В. и др. Безопасность и фармакоэкономическая эффективность применения различных препаратов ацетилсалициловой кислоты у пациентов с ИБС. РМЖ. 2009;8:570-5.
23. Takada M, Fujimoto M, Hosomi K. Difference in risk of gastrointestinal complications between users of enteric-coated and buffered low-dose aspirin. Int J Clin Pharmacol Ther. 2014;52(3):181-91.
24. Endo H, Sakai E, Higurashi T, et al. Differences in the severity of small bowel mucosal injury based on the type of aspirin as evaluated by capsule endoscopy. Dig Liver Dis. 2012;44:833-8.
25. Hirata Y, Kataoka H, Shimura T, et al. Incidence of gastrointestinal bleeding in patients with cardiovascular disease: buffered aspirin versus enteric-coated aspirin. Scand J Gastroenterol. 2011;46:803-9.
26. Ajjan RA, Kietsiriroje N, Badimon L, et al. Antithrombotic therapy in diabetes: which, when, and for how long? Eur Heart J. 2021;42(23):2235-59. doi:10.1093/eurheartj/ehab128.
27. Ferreiro JL, Angiolillo DJ. Diabetes and antiplatelet therapy in acute coronary syndrome. Circulation. 2011;123(7):798-813. doi:10.1161/CIRCULATIONAHA.109.913376.
28. Gurbel PA, Bliden KP, Tantry US. Defining platelet response to acetylsalicylic acid: the relation between inhibition of serum thromboxane B2 and agonist-induced platelet aggregation. J Thromb Thrombolysis. 2021;51(2):260-4. doi:10.1007/s11239-020-02334-x.
29. Pedersen AK, FitzGerald GA. Dose-related kinetics of aspirin. Presystemic acetylation of platelet cyclooxygenase. N Engl J Med. 1984;311(19):1206-11. doi:10.1056/NEJM198411083111902.
30. Harrison P, Segal H, Blasbery K, et al. Screening for aspirin responsiveness after transient ischemic attack and stroke: comparison of 2 point-of-care platelet function tests with optical aggregometry. Stroke. 2005;36(5):1001-5. doi:10.1161/01.STR.0000162719.11058.bd.
31. Gum PA, Kottke-Marchant K, Poggio ED, et al. Profile and prevalence of aspirin resistance in patients with cardiovascular disease. Am J Cardiol. 2001;88(3):230-5. doi:10.1016/s0002-9149(01)01631-9.
32. Venketasubramanian N, Agustin SJ, Padilla JL, et al. Comparison of Different Laboratory Tests to Identify "Aspirin Resistance" and Risk of Vascular Events among Ischaemic Stroke Patients: A Double-Blind Study. J Cardiovasc Dev Dis. 2022;9(5):156. doi:10.3390/jcdd9050156.
33. Dash P, Singh VK, Gautam D, et al. Aspirin resistance and blood biomarkers in predicting ischemic stroke recurrence: An exploratory study. Brain Circ. 2022;8(1):31-7. doi:10.4103/bc.bc_75_21.
34. Lordkipanidzé M, Pharand C, Schampaert E, et al. A comparison of six major platelet function tests to determine the prevalence of aspirin resistance in patients with stable coronary artery disease. Eur Heart J. 2007;28(14):1702-8. doi:10.1093/eurheartj/ehm226.
35. Maree AO, Curtin RJ, Dooley M, et al. Platelet response to low-dose enteric-coated aspirin in patients with stable cardiovascular disease. J Am Coll Cardiol. 2005;46(7):1258-63. doi:10.1016/j.jacc.2005.06.058.
36. Khan H, Zamzam A, Gallant RC, et al. Aspirin nonsensitivity in patients with vascular disease: Assessment by light transmission aggregometry (aspirin nonsensitivity in vascular patients). Res Pract Thromb Haemost. 2021;5(8):e12618. doi:10.1002/rth2.12618.
37. Krasopoulos G, Brister SJ, Beattie WS, Buchanan MR. Aspirin "resistance" and risk of cardiovascular morbidity: systematic review and meta-analysis. BMJ. 2008;336(7637): 195-8. doi:10.1136/bmj.39430.529549.BE.
38. Филькова А. А., Пантелеев М. А., Свешникова А. Н. Обратимая агрегация тромбоцитов в присутствии ионов кальция: механизмы и потенциальная значимость. Вопросы гематологии/ онкологии и иммунопатологии в педиатрии. 2019;18(3):120-9. doi:10.24287/1726-1708-2019-18-3-120-129.
39. Stark B, Johnson C, Roth G. Global prevalence of coronary artery: an update from the global burden of disease study. JACC. 2024;83(13_Supplement):2320.
40. Lawler PR, Bhatt DL, Godoy LC, et al. Targeting cardiovascular inflammation: next steps in clinical translation. Eur Heart J. 2021;42(1):113-31. doi:10.1093/eurheartj/ehaa099.
41. Кобалава Ж. Д., Писарюк А. С., Филькова А. А. и др. Фенотипы тромбоцитов и практические аспекты методов тестирования функции тромбоцитов в кардиологии. Рациональная Фармакотерапия в Кардиологии. 2023;19(6):614-28. doi:10.20996/1819-6446-2023-2981.
42. Cofer LB, Barrett TJ, Berger JS. Aspirin for the Primary Prevention of Cardiovascular Disease: Time for a Platelet-Guided Approach. Arterioscler Thromb Vasc Biol. 2022; 42(10):1207-16. doi:10.1161/ATVBAHA.122.318020.
43. Haastrup PF, Grønlykke T, Jarbøl DE. Enteric coating can lead to reduced antiplatelet effect of low-dose acetylsalicylic acid. Basic Clin Pharmacol Toxicol. 2015;116(3):212-5. doi:10.1111/bcpt.12362.
44. Batterman RC. Comparison of buffered and unbuffered acetylsalicylic acid. N Engl J Med. 1958;258(5):213-9. doi:10.1056/NEJM195801302580503.
45. Feldman M, Cryer B. Aspirin absorption rates and platelet inhibition times with 325-mg buffered aspirin tablets (chewed or swallowed intact) and with buffered aspirin solution. Am J Cardiol. 1999;84(4):404-9. doi:10.1016/s0002-9149(99)00324-0.
46. Cox D, Maree AO, Dooley M, et al. Effect of enteric coating on antiplatelet activity of low-dose aspirin in healthy volunteers. Stroke. 2006;37(8):2153-8. doi:10.1161/01.STR.0000231683.43347.ec.
47. Peace A, McCall M, Tedesco T, et al. The role of weight and enteric coating on aspirin response in cardiovascular patients. J Thromb Haemost. 2010;8(10):2323-5. doi:10.1111/j.1538-7836.2010.03997.x.
Об авторах
Ж. Д. КобалаваРоссия
Д.м.н., профессор, член-корр. РАН, зав. кафедрой внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева; руководитель Института клинической медицины.
Москва
Конфликт интересов:
Нет
А. С. Писарюк
Россия
К.м.н., доцент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева; врач-кардиолог отделения реанимации и интенсивной терапии для кардиологических больных.
Москва
Конфликт интересов:
Нет
А. А. Филькова
Россия
К. б. н., доцент инженерно-физического института; н. с.
Москва
Конфликт интересов:
Нет
Ё. С. Тухсанбоев
Россия
Аспирант кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева; врач-кардиолог отделения реанимации и интенсивной терапии для кардиологических больных.
Москва
Конфликт интересов:
Нет
А. Н. Амирова
Россия
Аспирант кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева.
Москва
Конфликт интересов:
Нет
А. Д. Корнейчук
Россия
Аспирант по направлению "Биофизика"; м.н.с.
Москва
Конфликт интересов:
Нет
Г. С. Павликов
Россия
Врач-реаниматолог отделения реанимации и интенсивной терапии для больных с острым нарушением мозгового кровообращения.
Москва
Конфликт интересов:
Нет
Л. Р. Бурханова
Россия
Зав. кардиологическим отделением.
Москва
Конфликт интересов:
Нет
И. А. Мерай
Россия
К. м. н., профессор кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева; зав. отделением реанимации и интенсивной терапии для кардиологических больных.
Москва
Конфликт интересов:
Нет
М. А. Пантелеев
Россия
Д.ф.-м.н., член-корр. РАН, профессор, зав. лабораторией клеточного гемостаза и тромбоза; профессор кафедры медицинской физики физического факультета.
Москва
Конфликт интересов:
Нет
А. Н. Свешникова
Россия
Д.ф.-м.н., профессор, зав. лабораторией клеточной биологии и трансляционной медицины; зав. лабораторией внутриклеточной сигнализации и системной биологии; профессор факультета фундаментальной физико-химической инженерии.
Москва
Конфликт интересов:
Нет
- У пациентов с сахарным диабетом часто выявляются гиперреактивные тромбоциты и как правило сниженный ответ на терапию ацетилсалициловой кислотой (АСК).
- Для всех пациентов со стабильной ишемической болезнью сердца необходимость антитромбоцитарной терапии для вторичной профилактики развития сердечно-сосудистых событий не вызывает сомнений.
- Для оценки эффективности АСК до сих пор не существует "золотого стандарта", однако в настоящий момент большие ожидания связаны с агрегометрией тромбоцитов и ее различных модификаций.
- До 60% пациентов резистентны к терапии АСК, одним из возможных факторов развития устойчивости может являться кишечнорастворимое покрытие.
- Буферная форма АСК, которая всасывается в желудке, потенциально более эффективна у пациентов с сахарным диабетом и ишемической болезнью сердца по сравнению с кишечнорастворимой формой без потерь в безопасности.
Рецензия
Для цитирования:
Кобалава Ж.Д., Писарюк А.С., Филькова А.А., Тухсанбоев Ё.С., Амирова А.Н., Корнейчук А.Д., Павликов Г.С., Бурханова Л.Р., Мерай И.А., Пантелеев М.А., Свешникова А.Н. Эффективность ацетилсалициловой кислоты с содержанием буфера и ацетилсалициловой кислоты в кишечнорастворимой оболочке по воздействию на агрегацию тромбоцитов у пациентов со стабильной ишемической болезнью сердца и сахарным диабетом 2 типа (КАСКАД): обоснование и дизайн одноцентрового наблюдательного сравнительного исследования. Российский кардиологический журнал. 2025;30(1):6250. https://doi.org/10.15829/1560-4071-2025-6250. EDN: WESPME
For citation:
Kobalava Zh.D., Pisaryuk A.S., Filkova A.A., Tukhsanboev E.S., Amirova A.N., Korneichuk A.D., Pavlikov G.S., Burkhanova L.R., Meray I.A., Panteleev M.A., Sveshnikova A.N. Efficacy of buffered and enteric-coated acetylsalicylic acid on platelet aggregation in patients with stable coronary artery disease and type 2 diabetes (CASCADE): rationale and design of a single-center observational comparative study. Russian Journal of Cardiology. 2025;30(1):6250. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6250. EDN: WESPME
JATS XML

















































