Перейти к:
Предикторы венозных тромбоэмболических осложнений у больных ишемическим инсультом
https://doi.org/10.15829/1560-4071-2025-6245
EDN: YJEWBK
Аннотация
Цель. Выявить предикторы развития венозных тромбоэмболий (ВТЭ) у больных ишемическим инсультом (ИИ).
Материал и методы. Проведено одноцентровое проспективное исследование. Критерии включения: 1) наличие ИИ, подтвержденного данными нейровизуализации, 2) длительность госпитализации на момент включения ≤72 ч, 3) индекс мобильности Rivermead Mobility Index (RMI) ≤3 баллов. Скринированы 126 пациентов. Исследование подразумевало 2 визита: на 3±1 сут. госпитализации и 10±1 сут. госпитализации. Из исследования исключались пациенты без выявленного тромбоза глубоких вен (ТГВ) на первом визите, у которых второй визит не состоялся. Исследуемую группу составили 94 пациента. На визитах выполнялись ультразвуковое исследование вен нижних конечностей и сердца, исследование биомаркеров, при выявлении ТГВ проводилась компьютерная томография‑ангиопульмонография.
Результаты. Всего в исследованной группе больных ИИ выявлено 46 случаев ТГВ (49%), из них 26 "ранних" тромбозов (ТГВ на визите 1) и 20 "поздних" тромбозов (ТГВ диагностирован на визите 2). Предикторами "ранних" тромбозов являются уровень лейкоцитов крови при поступлении >10,6 (отношение шансов (ОШ) 3,58, 95% доверительный интервал (ДИ): 1,12‑11,39, p=0,028) и количество баллов по шкале Padua >5 (ОШ 5,14, 95% ДИ: 1,62‑16,29, p=0,005). В качестве предикторов "поздних" тромбозов предлагаются — уровень d‑димера на 3 сут. ≥3‑кратного превышения верхней границы референсного интервала (ОШ 26,6, 95% ДИ: 3,0‑232,9, p=0,004) и отношение скоростей кровотока на передней большеберцовой вене (ПББВ) со стороны поражения к противоположной стороне ≤0,90 (ОШ 4,1, 95% ДИ: 1,1‑15,4, p=0,039).
Заключение. При ИИ наблюдается высокая частота ВТЭ (49%) среди маломобильных больных (RMI ≤3). Тромбозы можно разделить на "ранние" (3±1 сут.) и "поздние" (10±1 сут. госпитализации). Предикторами "ранних" тромбозов являются 1) количество баллов по Padua >5 и 2) лейкоциты при поступлении >10,6*109. Предикторами "поздних" тромбозов являются 1) 3‑кратное повышение верхнего референса уровня d‑димера и 2) отношение скоростей кровотока на ПББВ со стороны поражения к противоположной стороне ≤0,90 на 3±1 сут. госпитализации.
Для цитирования:
Уланова Н.Д., Починка И.Г., Ботова С.Н. Предикторы венозных тромбоэмболических осложнений у больных ишемическим инсультом. Российский кардиологический журнал. 2025;30(8):6245. https://doi.org/10.15829/1560-4071-2025-6245. EDN: YJEWBK
For citation:
Ulanova N.D., Pochinka I.G., Botova S.N. Predictors of venous thromboembolism in patients with ischemic stroke. Russian Journal of Cardiology. 2025;30(8):6245. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6245. EDN: YJEWBK
Инсульт является наиболее частым цереброваскулярным заболеванием и остается одной из ведущих причин смертности во всем мире, унося ~5,5 млн жизней в год [1]. Заболеваемость инсультом в Российской Федерации составляет 2,5-4 случая на 1 тыс. человек [2], из которых 85% случаев приходится на долю ишемического инсульта (ИИ) [1]. Инсульт, сопровождающийся обездвиженностью, является известным фактором риска развития венозной тромбоэмболии (ВТЭ), клинически проявляющейся в виде тромбоза глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА). Инсульт принято относить к категории умеренных факторов риска ВТЭ [3]. По данным российского регистра СИРЕНА, доля больных с инсультом в структуре причин ТЭЛА составила 4,6% [4], доля больных, перенесших инсульт в анамнезе, — 9,9% [5]. Причем среди больных ТЭЛА с фибрилляцией предсердий доля пациентов с инсультом в анамнезе достигает 23,8% [6]. В случае развития ВТЭ у больного ИИ прогноз существенно ухудшается [7].
На сегодняшний день имеются доказательства высокой эффективности антикоагулянтной терапии в отношении профилактики ВТЭ у больных ИИ. На фоне применения антикоагулянтов отношение шансов (ОШ) ТГВ при ИИ составляет 0,21, 95% доверительный интервал (ДИ): 0,15-0,29 [8]. В то же время использование антикоагулянтов сопровождается повышением риска как внутричерепных кровотечений (ОШ 1,68, 95% ДИ: 1,11-2,55), так и внечерепных кровотечений (ОШ 1,65, 95% ДИ: 1,0-2,75) [8]. Авторы метаанализа клинических исследований с ранним рутинным применением антикоагулянтов при ИИ приходят к выводу, что риск внутричерепной геморрагии превышает пользу от снижения частоты ВТЭ [9]. Поэтому современные клинические рекомендации не дают конкретного алгоритма при определении показаний к назначению антикоагулянтов для профилактики ВТЭ и предлагают врачу самостоятельно определять баланс между пользой от предотвращения ВТЭ и потенциальным риском внутричерепных и внечерепных кровотечений1. Сохраняющаяся в настоящее время неопределенность в этом вопросе делает актуальным поиск дополнительных надежных предикторов ВТЭ при ИИ, использование которых позволит конкретизировать критерии для назначения профилактической антикоагулянтной терапии.
Цель исследования: выявить предикторы развития ВТЭ у больных ИИ.
Материал и методы
Проведено одноцентровое проспективное наблюдательное исследование. Больные ИИ, госпитализированные в Региональный сосудистый центр на базе ГБУЗ НО Городская клиническая больница № 13 Нижнего Новгорода, включались с ноября 2022г по февраль 2024г. Использовались следующие критерии включения: 1) наличие ИИ, подтвержденного данными нейровизуализации (компьютерная томография (КТ) или магнитно-резонансная томография головного мозга), 2) длительность госпитализации на момент включения ≤72 ч, 3) индекс мобильности Rivermead Mobility Index (RMI) ≤3 баллов. Всего были скринированы 126 пациентов. Оценка риска ВТЭ проводилась с помощью шкалы Padua [10]. Протокол исследования предполагал два визита: визит 1 на 3±1 сут. госпитализации и визит 2 на 10±1 сут. госпитализации. На визите 1 пациентам проводились триплексное ультразвуковое исследование (УЗИ) вен нижних конечностей с определением скорости кровотока в глубоких венах (УЗИ-1) и эхокардиография с помощью аппарата Medison HS30, Samsung, а также забор образцов крови на определение следующих биомаркеров — С-реактивного белка (СРБ) (набор реагентов Beckman Coulter, на биохимическом анализаторе Olimpus AU 680), N-концевого промозгового натрийуретического пептида (набор реагентов Вектор-Бест, на иммуноферментном анализаторе FAX-2100) и d-димера (экспресс-тест, на флуориметрическом анализаторе Ramp Clinical Reader). На визите 2 выполнялось повторное УЗИ вен нижних конечностей (УЗИ-2). Из исследования исключались пациенты, у которых на визите 1 ТГВ отсутствовал, а визит 2 не состоялся по любой причине (смерть, ранняя выписка и др.). Пациенты с выявленным ТГВ на визите 1 из исследования не исключались даже в случае отсутствия визита 2. Таким образом, исследуемую группу составили все пациенты с выявленным ТГВ на визите 1, а также больные без ТГВ на визите 1, которые прошли визит 2. Исследуемая группа включала 94 пациента. Дизайн исследования и включение пациентов представлены на рисунке 1. Всем пациентам проводились диагностические и лечебные мероприятия в соответствии с российскими клиническими рекомендациями "Ишемический инсульт и транзиторная ишемическая атака у взрослых" 2021г. Больным, у которым по данным УЗИ выявлялись признаки ТГВ, при отсутствии противопоказаний, проводилась КТ-ангиопульмонография для диагностики ТЭЛА. Противопоказаниями к проведению КТ-ангиографии считали непереносимость йодсодержащих контрастных препаратов и расчетная скорость клубочковой фильтрации <20 мл/мин.
Статистический анализ данных проведен с помощью программ STATISTICA 10 (StatSoft) и MedCalc (MedCalc software LTD). Количественные данные представлены в виде медиан и интерквартильных интервалов. Нормальность распределения количественных данных определяли с помощью критерия Колмогорова-Смирнова. При сравнении количественных переменных в группах использовался непарамет- рический критерий Манна-Уитни. Для сравнения долей использовался критерий χ2-Pearson. Для количественной оценки связи между параметрами применялся метод ранговой корреляции Спирмена. При построении многофакторной модели бинарного исхода использовалась логистическая регрессия. Для оценки качества бинарной классификации использовался ROC-анализ (receiver operating characteristic).
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации. Протокол исследования был одобрен Этическим комитетом ФГБОУ ВО "ПИМУ" Минздрава России. Авторы заявляют об отсутствии конфликта интересов. Исследование выполнено без привлечения внешнего финансирования.
Результаты
В исследуемой группе, включающей 94 больных ИИ, ВТЭ диагностированы в 46 случаях (49%). У всех 46 больных с ВТЭ был выявлен ТГВ нижних конечностей, из них в 40 случаях пациентам выполнена КТ-ангиопульмонография, ТЭЛА диагностирована у 31 пациента (78% от числа обследованных больных с ТГВ). Среди 48 больных без ВТЭ смертельный исход в стационаре произошел в 3 случаях (летальность 6%). Зарегистрировано 23 смертельных исхода больных, имеющих ВТЭ (летальность составила 50%), p<0,001 χ2-Pearson. При этом из 15 пациентов с ТГВ без ТЭЛА скончались в стационаре 9 (60%), из 31 пациента с ТГВ, осложненным ТЭЛА, смерть наступила в 14 случаях (45%), p=0,345.
Исходя из факта и срока выявления ВТЭ, пациенты были разделены на три подгруппы следующим образом: 1 подгруппу составили 48 больных (51%), у которых ТГВ не был выявлен на обоих визитах, 2 подгруппу составили 26 пациентов, у которых ТГВ был выявлен на визите 1 (3±1 сут. госпитализации), такие ВТЭ назвали "ранними". 3 подгруппу составили 20 пациентов, у которых на визите 1 тромбозы отсутствовали, но ТГВ выявлен при контрольном УЗИ-2 на визите 2 (10±1 сут. госпитализации), такие тромбозы именовали "поздними". Таким образом, частота развития "ранних" тромбозов составила 20% от числа пациентов, прошедших скрининг (26 случаев из 126 больных), а частота "поздних" тромбозов составила 29% от числа пациентов, не имеющих ТГВ по данным УЗИ-1 (20 случаев из 68 больных). Сравнительная характеристика групп представлена в таблице 1. Из 26 пациентов с "ранним" тромбозом ТЭЛА развилась в 17 случаях (65%), из 20 пациентов с "поздними" тромбозами ТЭЛА выявлена в 14 случаях (70%), p=0,74.
Обратимся к "ранним" тромбозам. Подгруппа 2 по сравнению с подгруппой 1 характеризовалась достоверно большим количеством баллов при оценке тяжести ИИ по NIHSS и оценки мобильности по RMI, более высокими уровнями лейкоцитов при поступлении, более высокими уровнями СРБ и d-димера, достоверно более низким отношением скоростей кровотока в передней большеберцовой вене (ПББВ) и большим количеством баллов по шкале Padua, таблица 1. Биомаркеры СРБ и d-димер, а также скоростные параметры кровотока в венах исследовались на визите 1, т.е. в день выявления "ранних" ТГВ. Таким образом, изменения перечисленных характеристик отражают факт произошедшего тромбоза и не могут быть использованы в качестве предикторов "ранних" ТГВ. Обе шкалы NIHSS и RMI отражают тяжесть ИИ и характеризуются достоверной корреляцией между собой: r=-0,48 (p<0,001). Поэтому для дальнейшего анализа в качестве претендентов на роль предикторов "ранних" тромбозов отобраны уровень лейкоцитов, оценка по RMI при поступлении и количество баллов по шкале Padua.
Проведен ROC-анализ для уровня лейкоцитов в общем анализе крови в отношении прогнозирования "ранних" тромбозов: AUC=0,674, p=0,007, точка отсечения (уровень лейкоцитов, соответствующий индексу Youden) >10,6*109 лейкоцитов. По результатам ROC-анализа для шкалы Padua AUC=0,716, p<0,001, точка отсечения (количество баллов по шкале Padua, соответствующее индексу Youden) >5. При RMI ≤1 частота "ранних" ТГВ составила 34%, при RMI в диапазоне 2-3 баллов — 8% (p=0,014). Однако при проведении многофакторного анализа только уровень лейкоцитов и количество баллов по шкале Padua продемонстрировали достоверную связь с развитием ранних тромбозов (табл. 2).
В таблице 3 представлена балльная шкала предикторов "ранних" тромбозов. Наличию каждого предиктора присваивается 1 балл. Представленная шкала лучше предсказывает развитие "ранних" тромбозов, чем каждый из предикторов в отдельности. По результатам ROC-анализа AUC=0,768, p<0,001, рисунок 2. Прогностическая ценность отрицательного результата предлагаемой шкалы прогнозирования "ранних" ТГВ составляет 0,86, прогностическая ценность положительного результата при наличии 1 балла составляет 0,33, при наличии 2 баллов — 0,80, p<0,001, таблица 4.
Теперь обратимся к "поздним" тромбозам. Подгруппа 3 по сравнению с подгруппой 1 характеризовалась достоверно более высоким уровнем d-димера и низким отношением скоростей кровотока на ПББВ со стороны поражения к противоположной стороне (табл. 1). Оба параметра были получены на визите 1, поэтому могут претендовать на роль предикторов "поздних" тромбозов, выявляемых на визите 2. Проведен ROC-анализ для уровня d-димера в отношении прогнозирования "поздних" ТГВ: AUC=0,74, p<0,001, точка отсечения определена на уровне ≥1,5 нг/мл, что соответствует трехкратному превышению верхней границы референсного интервала. Также проведен ROC-анализ для отношения скорос-тей на ПББВ: AUC=0,718, p=0,002, точка отсечения определена на уровне ≤0,90. При проведении многофакторного анализа подтверждена достоверная связь "поздних" тромбозов как с повышенным уровнем d-димера, так и с низким отношением скоростей венозного кровотока (табл. 5).
В таблице 6 представлена балльная шкала предикторов "поздних" тромбозов: наличию каждого предиктора присваивается 1 балл. Представленная шкала лучше предсказывает развитие "поздних" тромбозов, чем каждый из предикторов в отдельности. По результатам ROC-анализа AUC=0,825, p<0,001, рисунок 3.
Прогностическая ценность отрицательного результата предлагаемой шкалы прогнозирования поздних ТГВ составляет 1,00, прогностическая ценность положительного результата при наличии 1 балла составляет 0,27, при наличии 2 баллов — 0,65, p<0,001, таблица 7. Таким образом, балльная шкала предикторов характеризуется высокой предсказательной ценностью отрицательного результата, что может быть использовано в алгоритмах назначения антикоагулянтов для профилактики ВТЭ у больных ИИ.
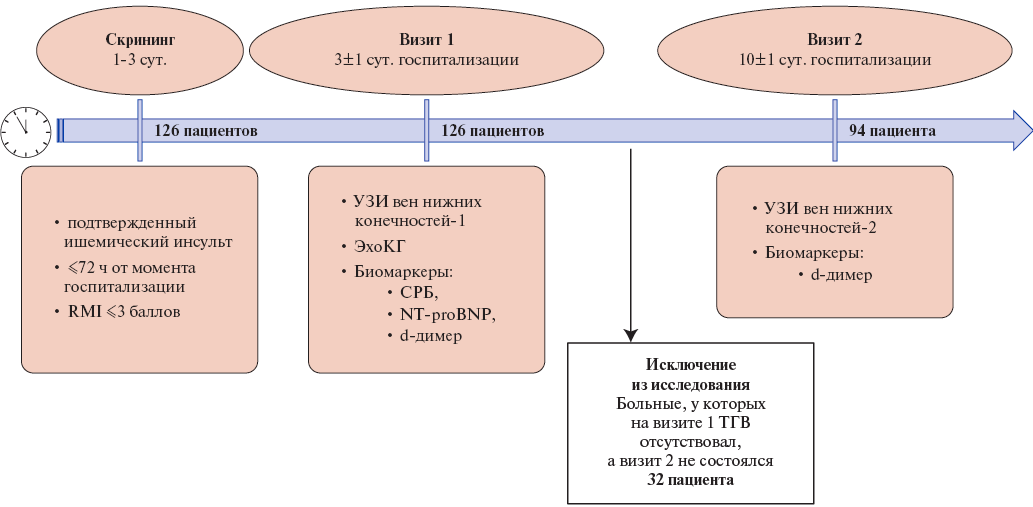
Рис. 1. Дизайн и движение пациентов в исследовании.
Сокращения: СРБ — С-реактивный белок, ТГВ — тромбоз глубоких вен нижних конечностей, УЗИ — ультразвуковое исследование, ЭхоКГ — эхокардиография, NT-proBNP — N-концевой промозгового натрийуретический пептид, RMI — индекс мобильности пациента.
Таблица 1
Сравнительная характеристика пациентов в подгруппах
|
Параметр |
Подгруппа 1 (нет ТГВ), n=48 |
Подгруппа 2 ("ранний" ТГВ), n=26 |
Подгруппа 3 ("поздний" ТГВ), n=20 |
p-значение для попарного сравнения* |
||
|
p (1-2) |
p (1-3) |
p (2-3) |
||||
|
Возраст, лет |
73 [ 63; 84] |
77 [ 70; 84] |
74 [ 64; 84] |
0,239 |
0,762 |
0,432 |
|
Пациенты мужского пола |
13 (27%) |
8 (31%) |
5 (25%) |
0,737 |
0,859 |
0,667 |
|
ИМТ, кг/м2 |
27 [ 25; 31] |
26 [ 24; 29] |
26 [ 24; 32] |
0,567 |
0,772 |
0,885 |
|
Больные, госпитализированные в пределах 4,5 ч от начала симптомов |
8 (17%) |
4 (15%) |
3 (15%) |
0,886 |
0,865 |
0,971 |
|
ИИ в бассейне среднемозговой артерии |
37 (77%) |
20 (77%) |
16 (80%) |
0,988 |
0,792 |
0,802 |
|
NIHSS, балл |
14 [ 9; 21] |
18 [ 13; 25] |
18 [ 13; 21] |
0,047 |
0,111 |
0,666 |
|
RMI, балл |
1 [ 0; 2] |
0 [ 0; 1] |
0 [ 0; 1] |
0,017 |
0,329 |
0,277 |
|
Наличие ФП/ТП |
19 (40%) |
7 (27%) |
12 (60%) |
0,276 |
0,124 |
0,024 |
|
ФВ ЛЖ, % |
53 [ 46; 58] |
52 [ 46; 57] |
49 [ 43; 56] |
0,885 |
0,201 |
0,247 |
|
Гемоглобин, г/л |
134 [ 124; 144] |
131 [ 121; 144] |
138 [ 125; 147] |
0,704 |
0,581 |
0,394 |
|
Уровень лейкоцитов при поступлении, *109 |
9,1 [ 7,6; 11,2] |
12,4 [ 8,9; 15,1] |
7,9 [ 6,7; 14,0] |
0,013 |
0,408 |
0,056 |
|
Уровень тромбоцитов, *109 |
215 [ 181; 272] |
216 [ 141; 279] |
213 [ 171; 280] |
0,408 |
0,941 |
0,690 |
|
МНО |
1,00 [ 0,94; 1,09] |
1,08 [ 0,93; 1,14] |
1,05 [ 0,95; 1,14] |
0,174 |
0,211 |
0,833 |
|
Значение глюкозы крови при поступлении, ммоль/л |
7,1 [ 6,3; 8,0] |
7,7 [ 6,2; 10,0] |
7,1 [ 6,3; 11,9] |
0,277 |
0,662 |
0,790 |
|
Общий холестерин |
5,16 [ 4,51; 6,39] |
4,57 [ 3,80; 5,72] |
4,53 [ 4,18; 5,26] |
0,105 |
0,054 |
0,816 |
|
рСКФ, мл/мин |
62 [49; 79] |
64 [ 36; 80] |
65 [ 52; 86] |
0,483 |
0,415 |
0,445 |
|
СРБ, мг/мл |
35,7 [ 12,2; 77,5] |
100,0 [ 74,0; 126,2] |
66,0 [ 30,8; 134,2] |
<0,001 |
0,058 |
0,204 |
|
NT-proBNP, пг/мл |
258 [ 35; 762] |
399 [ 150; 671] |
501 [ 142; 890] |
0,284 |
0,160 |
0,530 |
|
d-димер, мкг/мл |
1,04 [ 0,47; 2,36] |
5,00 [ 4,13; 7,04] |
2,63 [ 1,76; 5,00] |
<0,001 |
<0,001 |
0,045 |
|
Отношение скоростей кровотока на ПББВ при УЗИ-1 (сторона поражения к здоровой стороне) |
0,94 [ 0,84; 0,97] |
0,00 [ 0,00; 0,87] |
0,84 [ 0,69; 0,91] |
<0,001 |
0,005 |
0,006 |
|
Количество случаев ТЛТ |
3 (6%) |
1 (4%) |
2 (10%) |
0,662 |
0,589 |
0,402 |
|
Применение ОАК до ИИ |
6 (13%) |
2 (8%) |
3 (15%) |
0,524 |
0,782 |
0,430 |
|
Профилактическое применение НМГ с 1-2 суток |
1 (2%) |
4 (15%) |
0 (0%) |
0,090 |
0,649 |
0,191 |
|
Шкала Padua, баллы |
5 [ 5; 5,5] |
6 [ 5; 7] |
5 [ 5; 6,5] |
0,001 |
0,225 |
0,226 |
|
Шкала риска кровотечений IMPROVE |
3,0 [ 2,5; 4,0] |
2,75 [ 2,5; 4,0] |
4,0 [ 2,5; 5,0] |
0,578 |
0,931 |
0,517 |
Примечание: * — при сравнении количественных переменных использовался тест Mann-Whitney, при сравнении долей — χ2-Pearson.
Сокращения: ИИ — ишемический инсульт, ИМТ — индекс массы тела, МНО — международное нормализованное отношение, НМГ — низкомолекулярные гепарины, ОАК — оральные антикоагулянты, ПББВ — передняя большеберцовая вена, рСКФ — расчетная скорость клубочковой фильтрации, СРБ — С-реактивный белок, ТГВ — тромбоз глубоких вен, ТЛТ — тромболитическая терапия, УЗИ — ультразвуковое исследование, ФВ ЛЖ — фракция выброса левого желудочка, ФП/ТП — фибрилляция/трепетание предсердий, NIHSS — шкала тяжести инсульта National Institutes of Health Stroke Scale, NT-proBNP — N-концевой промозгового натрийуретический пептид, RMI — индекс мобильности пациента.
Таблица 2
Результаты многофакторного анализа прогнозирования "ранних" тромбозов (логистическая регрессия)
|
Параметр |
ОШ |
95% ДИ |
p |
|
Уровень лейкоцитов в 1-е сутки >10,6*109, (0 — нет, 1 — да) |
3,58 |
1,12-11,39 |
0,028 |
|
RMI =0 или 1 (0 — нет, 1 — да) |
4,49 |
0,82-24,57 |
0,078 |
|
Количество баллов по шкале Padua >5, (0 — нет, 1 — да) |
5,14 |
1,62-16,29 |
0,005 |
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов, RMI — индекс мобильности пациента.
Таблица 3
Балльная шкала наличия предикторов "ранних" ТГВ
|
Наличие предикторов |
Баллы |
|
Отсутствие предикторов |
0 |
|
Присутствует 1 из двух предикторов (либо уровень лейкоцитов в 1-е сут. >10,6*109, либо количество баллов по шкале Padua >5) |
1 |
|
Присутствуют оба предиктора (уровень лейкоцитов в 1-е сут. >10,6*109 и количество баллов по шкале Padua >5) |
2 |
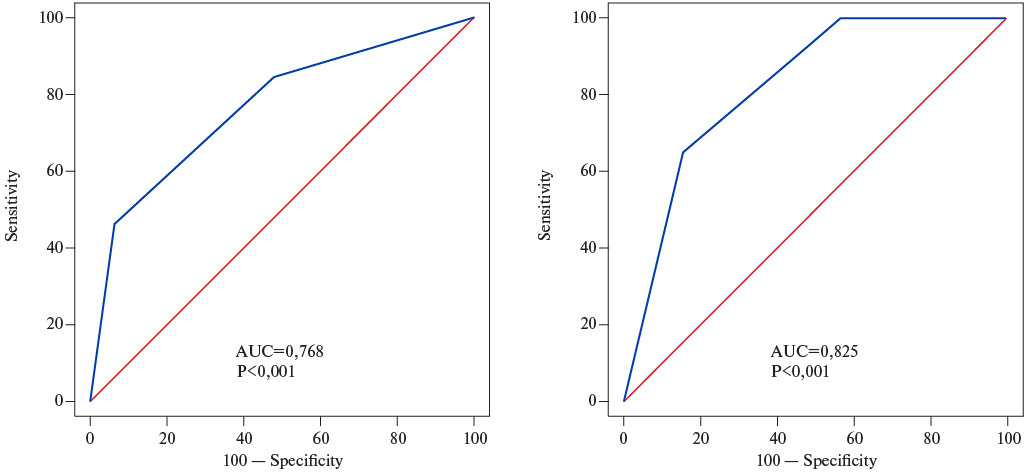
Рис. 2. ROC-анализ балльной шкалы в отношении прогнозирования "ранних" ТГВ.
Сокращение: AUC — площадь под кривой.
Рис. 3. ROC-анализ балльной шкалы в отношении прогнозирования "поздних" ТГВ.
Сокращение: AUC — площадь под кривой.
Таблица 4
Наличие предикторов и "ранние" тромбозы
|
Количество баллов по шкале |
0 (нет предикторов) |
1 (наличие одного из предикторов) |
2 (наличие двух предикторов) |
|
Тромбозов нет (количество наблюдений) |
25 |
20 |
3 |
|
"Ранний" тромбоз (количество наблюдений) |
4 |
10 |
12 |
Таблица 5
Результаты многофакторного анализа прогнозирования "поздних" тромбозов (логистическая регрессия)
|
Параметр |
ОШ |
95% ДИ |
p |
|
Уровень d-димера на 3-и сут. ≥3-кратного превышения верхней границы референсного интервала (0 — нет, 1 — да) |
26,6 |
3,0-232,9 |
0,004 |
|
Отношение скоростей кровотока на ПББВ со стороны поражения к противоположной стороне ≤0,90 (0 — нет, 1 — да) |
4,1 |
1,1-15,4 |
0,039 |
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов, ПББВ — передняя большеберцовая вена.
Таблица 6
Балльная шкала наличия предикторов "поздних" ТГВ
|
Наличие предикторов |
Баллы |
|
Отсутствие предикторов |
0 |
|
Присутствует 1 из двух предикторов (либо уровень d-димера на 3-и сут. ≥3-кратного превышения верхней границы референсного интервала, либо отношение скоростей кровотока на ПББВ со стороны поражения к противоположной стороне ≤0,90) |
1 |
|
Присутствуют оба предиктора уровень d-димера на 3-и сут. ≥3-кратного превышения верхней границы референсного интервала и отношение скоростей кровотока на ПББВ со стороны поражения к противоположной стороне ≤0,90) |
2 |
Сокращение: ПББВ — передняя большеберцовая вена.
Таблица 7
Наличие предикторов и "поздние" тромбозы
|
Количество баллов по шкале |
0 (нет предикторов) |
1 (наличие одного из предикторов) |
2 (наличие двух предикторов) |
|
Тромбозов нет (количество наблюдений) |
20 |
19 |
7 |
|
"Поздний" тромбоз (количество наблюдений) |
0 |
7 |
13 |
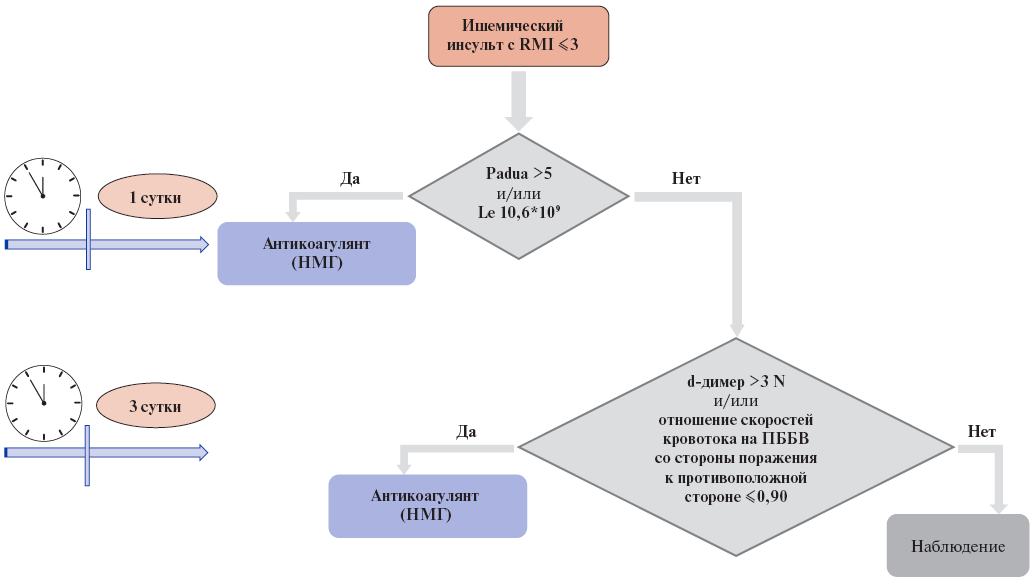
Рис. 4. Алгоритм определения показаний к назначению антикоагулянтов для профилактики ВТЭ у больных ИИ.
Сокращения: НМГ — низкомолекулярные гепарины, ПББВ — передняя большеберцовая артерия, RMI — индекс мобильности, Le — уровень лейкоцитов, N — верхний предел референсного интервала.
Обсуждение
Исследование показало, что у маломобильных пациентов с ИИ (RMI ≤3) частота ВТЭ достигает 49%. Уже к третьим суткам у 20% больных развивается "ранний" ТГВ, а в следующие 7 дней у каждого четвертого фиксируется "поздняя" ВТЭ. При диагностированном ТГВ у 78% пациентов КТ-ангиопульмонография подтверждает наличие ТЭЛА. Обнаруженная частота ТЭЛА при ТГВ у больных ИИ значительно превышает данные, представленные в других публикациях [11]. Наличие ВТЭ, включающей как изолированный ТГВ, так и ТГВ с ТЭЛА, сопровождается достоверным многократным повышением риска летального исхода во время стационарного лечения по поводу ИИ (ОШ 15, 95% ДИ: 4-56, p<0,001). При этом выявление ТЭЛА у больного с ранее диагностированным ТГВ не приводило к достоверному влиянию на частоту летальных исходов. Следует заметить, что подтверждение ТЭЛА у больного с ТГВ в сущности не меняет медикаментозную терапию ВТЭ — наличие ИИ является противопоказанием к тромболитической терапии ТЭЛА [3], при выявлении ВТЭ в любом ее проявлении (ТГВ, ТГВ с ТЭЛА) показано применение антикоагулянтов в лечебных дозах. Отсутствие влияния диагностированной ТЭЛА как на характер антитромботической терапии, так и на летальность при ИИ с ТГВ, делает закономерным вопрос о целесообразности проведения КТ-ангиопульмонографии для верификации ТЭЛА в данной группе пациентов. Действительно, в такой ситуации всегда присутствующий риск развития йод-индуцированной нефропатии не уравновешивается очевидными преимуществами от проведения КТ-ангиографии. Между тем, согласно клиническим рекомендациям, выполнение КТ-ангиографии показано всем пациентам с высокой клинической вероятностью наличия ТЭЛА [3]. Полагаем, что выполнение визуализации необходимо, т.к. КТ-ангиография не ограничивается описанием проходимости легочных артерий, но также дает информацию о легочной паренхиме и плевральных полостях, что востребовано при лечении тяжелых лежачих больных ИИ. У пациентов с низкой расчетной скоростью клубочковой фильтрации (и, соответственно, с максимальным риском контраст-индуцированной нефропатии) для диагностики ТЭЛА предпочтительно использование эхокардиографии.
Высокая летальность при ИИ, осложненном ВТЭ, подчеркивает важность выявления предикторов тромбозов для определения показаний к медикаментозной профилактике ТГВ. Ранние тромбозы достаточно надежно прогнозировались шкалой Padua (AUC 0,716), рекомендуемой для оценки риска ВТЭ у нехирургических больных. Но в отличие от классической интерпретации данной шкалы (высокий риск ≥4 баллов), в контексте тяжелого ИИ предиктором ВТЭ следует считать >5 баллов. Комбинация шкалы Padua и лейкоцитоза улучшает прогнозирование, подтверждая связь воспаления и гиперкоагуляции при ранних тромбозах.
Повышенный уровень d-димера и низкое отношение скоростей кровотока на ПББВ со стороны поражения к противоположной стороне, выявляемые уже на визите 1, не только претендуют на роль предикторов "поздних" тромбозов, но и наводят на мысль, что субклинический тромботический процесс у больных с "поздними" тромбозами начинается рано, за несколько дней до появления визуализируемого ТГВ.
Можно обратить внимание, что профилактическое применение низкомолекулярных гепаринов использовалось только в 5 случаях (табл. 1). Клинические рекомендации, как отечественные, так и зарубежные, остаются неопределёнными в отношении раннего применения антикоагулянтов для профилактики ТГВ из-за риска внутричерепных кровоизлияний. Однако предложенные предикторы ВТЭ помогают выделить пациентов с высоким риском тромбозов, для которых использование антикоагулянтов может быть оправданным.
Предполагается, что наличие большого количества баллов по Padua (>5) и лейкоцитоза (>10,6*109) в первые сутки пребывания в стационаре могут являться критериями для применения антикоагулянтов для профилактики "ранних" ТГВ при ИИ. На 3 сут. пребывания в стационаре 3-кратное повышение верхнего предела референсного интервала уровня d-димера и отношение скоростей кровотока на ПББВ со стороны поражения к противоположной стороне ≤0,90 могут являться критериями для назначения антикоагулянтов с целью профилактики "поздних" ТГВ (рис. 4). Важно отметить, что пациенты с ВТЭ не имели достоверных отличий по шкале риска кровотечений IMPROVE, только 4 пациента по этой шкале имели ≥7 баллов, соответствующих высокому риску кровотечений (2 в подгруппе больных без ВТЭ и 2 в подгруппе "поздних" ВТЭ). Предлагаемый алгоритм оценки риска ВТЭ уточняет и структурирует подход к профилактике венозных тромбозов с помощью анти- коагулянтов.
Заключение
Частота выявления ТГВ у маломобильных больных (RMI ≤3) с ИИ при двукратном УЗИ вен нижних конечностей за время госпитализации составляет 49%. По времени выявления тромбозы можно разделить на "ранние" (3±1 сут. госпитализации) и "поздние" (10±1 сут. госпитализации). Предикторами "ранних" тромбозов являются 1) наличие количества баллов по Padua >5 и 2) лейкоцитоза при поступлении >10,6*109. Предикторами "поздних" тромбозов являются 1) 3-кратное повышение верхнего предела референсного интервала уровня d-димера и 2) отношение скоростей кровотока на ПББВ со стороны поражения к противоположной стороне ≤0,90 на 3±1 сут. госпитализации. Для прогнозирования ВТЭ при ИИ можно использовать шкалы балльной оценки предлагаемых предикторов. Оценка риска ВТЭ на основании выявления предикторов позволяет определить пациентов, обоснованно нуждающихся в профилактическом применении антикоагулянтов.
1 Клинические рекомендации. Ишемический инсульт и транзиторная ишемическая атака. Одобрено Научно-практическим Советом Минздрава РФ. Дата размещения: 20.11.2024. Доступно по ссылке: https://cr.minzdrav.gov.ru/recomend/814_1.
Список литературы
1. Johnson CO, Nguyen M, Roth GA, et al.; GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990‑2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 2019;18(5):439‑58. doi:10.1016/S14744422(19)30034‑1.
2. Клочихина О. А., Шпрах В. В., Стаховская Л. В. и др. Динамика показателей заболеваемости инсультом и смертности от него за восьмилетний период на территориях, вошедших в федеральную программу реорганизации помощи пациентам с инсультом. Acta Biomedica Scientifica. 2021;6(1):75‑80. doi:10.29413/ABS.2021‑6.1.10.
3. Konstantinides SV, Meyer G, Becattini C, et al.; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Heart J. 2020;41(4):543‑603. doi:10.1093/eurheartj/ehz405.
4. Черепанова Н. А., Эрлих А. Д., Павлова Т. В. и др. Валидизация шкалы SIRENA для оценки риска госпитальной смерти у пациентов с острой тромбоэмболией легочной артерии на независимой выборке. Российский кардиологический журнал. 2022;27(2S):4984. doi:10.15829/1560‑4071‑2022‑4984.
5. Эрлих А. Д., Атаканова А. Н., Неешпапа А. Г. и др. Российский регистр острой тромбоэмболии лёгочной артерии СИРЕНА: характеристика пациентов и лечение в стационаре. Российский кардиологический журнал. 2020;25(10):3849. doi:10.15829/1560‑4071‑2020‑3849.
6. Алиева Э. Х., Сыромятникова Л. И., Эрлих А. Д. и др. Тромбоэмболия легочной артерии и фибрилляция предсердий: анализ данных Российского регистра "СИРЕНА". Российский кардиологический журнал. 2022;27(7):5035. doi:10.15829/1560‑4071‑2022‑5035.
7. Keller K, Schmitt VH, Hahad O, et al. Outcome of Pulmonary Embolism with and without Ischemic Stroke. Journal of Clinical Medicine. 2024;13(10):2730. doi:10.3390/jcm13102730.
8. Dennis M, Caso V, Kappelle LJ, et al. European Stroke Organisation. European Stroke Organisation (ESO) guidelines for prophylaxis for venous thromboembolism in immobile patients with acute ischaemic stroke. Eur Stroke J. 2016;1(1):6‑19. doi:10.1177/2396987316628384.
9. Geeganage CM, Sprigg N, Bath MW, et al. Balance of symptomatic pulmonary embolism and symptomatic intracerebral hemorrhage with low‑dose anticoagulation in recent ischemic stroke: a systematic review and meta‑analysis of randomized controlled trials. J Stroke Cerebrovasc Dis. 2013;22(7):1018‑27. doi:10.1016/j.jstrokecerebrovasdis.2012.03.005.
10. Barbar S, Noventa F, Rossetto V, et al. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. J Thromb Haemost. 2010;8(11):2450‑7. doi:10.1111/j.1538‑7836.2010.04044.x.
11. Рябинкина Ю. В., Гнедовская Е. В., Максимова М. Ю. и др. Инсульт: частота развития и факторы риска венозных тромбоэмболических осложнений в условиях отделения реанимации и интенсивной терапии. Анестезиология и реаниматология. 2015;60(5):54‑9.
Об авторах
Н. Д. УлановаРоссия
Нина Дмитриевна Уланова — врач приемного отделения ГБУЗ НО ГКБ № 13 Автозаводского района, ассистент кафедры эндокринологии и внутренних болезней
Нижний Новгород
И. Г. Починка
Россия
Илья Григорьевич Починка — д.м.н., доцент кафедры эндокринологии и внутренних болезней, зав. кардиологическим отделением ГБУЗ НО ГКБ № 13 Автозаводского района
Нижний Новгород
С. Н. Ботова
Россия
Светлана Николаевна Ботова — к.м.н., доцент кафедры эндокринологии и внутренних болезней, зам. главного врача по медицинской части ГБУЗ НО ГКБ № 13 Автозаводского района
Нижний Новгород
Дополнительные файлы
- При ишемическом инсульте (ИИ) наблюдается высокая частота венозных тромбоэмболий (ВТЭ) (49%) у маломобильных пациентов (RMI ≤3).
- ВТЭ при ИИ можно разделить на "ранние" (3±1 сут.) и "поздние" (10±1 сут. госпитализации).
- Выявление предикторов "ранних" и "поздних" тромбозов позволяет определить показания к назначению антикоагулянтов для профилактики ВТЭ у больных ИИ.
Рецензия
Для цитирования:
Уланова Н.Д., Починка И.Г., Ботова С.Н. Предикторы венозных тромбоэмболических осложнений у больных ишемическим инсультом. Российский кардиологический журнал. 2025;30(8):6245. https://doi.org/10.15829/1560-4071-2025-6245. EDN: YJEWBK
For citation:
Ulanova N.D., Pochinka I.G., Botova S.N. Predictors of venous thromboembolism in patients with ischemic stroke. Russian Journal of Cardiology. 2025;30(8):6245. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6245. EDN: YJEWBK
JATS XML

















































