Перейти к:
Кальцификация грудного отдела аорты у пациентов с резистентной артериальной гипертензией
https://doi.org/10.15829/1560-4071-2025-6226
EDN: TPGKMB
Аннотация
Цель. Оценить кальцификацию грудного отдела аорты и параметры суточного мониторирования артериального давления (СМАД) у пациентов с резистентной артериальной гипертензией (РАГ).
Материал и методы. В исследование включены 138 пациентов с диагнозом РАГ. По результатам СМАД (Schiller BR-102 plus) пациенты разделены на группы контролируемой (1 группа, n=68) и неконтролируемой РАГ (2 группа, n=70). Кальциевый индекс (КИ) грудного отдела аорты определен с помощью 64-спирального компьютерного томографа ("Siemens", Германия) в процессе сканирования от корня до диафрагмы.
Результаты. Статистически значимых отличий между группами по основным клинико-антропометрическим характеристикам не выявлено. КИ составил от 312 до 2738 единиц Агатстона и оказался выше в группе неконтролируемой РАГ (р<0,00001). С помощью ROC анализа установлено, что КИ величиной 900 ед. Агатстона с чувствительностью 71,4% и специфичностью 66,2% отличает лиц с контролируемой и неконтролируемой РАГ (AUC=0,791). При анализе результатов СМАД наиболее значимые отличия получены при сопоставлении пульсового артериального давления (ПАД), суточного индекса систолического артериального давления (САД), величины утреннего подъема и вариабельности САД в дневные часы. Независимо от эффективности антигипертензивной терапии КИ положительно коррелировал с вариабельностью САД, ПАД, величиной утреннего подъема и отрицательно с суточным индексом САД, но сила связи больше при недостижении целевого уровня АД.
Заключение. У пациентов с РАГ при отсутствии контроля АД отмечаются более высокие значения ПАД, величины утреннего подъема и вариабельности САД, снижение суточного индекса САД. КИ выше в группе пациентов с неконтролируемой РАГ и связан с вариабельностью САД, ПАД, величиной утреннего подъема АД и степенью ночного снижения САД.
Ключевые слова
Для цитирования:
Хаишева Л.А., Литвинова М.С., Умугванеза Д.А., Хаишев К.А. Кальцификация грудного отдела аорты у пациентов с резистентной артериальной гипертензией. Российский кардиологический журнал. 2025;30(7):6226. https://doi.org/10.15829/1560-4071-2025-6226. EDN: TPGKMB
For citation:
Khaisheva L.A., Litvinova M.S., Umugwaneza J.A., Khaishev K.A. Thoracic aortic calcification in patients with resistant hypertension. Russian Journal of Cardiology. 2025;30(7):6226. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6226. EDN: TPGKMB
По результатам исследований последнего десятилетия кальцификация сосудов признана независимым фактором риска сердечно-сосудистых осложнений [1]. Известно, что процесс кальцификации может развиваться в различных слоях сосудистой стенки. В частности, кальцифицирующее поражение интимы, имеющее пятнистое распределение, рассматривается как один из этапов атеросклероза [2] и связано с дислипидемией и провоспалительными факторами [3]. Отдельно выделяют кальцификацию медии, которая начинается в гладкомышечных клетках сосудистой стенки, распространяется диффузно по всему сосудистому периметру [2] и наиболее часто обнаруживается при сахарном диабете (СД), хронической болезни почек (ХБП) и артериальной гипертензии (АГ) [4]. Примечательно, что при ХБП и СД очаги кальцификации выявляются преимущественно в области бифуркации сосудов и местах их резкого сужения, тогда как при АГ наиболее выраженные изменения описаны в грудном отделе аорты [5]. Данное обстоятельство авторы объясняют тем, что основные пусковые факторы кальцификации сосудов, такие как внутрисосудистое давление, скорость кровотока и напряжение сдвига, имеют более высокие значения при АГ в проксимальном сегменте аорты. Считается, что кальциноз сосудов отражает тяжесть их повреждения при гипертонии [6].
Мультиспиральная компьютерная томография (МСКТ) является ведущим методом визуализации депозитов кальция в сосудистой стенке и все чаще используется для выявления и оценки выраженности кальцификации некоронарных артерий [2]. Для прижизненного определения сосудистого кальциноза могут использоваться различные методы количественной оценки [7], наиболее информативным считается метод Агатстона, что нашло отражение в растущем количестве публикаций, посвященных определению кальциевого скоринга некоронарных артерий по данным МСКТ. В выполненных работах было показано, что кальцификация грудного отдела аорты является предиктором серьезных сердечно-сосудистых событий и общей смертности, а также важнейшим маркером возрастной патологической дегенерации магистральных артерий [2]. В частности, в проспективном когортном исследовании (>27 тыс. участников, 14 лет наблюдения) было продемонстрировано увеличение риска смертности от всех причин в 1,24 (95% доверительный интервал (ДИ): 1,17-1,31) и риска развития фатальных и нефатальных сердечно-сосудистых событий в 1,22 раза (95% ДИ: 1,14-1,30) при исходном наличии кальцификации грудного отдела аорты [8]. Также в популяционных эпидемиологических исследованиях доказана высокая степень связи АГ с кальцинозом аорты [9][10]. По данным многоэтнического исследования атеросклероза (MESA) независимым предиктором кальцификации грудного отдела аорты признан уровень систолического артериального давления (САД) (отношение шансов 1,10, 95% ДИ: 1,06;1,14, р<0,001) [11]. С другой стороны, известна прогностическая значимость отдельных параметров суточного мониторирования артериального давления (СМАД), коррелирующих с поражением органов-мишеней и сердечно-сосудистыми исходами сильнее абсолютных значений артериального давления (АД) [12].
Пациенты с резистентной АГ (РАГ) отличаются от лиц с контролируемой АГ более частым развитием поражения органов-мишеней и более высоким риском сердечно-сосудистых осложнений, что объясняет пристальное внимание ученых и клиницистов к данной проблеме. Принимая во внимание ограниченность литературных данных о выраженности кальцификации грудного отдела аорты в указанной когорте больных, целью настоящего исследования стало: оценить кальцификацию грудного отдела аорты и параметры СМАД у пациентов с РАГ.
Материал и методы
Ретроспективно проанализировано 6130 историй болезни пациентов с диагнозом I10.0 "Эссенциальная (первичная) гипертензия" по международной статистической классификации болезней 10 пересмотра (МКБ-10). Были выявлены 936 человек, нуждавшихся в приеме ≥3 антигипертензивных препаратов. Исключив лиц с симптоматическими формами АГ, ХБП III-V ст., СД 1 и 2 типов, острыми и хроническими формами ишемической болезни сердца, гиповитаминозом D (<30 нг/мл), вероятным синдромом обструктивного апноэ сна и приемом терапии, способной повлиять на уровень АД, выделены 265 пациентов с вероятной РАГ, которым не менее 6 мес. проводилась коррекция фармакотерапии. Приверженность к лечению оценивали с помощью лекарственного опросника BMQ (Brief Medication Questionnaire) и мониторинга количества принятых таблеток. Путем оценки записей дневника самоконтроля оценивалась эффективность терапии. По результатам СМАД была исключена псевдорезистентность. Таким образом, в основное исследование включены 138 пациентов с диагнозом РАГ, установленным на основании рекомендаций Российского кардиологического общества [13].
Обязательным условием участия в исследовании был возраст от 45 до 70 лет, для женщин состояние постменопаузы и наличие подписанного пациентом письменного информированного согласия (протокол заседания локального независимого этического комитета ГБОУ ВПО РостГМУ Минздрава России № 17/18 от 23.10.2017).
Клиническое обследование выполнено по стандартной методике и включало сбор жалоб, анамнеза и физикальные методы. Лабораторное обследование, включая клинический анализ крови, определение уровня глюкозы, липидного профиля, белкового обмена, мочевины, креатинина, электролитов, трансаминаз, С-реактивного белка и коагулограммы, а также клинического анализа мочи выполнены на базе лаборатории ГБУ РО КДЦ "Здоровье".
СМАД проводилось по общепринятой стандартной методике с помощью аппарата Schiller BR-102 plus (Швеция). По результатам СМАД пациенты были разделены на группы контролируемой (n=68) и неконтролируемой (n=70) РАГ.
Кальциевый индекс (КИ) грудного отдела аорты оценивали на 64-спиральном компьютерном томографе ("Siemens", Германия) в процессе сканирования от корня до диафрагмы по методу Агатстона как произведение площади кальцинированного поражения на фактор плотности. Порог обнаружения сосудистого кальция был установлен на уровне 130 HU (единицы Хаунсфилда).
Статистический анализ выполнен с помощью пакета программ Statistica, v.12,0 (StatSoft, США). Качественные переменные представлены в виде абсолютных (n) и относительных (%) величин, количественные данные — в виде медианы интерквартильного интервала (Ме [ 25%; 75%]). Сравнение распределения категориальных данных выполнено методом χ2, количественных данных — с помощью U теста Манна-Уитни. Для оценки связи между вариационными рядами рассчитывался коэффициент корреляции Спирмена. Для поиска диагностически значимого уровня кальцификации грудной аорты использовался ROC-анализ. Статистически значимыми считались различия данных и корреляция между данными при р<0,001.
Результаты
Анализ клинико-демографических характеристик полученных групп представлен в таблице 1. Группы были сопоставимы по таким характеристикам, как возраст, пол, статус курения, индекс массы тела и объем талии, а также по качественному и количественному составу антигипертензивной терапии. Статистически значимые отличия получены при сопоставлении длительности регулярной антигипертензивной терапии, которая оказалась большей в группе участников, достигших целевого уровня АД, и составила 7,0 [ 6,0; 8,0] лет vs 5,0 [ 4,0; 6,0] лет при недостижении целевого АД (р<0,0001).
При изучении результатов лабораторного обследования (табл. 2) не было выявлено отличий при сравнении скорости клубочковой фильтрации (СКФ), уровня суточной альбуминурии, мочевой кислоты, общего холестерина и фракций липопротеинов в полученных группах. Дефицит витамина D и диспаратиреоз являются наиболее важными регуляторами гомеостаза кальция [14], в связи с чем исключались на этапе скрининга. При этом концентрация фосфора, общего и иони- зированного кальция была сопоставима у пациентов 1 и 2 групп.
При оценке параметров СМАД не было получено статистически значимой разницы по величине суточного индекса диастолического АД и частоте сердечных сокращений, а наиболее значимые отличия между группами получены при сопоставлении пульсового АД (ПАД), суточного индекса и вариабельности САД в дневные часы, а также величины утреннего подъема АД (табл. 3).
Анализ результатов МСКТ грудного отдела аорты показал, что КИ во всей группе обследованных пациентов составил от 312 до 2738 единиц Агатстона и оказался статистически значимо выше в группе лиц, не достигших целевого уровня АД — 1145,0 [ 834,0; 1752,0] ед. Агатстона в сравнении с группой контролируемой РАГ — 837,0 [ 605,0; 998,5] ед. Агатстона (р<0,0001).
Оценка корреляции КИ с клинико-демографическими параметрами выявила положительную связь с возрастом участников (r=0,52, р<0,0001 в 1 группе и r=0,43, р<0,0001 во 2) и отрицательную связь с длительностью регулярной антигипертензивной терапии (r=-0,69, р<0,0001 в 1 группе и r=-0,73, р<0,0001 во 2). Не было обнаружено связи КИ с индексом массы тела, уровнем мочевой кислоты и СКФ. При этом КИ положительно коррелировал с уровнем липопротеинов низкой плотности (в 1 группе r=0,41, p=0,0013, во 2 — r=0,33, p=0,02).
При изучении взаимосвязи выраженности кальцификации грудного отдела аорты с результатами СМАД (рис. 1) обнаружена положительная связь КИ с величиной САД за сутки, сопоставимая по силе в обеих группах участников. Также КИ положительно коррелировал с уровнем ПАД, сильнее в группе пациентов, не достигших целевого уровня АД. Обнаружена отрицательная связь КИ с суточным индексом САД и положительная с величиной утреннего подъема АД умеренная по силе в группе контролируемой РАГ и сильная в группе неконтролируемой РАГ. Независимо от достижения целевого уровня АД КИ положительно коррелировал с вариабельностью САД в дневные и ночные часы.
С помощью ROC анализа получено (рис. 2), что КИ величиной 900 ед. Агатстона с чувствительностью 71,4% и специфичностью 66,2% (AUC=0,791) позволяет различать пациентов с контролируемой и неконтролируемой РАГ.
Таблица 1
Клиническо-демографическая характеристика пациентов с РАГ (Ме [ 25%; 75%])
|
Параметры |
Контролируемая РАГ (n=68) |
Неконтролируемая РАГ (n=70) |
Значения р |
|
Возраст, годы |
60,5 [ 56,0; 64,5] |
62,0 [ 58,0; 66,0] |
0,16 |
|
Пол (мужской, %) |
30 (44,1) |
31 (44,3) |
0,98 |
|
Статус курения (n, %) |
12 (17,6) |
14 (20) |
0,231 |
|
Отягощенная наследственность (n, %) |
33 (48,5) |
37 (52,8) |
0,133 |
|
ИМТ, кг/м2 |
31,5 [ 29,7; 34,1] |
31,0 [ 28,0; 33,5] |
0,12 |
|
ОТ, см |
93,5 [ 84,5; 99,0] |
96,5 [ 87,0; 105,0] |
0,15 |
|
Длительность АГ, годы |
17,5 [ 16,0; 19,5] |
17,6 [ 16,0; 21,0] |
0,52 |
|
Количество принимаемых препаратов |
4,4 [ 4,1; 4,8] |
4,4 [ 4,1; 4,7] |
0,85 |
|
Длительность АГТ, годы |
7,0 [ 6,0; 8,0] |
5,0 [ 4,0; 6,0] |
<0,00001 |
Сокращения: АГ — артериальная гипертензия, АГТ — антигипертензивная терапия, ИМТ — индекс массы тела, ОТ — окружность талии, РАГ — резистентная артериальная гипертензия.
Таблица 2
Результаты лабораторного обследования пациентов с РАГ (Ме [ 25%; 75%])
|
Параметры |
Контролируемая РАГ (n=68) |
Неконтролируемая РАГ (n=70) |
Значения р |
|
Глюкоза, ммоль/л |
5,0 [ 4,0; 5,0] |
5,0 [ 4,0; 5,0] |
0,626 |
|
СКФ (CKD-EPI мл/мин/1,73 м2) |
73,5 [ 68,5; 79,0] |
74,5 [ 67,0; 82,0] |
0,901 |
|
МК, мкмоль/л |
340,0 [ 285,5; 399,5] |
352,5 [ 311,0; 396,0] |
0,317 |
|
Альбуминурия, мг/мл |
9,0 [ 5,0; 12,0] |
10,0 [ 5,0; 13;0] |
0,082 |
|
СРБ |
2,0 [ 1,7; 2,5] |
2,25 [ 1,8; 2,8] |
0,0913 |
|
Фибриноген |
4,29 [ 4,0; 4,6] |
4,35 [ 3,9; 4,8] |
0,667 |
|
ОХС, ммоль/л |
5,2 [ 4,3; 6,0] |
5,3 [ 4,5; 6,1] |
0,116 |
|
ЛВП, ммоль/л |
1,20 [ 1,06; 1,4] |
1,21 [ 1,05; 1,35] |
0,698 |
|
ЛНП, ммоль/л |
4,0 [ 3,7; 4,3] |
4,0 [ 3,6; 4,3] |
0,793 |
|
ТГ, ммоль/л |
1,5 [ 1,3; 1,8] |
1,6 [ 1,3; 1,9] |
0,171 |
|
Фосфор неорганический, ммоль/л |
1,72 [ 1,33; 2,15] |
1,69 [ 1,27; 2,10] |
0,188 |
|
Кальций общий, ммоль/л |
2,18 [ 2,11; 2,24] |
2,16 [ 2,11; 2,20] |
0,119 |
|
Кальций ионизированный, ммоль/л |
1,17 [ 1,14; 1,23] |
1,15 [ 1,12; 1,21] |
0,023 |
Сокращения: МК — мочевая кислота, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ОХС — общий холестерин, РАГ — резистентная артериальная гипертензия, СРБ — С-реактивный белок, СКФ — скорость клубочковой фильтрации, ТГ — триглицериды.
Таблица 3
Показатели СМАД у лиц с контролируемой и неконтролируемой РАГ (Ме [ 25%; 75%])
|
Параметры |
Контролируемая РАГ (n=68) |
Неконтролируемая РАГ (n=70) |
Значения р |
|
САД, мм рт.ст. |
126 [ 123; 128] |
138 [ 135; 142] |
<0,0001 |
|
ДАД, мм рт.ст. |
74 [ 69; 78] |
76 [ 70; 81] |
0,041 |
|
ПАД, мм рт.ст. |
52,5 [ 47,0; 56,5] |
60,0 [ 55,0; 65,0] |
<0,0001 |
|
СИ САД, % |
8,5 [ 6; 11] |
6,5 [ 3; 8] |
0,0013 |
|
СИ ДАД, % |
9 [ 6; 12] |
8 [ 6; 11] |
0,568 |
|
ИВ САДд, % |
22 [ 18; 27] |
62 [ 48; 69] |
<0,0001 |
|
ИВ САДн, % |
22 [ 16; 33] |
58 [ 51; 68] |
0,0071 |
|
ИВ ДАДд, % |
13 [ 8,8; 23] |
39 [ 27; 53] |
0,0042 |
|
ИВ ДАДн, % |
10 [ 4,8; 18] |
30 [ 23; 42] |
0,0013 |
|
SDc-день |
15 [ 13; 17] |
18 [ 15; 24] |
<0,0001 |
|
SDd-день |
10 [ 9; 11] |
11 [ 10; 12] |
0,027 |
|
SDc-ночь |
14 [ 11; 15] |
16 [ 12; 19] |
0,002 |
|
SDd-ночь |
9 [ 8; 11] |
11 [ 9; 13] |
0,0012 |
|
ВУП, мм рт.ст. |
20,5 [ 19,0; 23,5] |
28,0 [ 23,0; 32,0] |
<0,0001 |
|
СУП, мм рт.ст./ч |
15 [ 11; 22] |
25 [ 22; 33] |
0,0009 |
|
ЧСС, уд./мин |
73 [ 65; 78] |
72 [ 64; 78] |
0,236 |
Сокращения: ВУП — величина утреннего подъема, ДАД — диастолическое артериальное давление, ИВ ДАД — индекс времени диастолического артериального давления, ИВ САД — индекс времени систолического артериального давления, ПАД — пульсовое артериальное давление, РАГ — резистентная артериальная гипертензия, САД — систолическое артериальное давление, СИ ДАД — суточный индекс диастолического артериального давления, СИ САД — суточный индекс систолического артериального давления, СУП — скорость утреннего подъема, ЧСС — частота сердечных сокращений, SDc-день — вариабельность систолического артериального давления в дневные часы, SDc-ночь — вариабельность систолического артериального давления в ночные часы, SDd-день — вариабельность диастолического артериального давления в дневные часы, SDd-ночь — вариабельность диастолического артериального давления в ночные часы.
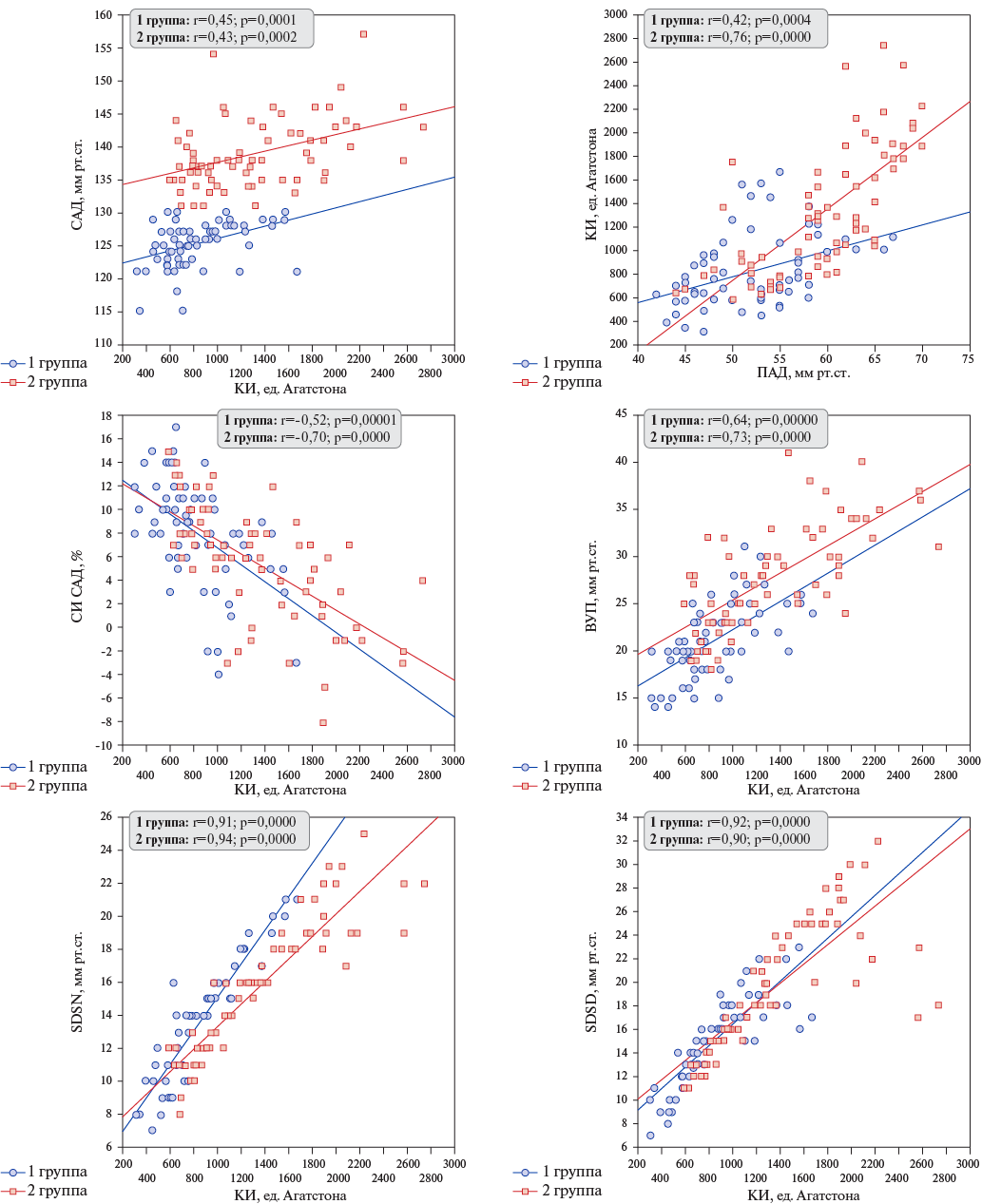
Рис. 1. Взаимосвязь КИ грудной аорты с результатами СМАД у пациентов с контролируемой и неконтролируемой РАГ.
Сокращения: ВУП — величина утреннего подъема, КИ — кальциевый индекс, ПАД — пульсовое артериальное давление, САД — систолическое артериальное давление, СИ САД — суточный индекс систолического артериального давления, SDSD — вариабельность систолического артериального давления в дневные часы, SDSN — вариабельность систолического артериального давления в ночные часы.
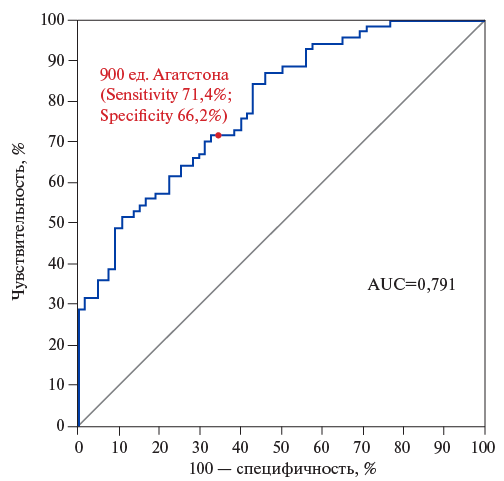
Рис. 2. ROC-анализ зависимости КИ и принадлежности пациентов к группам контролируемой или неконтролируемой РАГ.
Обсуждение
На сегодняшний день в доступной литературе имеется большое количество публикаций, посвященных изучению кальцификации грудного отдела аорты и ее прогностической значимости. Выполненные исследования отличаются значительной вариативностью методологических подходов и существенными различиями популяционных характеристик участников. Несмотря на это, основные факторы, вносящие вклад в развитие кальциноза, признаны большинством авторов. В частности, многократно показано увеличение распространенности кальцификации сосудов с возрастом. Согласно данным Барбараш О. Л. и др. [6], в возрасте старше 70 лет депозиты кальция в сосудистой стенке обнаруживается более чем у 90% мужчин и 67% женщин. В работе нидерландских ученых с участием 5718 человек продемонстрировано, что поражение грудного отдела аорты в сравнении с кальцификацией коронарных артерий встречается в более раннем возрасте и выявляется у 88% лиц от 55 до 59 лет и 99% в возрасте от 70 до 74 лет [15]. Принимая во внимание данные результаты, в настоящее исследование не включались лица старше 70 лет, но тем не менее была выявлена положительная связь КИ с возрастом участников.
Относительно вклада гендерных отличий в развитие кальцификации сосудов данные опубликованных работ весьма противоречивы. Так, в публикации авторов из университета Виттена/Хердеке, Германия [16], показана большая выраженность кальцификации грудной аорты среди мужчин, тогда как Craiem D, et al. [17] сообщили о наиболее выраженном поражении у женщин среднего возраста. Обнаруженные противоречия могут объясняться отличиями клинико-демографических показателей обследованных групп. Так, участники первого исследования — это лица от 45 до 74 лет без ранее доказанной ишемической болезни сердца и перенесенного инсульта в анамнезе, во второй работе — это пациенты без анамнеза какого-либо сердечно-сосудистого заболевания в возрасте от 2 лет. В нашем исследовании не обнаружено влияния половой принадлежности на выраженность кальциноза грудного отдела аорты, что может быть обусловлено высокими значениями медианы возраста участников, а также исключением на этапе скрининга женщин, не вступивших в менопаузу.
В ряде публикации продемонстрирован вклад атерогенных форм дислипидемии в развитие кальцификации медиального слоя грудной аорты [9][15]. Однако в бразильском лонгитюдном исследовании здоровья взрослых [5] убедительно продемонстрирована связь гиперлипидемии с кальцификацией коронарных артерий и брюшного отдела аорты, тогда как с поражением грудного отдела аорты взаимосвязь не обнаружена. Надо сказать, что большинство участников этого исследования имели СД, что могло повлиять на результаты. В отдельных публикациях сообщается о связи регулярного приема гиполипидемических препаратов с формированием более выраженного сосудистого кальциноза [18]. Нами обнаружена слабая положительная связь КИ с уровнем липопротеинов низкой плотности при отсутствии регулярной гиполипидемической терапии, что может подтверждать вклад атерогенных фракций липопротеидов в развитие кальцификации грудной аорты у лиц с РАГ и свидетельствовать об актуальности данной проблемы, требующей дальнейшего изучения.
Не вызывает сомнения факт прогрессирования сосудистого кальциноза у лиц с ХБП [19]. Однако в данной работе нами не обнаружена связь КИ со СКФ, что вероятно обусловлено включением в исследование пациентов без существенного снижения функционального почечного статуса, а также тем обстоятельством, что длительный прием антигипертензивной терапии неизбежно вносит вклад в замедление прогрессирования почечной дисфункции [20].
Абсолютное большинство авторов в качестве самого значимого предиктора развития кальцификации грудного отдела аорты признают системное повышение АД. Доказано, что выраженность кальциноза прямо пропорциональна степени повышения АД. Даже при использовании более низких пороговых цифр АД при определении гипертонии согласно рекомендациям Американского колледжа кардиологов/Американской кардиологической ассоциации по АГ 2017г в исследовании с участием 3022 пациентов (медиана возраста 49,4 лет) у лиц с 2 степенью повышения АД в сравнении с лицами с уровнем АД <140/90 мм рт.ст. кальцификация грудного отдела аорты была выше [9], что согласуется с полученными нами результатами.
При этом доказана более сильная корреляция отдельных параметров СМАД в сравнении с клиническим АД с риском развития инфаркта миокарда и инсульта, гипертрофией левого желудочка и ХБП [12][13]. Однако в доступной литературе крайне мало работ, посвящённых изучению взаимосвязи кальцификации грудного отдела аорты с характеристиками суточного профиля АД. Одна из немногих публикаций принадлежит авторам из университета Карабука (Турция), в которой сообщили о наиболее выраженной кальцификации грудного отдела аорты в группе пациентов с нарушением суточного ритма АД по типу non-dipper [21]. В исследовании Jan YT, et al. [9] независимо от САД уровень ПАД предсказывал более высокую вероятность кальцификации грудной аорты. Аналогичные выводы сделаны на основании анализа данных цикла NHANES 2013-2014гг [22]. Общеизвестно, что ПАД является маркером повышенной сосудистой жесткости и фактором риска сердечно-сосудистых событий среди пациентов с гипертонией [23]. В свою очередь, доказана патологическая связь между кальцификацией и жесткостью сосудистой стенки [24][25]. Кальцификация грудного отдела аорты признана суррогатным маркером её жесткости при АГ [21]. Обнаруженная нами положительная связь КИ с ПАД, более сильная в группе неконтролируемой РАГ, может свидетельствовать о вкладе кальцификации грудного отдела аорты в увеличение её жесткости у лиц с РАГ.
Нами также обнаружена связь КИ с величиной утреннего подъема САД. Согласно данным литературы, большинство авторов связывают увеличение величины утреннего подъема с активностью симпатической нервной системы. Однако в исследовании отечественных ученых [26] среди пациентов с АГ в возрасте от 55 до 83 лет утренний подъем САД был выше у пациентов с изолированной систолической АГ, которая, как известно, ассоциируется с повышенной сосудистой жесткостью. В небольшой работе у лиц с впервые выявленной АГ величина утреннего подъема коррелировала со скоростью распространения пульсовой волны — важнейшим показателем жесткости сосудистой стенки [27].
Хорошо изучена взаимосвязь сосудистой жесткости с вариабельностью САД. Так, в исследовании Boardman H, et al. (2017) более высокая вариабельность АД у молодых людей была связана с увеличением жесткости аорты. Обнаруженная нами связь КИ с величиной ПАД и вариабельностью САД может свидетельствовать о вкладе кальцификации в формирование повышенной жесткости аорты у пациентов с РАГ. Поскольку известно, что жесткость аорты является маркером старения сосудов, кальцификация аорты, вероятно, является одновременно следствием и причиной сердечно-сосудистых заболеваний [28], что в контексте настоящего исследования может объяснять недостижение целевого уровня АД у лиц с РАГ.
Таким образом, полученные отличия при сравнении результатов СМАД свидетельствуют о том, что пациенты с неконтролируемой РАГ имеют более неблагоприятный суточный профиль АД, подтверждающий более выраженное ремоделирование сосудистого русла. Выявленные значения КИ, статистически значимо большие в группе неконтролируемой РАГ, согласуются с ранее представленными результатами и могут свидетельствовать о важнейшем вкладе гемодинамического напряжения сосудистой стенки в развитие её кальцификации. Сочетание медианы возраста пациентов 2 группы 62,0 [ 58,0; 66,0] года с величиной ПАД 60,0 [ 55,0; 65,0] мм рт.ст. можно рассматривать как подтверждение более высокого риска сердечно-сосудистых осложнений у лиц с неконтролируемой РАГ.
Заключение
КИ выше в группе пациентов с неконтролируемой РАГ. При недостижении целевого уровня АД у лиц с РАГ отмечаются более высокие значения ПАД, величины утреннего подъема и вариабельности в дневные часы САД, снижение суточного индекса САД. Независимо от контроля АГ КИ положительно связан с вариабельностью САД. КИ положительно связан с ПАД и величиной утреннего подъема и сила связи больше при недостижении целевого уровня АД.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Yuan C, Ni L, Zhang C, et al. Vascular calcification: New insights into endothelial cells. Microvasc Res. 2021;134:104105. doi:10.1016/j.mvr.2020.104105.
2. Desai MY, Cremer PC, Schoenhagen P. Thoracic Aortic Calcification: Diagnostic, Prognostic, and Management Considerations. JACC Cardiovasc Imaging. 2018;11(7):1012-26. doi:10.1016/j.jcmg.2018.03.023.
3. Zhang Y, He D, Zhang W, et al. ACE Inhibitor Benefit to Kidney and Cardiovascular Outcomes for Patients with Non-Dialysis Chronic Kidney Disease Stages 3-5: A Network Meta-Analysis of Randomised Clinical Trials. Drugs. 2020;80(8):797-811. doi:10.1007/s40265-020-01290-3.
4. Poredos P, Poredos P, Jezovnik MK. Structure of Atherosclerotic Plaques in Different Vascular Territories: Clinical Relevance. Curr Vasc Pharmacol. 2018;16(2):125-9. doi:10.2174/1570161115666170227103125.
5. Pedrosa JF, Brant LCC, de Aquino SA, et al. Segmental Evaluation of Thoracic Aortic Calcium and Their Relations with Cardiovascular Risk Factors in the Brazilian Longitudinal Study of Adult Health (ELSA-Brasil). Cells. 2021;10(5):1243. doi:10.3390/cells10051243.
6. Барбараш О.Л., Кашталап В.В., Шибанова И.А. и др. Фундаментальные и прикладные аспекты кальцификации коронарных артерий. Российский кардиологический журнал. 2020;25(3S):4005. doi:10.15829/1560-4071-2020-4005.
7. Егшатян Л. В., Мокрышева Н. Г. Эктопическая кальцификация при хронической болезни почек. Часть 2. Методы диагностики и эффективность. Нефрология. 2018;22(2):50-8. doi:10.24884/1561-6274-2018-22-2-50-58.
8. Tan W, Li X, Zheng S, et al. A Porcine Model of Heart Failure With Preserved Ejection Fraction Induced by Chronic Pressure Overload Characterized by Cardiac Fibrosis and Remodeling. Front Cardiovasc Med. 2021;8:677727. doi:10.3389/fcvm.2021.677727.
9. Jan YT, Tsai PS, Longenecker CT, et al. Thoracic Aortic Calcification and Pre-Clinical Hypertension by New 2017 ACC/AHA Hypertension Guidelines. Diagnostics (Basel). 2021; 11(6):1027. doi:10.3390/diagnostics11061027.
10. Qazi S, Chuang ML. Aortic arch calcification: A simple but powerful marker of subclinical cardiovascular disease. Lancet Reg Health West Pac. 2022;23:100500. doi:10.1016/j.lanwpc.2022.100500.
11. Youssef G, Guo M, McClelland RL, et al. Risk Factors for the Development and Progression of Thoracic Aorta Calcification: The Multi-Ethnic Study of Atherosclerosis. Acad Radiol. 2015;22(12):1536-45. doi:10.1016/j.acra.2015.08.017.
12. Chiriacò M, Pateras K, Virdis A, et al. Association between blood pressure variability, cardiovascular disease and mortality in type 2 diabetes: A systematic review and meta-analysis. Diabetes Obes Metab. 2019;21(12):2587-98. doi:10.1111/dom.13828.
13. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
14. Косматова О.В., Мягкова М.А., Скрипникова И.А. Влияние витамина D и кальция на сердечно-сосудистую систему: вопросы безопасности. Профилактическая медицина. 2020;23(3):140-8. doi:10.17116/profmed202023031140.
15. Lessmann N, de Jong PA, Celeng C, et al. Sex Differences in Coronary Artery and Thoracic Aorta Calcification and Their Association With Cardiovascular Mortality in Heavy Smokers. JACC Cardiovasc Imaging. 2019;12(9):1808-17. doi:10.1016/j.jcmg.2018.10.026.
16. Kälsch H, Mahabadi AA, Moebus S, et al. Association of progressive thoracic aortic calcification with future cardiovascular events and all-cause mortality: ability to improve risk prediction? Results of the Heinz Nixdorf Recall (HNR) study. Eur Heart J Cardiovasc Imaging. 2019;20(6):709-17. doi:10.1093/ehjci/jey173.
17. Craiem D, Alsac JM, Casciaro ME, et al. Association Between Thoracic Aorta Calcium and Thoracic Aorta Geometry in a Cohort of Asymptomatic Participants at Increased Cardiovascular Risk. Rev Esp Cardiol (Engl Ed). 2016;69(9):827-35. doi:10.1016/j.rec.2016.01.031.
18. Zhang X, Li Y, Yang P, et al. Trimethylamine-N-Oxide Promotes Vascular Calcification Through Activation of NLRP3 (Nucleotide-Binding Domain, Leucine-Rich-Containing Family, Pyrin Domain-Containing-3) Inflammasome and NF-κB (Nuclear Factor κB) Signals. Arterioscler Thromb Vasc Biol. 2020;40(3):751-65. doi:10.1161/ATVBAHA.119.313414.
19. Кузьмин О.Б., Бучнева Н.В., Жежа В.В. и др. Неконтролируемая артериальная гипертензия: почка, нейрогормональный дисбаланс и подходы к антигипертензивной лекарственной терапии. Кардиология. 2019;59(12):64-71. doi:10.18087/cardio.2019.12.n547.
20. Zhao JV, Schooling CM. Using Mendelian randomization study to assess the renal effects of antihypertensive drugs. BMC Med. 2021;19(1):79. doi:10.1186/s12916-021-01951-4.
21. Adar A, Onalan O, Cakan F, et al. Aortic Arch Calcification on Routine Chest Radiography is Strongly and Independently Associated with Non-Dipper Blood Pressure Pattern. Arq Bras Cardiol. 2020;114(1):109-17. doi:10.5935/abc.20190229.
22. Heffernan KS, Barreira TV. Association between pulse pressure and aortic calcification: Findings from the National Health and Nutrition Examination Survey 2013-2014. J Clin Hypertens (Greenwich). 2020;22(5):879-85. doi:10.1111/jch.13853.
23. Васюк Ю.А., Иванова С.В., Школьник Е. Л. и др. Согласованное мнение российских экспертов по оценке артериальной жесткости в клинической практике. Кардиоваскулярная терапия и профилактика. 2016;15(2):4-19. doi:10.15829/1728-8800-2016-2-4-19.
24. Ata Korkmaz A, Akyüz AR. Aortic knob calcification and cardioankle vascular index in asymptomatic hypertensive patients. Blood Press Monit. 2017;22(1):8-11. doi:10.1097/MBP.0000000000000221.
25. Guo J, Fujiyoshi A, Willcox B, et al. Increased Aortic Calcification Is Associated With Arterial Stiffness Progression in Multiethnic Middle-Aged Men. Hypertension.2017;69(1):102-8. doi:10.1161/HYPERTENSIONAHA.116.08459.
26. Ларина В.Н., Федорова Е. В., Кульбачинская О.М. Утренний подъем артериального давления: обзор отечественной и зарубежной литературы. Лечебное дело. 2019;3:66-72. doi:10.24411/2071-5315-2019-12143.
27. Kıvrak A, Özbiçer S, Kalkan GY, et al. Morning blood pressure surge and arterial stiffness in newly diagnosed hypertensive patients. Blood Press. 2017;26(3):181-90. doi:10.1080/08037051.2017.1278678.
28. Boardman H, Lewandowski AJ, Lazdam M. Aortic stiffness and blood pressure variability in young people: a multimodality investigation of central and peripheral vasculature. J Hypertens. 2017;35(3):513-22. doi:10.1097/HJH.0000000000001192.
Об авторах
Л. А. ХаишеваРоссия
Хаишева Лариса Анатольевна — д.м.н., профессор кафедры терапии.
Ростов-на-Дону
Конфликт интересов:
Нет
М. С. Литвинова
Россия
Литвинова Марина Сергеевна — к.м.н., ассистент кафедры терапии.
Ростов-на-Дону
Конфликт интересов:
Нет
Дж. А. Умугванеза
Франция
Умугванеза Джозеф Айне — сотрудник.
Жуар, Seine-et-Marne
Конфликт интересов:
Нет
К. А. Хаишев
Россия
Хаишев Кирилл Артурович — сотрудник.
Ростов-на-Дону
Конфликт интересов:
Нет
Дополнительные файлы
- Пациенты с неконтролируемой резистентной артериальной гипертензией в сравнении с пациентами, достигшими целевого уровня артериального давления, отличаются более выраженной кальцификацией грудного отдела аорты.
- Кальциевый индекс коррелирует с отдельными параметрами суточного мониторирования артериального давления, что может свидетельствовать о вкладе кальцификации грудного отдела аорты в прогрессирование резистентной артериальной гипертензии.
Рецензия
Для цитирования:
Хаишева Л.А., Литвинова М.С., Умугванеза Д.А., Хаишев К.А. Кальцификация грудного отдела аорты у пациентов с резистентной артериальной гипертензией. Российский кардиологический журнал. 2025;30(7):6226. https://doi.org/10.15829/1560-4071-2025-6226. EDN: TPGKMB
For citation:
Khaisheva L.A., Litvinova M.S., Umugwaneza J.A., Khaishev K.A. Thoracic aortic calcification in patients with resistant hypertension. Russian Journal of Cardiology. 2025;30(7):6226. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6226. EDN: TPGKMB
JATS XML

















































