Перейти к:
Бивентрикулярная гипертрофическая кардиомиопатия с мутацией в генах ACTC1 и LDB3, результаты первичной профилактики внезапной сердечной смерти. Клинический случай
https://doi.org/10.15829/1560-4071-2025-6224
EDN: LMUMJJ
Аннотация
Введение. Гипертрофическая кардиомиопатия (ГКМП) значительно увеличивает риск внезапной сердечной смерти (ВСС), особенно у пациентов молодого возраста. Семейные формы ГКМП требуют индивидуального подхода в отношении стратификации риска и определения показаний к первичной профилактике ВСС.
Краткое описание. В данном клиническом случае описано наблюдение за пациентом с редкой генетической аномалией (сочетание мутаций генов ACTC1 и LDB3), у которого благодаря своевременной диагностике были определены показания к имплантации кардиовертера-дефибриллятора, что позволило купировать эпизод фибрилляции желудочков (ФЖ). В клиническом случае описана динамика эхокардиографических параметров пациента, морфологические особенности (бивентрикулярная гипертрофия миокарда, миокардиальный мостик), а также особенности течения заболевания, терапевтические подходы и результаты лечения за 6 лет наблюдения.
Обсуждение. Тщательная стратификация риска ВСС, включая оценку семейного анамнеза, постоянное наблюдение с динамическим проведением эхокардиографии и холтеровского мониторирования электрокардиограммы, позволила своевременно имплантировать кардиовертер-дефибриллятор и своевременно купировать ФЖ. Профилактические меры, преемственность между стационарным и амбулаторным этапами сохранили жизнь пациенту, улучшили прогноз и замедлили прогрессирование гипертрофии левого желудочка. Редкий генетический вариант ГКМП с мутациями в генах ACTC1 и LDB3 описан всего в трех случаях за 5 лет, что подчеркивает научную значимость данного клинического случая. Сочетание бивентрикулярной гипертрофии, миокардиального мостика и эпизодов желудочковой тахикардии и ФЖ может быть связано с данным генотипом, что требует дальнейшего изучения с целью улучшения стратегий управления рисками ВСС.
Ключевые слова
Для цитирования:
Ларина В.Н., Варламова Ю.Ю., Скиба А.С., Скиба И.К. Бивентрикулярная гипертрофическая кардиомиопатия с мутацией в генах ACTC1 и LDB3, результаты первичной профилактики внезапной сердечной смерти. Клинический случай. Российский кардиологический журнал. 2025;30(5S):6224. https://doi.org/10.15829/1560-4071-2025-6224. EDN: LMUMJJ
For citation:
Larina V.N., Varlamova Yu.Yu., Skiba A.S., Skiba I.K. Biventricular hypertrophic cardiomyopathy with ACTC1 and LDB3 mutations, results of primary prevention of sudden cardiac death: а case report. Russian Journal of Cardiology. 2025;30(5S):6224. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6224. EDN: LMUMJJ
Введение
Гипертрофическая кардиомиопатия (ГКМП) — это аутосомно-доминантное заболевание сердца, вызываемое мутациями в генах саркомера и связанных с саркомерами белков, кодирующих элементы сократительного аппарата сердца. Характерные структурные изменения сердца включают гипертрофию левого желудочка (ГЛЖ), которая может привести к обструкции выносящего тракта левого желудочка (ВТЛЖ), в т. ч. динамической, диастолической дисфункции, ишемии миокарда, нарушениям ритма и вторичной митральной регургитации. Имеются данные, что ГКМП является наиболее распространенной установленной причиной внезапной сердечной смерти (ВСС) у здоровых людей в возрасте моложе 35 лет, включая людей со спортивным сердцем [1]. Распространенность ГКМП среди населения в целом в мире составляет 0,2% (1 из 500 взрослых), исходя из данных эхокардиографических (ЭхоКГ) исследований [2]. Изменения морфологии сердца встречаются у порядка 25% родственников пациентов с ГКМП и выявляются чаще у мужчин, хотя заболевание наследуется аутосомно-доминантным путем и не имеет генетически обоснованной половой принадлежности [3]. Наиболее часто ГКМП диагностируется в течение первых трех десятилетий жизни, однако может выявляться в любом возрасте, в т. ч. в пожилом. У 60% пациентов с ГКМП удается установить генную мутацию саркомера, в связи с чем сбор подробного семейного анамнеза является важным аспектом в стратификации риска у пациентов с данным заболеванием. Тщательный сбор анамнеза и оценка физикального статуса могут также помочь определить пациентов с высоким риском фатальных нарушений ритма. Наиболее частыми проявлениями ГКМП являются усталость, одышка, боль в области грудной клетки, ощущение сердцебиения и синкопальные состояния [4]. Раннее начало медикаментозной терапии, имплантация кардиовертера-дефибриллятора и проведение оперативного лечения в случае наличия показаний значительно улучшают показатели выживаемости при ГКМП за последние несколько десятилетий [5]. Неполная пенетрантность и изменчивая экспрессия мутировавших генов могут вызывать непредсказуемые проявления ассоциированных с ГКМП генов даже в пределах одной семьи. Среди всех пациентов с установленным диагнозом ГКМП, с положительным результатом молекулярно-генетического исследования наиболее часто выявляются мутации в гене тяжелой цепи β-миозина 7 (MYH7) и миозин-связывающего белка C3 (MYBPC3), которые в сумме составляют ~75% случаев. Реже встречаются мутации тонких филаментных протеинов, таких как тропонин T, тропонин I, легких цепей миозина и актина. Мутации TNNI3, TNNT2, TPM1, MYL2, MYL3 и ACTC1 выявляются у наименьшей доли пациентов, от 1% до 5%. На текущий момент нет данных, указывающих на связь между прогнозом и конкретной мутацией гена [6][7].
Осложнения ГКМП, такие как нарушения ритма, хроническая сердечная недостаточность, относительная коронарная недостаточность обусловливают высокий риск развития неблагоприятных сердечно-сосудистых событий. Учитывая преимущественно молодой возраст первичного выявления ГКМП, необходимость наблюдения взрослых пациентов, а также наличие современных эффективных методов коррекции сердечно-сосудистого риска, коллективу авторов представляется актуальным повышение осведомленности врачей о данном заболевании и о современных подходах к ведению данной группы пациентов на практическом примере.
Клинический случай
Информация о пациенте. Пациент, 22 года, предъявляет жалобы на эпизоды потери сознания, одышку при подъеме по лестнице на 3 этаж, давящую боль в грудной клетке слева, головокружение, потемнение в глазах, возникающие при физической нагрузке и проходящие в покое самостоятельно.
Анамнез заболевания. Дебют заболевания в 15 лет, когда у пациента впервые появились неспецифические жалобы на плохую переносимость душных помещений, повышенную утомляемость, слабость, одышку при умеренной физической нагрузке. Пациент был обследован амбулаторно, выполнена ЭхоКГ, по данным которой было установлено, что у пациента имеются признаки гипертрофии базального отдела межжелудочковой перегородки (МЖП) до 14,5 мм, признаков обструкции ВТЛЖ не выявлено. Было рекомендовано наблюдение у детского кардиолога, контроль ЭхоКГ в динамике. Через полгода у пациента впервые произошла потеря сознания, которая развилась на фоне физической нагрузки, в связи с чем он был госпитализирован в детское кардиологическое отделение в 2018г в возрасте 16 лет. Изучен семейный анамнез. Дед пробанда по линии матери умер внезапно в 33 года, страдал заболеванием сердца, каким — неизвестно, дед пробанда по отцовской линии умер в 62 года во сне, отец ребенка внезапно умер в 41 год, причина неизвестна, мать имеет установленный диагноз ГКМП. При поступлении на электрокардиограмме (ЭКГ) был зарегистрирован эктопический предсердный ритм с частотой сердечных сокращений (ЧСС) 51 в 1 мин. При физикальном обследовании был выявлен систолический шум с максимальной интенсивностью в V точке аускультации. По данным лабораторных исследований было выявлено повышение уровня N-концевого промозгового натрийуретического пептида (NT-proBNP) до 170 пг/мл. По данным ЭхоКГ, выполненной в стационаре, выявлены признаки ассиметричной ГЛЖ, максимально — в средней трети МЖП (до 27 мм). Толщина МЖП в базальном отделе 14 мм, толщина задней стенки в базальном отделе 10 мм, в средней трети 11 мм. Также были выявлены признаки диастолической дисфункции левого желудочка (ЛЖ) по 2 типу, правого желудочка (ПЖ) — по 1 типу. Выполнено нагрузочное тестирование, на ЭКГ после выполнения физической нагрузки регистрировался синусовый ритм с ЧСС 90 уд./мин, отмечено незначительное удлинение QTc. Учитывая выраженную гипертрофию, признаки субэндокардиальной ишемии миокарда, а также необструктивный характер кардиомиопатии, принято решение о назначении кардиопротективной терапии блокаторами кальциевых каналов (верапамил) в стартовой дозе 40 мг/сут. Принимая во внимание отсутствие у пациента зарегистрированных эпизодов неустойчивой желудочковой тахикардии (ЖТ), толщину МЖП <30 мм, а также отрицательный результат пробы с физической нагрузкой, абсолютных показаний для имплантации кардиовертера-дефибриллятора (ИКД) на момент госпитализации не выявлено. Пятилетний риск ВСС по калькулятору HCM Risk-SCD был оценен в 4,2% (промежуточный риск). Пациенту было рекомендовано наблюдение у кардиолога по месту жительства, ограничение физических нагрузок, проведение генетического тестирования, магнитно-резонансной томографии сердца и прием рекомендованной медикаментозной терапии.
При проведении молекулярно-генетического тестирования были выявлены мутации в генах ACTC1 и LDB3, а также обследован родной брат пациента, у которого также выявлены мутации в генах белков саркомера и ГЛЖ. Составлено генетическое дерево (рис. 1).
При амбулаторном наблюдении в течение трех лет значительной динамики состояния не отмечалось. По данным ЭхоКГ в 2019-2020гг выявлено нарастание толщины МЖП до 31 мм, а также отрицательная лабораторная динамика, в виде увеличения уровня NT-proBNP до 244 пг/мл. По данным холтеровского мониторирования ЭКГ (ХМЭКГ) 2019-2020гг значимых эпизодов нарушения ритма выявлено не было. Пятилетний риск ВСС по калькулятору HCM Risk-SCD сохранялся на уровне 4,0-4,1% (промежуточный риск). Наблюдение было продолжено, медикаментозная терапия не корректировалась. В конце 2020г пациент перенес коронавирусную инфекцию, заболевание протекало в легкой форме, без осложнений.
В марте 2021г, в возрасте 19 лет по результатам ХМЭКГ был зарегистрирован эпизод ЖТ, была рекомендована госпитализация с целью имплантации ИКД. Перед оперативным вмешательством было проведено обследование, по результатам которого выявлено нарастание толщины МЖП до 32 мм, толщины стенки ПЖ до 9 мм, а также увеличение уровня NT-proBNP до 680 пг/мл. Пятилетний риск ВСС составил 9,5% (высокий), в связи с чем пациенту был имплантирован ИКД (Medronic Evera MRI S VR Sure Scan). Рекомендована терапия: метопролол 100 мг 1 раз/сут., торасемид 2,5 мг/сут., эплеренон 50 мг/сут. Рекомендована плановая проверка работы ИКД через 1 год.
Через 2 мес. после имплантации ИКД у пациента появились жалобы на дискомфорт в области грудной клетки, которые не были связаны с физической нагрузкой и не сопровождались какими-либо изменениями на ЭКГ. От проведения нагрузочных проб в амбулаторных условиях было принято решение воздержаться.
В мае 2022г у пациента во время физической нагрузки (бег) развился эпизод потери сознания. За помощью пациент не обращался, однако при плановой проверке ИКД был выявлен эпизод фибрилляции желудочков (ФЖ), который был купирован разрядом дефибриллятора 36J, в связи с чем пациент был госпитализирован в отделение кардиохирургии с целью обследования, корректировки терапии и настройки работы ИКД.
При обследовании не было выявлено признаков обструкции ВТЛЖ в покое, при нагрузочном тестировании была зарегистрирована незначительная динамическая обструкция ВТЛЖ, однако показаний для оперативного лечения на момент госпитализации выявлено не было. Выполнено перепрограммирование ИКД: уменьшена чувствительность по желудочковому каналу до 0,4 мВ, проведена коррекция параметров детекции ФЖ в сторону увеличения ЧСС от 200 уд./мин, укорочения времени детекции до 18/24 циклов, частота детекции ЖТ увеличена от 150 уд./мин. Медикаментозная терапия была скорректирована: отменен торасемид, назначен валсартан 40 мг 1 раз/сут. Амиодарон был рассмотрен к назначению, однако в связи с отсутствием жизнеугрожающих нарушений ритма, желудочковой экстрасистолией высокой градации по Lown-Wolf по данным ХМЭКГ, молодым возрастом пациента, а также наличием ИКД от назначения амиодарона было принято решение отказаться. Рекомендована плановая госпитализация с целью проведения компьютерной томографии (КТ) коронарных артерий.
Через 3 мес. пациент был госпитализирован в плановом порядке. В связи с наличием жалоб на дискомфорт в области грудной клетки, невозможностью полностью исключить ишемию миокарда, было принято решение о проведении КТ-ангиографии коронарных артерий. По результатам КТ был выявлен миокардиальный мостик по ходу передней межжелудочковой артерии. При выписке пациенту рекомендована консультация кардиохирурга, медикаментозная терапия осталась без изменений. Согласно консультации кардиохирурга, пациенту предложено дальнейшее наблюдение. Динамика клинически значимых показателей пациента на временной шкале представлена на рисунке 2.
Дифференциальная диагностика. Дифференциальная диагностика проводилась между ГКМП и ГЛЖ вторичного происхождения (артериальная гипертензия, спортивное сердце). Диагноз ГКМП в данном случае представляется наиболее вероятным ввиду наличия ГЛЖ >1,5 см и данных молекулярно-генетического тестирования, а также асимметрии толщины миокарда сегментов МЖП и передней стенки ЛЖ с преобладанием утолщения МЖП; молодого возраста пациента; уменьшенного объема полости ЛЖ; наличия диастолической дисфункции ЛЖ. На основании жалоб, данных анамнеза, инструментальных и лабораторных исследований был установлен клинический диагноз.
Основной диагноз: Необструктивная форма асимметричной ГКМП, семейная форма (мутация в генах ACTC1 и LDB3). Миокардиальный мостик по ходу передней межжелудочковой артерии. Нарушение ритма сердца: Эпизод ФЖ от 24.05.2022, купированный разрядом дефибриллятора 36J. Неустойчивая ЖТ. Имплантация ИКД от 2022г.
Осложнение основного диагноза: Хроническая сердечная недостаточность IIА стадии с сохраненной фракцией выброса ЛЖ (60%), I функционального класса по NYHA.
Исход и последующее наблюдение. В процессе лечения уменьшилась выраженность одышки, ангинозные приступы на фоне умеренной физической нагрузки прекратились, достигнут максимальный терапевтический эффект. При дальнейшем наблюдении отмечалась положительная динамика в виде уменьшения толщины МЖП, стенки ПЖ до 27 и 7 мм, соответственно. Отмечается нарастание уровня NT-proBNP. Пациент в настоящее время наблюдается у кардиолога, от оперативного лечения миокардиального мостика отказывается в связи с отсутствием жалоб. На ЭКГ без динамики (ритм синусовый, нормальное положение электрической оси сердца, признаки ГЛЖ, депрессия сегмента ST в отведениях II, III, AVF, V4-V6 до 1-2 мм, отрицательные Т глубиной от 2 до 6 мв; (+/-) Т в отведениях V3-V4) (рис. 3). По данным плановых проверок ИКД и ХМЭКГ за последние 2 года не было зарегистрировано ни одного эпизода жизнеугрожающих нарушений ритма сердца.
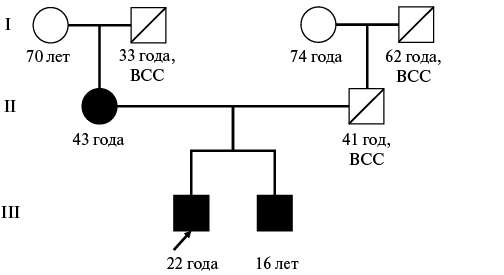
Рис. 1. Генетическое дерево.
Сокращение: ВСС — внезапная сердечная смерть.
Первые жалобы | Госпитализация | COVID-19 | Эпизод ЖТ по ХМЭКГ Имплантация ИКД | Впервые жалобы на дискомфорт в области ГК | СинкопеЭпизод ФЖ, купированный ИКД | КАГ, выявлен миокардиальный мостик | ||
ФВ ЛЖ | 57% | 58% | 57% | 59% | 59% | 62% | 57% | 60% |
ТМЖП | 14,5 | 27 | 31 | 31 | 32 | 31 | 31 | 27 |
ТПЖ | N | 8 | 8 | 8 | 9 | 9 | 9 | 7 |
ГД ВТЛЖ | N | N | 34 | 34 | 38 | 33 | 28 | 30 |
ГД ВТПЖ | N | N | N | N | N | N | N | N |
NT-proBNP | н/д | 168 | 244 | н/д | 680 | 544 | 1366 | 1833 |
ТШХ | н/д | 575 | н/д | н/д | 480 | н/д | н/д | 515 |
Терапия | нет | Верапамил | н/д | н/д | Метопролол Торасемид Эплеренон | Метопролол Торасемид Эплеренон | Метопролол Валсартан Эплеренон | Метопролол Валсартан Эплеренон |
06.2017 | 03.2018 | 03.2019 | 2020 | 03.2021 | 05.2021 | 05.2022 | 08.2022 |
Рис. 2. Временная шкала.
Сокращения: ГД ВТЛЖ — градиент давления в выносящем тракте левого желудочка, ГД ВТПЖ — градиент давления в выносящем тракте правого желудочка, ГК — грудная клетка, ЖТ — желудочковая тахикардия, ИКД — имплантируемый кардиовертер-дефибриллятор, КАГ — коронароангиография, н/д — нет данных, ТМЖП — толщина межжелудочковой перегородки, ТПЖ — толщина правого желудочка, ТШХ — тест шестиминутной ходьбы, ХМЭКГ — холтеровское мониторирование электрокардиограммы, ФВ ЛЖ — фракция выброса левого желудочка, ФЖ — фибрилляция желудочков, N — норма, NT-proBNP — N-концевой промозговой натрийуретический пептид.
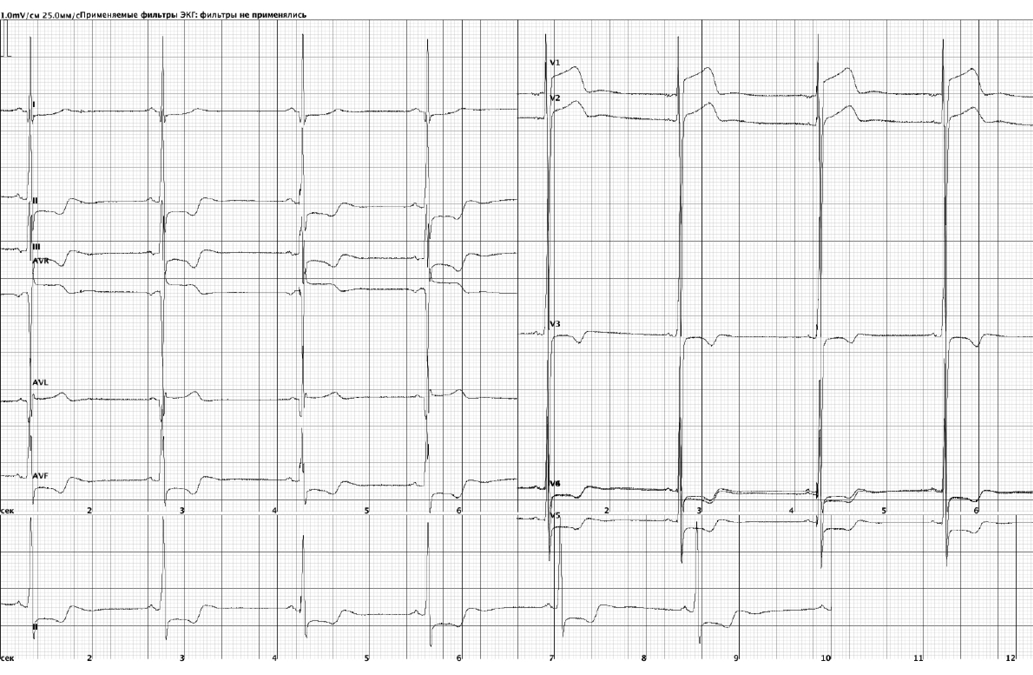
Рис. 3. ЭКГ.
Обсуждение
Несмотря на успешную первичную профилактику ВСС в данном клиническом примере, по данным отечественных авторов, в российской популяции частота ВСС остается высокой и превышает таковую в западных популяциях примерно в 2 раза [8]. На сегодняшний день опубликовано значительное количество работ, посвященных ГКМП, но данные по конкретным генотипическим вариантам заболевания ограниченны [9]. Для данного клинического случая примечательным является генетический вариант ГКМП. Мутации в генах ACTC1 и LDB3 являются редкими, а в научной литературе за последние 5 лет описано всего три клинических случая с данной генетической аномалией, что обусловливает значимость этого случая для научного сообщества. Сочетание гипертрофии ЛЖ и ПЖ, наличие миокардиального мостика, эпизоды ЖТ и ФЖ могут быть связаны с генетическим вариантом заболевания. Основной задачей в ведении данного пациента стала динамическая оценка риска ВСС, который до момента регистрации ЖТ по данным ХМЭКГ оставался промежуточным. Назначение медикаментозной терапии позволило несколько уменьшить данный риск, однако, с учетом всех имевшихся данных, оперативное лечение для данного пациента было единственной возможностью существенно повлиять на прогноз заболевания. Требуется более тщательное изучение особенностей течения ГКМП с данным генотипом для формирования лучших стратегий по управлению рисками у данной группы пациентов.
Заключение
Данный клинический случай демонстрирует течение ГКМП, развившейся в детском возрасте и наблюдаемой в течение нескольких лет врачом-кардиологом взрослым. Стратификация риска ВСС, в т. ч. тщательная оценка семейного анамнеза, динамическое наблюдение с выполнением ЭхоКГ, ХМЭКГ позволила своевременно определить показания к имплантации ИКД и купировать такое грозное осложнение ГКМП, как ФЖ. Профилактические мероприятия позволили сохранить пациенту жизнь, улучшить прогноз, а также затормозить и даже несколько уменьшить прогрессирование ГЛЖ, что позволяет предотвратить, или, по крайней мере, отложить на более поздний срок необходимость оперативного лечения. Не последнюю роль в судьбе данного пациента сыграла преемственность между стационарным и амбулаторным этапами лечения, которая позволила вовремя направить пациента на оперативное лечение, а также проводить в дальнейшем динамическую оценку параметров гемодинамики и сердечного ритма.
Информированное согласие. От пациента получено письменное добровольное информированное согласие на публикацию результатов обследования и лечения (дата подписания 10.10.2024).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Czimbalmos C, Csecs I, Toth A, et al. The demanding grey zone: Sport indices by cardiac magnetic resonance imaging differentiate hypertrophic cardiomyopathy from athlete's heart. PLoS One. 2019;14(2):e0211624. doi:10.1371/journal.pone.0211624.
2. Maron BJ, Rowin EJ, Maron MS. Global Burden of Hypertrophic Cardiomyopathy. JACC Heart Fail. 2018;6(5):376-8. doi:10.1016/j.jchf.2018.03.004.
3. Patel N, Shetty NS, Pampana A, et al. Sex-Associated Differences in Clinical Outcomes After Septal Reduction Therapies in Hypertrophic Cardiomyopathy. Mayo Clin Proc. 2024;99(12):1933-44. doi:10.1016/j.mayocp.2024.05.026.
4. Engel TR. Diagnosis of Hypertrophic Cardiomyopathy: Who Is in Charge Here-The Physician or the Computer? J Am Coll Cardiol. 2020;75(7):734-5. doi:10.1016/j.jacc.2019.12.028.
5. Liu Q, Li D, Berger AE, et al. Survival and prognostic factors in hypertrophic cardiomyopathy: a meta-analysis. Sci Rep. 2017;7(1):11957. doi:10.1038/s41598-017-12289-4.
6. Салахов Р.Р., Голубенко М.В., Павлюкова Е.Н. и др. Опыт молекулярно-генетической диагностики гипертрофической кардиомиопатии с использованием нанопорового секвенирования ДНК. Российский кардиологический журнал. 2021;26(10):4673. doi:10.15829/1560-4071-2021-4673.
7. Габрусенко С.А., Гудкова А.Я., Козиолова Н.А. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
8. Давыдова В. Г., Гудкова А.Я., Крутиков А. Н. др. Клинические, морфологические и генетические характеристики пациентов молодого возраста с гипертрофической кардиомиопатией, имеющих показания к имплантации кардиовертера-дефибриллятора. Российский кардиологический журнал. 2024;29(11):5994. doi:10.15829/1560-4071-2024-5994.
9. Андреева С.Е., Марусова М.О., Борцова М.А. и др. Семейная форма гипертрофической кардиомиопатии со среднежелудочковой обструкцией на фоне вариантов в генах MYH7, FHOD3 и BAG3: клинический случай. Российский кардиологический журнал. 2024;29(10S):6146. doi:10.15829/1560-4071-2024-6146.
Об авторах
В. Н. ЛаринаРоссия
д.м.н., профессор, зав. кафедрой поликлинической терапии института клинической медицины
Москва
Конфликт интересов:
Нет
Ю. Ю. Варламова
к.м.н., зав. кардиологическим отделением
Москва
Конфликт интересов:
Нет
А. С. Скиба
Россия
ассистент кафедры поликлинической терапии лечебного факультета
Москва
Конфликт интересов:
Нет
И. К. Скиба
Россия
аспирант кафедры поликлинической терапии лечебного факультета
Москва
Конфликт интересов:
Нет
Дополнительные файлы

|
1. Презентация случая | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(824KB)
|
Метаданные ▾ | |
- Стратификация риска внезапной сердечной смерти, сбор семейного анамнеза, оценка эхокардиографических параметров и данных суточного мониторирования электрокардиограммы в динамике является ключевой задачей в профилактике фатальных нарушений ритма у молодых пациентов.
- Сочетание мутаций генов ACTC1и LDB3 может быть ассоциировано с бивентрикулярной гипертрофией миокарда и миокардиальным мостиком, что требует подтверждения с участием большего числа наблюдений.
Рецензия
Для цитирования:
Ларина В.Н., Варламова Ю.Ю., Скиба А.С., Скиба И.К. Бивентрикулярная гипертрофическая кардиомиопатия с мутацией в генах ACTC1 и LDB3, результаты первичной профилактики внезапной сердечной смерти. Клинический случай. Российский кардиологический журнал. 2025;30(5S):6224. https://doi.org/10.15829/1560-4071-2025-6224. EDN: LMUMJJ
For citation:
Larina V.N., Varlamova Yu.Yu., Skiba A.S., Skiba I.K. Biventricular hypertrophic cardiomyopathy with ACTC1 and LDB3 mutations, results of primary prevention of sudden cardiac death: а case report. Russian Journal of Cardiology. 2025;30(5S):6224. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6224. EDN: LMUMJJ
JATS XML

















































