Перейти к:
Полиморфизм генов PPARG, AGTR1, VEGF-A: частота и связь с фенотипами ожирения
https://doi.org/10.15829/1560-4071-2025-6176
EDN: YFULAZ
Аннотация
Цель: Оценить связь частоты аллелей и генотипов однонуклеотидных полиморфизмов rs1801282 гена рецептора, активируемого пероксисомными пролифераторами гамма (PPARG), rs5186 гена рецептора ангиотензина II 1 типа (AGTR1), rs699947 гена фактора роста эндотелия сосудов (VEGF-A) у пациентов с различными фенотипами абдоминального (АО) и эктопического (ЭО) ожирения.
Материалы и методы: В кросс-секционное исследование были включены 100 пациентов европеоидной расы (47 мужчин, 53 женщины, медиана возраста 58,5 [50;69] лет). Всем пациентам была выполнена компьютерная томография грудной клетки и забрюшинного пространства с расчетом объемов периваскулярной жировой ткани Цель. Оценить связь частоты аллелей и генотипов однонуклеотидных полиморфизмов rs1801282 гена рецептора, активируемого пероксисомными пролифераторами гамма (PPARG), rs5186 гена рецептора ангиотензина II 1 типа (AGTR1), rs699947 гена фактора роста эндотелия сосудов (VEGF-A) у пациентов с различными фенотипами абдоминального (АО) и эктопического (ЭО) ожирения. Материал и методы. В кросс-секционное исследование были включены 100 пациентов европеоидной расы (47 мужчин, 53 женщины, медиана возраста 58,5 [50;69] лет). Всем пациентам была выполнена компьютерная томография грудной клетки и забрюшинного пространства с расчетом объемов периваскулярной жировой ткани (ЖТ) (ПВЖТ), перикардиальной ЖТ (ПКЖТ) и толщины паранефральной ЖТ (ПНЖТ). Объем ПКЖТ ≥3,2 см3, объем ПВЖТ ≥0,4 см3, толщину ПНЖТ ≥1,91 см считали критериями перикардиального (ПКО), периваскулярного (ПВО) и паранефрального (ПНО) ожирения. Всем пациентам идентифицировали аллели и генотипы полиморфных маркеров генов-кандидатов. Результаты. В распределении генотипов полиморфного маркера rs5186 гена AGTR1 обнаружена статистическая значимость (p=0,014) между группой с любым вариантом ожирения и пациентами без ожирения; распределение генотипов отличалось от равновесия Харди-Вайнберга (РХВ) в группах ЭО (p=0,0009) и смешанного ожирения (p=0,05). В отношении маркера rs699947 гена VEGF-A в группах ЭО, АО и ЭО+АО, с любым вариантом ожирения выявлено статистически значимое увеличение частоты мутантного аллеля С (62,5%, 50%, 46,3%, 47,75%, соответственно) по сравнению с группой без ожирения (40%) (χ2=10,806; p=0,013). Отклонение частоты генотипов от РХВ в отношении rs699947 гена VEGF-A было обнаружено в группе ЭО (p<0,0001). Заключение. Полученные нами данные позволяют предположить, что однонуклеотидные полиморфизмы rs1801282 гена PPARG, rs5186 гена AGTR1, rs699947 VEGF-A могут иметь связь с распределением ЖТ в организме и быть маркерами различных фенотипов ЭО и АО. Проверка выдвинутой нами гипотезы требует дополнительных исследований с включением выборок большего размера и групп сравнения.
Ключевые слова
Для цитирования:
Брагина А.Е., Васильченко М.К., Родионова Ю.Н., Осадчий К.К., Муравлев А.П., Воронков М.А., Александрова Е.А., Подзолков В.И. Полиморфизм генов PPARG, AGTR1, VEGF-A: частота и связь с фенотипами ожирения. Российский кардиологический журнал. 2025;30(3):6176. https://doi.org/10.15829/1560-4071-2025-6176. EDN: YFULAZ
For citation:
Bragina A.E., Vasilchenko M.K., Rodionova Yu.N., Osadchiy K.K., Muravlev A.P., Voronkov M.A., Aleksandrova E.A., Podzolkov V.I. Polymorphism of the PPARG, AGTR1, VEGF-A genes: frequency and association with obesity phenotypes. Russian Journal of Cardiology. 2025;30(3):6176. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6176. EDN: YFULAZ
Ожирение является одним из основных факторов риска сердечно-сосудистых (ССЗ), онкологических и других неинфекционных заболеваний. На данный момент распространенность ожирения во взрослой популяции сравнима с масштабами пандемии [1]. Особый интерес представляет изучение висцерального ожирения как независимого маркера ССЗ и выраженных метаболических нарушений [2]. По мере накопления данных о распределении жировой ткани в организме стало очевидным, что вклад различных фенотипов ожирения (как эктопического (ЭО), так и ожирения в целом) в повышение кардиометаболического риска неравнозначен и представляет собой более сложный процесс, чем предполагалось ранее. В субисследовании Framingham Heart Study [3], а также в нашем исследовании на российской популяции [4][5] продемонстрировано, что наличие эктопических жировых депо не всегда сочетается с наличием ожирения в целом. Выявленная диссоциация формирует интерес к изучению распределения жировой ткани в организме, а также влияния генетических/эпигенетических факторов на данный процесс.
Крупнейшие генетические исследования о распределении жировой ткани на данный момент основаны на данных UK Biobank, наиболее крупномасштабной биомедицинской базе данных и исследовательском ресурсе, содержащем подробную генетическую и медицинскую информацию [6]. В исследовании Agrawal S, et al. (2022), включившем 38965 участников UK Biobank с доступными массивами генотипов и показателями висцеральной и подкожной жировой ткани, была изучена генетическая архитектура распределения жира, независимо от конституциональных особенностей [7]. В результате из 250 идентифицированных локусов выделили 54 однонуклеотидных полиморфизма, которые были связаны с отложениями жировой ткани в области бедер и ягодиц [7]. Следует обратить внимание, что хотя вопросы распределения жировой ткани обсуждаются в современной литературе, исследований, посвященных оценке вклада полиморфизмов различных генов непосредственно в распределение эктопической жировой ткани, до сих пор не проводилось.
Среди генов и их полиморфизмов, представляющих интерес в отношении различных фенотипов ожирения и распределения жировой ткани, можно выделить ген рецептора, активируемого пероксисомными пролифераторами гамма (PPARG). В исследовании Agrawal S, et al. (2022) показана связь полиморфизма rs527620413 с увеличением абдоминальной подкожной жировой ткани с поправкой на индекс массы тела (ИМТ) (beta=0,071; p=6,8×10⁻¹¹), полиморфизма rs71304101 с увеличением жира в бедренно-ягодичной области с поправкой на ИМТ (beta=0,062; p=1,7×10⁻⁹), а также полиморфизма rs17036328 со снижением отношения висцеральная/абдоминальная подкожная жировая ткань (beta=-0,058; p=2,4×10⁻⁸) [7]. При этом в литературе имеются данные об экспрессии гена PPARG в эктопических жировых депо. Так, в исследовании Пантелеевой А. А. и др. (2021) было продемонстрировано, что уровень мРНК PPARG в эпикардиальной жировой ткани пациентов с ишемической болезнью сердца имел тенденцию к повышению в группе с абдоминальным ожирением (АО) по сравнению с группой без АО [8].
Среди генов-кандидатов для изучения распределения жира в организме может обсуждаться ген фактора роста эндотелия сосудов (VEGF-A). Так, в метаанализе Heid IM, et al. (2010), включившем 32 исследования GWAS (полногеномный поиск ассоциаций) и 77167 участников, а также дополнительные 29 исследований с 113636 участниками, было продемонстрировано, что VEGF-A, принимающий участие в ангиогенезе, связан с половым диморфизмом распределения жировой ткани [9]. Кроме того, данный ген входит в 14 идентифицированных в данном исследовании локусов, которые взаимосвязаны с индексом окружность талии/окружность бедер (ОТ/ОБ) [9].
Учитывая роль ренин-ангиотензин-альдостероновой системы в патогенезе ожирения, становится очевидной необходимость изучения вклада полиморфизма генов, ответственных за функционирование данной системы, в особенности, распределения жировой ткани. Имеются работы, в которых описаны ассоциации полиморфизмов генов ренин-ангиотензин-альдостероновой системы с развитием ряда ССЗ, а в контексте изучения ожирения одним из генов-кандидатов, представляющих интерес для изучения, является ген рецептора ангиотензина II 1 типа (AGTR1) [10][11]. Однако в перечисленных работах не проводился анализ взаимосвязи полиморфизмов генов с особенностями распределения эктопической жировой ткани.
В связи с чем целью данной работы стала оценка связи частоты аллелей и генотипов однонуклеотидных полиморфизмов rs1801282 гена PPARG, rs5186 гена AGTR1, rs699947 VEGF-A у пациентов с различными фенотипами АО и ЭО.
Материал и методы
В кросс-секционное исследование были включены 100 пациентов европеоидной расы, госпитализированных и обследованных в Университетской клинической больнице № 4 ФГАОУ ВО Первого МГМУ им. И. М. Сеченова (Сеченовский Университет) с февраля по сентябрь 2023г. Всеми пациентами было подписано добровольное информированное письменное согласие на участие в исследовании.
Критериями включения в исследование были: возраст старше 18 лет, наличие подписанного информированного согласия на участие в исследовании. Исследование проводилось в соответствии с Хельсинкской декларацией о правах человека. Проведение исследования одобрено на заседании Локального этического комитета от 08.12.2022 (протокол № 25-22).
Критериями невключения были: симптоматическая артериальная гипертензия (АГ), клапанные пороки сердца, хроническая сердечная недостаточность III-IV функционального класса, фибрилляция предсердий, клинико-лабораторные проявления печеночной недостаточности, хронической болезни почек, онкологические заболевания, беременность, психические заболевания.
Всем пациентам была произведена оценка анамнестических данных: степень и продолжительность АГ, статус курения. Всем пациентам была проведена оценка антропометрических показателей: роста, веса, ОТ; рассчитан ИМТ по формуле: вес (кг)/рост (м)².
Наличие избыточной массы тела, общего ожирения, степени ожирения определялись в соответствии с клиническими рекомендациями "Ожирение", 2021 [12]. АО диагностировалось при ОТ >94 см у мужчин и >80 см у женщин [12].
Степень АГ определяли в соответствии с рекомендациями Европейского общества кардиологов (ESC)/Европейского общества по АГ (ESH), 2018 [13].
Биохимическое исследование крови, включающее оценку показателей липидного спектра, уровня гликемии, проводилось по стандартным методикам. Наличие дислипидемии определялось согласно рекомендациям Европейского общества кардиологов (ESC)/Европейского общества по изучению атеросклероза (EAS) по лечению дислипидемий: модификация липидов для снижения сердечно-сосудистого риска, 2019 [14]. Наличие сахарного диабета определяли в соответствии с рекомендациями Российской ассоциации эндокринологов по сахарному диабету 2 типа у взрослых, 2022 [15].
Всем пациентам выполнялась рентгеновская компьютерная томография грудной клетки и забрюшинного пространства в спиральном режиме на томографе Toshiba Aquilion Prime по стандартизованному протоколу с пиковым напряжением на трубке 120 кВ и автоматическим выбором силы тока в диапазоне от 100 до 500 мА, с толщиной среза 1 мм. Объемы перикардиальной жировой ткани (ПКЖТ) и периваскулярной жировой ткани (ПВЖТ) определялись полуавтоматическим методом на единственном срезе на уровне переднего отрезка пятого межреберья; толщина паранефральной жировой ткани (ПНЖТ), состоящей из пара- и периренальной жировой клетчатки, определялась на одном срезе на уровне левой почечной вены [16] с использованием специализированного программного обеспечения QCT Pro Tissue Composition Module (Mindways Software, США) после калибровки томографа по специальному фантому. Объем ПКЖТ ≥3,2 см³ и объём ПВЖТ ≥0,4 см³ считали критериями перикардиального ожирения и периваскулярного ожирения [4], толщину ПНЖТ ≥1,91 см — критерием паранефрального ожирения [17].
Всем пациентам (n=100) идентифицировали аллели и генотипы полиморфных маркеров rs1801282 гена PPARG, rs5186 гена AGTR1, rs699947 гена VEGF-A методом полимеразной цепной реакции в режиме реального времени в препаратах ДНК человека, полученных из венозной крови, с использованием аллель-специфичных TaqMan-зондов на оборудовании Real-time CFX96C1000 Touch, Bio-Rad. Для выделения ДНК из анализируемого материала использовался комплект реагентов ДНК—ЭКСТРАН-1 (ООО НПФ "Синтол").
В результате для полиморфного маркера rs1801282 гена PPARG идентифицированы аллели С и G, генотипы C/C, С/G, G/G; для полиморфного маркера rs5186 гена AGTR1 идентифицированы аллели А и С, генотипы А/А, А/С, С/С; для полиморфного маркера rs699947 гена VEGF-A идентифицированы аллели А и С, генотипы А/А, А/С, С/С.
Для выявления всех возможных связей между частотами различных генотипов и фенотипов ожирения был проведен статистический анализ. Частоты аллелей (%) рассчитывались на основании подсчета генов и генотипов. Сопоставление частот полиморфизмов генов, изученных в нашем исследовании, проводилось в сравнении с распространенностью генотипов и аллелей, полученных из открытой базы данных 1000 Genomes Browsers (A Deep Catalog of Human Genetic Variation1). Частоты каждого однонуклеотидного полиморфизма сопоставлялись с ожидаемыми для популяции в соответствии с равновесием Харди-Вайнберга (РХВ).
Статистическую обработку полученных результатов проводили с использованием статистического пакета программ IBM SPSS Statistics 27. При нормальном распределении величин рассчитывали среднее значение и стандартное отклонение (М±σ). При непараметрическом распределении данных рассчитывали медиану и интерквартильный размах (Mе [ Q25; Q75]). При межгрупповом сравнении нескольких независимых выборок количественных показателей использовали критерий Краскела-Уоллиса, при внутригрупповом сравнении двух независимых выборок — непараметрический U-критерий Манна-Уитни, при сравнении качественных характеристик — критерий χ² Пирсона. Статистически значимыми считали результат при вероятности ошибки p<0,05.
Результаты
Клиническо-демографическая характеристика обследованных пациентов представлена в таблице 1.
Таблица 1
Клинико-демографическая характеристика обследованных пациентов
|
Показатель |
Значение |
|
Пол: муж/жен, n (%) |
47 (47)/53 (53) |
|
Возраст, годы |
58,5 [ 50;69] |
|
ИМТ, кг/м² |
28,74 [ 24,84;32,49] |
|
Избыточная масса тела (ИМТ ≥25 кг/м²), n (%) |
32 (32) |
|
Ожирение (ИМТ ≥30 кг/м²), n (%) |
43 (43) |
|
Степень ожирения I/II/III, % |
72/26/2 |
|
Курение, да/нет, n (%) |
8 (8)/90 (90) |
|
Артериальная гипертензия, n (%) |
69 (69) |
|
Ишемическая болезнь сердца, n (%) |
12 (12) |
|
Сахарный диабет, n (%) |
4 (4) |
|
Дислипидемия, n (%) |
49 (49) |
|
Перикардиальная жировая ткань, см³ |
2,95 [ 2,00;3,87] |
|
Периваскулярная жировая ткань, см³ |
0,35 [ 0,20;0,40] |
|
Паранефральная жировая ткань, см |
1,35 [ 0,63;2,21] |
Сокращение: ИМТ — индекс массы тела.
Доля женщин (n=53) составила 53%, мужчин (n=47) — 47%. Частота дислипидемии (49%) соответствовала общепопуляционной [18]. Абдоминальный тип ожирения (ОТ ≥94 см у мужчин и ≥80 см у женщин) имелся у 86 (86%) пациентов.
В зависимости от фенотипа ЭО/АО исследуемая выборка пациентов была разделена на несколько вариантов: с изолированным ЭО (перикардиальное ожирение, периваскулярное ожирение, паранефральное ожирение или их сочетание) без АО (группа 1 — ЭО) (n=4; 4%), с изолированным АО без эктопического (группа 2 — АО) (n=20; 20%), со смешанным ожирением (группа 3 — ЭО+АО) (n=66; 66%), лица, у которых наблюдался факт наличия любого ожирения из вышеперечисленных (группа 4) (n=90; 90%) и лица без ожирения (группа 5) (n=10; 10%).
Всем включенным в исследование пациентам было проведено генетическое исследование полиморфизмов генов PPARG, AGTR1 и VEGF-A. Распределение частот генотипов и аллелей однонуклеотидных полиморфизмов во всей выборке представлено на рисунке 1. В исследованной выборке пациентов были сопоставлены частоты различных генотипов и аллелей изученных полиморфных вариантов генов-кандидатов в зависимости от фенотипа ЭО и АО (табл. 2). В исследуемых группах выявлено одинаковое распределение генотипов и аллелей однонуклеотидного полиморфизма PPARG rs1801282. Наблюдалась тенденция к увеличению частоты генотипа C/G в группах ЭО (25%), АО (25%), ЭО+АО (31,8%), с любым вариантом ожирения (30%) по сравнению с группой без ожирения (20%), такая же тенденция наблюдалась в отношении генотипа G/G в группе АО (5%), ЭО+АО (1,5%) и с любым вариантом ожирения (2,2%) по сравнению с группой без ожирения (0%). Выявлена тенденция к увеличению частоты минорного аллеля G в группах ЭО (12,5%), АО (17,5%), АО+ЭО (17,4%) и любого варианта ожирения (17,2%) по сравнению с группой без ожирения (10%). Распределение генотипов данного полиморфного маркера соответствовало РХВ во всех исследуемых группах.
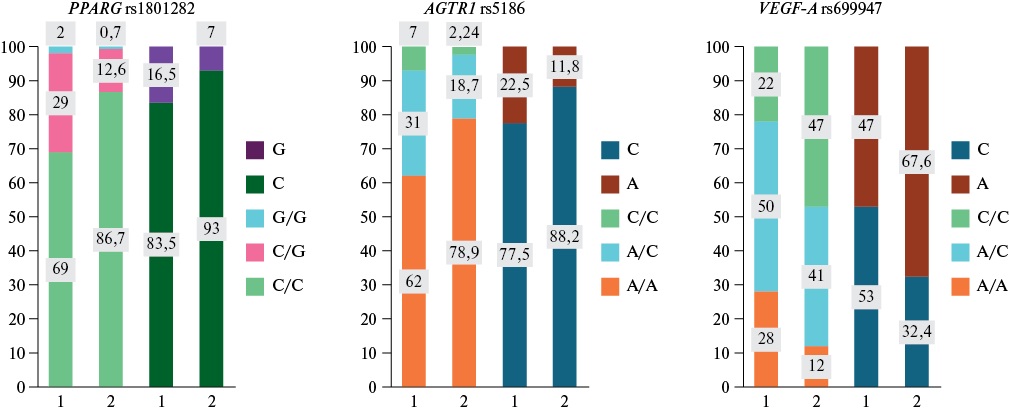
Рис. 1. Частота встречаемости генотипов и аллелей полиморфизмов генов у всех обследованных пациентов.
Примечание: 1 — данные, полученные в нашем исследовании, 2 — данные, полученные из открытой базы данных 1000 genomes project Phase 3 (Global population). Цветное изображение доступно в электронной версии журнала.
Таблица 2
Частота встречаемости генотипов и аллелей полиморфизмов генов у пациентов с различными фенотипами ожирения
|
ЭО |
АО |
ЭО+АО |
Ожирение (любое) |
Нет ожирения |
Значение χ² и р |
|||
|
PPARG rs1801282 |
Генотипы, % |
С/С |
75 |
70 |
66,7 |
67,8 |
80 |
2,101 0,91 |
|
С/G |
25 |
25 |
31,8 |
30 |
20 |
|||
|
G/G |
0 |
5 |
1,5 |
2,2 |
0 |
|||
|
Аллели, % |
С |
87,5 |
82,5 |
82,6 |
82,8 |
90 |
3,264 0,353 |
|
|
G |
12,5 |
17,5 |
17,4 |
17,2 |
10 |
|||
|
РХВ, р |
0,15 |
0,18 |
0,41 |
0,516 |
0,27 |
|||
|
AGTR1 rs5186 |
Генотипы, % |
A/A |
50 |
60 |
62,1 |
61,1 |
70 |
2,392 0,88 *5,991 *0,014 |
|
A/C |
50 |
35 |
28,8 |
31,1 |
30 |
|||
|
C/C |
0 |
5 |
9,1 |
7,8 |
0 |
|||
|
Аллели, % |
A |
75 |
77,5 |
76,5 |
76,7 |
85 |
3,61 0,307 |
|
|
C |
25 |
22,5 |
23,5 |
23,3 |
15 |
|||
|
РХВ, р |
0,0009 |
0,97 |
0,05 |
0,28 |
0,78 |
|||
|
VEGF-A rs699947 |
Генотипы, % |
A/A |
0 |
25 |
28,8 |
26,7 |
40 |
2,548 0,863 |
|
A/C |
75 |
50 |
50 |
51,1 |
40 |
|||
|
C/C |
25 |
25 |
21,2 |
22,2 |
20 |
|||
|
Аллели, % |
A |
37,5 |
50 |
53,7 |
52,25 |
60 |
10,806 0,013 |
|
|
C |
62,5 |
50 |
46,3 |
47,75 |
40 |
|||
|
РХВ, р |
<0,0001 |
1 |
0,95 |
0,75 |
0,1 |
|||
Примечание: * — χ² и р между группами 4 и 5.
Сокращения: АО — абдоминальное ожирение, РХВ — равновесие Харди-Вайнберга, ЭО — эктопическое ожирение.
В распределении генотипов полиморфного маркера rs5186 гена AGTR1 обнаружена статистическая значимость (p=0,014) между группами с любым вариантом ожирения и пациентами без ожирения; распределение генотипов отличалось от РХВ в группах ЭО (p=0,0009) и смешанного ожирения (p=0,05). Выявлена тенденция к увеличению частоты генотипа A/C в группах ЭО (50%), АО (35%), ЭО+АО (28,8%), любого варианта ожирения (31,1%) по сравнению с группой без ожирения (20%); генотипа C/C в группах АО (5%), ЭО+АО (9,1%), любого варианта ожирения (7,8%) по сравнению с группой без ожирения (0%). Также наблюдалась тенденция к увеличению частоты минорного аллеля C в группах с различными вариантами ожирения (ЭО, АО, ЭО+АО, любой вариант ожирения) — 25%, 22,5%, 23,5%, 23,3%, соответственно, по сравнению с группой без ожирения (15%).
Для полиморфного маркера rs699947 гена VEGF-A не было получено статистически значимых различий в генотипах между исследуемыми группами пациентов, однако наблюдались статистически значимые различия в аллельном распределении. В группах ЭО, АО и ЭО+АО, любого варианта ожирения выявлено статистически значимое увеличение частоты мутантного аллеля С (62,5%, 50%, 46,3%, 47,75%, соответственно) по сравнению с группой без ожирения (40%) (χ²=10,806; p=0,013). Кроме этого, в этих группа выявлена тенденция к увеличению частоты генотипа A/C (75%, 50%, 50%, 51,1%, соответственно) по сравнению с группой без ожирения (40%), а также генотипа C/C (25%, 25%, 21,2% и 22,2%, соответственно) по сравнению с группой без ожирения (20%). Отклонение частоты генотипов от РХВ в отношении rs699947 гена VEGF-A было обнаружено в группе ЭО (p<0,0001).
Обсуждение
В данной работе нами впервые были изучены однонуклеотидные полиморфизмы rs1801282 гена PPARG, rs5186 гена AGTR1, rs699947 гена VEGF-A у пациентов с различными фенотипами АО и ЭО. С целью выявления связей между частотами генотипов и аллелей исследуемых полиморфизмов и вариантов распределения висцеральной жировой ткани было сформировано 5 групп пациентов: с ЭО, с АО, со смешанным ожирением, которое подразумевало под собой сочетание ЭО и АО, с наличием любого варианта ожирения, а также пациенты без ЭО и АО. Учитывая небольшую когорту лиц с изолированным ЭО (n=4), анализ частоты генотипов и аллелей в данной группе не был приоритетным, акцент был сделан на группе АО, смешанного ожирения, а также группе с любым вариантом ожирения по сравнению с пациентами без ожирения. Стоит отметить, что в настоящее время практически нет данных, отражающих прямую связь данных генов с АО и ЭО, однако имеется ряд исследований, демонстрирующих их связь с общим ожирением, метаболическим синдромом (МС) и нарушениями липидного и углеводного обмена.
Ген PPARG, кодирующий ядерный белок-рецептор PPARG, крайне полиморфен, среди различных миссенс-вариантов в отношении связи с ожирением и уровнями липидов в сыворотке наибольший интерес представляет rs1801282, также известный как p.Pro12Ala [19]. В литературе имеются противоречивые данные о рисковых и протективных генотипах и аллелях данного полиморфизма в отношении метаболических нарушений, ССЗ и эндокринных заболеваний. Так, в метаанализе Sarhangi N, et al. (2020) была продемонстрирована протективная роль минорного аллеля G в отношении риска сахарного диабета 2 типа и развития инсулинорезистентности в различных генетических моделях [20]. Однако в отношении ожирения складывается впечатление, что именно аллель G является рисковым вариантом. В недавнем крупном метаанализе Li S, et al. (2022), включившем 120 исследований и 70317 участников, было продемонстрировано, что именно носители аллеля G имели значительно более высокие показатели ИМТ (SMD=0,08 кг/м², 95% доверительный интервал (ДИ): 0,04-0,12 кг/м², p<0,001), а также, что интересно, в отношении АО — ОТ (SMD=0,12 см, 95% ДИ: 0,06-0,18 см, p<0,001), и ОТ/ОБ (SMD=0,08, 95% ДИ: -0,01-0,17, p=0,08), чем C/C гомозиготы [21]. Это согласуется с результатами нашего исследования, где, несмотря на то, что статистической значимости выявлено не было, наблюдалась тенденция к увеличению частоты генотипа C/G (25%, 31,8% и 30%), G/G (5%, 1,5%, 2,2%) в группах с АО, ЭО+АО и любым вариантом ожирения, соответственно, по сравнению с группой без ожирения (C/G — 20% и G/G — 0%), а также более высокой частоте аллеля G в группах АО, ЭО+АО, с любым вариантом ожирения (17,5%, 17,4% и 17,2%, соответственно) по сравнению с группой без ожирения (10%).
Ген AGTR1 является одним из основных генов-кандидатов в изучении АГ [22]. В отношении связи данного полиморфизма с ожирением в литературе имеются противоречивые данные: в исследовании Разбековой М. и др. (2021) на казахской популяции 163 человек с факторами риска ССЗ показана протективная роль генотипа А/С гена rs5186 в отношении ожирения [23], с другой стороны, в исследовании Procopciuc LM, et al. (2010) из Румынии, где принимали участие 56 женщин с АГ и с/без МС и 71 женщина без АГ, было выявлено, что наличие генотипов A/C и C/C увеличивает риск развития МС в 10,53 раза (p=0,05), а также то, что пациентки с АГ и МС и генотипом C/C имели более высокий ИМТ по сравнению с пациентками c АГ без МС (p<0,05) [24]. При этом в отношении носительства аллеля С и дислипидемии, как фактора риска развития ССЗ, литературные данные в основном согласуются друг с другом [25][26]. Кроме этого, в проспективном исследовании Musso G, et al. (2019), в котором приняли участие 314 здоровых при первичной оценке и повторно обследованных через 10 лет человек, носительство аллеля С имело высокую предиктивную значимость в развитии неалкогольной жировой болезни печени, на данный момент определяемую как метаболически ассоциированная жировая болезнь печени (отношение шансов: 1,67, 95% ДИ: 1,26-2,21) [27]. В данной работе была высказана гипотеза о влиянии экспрессии мутантного аллеля С на постпрандиальный метаболизм липидов, вызванную дисфункциональной жировой тканью провоспалительную активацию лейкоцитов, что может способствовать повреждению печени и эндотелиальной дисфункции, приводя к развитию неалкогольного стеатогепатита и АГ [28]. Результаты нашего исследования также демонстрируют статистически значимые различия между распределением генотипов данного полиморфного маркера между группами с наличием любого варианта ожирения и отсутствием любого ожирения (χ²=5,991; p=0,014), а также тенденцию к увеличению частоты аллеля С в группах с ожирением (ЭО, АО, ЭО+АО, с любым вариантом ожирения) — 25%, 22,5%, 23,5%, 23,3%, соответственно, по сравнению с группой без ожирения (15%), а также генотипов с участием этого аллеля. Распределение генотипов rs5186 отклонялось РХВ в группах ЭО (p=0,0009) и смешанного ожирения (p=0,05). Данную выявленную особенность можно объяснить достаточно высокой распространенностью АГ в когорте наших больных (69%).
Роль полиморфизма rs699947 гена VEGF-A хорошо изучена в контексте онкологических заболеваний, в частности, носительство А аллели данного полиморфизма ассоциировано с раком щитовидной железы у мужчин (скорректированное отношение шансов =136, 95% ДИ: 1,02-1,81, p=0,039) [27]. Однако помимо этого в литературе обсуждается связь полиморфизма rs699947 с компонентами ожирения, хотя исследований, посвященных данной теме, крайне мало. В исследовании Skrypnik D, et al. (2020) была исследована связь данного полиморфизма с уровнем лептина в крови, а также с параметрами сердечно-сосудистого риска и эндотелиальной функции у пациентов с избыточным весом и ожирением в польской популяции. По результатам этого исследования была выявлена достоверная положительная корреляционная связь между сывороточными концентрациями VEGF-A и лептина у лиц с генотипом C/C rs699947 и избыточной массой тела и ожирением. Основываясь на этом, была высказана гипотеза о том, что экспрессия генов VEGF и лептина совместно регулируется механизмом, вероятно, зависящим от полиморфизма гена VEGF и статуса питания субъекта [28]. Повышение частоты генотипа C/C rs699947 (25%, 25%, 21,2% и 22,2%) в группах с различными типами ожирения по сравнению с группой без ожирения (20%) выявлено и в нашем исследовании, что можно объяснить вышеперечисленным. Помимо этого в нашем исследовании продемонстрировано, что в группах ЭО, АО, ЭО+АО и с любым вариантом ожирения выявлены статистически значимые различия в распределении аллелей (p=0,013) и увеличение частоты мутантного аллеля С в вышеперечисленных группах (62,5%, 50%, 46,3%, 47,75%, соответственно) по сравнению с группой без ожирения (40%), а также в этих группа выявлена тенденция к увеличению частоты генотипа A/C (75%, 50%, 50%, 51,1%, соответственно) по сравнению с группой без ЭО и АО (40%). Возможно, носительство именно мутантного аллеля С может быть связано с висцеральными и эктопическими отложениями жировой ткани.
Заключение
Существование генетического тестирования в настоящее время позволяет формировать персонализированный подход к пациентам в контексте превентивных мер в отношении различных заболеваний. Полученные нами данные позволяют предположить, что однонуклеотидные полиморфизмы rs1801282 гена PPARG, rs5186 гена AGTR1, rs699947 VEGF-A могут иметь связь с распределением жировой ткани в организме и быть маркерами различных фенотипов ЭО и АО. Наиболее существенным ограничением нашего исследования является маленькая выборка пациентов, а также территориальное ограничение Российской Федерацией, что позволяет экстраполировать полученные результаты только на российскую популяцию. Проверка выдвинутой нами гипотезы требует дополнительных исследований с включением выборок большего размера и групп сравнения.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. https://www.internationalgenome.org.
Список литературы
1. Баланова Ю. А., Шальнова С. А., Деев А. Д. и др. Ожирение в российской популяции — распространенность и ассоциации с факторами риска хронических неинфекционных заболеваний. Российский кардиологический журнал. 2018;(6):123-30. doi: 10.15829/1560-4071-2018-6-123-130.
2. Neeland IJ, Ross R, Després JP, et al. Visceral and ectopic fat, atherosclerosis, and cardiometabolic disease: a position statement. The Lancet Diabetes & Endocrinology. 2019; 7(9):715-25. doi: 10.1016/S2213-8587(19)30084-1.
3. Thanassoulis G, Massaro JM, Hoffmann U, et al. Prevalence, Distribution, and Risk Factor Correlates of High Pericardial and Intrathoracic Fat Depots in the Framingham Heart Study. Circ: Cardiovascular Imaging. 2010;3(5):559-66. doi: 10.1161/CIRCIMAGING.110.956706.
4. Подзолков В. И., Брагина А. Е., Осадчий К. К. и др. Эктопическое ожирение у пациентов без клинически значимых сердечно-сосудистых заболеваний: ориентировочные нормативы, частота и клинические характеристики. Терапевтический архив. 2022;94(9):1072-7. doi: 10.26442/00403660.2022.09.201847.
5. Подзолков В. И., Брагина А. Е., Родионова Ю. Н. и др. Эктопическая жировая ткань: частота и клинические характеристики фенотипов ожирения у пациентов. Кардиоваскулярная терапия и профилактика. 2024; 23(6):3980. doi: 10.15829/1728-8800-2024-3980.
6. Sun C, Kovacs P, Guiu-Jurado E. Genetics of Body Fat Distribution: Comparative Analyses in Populations with European, Asian and African Ancestries. Genes. 2021;12(6):841. doi: 10.3390/genes12060841.
7. Agrawal S, Wang M, Klarqvist MDR, et al. Inherited basis of visceral, abdominal subcutaneous and gluteofemoral fat depots. Nat Commun. 2022;13(1):3771. doi: 10.1038/s41467-022-30931-2.
8. Panteleeva AA, Razgildina ND, Pobozheva IA, et al. Expression of Genes Encoding Nuclear Factors PPARγ, LXRβ, and RORα in Epicardial and Subcutaneous Adipose Tissues in Patients with Coronary Heart Disease. Bull Exp Biol Med. 2021;170(5):654-7. doi: 10.1007/s10517-021-05126-2.
9. Heid IM, Jackson AU, Randall JC, et al. Meta-analysis identifies 13 new loci associated with waist-hip ratio and reveals sexual dimorphism in the genetic basis of fat distribution. Nat Genet. 2010;42(11):949-60. doi: 10.1038/ng.685.
10. Елькина А. Ю., Акимова Н. С., Шварц Ю. Г. Полиморфные варианты генов ангиотензинпревращающего фермента, ангиотензиногена, гена рецептора 1 типа к ангиотензину-II как генетические предикторы развития артериальной гипертонии. Российский кардиологический журнал. 2021;26(1S):4143. doi: 10.15829/1560-4071-2021-4143.
11. Adiyeva M, Aukenov N, Nurzhanova A, et al. The effect of AGTR1, AGТ, LPL, ADRB2 gene polymorphisms on central obesity in adolescents of the Kazakh population. BLL. 2022;124(01):53-8. doi: 10.4149/BLL_2023_008.
12. Дедов И. И., Мокрышева Н. Г., Мельниченко Г. А. и др. Ожирение. Клинические рекомендации. Consilium Medicum. 2021;23(4):311-25. doi: 10.26442/20751753.2021.4.200832.
13. Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). Eur Heart J. 2018;39(33):3021-104. doi: 10.1093/EURHEARTJ/EHY339.
14. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). Eur Heart J. 2020;41(1):111-88. doi: 10.1093/EURHEARTJ/EHZ455.
15. Дедов И. И., Шестакова М. В., Майоров А. Ю. и др. Сахарный диабет 2 типа у взрослых. Сахарный диабет. 2020;23(2S):4-102. doi: 10.14341/DM12507-9653.
16. Goldenberg L, Saliba W, Hayeq H, et al. The impact of abdominal fat on abdominal aorta calcification measured on non-enhanced CT. Medicine. 2018;97(49). doi: 10.1097/MD.0000000000013233.
17. Подзолков В. И., Брагина А. Е., Осадчий К. К. и др. Паранефральная жировая ткань: частота паранефрального ожирения и связь с антропометрическими индексами ожирения. Рациональная фармакотерапия в кардиологии. 2022;18(5):516-21. doi: 10.20996/1819-6446-2022-09-04.
18. Драпкина О. М., Имаева А. Э., Куценко В. А. и др. Дислипидемии в Российской Федерации: популяционные данные, ассоциации с факторами риска. Кардиоваскулярная терапия и профилактика. 2023;22(8S):3791. doi: 10.15829/1728-8800-2023-3791.
19. Хасанова К. Б., Медведева М. С., Валеева Е. В. и др. Роль полиморфизма rs1801282 гена PPARG в прогнозировании риска развития нарушений углеводного обмена и выборе тактики лечения. Consilium Medicum. 2022;24(4):266-70. doi: 10.26442/20751753.2022.4.201672.
20. Sarhangi N, Sharifi F, Hashemian L, et al. PPARG (Pro12Ala) genetic variant and risk ofT2DM: a systematic review and meta-analysis. Sci Rep. 2020;10(1):12764. doi: 10.1038/s41598-020-69363-7.
21. Li S, He C, Nie H, et al. G Allele of the rs1801282 Polymorphism in PPARγ Gene Confers an Increased Risk of Obesity and Hypercholesterolemia, While T Allele of the rs3856806 Polymorphism Displays a Protective Role Against Dyslipidemia: A Systematic Review and Meta-Analysis. Front Endocrinol. 2022;13:919087. doi: 10.3389/fendo.2022.919087.
22. Безменова И. Н., Аверьянова И. В. Полиморфизм 1166А>С гена AGTR1 как маркер метаболических нарушений в популяции жителей-северян. Ожирение и метаболизм. 2023;20(4):330-7. doi:10.14341/omet12986.
23. Razbekova M, Issanov A, Chan MY, et al. Genetic factors associated with obesity risks in a Kazakhstani population. BMJNPH. 2021;4(1):90-101. doi: 10.1136/bmjnph-2020-000139.
24. Procopciuc LM, Sitar-Tăut A, Pop D, et al. Renin angiotensin system polymorphisms in patients with metabolic syndrome (MetS). European Journal of Internal Medicine. 2010;21(5):414-8. doi: 10.1016/j.ejim.2010.06.001.
25. Semianiv M, Sydorchuk L, Semianiv I, et al. Dyslipidemia as a predictor of essential arterial hypertension depending on AGTR1 (RS5186) and VDR (RS2228570) genes polymorphism. 2022;29(2). Romanian Journal of Diabetes Nutrition and Metabolic Diseases. 2022;29(2):253-60.
26. Musso G, Saba F, Cassader M, et al. Angiotensin II Type 1 Receptor rs5186 Gene Variant Predicts Incident NAFLD and Associated Hypertension: Role of Dietary Fat-Induced ProInflammatory Cell Activation. Am J Gastroenterol. 2019;114(4):607-19. doi: 10.14309/ajg.0000000000000154.
27. Hsiao PJ, Lu MY, Chiang FY, et al. Vascular endothelial growth factor gene polymorphisms in thyroid cancer. Journal of Endocrinology. 2007;195(2):265-70. doi: 10.1677/JOE-07-0395.
28. Skrypnik D, Mostowska A, Jagodziński P, et al. Association of rs699947 (-2578 C/A) and rs2010963 (-634 G/C) Single Nucleotide Polymorphisms of the VEGF Gene, VEGF-A and Leptin Serum Level, and Cardiovascular Risk in Patients with Excess Body Mass: A Case— Control Study. JCM. 2020;9(2):469. doi: 10.3390/jcm9020469.
Об авторах
А. Е. БрагинаРоссия
д.м.н., профессор кафедры факультетской терапии № 2 Москва
Конфликт интересов:
нет
М. К. Васильченко
Россия
ассистент кафедры факультетской терапии № 2 Москва
Конфликт интересов:
нет
Ю. Н. Родионова
Россия
к.м.н., доцент кафедры факультетской терапии № 2 Москва
Конфликт интересов:
нет
К. К. Осадчий
Россия
к.м.н., доцент кафедры факультетской терапии № 2 Москва
Конфликт интересов:
нет
А. П. Муравлев
Россия
врач-рентгенолог рентгенологического отделения Университетской клинической больницы № 4 Москва
Конфликт интересов:
нет
М. А. Воронков
Россия
ординатор Москва
Конфликт интересов:
нет
Е. А. Александрова
Россия
студент Москва
Конфликт интересов:
нет
В. И. Подзолков
Россия
д.м.н., профессор, зав. кафедрой факультетской терапии № 2, директор клиники факультетской терапии № 2 Москва
Конфликт интересов:
нет
Дополнительные файлы
Что известно о предмете исследования?
- Наличие эктопических жировых депо не всегда сочетается с наличием ожирения в целом; данная диссоциация формирует интерес к изучению распределения жировой ткани в организме, а также влияния генетических/эпигенетических факторов на этот процесс.
- Выделено множество генов и полиморфизмов, которые представляют интерес в отношении фенотипов ожирения и распределения жировой ткани, среди них присутствуют такие гены, как PPARG, VEGF-Aи AGTR1.
Что добавляют результаты исследования?
- Обнаружена статистически значимая разница в распределении генотипов полиморфизма rs5186 гена AGTR1у лиц с любым вариантом ожирения по сравнению с пациентами без ожирения: у лиц с любым вариантом ожирения наблюдается более высокая частота мутантного аллеля C.
- Распределение генотипов и увеличение частоты мутантного аллеля С полиморфизма rs5186 гена AGTR1в группах с изолированным ЭО и смешанным ожирением (ЭО+АО), а также распределение аллелей и увеличение частоты мутантного аллеля С полиморфизма rs699947 гена VEGF-Aв группе с изолированным ЭО отличаются от общей популяции, что проявляется отклонением от РХВ; это позволяет предполагать, что данные однонуклеотидные полиморфизмы могут быть маркерами ожирения.
Рецензия
Для цитирования:
Брагина А.Е., Васильченко М.К., Родионова Ю.Н., Осадчий К.К., Муравлев А.П., Воронков М.А., Александрова Е.А., Подзолков В.И. Полиморфизм генов PPARG, AGTR1, VEGF-A: частота и связь с фенотипами ожирения. Российский кардиологический журнал. 2025;30(3):6176. https://doi.org/10.15829/1560-4071-2025-6176. EDN: YFULAZ
For citation:
Bragina A.E., Vasilchenko M.K., Rodionova Yu.N., Osadchiy K.K., Muravlev A.P., Voronkov M.A., Aleksandrova E.A., Podzolkov V.I. Polymorphism of the PPARG, AGTR1, VEGF-A genes: frequency and association with obesity phenotypes. Russian Journal of Cardiology. 2025;30(3):6176. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6176. EDN: YFULAZ
JATS XML

















































