Перейти к:
Мультипараметрическое ультразвуковое исследование печени у пациентов кардиологического профиля с избыточной массой тела: определение причины фиброза и выраженности стеатоза
https://doi.org/10.15829/1560-4071-2025-6163
EDN: XYHCSX
Аннотация
Цель. Оценить возможность использования мультипараметрического ультразвукового исследования печени для определения патофизиологических причин повышения жесткости у пациентов с кардио-метаболическими рисками.
Материал и методы. Проведено исследование с участием 104 пациентов кардиологического профиля, из них 48 мужчин (46,2%), 56 женщин (53,8%) в возрасте от 49 до 73 лет, европеоидной расы. Критерии включения — хроническая сердечная недостаточность IIВ стадии (II, III функциональные классы по NYHA), основной и дополнительные критерии метаболического синдрома, содержащие кардиометаболические риски развития метаболически ассоциированной стеатозной болезни печени. Все пациенты обследованы по единому диагностическому алгоритму, состоящему из 2 этапов: 1 этап — клинико-лабораторный, 2 этап — инструментальный с использованием методов ультразвукового исследования печени (В-режим, цветовое допплеровское картирование, двумерная эластография сдвиговых волн, количественная стеатометрия).
Результаты. Предложена балльная система оценки преобладающего вклада в развитие фиброза печени с учетом данных мультипараметрического ультразвукового исследования печени. Сумма баллов 0-8: преобладает поражение печени — в этом случае наблюдаются характерные признаки поражения, такие как повышенная эхогенность и отсутствие значительного расширения венозных сосудов. Сумма баллов 9-14: комбинация поражений — признаки включают как изменения, связанные с печенью (например, стеатоз), так и признаки венозного застоя. Сумма баллов 15-16: преобладает поражение сердечно-сосудистой системы — в этом случае значительное расширение венозных сосудов и другие признаки застойной гепатопатии являются основными, что указывает на венозный застой как основную причину изменений в печени.
Заключение. Мультипараметрическое ультразвуковое исследование печени в сочетании с разработанной балльной системой оценки может быть использовано для дифференциации причин повышения жесткости печени и выраженности стеатоза печени у пациентов с кардиометаболическими рисками. Стандартизация протокола ультразвукового исследования повышает воспроизводимость методики.
Ключевые слова
Для цитирования:
Шестакова Д.Ю., Борсуков А.В., Скутарь А.И., Ахмедова А.Р. Мультипараметрическое ультразвуковое исследование печени у пациентов кардиологического профиля с избыточной массой тела: определение причины фиброза и выраженности стеатоза. Российский кардиологический журнал. 2025;30(1):6163. https://doi.org/10.15829/1560-4071-2025-6163. EDN: XYHCSX
For citation:
Shestakova D.Yu., Borsukov A.V., Skutar A.I., Akhmedova A.R. Multiparametric ultrasound liver examination in cardiological overweight patients: determining the cause of fibrosis and severity of steatosis. Russian Journal of Cardiology. 2025;30(1):6163. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6163. EDN: XYHCSX
В настоящее время заболеваемость сердечно-сосудистыми заболеваниями и метаболическими расстройствами, такими как ожирение и метаболический синдром, продолжает стремительно расти во всем мире [1]. По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания являются ведущей причиной смертности, вызывая ~17,9 млн смертей ежегодно, что составляет ~32% всех смертей. Одновременно с этим, распространенность метаболического синдрома, который включает ожирение, артериальную гипертензию, инсулинорезистентность и дислипидемию, достигает в среднем 20-30% в общей популяции, увеличивая риск развития хронической сердечной недостаточности (ХСН) и хронических заболеваний печени [2][3]. У пациентов с сочетанием ХСН и признаков метаболического синдрома повышается риск развития стеатозной болезни печени (в данном случае ее подтипа — метаболически ассоциированной стеатозной болезни печени (МАСБП)) [4][5]. Согласно последним данным, ~25% взрослого населения планеты страдает от МАСБП, что делает это заболевание ведущей причиной хронической патологии печени, в т. ч. за счет развивающегося фиброза на фоне стеатогепатита [6]. Более того, при наличии ХСН наблюдается частое развитие венозного застоя в печени, что также приводит к повышению жесткости тканей и может имитировать фиброз, связанный с жировыми отложениями. В последние годы концепция сердечно-печеночного континуума подчеркивает взаимосвязь между сердечной и печеночной функцией. Нарушения работы сердца, особенно при ХСН, могут привести к застойной гепатопатии — состоянию, при котором повышенное венозное давление вызывает застой крови в печени и как следствие развитие фиброза. В то же время МАСБП является ведущей причиной хронического повреждения печени у пациентов с кардиометаболическими рисками [7].
Фиброз печени является ключевым прогностическим фактором для многих хронических заболеваний печени. У пациентов с МАСБП прогрессирование фиброза увеличивает риск развития цирроза и печеночной недостаточности. При этом фиброз печени у пациентов с ХСН может усугублять течение заболевания за счет венозного застоя в большом круге кровообращения. Исследования показывают, что выраженность фиброза печени коррелирует с тяжестью ХСН и влияет на прогноз пациентов [8]. У пациентов с ХСН и сопутствующим фиброзом печени значительно повышается риск госпитализации, ухудшения сердечной функции и смерти. В одном из недавних исследований было установлено, что пациенты с тяжелой ХСН и признаками фиброза печени имеют более высокий риск смертности по сравнению с пациентами без фиброза [9].
Мультипараметрическое ультразвуковое (УЗ) исследование, включающее в себя в т. ч. УЗ эластографию печени, позволяющую измерять жесткость тканей в килопаскалях, стало важным инструментом для оценки фиброза печени [10]. Однако у пациентов с ХСН и метаболическим синдромом высокие значения жесткости печени могут быть обусловлены различными причинами: истинным фиброзом вследствие МАСБП, венозным застоем при сердечной недостаточности или их комбинацией. Это создает значительные диагностические трудности, т. к. интерпретация результатов УЗ эластографии становится затруднительной [11]. Несмотря на наличие исследований, посвященных роли эластографии в диагностике фиброза при МАСБП, у пациентов с ХСН и метаболическим синдромом все еще нет четких критериев для дифференциальной диагностики причин повышения жесткости печени [12]. В связи с этим важно разработать методы, которые позволят более точно выявлять причину развития фиброза печени.
Цель: оценить возможность использования мультипараметрического УЗ исследования печени для определения патофизиологических причин повышения жесткости у пациентов с кардиометаболическими рисками.
Материал и методы
Дизайн исследования. На клинической базе Проблемной научно-исследовательской лаборатории "Диагностические исследования и малоинвазивные технологии" ФГБОУ ВО "Смоленский государственный медицинский университет" Минздрава России (ОГБУЗ "Клиническая больница № 1") в период 2023-2024гг проведено исследование с участием 104 пациентов кардиологического профиля, из них 48 мужчин (46,2%), 56 женщин (53,8%) в возрасте от 49 до 73 лет, европеоидной расы. Критерии включения (обусловленные сердечно-сосудистой патологией, а также основным и дополнительными критериями метаболического синдрома), критерии невключения и исключения представлены в таблице 1.
Таблица 1
Критерии включения, невключения и досрочного исключения из исследования
|
Критерии включения |
Критерии невключения |
Критерии исключения |
|
• ХСН IIВ стадии (II, III функциональные классы по NYHA) • ИМТ ≥25 кг/м² • Окружность талии >94 см для мужчин и >80 см для женщин • Артериальное давление ≥130/85 мм рт.ст. или пациенты на гипотензивной терапии • Тощаковая гликемия ≥5,6 ммоль/л |
• Наличие вирусных гепатитов • Алкогольная болезнь печени • Аутоиммунные и наследственные заболевания печени • Онкологические заболевания, влияющие на функцию печени • История злоупотребления алкоголем или наркотиками • Тяжелая почечная недостаточность • Ожирение IV степени (ИМТ ≥40 кг/м²) • Беременность или лактация • Прием гепатотоксических препаратов |
• Отзыв информированного согласия • Декомпенсация сердечной деятельности • Развитие заболеваний печени другой этиологии • Острые инфекционные заболевания • Технические пациенто-зависимые факторы, затрудняющие проведение ультразвуковых исследований |
Сокращения: ИМТ — индекс массы тела, ХСН — хроническая сердечная недостаточность.
В контрольную группу 1 включены условно здоровые пациенты (n=51) без сердечно-сосудистой патологии и без патологии печени (для определения уровня специфичности мультипараметрического УЗ исследования). В контрольную группу 2 включены пациенты гастроэнтерологического профиля (n=48) с ожирением, сахарным диабетом 2 типа, МАСБП. В контрольную группу 3 включены пациенты кардиологического профиля (n=44) с ХСН без основного, дополнительных критериев метаболического синдрома и без МАСБП. Все пациенты были обследованы по единому диагностическому алгоритму при поступлении в медицинскую организацию и через 10-14 дней при выписке. Дизайн исследования представлен на рисунке 1.

Рис. 1. Дизайн исследования.
Сокращения: АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, Б/х — биохимический, ОАК — общий анализ крови, ОАМ — общий анализ мочи, УЗИ — ультразвуковое исследование, УЗ — ультразвуковая, ЦДК — цветовое допплеровское картирование.
УЗ исследование выполнено с использованием оборудования — БИОСС Ангиодин-Соно/П-Ультра (Россия), конвексный датчик 3,5 МГц, Esaote (Италия), конвексный датчик 3,5-5 МГц, Canon Aplio i800 (Япония), конвексный датчик 3,5 МГц и TELEMED, MLS (Литва), конвексный датчик 3,5 МГц. Эластография и стеатометрия печени проводились с учетом основных правил по данным клинических рекомендаций (рис. 2, 3).
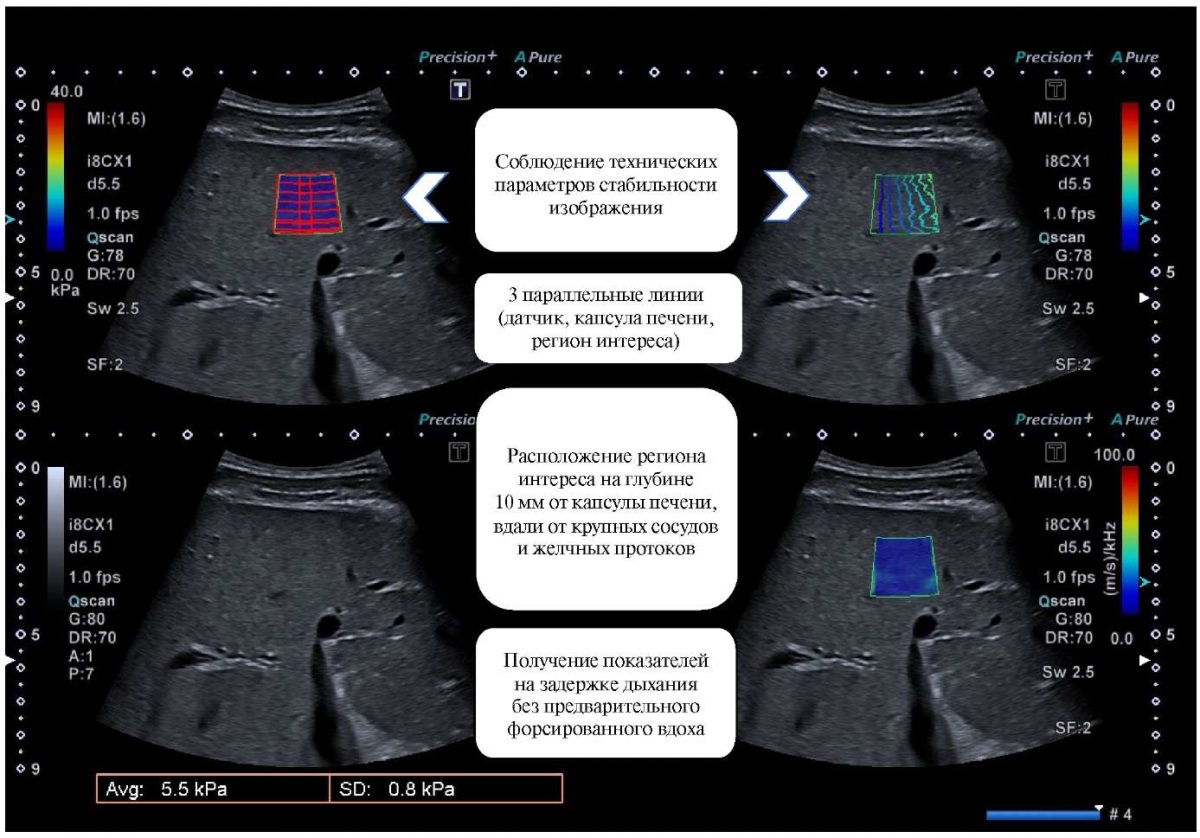
Рис. 2. Правила проведения УЗ эластографии печени.
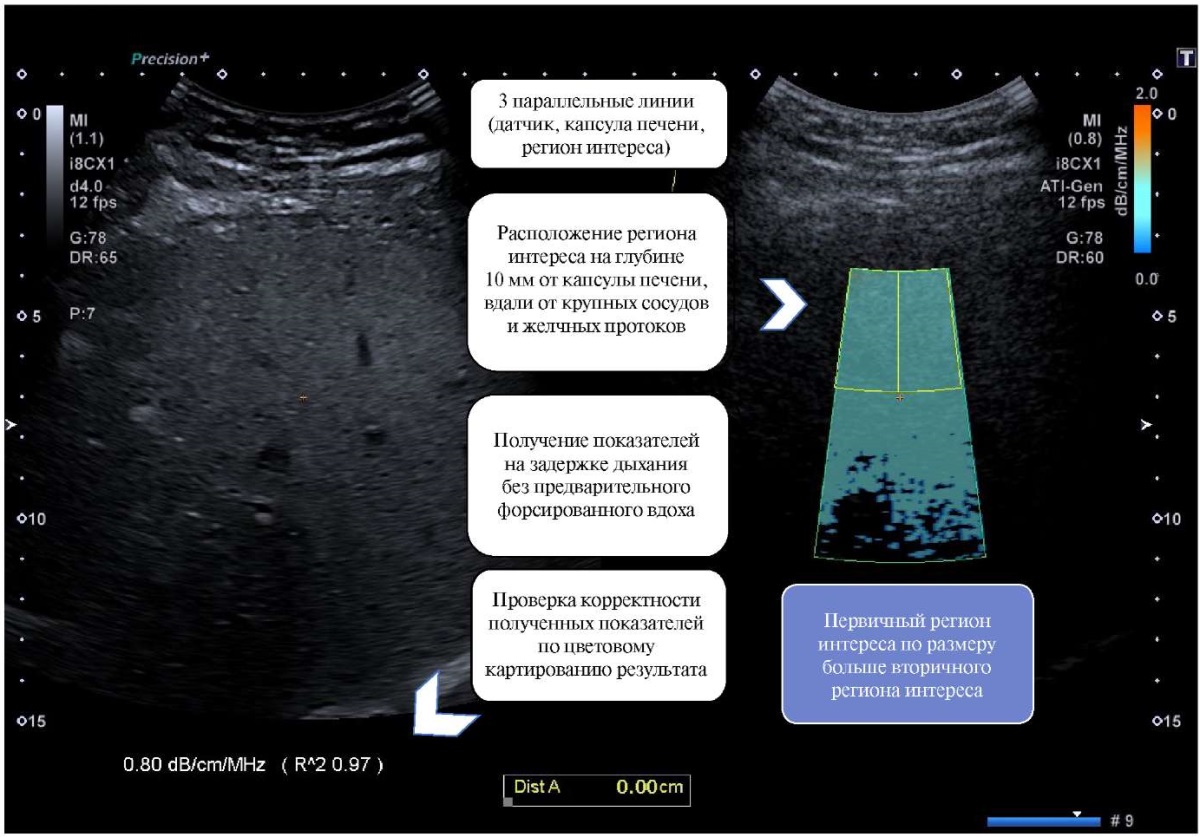
Рис. 3. Правила проведения УЗ стеатометрии печени.
Комплексный индекс FIB-4 <1,45 — отрицательное прогностическое значение для выраженного фиброза (F2-F3); FIB-4 >3,25 — положительное прогностическое значение для выраженного фиброза (F2-F3). FIB-4 использовался для оценки влияния печеночных причин на развитие фиброза печени.
Мультипараметрическое УЗ исследование проводилось на оборудовании БИОСС Ангиодин-Соно/П-Ультра (Россия), конвексный датчик 3,5-5 МГц. Двумерная УЗ сдвиговолновая эластография печени с оценкой жесткости в килопаскалях (кПа) и количественная УЗ стеатометрия печени с оценкой коэффициента затухания УЗ волны в тканях в децибел на сантиметр (дБ/см) проводилась по стандартным методикам [13-15].
Лечение пациентов с ХСН IIВ стадии, II-III функциональным классом проводилось врачом-кардиологом по стандартной схеме и было направлено на поддержание функции сердца, уменьшение симптомов, предотвращение декомпенсации и улучшение прогноза. Основные направления терапии (медикаментозной и немедикаментозной) — применение лекарственных средств для контроля объема циркулирующей крови, снижения нагрузки на сердце и предотвращения ремоделирования миокарда.
Этические принципы. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был рассмотрен и одобрен локальным этическим комитетом ОГБУЗ "Клиническая больница № 1" (протокол № 1 от 09 марта 2023г). Перед участием у всех респондентов было запрошено письменное информированное согласие. Форма информированного согласия была распечатана и предоставлена респондентам, с тем чтобы они смогли ознакомиться с целями, задачами, процедурами исследования и, при необходимости, задать вопросы.
Статистический анализ. Статистический анализ был проведен с использованием программ Microsoft Office Excel 2017. Уровень значимости p<0,05. Для анализа данных использовались методы описательной статистики, включающие расчет средних значений и стандартных отклонений для количественных переменных. Для сравнения групп пациентов были использованы непараметрические критерии, такие как критерий Манна-Уитни и критерий Краскела-Уоллиса, учитывая распределение данных. Также применялись методы корреляционного анализа для оценки взаимосвязей между различными показателями.
Результаты
Так, нами предложена балльная система оценки с учетом полученных результатов (табл. 2).
Таблица 2
Сравнение признаков мультипараметрического УЗ исследования печени у пациентов с поражением печени и сердечно-сосудистой системы
|
Ультразвуковой признак |
Пациенты с поражением преимущественно печени |
Пациенты с поражением преимущественно сердечно-сосудистой системы |
|
Эхогенность печени |
Повышенная (гиперэхогенная) из-за стеатоза |
Гетерогенная или нормальная, возможна мозаичная структура |
|
Размер печени |
Нормальный или увеличен (гепатомегалия) |
Значительное увеличение, часто с закругленными краями |
|
Расширение печеночных вен |
Не характерно |
Присутствует, выраженное |
|
Расширение нижней полой вены |
Не характерно |
Расширена >20 мм, отсутствие коллапсируемости на вдохе |
|
Скорость кровотока в воротной вене |
Норма |
Снижение или ретроградный кровоток |
|
Жесткость печени на эластографии |
Повышена (истинный фиброз) |
Повышена, но может снижаться после лечения сердечной недостаточности |
|
Наличие асцита |
Редко |
Часто наблюдается при застое |
|
Спленомегалия |
Не характерно |
Часто наблюдается |
Для определения того, какой тип поражения преобладает (поражение печени, сердечно-сосудистой системы или комбинация), предложена балльная система оценки, основанная на признаках, характерных для каждого типа поражения. Каждый признак оценивается в баллах в зависимости от его специфичности для конкретного состояния. Каждый признак оценивается от 0 до 2 баллов: 0 баллов — признак отсутствует или не выражен; 1 балл — признак умеренно выражен, может встречаться как при поражении печени, так и при поражении сердечно-сосудистой системы; 2 балла — признак выражен и специфичен для определенного состояния (рис. 4). Предложенная балльная система может помочь дифференцировать причину фиброза и облегчает определение доминирующего патофизиологического процесса.

Рис. 4. Распределение пациентов основной и контрольной групп по сумме баллов согласно показателям, полученным при мультипараметрическом УЗ исследовании печени.
Для каждого пациента суммируются баллы по каждому признаку, чтобы определить, какой тип поражения преобладает (табл. 3).
Таблица 3
Балльная система оценки вклада сердечно-печеночного континуума в формирование фиброза печени
|
Признак |
Описание |
Оценка (баллы) |
Интерпретация |
|
Эхогенность печени |
Эхогенность нормальная |
0 баллов |
Сумма баллов 0-8: Преобладает поражение печени. В этом случае наблюдаются характерные признаки поражения, такие как повышенная эхогенность и отсутствие значительного расширения венозных сосудов. Сумма баллов 9-14: Комбинация поражений. Признаки включают как изменения, связанные с печенью (например, стеатоз), так и признаки венозного застоя. Это может указывать на наличие обеих патологий. Сумма баллов 15-16: Преобладает поражение сердечно-сосудистой системы. В этом случае значительное расширение венозных сосудов и другие признаки застойной гепатопатии являются основными, что указывает на венозный застой как основную причину изменений в печени. |
|
Гетерогенная эхогенность — мозаичная |
1 балл |
||
|
Повышенная эхогенность (гиперэхогенная) |
2 балла |
||
|
Размер печени |
Размер в пределах нормы |
0 баллов |
|
|
Умеренное увеличение печени (ККР правой доли до 180 мм) |
1 балл |
||
|
Значительное увеличение печени с закругленными краями (ККР размер правой доли >180 мм) |
2 балла |
||
|
Расширение печеночных вен |
Печеночные вены не расширены (до 6 мм) |
0 баллов |
|
|
Умеренное расширение печеночных вен (6-8 мм) |
1 балл |
||
|
Явное расширение печеночных вен (>8 мм) |
2 балла |
||
|
Расширение нижней полой вены |
НПВ в пределах нормы (до 20 мм) |
0 баллов |
|
|
НПВ в пределах 20-25 мм |
1 балл |
||
|
Значительное расширение НПВ (>25 мм), отсутствие коллапсируемости на вдохе |
2 балла |
||
|
Скорость кровотока в воротной вене |
Скорость кровотока в норме |
0 баллов |
|
|
Снижение скорости кровотока |
1 балл |
||
|
Ретроградный кровоток |
2 балла |
||
|
Жесткость печени по данным эластографии на фоне приема диуретических препаратов |
Не снижается |
0 баллов |
|
|
Остается прежней |
1 балл |
||
|
Снижается |
2 балла |
||
|
Наличие асцита |
Асцит отсутствует |
0 баллов |
|
|
Асцит — малый объем (до 500 мл) |
1 балл |
||
|
Асцит — большой объем (более 500 мл) |
2 балла |
||
|
Спленомегалия (увеличение селезенки) |
Селезенка в норме |
0 баллов |
|
|
Увеличение площади селезенки в пределах 30-49 см² |
1 балл |
||
|
Увеличение площади селезенки более 50 см² |
2 балла |
Сокращения: ККР — кранио-каудальный размер, НПВ — нижняя полая вена.
Для оценки воспроизводимости предложенной балльной системы оценки причин возникновения фиброза печени была проведена дополнительная работа с участием врачей с разным стажем работы. В исследовании приняли участие 4 врача с опытом работы 2-4 года и 3 врача с опытом работы >10 лет, которые проводили мультипараметрическое УЗ исследование брюшной полости по предложенной схеме. Оценка индекса воспроизводимости показала высокую согласованность результатов между врачами с разным уровнем опыта. Коэффициент внутриклассовой корреляции (ICC) составил 0,79 у врачей со стажем 2-4 года и 0,84 у врачей со стажем >10 лет, что свидетельствует о высокой степени воспроизводимости метода. Несмотря на различия в опыте, врачи демонстрировали сопоставимые результаты, что подчеркивает надежность и стандартизацию предложенной методики.
Обсуждение
Использование балльной системы показало, что у пациентов основной группы баллы в среднем находятся в диапазоне от 9 до 14, что свидетельствует о смешанной этиологии повышения жесткости печени. У этих пациентов высокие значения жесткости могли быть обусловлены как истинным фиброзом на фоне МАСБП, так и венозным застоем в результате сердечной недостаточности. Это согласуется с концепцией сердечно-печеночного континуума, подчеркивающей тесную взаимосвязь между состоянием сердечно-сосудистой системы и функцией печени. Контрольные группы дали возможность оценить вклад каждой из патологий в общую картину повышения жесткости печени. Пациенты контрольной группы 1 имели нулевые баллы, что подтверждает отсутствие изменений в печени и сердечно-сосудистой системе, служа эталоном для оценки специфичности методики. В контрольной группе 2, где пациенты имели только МАСБП и сопутствующие метаболические нарушения, балльная оценка преимущественно находилась в диапазоне от 0 до 8 баллов, что подтверждает связь между фиброзом печени и метаболическими нарушениями. В свою очередь, в контрольной группе 3, состоящей из пациентов с ХСН, без МАСБП, баллы находились в диапазоне от 15 до 16, что указывает на наличие выраженного венозного застоя, приводящего к повышению жесткости печени. Анализ данных с использованием диаграммы плотности распределения показал различия в характере распределения баллов среди групп. Основная группа продемонстрировала широкое распределение значений, что свидетельствует о смешанном генезе фиброза и неоднородности популяции. Контрольные группы показали более узкое распределение, что указывает на более специфическое влияние одного фактора — либо метаболического, либо сердечно-сосудистого.
Таким образом, разработанная балльная система и проведенный анализ показали высокую эффективность мультипараметрического УЗ исследования для определения причины повышения жесткости печени. Применение данной методики в клинической практике может улучшить диагностику и помочь в выборе более эффективной стратегии лечения для пациентов с кардиометаболическими рисками. Важно отметить, что в случаях сочетания ХСН и МАСБП для точной диагностики требуется комплексный подход, включающий как УЗ методы, так и лабораторные маркеры.
Заключение
Мультипараметрическое УЗ исследование печени в сочетании с разработанной балльной системой оценки может быть использовано для дифференциации причин повышения жесткости печени и определения выраженности стеатоза печени у пациентов с кардиометаболическими рисками. Стандартизация протокола УЗ исследования повышает воспроизводимость методики.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Алфёрова В. И., Мустафина С. В. Распространенность ожирения во взрослой популяции Российской Федерации (обзор литературы). Ожирение и метаболизм. 2022;19(1):96-105. doi:10.14341/omet12809.
2. Emmons-Bell S, Johnson C, Roth G. Prevalence, incidence and survival of heart failure: a systematic review. Heart. 2022;108(17):1351-60. doi:10.1136/heartjnl-2021-320131.
3. Li Z, Hongmei Z, Jing W. Metabolism and chronic inflammation: the links between chronic heart failure and comorbidities. Frontiers in Cardiovascular Medicine. 2021;8: 650278. doi:10.3389/fcvm.2021.650278.
4. Сабиров И. С., Каршина О. О., Сабирова А. И., Халматов А. Н. Метаболически ассоциированная жировая болезнь печени и пожилой возраст. Экспериментальная и клиническая гастроэнтерология. 2024;(3):25-32. doi:10.31146/1682-8658-ecg-223-3-25-32.
5. Венидиктова Д. Ю., Борсуков А. В. Инструментальные особенности дифференциальной диагностики метаболически ассоциированной и неалкогольной жировой болезней печени. Сибирский журнал клинической и экспериментальной медицины. 2023;38(2): 209-17. doi:10.29001/2073-8552-2023-38-2-209-217.
6. Llovet JM, Willoughby CE, Singal AG, et al. Nonalcoholic steatohepatitis-related hepatocellular carcinoma: pathogenesis and treatment. Nature reviews Gastroenterology & hepatology. 2023;20(8):487-503. doi:10.1038/s41575-023-00754-7.
7. Westcott F, David JD, Leanne H. Hepatic fatty acid and glucose handling in metabolic disease: potential impact on cardiovascular disease risk. Atherosclerosis. 2024;394: 117237. doi:10.1016/j.atherosclerosis.2023.117237.
8. Hamza EH, Vincenzo AD, Vettor R, et al. Relationship between heart disease and liver disease: a two-way street. Cells. 2020;9(3):567. doi:10.3390/cells9030567.
9. Aspromonte N, Fumarulo I, Petrucci L, et al. The Liver in Heart Failure: From Biomarkers to Clinical Risk. International Journal of Molecular Sciences. 2023;24(21):15665. doi:10.3390/ijms242115665.
10. Gao Jing MD, Lee BS, Trujillo M. Reliability of performing multiparametric ultrasound in adult livers. Journal of Ultrasound in Medicine. 2022;41(3):699-711. doi:10.1002/jum.15751.
11. Nagao K, Shiori MK, Kenji A, et al. Association Between the Liver Fibrosis Markers and Scores, and Hemodynamic Congestion Assessed by Peripheral Venous Pressure in Patients With Acute Heart Failure. Journal of the American Heart Association. 2023;12(21):e030788. doi:10.1161/JAHA.123.030788.
12. Berumen J, Baglieri J, Kisseleva T, Mekeel K. Liver fibrosis: Pathophysiology and clinical implications. WIREs mechanisms of disease. 2021;13(1):e1499. doi:10.1002/wsbm.1499.
13. Borsukov AV, Venidiktova DYu, Borsukov SA. Novel method for quantifying hepatic steatosis in patients with metabolically associated fatty liver disease. International journal of Innovative Medicine. 2022;2:12-6. doi:10.33667/2782-4101-2022-2-12-16.
14. Борсуков А. В., Венидиктова Д. Ю., Смирнова А. Д., Якушева М. А. Жесткость, упругость, эластичность, плотность — клиническая интерпретация физических свойств тканей печени для врача ультразвуковой диагностики. Медицинский алфавит. 2023;28:37-43. doi:10.33667/2078-5631-2023-28-37-43.
15. Barr RG, Wilson SR, Rubens D, et al. Update to the society of radiologists in ultrasound liver elastography consensus statement. Radiology. 2020;296(2):263-74. doi:10.1148/radiol.2020192437.
Об авторах
Д. Ю. ШестаковаРоссия
Шестакова Дарья Юрьевна — к.м.н., с.н.с. Проблемной научно-исследовательской лаборатории "Диагностические исследования и малоинвазивные технологии".
Смоленск
Конфликт интересов:
Нет
А. В. Борсуков
Россия
Борсуков Алексей Васильевич — д.м.н., профессор, директор Проблемной научно-исследовательской лаборатории "Диагностические исследования и малоинвазивные технологии".
Смоленск
Конфликт интересов:
Нет
А. И. Скутарь
Россия
Скутарь Анастасия Ивановна — м.н.с. Проблемной научно-исследовательской лаборатории "Диагностические исследования и малоинвазивные технологии".
Смоленск
Конфликт интересов:
Нет
А. Р. Ахмедова
Россия
Ахмедова Алида Рустамовна — аспирант Проблемной научно-исследовательской лаборатории "Диагностические исследования и малоинвазивные технологии".
Смоленск
Конфликт интересов:
Нет
Дополнительные файлы
- Впервые предложена балльная система для оценки вклада различных факторов (метаболических и кардиогенных) в повышение жесткости печени у пациентов с кардиометаболическими рисками.
- Мультипараметрическое ультразвуковое исследование печени (В-режим, эластография, стеатометрия) позволяет дифференцировать причины изменения жесткости печени: стеатоз, фиброз, венозный застой или их сочетание.
- Использование балльной системы обеспечивает точность и воспроизводимость диагностики, что способствует более персонализированному подходу к лечению пациентов с метаболически ассоциированной стеатозной болезнью печени.
- Результаты исследования подтверждают ценность ультразвуковых методов диагностики для определения выраженности изменений в печени, связанных с венозным застоем, у пациентов с хронической сердечной недостаточностью.
- Разработанный протокол ультразвукового исследования может стать основой для стандартизации диагностики в клинической практике и научных исследованиях.
Рецензия
Для цитирования:
Шестакова Д.Ю., Борсуков А.В., Скутарь А.И., Ахмедова А.Р. Мультипараметрическое ультразвуковое исследование печени у пациентов кардиологического профиля с избыточной массой тела: определение причины фиброза и выраженности стеатоза. Российский кардиологический журнал. 2025;30(1):6163. https://doi.org/10.15829/1560-4071-2025-6163. EDN: XYHCSX
For citation:
Shestakova D.Yu., Borsukov A.V., Skutar A.I., Akhmedova A.R. Multiparametric ultrasound liver examination in cardiological overweight patients: determining the cause of fibrosis and severity of steatosis. Russian Journal of Cardiology. 2025;30(1):6163. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6163. EDN: XYHCSX
JATS XML

















































