Перейти к:
Семейная форма гипертрофической кардиомиопатии со среднежелудочковой обструкцией на фоне вариантов в генах MYH7, FHOD3 и BAG3: клинический случай
https://doi.org/10.15829/1560-4071-2024-6146
EDN: VIRLCM
Аннотация
Введение. Гипертрофическая кардиомиопатия со среднежелудочковой обструкцией (ГКМП СрОб) представляет собой подгруппу повышенного риска неблагоприятных исходов среди пациентов с данной формой кардиомиопатии, способствующей формированию апикальной аневризмы, которая является анатомическим субстратом для развития злокачественных аритмий, тромбоэмболий, а также прогрессирования до "конечной стадии" с развитием систолической сердечной недостаточности. Генетические причины ГКМП СрОб мало описаны в отечественной и зарубежной литературе.
Краткое описание. Мы представляем клинический случай пациентки 54 лет с семейной формой ГКМП с формированием изолированной СрОб на фоне редких миссенс-вариантов в генах MYH7, FHOD3 и BAG3. Клиническая картина была представлена пароксизмальной формой фибрилляции предсердий, а также пароксизмами неустойчивой желудочковой тахикардии.
Дискуссия. Согласно европейскому калькулятору оценки риска внезапной сердечной смерти пациентка стратифицирована в группу промежуточного риска, однако дополнительно было принято во внимание наличие зон контрастного усиления гадолиния в миокарде при магнитно-резонансной томографии, а также отсутствие подходящих условий для хирургического устранения СрОб, что явилось ключевым в определении показаний к имплантации кардиовертера-дефибриллятора в рамках первичной профилактики внезапной сердечной смерти.
Ключевые слова
Для цитирования:
Андреева С.Е., Марусова М.О., Борцова М.А., Костарева А.А. Семейная форма гипертрофической кардиомиопатии со среднежелудочковой обструкцией на фоне вариантов в генах MYH7, FHOD3 и BAG3: клинический случай. Российский кардиологический журнал. 2024;29(10S):6146. https://doi.org/10.15829/1560-4071-2024-6146. EDN: VIRLCM
For citation:
Andreeva S.E., Marusova M.O., Bortsova M.A., Kostareva A.A. Familial hypertrophic cardiomyopathy with midventricular obstruction associated with MYH7, FHOD3 and BAG3 gene variants: a case report. Russian Journal of Cardiology. 2024;29(10S):6146. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6146. EDN: VIRLCM
Гипертрофическая кардиомиопатия со среднежелудочковой обструкцией (ГКМП СрОб) формируется у пациентов с гипертрофией срединных отделов межжелудочковой перегородки (МЖП), как правило, в сочетании с гипертрофией папиллярных мышц [1]. Критерием ГКМП СрОб является выявление градиента давления на уровне срединных отделов ≥30 мм рт.ст. [2]. СрОб выявляется в порядка 10% всех случаев ГКМП, из них у 15-30% развивается верхушечная аневризма, которая может стать субстратом для фатальных желудочковых аритмий и тромбов в полостях сердца [3][4]. В проспективных исследованиях наличие СрОб являлось надежным предиктором прогрессирования до "конечной стадии" ГКМП ("выгорания") и связанной с ней сердечной недостаточности, равно как и внезапной сердечной смерти (ВСС) [5]. Данные о генетических причинах ГКМП СрОб являлись предметом изучения ограниченного количества зарубежных работ, а также скромно представлены в отечественной литературе [6][7].
Мы представляем клинический случай пациентки 54 лет с ГКМП СрОб на фоне вариантов в генах MYH7, FHOD3, BAG3 неопределенной клинической значимости, с семейным анамнезом по развитию ГКМП, госпитализированной для решения вопроса об имплантации кардиовертера-дефибриллятора (ИКД).
Клинический случай
Жалобы при поступлении. На эпизоды учащенного ритмичного сердцебиения, "замирания", длительностью до 10 мин, возникают ежедневно, купируются самостоятельно. Переносимость физических нагрузок высокая. Одышку, отеки нижних конечностей, ангинозные боли не описывает.
Анамнез заболевания. Пациентка без анамнеза гипертонической болезни, артериальное давление при самоконтроле 120/80 мм рт.ст. В возрасте 44 лет на плановой электрокардиограмме были выявлены инфарктоподобные изменения, что привело к госпитализации, дообследованию, по результатам которого был установлен диагноз ГКМП (рис. 1). Результаты эхокардиографии (ЭхоКГ) за тот период не представлены. На тот момент жалоб пациентка не предъявляла. Назначена терапия метопролола сукцинатом 25 мг 2 раза/сут., наблюдалась у кардиолога по месту жительства.
В возрасте 53 лет отметила возникновение коротких эпизодов учащенного ритмичного сердцебиения, "замирания", выполнено плановое холтеровское мониторирование электрокардиограммы (метопролол сукцинат 25 мг 2 раза/сут.): синусовый ритм с частотой сердечных сокращений (ЧСС) 51-65-108 уд./мин, 846 одиночных желудочковых экстрасистол, эпизод желудочковой тахикардии (7 комплексов) с ЧСС 144 уд./мин, 532 одиночных наджелудочковых экстрасистол. ЭхоКГ в возрасте 53 лет: левое предсердие 38 мм, конечно-диастолический размер 42 мм, конечно-диастолический объем 62 мл, МЖП максимально утолщена до 21 мм, задняя стенка левого желудочка (ЛЖ) до 18 мм, фракция выброса Симпсон 71%, максимальный градиент в выносящем тракте ЛЖ (ВТЛЖ) 61 мм рт.ст., правый желудочек (ПЖ) 25 мм, передняя стенка ПЖ 5 мм, TAPSE 19 мм, нижняя полая вена спадается >50%, расчетное давление в легочной артерии не повышено.
Выполнена коронарография — значимых ангиографических изменений не выявлено.
В возрасте 54 лет — дебют фибрилляции предсердий (ФП), потребовавшей госпитализации, синусовый ритм восстановлен посредством электроимпульсной терапии. Назначен апиксабан в дозе 5 мг 2 раза/сут. На фоне инициированной терапии амиодароном зафиксирован амиодарон-индуцированный тиреотоксикоз, что привело к замене амиодарона на соталол 40 мг 2 раза/сут.
Пациентка была направлена на телемедицинскую консультацию в ФГБУ "НМИЦ им. В. А. Алмазова", по результатам которой была отобрана на госпитализацию для решения вопроса об ИКД.
Анамнез жизни. Работает (отделочник). Вредные привычки в прошлом и на настоящий момент отрицает. Наследственность: отягощена, у родной сестры в 51 год установлен диагноз ГКМП, перенесла радиочастотную аблацию по поводу ФП в 57 лет, на настоящий момент жива, 58 лет. Тетя по линии отца умерла внезапно в 40 лет, имела заболевание сердца. Родословная пациентки представлена на рисунке 2. Значимая сопутствующая патология представлена атеросклерозом брахиоцефальных артерий со стенозом до 30%, по поводу чего получает розувастатин 40 мг и эзетимиб 10 мг.
Объективный осмотр — без особенностей. ЧСС 56 уд./мин. Тоны сердца ясные, ритмичные, шум не выслушивается. Артериальное давление 115/80 мм рт.ст. Дыхание везикулярное. Печень не увеличена. Отеков нет. Индекс массы тела — 25 кг/м2.
Результаты обследования. По результатам лабораторных исследований — без значимых отклонений. Гемоглобин 146 г/л, лейкоцитоза нет. Аланин- и аспартатаминотрансферазы, билирубин, электролиты в норме. Креатинин 81 мкмоль/л, скорость клубочковой фильтрации по CKD-EPI 71 мл/мин/1,73 м2. Липидограмма на фоне липидоснижающей терапии: общий холестерин 3,3 ммоль/л, холестерин липидов низкой плотности 1,5 ммоль/л, триглицериды 1,7 ммоль/л, холестерин липидов высокой плотности 1,1 ммоль/л.
На электрокардиограмме: синусовый ритм с ЧСС 56 уд./мин, электрическая ось сердца в норме, признаки гипертрофии ЛЖ, изменения реполяризации в виде глубоких отрицательных зубцов Т в отведениях I, II, III, aVF, V4-V6 (рис. 3).
По данным ЭхоКГ в возрасте 54 лет: глобальная систолическая функция ЛЖ сохранена (фракция выброса Симпсон 69%), зон локального нарушения сократимости не выявлено. Дилатация левого предсердия (индекс объема 77 мл/м2). Концентрическая гипертрофия ЛЖ с максимальным утолщением МЖП до 23 мм на уровне срединных отделов. Отмечается обструктивный кровоток на уровне средней трети ЛЖ (область папиллярных мышц, не из-за переднесистолического движения передней створки митрального клапана) — с максимальным градиентом 49 мм рт.ст. Диастолическая дисфункция 2 степени. Результаты ЭхоКГ представлены в таблице 1.
По данным магнитно-резонансной томографии (МРТ) сердца с контрастным усилением гадолинием: дилатация левого предсердия (47*45 мм), остальные камеры сердца не расширены. Выраженная асимметричная гипертрофия миокарда ЛЖ, в большей степени срединных отделов МЖП (до 24 мм). Отчетливого переднесистолического движения створок митрального клапана не выявлено. Полость ЛЖ в систолу на уровне срединных отделов практически не дифференцируется. Глобальная сократительная способность ЛЖ сохранена (66%). Толщина миокарда ПЖ 4-8 мм. Нарушений локальной сократимости не выявлено. Данных за апикальную аневризму не получено. На отсроченных постконтрастных изображениях во всех стенках ЛЖ определяются интрамуральные фиброзные изменения (рис. 3).
Генетическое тестирование. Методом секвенирования нового поколения с применением целевого обогащения было проведено исследование 39 генов, ассоциированных с развитием ГКМП, а также её т. н. "фенокопий", с последующей верификацией результата по Сэнгеру. Выявлены варианты в генах: MYH7 (p.Thr1929Met), FHOD3 (p.Ala493Thr), BAG3 (p.Cys179Trp), все в гетерозиготном состоянии, которые интерпретированы как варианты неопределенной клинической значимости (VUS) (табл. 2).
Медицинские вмешательства. Выполнена стратификация риска ВСС по шкале "HCM-SCD" (европейская модель), расчетный риск составил 5,35% (промежуточный) [8]. Принимая во внимание изолированную СрОб, перспективы успешной миоэктомии трансаортальным доступом были расценены как сомнительные. Было также учтено наличие зон позднего контрастного усиления гадолиния при МРТ сердца во всех стенках ЛЖ. Результаты генетического тестирования на момент госпитализации еще не были известны. Принято решение об имплантации ИКД-DR. В связи с минимальной ЧСС до 40 уд./мин на фоне небольших доз соталола (40 мг 2 раза/сут.), выбор пал на ИКД с функцией двухкамерной электрокардиостимуляции по требованию для расширения перспектив титрации антиаритмической терапии.
Клинический диагноз. Основной: ГКМП со СрОб, семейная форма. Риск ВСС по шкале "HCM-SCD" 5,35%, промежуточный (дата расчета 10.12.2023). Генетические варианты в MYH7 (p.Thr1929Met), FHOD3 (p.Ala493Thr), BAG3 (p.Cys179Trp) неопределенной клинической значимости по ACMG. Имплантация двухкамерного ИКД Intica Neo 5 DR-T (IS-1;DF-1) от 12.12.2023.
Осложнения: Пароксизмальная форма ФП, вне пароксизма. CHA2DS2-VASc — 1 балл. HAS-BLED — 0 баллов. EHRA III. Электроимпульсная терапия с восстановлением синусового ритма от 05.03.2023. Желудочковая экстрасистолия 5 градации по Ryan. Пароксизмы неустойчивой мономорфной желудочковой тахикардии. Морганьи-Адамса-Стокса (-).
Сопутствующий: Гиперлипидемия 2б типа. Атеросклероз брахиоцефальных артерий гемодинамически незначимый. Амиодарон-индуцированный тиреотоксикоз в анамнезе, эутиреоз. Коронарография от 05.11.2023.
Динамика и исходы. На настоящий момент на фоне антиаритмической терапии соталолом наблюдаются повторные пароксизмы тахисистолической ФП, требующие госпитализации и проведения электроимпульсной терапии, в связи с чем планируется проведение радиочастотной аблации субстрата аритмии.
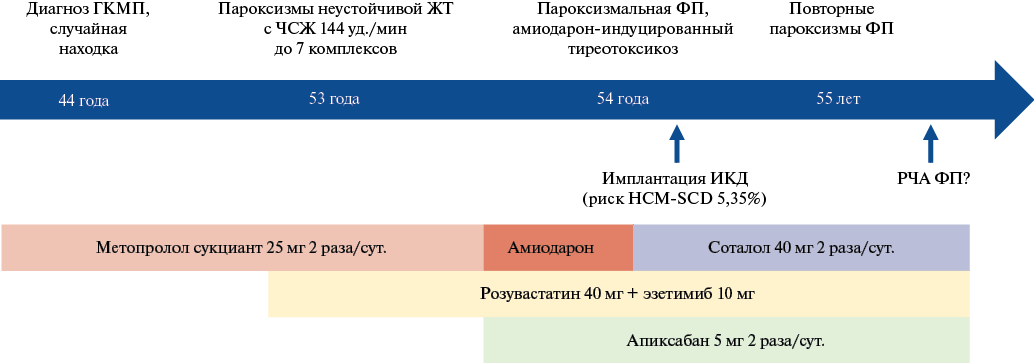
Рис. 1. Динамика клинических проявлений и проводимая терапия.
Сокращения: ГКМП — гипертрофическая кардиомиопатия, ЖТ — желудочковая тахикардия, ИКД — имплантируемый кардиовертер-дефибриллятор, РЧА — радиочастотная аблация, ФП — фибрилляция предсердий, ЧСЖ — частота сокращений желудочков.
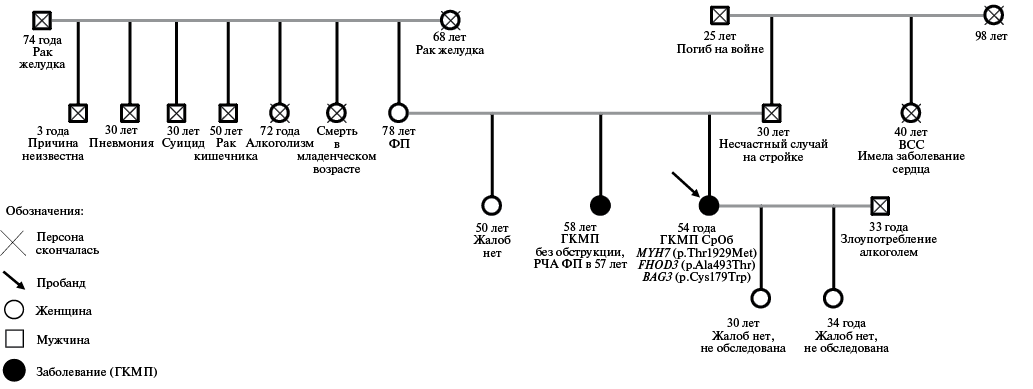
Рис. 2. Родословная пациентки c семейной формой с ГКМП со СрОб на фоне вариантов в генах MYH7, FHOD3, BAG3.
Примечание: для живых пациентов указан возраст на момент составления родословной, для умерших пациентов указан возраст смерти и причина, со слов пациентки.
Сокращения: ВСС — внезапная сердечная смерть, ГКМП — гипертрофическая кардиомиопатия, РЧА — радиочастотная аблация, СрОб — среднежелудочковая обструкция, ФП — фибрилляция предсердий.
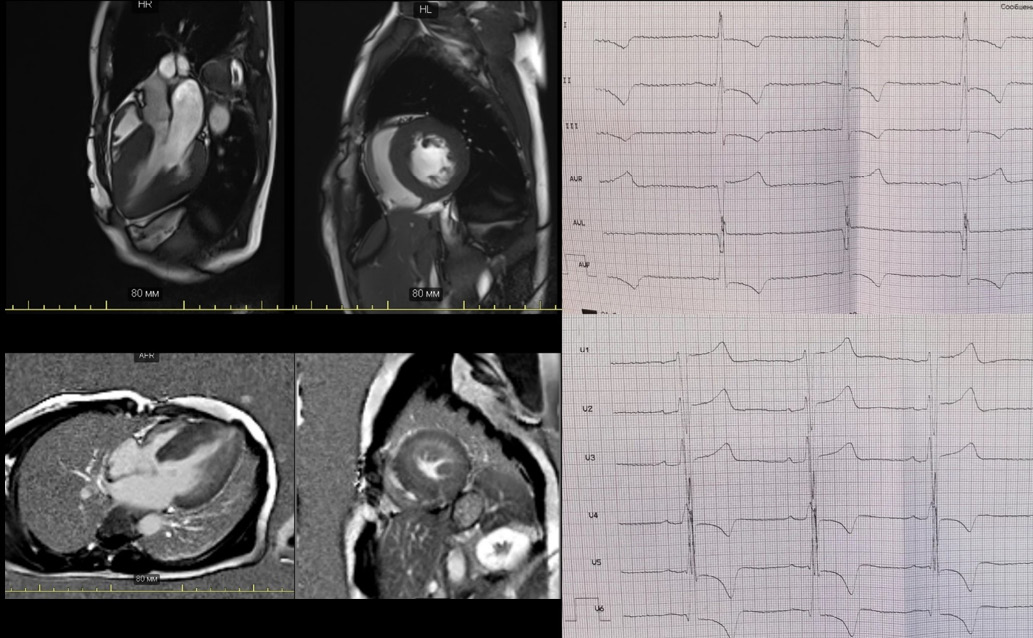
Рис. 3. Результаты МРТ сердца (А-Г) и электрокардиограмма (Д-Е) пациентки.
Примечание: визуализируется гипертрофия всех стенок ЛЖ, включая верхушку, с максимумом в срединных отделах МЖП, а также гипертрофия миокарда правого желудочка. На отсроченных постконтрастных изображениях (В, Г) — интрамуральные фиброзные изменения по всех стенках ЛЖ.
Таблица 1
Результаты ЭхоКГ пациентки 54 лет с ГКМП со СрОб
Параметр | Результат | Единицы измерения |
Левое предсердие | 50 | мм |
Объем левого предсердия | 135 | мл |
Индекс объема левого предсердия | 77 | мл/м2 |
Межжелудочковая перегородка, базально: Срединные отделы | 18 23 | мм |
Задняя стенка левого желудочка | 18 | мм |
Индекс массы миокарда | 190 | г/м2 |
Относительная толщина стенок | 0,86 | |
Фракция выброса левого желудочка по Симпсон | 69 | % |
Конечный диастолический размер | 42 | мм |
Конечный диастолический объем | 128 | мл |
Индекс конечного диастолического объема | 73 | мл/м2 |
Конечный систолический объем | 40 | мл |
Индекс конечного систолического объема | 23 | мл/м2 |
Ударный объем | 88 | мл |
Площадь правого предсердия | 15 | см2 |
Правый желудочек, базально | 34 | мм |
Правый желудочек, передне-задний размер | 27 | мм |
Передняя стенка правого желудочка | 4 | мм |
TAPSE | >17 | мм |
Расчетное систолическое давление в легочной артерии | 24 | мм рт.ст. |
Градиент в ВТЛЖ, максимальный | 12 | мм рт.ст. |
Градиент на уровне срединных отделов, максимальный | 49 | мм рт.ст. |
Пик Е | 0,73 | м/сек |
Пик А | 0,74 | м/сек |
e' септальный | 5 | см/сек |
e' латеральный | 7 | см/сек |
Е/А | 0,99 | |
Е/е' | 12 | |
Deceleration time | 154 | мсек |
Диастолическая дисфункция | 2 | степени |
Передне-систолическое движение митрального клапана | нет | |
Митральная регургитация | 1 | степени |
Аортальная регургитация | нет | |
Пульмональная регургитация | приклапанная | |
Трикуспидальная регургитация | приклапанная |
Сокращения: ВТЛЖ — выносящий тракт левого желудочка, TAPSE — систолическая экскурсия кольца трикуспидального клапана.
Таблица 2
Характеристика выявленных генетических вариантов у пациентки
Характеристика/ген | MYH7 | FHOD3 | BAG3 |
Хромосомная позиция | Chr14:23882972 | Сhr18:34232723 | Chr10:121431796 |
Вариант | NM_000257.4: c.C5786T: p.Thr1929Met | NM_001281740.3: c.G1477A: p.Ala493Thr | NM_004281.4: c.C537G: p.Cys179Trp |
Номер rs | rs730880918 | rs1440337292 | rs1564774433 |
Зиготность | гетеро- | гетеро- | гетеро- |
Частота по GnomAD, % | 0.005308 | 0.006378 | не зарегистрирован |
Патогенность по ACMG/AMP | VUS | VUS | VUS |
Примечание: по сборке hg38. VUS — вариант неопределенной клинической значимости.
Обсуждение
Представленный клинический случай демонстрирует клиническое течение ГКМП СрОб у пациентки с комбинацией редких миссенс-вариантов в генах MYH7, FHOD3 и BAG3 и семейным анамнезом по развитию ГКМП и ВСС.
Гены белков саркомеров (MYH7, MYBPC3 и др.) являются наиболее распространенной причиной ГКМП у генотип-позитивных пациентов [1]. В то же время известно, что пенетрантность саркомерных вариантов составляет лишь порядка 50% [9], что побуждает исследователей к поиску других генетических и приобретенных причин, влияющих на реализацию фенотипа ГКМП. В этом отношении гены FHOD3 и BAG3 примечательны тем, что их частые варианты имеют наиболее сильную ассоциацию с фенотипом ГКМП по результатам полногеномных исследований ассоциаций [10][11]. Редкие же варианты гена, который кодирует белок FHOD3, участвующий в сборке актина в кардиомиоцитах, относительно недавно были описаны как одна из причин развития ГКМП в 1-2% случаев [12]. Описания редких вариантов гена BAG3, играющего критическую роль в процессах белковой деградации и апоптоза, в связи с ГКМП ограничены единичными клиническими случаями при узком спектре мутаций [13].
В приведенном клиническом примере проведение генетического исследования у сестры пробанда, имеющей фенотип ГКМП, а также каскадного клинического и генетического скрининга среди других родственников пациентки могло существенно повлиять на интерпретацию выявленных генетических вариантов и их вклад в реализацию фенотипа кардиомиопатии в данной семье, однако, не было доступно на момент написания статьи, но рассматривается в будущем.
Красной линией здесь проходил вопрос стратификации риска ВСС, поскольку известно, что среднежелудочковый морфологический вариант ГКМП является одним из неблагоприятных фенотипов с точки развития апикальной аневризмы, дилатации и сопутствующих рисков ВСС [1]. Европейский калькулятор стратификации риска ВСС "HCM-SCD" формально учитывает только градиент на уровне ВТЛЖ, но не учитывает степень СрОб [8]. Семейный анамнез ВСС в 40 лет у тети пациентки также не попадал под критерии, применяемые в данном калькуляторе. Возможности хирургического лечения как метода, способного повлиять на прогноз заболевания, в данном случае были ограничены. Следует отметить, что согласно данным литературы, хирургическое лечение ГКМП СрОб трансапикальным доступом демонстрирует благоприятные отдаленные результаты в опытных центрах, но не представляется широко распространённой тактикой как в России, так и за рубежом [1][3], в то время как трансаортальный доступ предоставляет ограниченные возможности в коррекции СрОб. Данные МРТ сердца с контрастным усилением гадолинием, которые учитывает американская модель расчета риска ВСС [2], здесь были необходимы для исключения апикальной аневризмы (не выявлена у пациентки), учета степени распространенности фиброза (интрамуральные фиброзные изменения во всех стенках ЛЖ) и явились одним из обоснований к постановке ИКД у пациентки с промежуточным риском ВСС.
Заключение
ГКМП с СрОб является важной морфологической формой ГКМП, ассоциированной с повышенным риском развития неблагоприятных исходов. Такие пациенты требуют персонализированного подхода при стратификации риска ВСС с применением методов мультимодальной визуализации. Редкие миссенс-варианты в генах FHOD3 и BAG3 могут рассматриваться как модификаторы реализации фенотипа ГКМП, либо же могут быть интерпретированы в качестве самостоятельной причины заболевания при получении дополнительных сегрегационных данных.
Информированное согласие
От пациентки получено письменное добровольное информированное согласие на публикацию результатов обследования и лечения (дата подписания 06.12.2023).
Отношения и деятельность. Работа выполнена при финансовой поддержке гранта РНФ 15-20-00271 П.
Список литературы
1. Габрусенко С. А.., Гудкова А. Я., Козиолова Н. А. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
2. Ommen SR, Mital S, Burke MA, et al. 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy. Circulation. 2020;142:558-631. doi:10.1161/CIR.0000000000000937.
3. Schaff HV, Juarez-Casso FM. Treatment Strategies for Hypertrophic Cardiomyopathy: Surgical. Am J Cardiol. 2024;212:S53-63. doi:10.1016/j.amjcard.2023.10.053.
4. Maeda R, Minami Y, Haruki S, et al. Implantable cardioverter defibrillator therapy and sudden death risk stratification in hypertrophic cardiomyopathy patients with midventricular obstruction: A single-center experience. Int J Cardiol. 2016;214:419-22. doi:10.1016/J.IJCARD.2016.03.231.
5. Efthimiadis GK, Pagourelias ED, Parcharidou D, et al. Clinical characteristics and natural history of hypertrophic cardiomyopathy with midventricular obstruction. Circ J. 2013;77:2366-74. doi:10.1253/CIRCJ.CJ-12-1561.
6. Inagaki N, Hayashi T, Takei Y, et al. Clinical and genetic backgrounds of hypertrophic cardiomyopathy with mid-ventricular obstruction. J Hum Genet. 2018;63:1273-6. doi:10.1038/S10038-018-0509-9.
7. Комиссарова С. М., Ринейская Н. М., Чакова Н. Н. и др. Смешанный фенотип: некомпактный миокард левого желудочка и гипертрофическая кардиомиопатия. Кардиология. 2020;60(4):137-45. doi:10.18087/CARDIO.2020.4.N728.
8. Arbelo E, Protonotarios A, Gimeno JR, et al. 2023 ESC Guidelines for the management of cardiomyopathies: Developed by the task force on the management of cardiomyopathies of the European Society of Cardiology (ESC). Eur Heart J. 2023;44:3503-626. doi:10.1093/eurheartj/ehad194.
9. Lorenzini M, Norrish G, Field E, et al. Penetrance of Hypertrophic Cardiomyopathy in Sarcomere Protein Mutation Carriers. J Am Coll Cardiol. 2020;76:550-9. doi:10.1016/J.JACC.2020.06.011.
10. Harper AR, Goel A, Grace C, et al. Common genetic variants and modifiable risk factors underpin hypertrophic cardiomyopathy susceptibility and expressivity. Nat Genet. 2021;53:135-42. doi:10.1038/s41588-020-00764-0.
11. Tadros R, Francis C, Xu X, et al. Shared genetic pathways contribute to risk of hypertrophic and dilated cardiomyopathies with opposite directions of effect. Nat Genet. 2021;53:12834. doi:10.1038/s41588-020-00762-2.
12. Ochoa JP, Sabater-Molina M, García-Pinilla JM, et al. Formin Homology 2 Domain Containing 3 (FHOD3) Is a Genetic Basis for Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2018;72:2457-67. doi:10.1016/j.jacc.2018.10.001.
13. Lin H, Koren SA, Cvetojevic G, et al. The role of BAG3 in health and disease: A "Magic BAG of Tricks". J Cell Biochem. 2022;123:421. doi:10.1002/jcb.29952.
Об авторах
С. Е. АндрееваРоссия
София Евгеньевна Андреева — врач-кардиолог, аспирант кафедры кардиологии, лаборант-исследователь НЦМУ "Центр персонализированной медицины"
Санкт-Петербург
М. О. Марусова
Россия
Мария Олеговна Марусова — врач-кардиолог кардиологического отделения № 8
Санкт-Петербург
М. А. Борцова
Россия
Мария Александровна Борцова — к.м.н., зав. кардиологическим отделением № 8
Санкт-Петербург
А. А. Костарева
Россия
Анна Александровна Костарева— д.м.н., директор Института молекулярной биологии и генетики
Санкт-Петербург
Дополнительные файлы
- Форма гипертрофической кардиомиопатии со среднежелудочковой обструкцией ассоциирована с худшим прогнозом.
- Магнитно-резонансную томографию сердца с контрастным усилением гадолинием рекомендуется выполнять таким пациентам с целью выявления апикальной аневризмы, определения распространенности фиброза для решения вопроса об имплантации кардиовертера-дефибриллятора.
- Редкие миссенс-варианты в генах FHOD3и BAG3могут выступать в качестве модификаторов реализации фенотипа гипертрофической кардиомиопатии, в т. ч. ее среднежелудочковых форм, либо же могут быть интерпретированы в качестве самостоятельной причины заболевания при выявлении дополнительных подтверждающих данных.
Рецензия
Для цитирования:
Андреева С.Е., Марусова М.О., Борцова М.А., Костарева А.А. Семейная форма гипертрофической кардиомиопатии со среднежелудочковой обструкцией на фоне вариантов в генах MYH7, FHOD3 и BAG3: клинический случай. Российский кардиологический журнал. 2024;29(10S):6146. https://doi.org/10.15829/1560-4071-2024-6146. EDN: VIRLCM
For citation:
Andreeva S.E., Marusova M.O., Bortsova M.A., Kostareva A.A. Familial hypertrophic cardiomyopathy with midventricular obstruction associated with MYH7, FHOD3 and BAG3 gene variants: a case report. Russian Journal of Cardiology. 2024;29(10S):6146. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6146. EDN: VIRLCM
JATS XML

















































