Перейти к:
Болезнь Данона у женщин: современный взгляд на проблему: серия клинических случаев
https://doi.org/10.15829/1560-4071-2024-6142
EDN: MDUURV
Аннотация
Введение. Болезнь Данона — редкая кардиомиопатия (КМП) с мультисистемным поражением, которая связана с полиморфизмами гена LAMP2, кодирующего лизосом-ассоциированный мембранный протеин 2 (LAMP2). Данный белок является важнейшим регулятором аутофагии и продуцируется преимущественно в миокарде, скелетных мышцах и головном мозге, что находит отражение в классической триаде заболевания: гипертрофическая КМП, скелетная миопатия и когнитивные нарушения. Болезнь Данона характеризуется максимальной пенетрантностью независимо от пола, тогда как экспрессивность значительно менее предсказуема у женщин, учитывая X-сцепленный доминантный тип наследования и мозаицизм клеточной продукции протеина LAMP2 в результате случайной инактивации одной из X-хромосом.
Краткое описание. В статье представлены два клинических случая, демонстрирующие различные варианты течения заболевания у женщин с болезнью Данона. Проведены анализ данных историй болезни, оценка клинической картины, результатов лабораторного и инструментального обследования.
Дискуссия. В последние годы широкое развитие молекулярно-генетической диагностики и методов визуализации привело к накоплению информации о естественном течении и прогнозе болезни Данона. Стало понятно, что у пациентов женского пола с болезнью Данона, прежде рассматриваемых, в основном, как носителей мутации, клинические проявления могут варьировать от малосимптомных фенотипов с изолированным развитием КМП до тяжелых форм заболевания с мультисистемным поражением и ранним дебютом. Повышение осведомленности практикующих врачей об особенностях течения болезни Данона у женщин, мультидисциплинарное обследование, а также
Ключевые слова
Для цитирования:
Мясников Р.П., Нефедова Д.А., Кузина Н.Н., Куликова О.В., Гагарина Е.В., Мершина Е.А., Драпкина О.М. Болезнь Данона у женщин: современный взгляд на проблему: серия клинических случаев. Российский кардиологический журнал. 2024;29(10S):6142. https://doi.org/10.15829/1560-4071-2024-6142. EDN: MDUURV
For citation:
Myasnikov R.P., Nefedova D.A., Kuzina N.N., Kulikova O.V., Gagarina E.V., Mershina E.A., Drapkina O.M. Danon disease in women: a modern view of the problem: a case series. Russian Journal of Cardiology. 2024;29(10S):6142. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6142. EDN: MDUURV
Болезнь Данона — редкая кардиомиопатия (КМП) с мультисистемным поражением, связанная с полиморфизмами гена LAMP2, кодирующего лизосом-ассоциированный мембранный протеин 2 (LAMP2). Исходя из названия, данный белок является важнейшим компонентом мембран лизосом и регулирует процесс аутофагии. Варианты гена LAMP2 приводят к снижению экспрессии или полному отсутствию протеина, в результате чего нарушается цитоплазматический обмен и происходит накопление нерасщепленного гликогена и иного аутофагического материала с образованием крупных вакуолей. Следствием этого, в свою очередь, является гипертрофия клеток. Кроме того, возникает дисбаланс энергетического обмена с исходом в окислительный стресс и преждевременную гибель клеток пораженных органов и систем с развитием распространенных фиброзных изменений 1 [1-3].
Несмотря на то, что белок LAMP2 продуцируется во всех тканях, наиболее выраженная его экспрессия наблюдается в миокарде, скелетных мышцах и головном мозге [1][4]. Это находит отражение в классическом фенотипе болезни Данона, для которого характерна триада признаков: гипертрофическая КМП (ГКМП) (одна из наиболее тяжелых и быстро прогрессирующих среди наследственных заболеваний миокарда), скелетная миопатия и когнитивные нарушения. При этом кардиальные симптомы, как правило, превалируют в клинической картине, в то время как мышечные и неврологические проявления менее выражены и могут существенно различаться [1][5-8]. Помимо этого, также могут обнаруживаться признаки вовлечения в патологический процесс сетчатки, печени и легких [1].
Согласно литературным данным, болезнь Данона характеризуется максимальной пенетрантностью независимо от пола, тогда как экспрессивность значительно менее предсказуема у женщин, что может проявляться не только малосимптомным фенотипом, но и тяжелой КМП (вплоть до фульминантного течения), учитывая X-сцепленный доминантный тип наследования и мозаицизм клеточной продукции протеина LAMP2 в результате случайной инактивации одной из X-хромосом1 [1].
В нашей статье представлены разные варианты течения заболевания у женщин с болезнью Данона.
Клинические случаи
На базе ФГБУ "НМИЦ терапии и профилактической медицины" Минздрава России (НМИЦ ТПМ) сформирован регистр пациентов с гипертрофией миокарда, которым было выполнено молекулярно-генетическое исследование. Из этой когорты были выбраны пациенты с вариантами гена LAMP2. Проведены анализ данных историй болезни, оценка клинической картины, результатов выполненного лабораторного и инструментального обследования.
Клинический случай 1. Пациентка 21 года, нормостенического телосложения. Рост — 171 см, вес — 71 кг. В 2017г в возрасте 14 лет при плановой регистрации электрокардиограммы (ЭКГ) впервые были выявлены признаки гипертрофии миокарда левого желудочка (ГЛЖ) и полная блокада правой ножки пучка Гиса. По данным эхокардиографии (ЭхоКГ) верифицирована концентрическая симметричная ГЛЖ до 1,8 см без признаков обструкции полости и выносящего тракта левого желудочка (ВТЛЖ). На основании проведенных обследований был установлен диагноз ГКМП. В 2019г выполнена магнитно-резонансная томография (МРТ) сердца с гадолинием (рис. 1), по результатам которой выявлены эксцентрическая асимметричная ГЛЖ (толщина межжелудочковой перегородки (МЖП) до 1,9 см, толщина боковой стенки левого желудочка (ЛЖ) до 1,6 см), протяженные участки замедления перфузии и отсроченного контрастирования, расположенные в ЛЖ субэндокардиально и интрамиокардиально (суммарный объем фиброзных изменений составлял 15% массы миокарда ЛЖ), что было расценено как сочетание ишемических и первичных фиброзных изменений. По результатам молекулярно-генетического исследования выявлен вероятно-патогенный вариант гена LAMP2. С антифибротической целью был назначен спиронолактон. В 2020г по данным ЭхоКГ отмечалось нарастание ГЛЖ до 2,3 см. С лета 2021г пациентка отметила появление одышки при физической нагрузке (ФН), а также однократный приступ учащенного сердцебиения, в связи с чем в декабре 2021г была впервые госпитализирована в НМИЦ ТПМ. При проведении холтеровского мониторирования ЭКГ (ХМ-ЭКГ) на "чистом фоне" отмечались синусовая брадикардия (средняя частота сердечных сокращений (ЧСС) 53 уд./мин), атриовентрикулярная (АВ) блокада I степени, пробежки наджелудочковой тахикардии, пробежки желудочковой тахикардии (ЖТ). По данным ЭхоКГ — выраженная симметричная ГЛЖ без обструкции полости и ВТЛЖ, фракция выброса (ФВ) ЛЖ 66%, диастолическая дисфункция ЛЖ III типа (рестриктивного), незначительная дилатация левого предсердия (ЛП), митральная регургитация 2 степени. В анализах крови наблюдалось повышение N-концевого промозгового натрийуретического пептида (NT-proBNP) до 2400 пг/мл. Учитывая высокий риск внезапной сердечной смерти при расчете по шкале HCM Risk-SCD (https://qxmd.com/calculate/calculator_303/hcm-risk-scd) и распространенный фиброз миокарда, был имплантирован двухкамерный кардиовертер-дефибриллятор (КВД). Инициирован прием бета-адреноблокаторов и диуретиков в низкой дозе, продолжен прием спиронолактона. После выписки пациентка самостоятельно отменила все лекарственные препараты. В ноябре 2022г во время быстрой ходьбы потеряла сознание и была госпитализирована в стационар, где при проверке КВД зафиксирован пароксизм ЖТ с трансформацией в фибрилляцию желудочков (ФЖ), купированный разрядом 41 Дж. По ХМ-ЭКГ регистрировались частая желудочковая экстрасистолия (3163/сут.) и пробежки ЖТ. Пациентке было рекомендовано увеличение дозы бисопролола до 7,5 мг/сут., однако от приема терапии отказывалась. При плановой проверке КВД в октябре 2023г суммарно зарегистрировано 15 эпизодов доставки шоковой терапии по поводу ЖТ/ФЖ (все эпизоды на фоне высокой ЧСС ~140 уд./мин). В динамике по данным ЭхоКГ отмечалось снижение ФВ ЛЖ до 50%. Был инициирован прием атенолола 50 мг/сут., при контрольном ХМ-ЭКГ ЖТ не было. В последующем потери сознания, срабатывания КВД не рецидивировали, назначенную терапию принимала регулярно, однако с начала 2024г пациентку начали беспокоить учащенное сердцебиение, жжение в груди и одышка при незначительной ФН. По данным ЭхоКГ от марта 2024г отмечались тенденция к дилатации левых камер сердца (ЛП 4,2 см, конечно-диастолический размер ЛЖ 5,2 см), снижение ФВ ЛЖ до 40%, акинез апикальных сегментов ЛЖ с распространением на средний сегмент МЖП, снижение сократимости правого желудочка (TAPSE 1,0 см), а также определялся тромб 2,2×1,5×0,8 см в верхушке ЛЖ. Госпитализирована в НМИЦ ТПМ в апреле 2024г, где начат прием варфарина, а также квадротерапия сердечной недостаточности (СН). В анализах крови отмечалось нарастание NT-proBNP до 3824 пг/мл, тропонина I до 104,7 пг/мл, а также повышение креатинфосфокиназы (КФК), аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ). Проведена коронароангиография, по данным которой коронарные артерии интактны. При проверке КВД эпизодов ЖТ/ФЖ не было. После выписки пациентка чувствовала себя относительно удовлетворительно, при контрольной ЭхоКГ от июля 2024г данных за тромбоз ЛЖ не получено, сохранялись снижение ФВ ЛЖ до 40% и акинез верхушечных сегментов ЛЖ. Продолжена терапия СН и антикоагулянтная терапия, запланировано обследование в динамике через 3 мес.
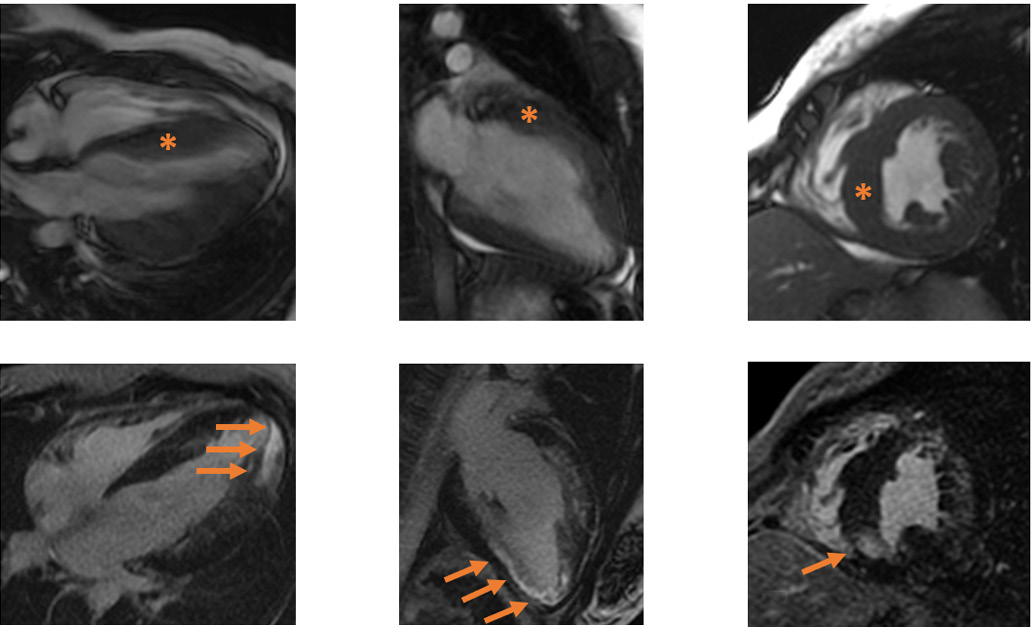
Рис. 1. МРТ сердца пациентки 1.
Примечание: (А-В) — кино-режим, SSFP-последовательность: А — длинная ось ЛЖ, 4-камерная проекция, Б — длинная ось ЛЖ, 2-камерная проекция, В — короткая ось на уровне средних сегментов ЛЖ; (Г-Е) — отсроченное контрастирование, IR-последовательность с подавлением сигнала от миокарда: Г — длинная ось ЛЖ, 4-камерная проекция, Д — длинная ось ЛЖ, 2-камерная проекция, Е — короткая ось на уровне средних сегментов ЛЖ.
ЛЖ умеренно расширен (индексированный КДО ЛЖ — 102 мл/м2 при норме 55-95 мл/м2), сократимость его не снижена, ФВ ЛЖ 57%. ПЖ умеренно расширен (индексированный КДО ПЖ — 104 мл/м2 при норме 58-94 мл/м2), сократимость его не снижена, ФВ ПЖ 55%. Гипертрофия миокарда ЛЖ с максимальной толщиной миокарда на уровне среднего нижнеперегородочного сегмента до 19 мм.
* — гипертрофия миокарда ЛЖ. Стрелками указаны зоны интрамиокардиального и субэндокардиального контрастирования по боковой и нижней стенкам ЛЖ и в МЖП.
Сокращения: КДО — конечно-диастолический объем, ЛЖ — левый желудочек, МЖП — межжелудочковая перегородка, ПЖ — правый желудочек, ФВ — фракция выброса.
Клинический случай 2. Пациентка 31 года, нормостенического телосложения. Рост — 172 см, вес — 93 кг. В анамнезе профессиональные занятия бальными танцами в течение 15 лет. В 2017г в возрасте 24 лет при плановом обследовании выявлена ГКМП без обструкции полости и ВТЛЖ. С 2019г пациентка начала отмечать эпизоды учащенного неритмичного сердцебиения, при ХМ-ЭКГ регистрировались феномен предвозбуждения желудочков, частая наджелудочковая экстрасистолия, пробежки наджелудочковой тахикардии. В апреле 2019г были проведены электрофизиологическое исследование сердца и радиочастотная аблация (РЧА) медленных путей АВ-соединения, однако после операции сохранялись приступы нарушений ритма сердца (НРС). В августе 2020г при повторном электрофизиологическом исследовании верифицирована фибрилляция предсердий (ФП), выполнена криобаллонная аблация устьев легочных вен, назначена терапия соталолом 160 мг/сут. с положительным эффектом. С июня 2021г после перенесенной острой респираторной вирусной инфекции у пациентки возобновились приступы учащенного сердцебиения, по данным ХМ-ЭКГ выявлено атипичное трепетание предсердий (ТП). По ЭхоКГ от января 2022г отмечались ГЛЖ до 1,6 см, признаки фиброзных изменений миокарда нижней и боковой стенок ЛЖ, незначительная дилатация ЛП. В феврале 2022г выполнена РЧА кавотрикуспидального истмуса, пограничного гребня, верхней полой вены. Назначался амиодарон 200 мг/сут., однако после выписки сохранялись частые симптомные пароксизмы ФП/ТП, в связи с чем в дальнейшем амиодарон был заменен на бисопролол 5 мг/сут. В апреле 2022г проведена МРТ сердца с гадолинием (рис. 2), по результатам которой описаны симметричная ГЛЖ до 1,5 см, обширная сливная зона интрамиокардиального фиброза ЛЖ, при этом характер накопления контраста, высокое время Т1 и увеличение ECV не позволяли исключить фенокопию ГКМП (болезни накопления/гликогеновые болезни). В ноябре 2022г пациентка впервые была госпитализирована в НМИЦ ТПМ, где выполнено высокоплотное картирование предсердий с последующей РЧА аритмогенных зон левого и правого предсердий. Взят анализ крови с целью проведения молекулярно-генетического исследования. В декабре 2022г — рецидив ФП без дальнейшего восстановления синусового ритма. По данным ХМ-ЭКГ от февраля 2023г — ритм ФП с ЧСС 78-126-141 уд./мин, 1 эпизод ширококомплексной тахикардии с частотой желудочковых сокращений 180 уд./мин длительностью 2 секунды (расценено как аберрация проведения), частая желудочковая экстрасистолия (3254/сут.). На фоне сохраняющейся тахисистолии у пациентки отмечались нарастание одышки и симптомная гипотония. Амбулаторно увеличена доза бисопролола без значимого эффекта, в связи с чем в июне 2023г была повторно госпитализирована в НМИЦ ТПМ, где выполнена электрическая кардиоверсия с последующим назначением амиодарона по насыщающей схеме в комбинации с бисопрололом. При проведении молекулярно-генетического исследования был выявлен нуклеотидный вариант chrX:120455543dup в гетерозиготном состоянии гена LAMP2. В анализах крови обращало на себя внимание повышение КФК, АСТ, ЛДГ, а также NТ-proBNP до 962 пг/мл. Инициирована прогноз-модифицирующая терапия: дапаглифлозин, спиронолактон. После выписки отмечалось возобновление ФП. Учитывая неэффективность антиаритмической терапии, выраженную тахисистолию, невозможность назначения адекватной ритм-урежающей терапии в связи со склонностью к гипотонии, принято решение о выполнении деструкции АВ-соединения. Первым этапом в августе 2023г проведена операция имплантации однокамерного электрокардиостимулятора. Вторым этапом планировалось проведение РЧА АВ-соединения, однако при поступлении в стационар в ноябре 2023г у пациентки зарегистрирован синусовый ритм с ЧСС 63 уд./мин. Проведена нагрузочная проба, по результатам которой НРС спровоцировано не было. По ЭхоКГ — без динамики. В связи с восстановлением синусового ритма принято решение отказаться от операции деструкции АВ-узла, продолжена терапия амиодароном в комбинации с бисопрололом. При контрольном обследовании в феврале 2024г сохранялся синусовый ритм, НРС не рецидивировали, отмечалось повышение толерантности к ФН. В настоящее время в отношении дальнейшей тактики ведения пациентки решается вопрос об имплантации КВД/ресинхронизирующего устройства, учитывая наличие болезни Данона с распространенным интрамиокардиальным фиброзом и ассоциированный с этим повышенный риск внезапной сердечной смерти.
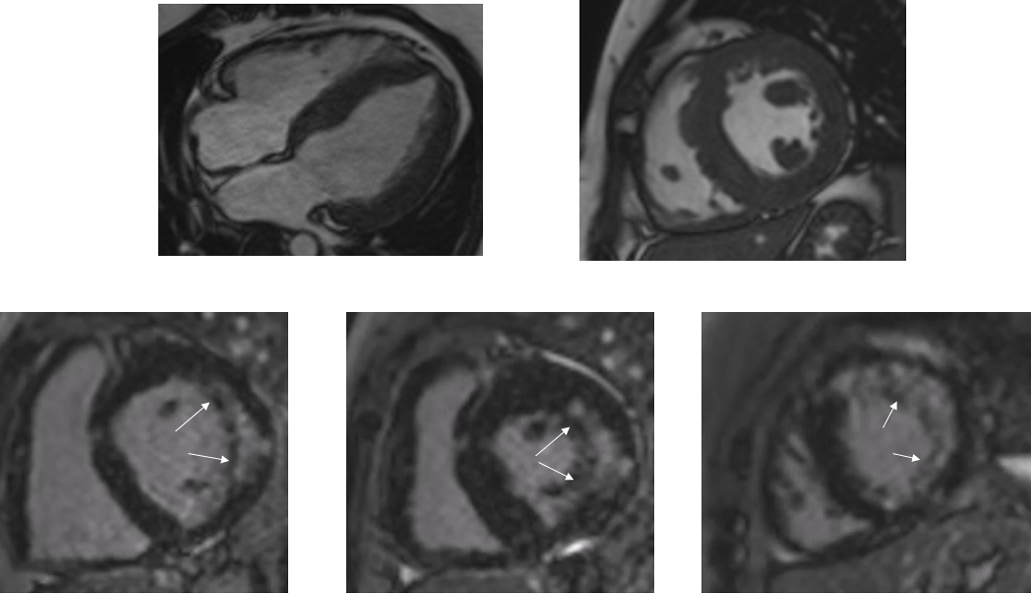
Рис. 2. МРТ сердца пациентки 2.
Примечание: (А, Б) — кино-режим, SSFP-последовательность: А — длинная ось ЛЖ, 4-камерная проекция, Б — короткая ось на уровне средних сегментов ЛЖ; (В-Д) — отсроченное контрастирование, IR-последовательность с подавлением сигнала от миокарда: В — короткая ось на уровне базальных сегментов ЛЖ, Г — короткая ось на уровне средних сегментов ЛЖ, Д — короткая ось на уровне апикальных сегментов ЛЖ.
Симметричная гипертрофия миокарда ЛЖ: толщина МЖП до 14 мм, толщина задней стенки ЛЖ до 15 мм, индекс массы миокарда ЛЖ — 129 г/м, гипертрофия папиллярных мышц (толщина передней мышцы — 16 мм, задняя мышца имеет 2 головки). ЛЖ расширен (КДО ЛЖ — 181 мл, КСО ЛЖ — 58 мл), сократимость его не снижена, ФВ ЛЖ 68%. Стрелками указаны участки диффузно-сливного интрамиокардиального накопления контраста по боковой, передней и нижней стенкам ЛЖ неишемического генеза.
Сокращения: КДО — конечно-диастолический объем, КСО — конечно-систолический объем, ЛЖ — левый желудочек, МЖП — межжелудочковая перегородка, ФВ — фракция выброса.
Обсуждение
В последние годы более широкое распространение визуализирующих и молекулярно-генетических методов диагностики, а также активный научный интерес привели к накоплению информации относительно естественного течения и прогноза болезни Данона, в т. ч. о тяжести заболевания не только у пациентов мужского пола, гомозиготных по полиморфизмам гена LAMP2, но и у гетерозиготных женщин [1][5][7][9-14].
Ведущим клиническим проявлением болезни Данона является тяжелая кардиальная патология. У большей части пациентов, независимо от гендерной принадлежности, отмечаются симптомы и признаки СН, что было подчеркнуто в систематическом обзоре Brambatti M, et al. (2019), в котором проанализированы данные 146 пациентов (90 мужчин и 56 женщин) с верифицированным диагнозом болезни Данона, при этом у 92,5% больных имелась клиника нарушений сердечной деятельности [1][7].
Однако наблюдаются значимые различия в типе ремоделирования миокарда в связи с полом: в то время как для мужчин характерна ГКМП, приводящая в 25% случаев к обструкции ВТЛЖ, у женщин может обнаруживаться как гипертрофический, так и дилатационный или гипокинетический недилатационный фенотипы в 30-50% случаев [1]. Так, в ранее упомянутой работе Brambatti M, et al. (2019) ремоделирование по гипертрофическому типу отмечалось в 96,2% случаев у пациентов мужского пола и в 70,3% — у лиц женского пола; дилатационная КМП у женщин наблюдалась с меньшей частотой — в 29,3% случаев [7]. Тем не менее в настоящий момент достоверно неизвестно, является ли дилатационный фенотип у женщин независимым видом ремоделирования или же он выступает как этап клинического континуума заболевания, при котором первично развивается гипертрофия миокарда, а затем, вследствие гибели кардиомиоцитов и заместительного фиброза, сердце становится гипокинетическим и далее дилатированным. В нередких случаях относительно благоприятного и медленно прогрессирующего течения болезнь Данона у лиц женского пола может быть не диагностирована длительный период времени до наступления поздних стадий заболевания [1][9][14]. В 1 клиническом примере отчетливо видно прогрессирование болезни от выраженной гипертрофии миокарда с массивным фиброзом до постепенной дилатации полостей со снижением ФВ ЛЖ на протяжении 7 лет.
Также стоит отметить, что у женщин наблюдается более выраженное и частое снижение ФВ ЛЖ по сравнению с мужчинами, у которых глобальная сократимость нередко остается сохранной вплоть до поздних стадий заболевания [1][15]. В частности, Lotan D, et al. (2020) были опубликованы результаты многоцентрового исследования, согласно которым отмечалось снижение ФВ до 28±13% у 59% женщин (из 27 вошедших в исследование) и до 34±11% у 40% мужчин (из 30 участвовавших) [5]. Это также нашло отражение у нашей пациентки (клинический случай 1).
Наблюдаемый диффузный и прогрессирующий фиброз является морфологическим субстратом электрической нестабильности миокарда и часто приводит к развитию нарушений ритма и проводимости сердца. Ранними проявлениями болезни Данона могут выступать укорочение интервала PQ и/или наличие дельта-волны на ЭКГ, суправентрикулярные тахикардии (включая ФП и ТП) и желудочковые аритмии, в частности, ЖТ и ФЖ, встречающиеся приблизительно у 60% пациентов. Нарушения проводимости аналогично широко распространены (от 35% до 50% больных) и могут быть представлены как блокадами синоатриального, так и АВ уровня, в т. ч. с наличием показаний к имплантации электрокардиостимулятора, а также нарушениями внутрижелудочковой проводимости [1][8]. В наших клинических примерах отчетливо видно разнообразное течение заболевания. У пациентки 1 превалировали нарушения проводимости и жизнеугрожающие НРС, тогда как у пациентки 2, наоборот, ведущими стали наджелудочковые аритмии, не поддающиеся интервенционному лечению. Как правило, нарушения ритма и блокады у женщин манифестируют в более поздние сроки, чем у мужчин, однако в литературе описаны и случаи развития аритмий в раннем возрасте у девочек [16]. Распространенность НРС обычно сопоставима среди полов [5]. Так, феномен предвозбуждения часто наблюдается у представителей обоих полов, но несколько реже у лиц женского пола (27%) по сравнению с мужчинами (69%) [1][6][17]. Кроме того, на ЭКГ нередко может обнаруживаться высокий вольтаж с изменениями реполяризации в рамках гипертрофии миокарда, что чаще отмечается у пациентов мужского пола [1].
Повсеместность экспрессии протеина LAMP2 во всех тканях и органах лежит в основе полисистемного поражения при болезни Данона. Однако, если для мужчин характерны экстракардиальные проявления, то у женщин данная симптоматика зачастую непредсказуема, может быть минимальна или отсутствовать вовсе [1][2][5-8].
Ведущим внесердечным проявлением выступает скелетная миопатия с преобладающим вовлечением проксимальных мышечных групп, что выражается в слабости, а также менее специфичных миалгии и снижении толерантности к ФН, которые, как правило, незначительны и преобладают у пациентов мужского пола. Наряду с этим в лабораторных анализах отмечается характерное повышение уровней аланинаминотрансферазы, АСТ, КФК и ЛДГ как маркеров продолжающегося повреждения миоцитов [1][12]. Несмотря на отсутствие клинических проявлений миопатии, в крови у обеих пациенток было отмечено повышение КФК и ЛДГ, что расценено как системное проявление болезни Данона.
В целом, для женщин, гетерозиготных по полиморфизмам гена LAMP2, в большинстве случаев характерны более поздний дебют, медленное прогрессирование и мягкая клиническая картина заболевания, нежели у мужчин [1][2][5-8][18]. Однако у наших пациенток болезнь дебютировала в молодом возрасте, и проявления в первом случае носили жизнеугрожающий характер с быстрым прогрессированием явлений СН, а во втором случае сопровождались тяжелой клинической симптоматикой в виде непрерывно рецидивирующих гемодинамически значимых наджелудочковых аритмий. Неблагоприятное течение заболевания у лиц женского пола находит отражение и в работе Hong KN, et al. (2022), в которой проведен анализ данных 38 пациентов (19 женщин и 19 мужчин) с болезнью Данона, перенесших трансплантацию сердца. Средний возраст достижения указанного исхода составил 20,2 года, причем он был одинаков для обоих полов [12].
Исходя из вышесказанного, X-сцепленный доминантный тип наследования приводит к значительно более вариабельному, но не обязательно менее тяжелому течению заболевания у женщин по сравнению с пациентами мужского пола, в связи с чем не следует рассматривать их исключительно как носителей вариантов гена LAMP2, поскольку это может повлечь недооценку ранних симптомов, отсрочить постановку диагноза и начало лечения [1][9][10][14]. Преимущественно поздний дебют, медленное прогрессирование, фенотипическое разнообразие и невыраженность или полное отсутствие экстракардиальных проявлений существенно затрудняют диагностику болезни Данона у лиц женского пола, которая может быть верифицирована случайным образом по результатам молекулярно-генетического исследования [1][5]. Кроме того, невысокая распространенность данной нозологии может являться основой для некоторого пренебрежения в спектре дифференциально диагностического поиска [10]. В связи с этим уровень внимания к болезни Данона должен оставаться высоким независимо от пола пациентов, а понимание патофизиологии и клинического течения заболевания может способствовать своевременным постановке диагноза, стратификации риска и началу лечения, а в будущем и отбору больных для генной терапии, проходящей в настоящее время клинические испытания [19].
Заключение
Болезнь Данона — КМП с мультисистемным поражением и X-сцепленным доминантным наследованием. Накопление и популяризация знаний об естественном течении и исходах заболевания, в т. ч. о возможности неблагоприятного прогноза у женщин, крайне важны для ранних диагностики и инициации лечения, особенно в эпоху прогрессивно развивающейся генной терапии наследственных КМП.
Информированное согласие
У всех пациентов было получено письменное информированное согласие на размещение информации в публикации.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Taylor MRG, Adler ED. Danon Disease. In: Adam MP, Feldman J, Mirzaa GM, et al., eds. GeneReviews®. Seattle (WA): University of Washington, Seattle; March 5, 2020.
Список литературы
1. Hong KN, Eshraghian EA, Arad M, et al. International Consensus on Differential Diagnosis and Management of Patients With Danon Disease: JACC State-of-the-Art Review. J Am Coll Cardiol. 2023;82(16):1628-47. doi:10.1016/j.jacc.2023.08.014.
2. Sugie K, Komaki H, Eura N, et al. A Nationwide Survey on Danon Disease in Japan. Int J Mol Sci. 2018;19(11):3507. doi:10.3390/ijms19113507.
3. Endo Y, Furuta A, Nishino I. Danon disease: a phenotypic expression of LAMP-2 deficiency. Acta Neuropathol. 2015;129(3):391-8. doi:10.1007/s00401-015-1385-4.
4. Hong KN, Brambatti M, John S, et al. Recommendations and guidance on the diagnosis and management of Danon disease. Expert Opinion on Orphan Drugs. 2021;9(1):25-33. doi:10.1080/21678707.2021.1882994.
5. Lotan D, Salazar-Mendiguchía J, Mogensen J, et al. Clinical Profile of Cardiac Involvement in Danon Disease: A Multicenter European Registry. Circ Genom Precis Med. 2020;13(6): e003117. doi:10.1161/CIRCGEN.120.003117.
6. Cenacchi G, Papa V, Pegoraro V, et al. Review: Danon disease: Review of natural history and recent advances. Neuropathol Appl Neurobiol. 2020;46(4):303-22. doi:10.1111/nan.12587.
7. Brambatti M, Caspi O, Maolo A, et al. Danon disease: Gender differences in presentation and outcomes. Int J Cardiol. 2019;286:92-8. doi:10.1016/j.ijcard.2019.01.020.
8. López-Sainz Á, Salazar-Mendiguchía J, García-Álvarez A, et al. Clinical Findings and Prognosis of Danon Disease. An Analysis of the Spanish Multicenter Danon Registry. Rev Esp Cardiol (Engl Ed). 2019;72(6):479-86. doi:10.1016/j.rec.2018.04.035.
9. Hedberg Oldfors C, Máthé G, Thomson K, et al. Early onset cardiomyopathy in females with Danon disease. Neuromuscul Disord. 2015;25(6):493-501. doi:10.1016/j.nmd.2015.03.005.
10. Olivotto I, Favilli S. Rare X-linked storage heart diseases are tougher on men but not kind to women. Int J Cardiol. 2019;286:113-4. doi:10.1016/j.ijcard.2019.03.007.
11. Bottillo I, Giordano C, Cerbelli B, et al. A novel LAMP2 mutation associated with severe cardiac hypertrophy and microvascular remodeling in a female with Danon disease: a case report and literature review. Cardiovasc Pathol. 2016;25(5):423-31. doi:10.1016/j.carpath.2016.07.005.
12. Hong KN, Battikha C, John S, et al. Cardiac Transplantation in Danon Disease. J Card Fail. 2022;28(4):664-9. doi:10.1016/j.cardfail.2021.11.007.
13. Gandaeva L, Sonicheva-Paterson N, McKenna WJ, et al. Clinical features of pediatric Danon disease and the importance of early diagnosis. Int J Cardiol. 2023;389:131189. doi:10.1016/j.ijcard.2023.131189.
14. Samad F, Jain R, Jan MF, et al. Malignant cardiac phenotypic expression of Danon disease (LAMP2 cardiomyopathy). Int J Cardiol. 2017;245:201-6. doi:10.1016/j.ijcard.2017.06.031.
15. Rigolli M, Kahn AM, Brambatti M, et al. Cardiac Magnetic Resonance Imaging in Danon Disease Cardiomyopathy. JACC Cardiovasc Imaging. 2021;14(2):514-6. doi:10.1016/j.jcmg.2020.08.011.
16. Благова О. В., Коган Е. А., Седов В. П. и др. Кардиомиопатия с рестриктивно-гипертрофическим фенотипом и первоначальным морфологическим диагнозом "амилоидоз" как проявление болезни Данона у женщины. Рациональная Фармакотерапия в Кардиологии. 2020;16(2):231-9. doi:10.20996/18196446-2020-03-01.
17. Jhaveri S, Herber J, Zahka K, et al. Arrhythmias and fasciculoventricular pathways in patients with Danon disease: A single center experience. J Cardiovasc Electrophysiol. 2019;30(10):1932-8. doi:10.1111/jce.14049.
18. Вайханская Т. Г., Сивицкая Л. Н., Даниленко Н. Г. и др. Болезнь Данона: Редко выявляемое системное заболевание с LAMP2-кардиомиопатией. Российский кардиологический журнал. 2017;(10):93-9. doi:10.15829/1560-4071-2017-10-93-99.
19. Rossano J, Taylor M, Lin K, et al. Abstract 11117: Phase 1 Danon Disease Results: The First Single Dose Intravenous (IV) Gene Therapy (RP-A501) With Recombinant AdenoAssociated Virus (AAV9:LAMP2B) for a Monogenic Cardiomyopathy. Circulation. 2022;(146):146:A11117. doi:10.1161/circ.146.suppl_1.11117.
Об авторах
Р. П. МясниковРоссия
Роман Петрович Мясников — к. м. н., руководитель лаборатории персонализированной диагностики, профилактики и терапии некоронарогенных заболеваний сердца Института персонализированной терапии и профилактики, в. н. с. отдела клинической кардиологии
Москва
Д. А. Нефедова
Россия
Дарья Антоновна Нефедова— лаборант-исследователь лаборатории персонализированной диагностики, профилактики и терапии некоронарогенных заболеваний сердца Института персонализированной терапии и профилактики, отдела клинической кардиологии
Москва
Н. Н. Кузина
Россия
Надежда Николаевна Кузина — лаборант-исследователь отдела клинической кардиологии
Москва
О. В. Куликова
Россия
Ольга Викторовна Куликова — к.м.н., с.н.с. лаборатории персонализированной диагностики, профилактики и терапии некоронарогенных заболеваний сердца Института персонализированной терапии и профилактики, отдела клинической кардиологии
Москва
Е. В. Гагарина
Россия
Евгения Викторовна Гагарина — м.н.с. отдела клинической кардиологии ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» Минздрава России; ассистент кафедры лучевой диагностики факультета фундаментальной медицины ФГБОУ ВО «МГУ им. М.В. Ломоносова»
Москва
Е. А. Мершина
Россия
Елена Александровна Мершина — к.м.н., доцент кафедры лучевой диагностики и лучевой терапии, зав. отделением рентгенодиагностики с кабинетами магнитно-резонансной и компьютерной томографии
Москва
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — академик РАН, д.м.н., профессор, директор
Москва
Дополнительные файлы
- Болезнь Данона — кардиомиопатия с мультисистемным поражением, связанная с полиморфизмами гена LAMP2и характеризующаяся триадой проявлений: гипертрофическая кардиомиопатия, скелетная миопатия и когнитивные нарушения.
- X-сцепленное доминантное наследование заболевания и асимметричная инактивация одной из X-хромосом в каждой клетке у женщин лежат в основе развития широкого спектра клинических проявлений: не только легких, но и крайне тяжелых.
- Пациентов женского пола не следует рассматривать лишь как носителей заболевания, поскольку это может повлечь недооценку ранних симптомов, отсрочить постановку диагноза и начало лечения.
- В статье представлены два клинических случая, отражающих различные варианты течения заболевания у женщин с болезнью Данона.
Рецензия
Для цитирования:
Мясников Р.П., Нефедова Д.А., Кузина Н.Н., Куликова О.В., Гагарина Е.В., Мершина Е.А., Драпкина О.М. Болезнь Данона у женщин: современный взгляд на проблему: серия клинических случаев. Российский кардиологический журнал. 2024;29(10S):6142. https://doi.org/10.15829/1560-4071-2024-6142. EDN: MDUURV
For citation:
Myasnikov R.P., Nefedova D.A., Kuzina N.N., Kulikova O.V., Gagarina E.V., Mershina E.A., Drapkina O.M. Danon disease in women: a modern view of the problem: a case series. Russian Journal of Cardiology. 2024;29(10S):6142. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6142. EDN: MDUURV
JATS XML

















































