Перейти к:
Магнитно-резонансная томография сердца при аритмогенной кардиомиопатии: развитие критериев диагностики и новые возможности
https://doi.org/10.15829/1560-4071-2024-6118
Аннотация
В обновленных диагностических критериях аритмогенной кардиомиопатии (АКМ) (2020 и 2022гг) магнитно-резонансная томография (МРТ) стала предпочтительным методом визуализации сердца. Это связано с достижениями в области МРТ и накоплением доказательной базы о достоверности метода. Неинвазивная оценка фиброзного замещения миокарда с помощью методик отсроченного накопления контрастного вещества на основе гадолиния (LGE) - ключевое нововведение, которое наравне с данными гистологии, вошло в категорию "структурные изменения". Методика продемонстрировала свою ценность в выявлении различных фенотипов АКМ (прежде всего левожелудочковой формы), в дифференциальной диагностике и семейном скрининге заболевания. Актуальность данных МРТ доказана в прогнозировании рисков неблагоприятных сердечно-сосудистых событий, в т.ч. внезапной сердечной смерти. Отдельные МРТ-методики, такие как Т1-картирование, оценка деформации миокарда, находятся в стадии изучения, но они уже показали свою перспективность в исследованиях на небольших группах. Получение и интерпретация данных МРТ сердца у пациентов с АКМ требует не только стандартизированных протоколов и высокого опыта врача-рентгенолога, но и командной работы с врачами-кардиологами. В статье суммируются текущие возможности МРТ при АКМ и предоставляется практический подход к диагностике и стратификации рисков.
Ключевые слова
Для цитирования:
Александрова С.А., Глазкова Е.Ю., Голухова Е.З. Магнитно-резонансная томография сердца при аритмогенной кардиомиопатии: развитие критериев диагностики и новые возможности. Российский кардиологический журнал. 2024;29(11S):6118. https://doi.org/10.15829/1560-4071-2024-6118
For citation:
Aleksandrova S.A., Glazkova E.Yu., Golukhova E.Z. Cardiac magnetic resonance imaging in arrhythmogenic cardiomyopathy: evolving diagnostic criteria and new capabilities. Russian Journal of Cardiology. 2024;29(11S):6118. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6118
Одно из первых упоминаний случая семейного поражения правого желудочка (ПЖ) у молодых людей относится к 1736г, а в 1982г на препаратах сердечной мышцы у молодых пациентов с правожелудочковой тахикардией было продемонстрировано частичное или полное замещение миоцитов жировой и/или фиброзной тканью [1]. Первоначально заболевание считалось дефектом развития, поражающим только ПЖ, поэтому Fontain G. предложил использовать термин "аритмогенная дисплазия правого желудочка" (АДПЖ) [2]. Позже был показан семейный характер заболевания, и дисплазию реклассифицировали в кардиомиопатию.
Исследования в области молекулярно-генетической биологии и данные методов визуализации показали, что заболевание поражает оба желудочка, и в зависимости от вовлеченности в патологический процесс можно дополнительно к правожелудочковому типу выделить бивентрикулярный и левожелудочковый тип [3]. Это послужило распространению более общего понятия "аритмогенная кардиомиопатия" (АКМ) [4]. Эксперты общества сердечного ритма (HRS) в 2019г интерпретировали АКМ "как аритмогенное расстройство сердечной мышцы, не объясняемое ишемической, гипертонической или клапанной болезнью сердца" [5]. Чтобы исключить различные толкования, рабочая группа Европейского общества кардиологов в 2023г представила обновленные клинические рекомендации по диагностике и лечению кардиомиопатий (ESC-2023) [6]. Взяв за основу фенотипический подход, предлагается пользоваться термином "аритмогенная кардиомиопатия ПЖ" при наличии дилатации и/или аномалии движения преимущественно стенки ПЖ с вовлечением или без вовлечения левого желудочка (ЛЖ) и соблюдении критериев диагностики 2010г [7]. АКМ изолированного ЛЖ попадает в новую группу "недилатационная кардиомиопатия".
Corrado D, et al. придерживаются другой концепции и предлагают сохранить и объединить 3 различных фенотипа единым термином "аритмогенная кардиомиопатия", чтобы подчеркнуть общую неишемическую рубцовую природу поражения миокарда при различных фенотипах заболевания [4].
Методология исследования
Проводился поиск и анализ работ, посвященных теме обзора, опубликованных на ресурсах Pubmed, и eLIBRARY.ru, по ключевым словам: "arrhythmogenic cardiomyopathy", "сardiac magnetic resonance" "late gadolinium enhancement". Оценивались работы по данной тематике за последние 10 лет. Всего проанализировано 160 статей, из которых отобрано 49 в наибольшей мере соответствовавших целям обзора.
Результаты
Диагностические критерии
Распространенность АКМ в общей популяции колеблется от 1:1000 до 1:5000 среди взрослых, а по некоторым оценкам, до 1:2000 [8][9]. У большинства пациентов с АКМ заболевание длительно протекает бессимптомно, когда эпизоды желудочковой аритмии (ЖА) наблюдаются при сохранной морфологии и функции желудочков. Пристальное внимание к заболеванию связано с высокими рисками внезапной сердечной смерти (ВСС), которые оцениваются >20% у молодых и до 35% у спортсменов [10]. Широкий спектр фенотипических проявлений и пересечение признаков с другими кардиомиопатиями, особенно с дилатационной кардиомиопатией (ДКМП), гипертрофической кардиомиопатией (ГКМП), синдромом Бругада значительно затрудняют дифференциальную диагностику [5]. Кроме этого, проявление заболевания сильно варьирует даже среди членов одной семьи с одним и тем же генетическим вариантом.
Отсутствие единого метода, который бы позволил однозначно установить диагноз, привело к формированию комплексного подхода на основании пошаговой оценки различных критериев с учетом специфичности их связи с АДПЖ. В 1994г McKenna WJ, et al. были опубликованы первые критерии диагностики, которые включали структурные, гистологические, электрокардиографические, аритмические и наследственные признаки этого заболевании (ITF-1994, международные критерии целевой группы для диагностики АКМ/дисплазии ПЖ) [11]. В них оценивали аномалии функции и структуры миокарда только ПЖ без акцента на вовлечение ЛЖ.
В 2010г с целью повышения чувствительности и специфичности диагностики, особенно для раннего выявления и при семейной истории заболевания критерии диагностики АДПЖ были пересмотрены (TFC-2010, критерии целевой группы для диагностики АКМ/дисплазии ПЖ 2010г) (табл. 1) [7]. Аналогично ITF-1994 модифицированные критерии TFC-2010 сохранили 5 основных категорий, в которые были добавлены новые критерии оценки и впервые были включены количественные показатели структурных изменений. Это позволило проводить более объективную оценку ПЖ, особенно с помощью методов визуализации, таких как магнитно-резонансная томография (МРТ) и эхокардиография. Важной особенностью стала вероятностная модель диагноза заболевания в соответствии с выполнением различных критериев.
Таблица 1
МРТ параметры в критериях диагностики АКМ 2010 и 2024гг
|
2010 |
2024 |
||
|
Категории |
ПЖ |
ПЖ-фенотип |
ЛЖ-фенотип |
|
I. Морфофункциональные аномалии желудочков* |
Большой • региональная акинезия или дискинезия, или диссинхрония сокращения ПЖ и один из следующих: • отношение КДО ПЖ к площади поверхности тела ≥110 мл/м² (муж.) и ≥100 мл/м² (жен.) • или ФВ ПЖ ≤40% |
Большой • локальный акинез, дискинез или выбухание ПЖ плюс одно из следующих: • глобальная дилатация ПЖ (увеличение КДО ПЖ**) или глобальная систолическая дисфункция ПЖ (снижение ФВ***) |
|
|
Малый • локальный акинез, дискинез или диссинхрония сокращения ПЖ и один из следующих: • отношение КДО ПЖ к площади поверхности тела 100109 мл/м² (муж.) и 9099 мл/м² (жен.) • или ФВ ПЖ 4145% |
Малый • локальный акинез, дискинез или выбухание свободной стенки ПЖ |
Малый • глобальная систолическая дисфункция ЛЖ с дилатацией ЛЖ или без нее (увеличение КДО ЛЖ**) |
|
|
II. Структурные аномалии* |
Большой • "кольцевидный" LGE ЛЖ ≥3 сегментах (субэпикардиальный или интрамиокардиальный паттерн полосы в 2 ортогональных проекциях) |
||
|
Малый • Однозначное LGE ПЖ (в 2 ортогональных проекциях) в ≥1 сегменте ПЖ (исключая трехстворчатый клапан) |
Малый • LGE в ЛЖ в 1 или 2 сегментах свободной стенки, перегородки или обоих (субэпикардиальный или интрамиокардиальный паттерн полосы в 2 ортогональных проекциях) (исключая LGE очаговое, мелкоочаговое и в области септального соединения) |
||
Примечание: * — название категории в критериях диагностики АКМ 2024г, ** — в соответствии с номограммами c учетом возраста, пола и площади поверхности тела, *** — в соответствии с номограммами c учетом возраста и пола.
Сокращения: КДО — конечный диастолический объем, ЛЖ — левый желудочек, ПЖ — правый желудочек, ФВ — фракция выброса, LGE — отсроченное накопление контрастного вещества на основе гадолиния.
Эволюция концепции развития АКМ, ограничения диагностических критериев при вовлечении ЛЖ, а также повышение точности и надежности диагностических методик подтолкнули к появлению новых критериев в 2020г (критерии Падуи) [4]. Ключевые изменения были связаны с введением характеристики ткани с помощью МРТ для выявления фиброзно-жирового замещения миокарда, добавление отдельных критериев для ЛЖ и алгоритма диагностики трех различных фенотипов АКМ.
В 2024г эксперты рабочей группы Corrado D, et al. вынесли на рассмотрение новый проект диагностических критериев (TFC-2024, предложенные критерии целевой группы для диагностики АКМ 2024г) [12]. В своей основной части они повторяют критерии Падуи 2020г, но пересматривают значимость и характерные признаки критериев МРТ в категории структурных аномалий.
Роль МРТ в диагностических критериях
Хотя первая работа с использованием МРТ изображений при АДПЖ датируется 1987г, в критериях ITF-1994 возможности МРТ оцениваются как неопределенные [11]. По мере накопления практического опыта МРТ стало играть все более значимую роль в дифференциальной диагностике АКМ, в прогнозировании течения и стратификации рисков. Критерии Падуи и TFC-2024 фактически закрепили ключевую роль МРТ в выявлении морфофункциональных и структурных изменений при АКМ. Учитывая позицию рабочей группы кардиологов ESC-2023, опирающуюся в диагностике АКМ на TFC-2010, в данном обзоре мы предлагаем рассмотреть текущие возможности МРТ при АКМ и их применение с точки зрения работающих критериев диагностики (табл. 1).
Морфофункциональная оценка
Современная морфофункциональная МРТ оценка базируется на анализе кино-МРТ импульсной последовательности (ИП) сбалансированных изображений стационарной свободной прецессии (bSSFP) и позволяет всесторонне оценить глобальное и региональные изменения обоих желудочков [13]. Характерным признаком АКМ являются локальные изменения движения стенки, которые появляются вследствие фиброзно-жирового замещения миокарда. Акинезы (полная потеря движения), дискинезы (движение сегмента миокарда наружу в систолу) и выбухания (микроаневризмы, которые сохраняются в систолу и диастолу) локализуются преимущественно в области "треугольника дисплазии": приточной отдел, верхушка и область оттока (рис. 1). Анализ проводят в 4-камерной плоскости, по короткой оси и оси выводного тракта ПЖ. Учитывая субъективность оценки и возможность неправильной интерпретации некоторых нормальных вариантов движения стенки ПЖ, а также вариабельность его геометрии, предлагается подтверждать наблюдение в нескольких проекциях [12].
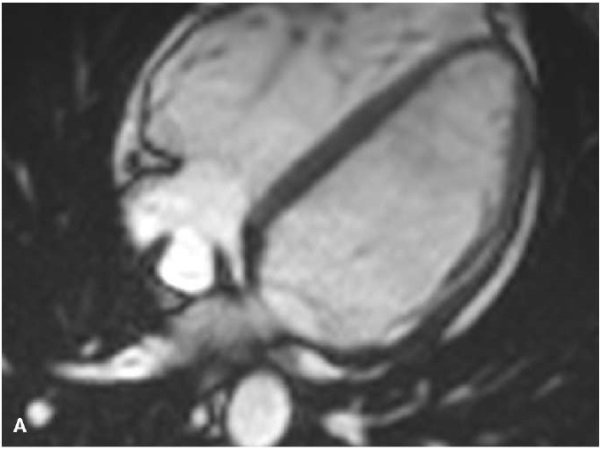
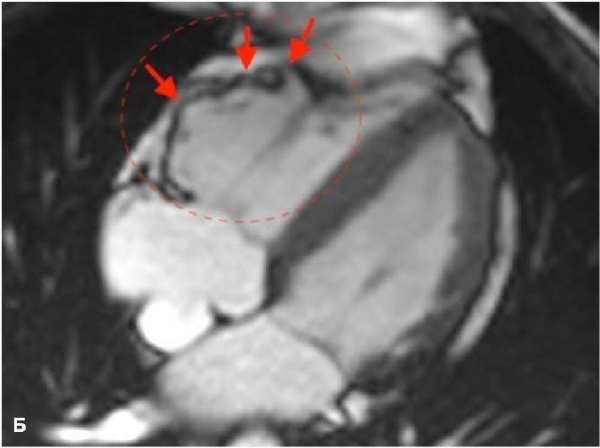
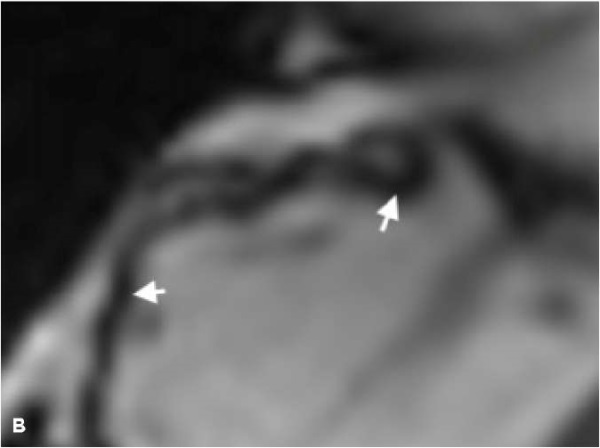
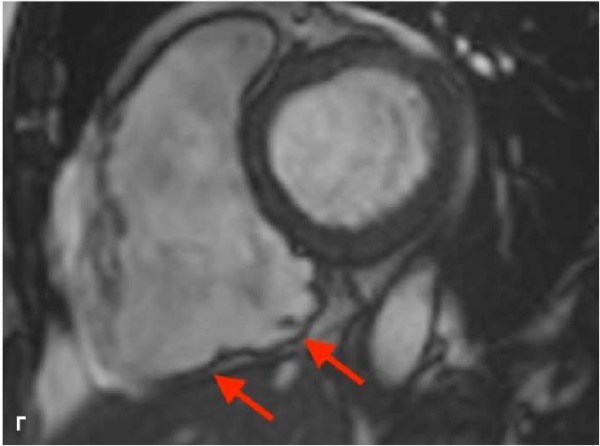
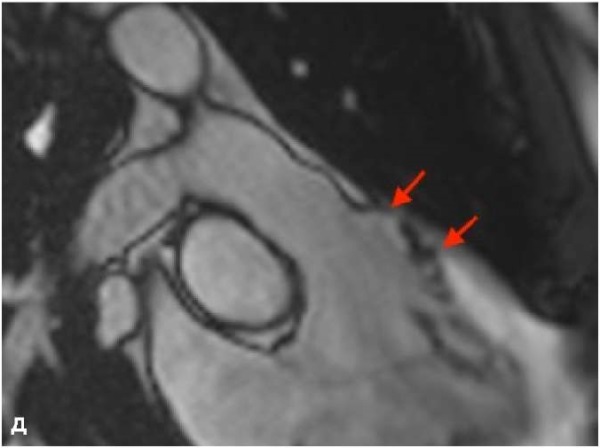
Рис. 1. МРТ — изображения, пациент А., 41 год, мужчина с пароксизмами желудочковой тахикардии и синкопальными состояниями.
Примечание: АКМ бивентрикулярная форма, кино-МРТ (bSSFP последовательность), видны множественные выпячивания/микроаневризмы — дискинеза ПЖ (красные стрелки) в типичных местах "треугольника дисплазии": А — 4-камерная плоскость, диастола; Б — 4-камерная плоскость, систола этого же пациента, видны множественные участки дискинезии по всей свободной стенке ПЖ; В — увеличенное изображение приточной части передней стенки ПЖ, виден артефакт "индийских чернил" или туши (белые стрелки), который представляет собой искусственно созданную черную линию, расположенную на границах раздела сред, приводящий к резкому очерчиванию границы, придавая изображению вид, как будто кто-то обвел эти границы чернилами; Г — короткая ось, систола, дискинезы по нижней стенки ПЖ (под задней створкой трикуспидального клапан); Д — плоскость выводного отдела ПЖ, систола, дискинезы по выходной отдел ПЖ. Расчет функциональных параметров: КДО/BSA ПЖ 97 мл/м², ФВ ПЖ 28%, КДО/BSA ЛЖ 83 мл/м², ФВ ЛЖ 62%. Цветное изображение доступно в электронной версии журнала.
Сокращения: АКМ — аритмогенная кардиомиопатия, КДО — конечный диастолический объем, ЛЖ — левый желудочек, МРТ — магнитно-резонансная томография, ПЖ — правый желудочек, ФВ — фракция выброса, bSSFP — импульсная последовательность сбалансированных изображений стационарной свободной прецессии.
Критерии Падуи и TFC-2024 подчеркивают важность региональных аномалий движения миокарда ПЖ как раннего проявления очаговой природы заболевания и включают этот признак изолированно в малый критерий АКМ. Региональные изменения ПЖ в комбинации с глобальной дисфункцией или дилатацией входят в большой критерии диагностики АКМ у всех авторов [4][7].
Для ЛЖ МРТ признаки локальной акинезии или дискинезии свободной стенки и/или межжелудочковой перегородки (МЖП) не являются патогномоничными и могут встречаться при других заболеваниях, например, ИБС. Поэтому, несмотря на включение региональной дисфункции в малый критерий АКМ ЛЖ в критериях Падуи, эксперты TFC-2024 не подтвердили ее значение и полностью исключили из критериев.
В оценке анатомии и функции метод МРТ по праву считается "золотым стандартом" для ЛЖ [14]. Для ПЖ показана большая, чем для ЛЖ, но достаточно низкая внутри- и межисследовательская вариабельность данных, чтобы считать методику надежным инструментом как для первоначальной оценки ПЖ, так и для динамического наблюдения [15]. Коэффициенты вариации между наблюдателями для объемов ПЖ находятся в диапазоне 6,4-11,3%, показывая высокую воспроизводимость данных [16]. Тем не менее в обычной клинической практике различия могут достигать 20%, что необходимо учитывать при работе с данными из неспециализированных центров [17].
Критерии TFC-2010 определяют пороговые значения фракции выброса (ФВ) и нормализованного конечного диастолического объема ПЖ. Критерии Падуи и TFC-2024 рекомендуют использовать референсные значения для обоих желудочков, полученные для соответствующего метода визуализации. Нормограммы по полу, возрасту и площади поверхности тела были представлены Европейской ассоциацией сердечно-сосудистой визуализации в 2019г [18]. Для спортсменов, занимающихся видами спорта, связанными с наибольшим ремоделированием желудочков, предложены свои эталонные показатели [19]. Необходимость этого перехода связана, во-первых, с ограничениями выборки, используемой для референтных значений TFC-2010, где средний возраст добровольцев (60 лет) значительно превышает возраст пациентов с подозрение на АКМ. Размеры сердца, как было продемонстрировано в нескольких работах, отрицательно коррелируют с возрастом и поэтому могли быть недооценены [20]. Во-вторых, сканирование выполняли с помощью традиционных ИП быстрого градиентного эха — FLASH. Данные, полученные наиболее распространенной сегодня ИП bSSFP, хорошо коррелируют с FLASH, но демонстрируют более высокие значения объема ЛЖ, вероятно, из-за более четкой дифференцировки границы эндо- и эпикарда [21].
Снижение глобальной функции ЛЖ (с дилатацией ЛЖ или без) включено в малые критерии Падуи и TFC-2024, т. к. не является специфическим для АКМ.
Структура миокарда
Изменение структуры миокарда по данным МРТ — это новые критерии, предложенные в 2020г и отредактированные в TFC-2024. МРТ позволяет выявить фиброзное замещение миокарда, используя данные об отсроченном накоплении контрастного препарата на основе гадолиния. В фиброзной ткани увеличивается объем и время вымывания контрастного вещества на основе гадолиния [22]. Накопление гадолиния (LGE) вызывает укорочение времени релаксации T1, которое проявляется как яркая интенсивность сигнала на МРТ изображении в ИП градиентного эха инверсии-восстановления. Для повышения контрастности изображений используют "обнуление" нормального сигнала миокарда, который будет казаться темным на фоне относительно яркого сигнала фиброзной ткани (рис. 2, 3 В).
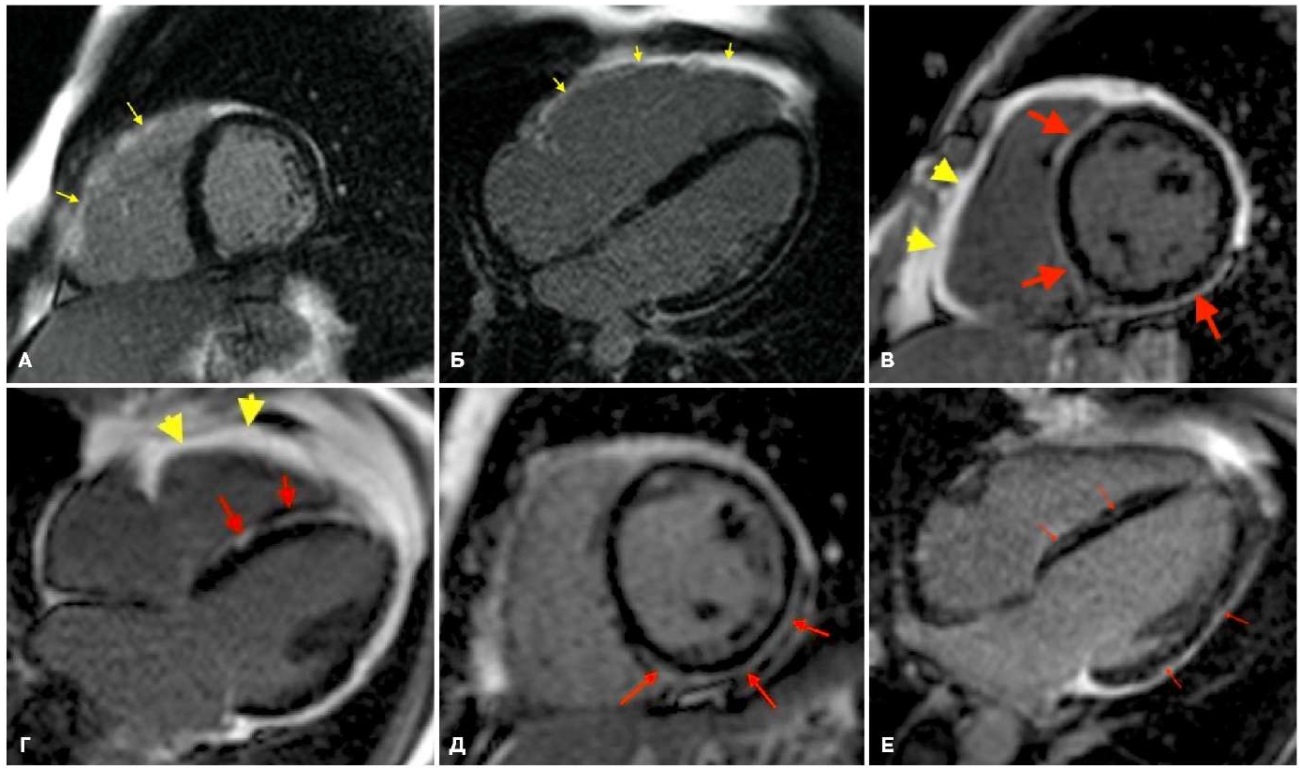
Рис. 2. МРТ, отсроченное контрастирование, PSIR последовательность, различные формы АКМ, А, В и Д — короткая ость, Б, Г и Е — 4-камерная плоскость.
Примечание: А и Б — пациент Д., 27 лет, пароксизмальная желудочковая тахикардия, АКМ ПЖ, по кино-изображениям расчет функциональных параметров: КДО/BSA ПЖ 148 мл/м² (N 55-105 мл/м²), ФВ ПЖ 35% (N 47-80%), КДО/BSA ЛЖ 85 мл/м² (N 47-92 мл/м²), ФВ ЛЖ 57% (N 56-78%), отмечается тотальное контрастирование свободной стенки ПЖ, выявленное по короткой оси (желтые стрелки) (А) и по 4-камерной плоскости (Б); также определяется субэндокардиальное накопление контрастного вещества ишемического генеза по заднебоковой и нижней стенке ЛЖ по короткой оси (А); В и Г — пациентка С., 44 года, пароксизмы желудочковой тахикардии и синкопальные состояния, АКМ бивентрикулярная форма, по кино-изображениям расчет функциональных параметров: КДО/BSA ПЖ 93 мл/м² (N 48-87 мл/м²), ФВ ПЖ 43% (N 47-80%), КДО/BSA ЛЖ 124 мл/м² (41-81 мл/м²), ФВ ЛЖ 48% (N 56-78%), отмечается тотальное контрастирование свободной стенки ПЖ (желтые стрелки) и кольцевидное накопление по миокарду ЛЖ (красные стрелки) выявленные по короткой оси (В) и по 4-камерной плоскости (Г); Д и Е — пациентка И., 39 лет, приступы неритмичного сердцебиения, сопровождавшиеся предобморочным состоянием, АКМ левожелудочковая форма, по кино-изображениям расчет функциональных параметров: КДО/BSA ПЖ 83 мл/м² (N 48-87 мл/м²), ФВ ПЖ 50% (N 47-80%), КДО/BSA ЛЖ 107 мл/м² (41-81 мл/м²), ФВ ЛЖ 54% (N 56-78%), отмечается субэпикардиальное контрастирование по заднему, заднебоковому сегментам ЛЖ с небольшим распространением на заднеперегородочный сегмент, выявленные по короткой оси (Д) и по 4-камерной плоскости (Е). Цветное изображение доступно в электронной версии журнала.
Сокращения: АКМ — аритмогенная кардиомиопатия, КДО — конечный диастолический объем, ЛЖ — левый желудочек, МРТ — магнитно-резонансная томография, ПЖ — правый желудочек, ФВ — фракция выброса, bSSFP — импульсная последовательность сбалансированных изображений стационарной свободной прецессии.
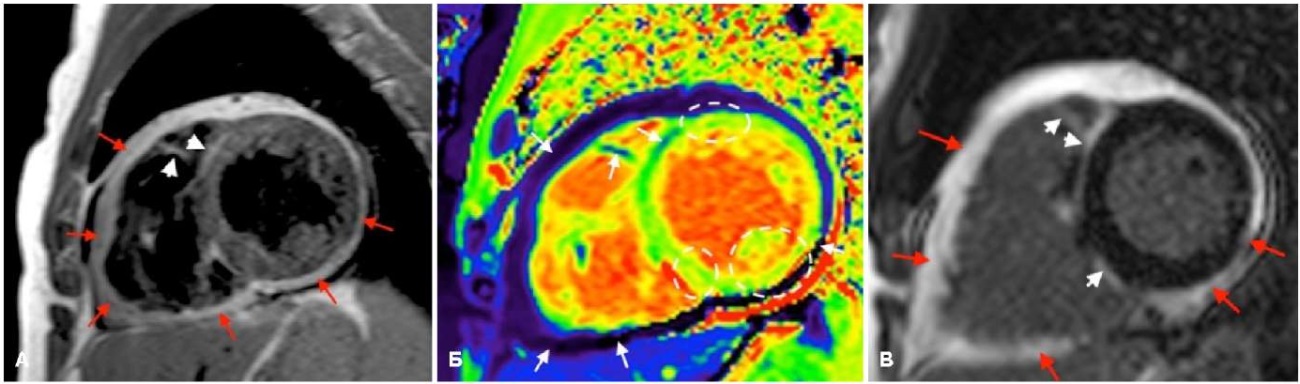
Рис. 3. МРТ, короткая ось, пациент П., 43 год, с пробежками желудочковой и наджелудочковой тахикардии.
Примечание: АКМ бивентрикулярная форма, по кино-изображениям КДО/BSA ПЖ 155 мл/м², ФВ ПЖ 38%, КДО/BSA ЛЖ 88 мл/м², ФВ ЛЖ 57%: А — TSE, Т1-ВИ, эпикардиальный жир утолщен, толщиной до 11 мм по передней стенке ПЖ, до 3 мм по боковой стенке ЛЖ, с признаками тотального "наползания" на миокард по всей стенке ПЖ и по заднему и заднебоковому сегменту ЛЖ с практически полным истончением миокарда ПЖ и сегментов ЛЖ (стрелки), также визуализируются участки жировой инфильтрации по МЖП со стороны ПЖ и трабекулам ПЖ (белые головки стрелок); Б — Т1 карта, в области жировой инфильтрации ПЖ и ЛЖ визуализируется резкое снижение МР-сигнала (белые стрелки), по миокарду истонченной части заднего и заднебокового сегментов ЛЖ, а также по переднему сегменту ЛЖ отмечается увеличение МР-сигнала до 1023-1095 мс (N 977±43 мс), с оценкой внеклеточного объема до 32,9% (N 25,4±2,5%) — признаки диффузного фиброза (пунктирные линии); В — LGE, PSIR последовательность, отмечается тотальное контрастирование эпикарда, миокарда ПЖ, и участки по МЖП (стрелки), что соответствует фиброзно-жировой инфильтрации миокарда. Цветное изображение доступно в электронной версии журнала.
Сокращения: АКМ — аритмогенная кардиомиопатия, КДО — конечный диастолический объем, ЛЖ — левый желудочек, МЖП — межжелудочковая перегородка, МРТ — магнитно-резонансная томография, ПЖ — правый желудочек, ФВ — фракция выброса, bSSFP — импульсная последовательность сбалансированных изображений стационарной свободной прецессии, LGE — отсроченное накопления контрастного вещества на основе гадолиния.
Обнаружение и количественная оценка заместительного (очагового) фиброза с помощью МРТ является устоявшейся методикой и имеет большую доказательную базу для широкого спектра сердечно-сосудистых заболеваний (ССЗ) (ишемическая болезнь сердца, ГКМП, ДКМП, аортальный стеноз, миокардит) [23][24]. Исследования продемонстрировали высокую пространственную корреляцию между областями LGE и результатами гистопатологии [25]. Локализация LGE в ЛЖ — важный параметр для дифференциации неишемического накопления (субэпикардиальный и интрамиокардиальный характер) от ишемического рубца [22]. Однако неишемическое LGE характерно как для АКМ, так и для ДКМП, миокардита, саркоидоза, поэтому требует внимательного анализа и соблюдения всего диагностического алгоритма при постановке диагноза. На ранних стадиях АКМ с вовлечением ЛЖ наиболее часто манифестирует в заднебоковой стенке, где можно выявить субэпикардиальное или реже интрамиокардиальное распространением LGE (рис. 2 Д) [26]. Локализация областей фиброза зависит от генетического статуса. Так, при десмосомальных мутациях наблюдаются субэпикардиальные "кольцевидные" очаги [27]. При не-десмосомальных мутациях LGE доминирует в заднебоковой стенке. Интрамиокардиальное LGE чаще определяется в МЖП. Очаговое и мелкоочаговое LGE в области соединения МЖП и свободной стенки — септальное соединение — не включается в анализ из-за неспецифического характера накопления КВ [12].
Методика LGE так же эффективна для оценки изменения структуры тонкой стенки ПЖ, однако возможности ограничены пространственным разрешением метода (рис. 2 А-Г). По различным данным чувствительность при заболевании ПЖ может колебаться от 30 до 70% по сравнению с электро-анатомическим картированием или результатами эндомиокардиальной биопсии [25][28]. В исследовании Perazzolo Marra МP, et al. (2021), у пациентов, соответствующих TFC-2010 и с LGE ПЖ, эндомиокардиальная биопсия подтвердила признаки фиброза в 57%, а для остальных была отрицательной и/или неспецифичной [25]. У всех пациентов с LGE ПЖ были выявлены нарушения движения стенки ПЖ, что подчеркивает значение сочетания нескольких признаков в повышении специфичности диагностики АКМ. Это подтверждается в другом исследовании, где 100% специфичности и 96% чувствительности метода МРТ были достигнуты путем комбинированной оценки аномалии движения стенки ПЖ (исключая гипокинезию) с аномалией сигнала (включая жировую инфильтрацию ЛЖ и LGE) [29].
Критерии Падуи предлагают использовать LGE в одном и более сегменте ПЖ как большой критерий. TFC-2024 уменьшили значимость признака LGE ПЖ, переведя его в малый критерий, и убрали ограничения с области накопления LGE, включив всю свободную стенку ПЖ. Для ЛЖ признак LGE сохранили как большой критерий (если наблюдается в ≥3 сегментах) и ввели малый критерий (1 или 2 сегмента ЛЖ). Для повышения диагностической точности и исключения возможных артефактов признак LGE необходимо подтвердить в 2 ортогональных проекциях. Включение признака LGE в рекомендации Падуи и TFC-2024, бесспорно, одно из важнейших изменений критериев, подчеркивающее роль МРТ в выявлении структурных изменений при АКМ.
Возможности МРТ, не включенные в диагностические критерии
Оценка жира
Изолированная оценка жировой ткани не включена в структурные диагностические критерии. Несмотря на то, что жировое замещение является характерным при АКМ, признак не является специфичным и широко встречается у лиц без признаков ССЗ [30]. Тем не менее МРТ получает все большее признание благодаря своей способности оценивать жировую ткань, в т. ч. инфильтрирующую миокард, и связанные с ней патологии. Интрамиокардиальный жир в ПЖ при АКМ определяется рядом с фиброзной тканью и локализуется в "треугольнике дисплазии", в нижнеперегородочной части ПЖ, трабекулах и модераторном тяже (рис. 3 А, 4). В ЛЖ жир чаще всего располагается субэпикардиально по латеральной стенке апикального сегмента и может иметь характерный фестончатый вид [31].
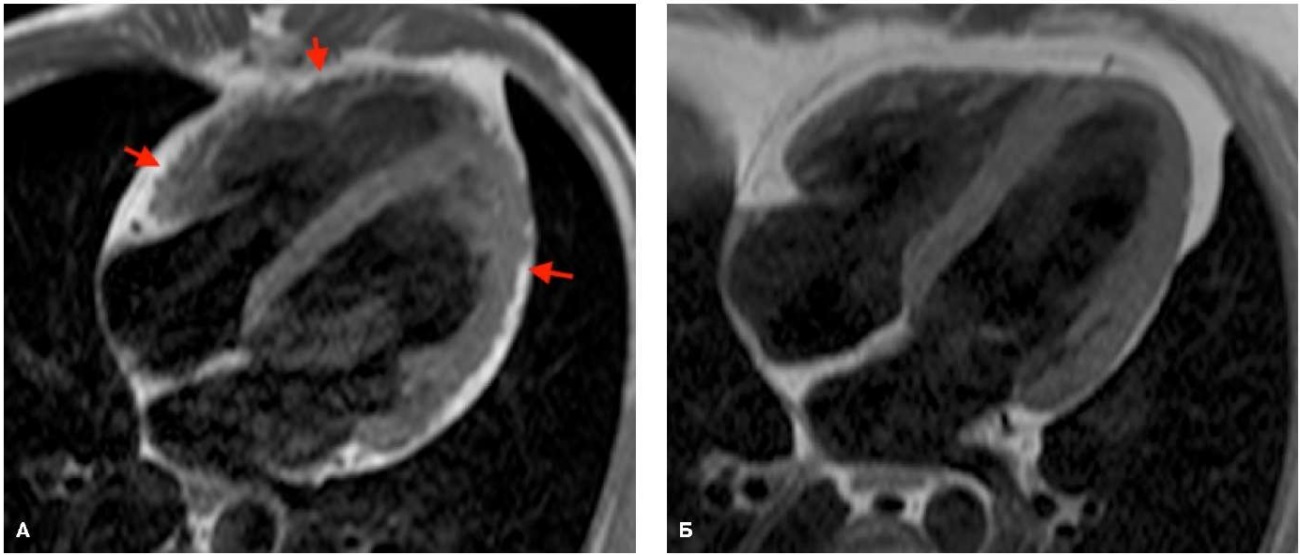
Рис. 4. МРТ TSE, 4-камерная плоскость, Т1-взвешенное изображение.
Примечания: А — тот же пациент из рисунка 1, видна жировая инфильтрация ПЖ и ЛЖ, жир выглядит как белые включения в миокард желудочков (красные стрелки), типичный признак, похожий на "укус", эпикардиальный жир как бы "наползает" на миокард; Б — утолщенный эпикардиальный жир без признаков "наползания" на миокард, норма. Цветное изображение доступно в электронной версии журнала.
Сокращения: ЛЖ — левый желудочек, ПЖ — правый желудочек.
На ИП с "черной кровью", взвешенных по Т1 интрамиокардиальный жир определяется как частичный или трансмуральный гиперинтенсивный сигнал в стенке ЛЖ. Хорошую согласованность с традиционными методиками показала оценка жира в ИП SSFP по наличию гиперинтенсивных областей, отделенных от крови артефактом "индийских чернил" (рис. 1 В) [32]. В отличие от качественной оценки, количественный анализ интрамиокардиального жира, особенно, в тонкой стенке ПЖ, остается сложной задачей. Тестируются новые ИП, например, IDEAL, данные которой хорошо коррелируют с гистологическими результатами, т. к. обеспечивают более точное измерение фракции жира в миокарде [33]. Таким образом, несмотря на расширяющиеся возможности в определении интрамиокардиального жирового замещения, данные МРТ пока могут служить дополнительным подтверждением основного диагноза, увеличивая специфичность метода [12].
Параметрические картирования
Т1-картирование и оценка внеклеточного объема позволяют выявить увеличение интерстициального пространства при другом виде фиброзного замещения — диффузном фиброзе (рис. 3 Б). Широкое распространение методик картирования ограничено необходимостью проведения стандартизации нормальных и пороговых значений у разных поставщиков и учреждений [34]. Подтверждена диагностическая и прогностическая значимость методики при различных ССЗ, в т. ч. амилоидозе, ГКМП, ДКМП [24]. У пациентов с подтвержденной АКМ в работе Georgiopoulos G, et al. собственные значения времени Т1 (МЖП и боковая стенка ЛЖ) были аномальными у 37%, включая тех, у кого традиционные методы не выявили изменений миокарда ЛЖ [35]. Повышенные значения собственного T1 и повышенная дисперсия значений T1 ЛЖ наблюдались у родственников с положительным генотипом АКМ, даже при отсутствии явного заболевания [36]. При исследовании ассоциации генотипа и фенотипа по данным МРТ у пациентов с АКМ обнаружена значимая взаимосвязь между высокими значениями Т1 ЛЖ и не-десмосомальной мутацией ламин А/С (LMNA)1. Эти данные предлагают по-новому взглянуть на механизмы развития АКМ, в основе которых, как традиционно считается, лежит очаговая фиброзно-жировая инфильтрация. Возможно, Т1-картирование поможет выявлять раннее поражение ЛЖ у лиц, находящихся в группе риска АКМ.
Т2-картирование и последовательности, взвешенные по Т2, могут быть ценным инструментом дифференциальной диагностики, благодаря чувствительности к отеку миокарда. Воспалительные процессы, связанные с АКМ, хорошо описаны, однако их роль в развитии АКМ до конца не изучена [37]. По данным исследований гистологические признаки активного миокардита определяются у 44-83% пациентов с АКМ [38]. Расширение протокола МРТ исследования (с оценкой отека) у пациентов с АКМ может улучшить общую оценку характеристик ткани миокарда и способствовать выявлению сопутствующей патологии [39].
Деформация миокарда
Анализ деформации миокарда желудочков является чувствительным маркером оценки структурных или функциональных изменений сердца и помогает выявить ранние признаки изменений, до момента снижения ФВ. МРТ методика отслеживания частиц (Feature Tracking) использует данные ИП bSSFP и не требует дополнительного сканирования. Анализ ПЖ может быть затруднен из-за погрешностей при выделении тонкой стенки. Тем не менее у пациентов с АКМ продемонстрировано нарушение глобальной бивентрикулярной деформации во всех 3 направлениях (все р<0,001) по сравнению со здоровыми испытуемыми [40]. Аномальные значения продольной и радиальной деформации при АКМ могут быть полезны для дифференциальной диагностики с ЖА из выводного тракта ПЖ [41].
Стратификация риска и прогноз
Исследования продемонстрировали, что снижение функции ЛЖ и ПЖ у пациентов с АКМ связано с неблагоприятными исходами. Разработанная в 2019г на данных свыше 500 пациентов с АКМ прогностическая модель оценки риска ЖА включает дисфункцию ПЖ как один из 7 достоверных предикторов ЖА [42]. Однако эта модель может недооценивать риск у пациентов с поражением ЛЖ, потому что данные о ЛЖ на тот момент не были интегрированы в критерии диагностики АКМ. В заявлении экспертов HRS по АКМ показаны высокие факторы риска ВСС и ЖТ у пациентов с комбинацией не-десмосомальных мутаций (фосфоламбин, ламин А/С, фламин С) и снижением ФВ ЛЖ <45%. Имплантация ИКД у этих пациентов относится к IIA классу рекомендаций [5]. Прогностическое значение показано для параметра деформации миокарда. В исследовании с участием 274 пациентов c АКМ при многофакторном анализе выявлена независимая связь глобальной продольной деформации ПЖ с риском возникновения неблагоприятных событий, в т. ч. ВСС [43].
Наличие заместительного фиброза ЛЖ является прогностическим фактором развития неблагоприятных исходов при различных ССЗ [24]. Степень и локализация LGE в миокарде связаны прежде всего с риском аритмических событий. Tandri H, et al. выявили связь LGE ПЖ с индуцируемой аритмией при электрофизиологическом исследовании у пациентов с АКМ [44]. Определенные закономерности распределения LGE в ЛЖ, такие как заднебоковая локализация при АКМ, были ассоциированы с ремоделированием ЛЖ и худшими исходами, что, как было показано позже, обусловлено не-десмосомальными мутациями [45]. Фенотип АКМ может определять риски наступления неблагоприятных кардиологических событий. В исследовании с участием 140 пациентов с АКМ Aquaro GD, et al. продемонстрировали, что вовлечение ЛЖ (левожелудочковый и бивентрикулярный тип) связано с высоким риском злокачественных ЖА в течение 5-летнего периода по сравнению с пациентами с изолированным поражением ПЖ [46].
Важная роль принадлежит МРТ при семейном скрининге. У бессимптомных родственников пациентов с АКМ данные МРТ могут указывать на субклиническое течение заболевания, что позволяет провести раннее вмешательство и мониторинг. Дополнительные параметры МРТ (повышенные значения Т1 и Т2 картирования) могут привлечь внимание врача и способствовать ранней диагностике АКМ1 [36].
Заключение
Диагностика АКМ остается сложной задачей, для решения которой используется мультимодальный подход. За последние десятилетия роль МРТ в диагностических критериях АКМ претерпела значительную эволюцию от метода, возможности которого не определены, до золотого стандарта морфофункциональной оценки и эталонного инструмента неинвазивной оценки фиброза миокарда. С включением данных МРТ о тканевых характеристиках чувствительность критериев АКМ увеличилась и МРТ стала предпочтительным методов визуализации. Ценность метода МРТ повышается за счет возможности комплексной оценки сердца и получения дополнительной информации, которая позволяет уточнить характер течения заболевания, провести дифференциальную диагностику и оценить риски для выбора тактики лечения.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Malas W, Pollinger N, Diaz G, et al. Association of Cardiovascular Magnetic Resonance Findings and Arrhythmogenic Cardiomyopathy Variants: A Genotype-phenotype. Book of Abstracts of the CMR 2024 Global CMR Conference, QEII Centre, January 25-27th. Analysis. J Cardiovasc Magn Res. 2024;26:100229. doi:10.1016/j.jocmr.2024.100516.
Список литературы
1. Marcus F, Fontaine G, Guiraud G, et al. Right ventricular dysplasia: a report of 24 adult cases. Circulation. 1982;65:384-98. doi:10.1161/01.cir.65.2.384.
2. Fontaine G, Guiraudon G, Frank R, et al. Stimulation studies and epicardial mapping in ventricular tachycardia: study of mechanisms and selection for surgery. In: H. K, editor. Reentrant Arrhythmias. Lancaster: MTP Publishers; 1977;33450.
3. Richard G, Bennett I, Haris M, et al. Arrhythmogenic Cardiomyopathy in 2018-2019: ARVC/ ALVC or Both? Heart and lung Circ. 2019;28(1):164-77. doi:10.1016/j.hlc.2018.10.013.
4. Corrado D, Perazzolo Marra M, Zorzi A, et al. Diagnosis of arrhythmogenic cardio myopathy: The Padua criteria. Int J Cardiol. 2020;319:10614. doi:10.1016/j.ijcard.2020.06.005.
5. Towbin J, McKenna W, Abrams D, et al. HRS expert consensus statement on evaluation, risk stratification, and management of arrhythmogenic cardiomyopathy. Hear Rhythm. 2019;16(11):30172. doi:10.1016/j.hrthm.2019.05.007.
6. Arbelo E, Protonotarios A, Gimeno JR, 2023 ESC Guidelines for the management of cardiomyopathies: Developed by the task force on the management of cardiomyopathies of the European Society of Cardiology (ESC). Eur Heart J. 2023;44(37):3503- 626. doi:10.1093/eurheartj/ehad194.
7. Marcus F, McKenna W, Sherrill D, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia. Eur Heart J. 2010;31(7):80614. doi:10.1093/eurheartj/ehq025.
8. Алексеева Д.Ю., Кофейникова О.А., Марапов Д.И., Васичкина Е.С. Клинические особенности различных фенотипических форм аритмогенной кардиомиопатии в педиатрической популяции: систематический обзор и метаанализ. Российский кардиологический журнал. 2022;27(4S):5146. doi:10.15829/1560-4071-2022-5146.
9. Krahn A, Wilde A, Calkins H, et al. Arrhythmogenic right ventricular cardiomyopathy. JACC Clinical Electrophysiology. 2022;8(4):533-53. doi:10.1016/j.jacep.2021.12.002.
10. Sen-Chowdhry S, Morgan RD, Chambers JC, et al. Arrhythmogenic cardiomyopathy: etiology, diagnosis, and treatment. Annu Rev Med. 2010;61:233-53. doi:10.1146/annurev.med.052208.130419.
11. McKenna W, Thiene G, Nava A.Diagnosis of arrhythmogenic right ventricular dysplasia/ cardiomyopathy. Task force of the working group myocardial and pericardial disease of the European society of cardiology. Br.Heart J. 1994;71:215-8.
12. Corrado D, Anastasakis A, Basso C.Proposed diagnostic criteria for arrhythmogenic cardiomyopathy: European Task Force consensus report. Int J Cardiology. 2024;395:131447. doi.10.1016/j.ijcard.2023.131447.
13. Шляхто Е.В. Кардиология. Национальное руководство. 2-е изд. М: ГЭОТАРМедиа, 2023. 816с. ISBN: 978-5-9704-7537-9.
14. Габрусенко С., Гудкова А., Козиолова Н. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
15. Терещенко С., Галявич А., Ускач Т и др. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
16. Couto M, Souto M, Martínez A, et al. Accuracy of right ventricular volume and function assessed with cardiovascular magnetic resonance: comparison with echocardiographic parameters. Clin Imaging. 2020;59(1):61-7. doi:10.1016/j.clinimag.2019.10.002.
17. Bluemke DA. ARVC: Imaging diagnosis is still in the eye of the beholder. J Am Coll Cardiol Img. 2011;4:288-91. doi:10.1016/j.jcmg.2011.01.007.
18. Petersen SE, Khanji MY, Plein S,, et al. European Association of Cardiovascular Imaging expert consensus paper: a comprehensive review of cardiovascular magnetic resonance normal values of cardiac chamber size and aortic root in adults and recommendations for grading severity. Cardiovascular Im. 2019;20:1321-31. doi:10.1093/ehjci/jez232. Erratum in: Eur Heart J Cardiovasc Imaging. 2019;20(12):1331. doi:10.1093/ehjci/jez289.
19. D'Ascenzi F, Anselmi F, Piu P, et al. Cardiac magnetic resonance normal reference values of biventricular size and function in male athlete's Heart. JACC: Cardiovasc Im. 2019;12:1755-65. doi:10.1016/j.jcmg.2018.09.021.
20. Natori S, Lai S, Finn JP, et al. Cardiovascular function in the multiethnic study of atherosclerosis: normal values by age, sex, and ethnicity. Am J Roentgenol. 2006;186:357- 65. doi:10.2214/AJR.04.1868.
21. Malayeri A, Johnson W, Macedo R, et al. Cardiac cine MRI: quantification of the relationship between fast gradient echo and steady-state free precession for determination of myocardial mass and volumes. J Magn Reson Imaging. 2008;28:60-6. doi:10.1002/jmri.21405.
22. Mewton N, Liu CY, Croisille P.Assessment of myocardial fibrosis with cardiovascular magnetic resonance. J Am Coll Cardiol. 2011;57(8):891-903. doi:10.1016/j.jacc.2010.11.013.
23. Bing Р, Duec МР. Myocardial fibrosis: why image, how to image and clinical implications. Heart. 2019;105:1832-40.
24. Голухова Е.З., Александрова С.А., Бердибеков Б.Ш. Прогностическая роль количественной оценки миокардиального фиброза по данным магнитно-резонансной томографии с отсроченным контрастированием при неишемических дилатационных кардиомиопатиях: систематический обзор и метаанализ. Российский кардиологический журнал. 2021;26(12):4776. doi:10.15829/1560-4071-2021-4776.
25. Perazzolo Marra MP, Cipriani A, Rizzo S, et al. Myocardial tissue characterization in arrhythmogenic cardiomyopathy: comparison between endomyocardial biopsy and cardiac magnetic resonance. JACC Cardiovasc Imaging. 2021;14(8):1675-8. doi:10.1016/J.JCMG.2021.02.015.
26. Marra MP, Rizzo S, Bauce B, et al. Arrhythmogenic right ventricular cardiomyopathy. Contribution of cardiac magnetic resonance imaging to the diagnosis. Herz. 2015;40:600- 6. doi:10.1007/s00059-015-4228-0.
27. Segura-Rodríguez D, Bermúdez-Jiménez FJ, Carriel V, et al. Myocardial fibrosis in arrhythmogenic cardiomyopathy: a genotype-phenotype correlation study. Eur. Heart J.Cardiovasc. Imaging. 2020;21:378-86. doi:10.1093/ehjci/jez277.
28. Marra MP, Leoni L, Bauce B, et al. Imaging study of ventricular scar in arrhythmogenic right ventricular cardiomyopathy: comparison of 3D standard electroanatomical voltage mapping and contrast-enhanced cardiac magnetic resonance. Circ Arrhythm Electrophysiol. 2012;5:91-100. doi:10.1161/CIRCEP.111.964635.
29. Aquaro GD, Barison A, Todiere G.Usefulness of Combined Functional Assessment by Cardiac Magnetic Resonance and Tissue Characterization Versus Task Force Criteria for Diagnosis of Arrhythmogenic Right Ventricular Cardiomyopathy. Am J Cardiol. 2016;118(11):1730-6. doi:10.1016/j.amjcard.2016.08.056.
30. Zghaib T, Te Riele A, James C, et al. Left ventricular fibro-fatty replacement in arrhythmogenic right ventricular dysplasia/cardiomyopathy: prevalence, patterns, and association with arrhythmias. J Cardiovasc Magn Reson. 2021;23:58. doi:10.1186/s12968-020-00702-3.
31. Rastegar N, Burt JR, Corona-Villalobos CP, et al. Cardiac MRI results and potential diagnostic errors in patients tested for arrhythmogenic right ventricular cardiomyopathy. RadioGraphics. 2014;34:553-1570.
32. Aquaro GD, Todiere G, Strata E.Usefulness of india ink artifact in steady-state free precession pulse sequences for detection and quantification of intramyocardial fat. J Magnet Res Im. 2014;40(1):1-249. doi.10.1002/jmri.24335.
33. Haliot K, Dubes V, Constantin M, et al. A 3D high resolution MRI method for the visualization of cardiac fibro-fatty infiltrations. Sci Rep. 2021;11:9266. doi:10.1038/s41598-021-85774-6.
34. Марченко Д., Александрова С., Глазкова Е. и др. Определение диапазона референсных значений нативного времени Т1-, Т2-релаксации миокарда параметрических карт в модификации MOLLY. Креативная кардиология. 2024;18(1):36-43. doi:10.24022/1997-3187-2.
35. Georgiopoulos G, Zampieri M, Molaro S, et al. Cardiac magnetic resonance in patients with ARVC and family members: the potential role of native T1 mapping. Int J Card Imaging. 2021;37:2037-47. doi:10.1007/s10554-021-02166-7.
36. Bourfiss M, Prakken NHJ, van der Heijden JF, et al. Diagnostic value of native T1 mapping in arrhythmogenic right ventricular cardiomyopathy. JACC Cardiovasc Imaging. 2019; 12 (8 Pt 1):1580-2. doi:10.1016/j.jcmg.2019.01.023.
37. Лутохина Ю., Благова О., Шестак А. и др. Эволюция диагностических критериев аритмогенной кардиомиопатии правого желудочка и их применения в клинической практике. Российский кардиологический журнал. 2021;26(11):4593. doi:10.15829/1560-4071-2021-4593.
38. Tavora F, Zhang M, Franco M, et al. Distribution of biventricular disease in arrhythmogenic cardiomyopathy: an autopsy study. Hum Pathol. 2012;43(4):592-6. doi:10.1016/j.humpath.2011.06.014.
39. Макаренко В., Шляппо М., Александрова С.Магнитно-резонансная визуализация аритмогенной дисплазии правого желудочка. Новости сердечно-сосудистой хирургии. 2019;(3):280-2. doi:10.24022/2588-0284-2019-3-4-280-282.
40. Dong Z, Dai L, Song H.Incremental Diagnostic Value of Right Ventricular Strain Analysis in Arrhythmogenic Right Ventricular Cardiomyopathy. J Am Heart Assoc. 2024;13(1):e031403. doi:10.1161/JAHA.123.031403.
41. Heermann P, Fritsch H, Koopmann M.Biventricular myocardial strain analysis using cardiac magnetic resonance feature tracking (CMR-FT) in patients with distinct types of right ventricular diseases comparing arrhythmogenic right ventricular cardiomyopathy (ARVC), right ventricular outflow-tract tachycardia (RVOT-VT). Clin Res Cardiol. 2019;108(10):1147-62. doi:10.1007/s00392-019-01450-w.
42. Cadrin-Tourigny J, Bosman LP, Nozza A, et al. A new prediction model for ventricular arrhythmias in arrhythmogenic right ventricular cardiomyopathy. Eur Heart J. 2019;40:1850-8.
43. Bourfiss M, Prakken N, James C.Prognostic value of strain by feature-tracking cardiac magnetic resonance in arrhythmogenic right ventricular cardiomyopathy, European Heart Journal - Cardiovascular Im. 2023;24(1):98-107.
44. Tandri H, Saranathan M, Rodriguez ER, et al. Noninvasive detection of myocardial fibrosis in arrhythmogenic right ventricular cardiomyopathy using delayed-enhancement magnetic resonance imaging. J Am Coll Cardiol. 2005;45(1):98-103. doi:10.1016/j.jacc.2004.09.053.
45. Feliu E, Moscicki R, Carrillo L, et al. Importance of cardiac magnetic resonance findings in the diagnosis of left dominant arrythmogenic cardiomyopathy. Rev Esp Cardiol. 2020;73(11):885-92. English, Spanish. doi:10.1016/j.rec.2019.12.004.
46. Aquaro GD, De Luca A, Cappelletto C, et al. Prognostic value of magnetic resonance phenotype in patients with arrhythmogenic right ventricular cardiomyopathy. J Am Coll Cardiol. 2020;75:2753-65. doi:10.1016/j.jacc.2020.04.023.techniques.
Об авторах
С. А. АлександроваРоссия
Александрова С. А. - к.м.н., с.н.с., зав. рентгеновским отделением № 2
Москва
Е. Ю. Глазкова
Россия
Глазкова Е. Ю. - к.м.н., н.с. рентгеновского отделения № 2
Москва
Е. З. Голухова
Россия
Голухова Е. З. - академик РАН, д.м.н., профессор, директор, зав. кафедрой кардиологии и функциональной диагностики Института подготовки кадров высшей квалификации профессионального образования
Дополнительные файлы
- Роль магнитно-резонансной томографии (МРТ) в критериях диагностики аритмогенной кардиомиопатии (АКМ) неуклонно возрастает.
- В обзоре представлены текущие возможности МРТ в оценке морфофункциональных и структурных изменений при АКМ и их применение с точки зрения работающих критериев диагностики.
- Рассмотрены перспективы использования новых МРТ параметров в диагностике АКМ и стратификации неблагоприятных исходов.
Рецензия
Для цитирования:
Александрова С.А., Глазкова Е.Ю., Голухова Е.З. Магнитно-резонансная томография сердца при аритмогенной кардиомиопатии: развитие критериев диагностики и новые возможности. Российский кардиологический журнал. 2024;29(11S):6118. https://doi.org/10.15829/1560-4071-2024-6118
For citation:
Aleksandrova S.A., Glazkova E.Yu., Golukhova E.Z. Cardiac magnetic resonance imaging in arrhythmogenic cardiomyopathy: evolving diagnostic criteria and new capabilities. Russian Journal of Cardiology. 2024;29(11S):6118. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6118
JATS XML

















































