Перейти к:
Лимфома правого предсердия в сочетании с раком почки. Клинический случай
https://doi.org/10.15829/1560-4071-2025-6115
EDN: WPJAMQ
Аннотация
Введение. Первичные лимфомы сердца являются редкой патологией, представляющей определенные диагностические сложности. Помимо химиотерапии, важным аспектом лечения пациентов с лимфомами сердца является борьба с нарушениями ритма и проводимости. Показания к имплантации электрокардиостимулятора (ЭКС), сроки проведения вмешательства в таких ситуациях продолжают обсуждаться.
Краткое описание. Представлен случай В-клеточной лимфомы правого предсердия у пожилой пациентки. Ранее обследована в связи с брадикардией, предсинкопальными состояниями. Выявлена атриовентрикулярная (АВ) блокада 3 степени, полная блокада левой ножки пучка Гиса, установлен двухкамерный ЭКС. По-видимому, нарушения проводимости были обусловлены прорастанием опухоли в зоне АВ узла, однако его инструментальных признаков в тот момент выявить не удалось. 3 недели спустя госпитализирована в связи с гипотонией, комой. Особенности электрокардиографической картины (признаки блокады правой, а не левой ножки пучка Гиса при правожелудочковой стимуляции) потребовали исключения диспозиции электрода и перфорации стенки сердца. При эхокардиографическом исследовании выявлены парааортальные гиперэхогенные полости с гетерогенным содержимым, линейные тени в зоне коаптации створок аортального клапана, трактовавшиеся как абсцесс корня аорты или аневризма аорты, проявления инфекционного эндокардита. Опухоль правого предсердия была диагностирована только при аутопсии. Второй находкой стал светлоклеточный почечноклеточный рак, также не выявлявшийся ранее при инструментальном обследовании.
Дискуссия. Случай редкого сочетания двух опухолей демонстрирует сложности диагностики образований сердца и подчеркивает важность их раннего распознавания даже при манифестации неспецифическими симптомами.
Ключевые слова
Для цитирования:
Мелехов А.В., Мануйлова О.О., Никитин И.Г., Петренко Н.В., Саликов А.В., Селиванов А.И., Тевосян А.Г., Уфимцева И.Ю. Лимфома правого предсердия в сочетании с раком почки. Клинический случай. Российский кардиологический журнал. 2025;30(5S):6115. https://doi.org/10.15829/1560-4071-2025-6115. EDN: WPJAMQ
For citation:
Melekhov A.V., Manuilova O.O., Nikitin I.G., Petrenko N.V., Salikov A.V., Selivanov A.I., Tevosyan A.G., Ufimtseva I.Y. Right atrial lymphoma in combination with kidney cancer: а case report. Russian Journal of Cardiology. 2025;30(5S):6115. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6115. EDN: WPJAMQ
Введение
Первичные лимфомы сердца составляют менее 1% от всех опухолей сердца и 0,5% от экстранодальных лимфом, они встречаются несколько чаще у пациентов с иммунодефицитом и перенесших трансплантацию органов. В 92,7% случаев первичные лимфомы В- или пре-В-клеточные. Вторичное поражение сердца при лимфомах встречается чаще — до 20-25% опухолей сердца [1-4].
Наиболее часто лимфомы поражают правое предсердие (ПП), в 75% случаев болезнью поражаются и другие камеры сердца [5][6]. Помимо миокарда лимфомы могут поражать перикард, что проявляется нарушениями проводимости, тахиаритмиями, сердечной недостаточностью, выпотом в перикард и тампонадой сердца [7][8].
Затрудняют диагностику поздняя манифестация заболевания, неспецифичность симптоматики, нередко не кардиальной. Необходимость морфологической верификации диагноза обусловливает необходимость проведения помимо неинвазивных визуализирующих методов обследования (эхокардиография (ЭхоКГ), компьютерная томография (КТ), магнитно-резонансная томография или позитронно-эмиссионная томография) эндомиокардиальной или открытой биопсии [4][9].
Основным методом лечения первичной лимфомы сердца является химиотерапия, включающая циклофосфамид, доксорубицин, винкристин, преднизолон (CHOP), а с 2010г — ритуксимаб, существенно улучшивший выживаемость пациентов. Также применяется иммунотерапия, лучевая терапия и хирургические методы. Общая выживаемость пациентов при адекватном лечении достигает 45,4 (5,6-120,4) мес. [6]. Поздняя диагностика существенно ухудшает прогноз [10].
Современные химиотерапевтические подходы показывают весьма благоприятные результаты как с точки зрения уменьшения опухоли, приводящего к улучшению гемодинамики и восстановлению нарушенной атриовентрикулярной (АВ) проводимости, так и с точки зрения прогноза [11-15], в т. ч. у весьма пожилых и коморбидных пациентов (73 года, наблюдение 10 мес. [15], 78 лет, наблюдение 3 мес. [16], 81 год, наблюдение 3 мес. [17], 84 года, наблюдение 6 нед. [18]).
Описаны случаи успешного хирургического удаления лимфомы сердца перед началом химиотерапии (пациент 52 лет [19], пациент 43 лет с ВИЧ [4]), а также частичного удаления опухоли у 70-летнего пациента, позволившего ему прожить 6 мес. после операции [20].
Важным аспектом хирургической помощи является борьба с нарушениями ритма и проводимости, нередко развивающимися у пациентов с лимфомами сердца [21-23]. Показания к имплантации электрокардиостимулятора (ЭКС), тип ЭКС (включая беспроводные стимуляторы), сроки проведения вмешательства являются предметом оживленной дискуссии [24-26].
Клинический случай
Пациентка С., 88 лет, 25.05.2024 доставлена в отделение реанимации ГКБ № 12 им. В. М. Буянова с направительным диагнозом "Кома, гипотония". Со слов родственников, ухудшение состояния в течение 2 дней: постепенное снижение уровня сознания, не откликалась на имя, не реагировала на раздражители. Вызванной бригадой скорой медицинской помощи зафиксировано артериальное давление 70/35 мм рт.ст., установлен центральный венозный катетер, начата вазопрессорная поддержка, искусственная вентиляция легких (ИВЛ) через ларингеальную маску.
Состояние при поступлении крайне тяжелое (оценка по шкале SOFA 4), медикаментозная седация пропофолом (глубина седации по шкале RASS (-5) баллов). Кожа бледная, тургор снижен. Отеков нет. Множественные синяки на обеих руках, ногах и передней брюшной стенке. ИВЛ в режиме BIPAP (верхнее давление 24 мБар, нижнее давление (PEEP) 7 мБар, уровень давления поддержки (PS, ASB) 14 мБар, частота принудительных вдохов 16 в мин, минутный объем дыхания 11 л/мин), FIO2 70%. SpO2 95%. Аускультативно дыхание жесткое, ослаблено в нижних отделах, там же выслушиваются влажные хрипы. При санации трахеобронхиального дерева слизисто-гнойная мокрота. Гемодинамика поддерживается внутривенной инфузией норэпинефрина 0,9 мкг/кг/мин. Артериальное давление 76/30 мм рт.ст., частота сердечных сокращений (ЧСС) 100 уд./мин, дефицита пульса нет. Шумы не выслушиваются. Язык сухой. Живот не увеличен, не вздут, при пальпации мягкий, безболезненный. Аускультативно перистальтика вялая. Мочеиспускание по катетеру, моча темно-коричневая. Область центрального венозного катетера без признаков воспаления, катетер проходим.
На электрокардиограмме (ЭКГ) ритм ЭКС (рис. 1).
По сведениям, имеющимся в единой медицинской информационно-аналитической системе, выяснено, что в 2015г перенесла эндопротезирование правого коленного сустава. Страдает умеренной артериальной гипертензией. В 2021г перенесла инфаркт головного мозга (лакунарный подтип по критериям TOAST). В выписном эпикризе очаговой неврологической симптоматики не описано, по данным КТ и магнитно-резонансной томографии головного мозга острых ишемических изменений, гематом, объемных образований не выявлено. На ЭКГ ритм синусовый, ЧСС 78-88 уд./мин, интервал PQ 110-180 мс, неспецифическая элевация STIII,AVF до 0,5 мм. При ЭхоКГ дилатация ПП (площадь 23 см2 (N >18), объём 74 мл).
С тех пор периодически падала без потери сознания. 01.05.2024 стала отмечать слабость, боль за грудиной, не смогла встать с постели, регистрировался пульс 40 уд./мин. Госпитализирована. На ЭКГ АВ блокада 3 степени, полная блокада левой ножки пучка Гиса (БЛНПГ). При ЭхоКГ клапанной патологии, нарушений локальной или глобальной сократимости левого желудочка (ЛЖ) не выявлено, давление в легочной артерии в норме, дилатации правого желудочка (ПЖ) нет. Размер левого предсердия 42 мм (N ≤40 мм), объём 97 мл, индекс объема 57 мл/м2 (N ≤34). Объем ПП 56 мл, 33 мл/м2 (N ≤27). Тропонин I 0,107-0,103 нг/мл (N 0-0,499), мозговой натрийуретический пептид 317,9 пг/мл (N 0-296).
07.05.2024 имплантирован двухкамерный ЭКС Sorin Esprit DR с активной фиксацией электродов BeFex в верхушке ПЖ и ушке ПП. Режим стимуляции DDD с частотой 60 в минуту. В дальнейшем регистрировалась фибрилляция предсердий, от восстановления синусового ритма решено воздержаться, к терапии добавлен метопролол. На ЭКГ (14.05.2024) ритм ЭКС со стимуляцией предсердий и желудочков. Выписана в удовлетворительном состоянии.
При этом на ЭКГ (рис. 1) морфология QRS комплексов не соответствует БЛНПГ, характерной для неосложненной стимуляции верхушки ПЖ. Появление блокады правой ножки пучка Гиса (БПНПГ) может указывать на перфорацию межжелудочковой перегородки (МЖП) со смещением электрода в верхушку ЛЖ, однако клинических проявлений этого не было, кроме того, нет соответствующих изменений в стандартных отведениях. Подобную картину могла бы объяснить также диспозиция желудочкового электрода в ЛЖ через дефект МЖП или межпредсердной перегородки, однако судя по данным КТ органов грудной клетки его положение было типичным. Признаков воспалительных изменений в легких не выявлено, двухсторонний гидроторакс, сердце, средостение — без особенностей (рис. 2).
При ультразвуковом исследовании (УЗИ) в условиях затрудненного выраженным пневматозом брюшной полости акустического доступа свободная жидкость в брюшной полости на момент осмотра не визуализируется. Диффузные изменения увеличенной печени, поджелудочной железы. Дилатации чашечно-лоханочной системы почек нет. Признаков тромбоза вен нижних конечностей не выявлено. КТ головного мозга — центральная и корковая атрофия.
При лабораторных исследованиях выявлены гемоконцентрация, тромбопения, лейкоцитоз (гемоглобин 158-164 г/л (N 112-153), эритроциты 4,97-4,89*1012/л (N 3,8-5,15), гематокрит 47,2-48,2% (N 34,9-45,6), тромбоциты 91-117*109/л (N 150-375), лейкоциты 11,3-12,2*109/л (N 3,4-10,8), гранулоциты 65,2-84,3% (N 42,2-75,2)), признаки острого миокардиального повреждения и перегрузки ЛЖ (тропонин I 0,215-0,546 мкг/л (N 0,008-0,029), креатинфосфокиназа общая 206-209 Ед/л (N 32-294), креатинфосфокиназа-МБ 36,2 Ед/л (N 0-25), N-концевой промозговой натрийуретический пептид 5127 пг/мл (N 12-450)). Повышен уровень С-реактивного белка (86,3-92,3 мг/л (N 0,1-7,0)), выраженное снижение почечной функции (креатинин 503-547 мкмоль/л (N 53-88), мочевина 59-61 ммоль/л (N 2,5-8,3)).
В венозной крови pH 7,23 (N 7,35-7,45), pCO2 35,8 мм рт.ст. (N 41-51), pO2 61,5 мм рт.ст. (N 35-49), лактат 5,5 ммоль/л (N 0,5-1,6), натрий 169 ммоль/л (N 130-155), калий 3,7 ммоль/л (N 3,5-5,3), хлор 134 ммоль/л (N 98-115).
Аланинаминотрансфераза 13,6 Ед/л (N 0-32), аспартатаминотрансфераза 46 Ед/л (N 5-34), щелочная фосфатаза 151 Ед/л (N 64-306), билирубин общий 27,4 мкмоль/л (N 1,7-20,5), билирубин прямой 13,7 мкмоль/л (N 0,9-5,0), общий белок 59 г/л (N 65-85), альбумин 29,2 г/л (N 35-55), альфа-амилаза 415-355 Ед/л (N 11-115).
Протромбин 26-33% (N 70-130), активированное частичное тромбопластиновое время 28,1-28,1 с (N 23-36,5), тромбиновое время 19,8-19,3 с (N 15-24), фибриноген 4,4-4,96 г/л (N 2,0-3,93), D-димер 5184-5828 нг/мл (N 0-500).
В анализе мочи белок 0,2-0,7 г/л, лейкоциты 500/мл, эритроциты ++.
Маркеры вирусных гепатитов, ВИЧ, сифилиса отрицательны. Мазок на новую коронавирусную инфекцию (COVID-19) отрицательный.
При ЭхоКГ в условиях затрудненной визуализации: аорта уплотнена, корень 3,1 см. Переднезадний размер левого предсердия 4,1 см (N <3,9 см). Гипертрофия ЛЖ: толщина МЖП 1,5 см (N ≤0,9 см), конечный диастолический размер ЛЖ 3,9 см (N ≤5,2 см), толщина задней стенки ЛЖ 1,4 см (N ≤0,9 см). Конечный диастолический объем ЛЖ 41 мл (N 46-138 мл), конечный систолический объем ЛЖ 20 мл, ударный объем 21 мл, фракция выброса ЛЖ 51%. Нарушений локальной сократимости ЛЖ не выявлено. В правых камерах электроды ЭКС. Створки аортального клапана (АК) уплотнены, с включениями кальцинатов, амплитуда раскрытия в норме. Недостаточность АК 1 ст. Створки митрального, трикуспидального клапанов уплотнены, раскрытие створок в диастолу достаточное. Незначительный перикардиальный выпот: сепарация листков перикарда за правыми камерами до 1,0 см.
Кроме того, циркулярно вдоль корня и восходящей аорты визуализируются дополнительные гиперэхогенные полости, с гетерогенным содержимым, формирующие диаметр аорты 6,0 см (рис. 3). В области коаптации створок АК визуализируется дополнительное линейное образование, длиной ~7 мм.
Выявленные находки трактовались как абсцесс корня аорты на фоне инфекционного эндокардита АК, либо ложная тромбированная аневризма аорты (микотическая?). Для уточнения диагноза рекомендовано проведение КТ аортографии, чреспищеводного ЭхоКГ. Однако нарастание почечной дисфункции требовало проведения заместительной почечной терапии (продленная гемодиафильтрация), что делало невозможным проведение этих исследований. При УЗИ брюшного отдела аорты без патологии, взяты посевы крови.
Учитывая заподозренный инфекционный эндокардит, лейкоцитоз, повышение С-реактивного белка, начата терапия цефтриаксоном и ванкомицином. Также получала метопролол, фуросемид, омепразол. Продолжалась ИВЛ, вазопрессорная поддержка высокими дозами норэпинефрина. Однако, несмотря на проводимое лечение, через 35 ч после поступления пациентка скончалась на фоне нарастания явлений полиорганной недостаточности, шока, грубых водно-электролитных и метаболических нарушений.
Клинический диагноз сформулирован следующим образом: инфекционный эндокардит АК. Синдром полиорганной недостаточности (сепсис, острое почечное повреждение, дыхательная недостаточность III степени, хроническая сердечная недостаточность с сохранной фракцией выброса ЛЖ, водно-электролитные нарушения (гипернатриемия, гиперхлоремия)).
При аутопсии обнаружено, что выявленные при ЭхоКГ находки были обусловлены первичным злокачественным новообразованием ПП. На рисунке 4 белым треугольником обозначен опухолевый узел неправильной формы, дольчатого строения, плотноватой консистенции, на разрезах бледно-розового цвета, размерами 8/6/6 см, заполняющий почти всю полость ПП. Опухолевая ткань распространяется в межпредсердную перегородку, прорастает в эпикард, "муфтообразно" обрастает коронарные артерии (желтой звездочкой обозначен поперечный срез правой коронарной артерии) и стенку аорты (правое изображение). Клапаны без патологии, створки АК (красные стрелки) и стенка аорты интактны. Электроды ЭКС установлены в верхушке ПЖ (белая стрелка) и ПП. Желтым треугольником обозначено ушко ПП. Имелись также патологоанатомические признаки застойной сердечной недостаточности.
Второй важной находкой стало злокачественное новообразование левой почки (рис. 5) (опухолевый узел размерами 8/6 см желтовато-серого цвета с дряблыми участками темно-красного цвета без прорастания капсулы почки, с прорастанием в стенку чашечно-лоханочной системы), рT2N0M0, стадия II.
Гистологическое строение обеих опухолей (В-клеточная лимфома и светлоклеточный почечноклеточный рак, G2) представлено на рисунке 6.
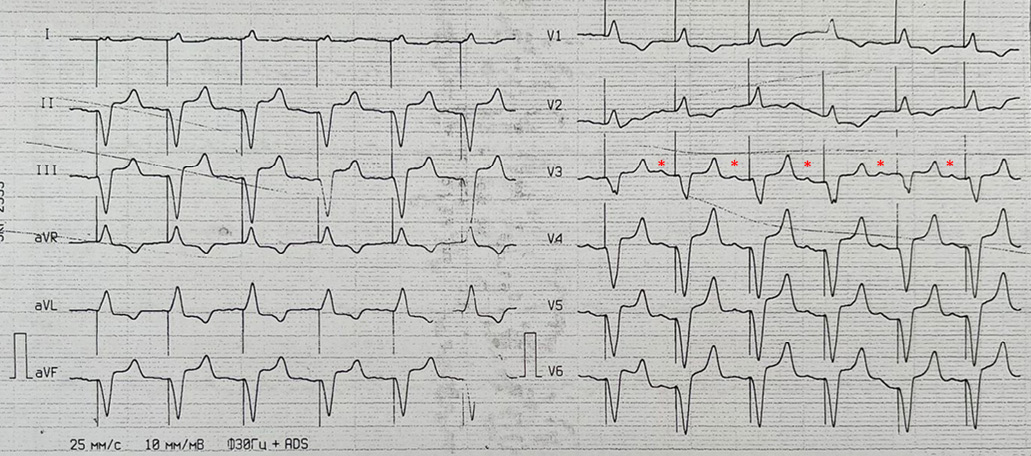
Рис. 1. ЭКГ при поступлении.
Примечание: электрокардиостимуляция в режиме VAT (Р-синхронизированная правожелудочковая стимуляция). Предсердная активность (зубцы Р) обозначены звездочками. Картина БПНПГ в грудных отведениях. ЧСС 91 уд./мин.
Сокращения: БПНПГ — блокада правой ножки пучка Гиса, ЧСС — частота сердечных сокращений.
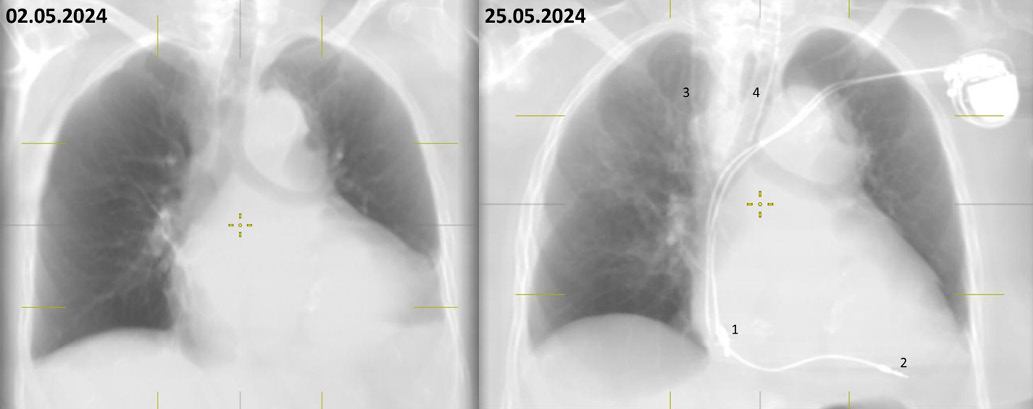
Рис. 2. Наложение нескольких срезов, полученных при КТ органов грудной клетки во фронтальной проекции.
Примечание: тень двухкамерного ЭКС в левой подключичной области, 1 — электрод в ПП, 2 — электрод в области верхушки ПЖ, 3 — тень центрального венозного катетера, 4 — тень интубационной трубки в просвете трахеи.
Сокращения: ПЖ — правый желудочек, ПП — правое предсердие, ЭКС — электрокардиостимулятор.
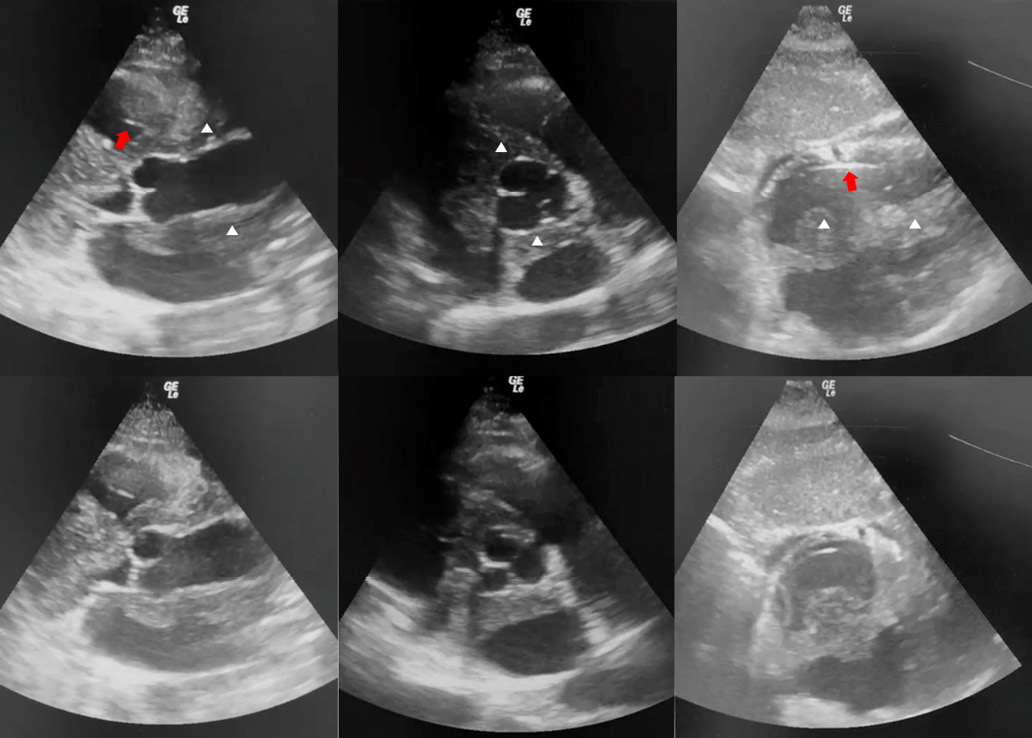
Рис. 3. ЭхоКГ. В левом ряду изображение по длинной оси, парастернальная позиция; в среднем — по короткой оси; в правом — субкостальная позиция.
Примечание: циркулярно вдоль корня и восходящей аорты дополнительные гиперэхогенные полости с гетерогенным содержимым, формирующие диаметр аорты 6,0 см (обозначены белыми треугольниками). В правых камерах электроды ЭКС (красная стрелка).
Сокращение: ЭКС — электрокардиостимулятор.
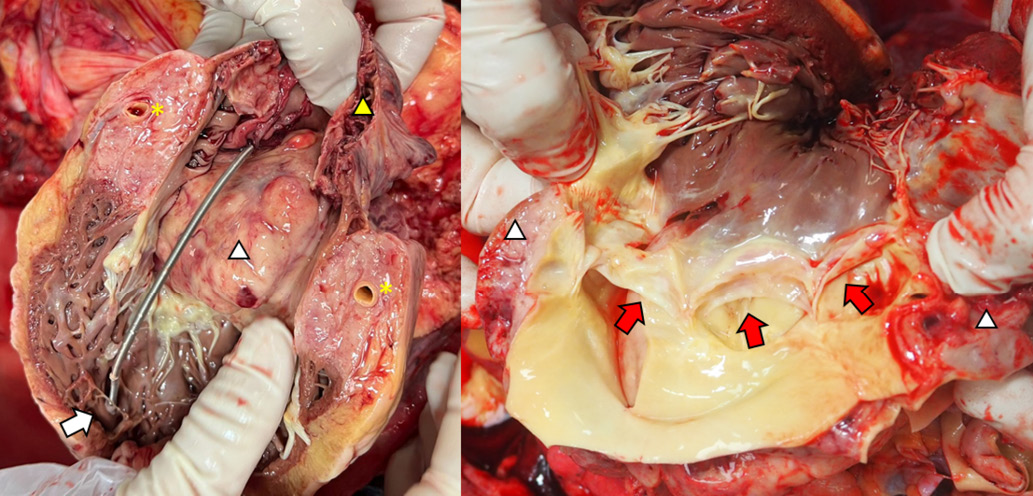
Рис. 4. Образование ПП, прорастающее в МЖП, ПЖ.
Примечание: цветное изображение доступно в электронной версии журнала.
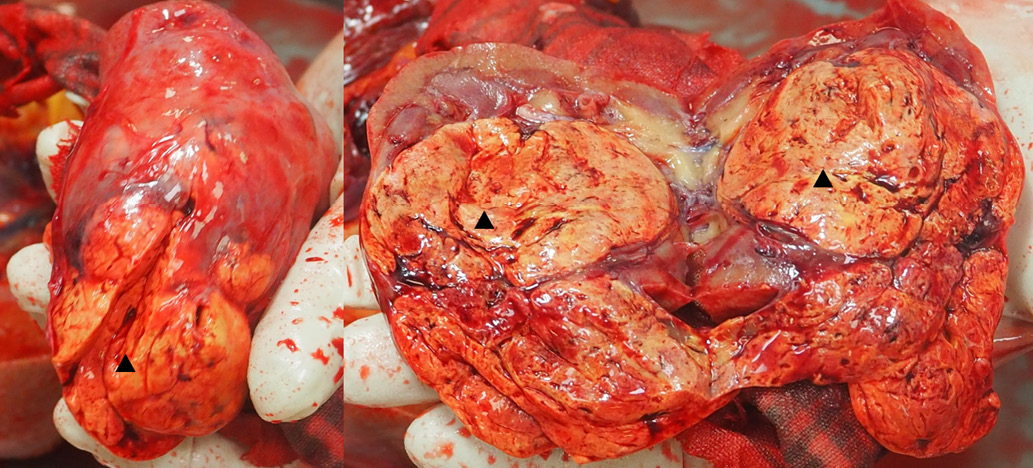
Рис. 5. Образование в средней трети левой почки, обозначено черным треугольником.
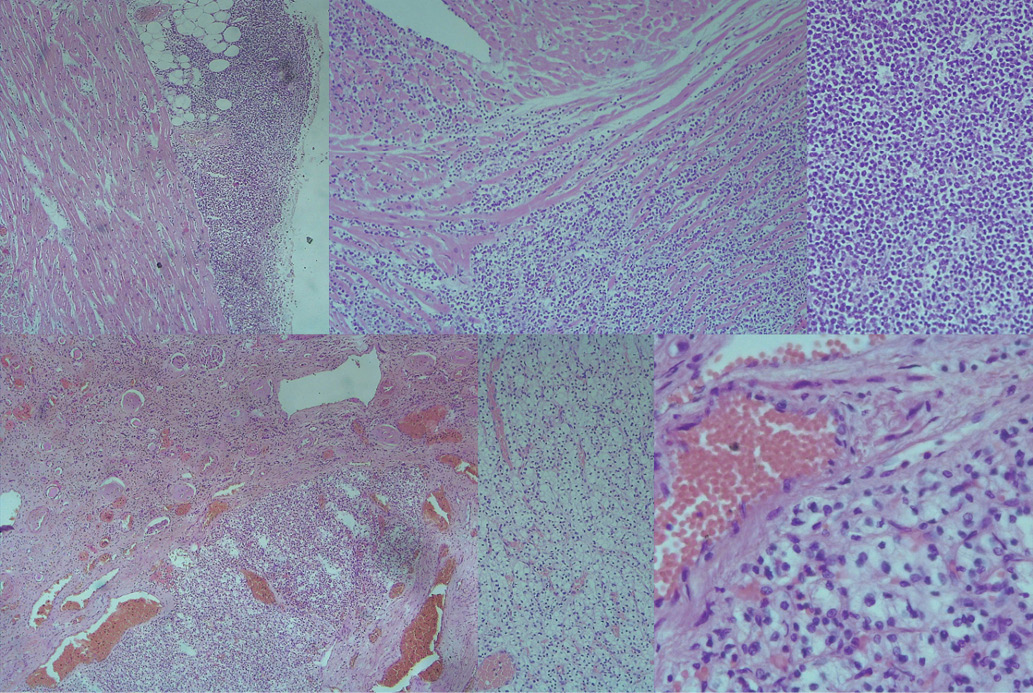
Рис. 6. Верхний ряд изображений — в эпикарде рост опухолевой ткани, имеющей строение лимфомы.
Примечание: нижний ряд — светлоклеточный почечноклеточный рак (G2). Окраска гематоксилин/эозин, увеличение х50, х100, х200. Цветное изображение доступно в электронной версии журнала.
Обсуждение
Причиной смерти пациентки стал первично-множественный синхронный рак, представленный редким сочетанием лимфомы сердца и рака почки. По-видимому, прорастание опухоли в зоне АВ-узла в начале мая 2024г манифестировало нарушениями АВ-проводимости, потребовавшими установки ЭКС. Выявленная тогда при ЭхоКГ дилатация ПП в отсутствие клапанной патологии, нарушений функции ЛЖ, дилатации ПЖ, повышения давления в легочной артерии, нуждалась в интерпретации, однако даже при повторном прицельном рассмотрении данных КТ органов грудной клетки (без внутривенного контрастирования), выполненной перед установкой ЭКС, каких-либо признаков опухолевого поражения выявить не удалось. Безусловно, наличие симультанной опухоли даже при своевременной диагностике лимфомы сердца вряд ли оставляло возможности для проведения химиотерапии и улучшения прогноза.
Выявленные при ЭхоКГ парааортальные изменения, описанные как гиперэхогенные полости с гетерогенным содержимым, трактовавшиеся как абсцесс корня аорты или аневризма аорты, оказались проявлениями опухоли. Линейное образование в области кооптации створок АК было интерпретировано как разрастания эндотелия (нити, наложения Ламбла, "клапанные нити", valvular strands) [27][28]. Однако при вскрытии дополнительных образований на АК обнаружено не было.
Опухоль почки также не визуализировалась при УЗИ, проведенном перед установкой ЭКС, однако зафиксированные в тот момент повышение гемоглобина (123-153 г/л (N 120-140) при нормальном гематокрите и количестве эритроцитов), тромбопению (105-131*109/л (N 180-320)) ретроспективно можно трактовать как проявления паранеопластического синдрома. В анализе мочи определялись лейкоциты (75/мкл), эритроциты (300/мкл), что, вероятно, связывали с катетеризацией мочевого пузыря. Почечная функция за время госпитализации несколько улучшилась (скорость клубочковой фильтрации по CKD-EPI 26,8-51 мл/мин/1,73 м2).
Интересным аспектом представленного случая являются особенности ЭКГ-картины. Схожее извращение морфологии стимулированных QRS комплексов описано у 91-летней пациентки с дилатацией ПЖ [29]. Предполагается, что причиной возникновения БПНПГ при правожелудочковой стимуляции в отсутствие диспозиции электрода и перфорации стенки сердца может быть более ранняя активация ЛЖ при наличии аномальных путей проведения. Также высказываются версии о возможности ретроградного проведения пейсмейкерного стимула по правой ножке пучка Гиса к АВ-соединению и антеградно по левой ножке пучка Гиса. Кроме того, часть МЖП, анатомически являющаяся стенкой ПЖ, функционально и электрически может вести себя как стенка ЛЖ [30][31]. Тяжелое поражение ПЖ и проводящей системы может привести к запаздыванию активации ПЖ с более ранним возбуждением ЛЖ [32][33]. В нашем случае причиной изменений привычной ЭКГ картины стало замещение структур ПП опухолевой тканью с ее прорастанием в МЖП и ПЖ, повреждением проводящих путей и развитием полной АВ блокады.
Заключение
Представленный случай редкого сочетания двух опухолей демонстрирует сложности диагностики образований сердца и подчеркивает важность их раннего распознавания даже при манифестации неспецифическими симптомами.
Заявление о получении информированного согласия у пациента. Тяжесть состояния пациентки и краткость ее пребывания в стационаре не позволяли получить у нее информированное согласие. Персональные данные пациентки в тексте статьи не раскрываются, вся информация представлена в обезличенном виде.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Gordon MJ, Danilova O, Spurgeon S, Danilov AV. Cardiac non-Hodgkin's lymphoma: clinical characteristics and trends in survival. Eur J Haematol. 2016;97(5):445-52. doi:10.1111/ejh.12751.
2. Jeudy J, Burke AP, Frazier AA. Cardiac Lymphoma. Radiol Clin North Am. 2016;54(4): 689-710. doi:10.1016/j.rcl.2016.03.006.
3. Voigt P, Wienbeck S, Weber MA, et al. Cardiac Hematological Malignancies: Typical Growth Patterns, Imaging Features, and Clinical Outcome. Angiology. 2018;69(2): 170-6. doi:10.1177/0003319717713581.
4. Sultan I, Aranda-Michel E, Habertheuer A, et al. Long-Term Outcomes of Primary Cardiac Lymphoma. Circulation. 2020;142(22):2194-5. doi:10.1161/CIRCULATIONAHA.120.047215.
5. Доронин В.А., Морозова Н.В., Градобоев М.И. др. Первичная диффузная В-крупноклеточная лимфома сердца. Клиническое наблюдение и обзор литературы. Клиническая онкогематология. 2009;(4):358-61.
6. Мартаков М.А., Селиваненко В.Т., Вишнякова М.В. и др. Удаление В-клеточной лимфомы правых камер сердца и протезирование трикуспидального клапана у ВИЧ-инфицированного пациента. Альманах клинической медицины. 2015;(38):133-5. doi:10.18786/2072-0505-2015-38-133-135.
7. Miguel CE, Bestetti RB. Primary cardiac lymphoma. Int J Cardiol. 2011;149(3):358-63. doi:10.1016/j.ijcard.2010.02.016.
8. Chinen K, Izumo T. Cardiac involvement by malignant lymphoma: a clinicopathologic study of 25 autopsy cases based on the WHO classification. Ann Hematol. 2005;84(8): 498-505. doi:10.1007/s00277-005-1009-5.
9. Гадаев И.Ю., Ершов В.И., Бочкарникова О.В. и др. Поражение сердца при лимфомах. Обзор литературы и описание случая клинического течения В-крупноклеточной лимфомы. Рациональная фармакотерапия в кардиологии. 2015:11(6):610-7.
10. Kaiafa G, Bobos M, Savopoulos C, et al. Heart and lymphoma: An unusual case of secondary cardiac lymphoma manifested through presyncope and syncope episodes and atrial flutter. Hellenic J Cardiol. 2018;59(3):182-5. doi:10.1016/j.hjc.2017.09.006.
11. Mao J, Xu Y, Zhu M, et al. Case report: Complete atrio-ventricular block successfully reversed in newly diagnosed primary cardiac B-cell lymphoma. Front Med (Lausanne). 2023;10:1119286. doi:10.3389/fmed.2023.1119286.
12. Hu B, Zhao J, Liang X, et al. A case of complete atrioventricular block associated with primary cardiac lymphoma reversed without cardiac pacemaker implantation. J Int Med Res. 2022;50(4):3000605221089780. doi:10.1177/03000605221089780.
13. Bohbot Y, Garot J, Danjon I, et al. Case report: Diagnosis, management and evolution of a bulky and invasive cardiac mass complicated by complete atrioventricular block. Front Cardiovasc Med. 2023;10:1135233. doi:10.3389/fcvm.2023.1135233.
14. Ito K, Nishimura Y, Tanaka H, Tejima T. Epicardial pacemaker implantation for sick sinus syndrome in a patient with supra vena cava obstructed by a primary cardiac lymphoma. J Cardiol Cases. 2020;21(6):234-7. doi:10.1016/j.jccase.2020.03.007.
15. Al Mawed M, Brockmeier J, Haertel D, et al. From inoperable to back to life: a case report of successfully treated obstructive right ventricular primary cardiac lymphoma. Eur Heart J Case Rep. 2022;6(2):ytac051. doi:10.1093/ehjcr/ytac051.
16. Ellen S, Emma H.Primary cardiac lymphoma: a case report. Eur Heart J Case Rep. 2023;7(4):ytad175. doi:10.1093/ehjcr/ytad175.
17. Sano M, Okada T, Yamashita D, et al. Left-sided primary cardiac lymphoma diagnosed by needle biopsy with total endoscopic anterolateral mini-thoracotomy: a case report. Eur Heart J Case Rep. 2023;7(12):ytad600. doi:10.1093/ehjcr/ytad600.
18. Nasir A, Patel YB. Diffuse Large B-cell Lymphoma Presenting as a Cardiac Mass. Cureus. 2024;16(5):e59755. doi:10.7759/cureus.59755.
19. Wang Z, Meng G. Case report: Surgical resection of a primary cardiac diffuse large B-cell lymphoma and reconstruction of involved right heart structures. Int J Surg Case Rep. 2023;111:108702. doi:10.1016/j.ijscr.2023.108702.
20. Кондратьев Д.А., Исаев М.Н., Тунгусов Д.С. и др. Хирургическое лечение первичной лимфомы сердца. Кардиология и сердечно-сосудистая хирургия. 2015;8(4):86-8. doi:10.17116/kardio20158486-88.
21. Al-Darzi WK, Hana A, Lahiri MK, et al. Diffuse B Cell Lymphoma Leading to Complete Heart Block: Is This Transient or Permanent? Am J Case Rep. 2020;21:e925760. doi:10.12659/AJCR.925760.
22. Tai CJ, Wang WS, Chung MT, et al. Complete atrio-ventricular block as a major clinical presentation of the primary cardiac lymphoma: a case report. Jpn J Clin Oncol. 2001;31(5):217-20. doi:10.1093/jjco/hye046.
23. Shigeno R, Okada T, Koyama T, Furukawa Y. Surgical resection and epicardial lead implantation for primary cardiac lymphoma with a complete atrioventricular block: a case report. Eur Heart J Case Rep. 2023;7(2):ytad035. doi:10.1093/ehjcr/ytad035.
24. Jayaprakash S. Clinical presentations, diagnosis, and management of arrhythmias associated with cardiac tumors. J Arrhythm. 2018;34(4):384-93. doi:10.1002/joa3.12030.
25. Clifford SM, Guerra SM, Mangion JR. Massive metastatic intracardiac lymphoma presenting with complete heart block with resolution following chemotherapy. Echocardiography. 2003;20(2):201-2. doi:10.1046/j.1540-8175.2003.03001.x.
26. Giudici MC, Sadler RL, Robken JA, et al. Complete atrioventricular block due to large cell lymphoma: resolution with chemotherapy. Clin Cardiol. 1996;19(3):262-4. doi:10.1002/clc.4960190326.
27. Aggarwal A, Leavitt BJ. Images in clinical medicine. Giant Lambl's excrescences. N Engl J Med. 2003;349(25):e24. doi:10.1056/ENEJMicm010900.
28. Домницкая Т.М., Сахно Ю.Ф., Седов В.П., Савина Н.М. Эхокардиографическая диагностика опухолей сердца. Кардиология. 2021;61(7):85-92. doi:10.18087/cardio.2021.7.n1182.
29. Issa ZF. Mechanism of Right Bundle Branch Block Pattern During Uncomplicated Right Ventricular Pacing. The Journal of Innovations in Cardiac Rhythm Management. 2014;(5):1721-4. doi:10.19102/icrm.2014.050805.
30. Lister JW, Klotz DH, Jomain SL, et al. Effect of pacemaker site on cardiac output and ventricular activation in dogs with complete heart block. Am J Cardiol. 1964;14:494-503. doi:10.1016/0002-9149(64)90033-5.
31. Mower MM, Aranaga CE, Tabatznik B. Unusual patterns of conduction produced by pacemaker stimuli. Am Heart J. 1967;74(1):24-8. doi:10.1016/0002-8703(67)90036-1.
32. Barold SS, Narula OS, Javier RP, et al. Significance of right bundle-branch block patterns during pervenous ventricular pacing. Br Heart J. 1969;31(3):285-90. doi:10.1136/hrt.31.3.285.
33. Yang YN, Yin WH, Young MS. Safe right bundle branch block pattern during permanent right ventricular pacing. J Electrocardiol. 2003;36(1):67-71. doi:10.1054/jelc.2003.50002.
Об авторах
А. В. МелеховРоссия
д.м.н., профессор кафедры госпитальной терапии им. Г. И. Сторожакова лечебного факультета
Москва
Конфликт интересов:
Нет
О. О. Мануйлова
Россия
к.м.н., зав. отделением лучевой диагностики
Москва
Конфликт интересов:
Нет
И. Г. Никитин
Россия
д.м.н., профессор, зав. кафедрой госпитальной терапии им. Г. И. Сторожакова лечебного факультета
Москва
Конфликт интересов:
Нет
Н. В. Петренко
Россия
зав. патологоанатомическим отделением
Москва
Конфликт интересов:
Нет
А. В. Саликов
Россия
к.м.н., главный врач; доцент кафедры общей хирургии
Москва
Конфликт интересов:
Нет
А. И. Селиванов
Россия
к.м.н., доцент кафедры госпитальной терапии им. Г.И. Сторожакова лечебного факультета
Москва
Конфликт интересов:
Нет
А. Г. Тевосян
Россия
врач функциональной диагностики
Москва
Конфликт интересов:
Нет
И. Ю. Уфимцева
Россия
врач функциональной диагностики
Москва
Конфликт интересов:
Нет
Дополнительные файлы

|
1. Презентация случая | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(7MB)
|
Метаданные ▾ | |
- Первичные лимфомы сердца — редкая патология с неспецифическими проявлениями, включающими сердечную недостаточность, нарушения ритма сердца и проводимости.
- Представлен случай 88-летней пациентки с В-клеточной лимфомой правого предсердия, не диагностированной ранее при обследовании перед установкой электрокардиостимулятора по поводу атриовентрикулярной блокады 3 степени.
- Интересны особенности электрокардиографической картины (признаки блокады правой, а не левой ножки пучка Гиса при правожелудочковой стимуляции). Описаны также сложности интерпретации эхокардиографических проявлений болезни.
- Второй находкой при аутопсии стал светлоклеточный почечноклеточный рак, также не выявлявшийся ранее при инструментальном обследовании.
Рецензия
Для цитирования:
Мелехов А.В., Мануйлова О.О., Никитин И.Г., Петренко Н.В., Саликов А.В., Селиванов А.И., Тевосян А.Г., Уфимцева И.Ю. Лимфома правого предсердия в сочетании с раком почки. Клинический случай. Российский кардиологический журнал. 2025;30(5S):6115. https://doi.org/10.15829/1560-4071-2025-6115. EDN: WPJAMQ
For citation:
Melekhov A.V., Manuilova O.O., Nikitin I.G., Petrenko N.V., Salikov A.V., Selivanov A.I., Tevosyan A.G., Ufimtseva I.Y. Right atrial lymphoma in combination with kidney cancer: а case report. Russian Journal of Cardiology. 2025;30(5S):6115. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6115. EDN: WPJAMQ
JATS XML

















































