Перейти к:
Расслоение аорты и тромбоэмболия легочной артерии: фатальное сочетание. Клинический случай
https://doi.org/10.15829/1560-4071-2025-6082
EDN: VQTEDK
Аннотация
В статье описан редкий случай прижизненной диагностики сочетания массивной тромбоэмболии легочной артерии и расслоения аорты (тип I по Дебейки, тип А по Стэнфорду) у пациента 42 лет с артериальной гипертензией, ожирением и подагрой. Комбинация этих потенциально фатальных патологий, даже при своевременной диагностике значительно затрудняет выбор лечебной тактики, поскольку применение антитромботических препаратов для лечения тромбоэмболии легочной артерии абсолютно противопоказано при расслоении аорты, а случаи успешного хирургического лечения в подобных обстоятельствах крайне редки.
Случай иллюстрирован данными инструментальных методов обследования и аутопсии.
Для цитирования:
Гаврилов Ю.В., Мануйлова О.О., Мелехов А.В., Мишутченко О.П., Никитин И.Г., Петренко Н.В., Саликов А.В., Суряхин В.С., Тевосян А.Г. Расслоение аорты и тромбоэмболия легочной артерии: фатальное сочетание. Клинический случай. Российский кардиологический журнал. 2025;30(5S):6082. https://doi.org/10.15829/1560-4071-2025-6082. EDN: VQTEDK
For citation:
Gavrilov Yu.V., Manuilova O.O., Melekhov A.V., Mishutchenko O.P., Nikitin I.G., Petrenko N.V., Salikov A.V., Suryakhin V.S., Tevosyan A.G. Aortic dissection and pulmonary embolism: a fatal combination: а case report. Russian Journal of Cardiology. 2025;30(5S):6082. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6082. EDN: VQTEDK
Введение
В клинических рекомендациях по ведению пациентов с тромбоэмболией легочной артерии (ТЭЛА) и острым аортальным синдромом (ОАС), включающим помимо расслоения аорты формирование интрамуральной гематомы, пенетрирующую аортальную язву и разрыв аорты, подчеркивается необходимость дифференциального диагноза между этими сердечно-сосудистыми катастрофами, которые могут проявляться болями в груди, одышкой, слабостью, гемодинамической нестабильностью, неврологическими симптомами [1, 2]. Острое расслоение аорты в редких случаях может вести к легочным осложнениям (сдавлению легочной артерии (ЛА), формированию аортопульмонального свища, острому прорыву аорты в легкое с массивным кровохарканьем), что в экстренных ситуациях, в условиях ограниченного времени значительно затрудняет диагностику и определение лечебной тактики, принципиально отличающейся у пациентов с ТЭЛА и ОАС [3-8]. При этом публикации, описывающие одновременное развитие ТЭЛА и ОАС, редки. Одна из первых статей, посвященных этому вопросу, опубликована только в 2003г, что можно связывать с увеличением доступности современных визуализирующих методик, позволяющих диагностировать это сочетание у тяжелых пациентов [9]. Среди 163 пациентов, оперированных по поводу аневризмы восходящей аорты (без расслоения), только у одного пациента была выявлена сопутствующая ТЭЛА, однако в цитируемой работе нет сведений о времени развития ТЭЛА, ее тяжести и влиянии на судьбу пациента [10].
Приводим описание редкого случая прижизненной диагностики сочетания массивной ТЭЛА и расслоения аорты (тип I по Дебейки, тип А по Стэнфорду).
Клинический случай
Пациент М., 42 года, 04.06.2024 доставлен бригадой скорой медицинской помощи в отделение реанимации и интенсивной терапии городской клинической больницы им. В. М. Буянова с подозрением на острый коронарный синдром без подъема сегмента ST, ТЭЛА. На догоспитальном этапе получил 250 мг ацетилсалициловой кислоты.
Известно, что в течение длительного времени страдает ожирением I ст. (рост 186 см, масса тела 120 кг, индекс массы тела 34,7 кг/м2), умеренной артериальной гипертензией, гипотензивные средства не принимает. Ангинозные приступы отрицает. С 2002г эпизоды артрита, купируемые нестероидными противовоспалительными препаратами. В 2023г установлен диагноз хроническая тофусная подагра, хронический подагрический артрит, деформирующий полиостеоартроз, получал аллопуринол, колхицин.
С 01.06.2024 прогрессировала выраженная слабость, профузный холодный липкий пот, одышка смешанного характера при минимальной физической нагрузке. 02.06.2024 амбулаторно проведена рентгенография органов грудной клетки (ОГК), патологических изменений не выявлено. Как видно из рисунка 1 (А, Б), в этот момент существенных отличий от рентгенограммы, выполненной несколько лет назад в рамках диспансеризации, не было.
При поступлении состояние тяжелое. Сознание ясное, ориентирован в пространстве, времени и собственной личности. Очевидных фенотипических проявлений синдрома соединительнотканной дисплазии нет. Абдоминальное ожирение. Кожа обычной окраски, пастозность нижних конечностей. Сыпи, проявлений кровоточивости нет. Тофус левого локтя и 5 пястно-фалангового сустава левой руки. Дефигурация 2-5 пястно-фаланговых суставов обеих кистей, обоих голеностопных суставов. Дыхание самостоятельное, при аускультации жесткое, ослабленное в нижних отделах с двух сторон, хрипов нет. SpO2 95% при дыхании атмосферным воздухом, частота дыхательных движений 18 в мин. Артериальное давление (АД) 168/100 мм рт.ст., частота сердечных сокращений (ЧСС) 117 уд./мин, дефицита пульса нет. Тоны сердца приглушены, ритмичны. Язык розовый, с белым налетом. Живот не увеличен в размерах, симметричный, не вздут, при пальпации мягкий, безболезненный. Симптомы раздражения брюшины отрицательные. Перистальтика активная. Мочеиспускание самостоятельное, дизурии нет, моча обычного цвета, диурез (со слов) достаточный.
На электрокардиограмме (ЭКГ) (рис. 2 А, Б) ритм синусовый. Неспецифические изменения конечной части желудочкового комплекса с формированием отрицательных зубцов Т в отведениях от нижней, боковой стенки. В серии тестов тропонин I 0,038-0,05 мкг/л (N 0,017-0,05), креатинфосфокиназа общая 32-32 ЕД/л (N 32-294), МВ-фракция креатинфосфокиназы 11,5-11,9 ЕД/л (N 0-25).
В связи с отсутствием ангинозных болей, лабораторного подтверждения острого миокардиального повреждения, ЭКГ-критериев инфаркта миокарда, стабильной гемодинамикой, острый коронарный синдром исключен, показаний к проведению экстренной коронароангиографии не было. АД постепенно нормализовано с помощью каптоприла, моксонидина, метопролола и внутривенного введения фуросемида. В течение последующих полутора суток проведено лабораторно-инструментальное обследование для последовательного исключения сердечно-сосудистых катастроф и других острых состояний.
В серии лабораторных анализов: гемоглобин 170-150-157 г/л (N 130-170), лейкоциты 14,2-11,4-14,4*109/л (N 4,0-10,0), тромбоциты 173-184-192*109/л (N 150-340). Калий 4,31-4,32 мМоль/л (N 3,44-5,3), натрий 144-143 мМоль/л (N 131-157), хлор 99 мМоль/л (N 95- 10). Креатинин 146-128 мкмоль/л (скорость клубочковой фильтрации по формуле Кокрофта 71-81 мл/мин/1,73 м2), мочевина 4,4-4,5 мМоль/л (N 2,5-8,3), альфа-амилаза 15,40 ЕД/л (N 11-115), глюкоза 9,3 мМоль/л (N 3,8-5,5), билирубин общий 25,4 мкмоль/л (N 1,7-20,5), билирубин прямой (конъюгированный) 6,6 мкмоль/л (N 0,9-5,0), аланиновая трансфераза 84,7 ЕД/л (N 0-32,0), аспарагиновая трансфераза 96,1 ЕД/л (N 5,0-34,0), С-реактивный белок 96,2-113 мг/л (N 0,1-7,0), прокальцитонин 0,18 нг/мл (N <0,5). Активированное частичное тромбопластиновое время 21,8-23,5-40 с (N 23,0-36,5), концентрация протромбина 74-74-23% (N 70-130), фибриногена 5,39-4,79-5,04 г/л (N 2,00-3,93), D-димер 2941-3544 нг/мл (0-500). Протеинурия 0,1-0,3 г/л, в остальном анализ мочи без особенностей. Рибонуклеиновой кислоты 2019-nCoV в назофарингеальном мазке не обнаружено.
На рентгенограмме ОГК в прямой проекции (лежа, с разворотом влево, рис. 1 В) легочные поля без видимых очаговых и инфильтративных изменений. Легочный рисунок незначительно диффузно усилен. Корни легких не расширены, структурны. Тень средостения не смещена. Тень сердца не расширена. Сосудистый пучок расширен. Диафрагма обычно расположена с двух сторон, контуры четкие, ровные. Синусы прослеживаются. Тень центрального венозного катетера (слева, проксимальный конец в проекции верхней полой вены).
Учитывая выявленный при ультразвуковом исследовании тромбоз правой подколенной вены, повышение уровня D-димера более чем в 2 раза от верхней границы нормы, одышку, пациенту было решено выполнить компьютерную томографию (КТ) ОГК с внутривенным контрастированием, несмотря на лабораторные признаки почечной дисфункции и высокий риск развития контрастиндуцированной нефропатии. Легкие без очаговых и инфильтративных изменений. Трахея и крупные бронхи не изменены. Плеврального выпота не выявлено. В полости перикарда выпота нет. Диаметр легочного ствола 33 мм (N 22-35 мм), диаметр правой ветви ЛА 26 мм (N 20-23 мм), левой — 25 мм (N 18-21 мм). В главных и долевых артериях массивные тромботические массы. Лимфатические узлы внутригрудные и подмышечные не увеличены. Мягкие ткани грудной стенки не изменены. Костные структуры без деструктивных изменений. Заключение: массивная ТЭЛА, 18 баллов по Миллер (рис. 3).
В отсутствие шока и артериальной гипотонии показаний к проведению системной тромболитической терапии у пациента не было, сатурация оставалась в пределах 95%. Учитывая отсутствие показаний к хирургической профилактике повторной ТЭЛА, назначен ривароксабан 15 мг 2 раза/сут.
Проведено эхокардиографическое (ЭхоКГ) исследование. В условиях затрудненной визуализации получены следующие данные: аневризма корня и восходящей аорты (корень 4,6 см, восходящий отдел 5,4 см, стенка уплотнена). Створки аортального клапана уплотнены, амплитуда раскрытия створок в норме. Vmax 1,1 м/с (N <2,6), недостаточность 2 ст., время полуспада градиента давления 402 мс. Незначительное увеличение левого предсердия (переднезадний размер 4,0 см (N <4,1), объем 65 мл (N <58). Гипертрофия миокарда левого желудочка (ЛЖ) (толщина межжелудочковой перегородки 1,6 см (N ≤1,0), задней стенки ЛЖ 1,6 (N ≤1,0), конечный диастолический размер ЛЖ 3,7 см (N ≤5,8)). Глобальная систолическая сократительная функция миокарда ЛЖ сохранена (фракция выброса 55%, конечный диастолический объем 115 мл (N 62-150), конечный систолический объем 52 мл, ударный объем 63 мл), локальная не нарушена. Недостаточность митрального клапана 1 ст. Признаки легочной гипертензии (среднее давление в ЛА 32-47 мм рт.ст.). Увеличение правых камер сердца с признаками перегрузки (правые камеры сердца преобладают над левыми, площадь правого предсердия (ПП) 30 см2 (N ≤18), базальный размер правого желудочка 5,8 см (N ≤4,1)). Систолическая функция правого желудочка снижена (TAPSE 0,9 см (N >1,7)). Недостаточность трикуспидального клапана 2 ст., градиент давления 27 мм рт.ст. Нижняя полая вена не визуализируется. Перикард без особенностей. Высокое давление в ПП могло занижать оценку давления в ЛА и выраженности трикуспидальной регургитации.
За время наблюдения у пациента развилось два эпизода кратковременной потери сознания, которые не сопровождались судорогами, непроизвольным мочеиспусканием. Первый эпизод возник во время транспортировки на КТ, мониторинг ЭКГ в это время не проводился, состояние было расценено как возможный аритмогенный обморок. Второй эпизод возник на следующий день после поступления утром, при мониторинге витальных функций нарушений ритма сердца, колебаний уровня АД, снижения сатурации в этот момент не зафиксировано.
Было отмечено нарастание одышки, беспокойное поведение пациента, появление акроцианоза, "мраморность" кожных покровов, снижение темпа диуреза, нарастание уровня лактата до 7,1 мМоль/л, ацидоз. Учитывая выявленную при поступлении на ЭхоКГ аневризму корня и восходящей части аорты, расширение сосудистого пучка на рентгенограмме, клиническая картина заставила предположить развитие ОАС.
Проведена КТ-ангиография аорты и ее ветвей с контрастированием (рис. 4). Восходящий отдел аорты расширен до 53 мм. Просвет грудного и брюшного отделов аорты контрастируется на всем протяжении, на фоне контрастированной крови от корня аорты до ее бифуркации прослеживается отслоившаяся интима. Плечеголовной ствол, левая общая сонная и левая подключичная артерии отходят от истинного просвета, контрастируются равномерно, без дефектов. Чревный ствол отходит от истинного просвета аорты, отмечается расслоение стенки верхней брыжеечной артерии в начальных отделах. Нижняя брыжеечная артерия отходит от истинного просвета. Почечная артерия справа отходит от ложного просвета, контрастирование паренхимы почки сохранено. Левая почка кровоснабжается от основного просвета. Расслоение стенки прослеживается до уровня бифуркации, правая подвздошная артерия отходит от ложного просвета аорты, левая от истинного. В легких с обеих сторон без очаговых и инфильтративных изменений. В просвете главных и долевых ЛА с двух сторон тромботические массы. Заключение: КТ-картина расслоения стенки аорты с переходом на верхнюю брыжеечную артерию (тип I по Дебейки, тип А по Стэнфорду). Двухсторонняя массивная ТЭЛА.
Ривароксабан отменен.
КТ головного мозга без контрастирования признаков наличия острой интракраниальной патологии не выявила.
Отмечено нарастание одышки, снижение АД. Зафиксирован эпизод фибрилляции желудочков, купировавшийся спонтанно, далее — эпизод идиовентрикулярного ритма с переходом в асистолию (рис. 2 В-Е). Проведены реанимационные мероприятия, восстановлена сердечная деятельность. Установлен временный электрокардиостимулятор (ВЭКС). Начата искусственная вентиляция легких (ИВЛ). Крайне тяжелое нестабильное состояние делало невозможным перевод пациента в кардиохирургический стационар, установку кава-фильтра.
При повторной ЭхоКГ на фоне ИВЛ, реанимационных мероприятий. Дуга аорты 4,1 см, в просвете аорты на визуализируемом участке нитевидная структура — отслойка интимы. Фракция выброса ЛЖ не более 15%. Перикард из полученного доступа без особенностей.
При повторной рентгенографии ОГК (лежа, в условиях динамической нерезкости, рис. 1 Г). Тень центрального венозного катетера слева с концом в проекции верхней полой вены. Инструментальные тени в проекции легочных полей. В легких без очаговых и инфильтративных изменений. Легочный рисунок смазан. Корни легких не расширены, структурны. Синусы свободны, латеральный слева частично вне поля исследования. Купола диафрагмы расположены обычно, контуры четкие, ровные. Тень сердца расширена. Сосудистый пучок расширен.
Несмотря на проводимое лечение, прогрессия полиорганной недостаточности привела к смерти пациента.
На аутопсии диагноз подтвержден. Макроскопическая картина свидетельствовала о достаточно длительном (дни-недели) существовании расслоения аневризмы аорты с сохранением приемлемого кровоснабжения внутренних органов. Помимо диагностированного тромбоза глубоких вен нижних конечностей, дополнительным источником ТЭЛА мог быть тромбоз ушка ПП (рис. 5, 6).
Микроскопическая картина демонстрировала
атеросклеротическое поражение стенки аорты умеренной выраженности (рис. 7). Признаков воспаления аортальной стенки, соединительнотканной дисплазии не выявлено. Структурные компоненты медии сохранены, мукоидоподобного вещества в участках, лишенных волокнистых структур, очаговой деструкции медии с дегенерацией эластического компонента или поражением мышечного компонента — признаков медианекроза, описанных O. Gsell и J. Erdheim [11], не выявлено.
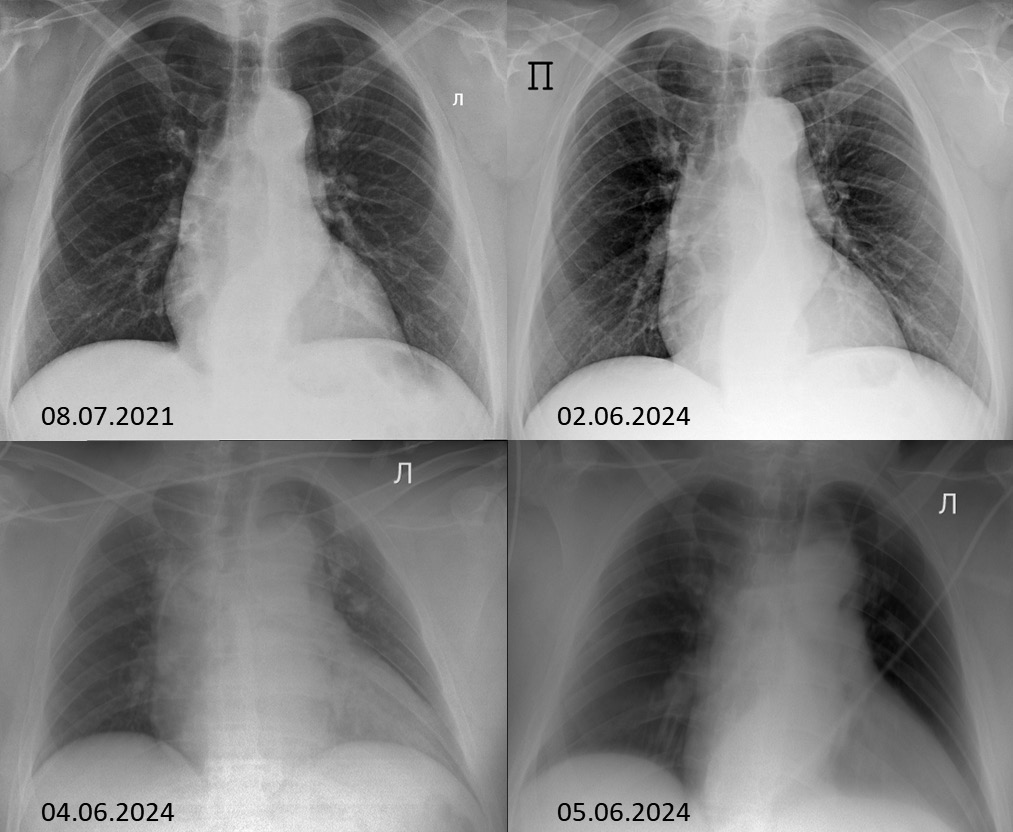
Рис. 1. Серия прямых рентгенограмм ОГК. Объяснения в тексте.

Рис. 2. Серия ЭКГ.
Примечание: А — ритм синусовый, ЧСС 120. Элевация сегмента ST в aVR, V1-V2, депрессия — в I, II, V5-V6, отрицательные зубцы Т в II, III, aVF, V5-V6. Б — ритм синусовый, ЧСС 120 уд./мин. Элевация сегмента ST в aVR, депрессия — в I, II, V5-V6, отрицательные зубцы Т в II, III, aVF, V4-V6. В — идиовентрикулярный ритм, ЧСС около 24 уд./мин. Г — установлен ВЭКС, ЧСС 70 уд./мин. Д — ритм синусовый, ЧСС 112 уд./мин. Неадекватная работа ВЭКС. Неспецифические изменения конечной части желудочкового комплекса. Е — остановка сердечной деятельности, спайки ВЭКС.
Сокращения: ВЭКС — временный электрокардиостимулятор, ЧСС — частота сердечных сокращений.
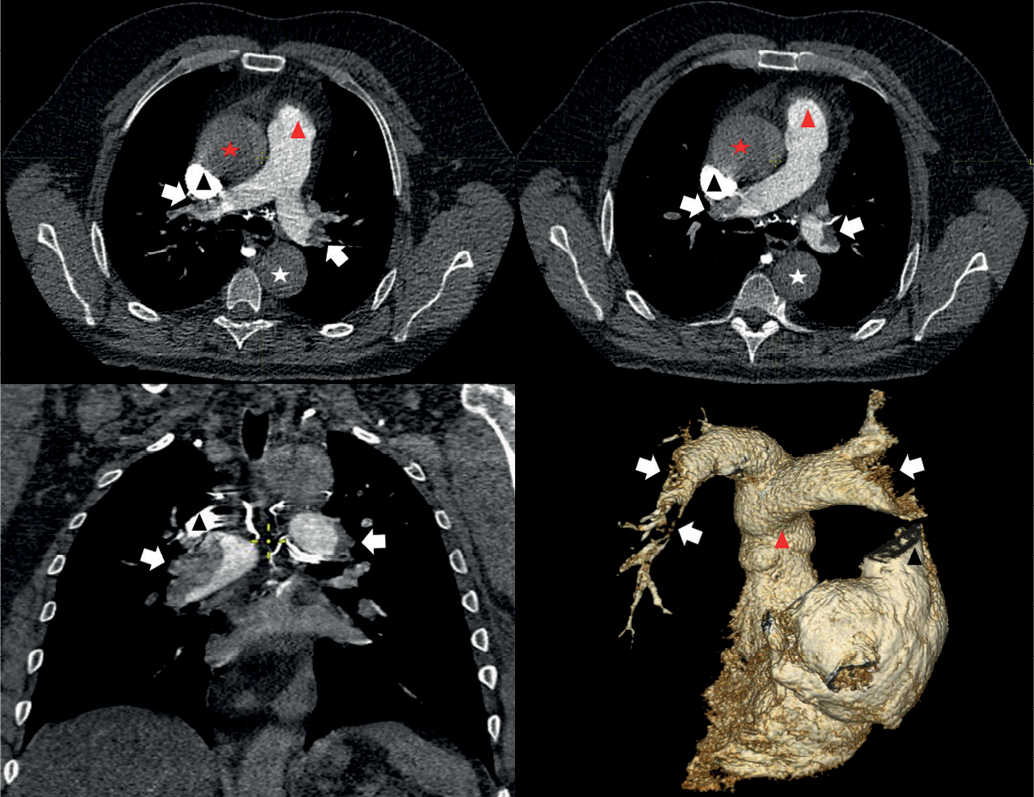
Рис. 3. КТ-картина массивной ТЭЛА.
Примечание: сверху — два аксиальных среза на разных уровнях, снизу слева — корональный, снизу справа — трехмерная реконструкция, вид сзади (удалены левые камеры, легочные вены, полые вены, плохо контрастированные мелкие ветви ЛА). Красной звездочкой отмечена восходящая часть аорты, белой — нисходящая, черным треугольником — контрастированная верхняя полая вена, красным — легочный ствол, белыми стрелками — дефекты контрастирования в ветвях главных ветвей ЛА. Цветное изображение доступно в электронной версии журнала.
Сокращение: ЛА — легочная артерия.
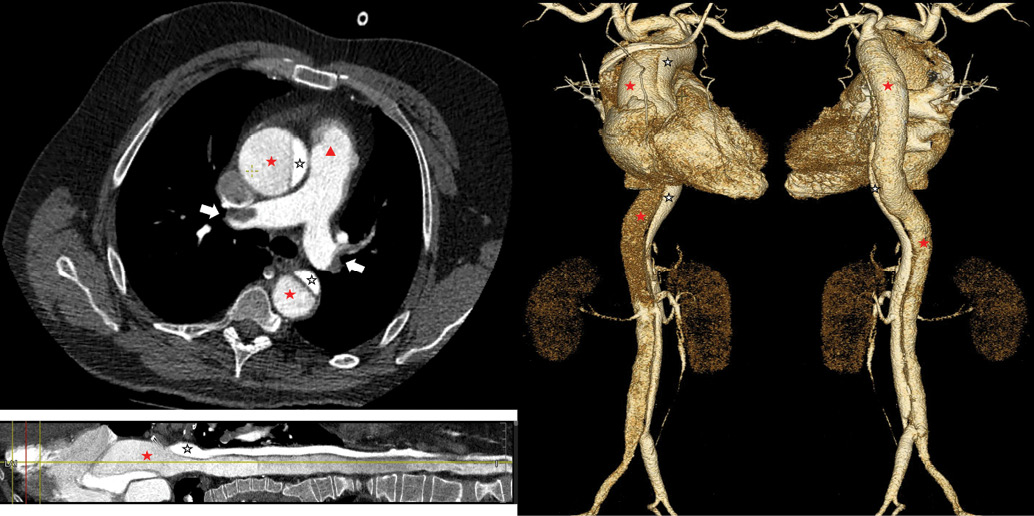
Рис. 4. КТ ОГК с внутривенным контрастированием.
Примечание: слева сверху — аксиальный срез, демонстрирующий отслоение интимы, истинный и ложный (красная и белая звездочки) просветы восходящего и нисходящего отделов дилатированной аорты, а также дефекты наполнения главных ветвей ЛА, обусловленные тромбоэмболией (белые стрелки, красный треугольник — ствол ЛА). Справа — трехмерная реконструкция, показывающая протяженность расслоения аорты и отхождение ее ветвей от истинного и ложного просветов (вид спереди и сзади). Слева снизу — планарное преобразование аорты по центральной линии. Цветное изображение доступно в электронной версии журнала.
Сокращение: ЛА — легочная артерия.
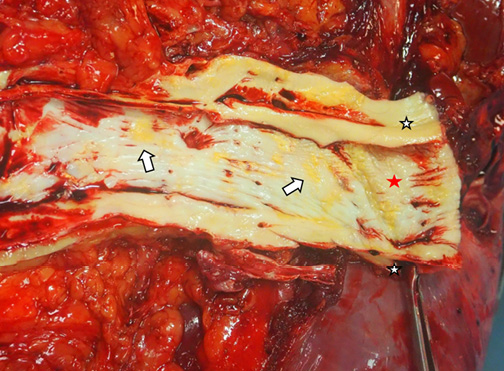
Рис. 5. Аутопсия.
Примечание: расслоение грудной аорты, истинный (красная звездочка) и ложный (белая звездочка) просветы аорты. Стрелками указаны атеромы. Цветное изображение доступно в электронной версии журнала.
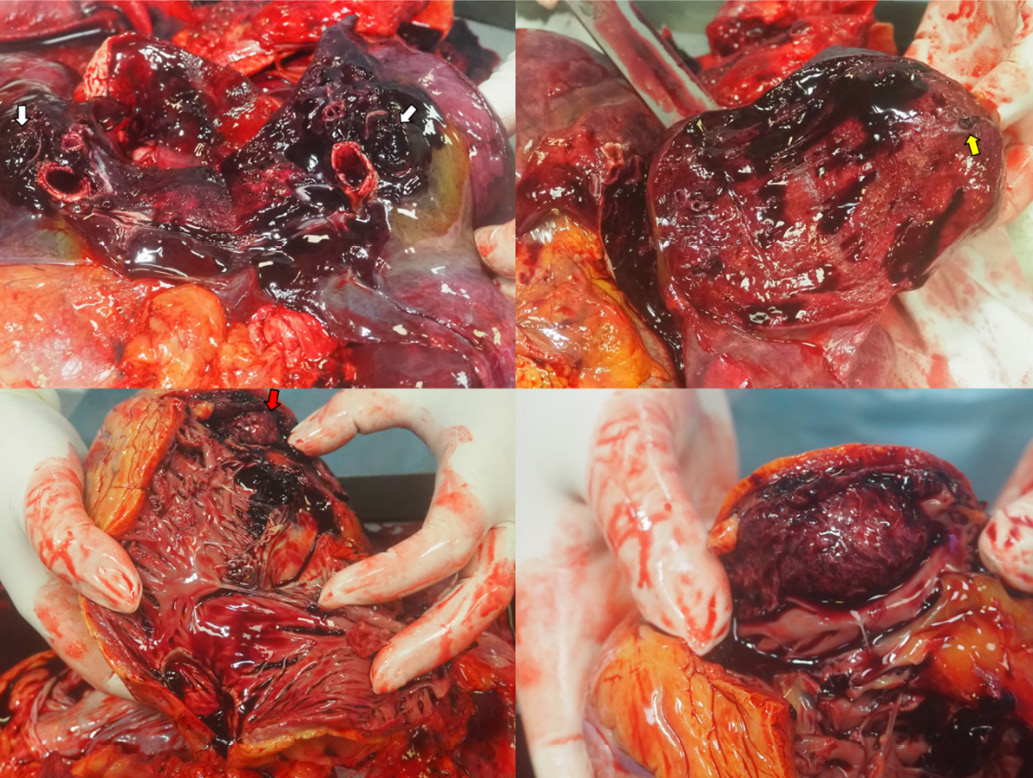
Рис. 6. Аутопсия.
Примечание: А — тромбоэмболы в просвете левой главной ветви ЛА (белые стрелки). Б — тромбоэмбол в сегментарной ветви ЛА (желтая стрелка). В — тромбоз ушка ПП, Г — площадка прикрепления тромба в ушке ПП. Цветное изображение доступно в электронной версии журнала.
Сокращения: ЛА — легочная артерия, ПП — правое предсердие.
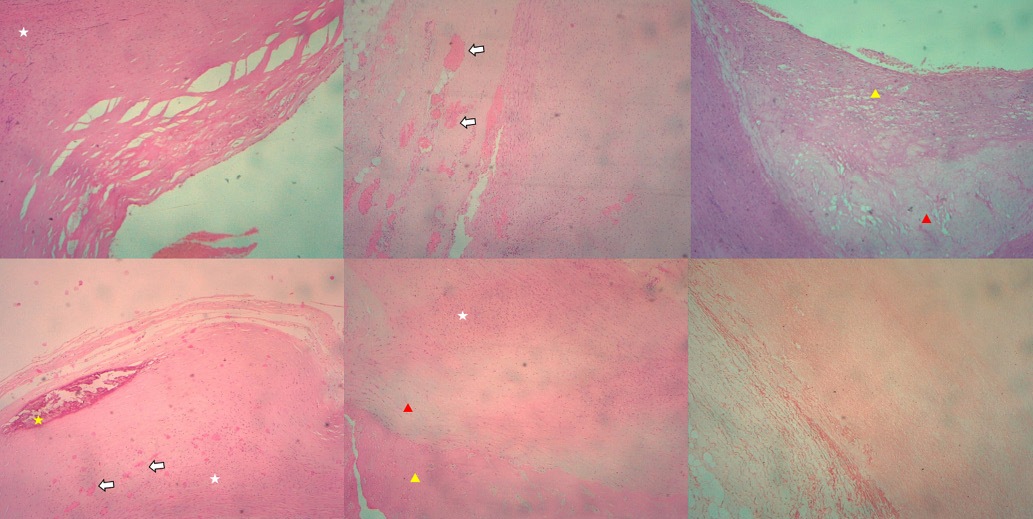
Рис. 7. Микроскопия.
Примечание: А — поперечный срез аневризмы грудной аорты. Б — полнокровные vasa vasorum, кровоизлияния в стенке аневризмы аорты (белые стрелки). В, Г, Д — атеросклеротические бляшки в грудной аорте. Окраска гематоксилином и эозином, ×100. Белыми звездочками обозначены зоны хронической лимфоплазмоцитарной инфильтрацией, желтой звездочкой — кальциноз, красными треугольниками — белково-липидное ядро бляшек, желтыми треугольниками — покрышка бляшек. Е — эластические волокна в стенке аорты, окраска на эластику по Вейгерту, ×100. Цветное изображение доступно в электронной версии журнала.
Таблица 1
Опубликованные случаи сочетания расслоения аорты с ТЭЛА
Тип расслоения аорты | Клинические особенности | Лечение | Исход |
Тип А | Мужчина, 66 лет [12] | Смерть через 48 ч | |
Мужчина, 60 лет. Рецидивирующий ТГВ, ТЭЛА [13] | Антикоагулянты не назначались, установлен кава-фильтр | Выписан через 54 дня | |
Женщина, 57 лет [14] | Реконструктивная операция на аорте отложена из-за ТЭЛА, начат гепарин | Выписана, скончалась через 8 мес. | |
Женщина, 71 год, АГ. ТГВ, ТЭЛА развились на 17-й день после диагностики ОАС [15] | Нефракционированный гепарин, имплантация кава-фильтра, стабилизация. Кава-фильтр удален, начат варфарин | Выписана на 39-й день, через 4 мес. стабильна | |
Мужчина, 75 лет, гемоперикард [16] | Экстренная операция: протезирование восходящей аорты дакроновым протезом, эмболэктомия тромбов легочной артерии, протезирование корня аорты биопротезом. По стабилизации начат варфарин | Выписан на 10-й день | |
Женщина, 56 лет, АГ. Ранее оперирована по поводу расслоения аорты типа А. Диагностировано расслоение нисходящей и абдоминальной аорты, ТГВ, ТЭЛА [17] | Начаты антикоагулянты, установлен кава-фильтр | Выписана | |
Мужчина, 47 лет, синдром Марфана, гипергомоцистеинемия, ТГВ [18] | Установлен кава-фильтр. Гепарин, затем антагонисты витамина К | Отсроченная операция на аорте | |
Тип В | Мужчина, 67 лет [19] | Смерть через 48 ч | |
Мужчина, 61 год, АГ, посттравматический судорожный синдром, алкоголь, кокаин. ТГВ нет [20] | Антикоагулянты не назначались, установлен кава-фильтр | Выписан | |
Мужчина, 67 лет, травма (субдуральная гематома, множественные переломы ребер, гемопневмоторакс, гематома почки). Через 2 нед. диагностированы ОАС и ТЭЛА [21] | Антикоагулянты не назначались, семья отказалась от операции на аорте | Через 8 нед. выписан, через 6 мес. стабилен | |
Женщина, 86 лет, АГ [22] | Установлен кава-фильтр, эндоваскулярное протезирование аорты стент-графтом | Выписана |
Сокращения: АГ — артериальная гипертония, ОАС — острый аортальный синдром, ТГВ — тромбоз глубоких вен, ТЭЛА — тромбоэмболия легочной артерии.
Обсуждение
Наиболее вероятно, что на фоне нелеченой артериальной гипертензии у пациента с ожирением и подагрой с 01.06.2024 начало развиваться расслоение имевшейся аневризмы восходящего отдела аорты, спровоцировавшее дисбаланс в системе коагуляции, тромбоз подколенной вены и ушка ПП, ТЭЛА, что через последовательность гемодинамических нарушений, аритмических событий, дыхательную недостаточность и почечную дисфункцию привело к смерти пациента. Несмотря на низкую вероятность ОАС у относительно молодого пациента без клинически явного атеросклероза и синдрома соединительнотканной дисплазии, на тяжесть его состояния и краткость пребывания в стационаре, удалось прижизненно диагностировать редкое сочетание этих сердечно-сосудистых катастроф.
Ретроспективно можно отметить, что расширение сосудистого пучка на прямой рентгенограмме ОГК в контексте описанной неспецифической клиники должно было быть своевременно интерпретировано. Поскольку при первой КТ клинической гипотезы об ОАС не было сформулировано, контрастирование аорты не проводили. Однако ретроспективно на аксиальных срезах можно заметить расширение восходящей аорты и неоднородность внутри просвета (рис. 3), соответствующую хорошо видному разделению истинного и ложного просветов на рисунке 4. При этом очевидное наличие тромбоэмболов в обеих ветвях ЛА, вероятно, имевших своим источником выявленный тромбоз вен нижних конечностей, исключает возможность мимикрии ОАС под ТЭЛА за счет сдавления легочного ствола интрамуральной гематомой.
К сожалению, эта комбинация патологий, каждая из которых потенциально фатальна, является достаточно сложной в отношении лечебной тактики, поскольку применение антитромботических препаратов для лечения ТЭЛА, выявленной первой, было абсолютно противопоказано после выявления расслоения аорты.
Редкость описанной коморбидности обуславливает невозможность появления обоснованных рекомендаций по ведению таких пациентов. В доступной литературе мы обнаружили описание нескольких случаев сочетания ТЭЛА и расслоения аорты — 7 типа А по Stanford и 4 — типа В (табл. 1). Как видно из этого беглого обзора, случаи достаточно разнообразны с точки зрения клинических обстоятельств, этиологии расслоения аорты и тактики ведения пациентов. Так, при диагностированном тромбозе глубоких вен и невозможности назначения антикоагулянтов, на первый план закономерно выходит установка кава-фильтра. В передовых кардиохирургических центрах возможно выполнение одномоментного вмешательства на аорте и удаление тромбоэмболов из ЛА.
Редкость сочетания значимой патологии аорты и ТЭЛА обуславливает отсутствие необходимости рутинного контрастирования и аорты и ЛА при проведении КТ для исключения кардиальной патологии. Однако даже при отсутствующей клинической гипотезе (в нашем случае из-за неспецифичной клинической картины и отсутствия четких факторов риска ОАС) и проведении визуализирующего исследования без соответствующей подготовки, КТ может выявлять патологию вне зоны, к которой приковано внимание клиницистов [23]. В нашем случае ключевым диагностическим методом, позволившим заподозрить ОАС, стало ЭхоКГ.
Заключение
Представленный случай напоминает о возможности сочетания расслоения аорты и ТЭЛА и подчеркивает значимость клинического подхода при использовании инструментальных методов в неясной диагностической ситуации.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Erbel R, Aboyans V, Boileau C, et al.; ESC Committee for Practice Guidelines. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(41):2873-926. doi:10.1093/eurheartj/ehu281.
2. Konstantinides SV, Meyer G, Becattini C, et al.; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603. doi:10.1093/eurheartj/ehz405.
3. Dell'Uomo M, Conti S, Di Meo F, et al. A Case Report of an Unusual Acute Intramural Hematoma Disguise as Pulmonary Embolism. J Cardiovasc Echogr. 2024;34(1):32-4. doi:10.4103/jcecho.jcecho_77_23.
4. Lee SH, Hong JH, Kim C. Atypical presentation of DeBakey type I aortic dissection mimicking pulmonary embolism in a pregnant patient: a case report. J Yeungnam Med Sci. 2024;41(2):128-33. doi:10.12701/jyms.2023.01319.
5. Berkowitz EJ, Kronzon I, Whyburn J, Perk G. Aortic dissection mimicking a massive pulmonary embolism, European Heart Journal — Cardiovascular Imaging. 2016;17(10):1145. doi:10.1093/ehjci/jew137.
6. Pagel PS, Sidhu J, Gerstman E. Massive pulmonary thromboembolism complicating acute type-a aortic dissection or another explanation for right ventricular dilatation? J Cardiothorac Vasc Anesth. 2013;27(6):1432-4. doi:10.1053/j.jvca.2012.12.016.
7. Taylor RC, Vedutla TS, Myint PK, Meenakshisundaram S. Diagnosis of pleuritic chest pain query PE: beware of dissecting thoracic aneurysm of aorta. Int J Cardiol. 2010;140(3): e56-8. doi:10.1016/j.ijcard.2008.11.083.
8. Chong WH, Saha BK, Wang C, Beegle S.Type A aortic dissection mimicking saddle pulmonary embolism on CT imaging. J Am Coll Emerg Physicians Open. 2020;1(2):132-6. doi:10.1002/emp2.12026.
9. Gupta R, Uhrbrock D, Birnbaum Y. Images in cardiology: coexisting pulmonary embolism and abdominal aortic dissection. Clin Cardiol. 2003;26(8):395. doi:10.1002/clc.4950260809.
10. Гончарова И.А., Панфилов Д.С., Беляева С.А. и др. Структура коморбидности при аневризме восходящей аорты. Российский кардиологический журнал. 2022;27(12):5102. doi:10.15829/1560-4071-2022-5102.
11. Новикова Е.Г., Титова Г.П., Галанкина И.Е. Морфологические изменения стенки аорты при расслаивающей аневризме. Архив патологии. 2013;75(6):3-8.
12. Bodian M, Guindo AS, Aw F, Yékiny CF, et al. Double Emergency Associating Acute Aortic Dissection and Pulmonary Embolism of Fatal Evolution: About a Case. J Clin Exp Cardiolog. 2018;9:617. doi:10.4172/2155-9880.1000617.
13. Morimoto S, Izumi T, Sakurai T, et al. Pulmonary embolism and deep vein thrombosis complicating acute aortic dissection during medical treatment. Intern Med. 2007; 46(8):477-80. doi:10.2169/internalmedicine.46.6215.
14. Leu HB, Yu WC. Images in cardiology: Massive pulmonary embolism in a patient with type A aortic dissection. Clin Cardiol. 2005;28(1):53. doi:10.1002/clc.4960280113.
15. Kagawa Y, Ota S, Hoshino K, et al. Acute Pulmonary Thromboembolism and Deep Vein Thrombosis during the Medical Treatment of Acute Aortic Dissection was Successfully Treated by the Combination of Inferior Vena Cava Filter Installation and Anti-Coagulant Therapy: A Case Report. Ann Vasc Dis. 2015;8(1):36-9. doi:10.3400/avd.cr.14-00083.
16. Ramponi F, Papps T, Edwards J.Successful Repair of Concomitant Acute Type A Aortic Dissection and Saddle Pulmonary Embolism. Aorta (Stamford). 2018;6(1):34-6. doi:10.1055/s-0038-1639345.
17. Elmali M, Gulel O, Bahcivan M. Coexistence of pulmonary embolism, aortic dissection, and persistent left superior vena cava in the same patient. J Cardiovasc Med (Hagerstown). 2008;9(11):1180-1. doi:10.2459/JCM.0b013e32830ce51e.
18. Herrera RN, Miotti JA, Pereyra AS, et al. Síndrome de Marfan con disección aórtica asociada a tromboembolismo venoso e hiperhomocisteinemia [Marfan syndrome associated with aortic dissection, venous thromboembolism and hyperhomocysteinemia]. Medicina (B Aires). 2012;72(6):478-80.
19. Tiemtoré-Kambou BM, Koama A, Kontogom S, et al. Aortic dissection-Pulmonary embolism association: A therapeutic dilemma. Radiol Case Rep. 2022;17(8):2779-83. doi:10.1016/j.radcr.2022.04.045.
20. Chaulagai B, Acharya D, Poudel S, Puri P. Simultaneous Aortic Dissection and Pulmonary Embolism: A Therapeutic Dilemma. Cureus. 2021;13(1):e12952. doi:10.7759/cureus.12952.
21. Chen XG, Shi SY, Ye YY, et al. Successful treatment of aortic dissection with pulmonary embolism: A case report. World J Clin Cases. 2022;10(16):5394-9. doi:10.12998/wjcc. v10.i16.5394.
22. Chai DZ, Zhang HY, Zhang F.Pulmonary Embolism and Stanford Type B Aortic Dissection in the Same Patient. J Vasc Med Surg. 2015;3:226. doi:10.4172/2329-6925.1000226.
23. Lee HY, Song IS, Yoo SM, et al. Rarity of isolated pulmonary embolism and acute aortic syndrome occurring outside of the field of view of dedicated coronary CT angiography. Acta Radiol. 2011;52(4):378-84. doi:10.1258/ar.2011.100361.
Об авторах
Ю. В. ГавриловРоссия
к.м.н., зав. отделением реанимации и интенсивной терапии № 1
Москва
Конфликт интересов:
Нет
О. О. Мануйлова
Россия
к.м.н., зав. отделением лучевой диагностики
Москва
Конфликт интересов:
Нет
А. В. Мелехов
Россия
д.м.н., профессор кафедры госпитальной терапии им. Г. И. Сторожакова лечебного факультета
Москва
Конфликт интересов:
Нет
О. П. Мишутченко
Россия
врач-патологоанатом
Москва
Конфликт интересов:
Нет
И. Г. Никитин
Россия
д.м.н., профессор, зав. кафедрой госпитальной терапии им. Г.И. Сторожакова лечебного факультета
Москва
Конфликт интересов:
Нет
Н. В. Петренко
Россия
зав. патологоанатомическим отделением
Москва
Конфликт интересов:
Нет
А. В. Саликов
Россия
к.м.н., главный врач; доцент кафедры общей хирургии
Москва
Конфликт интересов:
Нет
В. С. Суряхин
Россия
к.м.н., руководитель службы реанимации и интенсивной терапии
Москва
Конфликт интересов:
Нет
А. Г. Тевосян
Россия
врач функциональной диагностики
Москва
Конфликт интересов:
Нет
Дополнительные файлы

|
1. Презентация случая | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(9MB)
|
Метаданные ▾ | |
- Сочетание тромбоэмболии легочной артерии и расслоения аорты встречается крайне редко, их диагностика в условиях неспецифических проявлений требует клинического подхода при использовании инструментальных методов.
- Представлен случай комбинации массивной тромбоэмболии легочной артерии и расслоения аорты, иллюстрированный данными инструментальных исследований и аутопсии у пациента 42 лет с артериальной гипертензией, ожирением и подагрой.
- Лечение подобного сочетания чрезвычайно затруднено даже при своевременной диагностике, т. к. использование антитромботических препаратов для лечения тромбоэмболии легочной артерии абсолютно противопоказано при расслоении аорты, случаи успешного хирургического лечения крайне редки.
Рецензия
Для цитирования:
Гаврилов Ю.В., Мануйлова О.О., Мелехов А.В., Мишутченко О.П., Никитин И.Г., Петренко Н.В., Саликов А.В., Суряхин В.С., Тевосян А.Г. Расслоение аорты и тромбоэмболия легочной артерии: фатальное сочетание. Клинический случай. Российский кардиологический журнал. 2025;30(5S):6082. https://doi.org/10.15829/1560-4071-2025-6082. EDN: VQTEDK
For citation:
Gavrilov Yu.V., Manuilova O.O., Melekhov A.V., Mishutchenko O.P., Nikitin I.G., Petrenko N.V., Salikov A.V., Suryakhin V.S., Tevosyan A.G. Aortic dissection and pulmonary embolism: a fatal combination: а case report. Russian Journal of Cardiology. 2025;30(5S):6082. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6082. EDN: VQTEDK
JATS XML

















































