Перейти к:
Генетические предикторы развития кардиоваскулярной токсичности у пациентов онкогематологического профиля
https://doi.org/10.15829/1560-4071-2024-6081
EDN: HIYVWU
Аннотация
Цель. Выявить однонуклеотидные полиморфизмы, достоверно ассоциированные с кардиоваскулярной токсичностью у пациентов онкогематологического профиля, получающих противоопухолевую иммунохимиотерапию.
Материал и методы. Для проведения исследования на базе Клиники "Самарского государственного медицинского университета" проспективно было отобрано 34 пациента с установленным диагнозом неходжкинская в-клеточная фолликулярная лимфома, которым показано проведение противоопухолевой иммунохимиотерапии по схеме R-CHOP. В ходе наблюдения больные были разделены на 2 группы: основную группу составили 12 пациентов с кардиоваскулярной токсичностью (средний возраст 42,4 (2,8) лет, из них мужчин — n=3 (25%)), контрольную — 22 пациента, без нее (средний возраст 39,8 (1,7), из них мужчин — n=8 (36%)). Сердечно-сосудистая токсичность верифицировалась на основании сочетания специфических кардиологических жалоб со снижением фракции выброса левого желудочка >10% от исходного уровня или в абсолютном выражении менее, чем 53% и/или снижением продольной систолической деформации левого желудочка >12% от исходного уровня и/или повышением N-концевого промозгового натрийуретического пептида >125 пг/мл.
Результаты. В исследовании представлены выявленные генетические особенности у пациентов онкогематологического профиля в контексте возникновения кардиоваскулярной токсичности в ходе лечения злокачественного новообразования. Варианты rs1879257 гена ABCC5, rs13224758 гена PRKAG2, rs10925391 гена RYR2 и rs4149178 гена SLC22A7 имели статистически значимую ассоциацию с повышением риска развития сердечно-сосудистой токсичности у целевой группы больных в 5-6 раз. В дополнении к этому, в ходе исследования зафиксировано, что вариант rs2032582 гена ABCB1 проявлял обратный эффект и был связан со снижением риска развития сердечно-сосудистых осложнений, обладая протективным действием в отношении сердечно-сосудистой системы.
Заключение. Несмотря на то, что необходимы дальнейшие исследования для подтверждения диагностической и прогностической значимости обнаруженных генетических вариантов, результаты настоящего исследования говорят о перспективах генетического скрининга перед проведением противоопухолевой иммунохимиотерапии в качестве будущего инструмента для стратификации пациентов онкогематологического профиля и минимизации кардиоваскулярной токсичности.
Ключевые слова
Для цитирования:
Гиматдинова Г.Р., Данилова О.Е., Давыдкин И.Л., Милюткина Ю.С., Сустретов А.С., Германова О.А. Генетические предикторы развития кардиоваскулярной токсичности у пациентов онкогематологического профиля. Российский кардиологический журнал. 2024;29(10):6081. https://doi.org/10.15829/1560-4071-2024-6081. EDN: HIYVWU
For citation:
Gimatdinova G.R., Danilova O.E., Davydkin I.L., Milyutkina Yu.S., Sustretov A.S., Germanova O.A. Genetic predictors of cardiovascular toxicity in oncohematological patients. Russian Journal of Cardiology. 2024;29(10):6081. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6081. EDN: HIYVWU
Увеличение продолжительности жизни и улучшение качества проведения инструментальных и лабораторных методов диагностики привели к росту выявляемости злокачественных опухолей. Не стали исключением лимфопролиферативные заболевания, которые считаются группой злокачественных опухолей, в основе которых лежит клональная пролиферация лимфоидных клеток разной степени зрелости1. Однозначные причины развития патологического процесса в настоящее время не установлены. Одной из нозологий, входящих в категорию лимфопролиферативных заболеваний, являются лимфомы, которые, в свою очередь, подразделяют на лимфому Ходжкина и неходжкинские лимфомы [1]. Между собой данные нозологические единицы отличаются вариабельностью клинического течения и цитогистологическими особенностями опухоли. Фолликулярная лимфома является самым распространенным заболеванием среди всех вялотекущих (индолентных) неходжкинских лимфом и, согласно статистическим данным, составляет от 3 до 5 случаев на 100 тыс. населения в Европе и США [2]. Несмотря на широкий спектр лекарственных препаратов, применение программной противоопухолевой иммунохимиотерапии остается наиболее частым способом лечения пациентов с фолликулярными лимфомами. Отсутствие неограниченного доступа к современным таргетным соединениям, возможностям проведения трансплантации гемопоэтических стволовых клеток, комплаентности со стороны пациентов в регионах России побуждает докторов в условиях реальной клинической практики в большей степени применять стандартную программную иммунохимиотерапию по схеме R-CHOP, зарегистрированную в качестве первой линии терапии в клинических рекомендациях, разработанных отечественными онкологами и онкогематологами2. Широко известно, что лекарственные средства, используемые для лечения онкогематологических опухолей, обладают высокой токсичностью в отношении сердечно-сосудистой системы. С целью повышения эффективности своевременной верификации кардиоваскулярной токсичности (КТ) учеными предлагается использовать комплексный подход в отношении диагностики пациентов из группы риска [3]. Считается, что одномоментное применение лабораторных и инструментальных методов исследования поможет избежать ранние и отсроченные нежелательные явления среди онкогематологических больных. Учитывая это, поиск современной лабораторно-диагностической панели КТ как никогда актуален. В 2022г появилось первое расширенное руководство Европейской ассоциации кардиологов по ведению пациентов с сердечно-сосудистыми осложнениями, ассоциированными с проведением противоопухолевой терапии [4]. Однако независимо от установленного базового диагностического минимума спектр возможностей выявления КТ ежегодно расширяется.
В настоящее время в качестве наиболее чувствительных предикторов сердечно-сосудистых событий, ассоциированных с применением противоопухолевой терапии, считаются некоторые лабораторные (высокочувствительные тропонины, N-концевой промозговой натрийуретический пептид (NT-proBNP)) и инструментальные показатели (фракция выброса (ФВ) левого желудочка (ЛЖ), глобальная продольная систолическая деформация (ПД) ЛЖ) [5]. Однако нередко клинически и анамнестически сопоставимые между собой пациенты, получающие идентичную противоопухолевую терапию, по-разному проявляют нежелательные явления, в т. ч. со стороны сердечно-сосудистой системы. Во многом, согласно данным мировой медицинской литературы, такую вариабельность клинической выраженности определяет генетическая предрасположенность [6]. Изучение генетических особенностей у пациентов с тяжелой КТ позволит наиболее точно верифицировать больных с высоким риском сердечно-сосудистых осложнений и оптимизировать тактику ведения.
Материал и методы
Дизайн исследования. Для проведения исследования проспективно в период с января 2022г по сентябрь 2023г было отобрано 34 пациента с верифицированным (путем иммуногистохимического исследования биоптата) диагнозом неходжкинская в-клеточная фолликулярная лимфома, которым было показано проведение 6 курсов стандартной противоопухолевой иммунохимиотерапии по схеме R-CHOP: ритуксимаб 375 мг/м² в/в капельно (день 0 или 1), доксорубицин 50 мг/м² в/в капельно (день 1), циклофосфамид 750 мг/м² в/в капельно (день 1), винкристин 1,4 мг/м² суммарно не >2 мг (день 1), преднизолон 100 мг внутрь (дни 1-5); лечение возобновлялось на 22 день. Все отобранные больные проходили установленный исследованием диагностический минимум на базе Клиник ФГБОУ ВО "Самарского государственного медицинского университета" Минздрава России.
Критерии включения в исследование: возраст >18 лет; подтвержденный в ходе иммуногистохимического исследования диагноз неходжкинская В-клеточная фолликулярная лимфома; наличие показаний к терапии злокачественной гематологической опухоли; функциональный статус по шкале ECOG не >2 баллов; неотягощенный анамнез по сердечно-сосудистым заболеваниям; отрицательный результат стресс-эхокардиографического исследования (стресс-ЭхоКГ); подписанное добровольное информированное медицинское согласие.
Критерии невключения: возраст <18 лет; одномоментно существующее другое злокачественное новообразование; предшествующая противоопухолевая терапия в анамнезе; беременность; кормление грудью; низкая комплаентность пациента; тяжелые сопутствующие патологии в стадии декомпенсации; положительный результат стресс-ЭхоКГ.
Критерии исключения: отказ или невозможность пациента участвовать в исследовании; развитие у пациента заболеваний, относящихся к критериям невключения.
Диагностика нежелательных сердечно-сосудистых событий проводилась на трех этапах наблюдения: точка 1 (Т1) — до лечения, точка 2 (Т2) — после 3 курсов и точка 3 (Т3) — после 6 курсов противоопухолевой иммунохимиотерапии путем сбора жалоб со стороны пациента, анализированием сократительной способности миокарда (ФВ ЛЖ и ПД ЛЖ), определением уровня NT-proBNP в сыворотке крови. Генетические особенности были исследованы однократно путем проведения полноэкзомного секвенирования до лечения онкогематологической опухоли. Больные были поделены на 2 группы: основную составили пациенты (n=12) с возникшей КТ (средний возраст 42,4 (2,8) лет, из них мужчин — n=3 (25%)), контрольную (n=22) — без нее (средний возраст 39,8 (1,7) лет, из них мужчин — n=8 (36%)). Сердечно-сосудистая токсичность верифицировалась на основании сочетания специфических кардиологических жалоб с утвержденными критериями дисфункции миокарда: снижением ФВ ЛЖ >10% от исходного уровня или в абсолютном выражении менее, чем 53% и/или снижением ПД ЛЖ >12% от исходного уровня и/или повышением NT-proBNP >125 пг/мл [7]. Дизайн исследования наглядно представлен на рисунке 1. Настоящая работа не предполагала проведения прямого корреляционного анализа детальной клинической характеристики пациентов и кумулятивной дозы отдельных лекарственных соединений с уровнем исследуемых биомаркеров. Учитывая внушительный объем полученных данных в процессе анализа больных, данный материал представляет собой ограниченную часть, отражающую в большей степени особенности генетического "статуса" включенных пациентов. Уникальностью настоящего исследования является отсутствие кардиопротективной стратегии в связи с включением больных из группы низкого риска, без отягощенного сердечно-сосудистого анамнеза, что позволило объективизировать оценку полученных результатов.
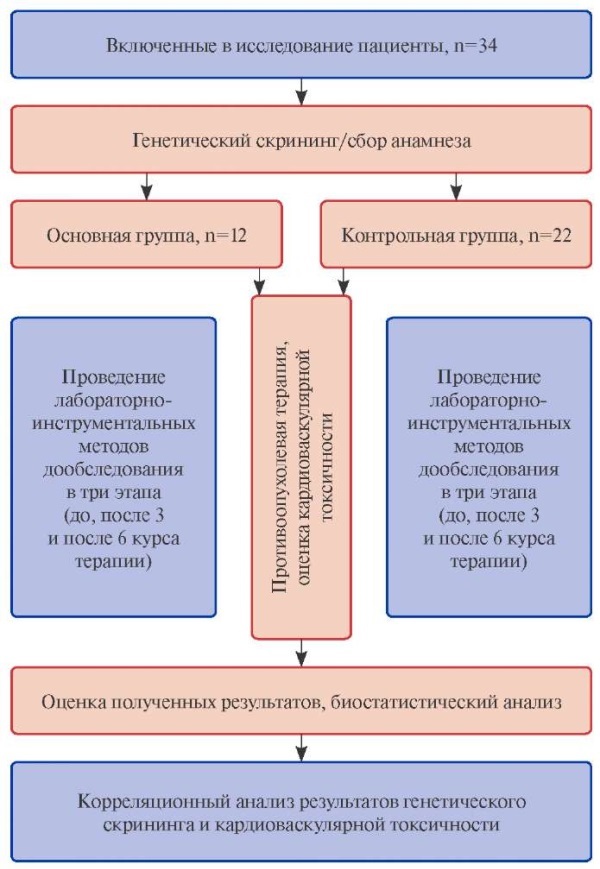
Рис. 1. Дизайн исследования.
Этические аспекты. Данные, представленные в настоящем исследовании, являются частью материала, полученного в ходе проведения клинической апробации, одобренной к реализации Министерством здравоохранения Российской Федерации от 2022г "Метод раннего выявления КТ у больных с индолентными неходжкинскими лимфомами". Все больные, включенные в исследование, были осведомлены о возможных рисках от участия (которые были одинаковы с невключенными пациентами), а также подписали добровольное информированное согласие на участие в соответствии со стандартами надлежащей клинической практики.
Методы исследования. Вся полученная о пациентах из обеих групп наблюдения информация была отражена в индивидуальной регистрационной карте. На этапе скрининга пациентам целевой группы проводился сбор анамнестических данных в отношении сердечно-сосудистой системы. Далее больным без отягощенного анамнеза выполнялась стресс-ЭхоКГ с фармакологической нагрузкой добутамином для выявления транзиторных нарушений локальной сократимости миокарда. Пациентам с отрицательной стресс-ЭхоКГ однократно проводился сбор периферической венозной крови для проведения исследования генетических особенностей больного, фиксировались антропометрические показатели (рост, вес, индекс массы тела), а также проводился физикальный осмотр (уровень систолического и диастолического артериального давления (АД), частота сердечных сокращений, наличие отеков, оценка признаков тромботических событий конечностей). Дальнейший анализ больных проходил в несколько этапов на каждой из трех заявленных контрольных точках. Выполнялся забор периферической венозной крови для оценки уровня NT-proBNP как маркера КТ с применением электрохемилюминесцентного иммуноанализа. В дополнение к этому, исследовалась сократительная способность миокарда путем оценки ФВ ЛЖ, а также ПД ЛЖ по спекл-трекинг технологии в состоянии покоя, в положении лежа на боку через левый парастернальный и апикальный доступы. Метод визуализации миокарда на всех контрольных точках проводился одним аккредитованным специалистом на ультразвуковом аппарате Mindray Resona I9 (Китай) в соответствии с российскими клиническими рекомендациями.
Выделение ДНК образцов периферической крови проводили с помощью набора для выделения ДНК из цельной крови "GM Blood Q" (Raissol, Россия) в соответствии с инструкциями производителя. Концентрацию ДНК определяли на флуориметре Qubit (ThermoFS, США), а чистоту — на микропланшетном ридере TecanInfinite® M200 PRO (Tecan, Швейцария).
Генотипирование было проведено с использованием секвенатора нового поколения NovaSeq 6000 (Illumina, США) на основе парных прочтений 2x100bp с минимальным покрытием 100х. Подготовка геномных библиотек проводилась с этапом ультразвуковой фрагментации на приборе Covaris S2 (США) с последующим преобразованием в ДНК-библиотеки с использованием набора "KAPA Hyper Prep Kit" (Roche, Швейцария). Концентрации ДНК-библиотек измеряли на флуориметре Quantus с комплектом реагентов "QuantiFluor® dsDNA System kit" (Promega, США). Для точного определения размера ДНК-библиотек и контроля качества был проведен высокочувствительный анализ ДНК с помощью гель-электрофореза с использованием системы биоанализатора 2100 (Agilent Technologies).
Отбор и анализ генов-кандидатов. В настоящем исследовании были отобраны и генотипированы однонуклеотидные варианты (ОНВ) (single nucleotide variant) в 347 генах. Критериями отбора генов-кандидатов являлась установленная ассоциация ОНВ данных генов с КТ противоопухолевой терапии, в ≥2 опубликованных ранее исследованиях, либо включение данных генов в крупномасштабные исследования с использованием метода полногеномного поиска ассоциаций (genome-wide association studies, GWAS). Также в генетический анализ были включены гены с ранее не подтвержденным участием в модификации рисков КТ, входящие в диагностические кардиопанели, при условии наличия ассоциаций ОНВ с различными вариантами сердечно-сосудистых событий. Полный перечень генов, вошедших в анализ, отображен в таблице 1.
Таблица 1
Перечень генов-кандидатов, включенных в анализ на наличие ассоциаций генетических вариантов с риском развития КТ
|
ABCB1 |
ABCB4 |
ABCC1 |
ABCC2 |
ABCC3 |
ABCC5 |
ABCC6 |
ABCC9 |
|
ABCG2 |
ABL1 |
ACADVL |
ACTA1 |
ACTA2 |
ACTC1 |
ACTN2 |
ACVR2B |
|
ACVRL1 |
ADAMTS2 |
AGK |
AGL |
AGPAT2 |
AKAP9 |
AKR1A1 |
AKR1C3 |
|
ALK1 |
ALMS1 |
ALPK3 |
ANK2 |
ANKRD1 |
ANO5 |
AQP1 |
ATP13A3 |
|
BAG3 |
BAG5 |
BMPR1B |
BMPR2 |
BRAF |
CACNA1C |
CACNA1D |
CACNA2D1 |
|
CACNB2 |
CALM1 |
CALM2 |
CALM3 |
CALR3 |
CASQ2 |
CAT |
CAV1 |
|
CAV3 |
CBL |
CBR1 |
CBR3 |
CBS |
CDH2 |
CDK13 |
CELF4 |
|
CFAP45 |
CFAP52 |
CFAP53 |
CFC1 |
CHAT |
CHD7 |
CHRNA1 |
CHRNB1 |
|
CHRND |
CHRNE |
CHST14 |
CITED2 |
CMYA5 |
COL1A1 |
COL1A2 |
COL3A1 |
|
COL5A1 |
COL5A2 |
COLQ |
COX15 |
CPT1A |
CPT2 |
CRELD1 |
CRYAB |
|
CSRP3 |
CTNNA3 |
CYBA |
CYP3A5 |
DCHS1 |
DES |
DMD |
DMPK |
|
DNAAF1 |
DNAAF3 |
DNAJC19 |
DOLK |
DPP6 |
DPYD |
DSC2 |
DSG2 |
|
DSP |
DTNA |
DYSF |
EDN |
EDN1 |
EIF2AK4 |
ELAC2 |
ELN |
|
EMD |
ENG |
EPHB4 |
ERCC2 |
EYA4 |
FBN1 |
FBN2 |
FHL1 |
|
FHL2 |
FHOD3 |
FKBP14 |
FKRP |
FKTN |
FLNA |
FLNC |
FLT4 |
|
FOXF1 |
FOXRED1 |
FXN |
GAA |
GATA4 |
GATA5 |
GATA6 |
GATAD1 |
|
GBE1 |
GDF1 |
GDF2 |
GJA1 |
GJA5 |
GLA |
GLRA1 |
GNAI2 |
|
GNB5 |
GPD1L |
GST |
GSTP1 |
GYG1 |
HAND1 |
HAS3 |
HCN4 |
|
HER2 |
HFE |
HRAS |
ILK |
ISPD |
JAG1 |
JPH2 |
JUP |
|
KCNA5 |
KCND3 |
KCNE1 |
KCNE1L |
KCNE2 |
KCNE3 |
KCNE5 |
KCNH2 |
|
KCNJ2 |
KCNJ5 |
KCNJ8 |
KCNK3 |
KCNQ1 |
KCNQ3 |
KLF2 |
KRAS |
|
LAMA4 |
LAMP2 |
LDB3 |
LEFTY2 |
LIPT1 |
LMNA |
LMOD3 |
LOX |
|
LRRC10 |
LZTR1 |
MAP2K1 |
MAP2K2 |
MAPK1 |
MARS |
MECP2 |
MED13L |
|
MFAP5 |
MIB1 |
MMP21 |
MNS1 |
MRAS |
MTO1 |
MYBPC3 |
MYBPHL |
|
MYH11 |
MYH6 |
MYH7 |
MYL2 |
MYL3 |
MYL4 |
MYLK |
MYLK2 |
|
MYOF |
MYOM1 |
MYOT |
MYOZ2 |
MYPN |
MYRF |
NCF4 |
NEBL |
|
NEXN |
NF1 |
NFU1 |
NKX2-5 |
NKX2-6 |
NODAL |
NOS1AP |
NOS3 |
|
NOTCH1 |
NOTCH2 |
NOTCH3 |
NOX1 |
NPPA |
NQO1 |
NR2F2 |
NRAS |
|
NUP155 |
PDLIM3 |
PHOX2B |
PKD1L1 |
PKP2 |
PLD1 |
PLEC |
PLEKHM2 |
|
PLN |
PLOD1 |
POR |
PPA2 |
PPCS |
PPP1CB |
PRDM16 |
PRDM6 |
|
PRKAG2 |
PRKD1 |
PRKG1 |
PSEN1 |
PSEN2 |
PTPN11 |
RAC2 |
RAF1 |
|
RANGRF |
RAPSN |
RARG |
RASA1 |
RBM20 |
RET |
RIT1 |
RPL3L |
|
RRAS |
RRAS2 |
RYR2 |
SALL4 |
SCL22A17 |
SCN10A |
SCN1B |
SCN2B |
|
SCN3B |
SCN4A |
SCN4B |
SCN5A |
SCNN1G |
SCO2 |
SDHA |
SGCA |
|
SGCB |
SGCD |
SGCG |
SHOC2 |
SKI |
SLC22A12 |
SLC22A17 |
SLC22A5 |
|
SLC22A6 |
SLC22A7 |
SLC25A20 |
SLC25A4 |
SLC28A3 |
SLC2A10 |
SLC39A13 |
SLC6A5 |
|
SLCO1B1 |
SLMAP |
SMAD1 |
SMAD2 |
SMAD3 |
SMAD4 |
SMAD6 |
SMAD9 |
|
SNTA1 |
SOS1 |
SOS2 |
SOX17 |
SPEG |
SPRED1 |
SPRED2 |
SULT2B1 |
|
SYNE1 |
SYNM |
SYNPO2L |
TAB2 |
TAFAZZIN |
TAZ |
TBX1 |
TBX20 |
|
TBX4 |
TBX5 |
TCAP |
TECRL |
TET2 |
TFAP2B |
TGFB2 |
TGFB3 |
|
TGFBR1 |
TGFBR2 |
TLL1 |
TMEM43 |
TMEM70 |
TMPO |
TNNC1 |
TNNI3 |
|
TNNI3K |
TNNT2 |
TNXB |
TOPBP1 |
TPM1 |
TRDN |
TRIM63 |
TRPM4 |
|
TSC1 |
TSC2 |
TTN |
TTR |
TYMS |
UGT1A6 |
VCL |
XRCC1 |
|
ZEB2 |
ZFPM2 |
ZIC3 |
Биоинформатическая обработка данных секвенирования. В процессе биоинформатического анализа данных секвенирования геномы образцов крови прошли процесс выравнивания на последовательность референсного генома GRCh38.p13 с помощью The Genome Analysis ToolKit (GATK)3 и The BWA MEM [8]. Далее с помощью GATK HaplotypeCaller версии 4.1.4 был выполнен поиск ОНВ. ОНВ с покрытием меньше 70х были исключены из финального анализа. Клиническая значимость выявленных вариантов оценивалась с использованием баз данных dbSNP, ClinVar, OMIM, HGMD, DMDM, LOVD и опубликованных литературных данных.
Статистический анализ. Статистическая обработка полученных результатов проводилась с использованием пакета прикладных программ IBM Statistics SPSS 26 версия (USA). Оценка данных произведена методами параметрической и непараметрической статистики. Количественные переменные представлялись в виде среднего арифметического и стандартного отклонения при подчинении закону нормального распределения, медианы (Мe), 25-го процентиля и 75-го процентиля при отклонении признака от нормального распределения, качественные показатели — в виде абсолютного числа больных и доли (%). Среди методов непараметрической статистики для двух несвязанных совокупностей использовался t критерий Стьюдента при нормальном распределении признака, критерий U Манна-Уитни для признаков с отличным от нормального распределением, для связанных переменных 2 групп — критерий Вилкоксона. Оценку достоверности различий качественных переменных проводили с помощью таблиц сопряженности, в случае если количество наблюдений в любой из ячеек данной таблицы было ≥10, использовался хи-квадрат Пирсона, если количество наблюдений от 5 до 9, использовалась поправка Йейтса на непрерывность, при количестве наблюдений <5 в любой из ячеек — точечный тест Фишера. В дополнение этому были рассчитаны отношения шансов (ОШ) и 95% доверительные интервалы (ДИ) для выявления ассоциаций между ОНВ и КТ. Различия считали статистически значимыми при р<0,05.
Результаты
Характеристика исследуемых пациентов
Настоящее исследование посвящено поиску однонуклеотидных полиморфизмов, достоверно ассоциированных с КТ у пациентов онкогематологического профиля, получающих противоопухолевую иммунохимиотерапию. Из всех скринированных пациентов, которые прошли этап верификации злокачественной гематологической опухоли путем иммуногистохимического исследования биоптата, отобрано 34 пациента, которым показано лечение по схеме R-CHOP. Все включенные больные на этапе скрининга не имели отягощенного сердечно-сосудистого анамнеза и получили отрицательный результат стресс-ЭхоКГ. Основные характеристики пациентов по группам на момент включения отражены в таблице 2.
Таблица 2
Характеристика включенных в исследование пациентов
|
Параметр/показатель |
Основная группа, n=12 |
Контрольная группа, n=22 |
χ² |
p-значение |
|
Возраст, лет, M (SD) |
42,4 (2,8) |
39,8 (1,7) |
— |
0,72 |
|
Мужчины, n (%) |
3 (25) |
8 (36) |
0,08 |
0,77 |
|
ИМТ, кг/м², M (SD) |
19,7 (1,1) |
20,4 (1,4) |
— |
0,86 |
|
Факт табакокурения, n (%) |
4 (33) |
4 (18) |
0,32 |
0,56 |
|
САД, мм рт.ст., M (SD) |
114 (4) |
112 (6,5) |
— |
0,93 |
|
ДАД, мм рт.ст., M (SD) |
74 (2,5) |
71 (7) |
— |
0,91 |
|
ЧСС, уд./мин, M (SD) |
74 (11) |
67 (9) |
— |
0,84 |
Примечание: количественные признаки представлены в виде среднего значения и стандартного отклонения M (SD), χ² — критерий согласия Пирсона, p — уровень значимости при сравнении признаков.
Сокращения: ДАД — диастолическое артериальное давление, ИМТ — индекс массы тела, САД — систолическое артериальное давление, ЧСС — частота сердечных сокращений.
Группы исследования были сопоставимы по возрасту, полу, индексу массы тела, анамнезу табакокурения, некоторым данным физикального осмотра, схеме противоопухолевой иммунохимиотерапии. Это позволило наиболее точно оценивать взаимосвязь анализируемых параметров в группах. Предикторы КТ (уровень NT-proBNP, ФВ ЛЖ и ПД ЛЖ), полученные трехкратно, представлены в таблице 3.
Таблица 3
Маркеры КТ у целевой группы пациентов
|
Визит Параметр |
V1 |
V2 |
PV1-2 (о/к) |
V3 |
PV1-3 (o/к) |
|||
|
О |
К |
О |
К |
О |
К |
|||
|
ФВ ЛЖ, %, M (SD) |
53,1 (1,09) |
52,7 (2,14) |
51,2 (1,92) |
51,4 (1,71) |
0,12/0,42 |
50,41 (0,78) |
52,2 (0,43) |
0,06/0,72 |
|
ПД ЛЖ, %, M (SD) |
22,11 (1,07) |
21,19 (1,14) |
16,7 (0,94) |
19,2 (1,14) |
0,03/0,08 |
15,1 (1,57) |
19,3 (1,57) |
<0,001/0,24 |
|
NT-proBNP, пг/мл, M (SD) |
98,7 (2,1) |
101,14 (1,19) |
247,15 (6,1) |
102,1 (3,3) |
<0,001/0,54 |
544,11 (9,7) |
97,18 (7,2) |
<0,001/0,69 |
Примечание: V1 — первый визит, V2 — второй визит, V3 — третий визит, О — основная группа, К — контрольная группа, PV1-2 (о/к) — уровень значимости при сравнении признаков между первым и вторым визитом основной и контрольной группы, PV1-3 (о/к) — уровень значимости при сравнении признаков между первым и третьим визитом контрольной группы.
Сокращения: ПД ЛЖ — продольная систолическая деформация левого желудочка, ФВ ЛЖ — фракция выброса левого желудочка, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Генотипирование
Из 347 отобранных генов-кандидатов статистически значимые (p<0,05) ассоциации были выявлены для 8 ОНВ в генах ABCB1, ABCC5, PRKAG2, RYR2, SLC22A7 и SCN5A. Статистически незначимые данные не представлены в настоящей работе. Для данных ОНВ была определена частота аллелей в основной и контрольной группах, данные приведены в таблице 4. Распределение соответствовало закону Харди-Вайнберга.
Таблица 4
Частота аллелей генетических вариантов, ассоциированных с КТ
|
Ген |
Вариант |
Аллель |
Основная группа, n=12 |
Контрольная группа, n=22 |
||||
|
Частота |
χ² |
p-значение |
Частота |
χ² |
p-значение |
|||
|
ABCB1 |
rs2032582 (2677T>G) |
T |
0,227 |
0,952 |
0,329 |
0,587 |
0,004 |
0,948 |
|
G |
0,773 |
0,413 |
||||||
|
rs2235013 (1725+38G>A) |
G |
0,364 |
3,592 |
0,058 |
0,609 |
0,209 |
0,648 |
|
|
A |
0,636 |
0,391 |
||||||
|
rs2235033 (1554+24T>C) |
T |
0,364 |
3,592 |
0,058 |
0,609 |
0,209 |
0,648 |
|
|
C |
0,636 |
0,391 |
||||||
|
ABCC5 |
rs1879257 (57902C>T) |
C |
0,682 |
0,571 |
0,450 |
0,848 |
2,396 |
0,122 |
|
T |
0,318 |
0,152 |
||||||
|
PRKAG2 |
rs13224758 (74859C>T) |
C |
0,773 |
0,952 |
0,329 |
0,935 |
0,112 |
0,738 |
|
T |
0,227 |
0,065 |
||||||
|
RYR2 |
rs10925391 (-19+7043A>C) |
A |
0,591 |
1,100 |
0,294 |
0,826 |
0,195 |
0,659 |
|
C |
0,409 |
0,174 |
||||||
|
SCN5A |
rs6797133 (612-708T>C) |
T |
0,273 |
3,227 |
0,072 |
0,435 |
1,308 |
0,253 |
|
C |
0,727 |
0,565 |
||||||
|
SLC22A7 |
rs4149178 (1586+206A>G) |
A |
0,682 |
2,396 |
0,122 |
0,891 |
0,342 |
0,559 |
|
G |
0,318 |
0,109 |
||||||
Примечание: χ² — критерий согласия Пирсона, p — уровень значимости при сравнении признаков.
Сравнительный анализ по аллелям показал, что носительство аллеля 2 для всех 8 ОНВ повышает вероятности развития КТ. Статистически значимые ассоциации выявлены для 3 ОНВ: носительство аллеля G варианта rs2032582 гена ABCB1 (ОШ 4,83; 95% ДИ: 1,52-15,37; р=0,004) аллеля C варианта rs10925391 гена RYR2 (ОШ 3,29; 95% ДИ: 1,05-10,30; р=0,029) и аллеля G варианта rs4149178 гена SLC22A7 (ОШ 3,83; 95% ДИ: 1,05-13,92; р=0,032) повышает риск КТ в 3,29-4,83 раза (табл. 5).
Таблица 5
Ассоциация генетических вариантов с КТ
|
Ген |
Вариант |
Позиция |
Аллель (1>2) |
Risk allele 2 |
Risk allele 1 |
Risk allele 2 |
|||
|
[ 1]<->[ 2] |
[ 22]<->[ 12+11] |
[ 11]<->[ 12+22] |
|||||||
|
ОШ (95% ДИ) |
Fisher-test |
ОШ (95% ДИ) |
Fisher-test |
ОШ (95% ДИ) |
Fisher-test |
||||
|
ABCB1 |
rs2032582 |
2677 |
T>G |
4,83 (1,52-15,37) |
0,004 |
0,18 (0,04-0,87) |
0,031 |
— |
0,027 |
|
rs2235013 |
1725+38 |
G>A |
2,72 (0,95-7,79) |
0,036 |
0,4 |
0,217 |
— |
0,027 |
|
|
rs2235033 |
1554+24 |
T>C |
2,72 (0,95-7,79) |
0,036 |
0,4 |
0,217 |
— |
0,027 |
|
|
ABCC5 |
rs1879257 |
57902 |
C>T |
2,6 (0,78-8,68) |
0,074 |
— |
0,676 |
4,96 (1,06-23,16) |
0,036 |
|
PRKAG2 |
rs13224758 |
74859 |
C>T |
4,22 (0,91-19,62) |
0,054 |
— |
1 |
5,56 (1,02-30,33) |
0,045 |
|
RYR2 |
rs10925391 |
-19+7043 |
A>C |
3,29 (1,05-10,30) |
0,029 |
0,45 |
0,451 |
6,1 (1,24-30,09) |
0,022 |
|
SCN5A |
rs6797133 |
612-708 |
T>C |
2,05 (0,68-6,19) |
0,096 |
0,2 (0,04-0,94) |
0,036 |
0,68 (0,1-4,77) |
0,35 |
|
SLC22A7 |
rs4149178 |
1586+206 |
A>G |
3,83 (1,05-13,92) |
0,032 |
— |
1 |
6,3 (1,3-30,53) |
0,02 |
Примечание: p — уровень значимости при сравнении признаков.
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов.
Согласно проведенному анализу по генотипам (аллель риска 1 — [ 22]<->[ 12+11] и аллель риска 2 — [ 11]<->[ 12+22]), обнаружено 4 ОНВ, увеличивающие вероятность развития КТ, индуцированной противоопухолевой иммунохимиотерапией. Аллель Т (TT+CT) варианта rs1879257 гена ABCC5 ассоциирована с увеличения развития КТ в 4,96 раза (ОШ 4,96; 95% ДИ: 1,06-23,16; p=0,036). Носительство аллеля G (GG+AG) варианта rs4149178 гена SLC22A7 повышает риск развития КТ в 6,3 раза (ОШ 6,3; 95% ДИ: 1,3-30,53; p=0,02). Аллель T (TT+CT) варианта rs13224758 гена PRKAG2 повышает риск развития КТ в 5,56 раза (ОШ 5,56; 95% ДИ: 1,02-30,33; р=0,045). Аллель C (CC+AC) варианта rs10925391 гена RYR2 ассоциирована с повышением риска развития КТ в 6,1 раза (ОШ 6,01; 95% ДИ: 1,24-30,09; р=0,022).
Помимо этого, было идентифицировано 2 ОНВ, ассоциированных со снижением риска развития КТ. Носительство аллеля T (TT+TG) варианта rs2032582 гена ABCB1 снижает вероятность развития кардиотоксичности в 5,8 раза (ОШ 0,18; 95% ДИ: 0,04-0,87; p=0,031). Наличие аллеля T (TT+TC) варианта rs6797133 гена SCN5A снижает риск развития КТ в 5 раз (ОШ 0,2; 95% ДИ: 0,04-0,94, p=0,036).
Для гена ABCB1 (MDR1) была обнаружена статистически значимая ассоциация 3 ОНВ (rs2032582, rs2235013, rs2235033) с развитием КТ (p=0,027), однако из-за небольшого числа пациентов, вошедших в настоящее исследование, ОШ для данных ОНВ не рассчитано.
Нами также была обнаружена комбинация носительства аллелей GAC вариантов rs2032582, rs3729856 и rs6797133 ассоциированная с повышенной вероятностью развития КТ (ОШ 10,29; 95% ДИ: 1,75-60,45, p=0,009). Носительство комбинации GAC наблюдалось у 82% пациентов в основной группе и у 30% в контрольной.
Обсуждение
В настоящее время активно обсуждаются вопросы ранней верификации КТ, опираясь на более информативные предикторы, включая генетические особенности пациента онкологического профиля. Благодаря исследованиям, направленным на поиск ОНВ, ассоциированных с риском развития сердечно-сосудистых событий в процессе проведения противоопухолевого лечения, на сегодняшний день идентифицированы >60 ОНВ в 40 генах, ассоциированных с повышением или снижением рисков развития КТ с разным уровнем статистической значимости [9]. В рекомендациях Европейской ассоциации кардиологов (ESC) по кардиоонкологии 2022г генетическое тестирование рассмотрено как один из возможных методов оценки индивидуального риска развития КТ у пациентов, получающих противоопухолевую терапию. В документе также представлен список ОНВ с наиболее убедительным уровнем значимости, включающий варианты rs1786814 (ген CELF4), rs2229774 (ген RARG), rs7853758 (ген SLC28A3), rs17863783 (ген UGT1A6), rs28714259, группа TTN (titin-truncating variants) [4]. Однако на сегодняшний день генотипирование не имеет подтверждения клинической значимости и не рекомендовано для рутинной диагностики рисков КТ.
В настоящей работе исследованы 34 пациента с диагнозом В-клеточная фолликулярная лимфома, которым была проведена противоопухолевая иммунохимиотерапия по схеме R-CHOP. В ходе анализа полученных данных установлено, что наиболее вариабельными и статистически значимыми (p<0,05) среди основной группы больных оказались изменения ПД ЛЖ и концентрации NT-proBNP, что соответствует данным мировой медицинской литературы [10-12]. Важно дополнить, что предикторы были диагностически весомыми после 3 курсов противоопухолевого лечения и не теряли актуальности до окончания всего исследования. Одномоментно с этим, определение ПД ЛЖ не всегда может быть основательно точным. Поскольку показатель напрямую зависит от нагрузки на сердечно-сосудистую систему, различия в результатах могут быть вызваны изменением уровня АД; более низкие значения могут быть связаны с более высокими значениями АД во время измерения [13].
ФВ ЛЖ среди онкогематологических больных не демонстрировала критически важных общепопуляционных изменений. Такой результат, вероятнее всего, связан с "запаздыванием" процессов ремоделирования клеточных структур миокарда. Именно поэтому в настоящее время учеными всего мира обсуждается вопрос ценности анализа ФВ ЛЖ в рамках диагностики КТ [14]. К тому же, снижение ФВ ЛЖ представляет собой относительно позднюю стадию нарушения систолической функции ЛЖ, что обеспечивает несвоевременную верификацию субклинической КТ [15]. С результатами углубленного анализа сократительной способности миокарда, фенотипов КТ, оптимальной комбинации исследования предикторов сердечно-сосудистой токсичности среди пациентов онкогематологического профиля можно ознакомиться в ряде других публикаций авторов [16-19].
В настоящем исследовании основная часть выявленных ОНВ, достоверно ассоциированных с развитием КТ, обнаружены в генах, кодирующих трансмембранные белки, которые участвуют в транспорте лекарственных средств. Несмотря на убедительные данные о том, что экспрессия генов, обеспечивающих адекватный метаболизм лекарственных соединений, поступивших в организм, является прогностическим фактором прогрессирования опухоли и лекарственной устойчивости, не исключается их роль в длительном повреждающем действии на кардиомиоциты. Так, например, в ряде литературных работ, посвященных изучению генетических особенностей у больных со злокачественными новообразованиями, подтверждается роль АТФ-связывающих кассетных транспортеров (ABC-транспортеры) в развитии нежелательных явлений со стороны сердца [20]. Известно, что ABC-транспортеры экспортируют многочисленные химиотерапевтические препараты, включая антрациклиновые соединения, из кардиомиоцитов, поэтому нарушение их функции может приводить к повышению риска развития сердечно-сосудистой недостаточности на фоне или после химиотерапии [21]. На сегодняшний день обнаружены ОНВ генов ABCC1, ABCC2, ABCC5 и ABCB1, которые в основном ассоциировались с повышением риска КТ [22-25]. В настоящем исследовании идентифицировано 3 ОНВ гена ABCB1, ассоциированных с риском возникновения КТ, при этом носительство аллеля Т варианта rs2032582 идентифицировано как фактор, снижающий вероятность развития нежелательных сердечно-сосудистых событий в процессе лечения. Также обнаружен вариант rs1879257 гена ABCC5, ассоциированный с 5-кратным увеличением риска развития КТ.
Транспортеры семейства переносчиков растворенных веществ (SLC) также описаны как возможные участники в патогенезе формирования нежелательных сердечно-сосудистых событий в ходе терапии онкологического больного [26]. В ряде исследований выявлено несколько вариантов генов SLC, которые, в основном, снижали риск развития КТ. Так, например, в работе Visscher H, et al. у пациентов обнаружен протективный эффект носительства минорного аллеля G варианта rs4149178 гена SLC22A7 против антрациклин-индуцированной сердечно-сосудистой токсичности [27]. Нами был выявлен вариант rs4149178 гена SLC22A7, ассоциированный с повышением риска возникновения КТ.
Среди изученных пациентов были обнаружены ассоциации для вариантов генов с неописанной ранее ролью в развитии КТ. Ген SCN5A кодирует сердечный натриевый канал, генерирующий быстрый натриевый ток [28]. Мутации в гене SCN5A как правило приводят к синдрому удлиненного интервала QT, вызывая фатальные клинические исходы у пациентов [29]. К тому же, в мировом научном сообществе установлена связь полиморфизмов гена с различными вариантами кардиомиопатий [30]. В настоящей работе при изучении пациентов с фолликулярными лимфомами обнаружен вариант rs6797133 гена SCN5A, для которого носительство аллеля T определено как протективный фактор.
Ген RYR2 кодирует одноименный белок, который образует каналы, транспортирующие положительно заряженные ионы кальция в клетке, обеспечивающие адекватное мышечное сокращение кардиомиоцитов [31]. Мутации в гене способны приводить к избыточному выходу кальция из внутриклеточных структур, вызывая нарушение сердечного ритма и силы сокращения миокарда [32]. В работе Desai VG, et al. у онкологических больных, которым была проведена противоопухолевая терапия с доксорубицином, наблюдалось дозонезависимое снижение экспрессии генов и белков, участвующих в гомеостазе кальция саркоплазматического ретикулума, включая RYR2 [33]. Подобное исследование было проведено уже в 2014г, в котором описано влияние лекарственного соединения на активность RYR2 путем связывания с белками и через окисление тиолов, нарушая усвоение ионов кальция, что влияет на сократительную функцию кардиомиоцитов и способствует развитию аритмического или застойного варианта КТ [34]. Эти данные наряду с результатами настоящего исследования позволяют предположить о возможной роли RYR2 в модуляции КТ. В основной группе пациентов с носительством аллеля С варианта rs10925391 наблюдалось повышение риска развития КТ.
Ген PRKAG2 кодирует субъединицу 5'АМФ-активируемой протеинкиназы, которая, в свою очередь, осуществляет контроль над энергетическим гомеостазом клетки. Считается, что мутации гена PRKAG2 вызывают дисфункцию AMФ-активируемой протеинкиназы, которая изменяет поглощение глюкозы, вызывает отложение гликогена и амилопектина и как следствие формирует гипертрофическую кардиомиопатию, приводя к предсердно-желудочковой аритмии [35]. Некоторые недавние исследования демонстрировали, что аналогичные мутации способны нарушать процессы фосфорилирования сердечного тропонина и сократимости миокарда, тем самым способствуя развитию сердечной недостаточности [36]. В настоящем исследовании носительство аллеля Т варината rs13224758 гена PRKAG2 повышало риск развития КТ в 5,5 раза.
Ограничения исследования. Ограничениями настоящего исследования можно считать небольшую выборку пациентов, отсутствие прямого корреляционного анализа кумулятивной дозы отдельных лекарственных соединений с уровнем лабораторных и инструментальных предикторов, а также отсутствие кардиопротективной стратегии среди включенных пациентов.
Заключение
Развитие кардиоонкологической службы существенно повлияло на изменение подхода к верификации КТ. Совершенствование методов диагностики нежелательных явлений со стороны сердца в процессе терапии противоопухолевыми препаратами привело к исследованию генетических особенностей целевой группы пациентов. В настоящем исследовании было выявлено 8 генетических вариантов, достоверно ассоциированных с модуляцией риска развития КТ. Учитывая небольшую выборку пациентов, полученные результаты требуют дальнейшего подтверждения диагностической и прогностической роли в модуляции КТ. Несмотря на это, настоящее исследование указывает на перспективы проведения генетического скрининга перед проведением противоопухолевой иммунохимиотерапии в качестве будущего инструмента для стратификации пациентов онкогематологического профиля для минимизации КТ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Поддубная И. В., Савченко В. Г., Поспелова Т. И. и др. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. М.: ООО "БукиВеди", 2018. 356с.
2. Поддубная И. В., Паровичникова Е. Н., Каприн А. Д., Варфоломеева С. Р. Клинические рекомендации Фолликулярная лимфома. https://oncology-association.ru/wp-content/uploads/2022/06/follikulyarnaya-limfoma.pdf.
3. https://www.broadinstitute.org/gatk/.
Список литературы
1. Бессмельцев С. С. Злокачественные лимфомы: история, распростаненность, этиология и патогенез (лекция). Вестник гематологии. 2023;(1):64-80.
2. Cerhan JR. Epidemiology of Follicular Lymphoma. Hematol Oncol Clin North Am. 2020; 34(4):631-46. doi:10.1016/j.hoc.2020.02.001.
3. Бусыгин В. В., Даниленко С. А., Зайкова-Хелимская И. В. Кардиоваскулярные осложнения современных противоопухолевых препаратов (обзор литературы). Забайкальский медицинский вестник. 2023;(1):122-36. doi:10.52485/19986173_2023_1_122.
4. Lyon A, López-Fernández T, Couch L, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J Cardiovasc Imaging. 2022;23(10):e333-e465. doi:10.1093/ehjci/jeac106.
5. Беленков Ю. Н., Ильгисонис И. С., Кириченко Ю. Ю. и др. Кардиоонкология сегодня: анализ первых европейских клинических рекомендаций 2022 года. Кардиология. 2023;63(7):3-15. doi:10.18087/cardio.2023.7.n2445.
6. Ding Y, Du K, Niu Y, et al. Genetic Susceptibility and Mechanisms Underlying the Pathogenesis of Anthracycline-Associated Cardiotoxicity. Oxid Med Cell Longev. 2022:5818612. doi:10.1155/2022/5818612.
7. Dobson R, Ghosh AK, Ky B, et al. BSE and BCOS guideline for transthoracic echocardiographic assessment of adult cancer patients receiving anthracyclines and/ or trastuzumab. JACC CardioOncology. 2021;3(1):1-16. doi:10.1016/J.JACCAO.2021.01.011.
8. Li H, Durbin R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics. 2009;25(14):1754-60. doi:10.1093/bioinformatics/btp324.
9. Bhatia S. Genetics of anthracycline cardiomyopathy in cancer survivors: JACC: cardio-oncology state-of-the-art review. Cardio Oncology. 2020;2(4):539-52. doi:10.1016/j.jaccao.2020.09.006.
10. Васюк Ю. А., Гендлин Г. Е., Емелина Е. И. и др. Методическое письмо для кардиологов учреждений онкологического профиля по профилактике сердечно-сосудистых осложнений противоопухолевой терапии. Междисциплинарный совет по кардиоонкологии, Российское кардиологическое общество. Кардиоваскулярная терапия и профилактика. 2023; 22(7):3685. doi:10.15829/1728-8800-2023-3685.
11. Kang Y, Scherrer-Crosbie M. Echocardiography Imaging of Cardiotoxicity. Cardiol Clin. 2019;37(4):419-27. doi:10.1016/j.ccl.2019.07.006.
12. Sulaiman S, Hesham D, Hamid MA, et al. The combined role of NT-proBNP and LV-GLS in the detection of early subtle chemotherapy-induced cardiotoxicity in breast cancer female patients. Egypt Heart J. 2021;73(1):20. doi:10.1186/s43044-021-00142-z.
13. Sławinski G, Hawryszko M, Lizewska-Springer A, et al. Global Longitudinal Strain in Cardio-Oncology: A Review. Cancers (Basel). 2023;15(3):986. doi:10.3390/cancers15030986.
14. Medvedofsky D, Maffessanti F, Weinert L, et al. 2D and 3D Echocardiography-Derived Indices of Left Ventricular Function and Shape: Relationship with Mortality. JACC Cardiovasc. Imaging. 2018;11:1569-79. doi:10.1016/j.jcmg.2017.08.023.
15. Plana JC, Galderisi M, Barac A, et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: A report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2014;27:911-39. doi:10.1016/j.echo.2014.07.012.
16. Гиматдинова Г. Р., Данилова О. Е., Давыдкин И. Л. и др. Современные аспекты ранней диагностики кардиотоксических осложнений лекарственной терапии в онкологии (обзор литературы). Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2022;15(1):107-13. doi:10.21320/2500-2139-2022-15-1-107-113.
17. Гиматдинова Г. Р., Данилова О. Е., Давыдкин И. Л. и др. Особенности микроциркуляции у пациентов с впервые выявленными индолентными неходжкинскими лимфомами с отягощенным сердечно-сосудистым анамнезом. Бюллетень медицинской науки. 2022;(2):37-42. doi:10.31684/25418475_2022_2_37.
18. Гиматдинова Г. Р., Данилова О. Е., Давыдкин И. Л. и др. Ассоциация клинико-диагностических показателей кардиоваскулярной токсичности у пациентов с неходжкинскими лимфомами в процессе программной противоопухолевой терапии. Архивъ внутренней медицины. 2024;(2):144-53. doi:10.20514/2226-6704-2024-14-2-144-153.
19. Гиматдинова Г. Р., Данилова О. Е., Давыдкин И. Л. и др. Диагностические возможности инструментальных методов исследования ранних сердечно-сосудистых нежелательных явлений у больных с лимфопролиферативными заболеваниями, вопросы качества и безопасности. Кардиоваскулярная терапия и профилактика. 2024;23(2):3784. doi:10.15829/1728-8800-2024-3784.
20. Gandara-Mireles JA, Lares-Asseff I, Reyes Espinoza EA, et al. Association of genetic polymorphisms NCF4 rs1883112, CBR3 rs1056892, and ABCC1 rs3743527 with the cardiotoxic effects of doxorubicin in children with acute lymphoblastic leukemia. Pharmacogenet Genomics. 2021;31(5):108-15. doi:10.1097/FPC.0000000000000428.
21. Armenian SH, Ding Y, Mills G, et al. Genetic susceptibility to anthracycline-related congestive heart failure in survivors of haematopoietic cell transplantation. British Journal of Haematology. 2013;163(2):205-13.
22. Yunis LK, Linares-Ballesteros A, Aponte N, et al. Pharmacogenetics of ABCB1, CDA, DCK, GSTT1, GSTM1 and outcomes in a cohort of pediatric acute myeloid leukemia patients from Colombia. Cancer Rep (Hoboken). 2023;6(3):e1744. doi:10.1002/cnr2.1744.
23. Serie DJ, Crook JE, Necela BM, et al. Genome-wide association study of cardiotoxicity in the NCCTG N9831 (Alliance) adjuvant trastuzumab trial. Pharmacogenet Genomics. 2017;27(10):378-85. doi:10.1097/FPC.0000000000000302.
24. Jansen RS, Mahakena S, Haas M, et al. ATP-binding Cassette Subfamily C Member 5 (ABCC5) Functions as an Efflux Transporter of Glutamate Conjugates and Analogs. J Biol Chem. 2015;290(51):30429-40. doi:10.1074/jbc.M115.692103.
25. Petrykey K, Rezgui AM, Guern ML, et al. Genetic factors in treatment-related cardiovascular complications in survivors of childhood acute lymphoblastic leukemia. Pharmacogenomics. 2021;22(14):885-901. doi:10.2217/pgs-2021-0067.
26. Liu X. SLC Family Transporters. Adv Exp Med Biol. 2019;1141:101-202. doi:10.1007/978-981-13-7647-4_3.
27. Visscher H, Rassekh SR, Sandor GS, et al. Genetic variants in SLC22A17 and SLC22A7 are associated with anthracycline-induced cardiotoxicity in children. Pharmacogenomics. 2015;16(10):1065-76. doi:10.2217/pgs.15.61.
28. Remme CA. SCN5A channelopathy: arrhythmia, cardiomyopathy, epilepsy and beyond. Philos Trans R Soc Lond B Biol Sci. 2023;378(1879):20220164. doi:10.1098/rstb.2022.0164.
29. Mizusawa Y, Horie M, Wilde AA. Genetic and clinical advances in congenital long QT syndrome. Circ J. 2014;78(12):2827-33. doi:10.1253/circj.cj-14-0905.
30. Jordan E, Peterson L, Ai T, et al. Evidence-Based Assessment of Genes in Dilated Cardiomyopathy. Circulation. 2021;144(1):7-19. doi:10.1161/CIRCULATIONAHA.120.053033.
31. Dridi H, Liu Y, Reiken S, et al. Heart failure-induced cognitive dysfunction is mediated by intracellular Ca2+ leak through ryanodine receptor type 2. Nat Neurosci. 2023; 26(8):1365-78. doi:10.1038/s41593-023-01377-6.
32. Gillis AM, Dobrev D. Targeting the RyR2 to Prevent Atrial Fibrillation. Circ Arrhythm Electrophysiol. 2022;15(10):e011514. doi:10.1161/CIRCEP.122.011514.
33. Desai VG, Vijay V, Han T, et al. Doxorubicin-induced delayed-onset subclinical cardiotoxicity in mice. J Appl Toxicol. 2022;42(5):778-92. doi:10.1002/jat.4256.
34. Hanna AD, Lam A, Tham S, et al. Adverse effects of doxorubicin and its metabolic product on cardiac RyR2 and SERCA2A. Mol Pharmacol. 2014;86(4):438-49. doi:10.1124/mol.114.093849.
35. Ahmad F, Arad M, Musi N, et al. Increased alpha2 subunit-associated AMPK activity and PRKAG2 cardiomyopathy. Circulation. 2005;112(20):3140-8. doi:10.1161/CIRCULATIONAHA.105.550806.
36. Liu Y, Bai R, Wang L, et al. Identification of a novel de novo mutation associated with PRKAG2 cardiac syndrome and early onset of heart failure. PLoS One. 2013;8(5):e64603. doi:10.1371/journal.pone.0064603.
Об авторах
Г. Р. ГиматдиноваРоссия
Гиматдинова Гелия Рифкатовна — очный аспирант кафедры госпитальной терапии с курсами гематологии и трансфузиологии; врач-гематолог отделения гематологии и химиотерапии № 2 Клиники.
Самара
Конфликт интересов:
Нет
О. Е. Данилова
Россия
Данилова Олеся Евгеньевна — к.м.н., доцент кафедры госпитальной терапии с курсами гематологии и трансфузиологии, зав. отделением гематологии и химиотерапии № 2 Клиники.
Самара
Конфликт интересов:
Нет
И. Л. Давыдкин
Россия
Давыдкин Игорь Леонидович — д.м.н., профессор, зав. кафедрой и клиникой госпитальной терапии с курсами гематологии и трансфузиологии.
Самара
Конфликт интересов:
Нет
Ю. С. Милюткина
Россия
Милюткина Юлия Сергеевна — биолог лаборатории метагеномики человека НОПЦ ГЛТ.
Самара
Конфликт интересов:
Нет
А. С. Сустретов
Россия
Сустретов Алексей Сергеевич — зав. лаборатории метагеномики человека НОПЦ ГЛТ.
Самара
Конфликт интересов:
Нет
О. А. Германова
Россия
Германова Ольга Андреевна — к.м.н., директор МНОЦ кардиоваскулярной патологии и кардиовизуализации, врач кардиолог, врач функциональной диагностики, доцент кафедры пропедевтической терапии с курсом кардиологии.
Самара
Конфликт интересов:
Нет
Дополнительные файлы
- Генетические полиморфизмы способны обладать кардиотоксическим и кардиопротективным эффектом.
- Выявлено 8 вариантов генетических полиморфизмов, достоверно ассоциированных с модуляцией риска развития кардиоваскулярной токсичности.
- Исследование "генетической пластичности" пациентов перед проведением потенциально кардиотоксичных схем противоопухолевой терапии позволит максимально точно прогнозировать нежелательные явления, а также оптимизировать ведение пациентов целевой группы.
Рецензия
Для цитирования:
Гиматдинова Г.Р., Данилова О.Е., Давыдкин И.Л., Милюткина Ю.С., Сустретов А.С., Германова О.А. Генетические предикторы развития кардиоваскулярной токсичности у пациентов онкогематологического профиля. Российский кардиологический журнал. 2024;29(10):6081. https://doi.org/10.15829/1560-4071-2024-6081. EDN: HIYVWU
For citation:
Gimatdinova G.R., Danilova O.E., Davydkin I.L., Milyutkina Yu.S., Sustretov A.S., Germanova O.A. Genetic predictors of cardiovascular toxicity in oncohematological patients. Russian Journal of Cardiology. 2024;29(10):6081. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6081. EDN: HIYVWU
JATS XML

















































