Перейти к:
Возможности применения тропонина I для оценки риска неблагоприятного исхода у пациентов с сердечно-сосудистыми заболеваниями в анамнезе
https://doi.org/10.15829/1560-4071-2024-6070
EDN: AXGUFS
Аннотация
Цель. Провести анализ ассоциаций уровня сердечного тропонина I, измеренного высокочувствительным методом (hs-cTnI), с исходами у пациентов с сердечно-сосудистыми заболеваниями в анамнезе и оценить прогностическую способность данного маркера в отношении неблагоприятных сердечнососудистых событий.
Материал и методы. В исследование были включены 10688 человек в возрасте 35-64 лет (59,3% женщин), являющихся участниками многоцентровых наблюдательных исследований ЭССЕ-РФ и ЭССЕ-РФ2, у которых имелись данные об уровне hs-cTnI. Уровень hs-cTnI в биообразцах определяли с помощью иммунохемилюминесцентного анализа с микрочастицами. Из общей выборки были выделены группы лиц с ишемической болезнью сердца или инфарктом миокарда в анамнезе (группа ИБС+ИМ) и острым нарушением мозгового кровообращения в анамнезе (группа ОНМК). Была выбрана комбинированная конечная точка (ККТ): смерть от сердечно-сосудистых причин, нефатальный ИМ или нефатальное ОНМК. Медиана периода наблюдения составила 7,5 лет.
Результаты. Было показано, что более высокий уровень hs-cTnI ассоциирован с увеличением вероятности наступления ККТ как в популяционной выборке в целом (отношение рисков (ОР) 1,51; 95% доверительный интервал (ДИ): 1,29-1,79, p<0,001), так и в группах ИБС+ИМ (ОР 1,54; 95% ДИ: 1,23-1,92,
p<0,001) и ОНМК (ОР 3,52; 95% ДИ: 1,97-6,29, p<0,001). Пороговые значения 4 пг/мл для женщин и 6 пг/мл для мужчин позволяют прогнозировать неблагоприятные исходы в группах ИБС+ИМ и ОНМК (Area Under the Curve (AUC) 0,8 и 0,89, соответственно). При построении кривых выживаемости КапланаМейера вероятность отсутствия ККТ у лиц с уровнем hs-cTnI ³4/6 пг/мл значимо ниже в обеих исследуемых группах.
Заключение. Данные настоящего исследования позволяют считать hs-cTnI перспективным прогностическим биомаркером в группах пациентов с отягощенным сердечно-сосудистым анамнезом. Выбранные пороговые значения дают возможность с высокой чувствительностью и специфичностью оценить вероятность наступления неблагоприятного исхода у пациентов с ИБС, ИМ и ОНМК в анамнезе.
Ключевые слова
Для цитирования:
Иванова А.А., Иевлев Р.В., Куценко В.А., Капустина А.В., Имаева А.Э., Баланова Ю.А., Метельская В.А., Шальнова С.А., Драпкина О.М. Возможности применения тропонина I для оценки риска неблагоприятного исхода у пациентов с сердечно-сосудистыми заболеваниями в анамнезе. Российский кардиологический журнал. 2024;29(9):6070. https://doi.org/10.15829/1560-4071-2024-6070. EDN: AXGUFS
For citation:
Ivanova A.A., Ievlev R.V., Kutsenko V.A., Kapustina A.V., Imaeva A.E., Balanova Yu.A., Metelskaya V.A., Shalnova S.A., Drapkina O.O. Troponin I potential in assessing the unfavorable outcome risk in patients with cardiovascular diseases. Russian Journal of Cardiology. 2024;29(9):6070. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6070. EDN: AXGUFS
Уровень сердечного тропонина I, определенного высокочувствительным методом (high-sensitivity cardiac Troponin I, hs-cTnI), превышающий 99-й перцентиль распределения, отражает значимое повреждение миокарда на фоне различных коронарогенных и некоронарогенных заболеваний [1]. Данный маркер во всем мире является золотым стандартом лабораторной диагностики острого инфаркта миокарда (ИМ) [2]. При этом субклиническое повышение hs-cTnI в диапазоне от нижнего предела обнаружения до 99-го перцентиля обладает прогностической ценностью в отношении исходов сердечно-сосудистых заболеваний (ССЗ), что неоднократно демонстрировалось в крупных популяционных исследованиях [3][4]. Наличие некоторых хронических неинфекционных заболеваний и факторов риска ассоциировано с повышением медианы уровня hs-cTnI. Так, по данным российского популяционного исследования, в котором анализировались данные пациентов, ранее включенных в ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний в регионах Российской Федерации) и ЭССЕ-РФ2, у лиц с ИМ и острым нарушением мозгового кровообращения (ОНМК) в анамнезе медиана hs-cTnI увеличивается, соответственно, на 0,38 пг/мл (95% доверительный интервал (ДИ): 0,30-0,46; p<0,001) и 1,29 пг/мл (95% ДИ: 1,05-1,54; p<0,001) по сравнению с лицами без этих патологий [4].
По данным литературы, добавление hs-cTnI к алгоритму оценки предтестовой вероятности ишемической болезни сердца (ИБС) повышает точность теста, а у пациентов с диагностированной ИБС уровень hs-cTnI коррелирует с тяжестью поражения коронарных артерий [5]. Более того, повышенный уровень hs-cTnI позволяет более точно оценить прогноз пациентов с ИБС и перенесенным ИМ, однако число исследований, в которых исследовалась прогностическая ценность hs-cTnI у пациентов с ССЗ, невелико. В работе Wereski R, et al. было показано, что уровень hs-cTnI >10 пг/мл у больных ИБС двукратно увеличивает риск развития ИМ или смерти от ССЗ [6]. Прогнозировать наступление неблагоприятного исхода в отдаленном периоде у пациентов после планового или экстренного чрескожного коронарного вмешательства или аортокоронарного шунтирования позволяет также уровень сердечного тропонина Т (cTnT), превышающий 14 пг/мл [7].
У пациентов с ОНМК повышение уровня hs-cTnI в остром периоде заболевания обусловлено, вероятно, повреждением миокарда на фоне экстремально высоких уровней катехоламинов в крови [8]. По данным крупного метаанализа, повышение уровня cTnI и cTnТ у пациентов с остро возникшей ишемией головного мозга (ОНМК или транзиторная ишемическая атака) ассоциировано с более высоким риском смерти в стационаре и вероятностью развития неблагоприятных сердечно-сосудистых событий в будущем [9]. При этом причины стойкого субклинического повышения hs-cTnI у пациентов в отдаленном периоде после перенесенного ОНМК и прогностическое значение hs-cTnI в данной когорте остаются неясными.
Цель настоящей работы — проанализировать ассоциации hs-cTnI с исходами и оценить прогностическую ценность данного маркера у пациентов с ССЗ (ИБС, ИМ, ОНМК) в анамнезе.
Материал и методы
В настоящее исследование вошли данные пациентов, ранее включенных в наблюдательные популяционные исследования ЭССЕ-РФ и ЭССЕ-РФ2 из 9 регионов Российской Федерации (РФ) [10]. Принцип формирования представительной систематической стратифицированной многоступенчатой случайной выборки в рамках данных исследований был представлен ранее [10]. Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации и было одобрено Независимым этическим комитетом ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины ("НМИЦ ТПМ") Минздрава России. Все участники подписали информированное согласие, включающее разрешение на использование биообразцов в научных целях.
Все участники исследования заполняли стандартный опросник, состоящий из 12 модулей [10]. В рамках настоящего исследования в анализ вошли данные о социально-демографическом статусе, анамнезе курения и коморбидных патологий. Диагнозы ИБС, перенесенного ИМ и ОНМК устанавливались при наличии анамнестических указаний на данные заболевания. Артериальная гипертония (АГ) диагностировалась при уровне систолического артериального давления (АД) ≥140 мм рт.ст. и/или диастолического АД ≥90 мм рт.ст., или при приеме антигипертензивной терапии. Ожирение определялось как индекс массы тела (ИМТ) ≥30 кг/м² и/или окружность талии ≥102 см для мужчин и ≥88 см для женщин.
В анализ вошли следующие биохимические показатели: холестерин (ХС) липопротеинов низкой плотности, ХС липопротеинов высокой плотности (ЛВП), триглицериды (ТГ), глюкоза, С-реактивный белок, определенный высокочувствительным методом, креатинин с расчетом скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI (Chronic Kidney disease — Epidemiology Collaboration).
Пробоподготовка образцов сыворотки и плазмы крови проводилась сразу после взятия крови по стандартной методике. Полученные аликвоты замораживали при температуре -25° С в пробирках типа Эппендорф по 500-1000 мкл. Не более чем через 2 нед. образцы доставлялись из регионов РФ в биобанк ФГБУ "НМИЦ ТПМ" Минздрава России на сухом льду при температуре -50° С и далее хранились в биобанке при температуре -70° С.
В конце 2020г в биообразцах были дополнительно определены концентрации hs-cTnI при помощи иммунохемилюминесцентного анализа с микрочастицами с использованием реактивов Architect Stat High Sensitive Troponin I (Abbott) на анализаторе Architect i2000sr (Abbott, Abbot Park IL, США). Нижний предел определения hs-cTnI составил 1,1 пг/мл, диапазон измерений: 0-50000 пг/мл.
Сбор данных о конечных точках (КТ) проводился 1 раз в 2 года путем прямого или непрямого контакта. Устанавливался жизненный статус пациента, причины смерти и новые случаи нефатального ИМ или ОНМК.
В рамках настоящего исследования в анализ включено 10688 человек в возрасте 35-64 лет (59,3% женщин), у которых имелись данные об уровне hs-cTnI. Медиана периода наблюдения в выборке составила 7,5 лет: 8,5 лет для ЭССЕ-1 и 3,8 лет для ЭССЕ-2. Была рассмотрена комбинированная КТ (ККТ) — смерть от ССЗ или нефатальный ИМ, или нефатальное ОНМК.
Статистический анализ. Статистический анализ проведен в среде R 4.1. Непрерывные параметры представлены медианой и интерквартильным размахом (Me (Q25; Q75)) или средним и стандартным отклонением (M±SD). Качественные показатели описаны относительными частотами в процентах. Оценка различий между двумя независимыми выборками для непрерывных параметров проведена с использованием критерия Манна-Уитни, для дискретных — точного двустороннего критерия Фишера. Ассоциация логарифма уровня hs-cTnI и наступления КТ оценивалась при помощи модели пропорциональных рисков Кокса с поправками на регион, пол, возраст, ИМТ, статус курения, наличие АГ, уровни глюкозы, ХС ЛВП, ТГ, общего ХС, СКФ. Для оценки вероятности наступления КТ к определенному моменту времени использованы кривые Каплана-Мейера. Сравнение двух кривых проводилось при помощи лог-рангового критерия. Для оценки прогностической значимости hs-cTnI использовался ROC-анализ с построением кривых и расчетом площади под кривой (Area Under the Curve — AUC). Уровень значимости принят равным 0,05.
Результаты
Участники исследования были разделены на 3 группы: в первую группу вошли лица без ИБС, ИМ и ОНМК в анамнезе (n=9319), во вторую — лица с ИБС и/или перенесенным ИМ (n=1111, далее — "группа ИБС+ИМ"), в третью — лица с ОНМК в анамнезе (n=258, далее — "группа ОНМК"). Таким образом, распространенность ИБС в представительной выборке регионов РФ среди лиц 35-64 лет составила 10,6%, распространенность ОНМК — 2,5%. Участники групп с анамнезом, отягощенным по ССЗ, были старше лиц без ССЗ, имели более высокую медиану ИМТ и показателей АД. У лиц с ИБС, ИМ и ОНМК также были более выражены метаболические нарушения: медианы уровня ТГ, общего ХС, ХС липопротеинов низкой плотности, глюкозы были статистически значимо выше, медиана ХС ЛВП — ниже, что было ожидаемо, поскольку данные показатели входят в число ключевых факторов риска развития ССЗ. Подробная характеристика групп с разделением по полу представлена в таблице 1. Медиана уровня hs-cTnI в группе ИБС+ИМ была статистически значимо выше, чем в группе пациентов без ССЗ. Между группой лиц без ССЗ и группой ОНМК не было статистически значимых различий по медиане уровня hs-cTnI, что может быть обусловлено небольшой численностью группы по сравнению с остальными.
Таблица 1
Основные характеристики исследуемых групп
|
Показатель, Me [ Q25;Q75] или (M±SD) |
Без ССЗ |
ИБС-ИМ |
ОНМК |
|||
|
М (3730) |
Ж (5589) |
М (504) |
Ж (607) |
М (114) |
Ж (144) |
|
|
Возраст, лет |
48 [ 41;55] |
51 [ 43;57] |
58 [ 52;62]*** |
58 [ 54;62]*** |
56 [ 51;62]*** |
57 [ 52;61]*** |
|
hs-cTnl, нг/л |
2,50 [ 1,60;3,90] |
2,00 [ 1,20;3,10] |
3,90 [ 2,50;6,50]** |
2,90 [ 1,80;4,30]** |
3,15 [ 2,32;6,07] |
2,80 [ 1,70;4,20] |
|
Глюкоза, ммоль/л |
5,30 [ 4,91;5,74] |
5,10 [ 4,80;5,54] |
5,49 [ 5,10;6,10]*** |
5,35 [ 5,00;6,00]*** |
5,40 [ 5,00;5,90] |
5,40 [ 4,99;5,97]*** |
|
ТГ, ммоль/л |
1,29 [ 0,91;1,90] |
1,16 [ 0,83;1,66] |
1,45 [ 0,97;1,96] |
1,47 [ 1,02;1,99]*** |
1,52 [ 1,00;1,94] |
1,29 [ 1,02;2,04]** |
|
вчСРБ, мг/л |
1,31 [ 0,64;2,82] |
1,59 [ 0,71;3,47] |
1,74 [ 0,77;3,72] |
2,46 [ 1,13;4,72]*** |
1,52 [ 0,83;3,69] |
2,41 [ 1,16;5,00] |
|
Вес, кг |
95,4±13,0 |
87,3±14,6 |
100,0±12,7*** |
95,8±15,3*** |
99,9±11,4*** |
94,8±13,0*** |
|
ИМТ, кг/м² |
28,40±4,87 |
28,90±6,06 |
29,60±4,89*** |
31,70±6,18*** |
29,70±5,91* |
32,00±7,37*** |
|
САД, мм рт.ст. |
137,0±18,2 |
133,0±19,5 |
141,0±20,7*** |
142,0±22,3*** |
144,0±22,3** |
142,0±23,7*** |
|
ДАД, мм рт.ст. |
86,9±11,6 |
82,8±10,8 |
88,0±11,8* |
86,1±11,6*** |
91,1±13,9** |
86,0±12** |
|
Общий ХС, ммоль/л |
5,46±1,13 |
5,61±1,13 |
5,19±1,34*** |
5,77±1,23** |
5,24±1,18 |
5,84±1,22* |
|
ХС ЛВП, ммоль/л |
1,32±0,32 |
1,55±0,35 |
1,27±0,35** |
1,47±0,34*** |
1,28±0,35 |
1,47±0,31** |
|
СКФ, мл/мин/1,73 м² |
96,2±12,7 |
91,9±12,5 |
90,2±15,8*** |
86,2±12,5*** |
91,2±14,2*** |
84,3±15,4*** |
|
Курение (да/нет) |
1239/3730 (33,2%) |
665/5589 (11,9%) |
145/504 (28,8%)* |
58/607 (9,56%) |
41/114 (36%) |
12/144 (8,33%) |
Примечание: * — p<0,05, ** — p<0,01, *** — p<0,001 в сравнении с лицами без ССЗ.
Сокращения: вчСРБ — С-реактивный белок, определенный высокочувствительным методом, ДАД — диастолическое артериальное давление, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, ЛВП — липопротеины высокой плотности, ОНМК — острое нарушение мозгового кровообращения, САД — систолическое артериальное давление, СКФ — скорость клубочковой фильтрации, ССЗ — сердечно-сосудистые заболевания, ТГ — триглицериды, ХС — холестерин, hs-cTnI — сердечный тропонин I, определенный высокочувствительным методом, M±SD — среднее, стандартное отклонение, Me [ Q25;Q75] — медиана, интерквартильный размах.
За весь период наблюдения было зарегистрировано 447 ККТ: 283 (3%) в группе лиц без ССЗ, 123 (11,1%) в группе ИБС+ИМ, 41 (15,9%) в группе ОНМК. Число КТ в группах с отягощенным сердечно-сосудистым анамнезом было выше (p<0,001). С целью оценить ассоциации между субклиническим повышением уровня hs-cTnI и неблагоприятными исходами в каждой группе был проведен расчет отношения рисков (ОР) для логарифма от уровня hs-cTnI. Анализ выполнялся при помощи трех моделей: 1) с поправкой на регион; 2) с поправками на регион, пол и возраст; 3) с поправками на регион, пол, возраст, ИМТ, статус курения, наличие АГ, уровень глюкозы, ХС ЛВП, ТГ, общего ХС, СКФ. Данные переменные вошли в многофакторную модель, поскольку данные факторы значимо изменяют медиану уровня hs-cTnI в соответствии с данными более ранней работы [4]. Результаты анализа представлены в таблице 2.
Таблица 2
Ассоциации уровня hs-cTnI с вероятностью наступления КТ
|
Модель 1, ОР (95% ДИ) |
Модель 2, ОР (95% ДИ) |
Модель 3, ОР (95% ДИ) |
|
|
Лица без ССЗ |
1,88 (1,64-2,14)* |
1,60 (1,37-1,86)* |
1,51 (1,29-1,79)* |
|
ИБС-ИМ |
1,72 (1,44-2,04)* |
1,54 (1,27-1,87)* |
1,54 (1,23-1,92)* |
|
ОНМК |
2,40 (1,62-3,53)* |
2,75 (1,76-4,31)* |
3,52 (1,97-6,29)* |
Примечание: * — p<0,001. Модель 1 — с поправкой на регион; Модель 2 — с поправкой на регион, пол и возраст; Модель 3 — с поправкой на регион, пол, возраст, индекс массы тела, статус курения, наличие артериальной гипертензии, уровень глюкозы, холестерина липопротеинов высокой плотности, триглицеридов, общего холестерина, скорости клубочковой фильтрации.
Сокращения: ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ОР — отношение рисков, ССЗ — сердечно-сосудистые заболевания.
По результатам ROC-анализа было установлено, что у пациентов в группах ИБС+ИМ и ОНМК hs-cTnI позволяет с высокой вероятностью прогнозировать развитие неблагоприятных исходов (рис. 1). В качестве отрезных уровней для анализа были также выбраны значения 4 пг/мл для женщин и 6 пг/мл для мужчин. Чувствительность и специфичность данного показателя составили 0,77 и 0,72 в группе ИБС+ИМ (AUС 0,8; 95% ДИ: 0,76-0,85; р=0,008), 0,7 и 0,93 в группе ОНМК (AUС 0,89; 95% ДИ: 0,83-0,94; р=0,002).
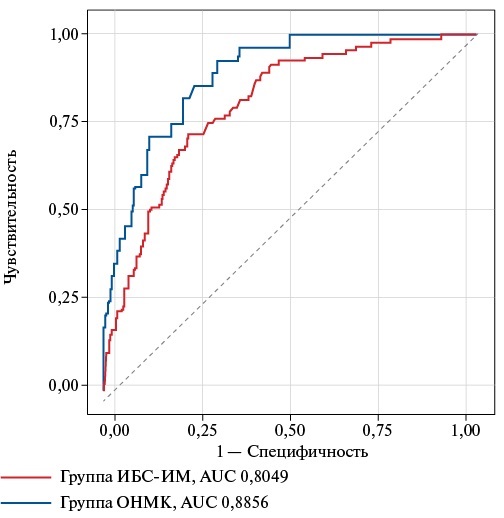
Рис. 1. Результаты ROC-анализа уровней hs-cTnI.
Сокращения: ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, AUC — the Area Under the Curve, hs-cTnI — сердечный тропонин I, определенный высокочувствительным методом.
На рисунке 2 показаны кривые Каплана-Мейера для оценки выживаемости в группе ИБС+ИМ. Для проведения анализа выживаемости участники данной группы были разделены на две подгруппы по отрезным уровням hs-cTnI, составляющим ≥4 пг/мл для женщин и >6 пг/мл для мужчин. Данные уровни были ранее определены в исследовании BiomarCaRE (The Biomarker for Cardiovascular Risk Assessment across Europe), одной из ключевых зарубежных работ, посвященных изучению прогностической ценности hs-cTnI в масштабах популяции [3]. Значения ≥4/6 пг/мл соответствуют умеренному и высокому риску развития неблагоприятного исхода, <4/6 пг/мл — низкому. Кривые в группе ИБС+ИМ значимо различаются, и различия сохраняются на протяжении всего периода наблюдения. В группе ОНМК анализ выживаемости не проводился в связи с ее небольшой численностью.
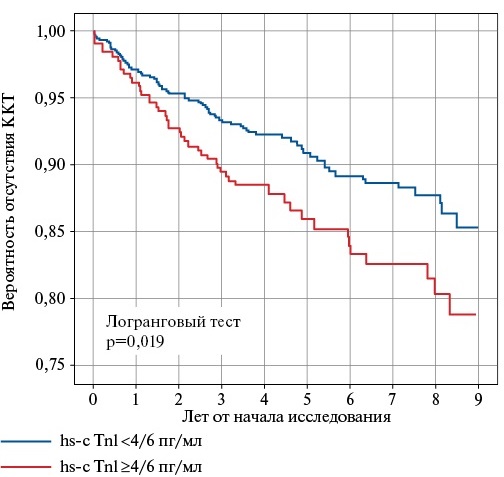
Рис. 2. Вероятность наступления ККТ в зависимости от уровня hs-cTnI в группе ИБС+ИМ.
Сокращения: ККТ — комбинированная конечная точка, hs-cTnI — сердечный тропонин I, определенный высокочувствительным методом.
Обсуждение
Во многих популяционных исследованиях, посвященных прогностической ценности hs-cTnI в отношении неблагоприятных сердечно-сосудистых событий, случаи ИБС, ИМ и ОНМК являются КТ, в связи с чем пациенты с данными диагнозами не включаются изначально или выбывают из анализа после наступления неблагоприятного исхода [4][11]. В рамках настоящей работы впервые в РФ был проведен анализ ассоциаций уровня hs-cTnI с неблагоприятными исходами у пациентов с ИБС, перенесенным ИМ или ОНМК.
По результатам анализа, медиана уровня hs-cTnI у пациентов с ИБС и перенесенным ИМ статистически значимо выше, чем в общей популяции. Полученные данные сопоставимы с результатами нескольких исследований, в которых более высокий уровень hs-cTnI был ассоциирован с наличием ИБС и позволял предсказывать наличие поражения коронарных артерий и степень его выраженности [5][12].
Кроме того, в рамках настоящего исследования было показано, что субклиническое повышение hs-cTnI в пределах 99-го перцентиля ассоциировано с риском развития неблагоприятных сердечно-сосудистых событий у пациентов с ИБС и перенесенным ИМ с учетом поправок на другие факторы (ОР 1,54; 95% ДИ: 1,23-1,92, p<0,001), что согласуется с данными зарубежных исследований. В работе Wereski R, et al., где ККТ включала ИМ или смерть от сердечно-сосудистой патологии у пациентов с диагностированной ИБС, ОР для логарифма от уровня hs-cTnI составило 2,3 (95% ДИ: 1,7-3,0, p<0,001), при этом концентрация hs-cTnI >10 пг/мл была ассоциирована с увеличением вероятности наступления КТ на 50% [6]. В нашей работе в качестве отрезных уровней были выбраны значения 4 пг/мл для женщин и 6 пг/мл для мужчин, соответствующие умеренному риску для европейской популяции, тогда как высокому риску соответствуют значения >10/12 пг/мл. Такой выбор обусловлен тем, что в пилотном исследовании в российской популяции верхний квартиль распределения hs-cTnI и критический уровень, при котором обнаруживалась связь с КТ, был ниже, чем в европейской [13]. При выполнении ROC-анализа было показано, что выбранные нами отрезные уровни позволяют с высокой чувствительностью и специфичностью прогнозировать развитие неблагоприятных сердечно-сосудистых событий.
Определение уровня hs-cTnT так же, как и уровня hs-cTnI, используется для оценки прогноза пациентов с ИБС, хотя данный маркер считается менее специфичным для стратификации риска сердечно-сосудистых событий [5, 14]. По данным Kaldal A, et al., уровень hs-cTnT <14 пг/мл ассоциирован с лучшей выживаемостью (ОР 0,37, 95% ДИ: 0,19-0,72; p=0,003) и более низкой вероятностью наступления ККТ, включавшей смерть от всех причин, нефатальный ИМ или ОНМК, повторное аортокоронарное шунтирование или чрескожное коронарное вмешательство (ОР 0,73, 95% ДИ: 0,55-0,98; p=0,04) [7]. Полученные нами результаты согласуются с данными зарубежных исследователей и демонстрируют более низкую вероятность наступления неблагоприятного исхода в подгруппе с более низким уровнем hs-cTnI при построении кривых дожития для ККТ.
Схожие результаты были получены для пациентов с перенесенным ОНМК в анамнезе: более высокий уровень hs-cTnI был ассоциирован с повышением вероятности наступления КТ. По сравнению с группой ИБС+ИМ, в группе ОНМК увеличение риска неблагоприятного исхода было кратно более выраженным (ОР 3,52; 95% ДИ: 1,97-6,29, p<0,001). В метаанализе с участием >10 тыс. пациентов и большинстве других работ высокая прогностическая ценность hs-cTnI в отношении риска смерти в стационаре и долгосрочных исходов была выявлена у пациентов в раннем периоде после перенесенного ОНМК, при этом прогностическим маркером выступали значения hs-cTnI выше 99-го перцентиля [8][9][15]. Ассоциация ОНМК в анамнезе со стойким повышением hs-cTnI ранее была отмечена в российской популяции [4]. Результаты настоящей работы добавляют информацию о том, что повышение hs-cTnI в пределах 99-го перцентиля у пациентов, когда-либо перенесших ОНМК, также имеет прогностическую ценность в отношении неблагоприятных исходов (смерть от ССЗ, ИМ, повторное ОНМК), что подтверждается результатами ROC-анализа.
Внедрение в клиническую практику рутинного применения hs-cTnI для оценки прогноза пациентов с диагностированными ССЗ требует дальнейших клинических исследований. Полученные в настоящей работе результаты говорят о том, что разработка моделей оценки риска сердечно-сосудистых осложнений, включающих hs-cTnI, может быть перспективной у пациентов с ИБС, перенесенным ИМ и ОНМК. Такие модели могли бы способствовать выявлению пациентов, нуждающихся в более интенсивной гиполипидемической терапии. В литературе имеются данные о том, что уровень hs-cTnI снижается на фоне терапии статинами, что позволяет оценить эффективность терапии [16]. Данное свойство hs-cTnI не оценивалось у пациентов с отягощенным сердечно-сосудистым анамнезом, что также может стать направлением дальнейших исследований, поскольку контроль эффективности гиполипидемической терапии крайне важен в данной группе пациентов.
Ограничения исследования. Ограничением настоящей работы является то, что основанием для включения пациентов в группы ИБС+ИМ и ОНМК служили анамнестические указания на наличие данных заболеваний, в частности, положительный ответ на вопрос анкеты "Говорил ли вам врач о наличии следующих заболеваний?". Тем не менее полученные нами результаты согласуются с данными работ, в которых проводилась верификация диагнозов, что дает основание оценить потенциальную погрешность как незначительную.
Заключение
Полученные данные позволяют считать hs-cTnI перспективным маркером для определения прогноза пациентов с ИБС, перенесенным ИМ и ОНМК. Более высокий уровень hs-cTnI ассоциирован с увеличением вероятности наступления неблагоприятного исхода независимо от других факторов риска как у пациентов с ИБС или перенесенным ИМ, так и у пациентов с ОНМК в анамнезе. Отрезные уровни hs-cTnI ≥4/6 пг/мл позволяют с высокой чувствительностью и специфичностью прогнозировать вероятность наступления КТ в данных группах.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Российское кардиологическое общество. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. doi:10.15829/29/1560-4071-2020-4103.
2. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44(38):3720-826. doi:10.1093/eurheartj/ehad191.
3. Blankenberg S, Salomaa V, Makarova N, et al. Troponin I and cardiovascular risk prediction in the general population: The BiomarCaRE consortium. Eur Heart J. 2016;37:2428- 37. doi:10.1093/eurheartj/ehw172.
4. Драпкина О.М., Шальнова С.А., Концевая А.В. и др. Прогностическая значимость тропонина I в оценке сердечно сосудистого риска в российской популяции. По результатам многоцентровых исследований ЭССЕ-РФ1 и ЭССЕ-РФ2. Кардиоваскулярная терапия и профилактика. 2023;22(5):3548. doi:10.15829/1728-8800-2023-3548.
5. Bay B, Goßling A, Blaum CM, et al. Association of High-Sensitivity Troponin T and I Blood Concentrations with All-Cause Mortality and Cardiovascular Outcome in Stable Patients-Results from the INTERCATH Cohort. J Am Heart Assoc. 2022;11(17):e024516. doi:10.1161/JAHA.121.024516.
6. Wereski R, Adamson P, Shek Daud NS, et al. High-Sensitivity Cardiac Troponin for Risk Assessment in Patients with Chronic Coronary Artery Disease. J Am Coll Cardiol. 2023;82(6):473-85. doi:10.1016/j.jacc.2023.05.046.
7. Kaldal A, Tonstad S, Jortveit J. Association of Troponin T measurements with long-term outcomes in patients with coronary artery disease participating in a secondary prevention trial. BMC Cardiovasc Disord. 2023;23(1):210. doi:10.1186/s12872-023-03249-0.
8. Chen Z, Venkat P, Seyfried D, et al. Brain-Heart Interaction: Cardiac Complications After Stroke. Circ Res. 2017;121(4):451-68. doi:10.1161/CIRCRESAHA.117.311170.
9. Alhazzani A, Kumar A, Algahtany M, Rawat D. Role of troponin as a biomarker for pre - dicting outcome after ischemic stroke. Brain Circ. 2021;7(2):77-84. doi:10.4103/bc.bc_51_20.
10. Научно-организационный комитет проекта ЭССЕ-РФ. Эпидемиология сердечно-сосудистых заболеваний в различных регионах России (ЭССЕ-РФ). Обоснование и дизайн исследования. Профилактическая медицина. 2013;16(6):25-34.
11. Kimenai DM, Anand A, de Bakker M, et al. Trajectories of cardiac troponin in the decades before cardiovascular death: a longitudinal cohort study. BMC Med. 2023;21(1):216. doi:10.1186/s12916-023-02921-8.
12. Tveit SH, Myhre PL, Hanssen TA, et al. Cardiac troponin I and T for ruling out coronary artery disease in suspected chronic coronary syndrome. Sci Rep. 2022;12(1):945. doi:10.1038/s41598-022-04850-7.
13. Шальнова С.А., Драпкина О.М., Концевая А.В. и др. Пилотный проект по изучению ассоциации тропонина I с сердечно-сосудистыми осложнениями в популяции российского региона. Кардиоваскулярная терапия и профилактика. 2021;20(5):2980. doi:10.15829/1728-8800-2021-2980.
14. Welsh P, Preiss D, Hayward C, et al. Cardiac Troponin T and Troponin I in the General Population. Circulation. 2019;139(24):2754-64. doi:10.1161/CIRCULATIONAHA.118.038529.
15. Zhang Y, Ouyang M, Qiu J, et al. Prognostic Value of Serum Cardiac Troponin in Acute Ischemic Stroke: An Updated Systematic Review and Meta-Analysis. J Stroke Cerebrovasc Dis. 2022;31(6):106444. doi:10.1016/j.jstrokecerebrovasdis.2022.106444.
16. Ford I, Shah AS, Zhang R, et al. High-Sensitivity Cardiac Troponin, Statin Therapy, and Risk of Coronary Heart Disease. J Am Coll Cardiol. 2016;68(25):2719-28. doi:10.1016/j.jacc.2016.10.020.
Об авторах
А. А. ИвановаРоссия
Иванова Анна Александровна — м.н.с., отдел фундаментальных и прикладных аспектов ожирения
Москва
Р. В. Иевлев
Россия
Иевлев Роман Владимирович — лаборант, отдел фундаментальных и прикладных аспектов ожирения, лаборатория биостатистики отдела эпидемиологии хронических неинфекционных заболеваний; студент 5-го курса механико-математического факультета
Москва
В. А. Куценко
Россия
Куценко Владимир Александрович — к. м. н., с. н. с., лаборатория биостатистики отдела эпидемиологии хронических неинфекционных заболеваний
Москва
А. В. Капустина
Россия
Капустина Анна Владимировна — с.н.с., отдел эпидемиологии хронических неинфекционных заболеваний
Москва
А. Э. Имаева
Россия
Имаева Асия Эмверовна — д.м.н., в.н.с., отдел эпидемиологии хронических неинфекционных заболеваний
Москва
Ю. А. Баланова
Россия
Баланова Юлия Андреевна — д.м.н., в.н.с., отдел эпидемиологии хронических неинфекционных заболеваний
Москва
В. А. Метельская
Россия
Метельская Виктория Алексеевна — д. б. н., г. н. с., лаборатория изучения биохимических маркеров риска хронических неинфекционных заболеваний им. Н. В. Перовой отдела фундаментальных и прикладных аспектов ожирения, профессор кафедры медицинской биохимии и иммунопатологии
Москва
С. А. Шальнова
Россия
Шальнова Светлана Анатольевна — д. м. н., профессор, руководитель отдела эпидемиологии хронических неинфекционных заболеваний
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — академик РАН, д.м.н., профессор, директор, главный внештатный специалист по терапии и общей врачебной практике Минздрава России, заслуженный врач Российской Федерации
Москва
Дополнительные файлы
- Уровень hs-cTnI ассоциирован с риском развития неблагоприятных сердечно-сосудистых событий у пациентов с ишемической болезнью сердца, перенесенным инфарктом миокарда или острым нарушением мозгового кровообращения в анамнезе.
- Пороговые значения >4 пг/мл для женщин и >6 пг/мл для мужчин позволяют эффективно прогнозировать развитие неблагоприятных исходов в указанных группах.
Рецензия
Для цитирования:
Иванова А.А., Иевлев Р.В., Куценко В.А., Капустина А.В., Имаева А.Э., Баланова Ю.А., Метельская В.А., Шальнова С.А., Драпкина О.М. Возможности применения тропонина I для оценки риска неблагоприятного исхода у пациентов с сердечно-сосудистыми заболеваниями в анамнезе. Российский кардиологический журнал. 2024;29(9):6070. https://doi.org/10.15829/1560-4071-2024-6070. EDN: AXGUFS
For citation:
Ivanova A.A., Ievlev R.V., Kutsenko V.A., Kapustina A.V., Imaeva A.E., Balanova Yu.A., Metelskaya V.A., Shalnova S.A., Drapkina O.O. Troponin I potential in assessing the unfavorable outcome risk in patients with cardiovascular diseases. Russian Journal of Cardiology. 2024;29(9):6070. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6070. EDN: AXGUFS
JATS XML

















































