Перейти к:
Анализ факторов риска аортального стеноза у пациентов с семейной гиперхолестеринемией
https://doi.org/10.15829/1560-4071-2025-6068
EDN: CARTWA
Аннотация
Цель. Проанализировать факторы, влияющие на развитие аортального стеноза (АС) у пациентов с гетерозиготной семейной гиперхолестеринемией (СГХС).
Материал и методы. Обследовано 114 пациента с гетерозиготной СГХС (средний возраст 54,3±2,7 лет, мужчин 85 (69,1%)), из них у 10 (8,8%) человек выявлен АС. СГХС диагностировалась по критериям Dutch Lipid Clinic Network. Проанализированы показатели липидного спектра, уровень липопротеида(а) (Лп(а)), возраст, отягощенная наследственность по сердечно-сосудистой патологии, курение, артериальная гипертензия (АГ), гипергликемия; учитывался факт наличия в анамнезе ишемической болезни сердца (ИБС), инфаркта миокарда (ИМ) и ишемического инсульта. Кумулятивные уровни липопротеидов низкой плотности (ЛНП) (КЛНП) и холестерина (ХС) неЛВП рассчитывались как суммарный показатель ХС ЛНП за годы жизни пациента с учетом достигнутых показателей на фоне гиполипидемической терапии.
Результаты. На развитие АС влияли возраст (отношение шансов (ОШ) 1,1 [1,02; 1,15], р=0,009); АГ (ОШ 8,15 [1,50; 44,08], р=0,017), показатели липидного спектра: общего ХС (ОШ 2,09 [1,38; 3,10], р=0,0006; ХС ЛНП (ОШ 2,8 [1,59; 4,79], р=0,0004), ХС неЛВП (ОШ 1,012 [1,005; 1,019], р=0,003), триглицеридов (ОШ 1,97 [1,33; 2,87], р=0,0007). Кумулятивные показатели также влияли на риск развития АС: КЛНП, накопленный за годы жизни (ОШ 2,13 [1,31; 3,54], р=0,003), кумулятивный уровень ХС неЛВП, накопленный за жизнь (ОШ 1,56 [1,01; 2,18], р=0,013), уровень Лп(а) (риск развития АС увеличивается в 10,6 раз при повышении Лп(а) на 1 единицу измерения (1 г/л)) (ОШАС=10,5 [5,0; 21,9], p=0,0017).
Наличие ИБС и ИМ при СГХС повышает риск развития АС (для ИБС ОШ 8,62 [1,07; 69,113], р=0,044; для ИМ ОШ 3,93 [1,08; 14,36], р=0,034). Сочетание ИМ и нарушения мозгового кровообращения в 4,94 повышает риск развития АС (ОШ 4,94 [1,23; 19,62], р=0,021). Наличие сухожильных ксантом значимо влияет на развитие АС (ОШ 50,2 [6,03; 413,00], р<0,001).
Заключение. Выявленный в молодом возрасте АС может быть проявлением СГХС. На развитие АС при СГХС влияют возраст и АГ, и комплекс липидных факторов: уровни общего ХС, уровни ЛНП, триглицеридов, а также уровни Лп(а) и кумулятивные показатели.
Ключевые слова
Для цитирования:
Корнева В.А., Кузнецова Т.Ю. Анализ факторов риска аортального стеноза у пациентов с семейной гиперхолестеринемией. Российский кардиологический журнал. 2025;30(1):6068. https://doi.org/10.15829/1560-4071-2025-6068. EDN: CARTWA
For citation:
Korneva V.A., Kuznetsova T.Yu. Analysis of risk factors for aortic stenosis in patients with familial hypercholesterolemia. Russian Journal of Cardiology. 2025;30(1):6068. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6068. EDN: CARTWA
Семейная гиперхолестеринемия (СГХС) — аутосомно-доминантное генетическое заболевание, характеризующееся повышенным с рождения уровнем холестерина (ХС) липопротеидов низкой плотности (ЛНП), более ранним развитием атеросклеротического процесса, преимущественно в коронарном бассейне. Характерными чертами СГХС являются сухожильные ксантомы, липоидная дуга роговицы до 45 лет; менее известным признаком является аортальный стеноз (АС), развивающийся у лиц в молодом возрасте. У пациентов с гетерозиготной СГХС (геСГХС) также продемонстрировано более раннее развитие АС, однако частота его развития ниже, чем при гомозиготной (гоСГХС). Факторы, определяющие развитие при геСГХС, изучены недостаточно. При гоСГХС аортальный клапан (АК) повреждается, по-видимому, из-за чрезвычайно высокой концентрации ХС в течение относительно короткого периода времени, тогда как при геСГХС требуются дополнительные факторы риска для развития вальвулопатии [1].
Цель: проанализировать факторы, влияющие на развитие АС у пациентов с геСГХС.
Материал и методы
В исследование включены пациенты из Карельского регистра пациентов с СГХС, обследовано 114 пациента с геСГХС (средний возраст 54,3±2,7 лет, мужчин 85 (69,1%)), из них у 10 (8,8%) человек выявлен АС.
СГХС диагностировалась по критериям Dutch Lipid Clinic Network (DLCN). Проанализированы следующие факторы риска: показатели липидного спектра, уровень липопротеида(а) (Лп(а)), возраст, отягощенная наследственность по сердечно-сосудистой патологии, курение, артериальная гипертензия (АГ), гипергликемия; учитывался факт наличия в анамнезе ишемической болезни сердца (ИБС), инфаркта миокарда (ИМ) и ишемического инсульта. Кумулятивные уровни ЛНП (КЛНП) и ХС не липопротеидов высокой плотности (ЛВП) (КХС неЛВП) рассчитывались как суммарный показатель ХС ЛНП за годы жизни пациента с учетом достигнутых показателей на фоне гиполипидемической терапии.
Протезирование АК выполнено у 4 пациентов с АС. Все пациенты получают терапию статинами, 5 получают комбинацию статина и эзетимиба, 2 человека — комбинацию статина и ингибиторов пропротеиновой конвертазы субтилизин-кексинового типа 9.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен Этическим комитетом МЗ и СР РК и ФГБОУ ВО ПетрГУ (14 ноября 2013г, протокол № 29). До включения в исследование у всех участников было получено письменное информированное согласие.
Результаты
Пациенты с геСГХС и АС были старше (возраст 60,8±11,7 лет) лиц без АС (48,72±13,99) (р=0,0049). Показатели липидного спектра представлены в таблице 1. У пациентов с геСГХС и АС до начала гиполипидемической терапии выявлены более высокие уровни общего ХС (ОХС) (11,84±1,88 ммоль/л по сравнению с 9,81±1,49 ммоль/л без АС, р<0,01); ХС ЛНП (9,21±1,09 ммоль/л по сравнению с 7,21±1,33 ммоль/л без АС, р<0,001); ХС неЛВП (10,31±1,92 ммоль/л по сравнению с 8,19±1,66 ммоль/л без АС, р<0,001). Количество баллов по шкале DLCN у пациентов с АС 14,39±5,32, без АС — 10,21±3,98 (р=0,0019). Не выявлено достоверных различий между показателями липидного спектра у пациентов в подгруппах с АС и без АС, получающих статины.
Таблица 1
Клинико-лабораторные показатели пациентов с геСГХС и АС
|
Показатели |
Пациенты с АС (n=10) |
Пациенты без АС (n=104) |
Достоверность |
|
Mean±StD |
Mean±StD |
р |
|
|
Возраст, лет |
60,8±11,7 |
48,72±13,99 |
0,0049 |
|
ОХС до терапии, ммоль/л |
11,84±1,88 |
9,81±1,49 |
<0,001 |
|
ХС ЛНП до терапии, ммоль/л |
9,21±1,09 |
7,21±1,33 |
<0,001 |
|
ХС ЛВП до терапии, ммоль/л |
1,51±0,24 |
1,52±0,45 |
>0,05 |
|
ТГ, ммоль/л |
1,49±0,31 |
1,63±0,71 |
>0,05 |
|
ХС неЛВП до терапии, ммоль/л |
10,31±1,92 |
8,19±1,66 |
<0,001 |
|
КЛНП, ммоль/л*лет |
534,49±149,38 |
343,97±126,41 |
<0,001 |
|
КХС неЛВП, ммоль/л*лет |
581,48±140,88 |
403,56±154,31 |
<0,001 |
|
КЛНП жизни/год, ммоль/л*лет |
8,61±1,29 |
6,99±1,31 |
<0,001 |
|
Лп(а), г/л |
1,13±0,71 |
0,35±0,41 |
<0,001 |
|
Глюкоза, мкмоль/л |
5,33±0,81 |
5,13±1,74 |
>0,05 |
|
DLCN, баллы |
14,39±5,32 |
10,21±3,98 |
0,0019 |
Сокращения: АС — аортальный стеноз, КЛНП — кумулятивный уровень холестерина липопротеидов низкой плотности, КХС неЛВП — кумулятивный уровень холестерина, не входящего в состав липопротеидов высокой плотности, Лп(а) — липопротеид(а), ОХС — общий холестерин, ТГ — триглицериды, ХС ЛНП — холестерин липопротеидов низкой плотной, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС неЛВП — холестерин не липопротеидов высокой плотности, DLCN — Dutch Lipid Clinic Network.
У пациентов с АС выше КЛНП, накопленный за годы жизни: 534,49±149,38 ммоль/л*лет по сравнению с 343,97±126,41 ммоль/л*лет у пациентов без АС, р<0,001. КЛНП, накопленный за год жизни у пациентов с АС, составляет 8,61±1,29 по сравнению с 6,99±1,31 ммоль/л у лиц без АС (р<0,001) (табл. 1).
Уровень КХС неЛВП у пациентов с АС составил 581,48±140,88 ммоль/л*лет по сравнению с 403,56±154,31 ммоль/л*лет у пациентов без АС, р<0,001. Показатель КХС неЛВП за год жизни 9,43±1,58 ммоль/л по сравнению 8,15±1,72 у лиц без АС, р=0,017. Также выше показатель КХС неЛВП, накопленный к моменту ИМ, у пациентов с АС 474,90±62,10 ммоль/л по сравнению с 423,51±98,90 ммоль/л, р<0,01. Показатель КХС неЛВП, накопленный к моменту дебюта ИБС у пациентов с АС 578,34±86,39 ммоль/л по сравнению с 471,02±130,28, р=0,019.
Уровень Лп(а) в 3,3 раза выше у пациентов с АС и составляет 1,13±0,71 г/л по сравнению с 0,35±0,41 г/л у лиц без АС, р<0,001. Уровень глюкозы в подгруппах также достоверно не различался.
Наличие ИБС у пациента с СГХС в 8,6 раз повышает риск развития АС (отношение шансов (ОШ) 8,62 [ 1,07; 69,113], р=0,044). Наличие ИМ в 3,93 раз повышает риск развития АС при СГХС (ОШ 3,93 [ 1,08; 14,36], р=0,034). Сочетание ИМ и нарушения мозгового кровообращения) в 4,94 повышает риск развития АС (ОШ 4,94 [ 1,23; 19,62], р=0,021). Наличие сухожильных ксантом в 50 раз повышало риск АС при СГХС (ОШ 50,2 [ 6,03; 413,00], р<0,001). Данные представлены в таблице 2.
Таблица 2
ОШ развития АС у пациентов с СГХС при наличии ССЗ, мутации гена рецептора ЛНП, и фенотипических проявлений СГХС
|
Показатель |
ОШ |
95% ДИ |
Р |
|
Мутации LDLR |
2,56 |
[ 0,42; 13,01] |
0,303 |
|
Сухожильные ксантомы |
50,2 |
[ 6,03; 413,00] |
<0,001 |
|
Липоидная дуга |
1,37 |
[ 0,39; 4,77] |
0,598 |
|
ИБС |
8,62 |
[ 1,07; 69,11] |
0,044 |
|
ИМ |
3,93 |
[ 1,08; 14,36] |
0,035 |
|
Сочетание ИМ и ОНМК |
4,94 |
[ 1,23; 19,62] |
0,021 |
|
Прием статинов |
4,19 |
[ 0,49; 34,36] |
0,179 |
Сокращения: ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ОШ — отношение шансов, LDLR — рецептор липопротеидов низкой плотности.
Не выявлено влияние мужского пола, курения, отягощенной наследственности по сердечно-сосудистым заболеваниям (ССЗ), наличия у пациента липоидной дуги роговицы, факта приема статинов на развитие АС при СГХС (табл. 2, 3).
Таблица 3
ОШ развития АС у пациентов с СГХС при наличии сердечно-сосудистых факторов риска
|
Показатель |
Однофакторный анализ |
||
|
ОШ |
95% ДИ |
p |
|
|
Наследственность по ССЗ |
4,01 |
[ 0,48; 33,02] |
0,195 |
|
Мужской пол |
0,43 |
[ 0,11; 1,70] |
0,225 |
|
Возраст |
1,10 |
[ 1,02; 1,15] |
0,009 |
|
ОХС, ммоль/л |
2,09 |
[ 1,38; 3,10] |
0,0006 |
|
ХС ЛНП, ммоль/л |
2,8 |
[ 1,59; 4,79] |
0,0004 |
|
ХС ЛВП, ммоль/л |
0,78 |
[ 0,19; 3,36] |
0,75 |
|
ТГ, ммоль/л |
1,97 |
[ 1,33; 2,87] |
0,0007 |
|
ХС неЛВП, ммоль/л |
1,012 |
[ 1,005; 1,019] |
0,0004 |
|
КЛНП, ммоль/л*лет |
2,3 |
[ 1,31; 3,54] |
0,003 |
|
КЛНП/год |
1,007 |
[ 1,02; 1,13] |
0,0007 |
|
КХС неЛВП, ммоль/л*лет |
1,6 |
[ 1,10; 2,18] |
0,013 |
|
АГ |
8,15 |
[ 1,50; 44,08] |
0,017 |
|
Курение |
1,03 |
[ 0,24; 4,20] |
0,960 |
|
ИМТ ≥25 |
2,74 |
[ 0,32; 22,56] |
0,353 |
|
ИМТ ≥29 |
3,45 |
[ 0,94; 12,61] |
0,057 |
Сокращения: АГ — артериальная гипертензия, ДИ — доверительный интервал, ИМТ — индекс массы тела, ОШ — отношение шансов, ОХС — общий холестерин, ССЗ — сердечно-сосудистые заболевания, ТГ — триглицериды, ХС ЛНП — холестерин липопротеидов низкой плотной, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС неЛВП — холестерин не липопротеидов высокой плотности, КЛНП — кумулятивный уровень холестерина липопротеидов низкой плотности, КХС неЛВП — кумулятивный уровень холестерина, не входящего в состав липопротеидов высокой плотности.
Возраст повышает риск развития АС при СГХС в 1,10 раз (ОШ 1,10 [ 1,03; 1,17], р=0,009). При большем уровне ОХС в 2,1 повышается ОШ АС при СГХС (ОШ 2,09 [ 1,38; 3,10], р<0,001). Уровень ХС ЛНП в 2,8 раз повышает ОШ АС при CГХС (ОШ 2,8 [ 1,59; 4,79], p=0,0003). Уровень триглицеридов (ТГ) повышает ОШ АС в 2 раза (ОШ 1,97 [ 1,33; 2,87], р=0,0007). Кумулятивные показатели также значимо влияли на ОШ развития АС. КЛНП, накопленный за годы жизни, в 2,13 раз повышал ОШ развития АС при СГХС (ОШ 2,13 [ 1,31; 3,54], р=0,003). Уровень КХС неЛВП, накопленный за жизнь пациентом СГХС, повышал ОШ АС в 1,6 раз (ОШ 1,56 [ 1,01; 2,18], р=0,013). АГ в 8,15 раз повышала ОШ АС при СГХС (ОШ 8,15 [ 1,50; 44,08], р=0,017). Наличие ИБС в 8,62 раза повышает риск развития АС (ОШ 8,62 [ 1,07; 69,11], р=0,044).
При анализе влияния показателей Лп(а) на ОШ развития АС при СГХС выявлено, что увеличение Лп(а) на 1 единицу измерения (1 г/л) приводит к повышению ОШ в 10,6 раз (ОШАС 10,5 [ 5,0; 21,9], p=0,0017). При увеличении Лп(а) на 0,1 единицу измерения ОШ увеличивается в 1,33 раза (ОШАС 1,3 [ 1,18; 1,38], p=0,0017). При увеличении Лп(а) на 0,01 единицу измерения ОШ развития АС при СГХС увеличивается в 1,03 раза (ОШАС 1,03 [ 1,017; 1,032], p=0,0016).
Получена формула расчета ОШ развития АС в зависимости от уровня Лп(а):
ОШ (АС) = exp(-3,8 + 2,29*Лп(а)).
На основании данных логистической регрессии получена формула расчета ОШ у пациентов СГХС:
ОШ (АС) = exp (18,31 + 3,16*ОХС + 0,018*КХС ЛНП — 3,04*КХС ЛНП/год — 2,10*КХС липопротеидов очень низкой плотности/год + 2,37*курение).
ROC-кривая риска развития АС представлена на рисунке 1.
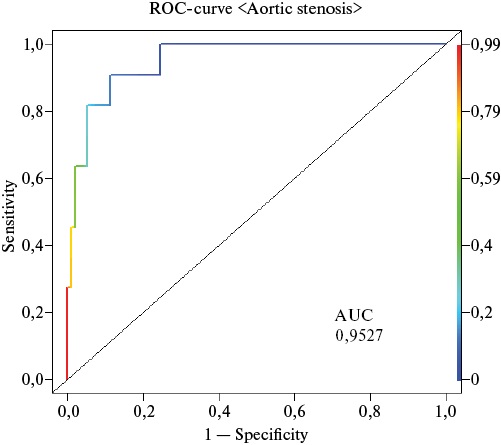
Рис. 1. ROC-кривая развития АС у пациентов с СГХС.
Примечание: цветное изображение доступно в электронной версии журнала.
Приводим клинический пример пациента с геСГХС и АС.
Пациент К, 63 года, поступил по поводу кардиомиопатии смешанного генеза (посттахикардитическая, ишемическая), осложненной пароксизмом устойчивой желудочковой тахикардии от 21.03.2023. Эффективная медикаментозная кардиоверсия амиодароном от 21.03.2023. Не курит. Без сахарного диабета и патологии щитовидной железы. В анамнезе — хроническая болезнь почек 3А ст. В течение многих лет повышение артериального давления до 160/80 мм рт.ст., постоянно принимает лозартан в дозе 50 мг/сут. Достигнутые цифры артериального давления 110-120/70 мм рт.ст.
В возрасте 33 лет (1993г) протезирование АК (механический протез) по поводу приобретенного АС. При коронарографии выявлен стеноз передней нисходящей артерии в проксимальном сегменте до 50%, по поводу которого выполнено маммарокоронарное шунтирование (1993г). В 2000г перенес задний ИМ, в последующем получал терапию аторвастатином в дозе 20 мг/сут., со слов пациента. Повторный инфаркт неуточненной локализации 08.03.2021. По данным коронарошунтографии 03.2022: шунт передней нисходящей артерии проходим, в передней нисходящей артерии стеноз дистального шунта 50%. Принимает комбинацию 20 мг розувастатина и 10 мг эзетимиба, липидный спектр не контролирует.
Перенес острое нарушение мозгового кровообращения в вертебробазилярном бассейне, в бассейне правой среднемозговой артерии в 2000, 2002, 2010, 2021гг с левосторонним спастическим гемипарезом. Транзиторная ишемическая атака в правом каротидном бассейне от 10.02.2019. Толерантность к физической нагрузке лимитирована последствиями острого нарушения мозгового кровообращения (передвигается в пределах квартиры без одышки и ангинозных болей).
Наследственность по сердечно-сосудистой патологии неизвестна.
В связи с развитием АС в молодом возрасте неинфекционной этиологии, повторными рецидивирующими сердечно-сосудистые событиями в молодом возрасте у пациента была заподозрена СГХС. При осмотре выявлены сухожильные ксантомы.
При ретроспективном анализе данных амбулаторной карты выявлена значимая дислипидемия до начала гиполипидемической терапии: ОХС с повышением до 12 ммоль/л, ЛНП в пределах 9,8-10 ммоль/л. На фоне терапии аторвастатином 20 мг/сут. снижение ОХС до 8,9 ммоль/л, ХС ЛНП до 6,5-7 ммоль/л. На фоне терапии розувастатина и эзетимиба снижение ОХС до 6,7 ммоль/л, ХС ЛНП до 4,5 ммоль/л. Была диагностирована определенная форма СГХС (DLCN — 16 баллов).
Таким образом, наличие у пациента АС, особенно сформировавшегося в молодом возрасте, без наличия инфекционной этиологии или врожденной патологии, может являться поводом заподозрить у пациента СГХС.
Обсуждение
АС — это воспалительное и дегенеративное заболевание, вызванное, главным образом, повреждением эндотелия. Описаны общие механизмы, лежащие в основе атеросклероза артерий и кальциноза АК [2]. Данные исследовательской программы SAFEHEART продемонстрировали, что частота протезирования АК была в 4,36 раза выше у пациентов с СГХС, чем у здоровых родственников. Средняя частота протезирования АК у пациентов с СГХС составила 1,7 случая на 1 тыс. пациентов в год по сравнению с соответствующей частотой в 7,7 раза при ССЗ [3]. В общей популяции кальциноз АК ассоциируется с возрастом, мужским полом, курением, гипертонией, сахарным диабетом, ожирением и гиперхолестеринемией [4]. Развитие АС связано с атеросклерозом и имеет общие факторы риска, включая возраст, АГ и гиперхолестеринемию [5]. Ранее нами были изучены факторы риска ИБС у пациентов с СГХС [6][7].
Пациенты с СГХС имеют крайне высокий уровень ХС ЛНП, который может быть связан с высоким риском развития кальциноза АК. Но в то же время риск развития кальциноза АК при геСГХС промежуточный по сравнению с более выраженным процессом при гоСГХС. Факторы риска, связанные с АС, можно разделить на три типа: дегенеративные, гемодинамические и метаболические [2]. Продемонстрировано, что увеличение возраста (дегенеративный биологический фактор), АГ (гемодинамический фактор) и повышенный уровень Лп(а) и скорректированный на Лп(а) уровень ХС ЛНП (два метаболических фактора) участвуют в развитии выраженного AС [8][9]. По данным нашего исследования ведущими факторами риска повышения вероятности развития АС были: возраст (ОШ 1,1 [ 1,02; 1,15], р=0,009); АГ (ОШ 8,15 [ 1,50; 44,08], р=0,017). Показатели липидного спектра, которые по нашим данным также играли значимую роль, следующие: ОХС (ОШ 2,09 [ 1,38; 3,10], р=0,0006); ХС ЛНП (ОШ 2,8 [ 1,59; 4,79], р=0,0004), ХС неЛВП (ОШ 1,012 [ 1,005; 1,019], р=0,003). Более высокий уровень ТГ и остаточного ХС связан с повышением риска развития АС, это объясняет роль повышенного содержания ТГ-богатых остаточных липопротеидов в качестве потенциальных факторов развития АС, вероятно, также связанных с воспалением [ 10]. В нашем исследование также выявлена значимая роль ТГ, ОШ 1,97 [ 1,33; 2,87], р=0,0007.
Кумулятивные показатели значимо влияли на ОШ развития АС. КЛНП, накопленный за годы жизни, в 2,13 раз повышал ОШ развития АС при СГХС (ОШ 2,13 [ 1,31; 3,54], р=0,003). Уровень КХС неЛВП, накопленный за жизнь пациентом СГХС, повышал ОШ АС в 1,6 раз (ОШ 1,56 [ 1,01; 2,18], р=0,013).
В нашем исследовании также продемонстрировано, что АС при СГХС наряду с устойчивым повышением уровня ХС ЛНП, возрастом, АГ, связан с повышенным уровнем Лп(а), что соответствует результатам, полученным другими авторами [9].
Более быстрое прогрессирование АС напрямую зависит от повышенного уровня Лп(а) и, в частности, от содержания частиц окисленных фосфолипидов [11][12]. Ранее нами изучалась роль Лп(а) в развитии ССЗ при СГХС [7]. В текущем исследовании было продемонстрировано, что повышение Лп(а) приводит к повышению ОШ развития АС в 10,6 раз при повышении Лп(а) на 1 единицу измерения (1 г/л) (ОШАС 10,5 [ 5,0; 21,9], p=0,0017). Механизмы, посредством которых Лп(а) приводит к кальцификации, до конца не изучены. Лп(а) связывается с протеогликанами и фибронектином на субэндотелиальном матриксе [13]. Лп(а) содержит >85% циркулирующих окисленных фосфолипидов (OxPLs), которые связываются с липопротеин-ассоциированной фосфолипазой А2, что приводит к выработке лизофосфатидилхолина [14][15].
Результаты нашего и аналогичных исследований могут привести к новым подходам в ведении пациентов с СГХС, направленным на предотвращение развития АС путем определения общей интенсивности и времени воздействия на уровень ХС ЛНП и повышенный уровень Лп(а).
Снижение уровня ХС ЛНП и Лп(а) в сочетании с контролем АГ может замедлить прогрессирование АС при СГХС, но это необходимо проверить в клинических испытаниях. Разработка методов лечения согласно выявленным факторам, повышающим вероятность развития АС при геСГХС, может стать новой терапевтической стратегией с целью остановить или, по крайней мере, замедлить развитие АС, и это должно идти параллельно со стратегией раннего выявления. У лиц с кальцинированным АС может быть рекомендовано измерение уровня Лп(а).
Заключение
Развитие АС в молодом возрасте можно рассматривать как важный дополнительный рекомендованный фактор диагностики СГХС, в т. ч. при недостаточно высоком уровне ЛНП (на фоне гиполипидемической терапии).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Dweck MR, Boon NA, Newby DE. Calcific aortic stenosis: a disease of the valve and the myocardium. J Am Coll Cardiol. 2012;60(19):1854-63. doi:10.1016/j.jacc.2012.02.093.
2. Mata P, Alonso R, Pérez de Isla L, Badimón L. Dyslipidemia and aortic valve disease. Curr Opin Lipidol. 2021;6:349-54. doi:10.1097/MOL.0000000000000794.
3. Pérez de Isla L, Arroyo-Olivares R, Alonso R, et al. SAFEHEART researchers. Incidence of cardiovascular events and changes in the estimated risk and treatment of familial hypercholesterolemia: the SAFEHEART registry. Rev Esp Cardiol (Engl Ed). 2020;10: 828-34. doi:10.1016/j.rec.2019.10.028.
4. Ferreira-Gonzalez I, Pinar-Sopena J, Ribera A, et al. Prevalence of calcific aortic valve disease in the elderly and associated risk factors: a population-based study in a Mediterranean area. Eur J Prev Cardiol. 2013;20:1022-30. doi:10.1177/2047487312451238.
5. Mundal LJ, Hovland A, Igland J, et al. Association of low-density lipoprotein cholesterol with risk of aortic valve stenosis in familial hypercholesterolemia. JAMA Cardiol. 2019;4:1156-9. doi:10.1001/jamacardio.2019.3903.
6. Корнева В.А., Кузнецова Т.Ю., Тихова Г. П. Анализ влияния традиционных факторов риска на развитие ишемической болезни сердца. Российский кардиологический журнал. 2017;(5):104-10. doi:10.15829/1560-4071-2017-5-104-110.
7. Корнева В.А., Кузнецова Т.Ю., Тихова Г.П. Значение определения липопротеида(а) как дополнительного маркера сердечно-сосудистого риска у пациентов с семейной гиперхолестеринемией. Российский кардиологический журнал. 2016;(6):45-9. doi:10.15829/1560-4071-2016-6-45-49.
8. Pérez De Isla L, Watts GF, Alonso R, et al. Lipoprotein(a), LDL-cholesterol, and hypertension: predictors of the need for aortic valve replacement in familial hypercholesterolaemia. Eur Heart J. 2021;42:2201-11. doi:10.1093/eurheartj/ehaa1066.
9. Smith JG, Luk K, Schulz C-A, et al. Association of low-density lipoprotein cholesterol-related genetic variants with aortic valve calcium and incident aortic stenosis. JAMA. 2014;312:1764-71. doi:10.1001/jama.2014.13959.
10. Kronenberg F.Aortic valve stenosis: the long and winding road. Eur Heart J. 2021;42: 2212-4. doi:10.1093/eurheartj/ehaa1069.
11. Nazarzadeh M, Pinho-Gomes AC, Bidel Z, et al. Plasma lipids and risk of aortic valve stenosis: a Mendelian randomization study. Eur Heart J. 2020;41:3913-20. doi:10.1093/eurheartj/ehaa070.
12. Schnitzler JG, Ali L, Groenen AG, et al. Lipoprotein(A) as orchestrator of calcific aortic valve stenosis. Biomolecules. 2019;9:760. doi:10.3390/biom9120760.
13. Capoulade R, Chan KL, Yeang C, et al. Oxidized phospholipids, lipoprotein(a), and progression of calcific aortic valve stenosis. J Am Coll Cardiol. 2015;66:1236-46.
14. Kaiser Y, Singh SS, Zheng KH, et al. Lipoprotein(a) is robustly associated with aortic valve calcium. Heart. 2021;107:1422-8. doi:10.1136/heartjnl-2021-319044.
15. Zheng KH, Tsimikas S, Pawade T, et al. Lipoprotein(a) and oxidized phospholipids promote valve calcification in patients with aortic stenosis. J Am Coll Cardiol. 2019;73:2150-62.
Об авторах
В. А. КорневаРоссия
Корнева Виктория Алексеевна — д.м.н., доцент, зав. кафедрой факультетской терапии, фтизиатрии, инфекционных болезней и эпидемиологии медицинского института.
Петрозаводск
Конфликт интересов:
Нет
Т. Ю. Кузнецова
Россия
Кузнецова Татьяна Юрьевна — к.м.н., доцент кафедры факультетской терапии, фтизиатрии, инфекционных болезней и эпидемиологии медицинского института.
Петрозаводск
Конфликт интересов:
Нет
Дополнительные файлы
- Выявленный в молодом возрасте аортальный стеноз (АС) при отсутствии инфекционной и врожденной этиологии может быть проявлением семейной гиперхолестеринемии (СГХС).
- Развитие АС при СГХС ассоциируется как с нелипидными факторами риска, такими как возраст и артериальная гипертензия, так и с липидными, причем метаболическими факторами, влияющими на прогрессирование поражения аортального клапана (уровни общего холестерина, уровни липопротеидов низкой плотной, триглицеридов, а также уровни липопротеида(а) и кумулятивные показатели).
Рецензия
Для цитирования:
Корнева В.А., Кузнецова Т.Ю. Анализ факторов риска аортального стеноза у пациентов с семейной гиперхолестеринемией. Российский кардиологический журнал. 2025;30(1):6068. https://doi.org/10.15829/1560-4071-2025-6068. EDN: CARTWA
For citation:
Korneva V.A., Kuznetsova T.Yu. Analysis of risk factors for aortic stenosis in patients with familial hypercholesterolemia. Russian Journal of Cardiology. 2025;30(1):6068. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6068. EDN: CARTWA

















































