Перейти к:
Оценка эффективности транскатетерного низкодозового тромболизиса у пациентов с тромбоэмболией легочной артерии промежуточно-высокого риска. Обоснование и дизайн исследования
https://doi.org/10.15829/1560-4071-2025-6060
EDN: HDSXKQ
Аннотация
Цель. Сравнение консервативной и инвазивной лечебных стратегий у пациентов с тромбоэмболией легочной артерии (ТЭЛА) промежуточно-высокого риска на основании мультимодальной оценки эффективности и безопасности.
Материал и методы. Данное исследование является одноцентровым открытым рандомизированным сравнительным исследованием. Планируется включение 100 пациентов с верифицированным диагнозом ТЭЛА промежуточно-высокого риска тридцатидневной летальности. Пациенты будут рандомизированы в соотношении 1:1 в группу стандартной антикоагулянтной терапии и в группу селективного транскатетерного тромболизиса низкой дозой алтеплазы. Период наблюдения за пациентами составит 12 мес. Первичная конечная точка — снижение соотношения правого желудочка к левому желудочку на ≥20% от исходного через 48±6 ч после инициации терапии. Вторичные конечные точки: гемодинамическая нестабильность пациента, большие кровотечения по классификации ISTH, снижение индекса Кванадли через 48 ч, степень резидуального тромбоза с перфузионным дефицитом на месяце 3-6, частота формирования посттромбоэмболического синдрома на месяце 3-6, 30-дневная, 90-дневная и годичная летальность.
Заключение. Исследование предоставит важные клинические данные в отношении краткосрочной и долгосрочной эффективности и безопасности различных лечебных подходов у пациентов с острой ТЭЛА промежуточно-высокого риска.
Ключевые слова
Для цитирования:
Симакова М.А., Пархоменко С.И., Лапшин К.Б., Глебовская Т.Д., Карпова Д.В., Маликов К.Н., Урумова Е.Л., Березина А.В., Зубарев Д.Д., Марукян Н.В., Моисеева О.М. Оценка эффективности транскатетерного низкодозового тромболизиса у пациентов с тромбоэмболией легочной артерии промежуточно-высокого риска. Обоснование и дизайн исследования. Российский кардиологический журнал. 2025;30(3):6060. https://doi.org/10.15829/1560-4071-2025-6060. EDN: HDSXKQ
For citation:
Simakova M.A., Parkhomenko S.I., Lapshin K.B., Glebovskay T.D., Karpova D.V., Malikov K.N., Urumova E.L., Berezina A.V., Zubarev D.D., Marukyan N.V., Moiseeva O.M. Efficacy of transcatheter low-dose thrombolysis in patients with intermediate-high risk pulmonary embolism. Study rationale and design. Russian Journal of Cardiology. 2025;30(3):6060. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6060. EDN: HDSXKQ
В настоящее время тромбоэмболия легочной артерии (ТЭЛА) является третьим по распространенности сердечно-сосудистым заболеванием, а также одной из основных причин смертности населения [1]. Заболеваемость легочной эмболией в странах Европы и США варьирует от 250 до 300 тыс. в год.
Несмотря на совершенствование подходов к диагностике и лечению пациентов с легочной эмболией, прогноз этого заболевания продолжает оставаться серьезным. Тяжесть ТЭЛА определяется, прежде всего, ее гемодинамическими последствиями, ассоциированными с внезапно развившейся легочной гипертензией. Известно, что ~45% пациентов с ТЭЛА имеют правожелудочковую дисфункцию, которая приводит к 25% летальности у нормотензивных пациентов и вызывает до 65% летальных исходов у пациентов с гипотензией [2]. Поскольку правый желудочек (ПЖ) имеет тонкостенную и податливую структуру, он менее адаптирован к резкому повышению постнагрузки [3]. У пациентов, ранее не имевших сердечно-сосудистых заболеваний, повышение давления в ПЖ возникает при окклюзии 25-30% легочной сосудистой сети [4]. В случае исходного наличия у пациента органической патологии правых или левых камер сердца этот порог может быть ниже. Когда постнагрузка достигает критического уровня, ПЖ расширяется, его систолическая функция снижается, что приводит к нарушению наполнения левых камер сердца и развитию синдрома малого выброса. Недостаточность коронарного кровотока в условиях сниженного ударного объема в сочетании с интрамуральной компрессией сосудов, кровоснабжающих ПЖ, приводят к его ишемии и прогрессирующей дисфункции. Важный вклад в снижение преднагрузки левых камер сердца вносит также смещение межжелудочковой перегородки в полость левого желудочка (ЛЖ) с развитием его D-образной конфигурации [5].
Понимание патогенеза острой правожелудочковой сердечной недостаточности нашло свое отражение в стратификации риска 30-дневной летальности, которая, согласно актуальным рекомендациям, определяет сегодня подходы к терапии ТЭЛА [1]. Наличие у пациента того или иного варианта гемодинамической нестабильности относит его к категории высокого риска летального исхода и требует ускоренной дезобструкции легочного русла посредством системной тромболитической терапии.
Вместе с тем нормотензия не исключает скрытую манифестацию и прогрессирование правожелудочковой недостаточности, которая в скором времени может привести к гемодинамической декомпенсации. Наличие у пациента признаков перегрузки правых камер сердца по данным эхокардиографического исследования (ЭхоКГ) или компьютерной томографии и повышенного уровня сердечного тропонина также определяет неблагоприятный прогноз больного и относит его к категории промежуточно-высокого риска 30-дневной летальности. По данным Bĕlohlávek J, et al., проанализировавших результаты собственного регистра, субмассивная легочная эмболия встречалась в 47% случаев. При этом летальность таких пациентов достигала 25% [6].
Ведение пациентов промежуточно-высокого риска в настоящее время остается одним из неразрешенных вопросов в лечении легочной эмболии. Несмотря на неоднократно доказанную эффективность системной тромболитической терапии в лечении ТЭЛА [7][8], ее роль в данной группе пациентов остается крайне спорной в связи с многократно возрастающими геморрагическими рисками. Так, в исследовании PEITHO, изучавшем применение системного тромболизиса у пациентов с ТЭЛА промежуточно-высокого риска летальности, продемонстрировано снижение частоты смертельных исходов и гемодинамической декомпенсации в группе применения тенектеплазы по сравнению с плацебо. Наряду с этим чаще встречались массивные кровотечения и геморрагический инсульт (6,3% vs 1,2% (р<0,001) и 2% vs 0,2% (р=0,003), соответственно) [9]. По данным метаанализа, проведенного Черепановой Н. А. и др., получены сходные данные об эффективности полнодозового тромболизиса в отношении смерти/рецидива ТЭЛА в сочетании со значительным возрастанием частоты геморрагических осложнений [10]. Таким образом, единственной опцией в лечении данной категории пациентов длительное время оставалась антикоагулянтная терапия. Вместе с тем в том же исследовании PEITHO показано, что до 5% исходно нормотензивных пациентов промежуточно-высокого риска, первоначально получавших антикоагулянты, имели в процессе наблюдения гемодинамическую нестабильность и нуждались в "спасительной" реперфузионной терапии в течение первых 72 ч после поступления [9]. Это побудило научное сообщество к разработке новых методов малоинвазивной эвакуации, фрагментации и локального лизиса тромботических масс, что позволяло бы повысить эффективность лечения и минимизировать риски геморрагических осложнений. Так появились интервенционные методы лечения ТЭЛА в варианте механической тромбэктомии [11][12] и/или селективного транскатетерного тромболизиса (СТТ) с использованием инфузионных катетеров и ультразвуковых устройств [13][14]. Согласно европейским рекомендациям в настоящее время место транскатетерного лечения определено как альтернативы системной тромболитической терапии в лечении пациентов с ТЭЛА промежуточно-высокого риска летальности в случае дестабилизации системной гемодинамики с классом показаний IIA [1][15]. Однако появляется все больше исследований, позволяющих полагать, что использование интервенционных методик обладает большей эффективностью и сопоставимым профилем безопасности при сравнении с рутинной антикоагулянтной терапией. Так, в сравнительном исследовании ULTIMA в группе пациентов промежуточно-высокого риска ТЭЛА показано преимущество ультразвукового транскатетерного тромболизиса над антикоагулянтной терапией в снижении соотношения конечных диастолических размеров ПЖ к ЛЖ (ПЖ/ЛЖ) (0,30±0,20 vs 0,03±0,16, р<0,001) и степени систолической дисфункции ПЖ при отсутствии нарастания частоты геморрагических событий [16].
Предварительные данные показывают, что селективный тромболизис является перспективным методом лечения ТЭЛА промежуточно-высокого риска, однако в заявлении экспертов Американской ассоциации сердца подчеркивается недостаток данных, прежде всего, относительно краткосрочных и долгосрочных результатов эндоваскулярного лечения легочной эмболии, что требует дальнейшего изучения [17].
Целью настоящего исследования стало сравнение стандартной антикоагулянтной терапии и СТТ сниженной дозой алтеплазы у пациентов с ТЭЛА промежуточно-высокого риска на основании мультимодальной оценки эффективности и безопасности.
Гипотеза. СТТ со сниженной дозой алтеплазы у пациентов с ТЭЛА промежуточно-высокого риска как метод быстрой реперфузии легких уменьшает постнагрузку на ПЖ, что отражается в снижении соотношения ПЖ/ЛЖ по данным ЭхоКГ или мультиспиральной компьютерной ангиопульмонографии (МСКТ-АПГ).
Материал и методы
Дизайн исследования. Данное исследование является одноцентровым открытым рандомизированным исследованием (рис. 1). Планируется включить 100 пациентов с верифицированным диагнозом ТЭЛА промежуточно-высокого риска тридцатидневной летальности, госпитализированных в отделения анестезиологии и реанимации кардиологического профиля. Диагностика ТЭЛА и стратификация риска летального исхода проводятся в соответствии с рекомендациями Европейского общества кардиологов по лечению пациентов с легочной эмболией 2019г [1]. Исследование выполняется врачами-кардиологами и соответствует стандартам надлежащей клинической практики (Good Clinical Practice) и принципам Хельсинкской декларации. Протокол исследования одобрен локальным этическим комитетом (№ 1511-23 от 27.11.2023г). Регистрационный номер исследования ClinicalTrials.gov NCT06487052.
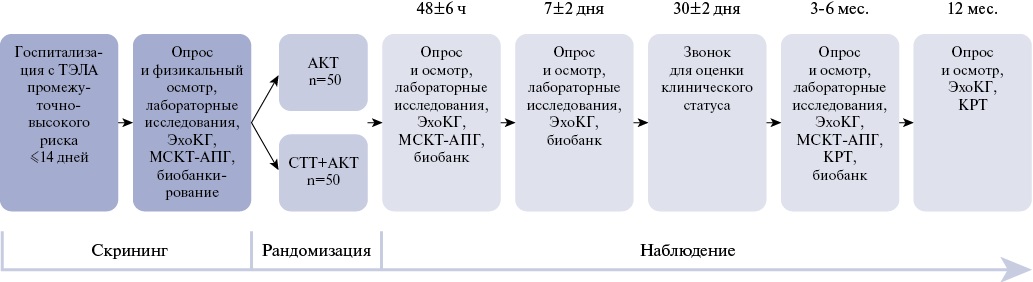
Рис. 1. Дизайн исследования.
Сокращения: АКТ — антикоагулянтная терапия, КРТ — кардиореспираторное тестирование, МСКТ-АПГ — мультиспиральная компьютерная ангиопульмонография, СТТ — селективный транскатетерный тромболизис, ТЭЛА — тромбоэмболия легочной артерии, ЭхоКГ — эхокардиография.
Критерии включения. В исследование включаются пациенты старше 18 лет, подписавшие форму информированного согласия, с подтвержденным с помощью МСКТ-АПГ диагнозом ТЭЛА давностью <14 дней. При этом обязательным условием включения является тромботическое поражение ствола и/или главной и/или долевой ветви легочной артерии в сочетании с наличием признаков перегрузки ПЖ (соотношение диаметров ПЖ/ЛЖ в четырехкамерной апикальной позиции на уровне базальных сегментов >1 (ПЖ/ЛЖ >1) по данным МСКТ-АПГ или ЭхоКГ) и биомаркеров повреждения миокарда — повышением уровня тропонина I выше референсных значений и/или N-концевого промозгового натрийуретического пептида >600 пг/мл.
Критерии невключения. В исследование не включаются пациенты с ТЭЛА высокого риска тридцатидневной летальности, пациенты с наличием тромбов в полостях сердца, а также с абсолютными противопоказаниями для применения тромболитической терапии (пациенты с геморрагическим инсультом или инсультом неизвестной этиологии в анамнезе, ишемическим инсультом или транзиторной ишемической атакой в течение последних 6 мес., обширным кровотечением в настоящее время или в течение предыдущих 6 мес., новообразованиями, аневризмами и пороками развития сосудов центральной нервной системы, обширным хирургическим вмешательством или обширной травмой в течение предыдущих 3 мес., язвенной болезнью желудка или двенадцатиперстной кишки в течение последних 3 мес. и иными состояниями, предусмотренными в инструкции по применению алтеплазы). В исследование не будут включаться пациенты с уровнем гемоглобина <70 г/л и/или количеством тромбоцитов ≤100×10⁹/л, пациенты с указанием на аллергические реакции на гепарин и фибринолитические препараты в прошлом, а также беременные и кормящие женщины.
Скрининг. Пациенту, соответствующему критериям включения/невключения после подписания информированного согласия проводится дополнительный опрос, включая сбор общих и анамнестических данных, физикальный осмотр, биобанкирование плазмы и сыворотки крови, трансторакальное ЭхоКГ с развернутой оценкой структуры и функции правых камер сердца.
Процедура рандомизации и режимы лечения ТЭЛА. После включения в исследование производится стратифицированная (по полу и возрасту) рандомизация с использованием программы WinPepi Etcetera® (J. H. Abramson, 2006-2016, version 3.26) в соотношении 1:1 в группу стандартной антикоагулянтной терапии и в группу СТТ низкой дозой алтеплазы. Распределение по лечебным группам является открытым для исследователей и пациентов. В течение не менее 24 ч до рандомизации всем пациентам проводится внутривенная терапия нефракционированным гепарином (НФГ) с поддержанием активированного частичного тромбопластинового времени (АЧТВ) в пределах 70-80 сек.
Группа СТТ. Пациентам, определенным в группу инвазивной стратегии, в течение 2 ч после рандомизации выполняется СТТ: механическая фрагментация тромботических масс катетером типа PigTail сочетается с последующим болюсным введением 1 мг алтеплазы и пролонгированной инфузией 1 мг/ч (для одностороннего тромботического поражения) или болюсным введением 2 мг алтеплазы с последующей инфузией 2 мг/ч (для двустороннего поражения). Общая продолжительность инфузии составляет 9 ч, общая доза алтеплазы 10 мг в случае одностороннего поражения и 20 мг при двустороннем поражении. Во время инфузии тромболитического препарата продолжается введение НФГ с поддержанием АЧТВ в пределах 50-60 сек. После окончания процедуры продолжается терапия НФГ в течение 24 ч с последующим переходом на пероральные антикоагулянтные препараты (антагонисты витамина К или прямые пероральные антикоагулянты) в соответствии с показаниями, требованиями инструкции к препарату и принципами локальной клинической практики.
Группа стандартной антикоагулянтной терапии. Для пациентов из группы консервативной тактики после рандомизации терапия НФГ с поддержанием целевого АЧТВ продолжается в течение 24 ч (суммарно не более 48 ч). Затем осуществляется переход на пероральные антикоагулянтные препараты (антагонисты витамина К или прямые пероральные антикоагулянты) в соответствии с показаниями, требованиями инструкции к препарату и принципами локальной клинической практики.
Стратегия ведения при ухудшении состояния пациента. В случае развития гемодинамической нестабильности пациента (остановка кровообращения, обструктивный шок (систолическое артериальное давление (САД) <90 мм рт.ст. или необходимость использования вазопрессоров для поддержания САД ≥90 мм рт.ст. в сочетании с признаками системной гипоперфузии) или персистирующая гипотензия (САД <90 мм рт.ст. или падение САД ≥40 мм рт.ст., длительностью >15 мин, несвязанное с иными причинами)) будет выполняться "спасительная" системная тромболитическая терапия: 10 мг алтеплазы в/в струйно в течение 1-2 мин с последующим в/в капельным введением 90 мг в течение 2 ч (общая доза алтеплазы 100 мг). После окончания инфузии будет продолжена терапия НФГ с поддержанием целевого АЧТВ (70-80 сек). Не ранее чем через 24 ч после стабилизации состояния осуществляется переход на пероральные антикоагулянтные препараты (в соответствии с принципами, изложенными ранее).
Наблюдение за пациентами. Проспективный характер исследования предполагает наблюдение за пациентами в течение 12 мес. посредством телефонного звонка и обязательных очных визитов на стационарном этапе — через 48 ч и 7 дней и амбулаторном этапе — через 3-6 и 12 мес., соответственно. Во время визитов выполняется оценка текущего клинического статуса, динамики ЭхоКГ, МСКТ-АПГ, уровня N-концевого промозгового натрийуретического пептида, маркеров системного воспаления и системы фибринолиза, а также кардиореспираторное нагрузочное тестирование. Такой подход позволяет проводить комплексную оценку состояния сердечно-сосудистой системы, своевременно выявлять развитие посттромбоэмболического синдрома в двух группах лечения и принимать решение о сроках антикоагулянтной терапии. В процессе наблюдения оцениваются первичная и вторичные конечные точки в группах инвазивной и консервативной стратегий. Данные каждого участника заносятся в специально разработанные для каждого визита индивидуальные регистрационные карты пациента. Пациент может прекратить участие в исследовании в любой момент и без объяснения причин. Планируемые сроки включения в исследование: до декабря 2025г.
Параметры оценки эффективности. Соотношение ПЖ к ЛЖ определяется посредством трансторакальной ЭхоКГ. Подсчет производится путем измерения конечного диастолического размера ПЖ и ЛЖ на уровне базальных сегментов в апикальной четырехкамерной позиции. В качестве параметров гемодинамической нестабильности в соответствии с рекомендациями Европейского общества кардиологов были определены следующие состояния: необходимость в сердечно-легочной реанимации, обструктивный шок, персистирующая гипотензия [1]. В рамках оценки эффективности также проводится анализ показателей МСКТ-АПГ, включая индекс Кванадли [18], индекс Score [19], подсчет числа легочных сегментов с дефицитом перфузии (c применением двухэнергетической компьютерной томографии).
Параметры оценки безопасности. Для стратификации тяжести геморрагических событий выбрана классификация Международного общества тромбоза и гемостаза, согласно которой кровотечение классифицируется как "большое" в случае фатального кровотечения или симптомного кровотечения в критической области или органе (внутричерепное, внутриспинальное, забрюшинное и иные виды кровоизлияний) или кровотечение, вызывающее снижение уровня на ≥20 г/л, что требует трансфузии не менее 2 доз цельной крови или эритроцитов [20].
Конечные точки. Первичной конечной точкой выбрано снижение ПЖ/ЛЖ на ≥20% от исходного через 48±6 ч после инициации терапии. В качестве вторичных конечных точек будут анализироваться: гемодинамическая декомпенсация пациента, большие кровотечения по классификации ISTH, снижение индекса Кванадли через 48 ч, степень резидуального тромбоза с перфузионным дефицитом на месяце 3-6, частота формирования посттромбоэмболического синдрома на месяце 3-6, 30-дневная, 90-дневная и годичная летальность.
Статистический анализ. Необходимый размер выборки был рассчитан по первичной точке — соотношению диаметра ПЖ/ЛЖ. Предполагается меньшее соотношение ПЖ/ЛЖ у пациентов группы исследования, чем в группе сравнения через 48 ч от начала лечения. Таким образом, будет проверяться гипотеза о превосходстве (superiority) эффективности лечения в группе исследования над группой сравнения [21]. Результаты расчетов проверены на публичном онлайн калькуляторе 1. Согласно выполненным расчетам, для superiority сравнения значений соотношения ПЖ/ЛЖ достаточно набрать по 50 пациентов в каждой группе для уровня превосходства (superiority margin) 0,1 при стандартных отклонениях 0,3 и средних значениях ПЖ/ЛЖ 1,03 и 1,28, соответственно, в группе исследования и в группе сравнения, 5% ошибке первого рода и 80% мощности. Статистическая обработка полученных данных будет проведена с использованием стандартных методов описательной статистики. Данные, не согласованные с нормальным распределением, будут представлены в виде медианы и межквартильного интервала — Ме [ 25%; 75%], нормальные показатели будут описаны как среднее ± стандартное отклонение — СРЕД±СО. Качественные (бинарные) данные будут представлены в виде частот — в абсолютном количестве и процентах — n (%). Будут оценены клинико-лабораторные ассоциации, а также ассоциации с исходами (построение кривых выживаемости Каплана-Мейера в подгруппах). Посредством многофакторного логистического регрессионного анализа будет оценена ассоциация клинико-лабораторных и анамнестических параметров (включая проводимое лечение) с частотой развития различных вариантов посттромбоэмболического синдрома. Показатель р<0,05 будет считаться значимым.
Обсуждение
В настоящее время инициировано большое количество исследований, изучающих применение СТТ у пациентов с ТЭЛА промежуточно-высокого риска летальности2 [22-25]. Однако лишь в единичных работах используются стандартные инфузионные катетеры. Одним из наиболее крупных исследований, сравнивающих ультразвуковой и неультразвуковой тромболизис, является исследование SUNSET sPE, в котором показано снижение индекса Миллера на 21±13% для ультразвукового тромболизиса и на 22±13% для селективного тромболизиса с использованием инфузионных катетеров (р=0,77) [22]. В исследовании, проведенном Liang NL, et al., и включившем 63 пациента, также показана не меньшая эффективность СТТ с использованием стандартных устройств в отношении выживаемости, соотношения ПЖ/ЛЖ и длительности стационарного лечения [23]. Вместе с тем в приведенных работах для неультразвукового тромболизиса используются инфузионные катетеры, незарегистрированные на территории Российской Федерации. Катетер типа PigTail применялся в исследовании PERFECT, субанализ которого показал сопоставимое снижение уровня легочной гипертензии как в группе ультразвукового, так и не ультразвукового тромболизиса [24]. В связи с этим фактом и доступностью в настоящем исследовании используется катетер типа PigTail.
Несмотря на убедительные доказательства эффективности и безопасности СТТ, на сегодня доза и длительность введения тромболитического препарата не регламентированы. В большинстве проводимых в настоящее время исследований общая доза вводимой алтеплазы не превышает 25 мг3 [25]. В зарубежных работах прослеживается тенденция к снижению доз и длительности введения тромболитика [26][27]. Однако открытым остается вопрос, возможно ли подобное снижение дозы при использовании неультразвуковых катетеров для фрагментации тромбов. По результатам проведенного нами ранее ретроспективного анализа применения СТТ средняя доза вводимой алтеплазы составила 50 мг, при этом отмечался повышенный риск геморрагических осложнений [28]. Опираясь на полученные данные, а также дизайн исследования SUNSET sPE, в качестве максимальной была выбрана доза алтеплазы 20 мг.
Важным аспектом лечения пациента с ТЭЛА является его наблюдение и дообследование после перенесенного эпизода острой тромбоэмболии. Показано, что у половины пациентов в дальнейшем сохраняются жалобы на одышку или плохую переносимость физических нагрузок, в 50% случаев имеет место та или иная степень персистирующих дефектов перфузии, а у части больных есть признаки дисфункции ПЖ по данным ЭхоКГ [29]. Все эти нарушения объединены понятием посттромбоэмболический синдром, крайним проявлением которого является хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) — орфанное заболевание с крайне неблагоприятным прогнозом. Так, по данным крупного проспективного наблюдательного исследования FOCUS, включившего 1098 пациентов, перенесших ТЭЛА, частота развития посттромбоэмболического синдрома достигала 16%, при этом ХТЭЛГ развивалась в 2,3% случаев. Отмечено, что пациенты с посттромбоэмболическим синдромом были старше, чаще имели индекс sPESI >0 и относились к категории промежуточного (а не к категории низкого) риска ТЭЛА в острой фазе заболевания [30].
В ранних исследованиях изучалась протективная роль тромболитической терапии в развитии отдаленных осложнений ТЭЛА. Так, в небольшом (n=40) рандомизированном исследовании, где сравнивались системный тромболизис и антикоагулянтная терапия у пациентов с ТЭЛА, получены данные о стойком улучшении легочной перфузии и более высокой диффузионной способности легких в течение 12 мес. наблюдения в группе тромболитической терапии [31]. Есть основания полагать, что использование транскатетерных технологий в лечении ТЭЛА позволит снизить частоту правожелудочковой дисфункции в долгосрочной перспективе [32]. Так, по результатам метаанализа, обобщившего данные 3920 пациентов, распространенность правожелудочковой дисфункции была ниже у пациентов, получавших тромболитическую терапию (0,17 (0,00, 0,44) в течение 1 года при системном тромболизисе и 0,07 (0,01, 0,19) при транскатетерном тромболизисе), чем у пациентов, получавших только антикоагулянтную терапию (0,24 (0,11, 0,37) в течение 1 года) [33]. Вместе с тем, по результатам длительного (медиана 37,8 мес.) наблюдения пациентов, включенных в исследование PEITHO, не обнаружено значимых различий в частоте летальных исходов (20,3% и 18,0%, р=0,43), наличии стойкой одышки (36,0% и 30,1%, р=0,23), остаточной легочной гипертензии и/или правожелудочковой дисфункции, частоте развития ХТЭЛГ (2,1% и 3,2%, р=0,79) в группах пациентов промежуточно-высокого риска, получивших системную инфузию тенектеплазы и плацебо, соответственно [34]. Стоит отметить, что исследование имело ряд ограничений, таких как меньший объем долгосрочной выборки (ЭхоКГ данные были доступны лишь у 290 пациентов из 1005, включенных в исследование PEITHO), а также не установленные в ряде случаев причины летальных исходов среди наблюдаемых пациентов. Диагностический алгоритм при подозрении на ХТЭЛГ не был частью протокола исследования, что делает невозможным установление истинной частоты развития ХТЭЛГ в наблюдаемой популяции.
Klok FA, et al., изучавшие данные 772 пациентов, перенесших ТЭЛА, посредством многофакторной логистической регрессии выявили 6 переменных, независимо связанных с развитием ХТЭЛГ, что в дальнейшем легло в основу шкалы ее прогнозирования. Одной из этих переменных стала быстрая реперфузия (системный тромболизис или эмболэктомия) в дебюте ТЭЛА, которая была статистически значимо связана со снижением частоты развития ХТЭЛГ [35].
Таким образом, имеющиеся в настоящее время данные носят противоречивый характер, имеются лишь отдельные наблюдения в отношении частоты развития посттромбоэмболического синдрома на фоне применения транскатетерных технологий в группе пациентов промежуточно-высокого риска. Отличительной чертой настоящего исследования станет долгосрочное (в течение 12 мес.) наблюдение пациентов с оценкой отдаленных последствий легочной эмболии при использовании антикоагулянтной терапии и СТТ.
Заключение
Проводимое исследование предоставит важные клинические данные в отношении краткосрочной и долгосрочной эффективности и безопасности различных лечебных подходов у пациентов с тромбоэмболией промежуточно-высокого риска летального исхода.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Интернет ресурс со свободным доступом: http://powerandsamplesize.com/Calculators/Compare-2-Means/2-Sample-Non-Inferiority-or-Superiority, дата последнего посещения 19.10.2023.
2. NCT03854266. Low Dose Catheter Directed Thrombolysis for Acute Pulmonary Embolism (BETULA). https://classic.clinicaltrials.gov/ct2/show/NCT03854266 (first received February 26, 2019).
3. NCT04088292. Low Dose Thrombolysis, Ultrasound Assisted Thrombolysis or Heparin for Intermediate High Risk Pulmonary Embolism (STRATIFY). https://classic.clinicaltrials.gov/ct2/show/NCT04088292 (first received September 12, 2019).
NCT05111613. The PEERLESS Study (PEERLESS). https://classic.clinicaltrials.gov/ct2/show/NCT05111613 (first received November 8, 2021).
NCT05493163. Catheter-directed Thrombolysis in Intermediate-high Risk Acute Pulmonary Embolism (PRAGUE-26). https://classic.clinicaltrials.gov/ct2/show/NCT05493163 (first received August 9, 2022).
Список литературы
1. Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603. doi: 10.1093/eurheartj/ehz405.
2. Bryce YC, Perez-Johnston R, Bryce EB, et al. Pathophysiology of right ventricular failure in acute pulmonary embolism and chronic thromboembolic pulmonary hypertension: a pictorial essay for the interventional radiologist. Insights Imaging. 2019;10(1):18. doi: 10.1186/s13244-019-0695-9.
3. Bristow MR, Zisman LS, Lowes BD, et al. The pressure-overloaded right ventricle in pulmonary hypertension. Chest. 1998;114(1 Suppl):101S-106S. doi: 10.1378/chest.114.1_supplement.101s.
4. McIntyre KM, Sasahara AA. The hemodynamic response to pulmonary embolism in patients without prior cardiopulmonary disease. Am J Cardiol. 1971;28(3):288-94. doi: 10.1016/0002-9149(71)90116-0.
5. Marcus JT, Gan CT, Zwanenburg JJ, et al. Interventricular mechanical asynchrony in pulmonary arterial hypertension: left-to-right delay in peak shortening is related to right ventricular overload and left ventricular underfilling. J Am Coll Cardiol. 2008;51(7): 750-7. doi: 10.1016/j.jacc.2007.10.041.
6. Bĕlohlávek J, Dytrych V, Linhart A. Pulmonary embolism, part I: Epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis and nonthrombotic pulmonary embolism. Exp Clin Cardiol. 2013;18(2):129-38.
7. Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015;36(10): 605-14. doi: 10.1093/eurheartj/ehu218.
8. Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a metaanalysis. JAMA. 2014;311(23):2414-21. doi: 10.1001/jama.2014.5990.
9. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediaterisk pulmonary embolism. N Engl J Med. 2014;370(15):1402-11. doi: 10.1056/NEJMoa1302097.
10. Черепанова Н. А., Подлипаева А. А., Андреева Е. С. и др. Тромболитическая терапия в сравнении с нефракционированным гепарином в лечении гемодинамически стабильных пациентов с тромбоэмболией легочной артерии: систематический обзор и метаанализ. Российский кардиологический журнал. 2022;27(3S):5120. doi: 10.15829/1560-4071-2022-5120.
11. Bishay VL, Adenikinju O, Todd R. FlowTriever Retrieval System for the treatment of pulmonary embolism: overview of its safety and efficacy. Expert Rev Med Devices. 2021;18(11):1039-48. doi: 10.1080/17434440.2021.1982379.
12. Sista AK, Horowitz JM, Tapson VF, et al. Indigo Aspiration System for Treatment of Pulmonary Embolism: Results of the EXTRACT-PE Trial. JACC Cardiovasc Interv. 2021;14(3): 319-29. doi: 10.1016/j.jcin.2020.09.053.
13. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: The SEATTLE II Study. JACC Cardiovasc Interv. 2015;8(10):1382-92. doi: 10.1016/j.jcin.2015.04.020.
14. D'Auria S, Sezer A, Thoma F, et al. Outcomes of catheter-directed thrombolysis vs. standard medical therapy in patients with acute submassive pulmonary embolism. Pulm Circ. 2020;10(1):2045894019898368. doi: 10.1177/2045894019898368.
15. Pruszczyk P, Klok FA, Kucher N, et al. Percutaneous treatment options for acute pulmonary embolism: a clinical consensus statement by the ESC Working Group on Pulmonary Circulation and Right Ventricular Function and the European Association of Percutaneous Cardiovascular Interventions. EuroIntervention. 2022;18(8):e623-e638. doi: 10.4244/EIJ-D-22-00246.
16. Kucher N, Boekstegers P, Müller OJ, et al. Randomized, controlled trial of ultrasoundassisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation. 2014;129(4):479-86. doi: 10.1161/CIRCULATIONAHA.113.005544.
17. Giri J, Sista AK, Weinberg I, et al. Interventional Therapies for Acute Pulmonary Embolism: Current Status and Principles for the Development of Novel Evidence: A Scientific Statement From the American Heart Association. Circulation. 2019;140(20):e774-e801. doi: 10.1161/CIR.0000000000000707.
18. Qanadli SD, El Hajjam M, Vieillard-Baron A, et al. New CT index to quantify arterial obstruction in pulmonary embolism: comparison with angiographic index and echocardiography. AJR Am J Roentgenol. 2001;176(6):1415-20. doi: 10.2214/ajr.176.6.1761415.
19. Leone MB, Giannotta M, Palazzini M, et al. A new CT-score as index of hemodynamic changes in patients with chronic thromboembolic pulmonary hypertension. Radiol Med. 2017;122(7):495-504. doi: 10.1007/s11547-017-0750-x.
20. Schulman S, Kearon C; Subcommittee on Control of Anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost. 2005;3(4):692-4. doi: 10.1111/j.1538-7836.2005.01204.x.
21. Lesaffre E. Superiority, equivalence, and non-inferiority trials. Bull NYU Hosp Jt Dis. 2008;66(2):150-4.
22. Avgerinos ED, Jaber W, Lacomis J, et al. Randomized Trial Comparing Standard Versus Ultrasound-Assisted Thrombolysis for Submassive Pulmonary Embolism: The SUNSET sPE Trial. JACC Cardiovasc Interv. 2021;14(12):1364-73. doi: 10.1016/j.jcin.2021.04.049.
23. Liang NL, Avgerinos ED, Marone LK, et al. Comparative Outcomes of UltrasoundAssisted Thrombolysis and Standard Catheter-Directed Thrombolysis in the Treatment of Acute Pulmonary Embolism. Vasc Endovascular Surg. 2016;50(6):405-10. doi: 10.1177/1538574416666228.
24. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Initial Results From a Prospective Multicenter Registry. Chest. 2015;148(3):667-73. doi: 10.1378/chest.15-0119.
25. Klok FA, Piazza G, Sharp ASP, et al. Ultrasound-facilitated, catheter-directed thrombolysis vs anticoagulation alone for acute intermediate-high-risk pulmonary embolism: Rationale and design of the HI-PEITHO study. Am Heart J. 2022;251:43-53. doi: 10.1016/j.ahj.2022.05.011.
26. Tapson VF, Sterling K, Jones N, et al. A Randomized Trial of the Optimum Duration of Acoustic Pulse Thrombolysis Procedure in Acute Intermediate-Risk Pulmonary Embolism: The OPTALYSE PE Trial. JACC Cardiovasc Interv. 2018;11(14):1401-10. doi: 10.1016/j.jcin.2018.04.008.
27. Sterling KM, Goldhaber SZ, Sharp ASP, et al. Prospective Multicenter International Registry of Ultrasound-Facilitated Catheter-Directed Thrombolysis in IntermediateHigh and High-Risk Pulmonary Embolism (KNOCOUT PE). Circ Cardiovasc Interv. 2024;17(3):e013448. doi: 10.1161/CIRCINTERVENTIONS.123.013448.
28. Пархоменко С. И., Лапшин К. Б., Глебовская Т. Д. и др. Тромбоэмболия легочной артерии: возможности интервенционного лечения в группе промежуточно-высокого риска. Артериальная гипертензия. 2023;29(3):306-19. doi: 10.18705/1607-419X-2023-29-3-306-319.
29. Klok FA, Hoeper MM. Predicting recurrent pulmonary embolism and chronic thromboembolic pulmonary hypertension: one more way to skin the cat. Eur Respir J. 2017;49(5):1700413. doi: 10.1183/13993003.00413-2017.
30. Valerio L, Mavromanoli AC, Barco S, et al. Chronic thromboembolic pulmonary hypertension and impairment after pulmonary embolism: the FOCUS study. Eur Heart J. 2022;43(36):3387-98. doi: 10.1093/eurheartj/ehac206.
31. Sharma GV, Burleson VA, Sasahara AA. Effect of thrombolytic therapy on pulmonarycapillary blood volume in patients with pulmonary embolism. N Engl J Med. 1980;303(15):842-5. doi: 10.1056/NEJM198010093031502.
32. Matusov Y, Yaqoob M, Karumanchi A, et al. Long term recovery of right ventricular function after treatment of intermediate and high risk pulmonary emboli. Thromb Res. 2023;225:57-62. doi: 10.1016/j.thromres.2023.03.012.
33. Wang D, Fan G, Zhang X, et al. Prevalence of long-term right ventricular dysfunction after acute pulmonary embolism: a systematic review and meta-analysis. EClinicalMedicine. 2023;62:102153. doi: 10.1016/j.eclinm.2023.102153.
34. Konstantinides SV, Vicaut E, Danays T, et al. Impact of Thrombolytic Therapy on the Long-Term Outcome of Intermediate-Risk Pulmonary Embolism. J Am Coll Cardiol. 2017;69(12):1536-44. doi: 10.1016/j.jacc.2016.12.039.
35. Klok FA, Dzikowska-Diduch O, Kostrubiec M, et al. Derivation of a clinical prediction score for chronic thromboembolic pulmonary hypertension after acute pulmonary embolism. J Thromb Haemost. 2016;14(1):121-8. doi: 10.1111/jth.13175.
Об авторах
М. А. СимаковаРоссия
к.м.н., руководитель, c.н.с. научно-исследовательской кардиоонкологии научного центра мирового уровня «Центр персонализированной медицины»
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
С. И. Пархоменко
Россия
врач-кардиолог, аспирант кафедры кардиологии
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
К. Б. Лапшин
Россия
зав. отделением анестезиологии-реанимации с палатами реанимации и интенсивной терапии № 14
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
Т. Д. Глебовская
Россия
к.м.н., зав. отделением анестезиологии и реанимации № 6
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
Д. В. Карпова
Россия
зав. отделением лучевой диагностики №1, врач-рентгенолог
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
К. Н. Маликов
Россия
м.н.с. научно-исследовательской лаборатории интервенционной хирургии, врач функциональной диагностики
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
Е. Л. Урумова
Россия
м.н.с. научно-исследовательской группы кардиоонкологии, научного центра мирового уровня «Центр персонализированной медицины», врач функциональной диагностики
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
А. В. Березина
Россия
д.м.н., главный научный сотрудник научно-исследовательской лаборатории кардиопульмонального тестирования; старший научный сотрудник научно-исследовательской группы кардиоонкологии научного центра мирового уровня «Центр персонализированной медицины»
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
Д. Д. Зубарев
Россия
к.м.н., заведующий отделением рентгенохирургических методов диагностики и лечения, научный сотрудник научно-исследовательской лаборатории интервенционной хирургии
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
Н. В. Марукян
Россия
м.н.с. научно-исследовательской лаборатории интервенционной хирургии, врач рентгенэндоваскулярный хирург
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
О. М. Моисеева
Россия
д.м.н., заведующая научно-исследовательским отделом некоронарогенных заболеваний сердца
Санкт-Петербург
Конфликт интересов:
Конфликт интересов не заявляется
Дополнительные файлы
- Нормотензивные пациенты с тромбоэмболией легочной артерии (ТЭЛА) промежуточно-высокого риска 30-дневной летальности имеют высокий риск гемодинамической декомпенсации в первые 72 ч пребывания в стационаре.
- Использование системного тромболизиса в данной группе пациентов ограничено высоким числом геморрагических осложнений.
- Исследование позволит оценить влияние селективного транскатетерного тромболизиса на краткосрочный и долгосрочный прогноз пациентов с ТЭЛА промежуточно-высокого риска летальности.
Рецензия
Для цитирования:
Симакова М.А., Пархоменко С.И., Лапшин К.Б., Глебовская Т.Д., Карпова Д.В., Маликов К.Н., Урумова Е.Л., Березина А.В., Зубарев Д.Д., Марукян Н.В., Моисеева О.М. Оценка эффективности транскатетерного низкодозового тромболизиса у пациентов с тромбоэмболией легочной артерии промежуточно-высокого риска. Обоснование и дизайн исследования. Российский кардиологический журнал. 2025;30(3):6060. https://doi.org/10.15829/1560-4071-2025-6060. EDN: HDSXKQ
For citation:
Simakova M.A., Parkhomenko S.I., Lapshin K.B., Glebovskay T.D., Karpova D.V., Malikov K.N., Urumova E.L., Berezina A.V., Zubarev D.D., Marukyan N.V., Moiseeva O.M. Efficacy of transcatheter low-dose thrombolysis in patients with intermediate-high risk pulmonary embolism. Study rationale and design. Russian Journal of Cardiology. 2025;30(3):6060. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6060. EDN: HDSXKQ

















































