Перейти к:
Проблема малого объема левого желудочка при выполнении транскатетерного протезирования аортального клапана: серия клинических случаев
https://doi.org/10.15829/1560-4071-2025-6043
EDN: FCZVMU
Аннотация
Современные методы лечения тяжелого стеноза аортального клапана включают в себя не только открытую хирургическую операцию, но и малоинвазивную транскатетерную имплантацию аортального клапана (ТИАК). Однако, несмотря на уменьшение перипроцедурных осложнений ТИАК с увеличением опыта хирургов, остается до конца не освещенной проблема вмешательств у пациентов с синдромом малого объема левого желудочка.
Известно, что при прогрессировании аортального стеноза левый желудочек может претерпевать концентрическое ремоделирование с гипертрофией миокарда, что приводит к уменьшению не только ударного объема, но и развитию диастолической дисфункции из-за увеличения ригидности стенки. Как результат, такой фенотип левого желудочка, особенно в сочетании с высокой легочной гипертензией, слабо устойчив к гемодинамическим перегрузкам, что несет повышенный риск интраоперационной летальности. В нашей работе представлены 3 клинических случая проведения ТИАК у схожих пациентов с малым объемом левого желудочка, в которых использованы различные модификации алгоритмов вмешательства.
Ключевые слова
Для цитирования:
Прохорихин А.А., Кукушкина Ю.В., Зубарев Д.Д., Горбатых А.В., Лапшин К.Б. Проблема малого объема левого желудочка при выполнении транскатетерного протезирования аортального клапана: серия клинических случаев. Российский кардиологический журнал. 2025;30(10S):6043. https://doi.org/10.15829/1560-4071-2025-6043. EDN: FCZVMU
For citation:
Prokhorikhin A.A., Kukushkina Yu.V., Zubarev D.D., Gorbatykh A.V., Lapshin K.B. Problem of small left ventricular volume during transcatheter aortic valve replacement: a case series. Russian Journal of Cardiology. 2025;30(10S):6043. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6043. EDN: FCZVMU
Введение
TAVI/TAVR или транскатетерная имплантация аортального клапана (ТИАК) — представляет собой малоинвазивный метод лечения пациентов с тяжелым аортальным стенозом (АС), являющийся аналогом открытому хирургическому вмешательству. Этиология и патогенез АС хорошо изучены, и как известно, в течение заболевания происходит утолщение стенок левого желудочка (ЛЖ) за счет концентрической гипертрофии, что, в свою очередь, приводит к уменьшению полости ЛЖ, повышенному конечно-диастолическому давлению и низкому ударному объему. Дальнейшие изменения ЛЖ связаны с декомпенсацией: дилатацией, падением фракции выброса (ФВ) и развитием тяжелой хронической сердечной недостаточности (ХСН). Критериями эхокардиографии (ЭхоКГ) диагностики синдрома малого объема ЛЖ (СМОЛЖ), сопряженного с АС, являются: эффективная площадь отверстия (EOA) <1 cм2, максимальная трансаортальная скорость потока (V max) ≥4 м/c, средний градиент на аортальном клапане (АК) (G mean) ≥40 мм рт.ст., индекс EOA ≤0,6 cм/м2, индекс ударного объема ЛЖ <35 мл/м2, ФВ ≥50%. Также прогностически важен сниженный индекс глобальной функции ЛЖ (≤21,7%) [1][2].
Вопреки распространенному мнению о больших рисках ТИАК у пациентов с низкой ФВ, вмешательство у пациентов с сохранной ФВ и гиперконтрактильным статусом ЛЖ также ассоциируется с повышенным риском хирургической летальности [3][4]. По данным литературного обзора Owais T, et al., одной из основных причин, ведущих к развитию подобных осложнений, является малая полость ЛЖ [5]. В исследовании Siato T, et al. у пациентов с СМОЛЖ отмечается повышенный риск смерти от всех причин в течение 30 дней, чаще развивается клинически зарегистрированный инсульт, кровотечение, парапротезная регургитация. Также нередко появляется необходимость перехода в открытую операцию [6].
На основании приведенных в данной публикации 3 клинических случаев ТИАК у пациентов с СМОЛЖ, предлагаются модификации интервенционного вмешательства [7].
Клинические случаи
Пациент 1
Пациентка А., 83 года, поступила 31.08.2023 для оперативного лечения тяжелого АС. Из анамнеза известно о длительном течении ишемической болезни сердца (ИБС) и артериальной гипертензии (АГ) с повышением артериального давления (АД) до 250/120 мм рт.ст. Также в течение последних 3 лет имелись проявления клиники ХСН с сохранной ФВ II функционального класса, сопровождающиеся отеками на голенях. Необходимо отметить важную анатомическую особенность пациентки — выраженный кифосколиоз 3 степени с соответствующими изменениями грудного отдела позвоночника и грудной клетки. Нарушений ритма и проводимости по данным электрокардиографией (ЭКГ) ранее не выявлялось. В рамках предоперационного обследования по протоколу ТИАК пациентке были выполнены мультиспиральная компьютерная томография (МСКТ)-ангиография аорты, селективная коронарография, ЭхоКГ, ЭКГ.
Основной диагноз: ХСН 2 стадии, с сохранной ФВ, II функционального класса по NYHA. Легочная гипертензия 3 степени.
По данным ЭхоКГ был выявлен выраженный АС со следующими показателями: ФВ ЛЖ 65%, V max 4,9 м/с, пиковый трансклапанный градиент (G max) 80 мм рт.ст., G mean — 46 мм рт.ст., EOA 1,27 см2. Выраженная гипертрофия миокарда — толщина базальной части межжелудочковой перегородки: 15 мм. Ударный объем ЛЖ — 42 мл. Митральная регургитация 2-3 ст. Расчетное систолическое давление в легочной артерии (РСДЛА) выраженно повышено до 90 мм рт.ст. (легочная гипертензия 3 степени).
Учитывая выраженные кифосколиотические изменения позвоночника, существенное снижение функций почек (хроническая болезнь почек С3б), левожелудочковую недостаточность, легочная гипертензия 3 степени, малый размер фиброзного кольца, риск периоперационных осложнений кардиохирургического вмешательства крайне высок — прогнозируемая летальность по EuroSCORE II 5,73%, в связи с чем пациентке было рекомендовано выполнение транскатетерного протезирования АК в плановом порядке. Абсолютных противопоказаний к выполнению процедуры ТИАК не было выявлено. Для планирования ТИАК была выполнена МСКТ-ангиография аорты: КТ-картина умеренного кальцинирования трехстворчатого АК. Периметр фиброзного кольца — 66,0 мм, диаметр — 29,0×26,5 мм. Согласно вышеуказанным анатомическим критериям, было решено выполнить имплантацию протеза "ACURATE Neo 2" — 23 мм (Boston Scientific).
Описание операции
Процедура ТИАК выполнялась по стандартной методике, принятой в нашем центре (рис. 1, 2). Поскольку согласно инструкции производителя перед имплантацией выбранного вида протеза необходимо выполнить предварительную вальвулопластику АК, была выполнена предилатация баллонным катетером 20×40 мм. После выполнения вальвулопластики у пациентки развилась тяжелая аортальная регургитация c падением гемодинамики до систолического АД 40 мм рт.ст. Поэтому было принято решение оперативного заведения, позиционирования и имплантации "ACURATE Neo 2" диаметром 23 мм в аортальную позицию с целью купирования регургитации и стабилизации гемодинамики. Однако после имплантации протеза состояние пациентки продолжило ухудшаться — развилась фибрилляция желудочков. Дальнейшие реанимационные мероприятия в течение 40 мин — без успеха. При аортографии отмечалось отсутствие подвижности створок протеза с сохраняющейся тяжелой регургитацией. После чего была констатирована биологическая смерть больной.
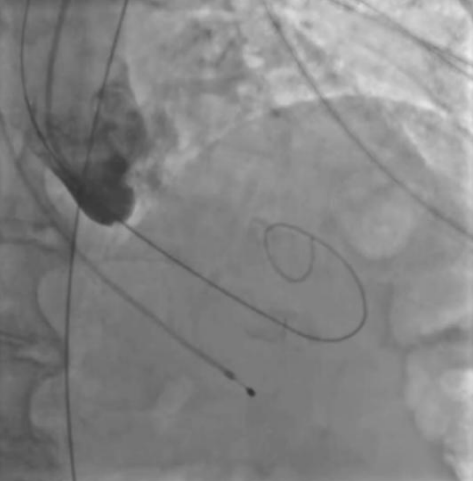
Рис. 1. Пациентка А. Ангиография корня аорты — аортальная регургитация после баллонной предилатации.
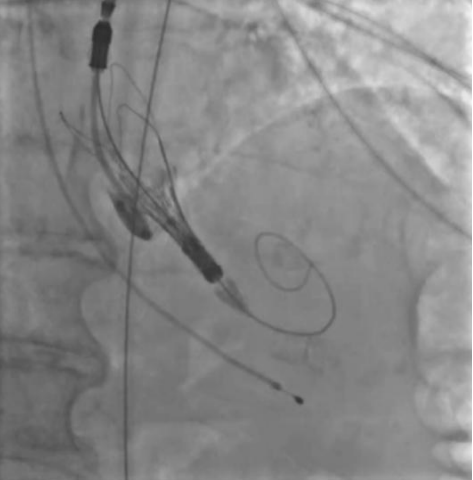
Рис. 2. Пациентка А. В момент проведения протеза визуализируется массивная аортальная регургитация.
При аутопсийном исследовании были обнаружены признаки атеросклеротического порока АК, состоятельный протез в позиции АК. Признаки ИБС в виде атеросклероза коронарных артерий без значимых стенозов; фибрилляции желудочков в виде пустых камер сердца и крупных сосудов, корковый некроз почек, в миокарде — фрагментация мышечных волокон, участки разрыва мышечных волокон, множественные контрактуры, участки свежих кровоизлияний; сердечной недостаточности — венозное полнокровие и дистрофия печени и почек; гипертонической болезни. Непосредственной причиной смерти была определена острая левожелудочковая недостаточность (фибрилляция желудочков).
Пациент 2
Пациентка Б., 88 лет, поступила 27.11.2023 с жалобами на одышку при неспешной ходьбе на расстояние 300-400 м с нарастанием симптомов в последний год. Из анамнеза жизни известно, что она длительно страдает АГ III степени. По данным ЭхоКГ от января 2023г был впервые поставлен диагноз АС.
Основной диагноз: ХСН 1 стадии, с сохранной ФВ, II функционального класса по NYHA.
По данным ЭхоКГ был выявлен выраженный АС (3 степени) по следующим показателям: ФВ ЛЖ 50%, V max 87 мм рт.ст., G mean 53 мм рт.ст., максимальная скорость аортальной струи 4,7 м/с, EOA 0,5 см2. Ударный объем ЛЖ — 32 мл. Выявлен СМОЛЖ. Аортальная регургитация 1 степени. Диффузное нарушение сократимости миокарда ЛЖ. Митральная регургитация 2-3 степени. РСДЛА 27 мм рт.ст.
Учитывая сочетанный клапанный порок: митральная недостаточность 2-3 степени и тяжелый АС с пиковым градиентом 87 мм рт.ст., а также диффузный гипокинез миокарда с нарушением проводимости по левой ножке пучка Гиса и желудочковая экстрасистолия 3 градации по Ryan, АГ III степени, прогнозируемая смертность по EuroSCORE II — 3,37%, что классифицируется как низкий риск. Однако в связи с возрастом, тяжестью основного заболевания и коморбидным фоном, определены показания к транскатетерному протезированию АК в плановом порядке. По данным МСКТ-ангиографии аорты: периметр фиброзного кольца — 68,6 мм, диаметр — 19×24 мм. Соответственно, был выбран самораскрывающийся клапан "ACURATE Neo 2" с диаметром — 23 мм (Boston Scientific).
Описание операции
Процедура ТИАК выполнялась по стандартной методике, принятой в нашем центре, за исключением этапа предилатации, который был сознательно пропущен с целью предотвращения развития тяжелой аортальной регургитации (рис. 3-5). Были выполнены позиционирование и прямая имплантация биологического клапана "ACURATE Neo 2" 23 мм, впоследствии дополненная постдилатацией баллонным катетером "Valver" 20×40 мм. На контрольной аортографии: аортальная регургитация 0-1 степени. Коронарные артерии не скомпрометированы, коронарный кровоток удовлетворительный. После выполнения основного этапа операции интродьюсер из правой общей бедренной артерии удален, затем выполнено ушивание места доступа системой зашивающего устройства "ProGlide" (6F) и AngioSeal VIP (8F), наложен кожный шов. Интраоперационно и ранний послеоперационный период протекал без особенностей.
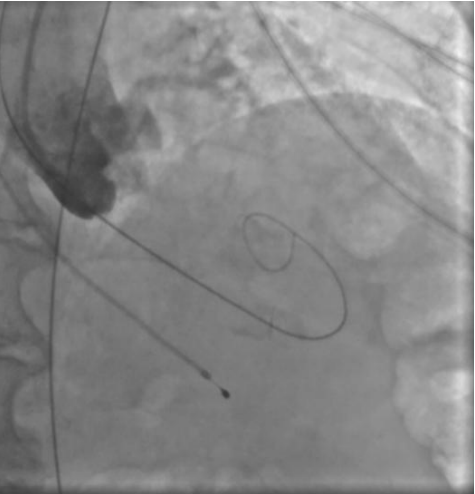
Рис. 3. Пациентка Б. Ангиография корня аорты: визуализируется минимальная регургитация.
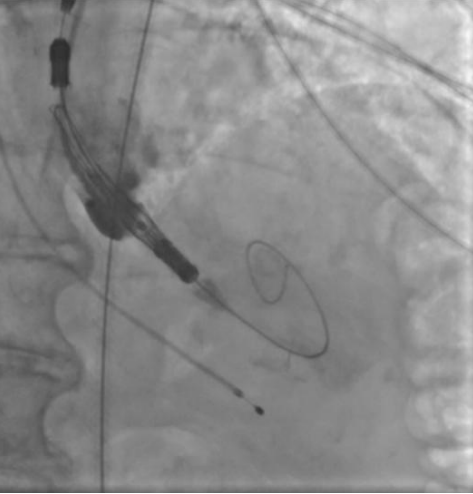
Рис. 4. Пациентка Б. Прямая имплантация протеза.
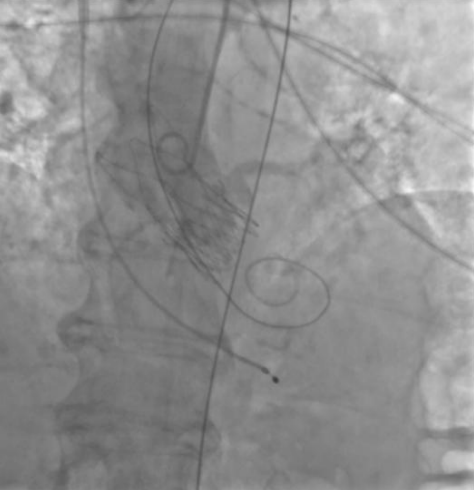
Рис. 5. Пациентка Б. Контрольная аортография.
Таблица 1
Основные характеристики гемодинамики пациентов
|
Показатель |
Пациентка А. |
Пациентка Б. |
Пациентка В. |
|
ФВ ЛЖ (%) |
65 |
50 |
63 |
|
Пиковый чересклапанный градиент (мм рт.ст.) |
80 |
87 |
129 |
|
Средний чересклапанный градиент (мм рт.ст.) |
46 |
53 |
86 |
|
Максимальная скорость аортальной струи (м/c) |
4,9 |
4,7 |
5,7 |
|
Эффективная площадь аортального клапана (см2) |
1,27 |
0,5 |
0,3 |
|
Индекс площади эффективного отверстия (см2/м2) |
0,9 |
0,29 |
0,16 |
|
Ударный объем левого желудочка (мл) |
42 |
32 |
50 |
|
Сопутствующие клапанные патологии |
митральная регургитация 2-3 степени |
митральная регургитация 2-3 степени |
митральная недостаточность 1-2 степени |
|
РСДЛА (мм рт.ст.) |
90 |
27 |
46 |
Сокращения: ФВ ЛЖ — фракция выброса левого желудочка, РСДЛА — расчетное систолическое давление в легочной артерии.
Инструментальные исследования в ранний послеоперационный период
По данным ЭхоКГ в аортальной позиции визуализируется биопротез без видимых признаков дисфункции. EOA — 2,04 см2. Транспротезная регургитация 0-1 ст.
Пациентка выписана на 3 сутки после операции.
Пациент 3
Пациентка В., 85 лет, поступила 15.05.2024 для плановой коррекции тяжелого АС. Из анамнеза жизни известно о длительном течении АГ III ст. риск 4, ИБС с атеросклерозом коронарных артерий и клиникой стенокардии напряжения 2-3 функционального класса, ХСН с сохранной ФВ, однократном пароксизме фибрилляции предсердий в 2023г. Открытую хирургическую операцию предполагалось проводить в условиях работы аппарата искусственного кровообращения с предварительной коронароангиографии, однако пациентка отказалась, в связи с чем консилиумом, с учетом возраста пациентки, было принято решение о выполнении ТИАК с предварительным стентированием.
Основной диагноз: ХСН 1 стадии, с сохранной ФВ, II-III функционального класса по NYHA. Легочная гипертензия 1-2 степени.
По данным ЭхоКГ был подтвержден тяжелый АС и недостаточность 1 степени: ФВ ЛЖ 63%, V max 5,7 м/с, пиковый трансклапанный градиент (G max) 129 мм рт.ст., G mean 86 мм рт.ст., EOA 0,3 см2, ударный объем ЛЖ 50 мл. Выраженный кальциноз створок АК и митрального клапана. Митральная недостаточность 1-2 степени. РСДЛА 46 мм рт.ст. Концентрическая гипертрофия ЛЖ.
По результатам ЭКГ было установлено нарушение межпредсердной проводимости, признаки увеличения левого предсердия. Для планирования ТИАК была выполнена МСКТ-ангиография аорты, где были выявлены выраженные проявления дегенеративных изменений створок АК. Размеры фиброзного кольца: диаметр — 25×17,5 мм, периметр 70,8 мм. Согласно вышеуказанным анатомическим критериям, было решено выполнить имплантацию протеза "ACURATE Neo 2" — 23 мм (Boston Scientific). Риск вмешательства с учетом сопутствующей патологии составил 4,64% (EuroSCORE II).
С учетом выбранной малоинвазивной тактики, предварительно была выполнена реваскуляризация миокарда в объеме ангиопластики со стентированием ствола левой коронарной артерии, огибающей артерии, передней межжелудочковой артерии, правой коронарной артерии.
Описание операции
Процедура ТИАК выполнялась по стандартной методике, принятой в нашем центре (рис. 6-9). После предилатации баллонным катетером "Valver" 18×40 мм возникло ухудшение гемодинамики за счет развития выраженной аортальной регургитации, проявившееся снижением диастолического АД до 20 мм рт.ст. В срочном порядке была выполнена имплантация "Acurate Neo2 S" диаметром 23 мм в аортальную позицию, после чего явления гипотонии и сердечной недостаточности были компенсированы. Коронарные артерии не были скомпрометированы. После выполнения основного этапа операции интродьюсер из правой общей бедренной артерии удален, затем выполнено ушивание места доступа системой зашивающего устройства "ProGlide" (6F) и AngioSeal VIP (6F), наложен кожный шов. Ход оперативного лечения без особенностей.
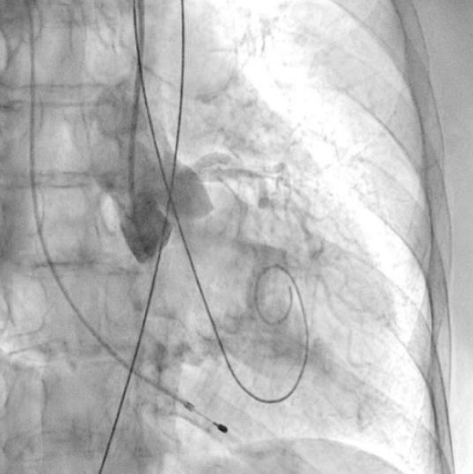
Рис. 6. Пациентка В. Ангиография корня аорты: визуализируется минимальная регургитация.
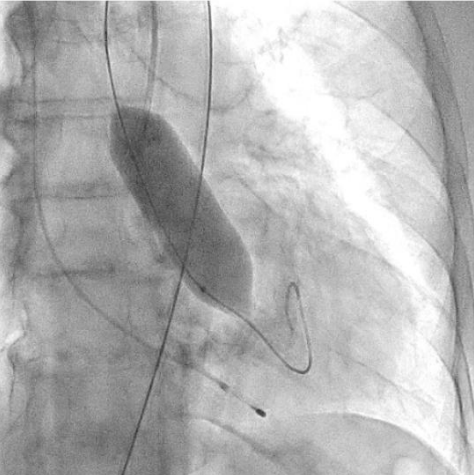
Рис. 7. Пациентка В. Баллонная предилатация.
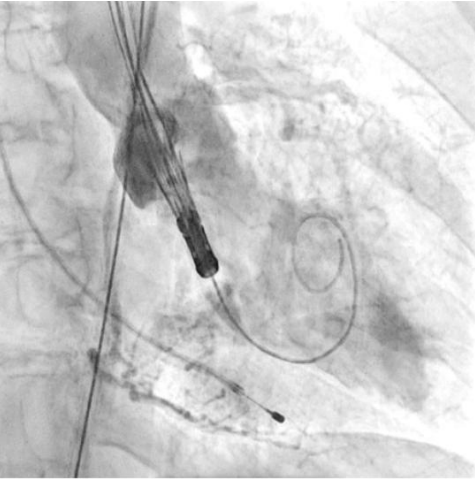
Рис. 8. Пациентка В. В момент проведения и позиционирования искусственного клапана визуализируется умеренная регургитация.
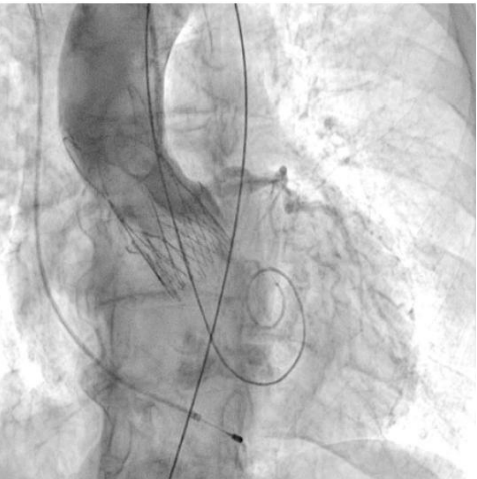
Рис. 9. Пациентка В. Контрольная ангиография.
Инструментальные исследования в ранний послеоперационный период
В послеоперационном периоде по данным ЭхоКГ нормально функционирующий биологический протез в аортальной позиции. V max — 2,0 см/с, средний градиент — 8,1 мм рт.ст. Парапротезная регургитация минимальная. Динамических изменений на ЭКГ не обнаружено.
Пациентка выписана на 5 сутки после операции.
Обсуждение
Накопленный опыт проведения ТИАК позволил расширить ее применение для пациентов с различным уровнем хирургического риска. Становится возможным решение более сложных клинических случаев, а оптимальный подход к разработке стратегии ведения и отбора пациентов для ТИАК позволяет эффективно минимизировать возникновение пери- и послеоперационных осложнений.
В представленных клинических случаях по данным ЭхоКГ у всех пациенток наблюдался феномен малого объема ЛЖ (табл. 1), однако подход к проведению оперативного вмешательства различался. Так, у первой пациентки причиной неудачной ТИАК послужила сложившаяся совокупность факторов. Развившийся гемодинамический коллапс можно объяснить тем, что, вероятно, произошла объемная перегрузка ЛЖ за счет возросшей аортальной регургитации (подтверждается при выполнении аортографии (рис. 1), что в сочетании с малой полостью и диастолической дисфункцией привело к молниеносному развитию острой левожелудочковой недостаточности. В Клинических рекомендациях по ХСН (2024) подчеркивают, что у пациентов с диастолической дисфункцией и малым объемом ЛЖ риск гемодинамического коллапса значительно возрастает, особенно при наличии сопутствующей легочной гипертензии [8]. В тот момент единственным возможным решением сложившейся ситуации стало быстрое заведение и установка биопротеза. Однако даже после имплантации клапана восстановления гемодинамики не произошло. При развитии подобного сценария выполняется продвинутая сердечно-легочная реанимация (СЛР), при этом краеугольным камнем успешной СЛР у пациентов после имплантации протеза является выполнение качественных компрессий, позволяющих создать достаточное пульсовое давление, необходимое для обеспечения запирательной функции протеза и разгрузки ЛЖ. К сожалению, наличие кифосколиотического изменения грудного отдела позвоночника не позволили выполнять эффективные компрессии ни мануально, ни с помощью механического устройства для непрямого массажа сердца, вследствие чего наступившая острая левожелудочковая недостаточность не была скомпенсирована работой протеза клапана, что и привело к летальному исходу. Данные аутопсии лишь подтверждают изложенную версию произошедших событий. Также нельзя исключить влияния сопутствующей желудочковой фибрилляции и выраженной легочной гипертензии на развитие неблагополучного течения ТИАК.
Во втором клиническом случае был учтен предыдущий опыт и изменена тактика проведения вмешательства у пациентки с аналогичным фенотипом ЛЖ. Исключение этапа баллонной вальвулопластики способствовало снижению риска перегрузки ЛЖ за счет аортальной регургитации. Таким образом, на всех этапах операции у второй пациентки сохранялась разграничительная функция нативного клапана или биопротеза. В третьем клиническом случае у пациентки наблюдался массивный кальциноз АК, что не позволяло исключить этап предилатации. Поэтому было принято решение выполнить щадящую вальвулопластику для обеспечения технической возможности проведения через АК системы доставки протеза. Тем не менее даже умеренная регургитация, появившаяся после этапа предилатации, негативно повлияла на гемодинамику пациентки, которая была скорректирована лишь после имплантации биопротеза. Таким образом, у пациентки удалось избежать выраженной объемной перегрузки ЛЖ, благодаря чему удалось успешно выполнить вмешательство, не прибегая к СЛР.
Исходя из нашего опыта, планируя ТИАК у пациентов с феноменом малого объема ЛЖ, мы предлагаем учитывать возможность развития объемной перегрузки ЛЖ и гемодинамического коллапса. Исходя из степени кальцинирования створок нативного АК, необходимо либо выполнять вальвулопластику баллонами малого диаметра (16-18 мм) при выраженном кальцинозе, чтобы обеспечить возможность проведения системы доставки, либо выполнять прямую имплантацию биопротеза с последующей постдилатацией/оптимизацией. В настоящее время при обзоре литературы нами не было найдено описания подобных клинических случаев или алгоритмов вмешательства.
Представленные нами особенности гемодинамики и связанные с этим риски не являются единственными для пациентов с феноменом малого объема ЛЖ. У таких пациентов также чаще встречаются перфорация стенки ЛЖ жестким проводником, полная атриовентрикулярная блокада и дислокация протеза [6][9]. Кроме того, описано редкое осложнение — "суицидальный левый желудочек", при котором имплантация протеза может вызывать обструкцию выводного отдела ЛЖ из-за обратного смещения межжелудочковой перегородки и развития SAM (systolic anterior motion)-синдрома [10][11]. Для предотвращения этого состояния рекомендуется активная инфузионная терапия (включая создание гиперволемии) в сочетании с бета-адреноблокаторами для снижения контрактильности миокарда.
При развитии гемодинамического коллапса ключевыми методами поддержки кровообращения остаются СЛР, прямой массаж сердца или экстренная установка экстракорпоральной мембранной оксигенации [12]. Для минимизации рисков, связанных с некачественными компрессиями, возможно использование автоматического устройства LUCAS [13]. Альтернативой является применение системы экстракорпоральной мембранной оксигенации, что позволяет выиграть время для перехода к открытому кардиохирургическому вмешательству, хотя это требует дополнительной подготовки пациента и операционной [14].
Наши наблюдения показывают, что пациенты с феноменом малого объема ЛЖ могут быть особенно уязвимы к осложнениям во время ТИАК. Это подчеркивает необходимость учета индивидуальных особенностей пациента при планировании вмешательства. Согласно клиническим рекомендациям Российской Федерации, ТИАК рекомендуется пациентам старше 75 лет или с высоким хирургическим риском (оценка по шкалам STS-PROM или EuroSCORE II >8%). При наличии у пациента ХСН и тяжелого АС с высоким градиентом давления (площадь клапана ≤1 см2 или ≤0,6 см2/м2, пиковая скорость кровотока ≥4 м/с, средний трансклапанный градиент ≥40 мм рт.ст.) предпочтение отдается либо ТИАК, либо хирургическому протезированию АК в условиях искусственного кровообращения [7]. Однако наши данные демонстрируют, что у пациентов с малым объемом ЛЖ даже выполнение стандартных рекомендаций может быть связано с повышенным риском гемодинамического коллапса. Это указывает на необходимость разработки дополнительных критериев отбора и индивидуализации подходов для данной группы пациентов. Таким образом, хотя клинические рекомендации предоставляют четкие ориентиры для отбора пациентов на ТИАК, они не учитывают специфические особенности пациентов с малым объемом ЛЖ. Наши данные подчеркивают важность исключения этапа баллонной вальвулопластики или использования баллонов малого диаметра для снижения риска объемной перегрузки ЛЖ. Мы полагаем, что эти подходы могут быть рассмотрены в будущих обновлениях рекомендаций для повышения безопасности процедуры у данной категории пациентов.
Заключение
Проблема ТИАК у пациентов с малым объемом ЛЖ на данный момент всё еще остается плохо изученной. В данной статье описаны клинические случаи, демонстрирующие различные подходы к проведению оперативного вмешательства и возникающие осложнения. Учитывая риск развития гемодинамического коллапса у таких пациентов, важно разработать эффективные стратегии лечения, включающие адаптацию операционных тактик и применение дополнительных методов поддержки. Модификация процедуры ТИАК без предварительной или с минимальной дилатацией может быть эффективным подходом к снижению риска интраоперационной летальности у пациентов с СМОЛЖ. Необходимо накопление клинического опыта для более глубокого понимания и оптимизации лечения таких пациентов.
Список литературы
1. Базылев В. В., Бабуков Р. М., Бартош Ф. Л., Лёвина А. В. Сравнительный анализ эхокардиографических показателей времени ускорения и соотношения времени ускорения к общему времени выброса левого желудочка с показателями катетеризации в оценке тяжести аортального стеноза у пациентов с Normal flow High Gradient. Медицинская визуализация. 2022;26(2):91-100. doi:10.24835/16070763-1006.
2. Ларина В. Н., Лунев В. И. Фенотипирование амбулаторных пациентов с сердечной недостаточностью с сохраненной фракцией выброса левого желудочка и неблагоприятным прогнозом. Российский кардиологический журнал. 2024;29(3):5759. doi:10.15829/1560-4071-2024-5759.
3. Reddy P, Chitturi KR, Merdler I, et al. The impact of ventricular remodeling on quality-oflife outcomes after Transcatheter aortic valve replacement. J Cardiol. 2025;85(6):494-9. doi:10.1016/j.jjcc.2024.10.001.
4. Al Balool J, Al Jarallah M, Rajan R, et al. Clinical outcomes of transcatheter aortic valve replacement stratified by left ventricular ejection fraction: A single centre pilot study. Ann Med Surg (Lond). 2022;77:103712. doi:10.1016/j.amsu.2022.103712.
5. Owais T, El Garhy M, Fuchs J, et al. Pathophysiological Factors Associated with Left Ventricular Perforation in Transcatheter Aortic Valve Implantation by Transfemoral Approach. J Heart Valve Dis. 2017;26(4):430-6.
6. Saito T, Inohara T, Yoshijima N, et al. Small left ventricle and clinical outcomes after transcatheter aortic valve replacement. J Am Heart Assoc. 2021;10(7): e019543. doi:10.1161/JAHA.120.019543.
7. Клименко А. А., Андрияшкина Д. Ю., Карпова Н. Ю., Кондрашов А. А. Ведение пациентов с аортальным стенозом: что нового в клинических рекомендациях 2023 года? РМЖ. 2024;3:2-6.
8. Галявич А. С., Терещенко С. Н., Ускач Т. М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. doi:10.15829/1560-4071-2024-6162.
9. Nasso G, Santarpino G, Contegiacomo G, et al. Perioperative left ventricular perforation in incomplete TAVI and completion of the procedure after surgical repair. J Cardiothorac Surg. 2022;17(1):171. doi:10.1186/s13019-022-01925-4.
10. Russo G, Taramasso M, Enriquez-Sarano M. Sudden Hemodynamic Collapse After Transcatheter Aortic Valve Replacement: Think Quick and Right. JACC Case Rep. 2023;29(2):102156. doi:10.1016/j.jaccas.2023.102156.
11. Weich HSH, John TJ, Joubert L, et al. Dynamic left ventricular outflow tract obstruction post–transcatheter aortic valve replacement. JACC Case Rep. 2021;3(6):871-4. doi:10.1016/j.jaccas.2021.04.035.
12. Gerfer S, Kuhn EW, Gablac H, et al. Outcomes and Characteristics of Patients with Intraprocedural Cardiopulmonary Resuscitation during TAVR. Thorac Cardiovasc Surg. 2023;71(2):101-6. doi:10.1055/s-0042-1750304.
13. Jensen PB, Andersen C, Nissen H. Transcatheter Aortic valve implantation in a patient with circulatory collapse, using the lucas® chest compression system Catheter. Cardiovasc Interv. 2013;81(6):1084-6. doi:10.1002/ccd.24590.
14. Torrado J, Barzallo D, Terré JA, et al. Impact of VA-ECMO on dynamic LV outflow obstruction after transcatheter aortic valve replacement. JACC Case Rep. 2023;29(2):102157. doi:10.1016/j.jaccas.2023.102157.
Об авторах
А. А. ПрохорихинРоссия
Алексей Андреевич Прохорихин — к.м.н., н.с. НИО сосудистой и интервенционной хирургии, врач по рентгенэндоваскулярным диагностике и лечению отделения рентгенохирургических методов диагностики и лечения.
Санкт-Петербург
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Ю. В. Кукушкина
Россия
Юлия Владимировна Кукушкина — студент 5 курса.
Санкт-Петербург
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Д. Д. Зубарев
Россия
Дмитрий Дмитриевич Зубарев — к.м.н., зав. отделением рентгенохирургических методов диагностики и лечения, н.с. научно-исследовательской лаборатории интервенционной хирургии, врач по рентгенэндоваскулярным диагностике и лечению.
Санкт-Петербург
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
А. В. Горбатых
Россия
Артём Викторович Горбатых — к.м.н., зав. НИЛ интервенционной хирургии, врач по рентгенэндоваскулярным диагностике и лечению отделения рентгенохирургических методов диагностики и лечения, врач-сердечно-сосудистый хирург.
Санкт-Петербург
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
К. Б. Лапшин
Россия
Кирилл Борисович Лапшин — зав. отделением анестезиологии-реанимации с палатами реанимации и интенсивной терапии ФГБУ "НМИЦ им. В.А. Алмазова" Минздрава России.
Санкт-Петербург
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
- Представлены различные тактики выполнения транскатетерной имплантации аортального клапана (ТИАК) у пациенток с синдромом малого объема левого желудочка.
- Предложено изменение порядка и степени выполнения баллонной вальвулопластики для предупреждения развития объемной перегрузки левого желудочка.
- Различные стратегии управления состоянием пациентов можно использовать как рекомендации к модификации процедуры ТИАК.
Рецензия
Для цитирования:
Прохорихин А.А., Кукушкина Ю.В., Зубарев Д.Д., Горбатых А.В., Лапшин К.Б. Проблема малого объема левого желудочка при выполнении транскатетерного протезирования аортального клапана: серия клинических случаев. Российский кардиологический журнал. 2025;30(10S):6043. https://doi.org/10.15829/1560-4071-2025-6043. EDN: FCZVMU
For citation:
Prokhorikhin A.A., Kukushkina Yu.V., Zubarev D.D., Gorbatykh A.V., Lapshin K.B. Problem of small left ventricular volume during transcatheter aortic valve replacement: a case series. Russian Journal of Cardiology. 2025;30(10S):6043. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6043. EDN: FCZVMU
JATS XML

















































