Перейти к:
Эра таргетной терапии гиперлипидемий
https://doi.org/10.15829/1560-4071-2024-6038
EDN: YYMUYK
Аннотация
Несмотря на разнообразие гиполипидемических препаратов — в основном, таблетированных форм, направленных на снижение уровня холестерина липопротеидов низкой плотности и триглицеридов, лишь малое количество пациентов достигают их целевых уровней. Причинами являются недостаточная приверженность к лечению, редкое использование комбинированных схем гиполипидемической терапии лечащими врачами, низкая доступность и высокая стоимость инъекционных липид-снижающих агентов. С появлением технологий таргетной терапии гиперлипидемий открывается новая эра в кардиологии. Данные инновации приведут к увеличению вероятности достижения цели за счет персонализированного и прецизионного подхода к лечению гиперлипидемии. Новые липид-снижающие препараты направлены на молекулярные мишени гиперхолестеринемии, гиперлипопротеидемии(а) и гипертриглицеридемии. Целью обзора является систематизация информации об инновационных гиполипидемических препаратах с точки зрения их механизма действия, стадии разработки, эффективности и безопасности.
Для цитирования:
Чубыкина У.В., Тюрина А.В., Ежов М.В. Эра таргетной терапии гиперлипидемий. Российский кардиологический журнал. 2024;29(8):6038. https://doi.org/10.15829/1560-4071-2024-6038. EDN: YYMUYK
For citation:
Chubykina U.V., Tyurina A.V., Ezhov M.V. The era of targeted therapy for hyperlipidemia. Russian Journal of Cardiology. 2024;29(8):6038. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6038. EDN: YYMUYK
Атеросклеротические сердечно-сосудистые заболевания (АССЗ) по-прежнему являются ведущей причиной смертности во всем мире, унося ежегодно жизни 19 млн человек [1-3]. Сегодня имеются убедительные данные эпидемиологических, генетических, интервенционных исследований, подтверждающих причинно-следственную связь аполипопротеин B (апоВ)-содержащих липопротеидов с АССЗ [2][4-6]. Холестерин (ХС) липопротеидов низкой плотности (ЛНП) является первичной целью гиполипидемической терапии и в его отношении сформулировано три ключевых правила для получения наибольшей пользы для пациента [1][2]. Во-первых, гиполипидемическую терапию, направленную на снижение уровня ХС ЛНП, необходимо инициировать раньше, т. е. своевременно. Недавно представлены результаты двух исследований с периодом наблюдения 16 лет (4958 и 18288 человек, соответственно), продемонстрировавшие, что у пациентов с повышенным уровнем ХС ЛНП с молодого возраста риски раннего развития АССЗ выше в сравнении с лицами, у кого более низкий уровень ХС ЛНП и определен в более взрослом возрасте [7][8]. Это означает, что уровень ХС ЛНП может определять стратегии первичной профилактики АССЗ, в особенности, у пациентов с семейной гиперхолестеринемией (СГХС), когда он повышен в несколько раз с рождения. Вторым ключевым правилом является соблюдение условия "чем ниже, тем лучше", т. е. до целевых значений. С течением времени рекомендации в отношении пороговых уровней ХС ЛНП в зависимости от категории риска изменялись с тенденцией к более низким целевым значениям по мере получения большей доказательной базы об эффективности и безопасности такого подхода [1][2]. Метаанализ 18 рандомизированных клинических исследований (РКИ) продемонстрировал, что более интенсивное снижение уровня ХС ЛНП было связано с уменьшением риска сердечно-сосудистых осложнений (ССО) на 24% (относительный риск 0,76; 95% доверительный интервал: 0,68-0,85) и риска смерти от любой причины на 10% (относительный риск 0,90; 95% доверительный интервал: 0,83-0,97) [9]. В-третьих, рекомендовано следовать принципу "чем дольше, тем лучше", что подразумевает использование гиполипидемической терапии в течение всей жизни. В метаанализе 21 РКИ снижение уровня ХС ЛНП на каждый 1 ммоль/л было связано со значимым уменьшением риска ССО на 12% к первому году, на 20% — к третьему, на 23% — к пятому и 29% — к седьмому году гиполипидемической терапии [10]. Таким образом, достижение и поддержание оптимальных уровней ХС ЛНП с более раннего возраста может замедлить темпы прогрессирования атеросклероза. Однако, несмотря на высокую эффективность липид-снижающих препаратов и возможность использования комбинированной терапии, сохраняется значимый разрыв между рекомендациями и реальной клинической практикой. Исследования DA VINCI [11] и SANTORINI [12] продемонстрировали, что лишь 20-33% пациентов с высоким и очень высоким риском АССЗ в странах Европы достигли целевого уровня ХС ЛНП. В России, по данным ретроспективного анализа медицинских историй болезни 12918 пациентов в рутинной клинической практике, лишь 12,5% пациентов с АССЗ достигли уровня ХС ЛНП <1,8 ммоль/л [13].
Кроме ХС ЛНП, повышенные значения липопротеида(а) (Лп(а)) и триглицеридов (ТГ) обладают доказанной причинно-следственной связью с АССЗ. Лп(а) — наиболее сложная и полиморфная из липопротеидных частиц. Отличительной чертой строения Лп(а) является наличие уникального апобелка(а), который ковалентно связан одной дисульфидной связью с апоB-100 в составе ЛНП-подобной частицы [14]. В эквимолярном соотношении Лп(а) более патогенен чем ЛНП, поскольку вследствие своей структуры обладает атерогенными, провоспалительными и тромбогенными свойствами [14]. Уровень Лп(а) генетически детерминирован и не подвержен влиянию диеты или физической активности [15]. В настоящее время рекомендуется измерить уровень Лп(а) один раз в жизни для стратификации сердечно-сосудистого риска и определения тактики лечения [1][2]. Несмотря на то, что физиологическая функция Лп(а) остается неясной, доказано, что его повышенные значения приводят к увеличению риска развития различных АССЗ, включая аортальный стеноз. Таргетные препараты, изолированно воздействующие на уровень Лп(а), изучаются в рамках РКИ и пока неясно, какая польза будет от его снижения для уменьшения риска ССО. Однако исследования с аферезом липопротеидов, в т. ч. проведенные в России, позволяют рассчитывать на успех таргетной терапии, подавляющей синтез Лп(а), в виде уменьшения вероятности развития ССО.
Гипертриглицеридемия (ГТГ), в контексте остаточного риска, является вторичной целью гиполипидемической терапии [1][2]. В метаанализе, включившем >370 тыс. принимающих статины пациентов, снижение концентрации ТГ на 1 ммоль/л было связано с уменьшением риска развития ССО на 16% после поправки на уровень ХС ЛНП [16]. ТГ — это целый пул апоВ-48- или апоВ-100-содержащих частиц, которые определяют клиническое течение патологического процесса [17]. ГТГ может быть первичной или генетически детерминированной, в таких случаях уровень ТГ увеличен в несколько раз или даже десятков раз. Первичная экстремальная ГТГ (>10 ммоль/л) сопряжена с высоким риском развития панкреатита и АССЗ, ее распространенность в России 0,1-0,2% [18][19]. Распространенность вторичной ГТГ высока, поскольку она может быть связана с ожирением, сахарным диабетом, неправильным образом жизни, гипофункцией щитовидной железы и почек [17]. При вторичной ГТГ повышение уровня ТГ не так выражено, но риск развития АССЗ возрастает. Соблюдение диеты, регулярные физические нагрузки и, в некоторых случаях, использование статинов, фибратов и омега-3-полиненасыщенных жирных кислот рекомендованы для коррекции уровня ТГ [1][2]. Однако при первичной ГТГ, когда уровни ТГ крайне высоки ввиду наличия патогенных генетических вариантов, их недостаточно для достижения целевых значений.
С появлением технологий таргетной терапии гиперлипидемий открывается новая эра в кардиологии. Целью обзора является систематизация информации об инновационных препаратах, направленных на молекулярные мишени гиперхолестеринемии, гиперлипопротеидемии(а) и ГТГ (рис. 1).
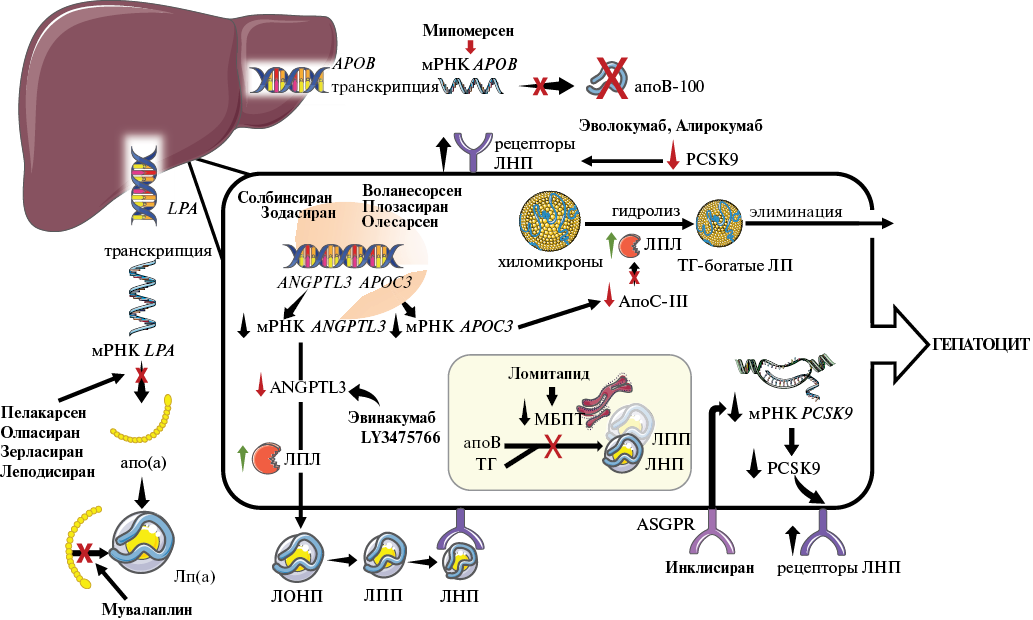
Рис. 1. Механизмы действия таргетных гиполипидемических препаратов.
Примечание: PCSK9 алирокумаб и эволокумаб блокируют разрушение рецепторов ЛНП в лизосомах, в результате увеличивается их экспрессия на гепатоцитах и снижается сывороточная концентрация ХС ЛНП. Инклисиран — малая интерферирующая РНК, нацеленная на мРНК PCSK9, связывается с ASGPR, затем проникает в цитоплазму, где антисмысловая цепочка взаимодействует с мРНК PCSK9 и приводит к ее ферментативной элиминации. ANGPTL3 и APOC-III являются основными ингибиторами активности ЛПЛ. Снижение уровня ANGPTL3 и APOC3-III способствует удалению из плазмы крови ТГ-богатых частиц за счёт повышения активности ЛПЛ. Препаратами, влияющими на активность ANGPTL3, являются эвинакумаб, зодасиран, LY3475766, солбинсиран. Препаратами, влияющими на активность APOC-III, являются воланесорсен, плозасиран и олесарсен. МБПТ играет ключевую роль в переносе ТГ на вновь синтезируемый апоВ, что приводит к образованию ЛОНП и хиломикронов. Ломитапид, ингибируя активность МБПТ, снижает секрецию хиломикронов кишечником и ЛОНП печенью, что приводит к снижению концентрации ХС ЛНП, ТГ и Лп(а). Мипомерсен ингибирует мРНК APOВ, тем самым подавляя синтез ЛОНП и снижая уровень ХС ЛНП. Пелакарсен, олпасиран, зерласиран и леподисиран ингибируют мРНК LPA, таким образом снижая концентрацию Лп(а). Мувалаплин блокирует участок связывания молекулы апо(а) с апоB-100, тем самым блокируя сборку частицы Лп(а).
Сокращения: апо(а) — аполипопротеин(а), апоВ — аполипопротеин B-содержащие липопротеиды, ЛНП — липопротеиды низкой плотности, ЛОНП — липопротеиды очень низкой плотности, Лп(а) — липопротеид(а), ЛПЛ — липопротеинлипаза, ЛПП — липопротеиды промежуточной плотности, МБПТ — микросомальный белок-переносчик ТГ, мРНК — матричная РНК, ТГ — триглицериды, ХС — холестерин, APOC-III — аполипопротеинC-III, PCSK9 — белок пропротеинконвертаза субтилизин/кексин 9 типа.
Методология исследования
Методологический подход к поиску литературы включал в себя несистематический поиск обзоров, РКИ, метаанализов, российских и зарубежных клинических рекомендаций в электронных базах данных PubMed, Google Scholar, ScienceDirect, ResearchGate, Elibrary. Отслеживание статуса клинических исследований проводилось в базе ClinicalTrials.gov. Использовались следующие текстовые запросы: гиперхолестеринемия, липопротеид (а), ТГ, атеросклероз, таргетная терапия, hypercholesterolemia, lipoprotein (a), triglycerides, atherosclerosis, targeted therapy. Временной интервал используемой литературы включал промежуток с 2018 по 2024гг, а также ключевые публикации более раннего периода.
Результаты
Таргетная терапия гиперхолестеринемии
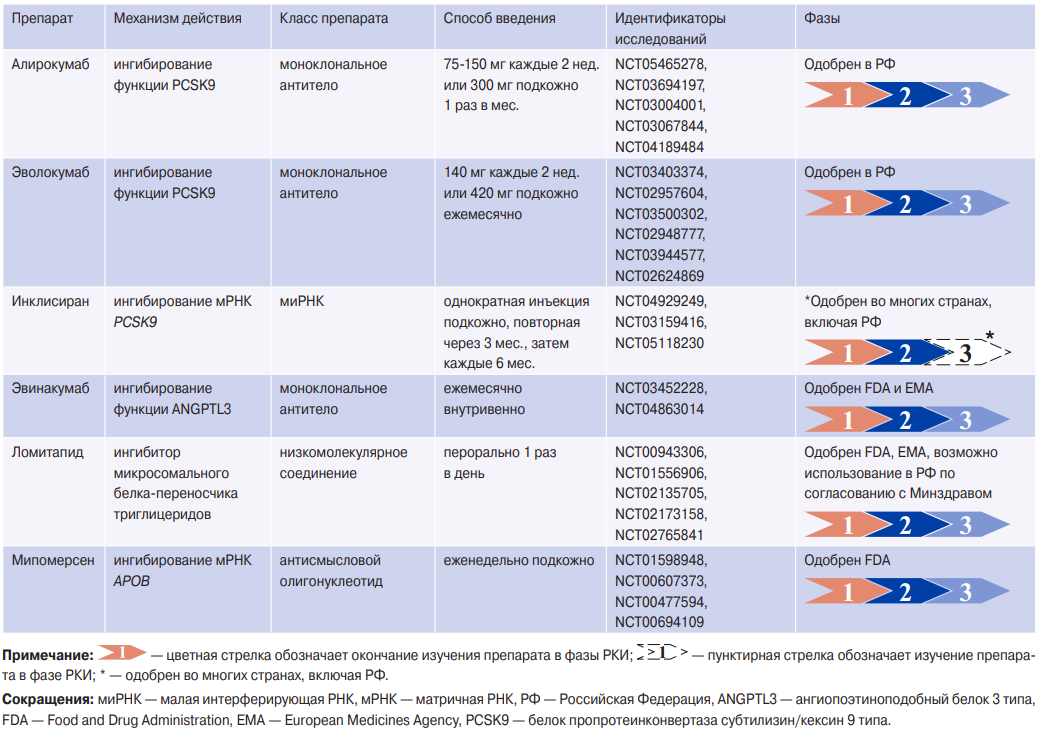
Ингибиторы PCSK9. Связывание белка пропротеинконвертазы субтилизин/кексин 9 типа (PCSK9) с рецепторами ЛНП способствует последующей лизосомальной деградации этих рецепторов в печени. Снижение активности PCSK9 приводит к увеличению количества рецепторов ЛНП на мембране гепатоцита и усиленному захвату ЛНП из кровотока [20].
Эволокумаб и алирокумаб являются моноклональными антителами к PCSK9, которые обеспечивают снижение уровня ХС ЛНП на 60% и риска ССО на 15% у пациентов с АССЗ, получавших преимущественно высокоинтенсивную терапию статинами [21][22]. В недавнем исследовании PACMAN-AMI (Effects of the PCSK9 Antibody Alirocumab on Coronary Atherosclerosis in Patients With Acute Myocardial Infarction) добавление к схеме лечения алирокумаба в течение 1 года после острого инфаркта миокарда приводило к большей регрессии атеросклеротических бляшек в коронарных артериях, в сравнении с группой пациентов на высокоинтенсивной терапии статинами [23].
Инклисиран — это синтетическая двухцепочечная малая интерферирующая РНК (миРНК), связанная с углеводной молекулой N-ацетилгалактозамина (GalNAc). Лиганд GalNAc обеспечивает взаимодействие с асиалогликопротеиновыми рецепторами (ASGPR), экспрессируемыми на поверхности гепатоцитов, что обусловливает высокую селективность препарата. Комплекс инклисиран-ASGPR проникает в цитоплазму, где антисмысловая цепь миРНК встраивается в РНК-индуцируемый комплекс подавления (RISC). Далее комплекс RISC с антисмысловой цепью инклисирана связывает и разрезает матричную РНК (мРНК) PCSK9, что приводит к уменьшению синтеза белка PCSK9. Этот эффект реализуется на протяжении жизни гепатоцита. Отсрочка следующего введения препарата не приводит к скачкообразному повышению ХС ЛНП. Долгосрочная эффективность, безопасность и переносимость инклисирана оценивалась в открытом исследовании ORION-8 с максимумом наблюдения до 6,8 лет и суммарным показателем воздействия 12109 пациенто-лет. К окончанию исследования 78,4% пациентов достигли заранее определенных целевых уровней ХС ЛНП, среднее снижение ХС ЛНП составило 49,4% [24]. В исследовании ORION-9 (482 пациента с гетерозиготной СГХС) инклисиран приводил к снижению ХС ЛНП на 40%, и почти у 40% участников было получено снижение ХС ЛНП на ≥50% [25]. В настоящее время проводятся РКИ ORION-4 (NCT03705234), где оценивается влияние инклисирана на клинические исходы у лиц с АССЗ [26], а также исследования по оценке эффективности инклисирана в реальной клинической практике — VICTORION-REAL (NCT05399992) и VICTORION-IMPLEMENT (NCT05362903) (табл. 1).
Ингибиторы ANGPTL3. Ангиопоэтиноподобный белок 3 (ANGPTL3) — это белок печени, который играет ключевую роль в регуляции уровня ХС посредством обратимого ингибирования липопротеинлипазы и эндотелиальной липазы [27-29]. Более низкий риск ССО отмечен у лиц с вариантами в гене ANGPTL3 с потерей функции и снижением уровня ANGPTL3 [30][31]. Это наблюдение привело к разработке фармакологических стратегий по ингибированию ANGPTL3 [32].
Эвинакумаб представляет собой человеческое моноклональное антитело, которое ингибирует ANGPTL3, что приводит к повышению активности липопротеинлипазы и эндотелиальной липазы и снижению концентрации ХС ЛНП и ТГ. Хотя механизм, посредством которого эвинакумаб снижает уровень ХС ЛНП, не совсем ясен, этот эффект не зависит от рецепторов ЛНП и, вероятнее всего, обусловлен повышенной элиминацией липопротеидов очень низкой плотности (ЛОНП). В РКИ с участием 272 пациентов подкожное (300-450 мг каждые 1 или 2 нед.) и внутривенное (15 мг/кг каждые 4 нед.) введение эвинакумаба доказало свою эффективность при первичной гиперхолестеринемии, когда ингибиторы PCSK9 в сочетании с максимально переносимой дозой статинов не привели к достижению целевого уровня ХС ЛНП (<2,6 ммоль/л или 1,4 ммоль/л для первичной и вторичной профилактики, соответственно). Через 16 нед. терапии наблюдалось снижение ХС ЛНП на 45% при подкожном еженедельном введении 300 мг эвинакумаба и на 50% — при его внутривенном введении 15 мг/кг каждые 4 нед. [33]. В исследовании ELIPSE HoFH (Evinacumab Lipid Studies in Patients With Homozygous Familial Hypercholesterolemia) у пациентов с гомозиготной СГХС эвинакумаб (15 мкг/кг каждые 4 нед.) в дополнение к максимально переносимой гиполипидемической терапии приводил к снижению концентрации ХС ЛНП на 49% [34] (табл. 1). В феврале 2021г Food and Drug Administration (FDA) одобрило эвинакумаб для лечения пациентов с гомозиготной СГХС.
Ломитапид. Селективный ингибитор микросомального белка-переносчика ТГ, был одобрен в 2012г FDA и 2013г European Medicines Agency (EMA) для снижения уровня ХС ЛНП у взрослых с гомозиготной СГХС [35]. Микросомальный белок-переносчик ТГ расположен в эндоплазматическом ретикулуме гепатоцитов и энтероцитов и играет ключевую роль в переносе ТГ на вновь синтезируемый апоВ, что приводит к образованию ЛОНП и хиломикронов. Ломитапид уменьшает секрецию хиломикронов кишечником и ЛОНП печенью, что приводит к снижению концентрации ХС ЛНП, ТГ и Лп(а). РКИ продемонстрировали (табл. 1), что у пациентов с гомозиготной СГХС, получающих статины и аферез липопротеидов, ломитапид снижает уровень ХС ЛНП на 50%, ТГ на 45%, Лп(а) на 15%, обладает приемлемым профилем безопасности и переносимости [36]. Аферез липопротеидов удалось прекратить у 6 из 18 участников исследования [36]. В регистровом исследовании LOWER (Lomitapide Observational Worldwide Evaluation Registry), куда были включены 187 пациентов с гомозиготной СГХС из разных стран, больные в течение 3 лет получали лечение ломитапидом, у 58,4% пациентов наблюдалось снижение уровня ХС ЛНП не менее чем на 50% от исходного уровня [37]. Наиболее частыми побочными эффектами являются повышение активности печеночных ферментов, диспепсия и жировой гепатоз, однако их проявления можно уменьшить с помощью диеты с низким содержанием жиров.
Мипомерсен. Антисмысловой олигонуклеотид второго поколения, блокирующий синтез апоB-100, что приводит к подавлению синтеза ЛОНП и снижению уровня ЛНП. Препарат преимущественно изучался среди пациентов с гомозиготной СГХС (табл. 1), вводится подкожно в дозе 200 мг 1 раз в нед. В РКИ пациенты с гомозиготной СГХС были рандомизированы в группу мипомерсена (n=34) или плацебо (n=17), период наблюдения составил 26 нед. В группе мипомерсена выявлено снижение концентрации ХС ЛНП на 21%, апоВ — на 24%, ТГ — на 17%, Лп(а) — на 23% [38]. У 21% пациентов было отмечено повышение сывороточных уровней трансаминаз, увеличение количества жира в печени — у 6,2% пациентов [39]. Побочные эффекты, отмеченные в ходе РКИ, привели к появлению в инструкции предупреждения о гепатотоксичности мипомерсена.
Таблица 1
Новые таргетные препараты для лечения гиперхолестеринемии
Таргетная терапия гиперлипопротеидемии(а)
Остается неясным, насколько необходимо снизить уровень Лп(а) для получения клинически значимого эффекта. Несколько исследований с менделевской рандомизацией показали, что для снижения риска ССО при воздействии до 5 лет необходимо абсолютное снижение концентрации Лп(а) на 50-100 мг/дл [40-42].
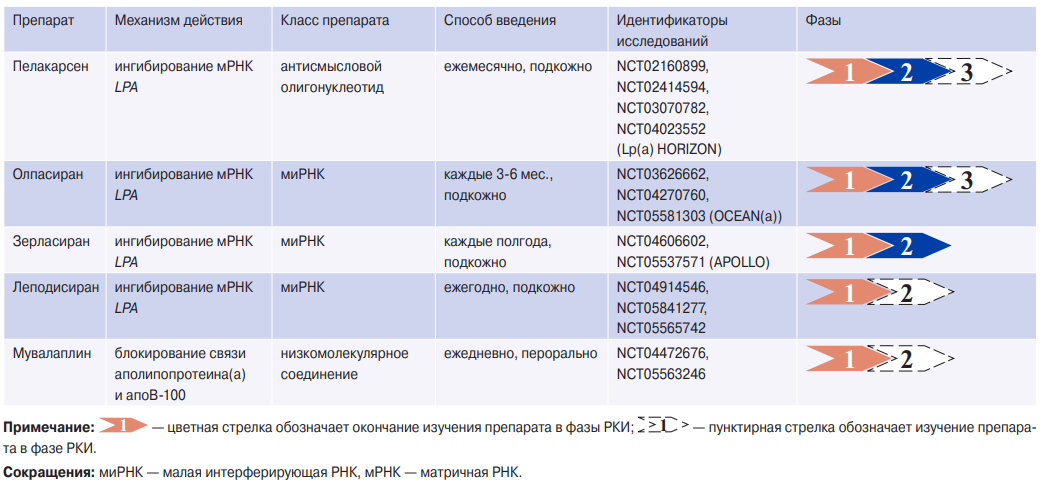
Препараты, направленные на подавление активности PCSK9, способны снижать уровень Лп(а) не более чем на 30%. Аферез липопротеидов эффективен и может рассматриваться для пациентов с очень высоким уровнем Лп(а) и прогрессирующим ССЗ, несмотря на оптимальное лечение других факторов риска [14]. Однако он доступен лишь в центрах экспертного уровня и имеет ограничения ввиду его трудоемкости и сложности для масштабирования. Безусловно, существует острая необходимость в инновационных подходах к снижению уровня Лп(а). Лп(а) находится под контролем одного гена LPA, что позиционирует его как идеального кандидата для разработки терапевтических средств на основе РНК-интерференции. Большинство таких подходов основаны на стратегии воздействия на мРНК LPA в гепатоцитах, что в итоге приводит к снижению синтеза аполипопротеина(а) и Лп(a). В настоящее время на разных фазах РКИ находятся четыре таргетных препарата: пелакарсен, олпасиран, зерласиран и леподисиран. Особняком стоит пероральный ингибитор синтеза Лп(а) мувалаплин (табл. 2).
Пелакарсен (TQJ230, AKCEAAPO[a]LRx) является антисмысловым олигонуклеотидом мРНК LPA, успешно преодолевшим первые две фазы РКИ [43][44]. Для улучшения доставки в печень и увеличения активности при уменьшении эффективной дозировки препарат был подвергнут GalNAc модификации. В РКИ 2 фазы с участием 64 человек с повышенным уровнем Лп(а) оценивали эффект немодифицированного препарата на 85-й или 99-й день [43]. В когорту А вошли пациенты с концентрацией Лп(а) от 125 до 437 нмоль/л (62% мужчин), в когорту В — выше 438 нмоль/л (82% женщин). В среднем уровень Лп(а) в крови снизился на 66,8% и 71,6%, соответственно. В рамках того же исследования была проведена оценка модифицированной GalNAc версии препарата, позже известного как пелакарсен (n=58). Однократное введение в дозе 80 мг привело к снижению уровня Лп(а) на 85%, которое сохранялось до 90-го дня. При многократном введении на 36-й день наблюдалось снижение в среднем на 92% в группе, получавшей 40 мг пелакарсена. Все участники завершили исследование без каких-либо побочных эффектов.
В более крупном исследовании 2-й фазы пелакарсена приняли участие 286 человек (66% мужчин) с АССЗ и Лп(а) свыше 60 мг/дл [44]. Все схемы приема, включавшие 20, 40 или 60 мг каждые 4 нед., 20 мг каждые 2 нед. и 20 мг еженедельно, привели к значимому снижению уровня Лп(а) через 6 мес. Максимальное снижение на 80% определено при еженедельном применении в дозе 20 мг. В результате было инициировано РКИ 3 фазы, включившее ~8 тыс. пациентов с доказанным АССЗ и уровнем Лп(а) >70 и 90 мг/дл (две страты), где ежемесячное подкожное введение пелакарсена в дозе 80 мг в сравнении с плацебо может продемонстрировать снижение риска ССО за счет избирательного снижения уровня Лп(а) (табл. 2). Результаты исследования ожидаются в 2025г, в нем участвует 50 российских центров, которые включили ~400 пациентов.
Олпасиран (AMG 890) — это модифицированная GalNAc миРНК, индуцирующая деградацию мРНК LPA. В РКИ 1 фазы приняли участие 64 человека с повышенным уровнем Лп(а), получившие однократное подкожное введение олпасирана в дозе от 3 до 225 мг [45]. Лечение привело к максимальному среднему изменению от -70 до -97% в зависимости от дозы препарата и степени повышения уровня Лп(а), причем эффект сохранялся в течение нескольких месяцев и серьезных побочных эффектов не отмечено. В РКИ 2 фазы включили 281 пациента с установленным АССЗ и уровнем Лп(a) >150 нмоль/л [46]. Основной целью данного исследования была оценка эффективности лечения олпасираном в течение 36 нед. с использованием подкожных инъекций в дозах 10 мг, 75 мг и 225 мг каждые 12 нед. или 225 мг каждые 24 нед. В группе плацебо концентрация Лп(а) увеличилась на 3,6%, тогда как снижение уровня Лп(а) достигало 101% при максимальной дозе олпасирана, вводимой каждые 12 нед. В настоящее время проводится исследование третьей фазы, в котором оценивается влияние олпасирана на ССО, включая смерть от ишемической болезни сердца, инфаркт миокарда и коронарную реваскуляризацию у 6 тыс. пациентов с АССЗ и повышенным уровнем Лп(а) (NCT05581303); предполагаемая дата окончания — декабрь 2026г (табл. 2).
Зерласиран (SLN360) — это инновационная миРНК, модифицированная GalNAc, способствующая репрессии мРНК LPA. Основываясь на многообещающих результатах доклинических исследований, было инициировано исследование 1-й фазы APOLLO [47], в котором приняли участие 32 человека без АССЗ и с уровнем Лп(а) >60 мг/дл. В целом зерласиран хорошо переносился. Уровень Лп(а) возвращался к исходному даже через 150 дней после введения препарата. В среднем концентрация Лп(a) понижалась на 70% и 80% после введения самых высоких доз — 300 мг и 600 мг, соответственно. Кроме того, зерласиран вызывал дозо-зависимое снижение уровня общего ХС на 18% и ХС ЛНП на 26%. В еще одном плацебо-контролируемом исследовании 1-й фазы, куда были включены 37 человек, как здоровых, так и с АССЗ, но с уровнем Лп(а) по медиане ~300 нмоль/л, препарат вводился в дозах 200, 300, 450 или 600 мг однократно либо многократно с интервалом в 8 нед. и продемонстрировал снижение концентрации Лп(а) до 30% после первой инъекции и до 99% после двух инъекций [48]. В РКИ фазы 2 будет проведена оценка эффективности, безопасности и переносимости зерласирана у 160 пациентов с повышенным уровнем Лп(а) и высоким риском АССЗ [NCT05537571]. Основной конечной точкой является среднее изменение концентрации Лп(а) через 36 нед., результаты ожидаются во второй половине 2024г (табл. 2).
Таблица 2
Новые таргетные препараты для коррекции гиперлипопротеидемии(а).
Леподисиран (LY3819469) будучи миРНК также нацелен на мРНК LPA. В плацебо-контролируемом исследовании 1-й фазы с однократным введением дозы леподисирана приняли участие 48 пациентов без АССЗ и с концентрацией Лп(а) >75 нмоль/л [49]. Максимальное снижение концентрации Лп(а) достигло 97% в группе с самой высокой дозой леподисирана (608 мг), которое сохранялось на 337-й день после инъекции (-94%). В настоящее время проводится РКИ фазы 2 для оценки эффективности леподисирана у 254 участников с уровнем Лп(а) >175 нмоль/л в течение 20 мес. Текущая дата окончания исследования 18 октября 2024г [NCT05565742]. В апреле 2023г было начато новое исследование 1-й фазы, посвященное фармакокинетике, безопасности и переносимости препарата у 28 пациентов с нормальной и сниженной функцией почек [NCT05841277].
Мувалаплин — это низкомолекулярное соединение, которое блокирует первоначальное нековалентное взаимодействие между aпo(a) и aпoB-100, предотвращая таким образом образование между ними дисульфидной связи и сборку Лп(a). Этот подход имитирует естественные варианты апо(a), которые не способны связываться с aпoB-100 [50]. Пероральный прием препарата у 114 здоровых лиц с любым уровнем Лп(а) в дозах от 30 до 800 мг в течение 14 дней приводил к увеличению концентрации мувалаплина в плазме и периода полувыведения в диапазоне от 70 до 414 ч. Мувалаплин уменьшал уровень Лп(а) в плазме в течение 24 ч после приема первой дозы, с дальнейшим снижением Лп(а) при повторном приеме. Максимальное снижение концентрации Лп(а) составило 63-65%, у 93% участников концентрация Лп(а) в плазме крови опустилась <50 мг/дл. Никаких клинически значимых изменений уровня или активности плазминогена не наблюдалось.
Таргетная терапия ГТГ
За последние десятилетия накопились данные эпидемиологических и генетических исследований, подтверждающие концепцию связи повышенного уровня ТГ с увеличением риска развития АССЗ, панкреатита и смертности от всех причин [17][51-54]. В России 32% взрослых лиц [55] имеет уровень ТГ >1,7 ммоль/л (~40 млн человек), из них у 0,1-0,2% уровень ТГ превышает 10,0 ммоль/л (не менее 146 тыс. человек) [18, 19]. ТГ (или ТГ-богатые частицы), уровень которых измеряется в стандартной липидной панели, включают целый спектр липопротеидов, различающихся по структуре и размеру. К основным видам ТГ-богатых частиц относят апоВ-48 содержащие хиломикроны и их ремнанты, апоВ-100 содержащие ЛОНП и их ремнанты, липопротеиды промежуточной плотности [17]. Метаболизм ТГ-богатых частиц регулируется действием липопротеинлипазы, которая расщепляет ТГ в наиболее крупных липопротеидах — хиломикронах и ЛОНП до их ремнантов [17]. В свою очередь, эффективность липолиза зависит от активности ингибиторов (апoC-II, апoA5 и др.) или индукторов (апoC-III, ANGPTL3, 4, 8 и др.) липопротеинлипазы [17]. В контексте регуляторов эффективности липолиза генетические исследования продемонстрировали, что носители патогенных вариантов нуклеотидных последовательностей с потерей функции в генах APOC3 и ANGPTL3 имели низкий уровень ТГ и АССЗ, что делает идею о таргетном медикаментозном воздействии на эти мишени перспективной для снижения ССР [56, 57].
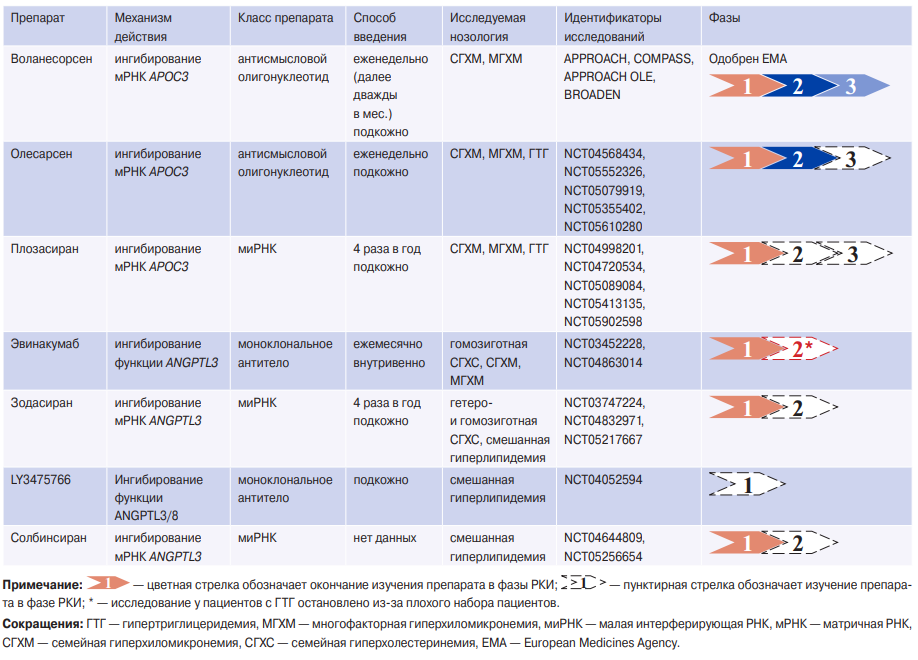
Ингибиторы апоС-III. AпoC-III является мощным ингибитором липопротеинлипазы и в настоящее время в РКИ изучаются три препарата, действие которых направлено на ингибирование апоС-III: воланесорсен, олесарсен, плозасиран (табл. 3).
Воланесорсен является антисмысловым олигонуклеотидом первого поколения, механизм действия которого был направлен на блокирование синтеза апоC-III в клетках печени путем ингибирования мРНК APOC3. По данным объединенного анализа РКИ терапия воланесорсеном была ассоциирована со снижением концентрации ТГ в крови на 74%, апоВ-48 на 69%, ХС ЛОНП на 71%, апоС-III на 80% [58]. Тромбоцитопения, возникающая у некоторых пациентов при лечении воланесорсеном, остается основной проблемой, требующей тщательного наблюдения [59]. Имеются данные, что лечение воланесорсеном ассоциировано с регрессией стеатоза печени у пациентов с тяжелой ГТГ, семейной частичной липодистрофией и семейной гиперхиломикронемией [60]. В мае 2019г воланесорсен был одобрен для применения в Европе и Великобритании для лечения взрослых пациентов с семейной гиперхиломикронемией, однако FDA отклонило его одобрение.
Олесарсен представляет собой усовершенствованную форму воланесорсена, поскольку этот антисмысловой олигонуклеотид конъюгирован с GalNAc, благодаря чему обеспечивается таргетная доставка препарата в гепатоциты с потенциально меньшим количеством ассоциированных с терапией побочных эффектов. В РКИ 2 фазы у пациентов с ГТГ терапия олесарсеном ассоциировалась со снижением уровня ТГ на 60%, апоС-III на 74%, ХС ЛОНП на 58%, ХС липопротеидов невысокой плотности на 20% и апоВ на 12-17%, при этом возрастала концентрация ХС липопротеидов высокой плотности (ЛВП) на 33-40%, ХС ЛНП на 16% и апоА-I на 14-18% [61]. Олесарсен является перспективным препаратом для лечения пациентов с тяжелой ГТГ и в настоящее время проводятся многочисленные РКИ 3 фазы для дальнейшей оценки его терапевтической ценности (табл. 3).
Плозасиран представляет собой конъюгированную с GalNAc миРНК, нацеленную на мРНК APOC3. В отличие от антисмысловых олигонуклеотидов воланесорсена и олесарсена, действующих в ядре гепатоцита, плозасиран действует преимущественно в цитоплазме. В клиническом исследовании фазы 1, где четыре пациента с семейной гиперхиломикронемией получали 50 мг плозасирана и 26 пациентов с многофакторной гиперхиломикронемией получали 10, 25, 50 или 100 мг плозасирана, отмечено снижение концентрации ТГ на 91,3% и 89,8% соответственно, а уровень ХС ЛВП увеличился на 152,4% и 110,8%, соответственно [62]. В настоящее время продолжаются два РКИ 2b фазы у пациентов с умеренной и тяжелой ГТГ (NCT04998201, NCT04720534) и одно исследование третьей фазы при семейной гиперхиломикронемии (NCT05089084) (табл. 3).
Ингибиторы ANGPTL3. Второй мишенью, играющей важную роль в метаболизме ТГ-богатых частиц, является ANGPTL3. Среди препаратов, которые направлены на ингибирование ANGPTL3, выделяют эвинакумаб, зодасиран, солбинсиран и LY3475766 (табл. 3).
Эвинакумаб является моноклональным антителом, ингибирующим функцию ANGPTL3. В РКИ 2 фазы изучали эффективность препарата у пациентов с выраженной ГТГ [63]. При семейной гиперхиломикронемии, когда отсутствует минимальная активность липопротеинлипазы, не отмечено снижения уровня ТГ, тогда как при многофакторной хиломикронемии — от 65 до 82% [63]. Однако дальнейшее изучение эффективности эвинакумаба в РКИ 2 фазы было остановлено в 2023г (решение спонсора, Regeneron) из-за плохого набора участников (NCT04863014).
Зодасиран представляет собой миРНК, нацеленную на ANGPTL3. В 16-нед. исследовании на здоровых добровольцах лечение зодасираном (100-300 мг подкожно) было связано со снижением уровня ТГ на 61-65% и ХС ЛНП на 45-54% через 12 нед. после второй дозы (инъекции проводилось в первый и 29 дни) [64]. В настоящее время проводятся два РКИ фазы 2 с зодасираном (табл. 3): при смешанной дислипидемии (NCT04832971) и гомозиготной СГХС (NCT05217667).
Также миРНК против мРНК ANGPTL3 солбинсиран изучается в рамках РКИ (табл. 3). В первой фазе клинических исследований проводилась оценка безопасности, переносимости, фармакокинетики и фармакодинамики у пациентов с гиперлипидемией (NCT04644809). В 2022г инициировано клиническое исследование 2b фазы по изучению эффективности и безопасности солбинсирана у взрослых пациентов со смешанной гиперлипидемией (NCT05256654). Результаты РКИ 1 и 2 фазы в настоящее время не опубликованы.
Комплекс, образованный ANGPTL3 и ANGPTL8 (ANGPTL3/8), ингибирует липопротеинлипазу в 100 раз более эффективно, чем ANGPTL3 [65]. Препарат LY3475766 является моноклональным антителом против комплекса ANGPTL3/8. В РКИ 1 фазы с участием 48 пациентов с гиперлипидемией терапия LY3475766 в дозировке 100, 300 и 600 мг ассоциировалась со дозозависимым снижением уровня ТГ на 59-70%, ХС ЛНП на 17-37%, апоВ на 14-31%, повышением уровня ХС ЛВП на 26% [65].
Таблица 3
Новые таргетные препараты для лечения ГТГ
Заключение
За последние десятилетия методы лечения гиперлипидемии эволюционировали от таблетированных форм, которые нужно принимать ежедневно, к инъекционным моноклональным антителам, которые вводят каждые 2-4 нед., и к лекарственным агентам на основе мРНК (антисмысловые олигонуклеотиды и миРНК), которые вводят 1 раз в несколько месяцев. Эти инновационные липид-снижающие препараты открыли возможности для долгосрочных терапевтических решений, которые могут совершить революцию в лечении гиперлипидемии. Во-первых, ожидается увеличение приверженности к лечению, в особенности, у молодых пациентов, кому сложно принять факт необходимости ежедневного приема лекарств, и коморбидных больных, которые уже принимают большое количество таблеток. Во-вторых, новый терапевтический подход затронет пациентов с такими редкими генетически детерминированными нарушениями липидного обмена, как СГХС или семейная гиперхиломикронемия. Также важно отметить изменение подхода к лечению гиперлипидемии, от целенаправленной коррекции ХС ЛНП к воздействию на ТГ и Лп(а). И наконец, новые таргетные гиполипидемические препараты для внедрения в реальную клиническую практику должны иметь не только клиническую эффективность и безопасность, но и экономическую выгоду.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Ежов М. В., Кухарчук В. В., Сергиенко И. В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471.
2. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. European heart journal. 2020;41(1):111-88. doi:10.1093/eurheartj/ehz455.
3. Tsao CW, Aday AW, Almarzooq ZI, et al. Heart Disease and Stroke Statistics-2022 Update: A Report From the American Heart Association. Circulation. 2022;145(8):e153-e639. doi:10.1161/cir.0000000000001052.
4. Johannesen CDL, Mortensen MB, Langsted A, et al. Apolipoprotein B and Non-HDL Cholesterol Better Reflect Residual Risk Than LDL Cholesterol in Statin-Treated Patients. Journal of the American College of Cardiology. 2021;77(11):1439-50. doi:10.1016/j.jacc.2021.01.027.
5. Zuber V, Gill D, Ala-Korpela M, et al. High-throughput multivariable Mendelian randomization analysis prioritizes apolipoprotein B as key lipid risk factor for coronary artery disease. International journal of epidemiology. 2021;50(3):893-901. doi:10.1093/ije/dyaa216.
6. Sniderman AD, Navar AM, Thanassoulis G. Apolipoprotein B vs Low-Density Lipoprotein Cholesterol and Non-High-Density Lipoprotein Cholesterol as the Primary Measure of Apolipoprotein B Lipoprotein-Related Risk: The Debate Is Over. JAMA cardiology. 2022;7(3):257-8. doi:10.1001/jamacardio.2021.5080.
7. Domanski MJ, Tian X, Wu CO, et al. Time Course of LDL Cholesterol Exposure and Cardiovascular Disease Event Risk. Journal of the American College of Cardiology. 2020;76(13):1507-16. doi:10.1016/j.jacc.2020.07.059.
8. Zhang Y, Pletcher MJ, Vittinghoff E, et al. Association Between Cumulative Low-Density Lipoprotein Cholesterol Exposure During Young Adulthood and Middle Age and Risk of Cardiovascular Events. JAMA cardiology. 2021;6(12):1406-13. doi:10.1001/jamacardio.2021.3508.
9. Hsu HY, Lin CJ, Lee YS, et al. Efficacy of more intensive lipid-lowering therapy on cardiovascular diseases: a systematic review and meta-analysis. BMC cardiovascular disorders. 2020;20(1):334. doi:10.1186/s12872-020-01567-1.
10. Wang N, Woodward M, Huffman MD, et al. Compounding Benefits of Cholesterol-Lowering Therapy for the Reduction of Major Cardiovascular Events: Systematic Review and Meta-Analysis. Circulation Cardiovascular quality and outcomes. 2022;15(6):e008552. doi:10.1161/circoutcomes.121.008552.
11. Ray KK, Molemans B, Schoonen WM, et al. EU-Wide Cross-Sectional Observational Study of Lipid-Modifying Therapy Use in Secondary and Primary Care: the DA VINCI study. European journal of preventive cardiology. 2021;28(11):1279-89. doi:10.1093/eurjpc/zwaa047.
12. Ray KK, Haq I, Bilitou A, et al. Treatment gaps in the implementation of LDL cholesterol control among high- and very high-risk patients in Europe between 2020 and 2021: the multinational observational SANTORINI study. The Lancet regional health Europe. 2023;29:100624. doi:10.1016/j.lanepe.2023.100624.
13. Ежов М. В., Чубыкина У. В., Дмитриев В. А. Трудности достижения целевых уровней холестерина липопротеидов низкой плотности у пациентов с атеросклеротическими сердечно-сосудистыми заболеваниями в условиях реальной клинической практики. Атеросклероз и дислипидемии. 2023;4(53):27-34. doi:10.34687/2219-8202.JAD.2023.04.0003.
14. Kronenberg F, Mora S, Stroes ESG, et al. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. European heart journal. 2022;43(39):3925-46. doi:10.1093/eurheartj/ehac361.
15. Kamstrup PR. Lipoprotein(a) and Cardiovascular Disease. Clinical chemistry. 2021;67(1): 154-66. doi:10.1093/clinchem/hvaa247.
16. Marston NA, Giugliano RP, Im K, et al. Association Between Triglyceride Lowering and Reduction of Cardiovascular Risk Across Multiple Lipid-Lowering Therapeutic Classes: A Systematic Review and Meta-Regression Analysis of Randomized Controlled Trials. Circulation. 2019;140(16):1308-17. doi:10.1161/circulationaha.119.041998.
17. Ginsberg HN, Packard CJ, Chapman MJ, et al. Triglyceride-rich lipoproteins and their remnants: metabolic insights, role in atherosclerotic cardiovascular disease, and emerging therapeutic strategies-a consensus statement from the European Atherosclerosis Society. European heart journal. 2021;42(47):4791-806. doi:10.1093/eurheartj/ehab551.
18. Ежов М. В., Батлук Т. И., Токмин Д. С. и др. Распространенность дислипидемии до и на фоне пандемии COVID-19. Анализ большой лабораторной базы данных. 2023;51(2):1-42. doi:10.34687/2219-8202.JAD.2023.02.0004.
19. Мешков А. Н., Ершова А. И., Деев А. И. и др. Распределение показателей липидного спектра у мужчин и женщин трудоспособного возраста в Российской Федерации: результаты исследования ЭССЕ-РФ за 2012-2014гг. Кардиоваскулярная терапия и профилактика. 2017;16(4):62-7. doi:10.15829/1728-8800-2017-4-62-67.
20. Brandts J, Dharmayat KI, Vallejo-Vaz AJ, et al. A meta-analysis of medications directed against PCSK9 in familial hypercholesterolemia. Atherosclerosis. 2021;325:46-56. doi:10.1016/j.atherosclerosis.2021.03.042.
21. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. The New England journal of medicine. 2017;376(18): 1713-22. doi:10.1056/NEJMoa1615664.
22. Schwartz GG, Steg PG, Szarek M, et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. The New England journal of medicine. 2018;379(22):2097-107. doi:10.1056/NEJMoa1801174.
23. Räber L, Ueki Y, Otsuka T, et al. Effect of Alirocumab Added to High-Intensity Statin Therapy on Coronary Atherosclerosis in Patients With Acute Myocardial Infarction: The PACMAN-AMI Randomized Clinical Trial. Jama. 2022;327(18):1771-81. doi:10.1001/jama.2022.5218.
24. Wright RS, Koenig W, Landmesser U, et al. Safety and Tolerability of Inclisiran for Treatment of Hypercholesterolemia in 7 Clinical Trials. Journal of the American College of Cardiology. 2023;82(24):2251-61. doi:10.1016/j.jacc.2023.10.007.
25. Raal FJ, Kallend D, Ray KK, et al. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. The New England journal of medicine. 2020;382(16):1520-30. doi:10.1056/NEJMoa1913805.
26. Scicchitano P, Milo M, Mallamaci R, et al. Inclisiran in lipid management: A Literature overview and future perspectives. Biomedicine & pharmacotherapy. 2021;143:112227. doi:10.1016/j.biopha.2021.112227.
27. Zhang R, Zhang K. An updated ANGPTL3-4-8 model as a mechanism of triglyceride partitioning between fat and oxidative tissues. Progress in lipid research. 2022;85:101140. doi:10.1016/j.plipres.2021.101140.
28. Kersten S. ANGPTL3 as therapeutic target. Current opinion in lipidology. 2021;32(6):335-41. doi:10.1097/mol.0000000000000789.
29. Morelli MB, Chavez C, Santulli G. Angiopoietin-like proteins as therapeutic targets for cardiovascular disease: focus on lipid disorders. Expert opinion on therapeutic targets. 2020;24(1):79-88. doi:10.1080/14728222.2020.1707806.
30. Noto D, Cefalù AB, Valenti V, et al. Prevalence of ANGPTL3 and APOB gene mutations in subjects with combined hypolipidemia. Arterioscler Thromb Vasc Biol. 2012;32(3):805-9. doi:10.1161/atvbaha.111.238766.
31. Arca M, D'Erasmo L, Minicocci I. Familial combined hypolipidemia: angiopoietin-like protein-3 deficiency. Current opinion in lipidology. 2020;31(2):41-8. doi:10.1097/mol.0000000000000668.
32. Ling P, Zheng X, Luo S, et al. Targeting angiopoietin-like 3 in atherosclerosis: From bench to bedside. Diabetes, obesity & metabolism. 2021;23(9):2020-34. doi:10.1111/dom.14450.
33. Rosenson RS, Burgess LJ, Ebenbichler CF, et al. Evinacumab in Patients with Refractory Hypercholesterolemia. The New England journal of medicine. 2020;383(24):2307-19. doi:10.1056/NEJMoa2031049.
34. Raal FJ, Rosenson RS, Reeskamp LF, et al. Evinacumab for Homozygous Familial Hypercholesterolemia. The New England journal of medicine. 2020;383(8):711-20. doi:10.1056/NEJMoa2004215.
35. Neef D, Berthold HK, Gouni-Berthold I. Lomitapide for use in patients with homozygous familial hypercholesterolemia: a narrative review. Expert review of clinical pharmacology. 2016;9(5):655-63. doi:10.1586/17512433.2016.1162095.
36. Blom DJ, Averna MR, Meagher EA, et al. Long-Term Efficacy and Safety of the Microsomal Triglyceride Transfer Protein Inhibitor Lomitapide in Patients With Homozygous Familial Hypercholesterolemia. Circulation. 2017;136(3):332-5. doi:10.1161/circulationaha.117.028208.
37. Underberg JA, Cannon CP, Larrey D, et al. Long-term safety and efficacy of lomitapide in patients with homozygous familial hypercholesterolemia: Five-year data from the Lomitapide Observational Worldwide Evaluation Registry (LOWER). Journal of clinical lipidology. 2020;14(6):807-17. doi:10.1016/j.jacl.2020.08.006.
38. Raal FJ, Santos RD, Blom DJ, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998-1006. doi:10.1016/s0140-6736(10)60284-x.
39. McGowan MP, Tardif JC, Ceska R, et al. Randomized, placebo-controlled trial of mipomersen in patients with severe hypercholesterolemia receiving maximally tolerated lipid-lowering therapy. PloS ONE. 2012;7(11):e49006. doi:10.1371/journal.pone.0049006.
40. Madsen CM, Kamstrup PR, Langsted A, et al. Lipoprotein (a)-lowering by 50 mg/dL (105 nmol/L) may be needed to reduce cardiovascular disease 20% in secondary prevention: a population-based study. Arteriosclerosis, thrombosis, and vascular biology. 2020;40(1):255-66. doi:10.1161/ATVBAHA.119.312951.
41. Lamina C, Kronenberg F. Estimation of the required lipoprotein (a)-lowering therapeutic effect size for reduction in coronary heart disease outcomes: a Mendelian randomization analysis. JAMA cardiology. 2019;4(6):575-9. doi:10.1001/jamacardio.2019.1041.
42. Burgess S, Ference BA, Staley JR, et al. Association of LPA variants with risk of coronary disease and the implications for lipoprotein (a)-lowering therapies: a Mendelian randomization analysis. JAMA cardiology. 2018;3(7):619-27. doi:10.1001/jamacardio.2018.1470.
43. Viney NJ, van Capelleveen JC, Geary RS, et al. Antisense oligonucleotides targeting apolipoprotein (a) in people with raised lipoprotein (a): two randomised, double-blind, placebo-controlled, dose-ranging trials. The Lancet. 2016;388(10057):2239-53. doi:10.1016/S0140-6736(16)31009-1.
44. Tsimikas S, Karwatowska-Prokopczuk E, Gouni-Berthold I, et al. Lipoprotein (a) reduction in persons with cardiovascular disease. New England Journal of Medicine. 2020;382(3):244-55. doi:10.1056/NEJMoa1905239.
45. Koren MJ, Moriarty PM, Baum SJ, et al. Preclinical development and phase 1 trial of a novel siRNA targeting lipoprotein (a). Nature medicine. 2022;28(1):96-103.
46. O'Donoghue ML, Rosenson RS, Gencer B, et al. Small interfering RNA to reduce lipoprotein (a) in cardiovascular disease. New England Journal of Medicine. 2022;387(20):1855-64. doi:10.1056/NEJMoa2211023.
47. Nissen SE, Wolski K, Balog C, et al. Single ascending dose study of a short interfering RNA targeting lipoprotein (a) production in individuals with elevated plasma lipoprotein (a) levels. JAMA. 2022;327(17):1679-87. doi:10.1001/jama.2022.5050.
48. Nissen SE, Wolski K, Watts GF, et al. Ascending and Multiple-Dose Trial of Zerlasiran, a Short Interfering RNA Targeting Lipoprotein(a): A Randomized Clinical Trial. JAMA. 2024:e244504. doi:10.1001/jama.2024.4504.
49. Nissen SE, Linnebjerg H, Shen X, et al. Lepodisiran, an extended-duration short interfering RNA targeting lipoprotein (a): a randomized dose-ascending clinical trial. JAMA. 2023;330(21):2075-83. doi:10.1001/jama.2023.21835.
50. Nicholls SJ, Nissen SE, Fleming C, et al. Muvalaplin, an oral small molecule inhibitor of lipoprotein (a) formation: a randomized clinical trial. JAMA. 2023;330(11):1042-53. doi:10.1001/jama.2023.16503.
51. Hernandez P, Passi N, Modarressi T, et al. Clinical management of hypertriglyceridemia in the prevention of cardiovascular disease and pancreatitis. Current atherosclerosis reports. 2021;23:1-13. doi:10.1007/s11883-021-00962-z.
52. Mosztbacher D, Hanák L, Farkas N, et al. Hypertriglyceridemia-induced acute pancreatitis: A prospective, multicenter, international cohort analysis of 716 acute pancreatitis cases. Pancreatology. 2020;20(4):608-16. doi:10.1016/j.pan.2020.03.018.
53. Nordestgaard BG. Triglyceride-rich lipoproteins and atherosclerotic cardiovascular disease: new insights from epidemiology, genetics, and biology. Circulation research. 2016;118(4):547-63. doi:10.1161/CIRCRESAHA.115.306249.
54. Gill PK, Dron JS, Hegele RA. Genetics of hypertriglyceridemia and atherosclerosis. Current opinion in cardiology. 2021;36(3):264-71. doi:10.1097/HCO.0000000000000839.
55. Драпкина О. М., Имаева А. Э., Куценко В. А. и др. Дислипидемии в Российской Федерации: популяционные данные, ассоциации с факторами риска. Кардиоваскулярная терапия и профилактика. 2023;22(8S):3791. doi:10.15829/1728-8800-2023-3791.
56. Stitziel NO, Khera AV, Wang X, et al. ANGPTL3 deficiency and protection against coronary artery disease. Journal of the American College of Cardiology. 2017;69(16):2054-63. doi:10.1016/j.jacc.2017.02.030.
57. TG and HDL Working Group of the Exome Sequencing Project, National Heart, Lung, and Blood Institute; Crosby J, Peloso GM, et al. Loss-of-function mutations in APOC3, triglycerides, and coronary disease. N Engl J Med. 2014;371(1):22-31. doi:10.1056/NEJMoa1307095.
58. Calcaterra I, Lupoli R, Di Minno A, et al. Volanesorsen to treat severe hypertriglyceridaemia: A pooled analysis of randomized controlled trials. Eur J Clin Invest. 2022;52(11):e13841. doi:10.1111/eci.13841.
59. Witztum JL, Gaudet D, Freedman SD, et al. Volanesorsen and Triglyceride Levels in Familial Chylomicronemia Syndrome. The New England journal of medicine. 2019;381(6):531-42. doi:10.1056/NEJMoa1715944.
60. Prohaska TA, Alexander VJ, Karwatowska-Prokopczuk E, et al. APOC3 inhibition with volanesorsen reduces hepatic steatosis in patients with severe hypertriglyceridemia. Journal of clinical lipidology. 2023;17(3):406-11. doi:10.1016/j.jacl.2023.04.007.
61. Tardif J-C, Karwatowska-Prokopczuk E, Amour ES, et al. Apolipoprotein C-III reduction in subjects with moderate hypertriglyceridaemia and at high cardiovascular risk. European heart journal. 2022;43(14):1401-12. doi:10.1093/eurheartj/ehab820.
62. Clifton P, Sullivan D, Baker J, et al. Pharmacodynamic effect of ARO-APOC3, an investigational hepatocyte-targeted RNA interference therapeutic targeting apolipoprotein C3, in patients with hypertriglyceridemia and multifactorial chylomicronemia. Circulation. 2020;142(3):A12594-A. doi:10.1161/circ.142.suppl_3.12594.
63. Rosenson RS, Gaudet D, Ballantyne CM, et al. Evinacumab in severe hypertriglyceridemia with or without lipoprotein lipase pathway mutations: a phase 2 randomized trial. Nature medicine. 2023;29(3):729-37. doi:10.1038/s41591-023-02222-w.
64. Watts GF, Schwabe C, Scott R, et al. RNAi inhibition of angiopoietin-like protein 3 (ANGPTL3) with ARO-ANG3 mimics the lipid and lipoprotein profile of familial combined hypolipidemia. European heart journal. 2020;41(2). doi:10.1093/ehjci/ehaa946.3331.
65. Gaudet D, Gonciarz M, Shen X, et al. A first-in-human single ascending dose study of a monoclonal antibody against the ANGPTL3/8 complex in subjects with mixed hyperlipidemia. Atherosclerosis. 2022;355:12. doi:10.1016/j.atherosclerosis.2022.06.034.
Об авторах
У. В. ЧубыкинаРоссия
Чубыкина Ульяна Валериевна — к. м. н., м. н. с. лаборатории нарушений липидного обмена НИИ клинической кардиологии им. А.Л. Мясникова.
Москва
Конфликт интересов:
Нет
А. В. Тюрина
Россия
Тюрина Александра Вячеславовна — к. м. н., м. н. с. лаборатории нарушений липидного обмена НИИ клинической кардиологии им. А.Л. Мясникова.
Москва
Конфликт интересов:
Нет
М. В. Ежов
Россия
Ежов Марат Владиславович — д. м. н., г. н. с. лаборатории нарушений липидного обмена НИИ клинической кардиологии им. А.Л. Мясникова.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
Что уже известно о предмете исследования?
- Липидология является одним из наиболее быстро развивающихся направлений медицины. Основными мишенями гиполипидемической терапии являются холестерин липопротеидов низкой плотности, липопротеид(а) и триглицериды.
Что нового?
- Полное секвенирование генома человека позволило не только определить основные молекулярные мишени гиперлипидемии, но и сформировать инновационные подходы к медикаментозному воздействию.
Возможный вклад в клиническую практику
- Таргетные липид-снижающие препараты открывают возможности для терапевтических решений, которые могут совершить революцию в лечении гиперлипидемии и атеросклероза.
Рецензия
Для цитирования:
Чубыкина У.В., Тюрина А.В., Ежов М.В. Эра таргетной терапии гиперлипидемий. Российский кардиологический журнал. 2024;29(8):6038. https://doi.org/10.15829/1560-4071-2024-6038. EDN: YYMUYK
For citation:
Chubykina U.V., Tyurina A.V., Ezhov M.V. The era of targeted therapy for hyperlipidemia. Russian Journal of Cardiology. 2024;29(8):6038. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6038. EDN: YYMUYK
JATS XML

















































