Перейти к:
Прогноз пациентов с ишемической болезнью сердца и сахарным диабетом — на что обратить внимание
https://doi.org/10.15829/1560-4071-2024-6030
EDN: DPDOQP
Аннотация
Пациенты с ишемической болезнью сердца (ИБС) и сахарным диабетом (СД) выделены экспертами в группу высокого сердечно-сосудистого риска как в России, так и за рубежом. Имея похожие пути развития и прогрессирования атеросклероза и атеротромбоза, эти заболевания потенцируют механизмы тромбообразования друг друга. В результате происходят неблагоприятные ишемические события со стороны сердца и сосудов, вносящие весомый вклад в показатели смертности данной группы больных. Влияние на риск тромбообразования является одним из ключевых звеньев на пути к улучшению прогноза пациентов с ИБС и СД. Современная антитромботическая терапия, включающая не только антиагрегант (ацетилсалициловую кислоту), но и антикоагулянт ривароксабан в дозе 2,5 мг позволяет максимально повлиять на пути развития атеротромбоза, тем самым снизить риски сердечнососудистых событий и смерти от всех причин. Цель обзора: проанализировать возможность снижения общего риска смерти при назначении основных групп препаратов, которые входят в состав терапии пациентов с ИБС и СД.
Ключевые слова
Для цитирования:
Некрасов А.А., Тимощенко Е.С., Некрасова Т.А., Бахрак Е.В. Прогноз пациентов с ишемической болезнью сердца и сахарным диабетом — на что обратить внимание. Российский кардиологический журнал. 2024;29(9):6030. https://doi.org/10.15829/1560-4071-2024-6030. EDN: DPDOQP
For citation:
Nekrasov A.A., Timoshchenko E.S., Nekrasova T.A., Bakhrak E.V. Prognosis of patients with coronary artery disease and diabetes — what to look for. Russian Journal of Cardiology. 2024;29(9):6030. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6030. EDN: DPDOQP
Смертность является важным медико-демографическим показателем состояния здоровья населения, а также критерием эффективности лечения пациента и исхода заболевания. Система здравоохранения любой страны стремится снижать этот показатель, используя различные программы диагностики и лечения пациентов, особенно в группах высокого риска.
Несмотря на положительную динамику, достигнутую по ряду медико-демографических показателей в Российской Федерации за последнее десятилетие, смертность от предотвратимых причин в нашей стране почти вдвое выше, чем в среднем по странам Европейского союза, а продолжительность жизни — на 8 лет ниже [1].
Большой вклад в развитие фатальных исходов вносят сердечно-сосудистые заболевания (ССЗ): ~1 млн пациентов в год умирают от болезней системы кровообращения, что составляет почти 50% от общего числа смертей по данным за 2022г1, 2. Весомый вклад в эти результаты вносят пациенты с атеросклеротическими заболеваниями.
По данным исследования Global Burden Disease, по всему миру наблюдается быстрый рост числа пациентов с ишемической болезнью сердца (ИБС). В 2017г таких пациентов насчитывалось 126 млн, а в 2019г — уже 197 млн, и прогнозируется рост числа больных в последующие годы [2]. Прогноз пациентов с ИБС представляется крайне неблагоприятным как во всем мире, так и в России, несмотря на проводимые лечебно-профилактические мероприятия. В 2022г смертность по причине ИБС составила >450 тыс. случаев, половину от всех смертей от причин, связанных с болезнями системы кровообращения2. Наиболее частыми причинами смерти у пациентов с ИБС являются внезапная сердечно-сосудистая смерть (16%), сердечная недостаточность (8,5%), инфаркт миокарда (ИМ) (6%), инсульт (5,5%), а среди не сердечно-сосудистых причин — онкология (20%) [3].
Число больных с сахарным диабетом (СД) также крайне высоко: их в мире насчитывается 425 млн, в Российской Федерации — 4,4 млн человек. При этом на СД 2 типа приходится 90-95% от числа всех больных с данным эндокринным заболеванием [4]. Пациенты с СД характеризуются высокими показателями смертности. В 2017г было зафиксировано 5 млн смертей у пациентов с СД в возрасте от 20 лет (9,9% от всех причин смерти пациентов этой возрастной категории) [5]. До 75-80% пациентов с СД 2 типа умирают от сердечно-сосудистых осложнений [6].
Так же как и в случае ИБС, прогнозируется увеличение количества больных с СД в последующие годы [5]. При исследовании 377909 человек по данным Биобанка Великобритании ИБС и СД 2 типа ассоциировались с увеличением риска смерти от сердечно-сосудистых причин более чем в 2 раза (отношение рисков (ОР) 2,61, 95% доверительный интервал (ДИ): 2,02-3,36 и ОР 2,08, 95% ДИ: 1,58-2,73, соответственно) [7]. При этом до 75% пациентов с ИБС могут иметь сопутствующий СД 2 типа [8]. Таким образом, ввиду широкой распространенности ИБС и СД, частого сочетания и схожего неблагоприятного влияния на прогноз, следует ожидать увеличения количества пациентов с высоким риском сердечно-сосудистых событий (ССС).
Учитывая высокую частоту неблагоприятных исходов, пациенты с СД и подтвержденными атеросклеротическими заболеваниями отнесены экспертами Европейского общества кардиологов к пациентам группы очень высокого сердечно-сосудистого риска (ССР), что подразумевает вероятность развития ССС в 20% и более случаев за 10 лет и требует комплексного подхода к контролю и коррекции вероятности неблагоприятных ССС и смертности [9].
Цель: проанализировать возможность снижения общего риска смерти для основных групп препаратов, которые входят в состав терапии пациентов с ИБС и СД.
Методология исследования
Методологический подход включал в себя несистематический поиск полнотекстовых статей рандомизированных клинических исследований (РКИ), метаанализов РКИ и клинических рекомендаций на английском и русском языках в электронных базах данных PubMed, Google Scholar, Elibrary по следующим запросам: общая смертность, ишемическая болезнь сердца, сахарный диабет, статины, ингибиторы пропротеин конвертазы субтилизин/кексин 9 типа (PCSK9), фибраты, бемпедоевая кислота, метформин, агонисты рецепторов глюкагоноподобного пептида-1 (арГПП-1), ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2), ингибиторы дипептидилпептидазы-4 (иДПП-4), ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов ангиотензина II (БРА), канакинумаб, колхицин, аспирин, антиагреганты, антитромботическая терапия.
Результаты
Причины высокого риска неблагоприятных ССС у пациентов с ИБС и СД
ИБС и СД 2 типа имеют общие звенья патогенеза (в т. ч. окислительный стресс, воспаление и атеротромбоз) и общие факторы риска, включая ожирение, гиперинсулинемию, гипертензию, дислипидемию и др.
Дислипидемия является одним из главных факторов, повреждающих эндотелий и вносящих вклад в развитие атеросклероза и ИБС. Циркулирующие в крови холестерин (ХС) и липопротеиды низкой плотности (ЛНП) в результате окисления модифицируются, проникают в субэндотелиальное пространство сосудов, после чего с помощью макрофагов преобразуются в пенистые клетки и формируют липидный слой [10].
На ранних этапах атеросклеротическая бляшка имеет тонкую соединительнотканную оболочку, небольшой размер и не вызывает гемодинамически значимого сужения коронарных артерий [11]. Тонкая фиброзная оболочка атеросклеротической бляшки может быть повреждена под влиянием внешних или внутренних факторов, что приводит к контакту содержимого бляшки с тромбоцитами и последующему формированию тромба на месте разрыва бляшки. В результате развивается острая ИБС. На поздних стадиях развития фиброзные бляшки имеют более прочную соединительнотканную капсулу [12].
Другим компонентом атеросклеротического процесса является дисфункция эндотелия. Основным веществом, продуцируемым эндотелием, является вазодилататор оксид азота (NO). NO снижает адгезию форменных элементов крови к сосудистой стенке, угнетает разрастание гладкомышечных клеток сосудов и препятствует выделению тканевых факторов, повышающих вероятность тромбообразования. Эндотелий также производит вещества с противоположным действием (вазоконстриктор), например, эндотелин-1, способствующий атеросклеротическому поражению сосудов. Повышение вазоконстрикторов и снижение выработки вазодилататоров является признаком эндотелиальной дисфункции, способствующей развитию атеросклероза [13].
СД 2 типа еще больше усиливает эндотелиальную дисфункцию сосудистой стенки из-за повышения продукции активных форм кислорода, вызывающих воспаление сосудистой стенки, хронической или острой гипергликемии, резистентности к инсулину, гиперинсулинемии и дислипидемии в сочетании со сниженным уровнем липопротеидов высокой плотности и повышенным уровнем ЛНП [14].
В патогенезе образования тромба ведущую роль играют изменения функциональной активности тромбоцитов, которым свойственна адгезия к коллагену на поврежденных участках сосудистой стенки, не покрытых эндотелием. Часто повреждение происходит в результате разрушения атеросклеротической бляшки, что приводит к контакту тромбоцитов с тромбогенными компонентами сосудистой стенки (тромбином, аденозиндифосфатом, коллагеном, биогенными аминами), которые также вызывают освобождение мощнейшего активатора агрегации тромбоксана А2. Последующие адгезия и агрегация тромбоцитов приводят к формированию пристеночных и окклюзирующих тромбов — патогенетической основы ИМ, ишемического инсульта, нестабильной стенокардии и других тромботических событий [15]. У пациентов с СД 2 типа увеличивается восприимчивость тромбоцитов к активации из-за более высокого содержания конечных продуктов гликозилирования, обусловливающих резистентность к инсулину и изменяющих текучесть мембраны; усиленного окислительного стресса, приводящего к образованию изопростанов и активации тромбоцитов путем взаимодействия с рецептором тромбоксана; более высокой продукции тромбоксана; повышенной экспрессии нескольких типов рецепторов, связанных с активацией тромбоцитов; более высокой реактивности нескольких активаторов тромбоцитов [14].
Одновременно с процессом активации и адгезии тромбоцитов в месте повреждения происходит процесс коагуляции. Активатор тромбоцитов — тканевой фактор — запускает каскад коагуляции и образование фермента свертывания крови — тромбина. Далее тромбин активирует образование из фибриногена нитей фибрина, которые входят в состав артериального тромба наряду с другими элементами крови [16].
СД 2 типа связан с более высокими количествами тканевого фактора, тромбина и фибриногена, а также гипофибринолитическим состоянием, характеризующимся более высоким содержанием ингибиторов активатора тканевого плазминогена и повышенным включением антифибринолитических белков в тромб, которые в совокупности снижают эффективность фибринолиза [14] (рис. 1).
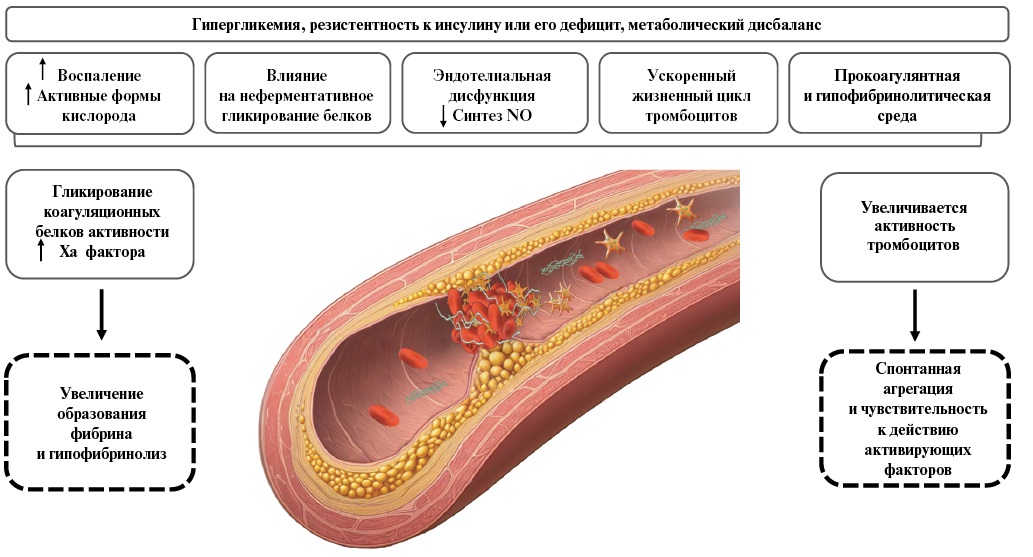
Рис. 1. Патогенетические причины развития артериального тромбоза
у пациентов с ИБС и СД.
Сокращение: NO — оксид азота.
Учитывая взаимное влияние патологических процессов у пациентов с ИБС и СД, становятся понятны опасения экспертов относительно высочайшего риска сердечно-сосудистых катастроф и высоких показателей смертности этих больных зачастую по причине фатальных тромботических событий.
Возможность снижения общей смертности как один из главных компонентов стратегии при лечении пациентов с ИБС и СД
Современный подход к выбору стратегии лечения пациентов предполагает проведение клинических исследований (КИ) для оценки эффективности и безопасности вмешательства и его влияния на прогноз жизни пациента. В КИ, направленных на изучение сердечно-сосудистых препаратов, чаще всего используются такие исходы, как общая смерть, смерть от сердечно-сосудистых причин, острый ИМ, острое нарушение мозгового кровообращения и т. д. — так называемые "жесткие" конечные точки (КТ). Но также могут оцениваться достижение целевых уровней артериального давления (АД), ЛНП, гликированного гемоглобина, фракция выброса левого желудочка и др. — такие точки называют суррогатными, или "мягкими" [17].
Параметр общей смертности — наиболее важный индикатор с демографической точки зрения, потому что включает в себя смерть от всех причин, включая не сердечно-сосудистые причины у пациентов с ССЗ. Кроме того, этот показатель отражает не только эффективность, но и безопасность проводимой терапии. Однако он имеет ряд ограничений, которые не позволяют широко его использовать в КИ: частота летальных событий ниже, чем отдельных не фатальных ССС, поэтому для достижения разницы по этому показателю среди групп сравнения необходим большой размер выборки и длительное наблюдение. Все это приводит к удорожанию проведения КИ [17].
В современном мире при использовании эффективных терапевтических стратегий частота неблагоприятных событий становится ниже, и для выявления разницы между группами стандартной и исследуемой терапии требуется большое количество пациентов и длительность наблюдения. Поэтому использование комбинированной КТ (например, сердечно-сосудистая смертность + ИМ + инсульт) в КИ стало общепринятой практикой, т. к. требует меньшего размера выборки, более короткого периода наблюдения, предлагает суммарную оценку эффекта лечения, которая становится актуальной в случае, если заболевание имеет несколько вариантов клинического течения. Например, атеросклеротическое поражение может проявляться в виде ИМ, инсульта, острой ишемии конечности или кардиоваскулярной смерти [17]. Важно подчеркнуть, что снижение риска комбинированной КТ, в которую входит показатель сердечно-сосудистой смерти, не всегда свидетельствует о возможности значимого влияния терапии именно на этот компонент. Так, в исследовании PEGASUS TIMI 54 у пациентов с ИМ от 1 до 3 лет в анамнезе применение тикагрелора в дозе 60 мг 2 раза/сут. в сочетании с ацетилсалициловой кислотой (АСК) позволило снизить относительный риск сердечно-сосудистой смерти/ИМ/инсульта на 16% (ОР 0,84, 95% ДИ: 0,74-0,95, р=0,004) в сравнении со стандартной терапией. Однако при анализе сердечно-сосудистой смертности, которая была выделена в качестве вторичной КТ, использование тикагрелора 60 мг в дополнение к АСК не повлияло на прогноз пациентов, и риск сердечно-сосудистой смерти был сопоставим с таковым на стандартной терапии (ОР 0,83, 95% ДИ: 0,68-1,01, р=0,07) [18]. Подобные результаты были получены в исследовании CANVAS, в котором канаглифлозин продемонстрировал превосходство по снижению риска ССС/сердечно-сосудистой смерти, не фатального ИМ и не фатального инсульта, по сравнению с плацебо у пациентов с СД 2 типа (ОР 0,84, 95% ДИ: 0,75-0,97). При этом риск сердечно-сосудистой смерти был сопоставим как на канаглифлозине, так и на стандартной терапии (ОР 0,87, 95% ДИ: 0,72-1,06) [19].
Таким образом, в РКИ не всегда удается продемонстрировать снижение риска сердечно-сосудистой или общей смертности. Однако если это фиксируется, то можно говорить о выраженном влиянии исследуемой терапии на прогноз жизни пациента. Такие результаты представляются важными для принятия клинического решения.
Рассмотрим, как основные направления терапии пациентов с ИБС и СД влияют на возможность сохранения жизни этих больных.
Коррекция дислипидемии
Для пациентов с ИБС и/или СД дислипидемия является одним из ведущих факторов риска развития и прогрессирования атеросклероза. Для коррекции дислипидемии необходимо использовать интенсивную гиполипидемическую терапию с ХС ЛНП ≥50% от исходных значений и <1,4 ммоль/л (55 мг/дл).
Терапией первой линии является применение статинов в максимально переносимых дозировках [9][20][21].
Исследование CARDS показало возможность снижения общего риска смерти у пациентов с СД при применении аторвастатина на 27% (p=0,059) [22]. Более свежие данные метаанализа 24 РКИ, включившего 2152137 пациентов с СД, показали отсутствие разницы по снижению риска смерти от всех причин у пациентов на терапии статинами по сравнению с теми, кто их не принимал как для первичной профилактики (ОР 0,89, 95% ДИ: 0,68-1,16, р=0,396), так и для вторичной (ОР 0,97, 95% ДИ: 0,86-1,09, p=0,600) [23].
При отсутствии эффекта от применения статинов рекомендовано использовать их комбинацию с эзетимибом и ингибиторами PSCK9 [9]. По данным исследования IMPROVE-IT, у пациентов после острого коронарного синдрома, добавление эзетимиба к терапии статинами обеспечивает дополнительное снижение относительного риска на 6% (ОР 0,936, 95% ДИ: 0,89-0,99, p=0,016) и абсолютного риска сердечно-сосудистой смерти/ИМ/ишемических цереброваскулярных событий на 2%. Однако при этом не было показано влияния на риск смерти от всех причин (ОР 1,01, 95% ДИ: 0,91-1,07, p=0,78) [24].
Ингибиторы PCSK9 (алирокумаб, эвалокумаб и инклисиран) снижают уровень ХС и ЛНП до 60% как при монотерапии, так и при присоединении к статинам и/или эзетимибу. Кроме того, ингибиторы PCSK9 снижают уровень триглицеридов, липопротеид(а), повышают ХС липопротеидов высокой плотности и аполипопротеида A1 [25-27].
Авторы метаанализа 54 РКИ, включившего данные о 87669 пациентах, принимавших ингибиторы PCSK9, отметили, что терапия эволокумабом, алирокумабом и инклисираном снижает риск сердечно-сосудистой смерти, однако влияние на риск общей смертности было показано только для алирокумаба (ОР 0,60, 95% ДИ: 0,43-0,84, р<0,01) по сравнению с контрольной группой [28].
Другой группой препаратов, которые изучались для снижения уровня липопротеидов, являются фибраты. Анализ 25 РКИ, в которых терапия фибратами сравнивалась как со статинами, так и с плацебо, а также оценивалась комбинация фибратов и статинов, не показал преимуществ данных препаратов по сравнению с терапией сравнения по снижению риска сердечно-сосудистой смерти и изменению липидного профиля [29].
Бемпедоевая кислота является пролекарством, которое снижает синтез ХС путем ингибирования АТФ-цитратлитазы. Анализ 6 РКИ, включивший 3956 пациентов с высоким ССР, не показал разницы по риску общей смертности (ОР 1,66, 95% ДИ: 0,45-6,04) среди пациентов, получавших бемпедоевую кислоту и плацебо [30].
Контроль гликемии
Важность строгого контроля гликемии для пациентов с СД 2 типа была показана в знаковом исследовании UKPDS: интенсивный контроль гликемии обеспечивал снижение ССР у пациентов с впервые выявленным СД, которые не принимали гипотензивные и гиполипидемические препараты. Для большинства взрослых пациентов с СД адекватным является целевой уровень гликированного гемоглобина <7,0% [21][31].
Метформин является наиболее изученным препаратом для инициальной и постоянной медикаментозной терапии СД 2 типа [21]. Применение метформина у пациентов с ССЗ ассоциируется со снижением риска как сердечно-сосудистой смерти (ОР 0,89, 95% ДИ: 0,85-0,94, p<0,0001), так и смерти от всех причин (ОР 0,90, 95% ДИ: 0,83-0,98, p=0,01) по сравнению с отсутствием терапии метформином [32].
У пациентов с высоким риском развития или наличием атеросклеротических ССЗ включение в схему лечения арГПП-1 или иНГЛТ-2 является болезнь-модифицирующим подходом к лечению. Если целевые значения гликемического контроля были достигнуты с использованием других средств, следует рассмотреть возможность включения в схему лечения препаратов из групп арГПП-1 или иНГЛТ-2 с подтвержденными преимуществами, заменив ими иные препараты [21].
Последние публикации показывают возможность сохранения жизни пациента при применении данных классов препаратов. Так, в анализе 10 исследований с участием 71553 пациентов с СД 2 типа в сочетании с ССЗ или ССР было показано значимое снижение риска смерти от всех причин на 13% на терапии иНГЛТ-2 по сравнению с плацебо (ОР 0,87, 95% ДИ: 0,80-0,96, р=0,004) [33].
арГПП-1 у пациентов с СД 2 типа также демонстрируют возможность снижения риска событий комбинированной КТ (ИМ, инсульт или сердечно-сосудистая смерть) на 14% (ОР 0,86, 95% ДИ: 0,80-0,93) и смерти от всех причин на 12% (ОР 0,88, 95% ДИ: 0,82-0,94) по сравнению с плацебо [34].
иДПП-4 также были изучены у пациентов с СД с сопутствующими ССЗ или высоким риском ССЗ. Метаанализ РКИ 157478 пациентов с СД 2 типа показал нейтральный эффект на риски развития как сердечно-сосудистой смерти (OР 0,95, 95% ДИ: 0,86-1,04; р=0,26), так и общей смертности (OР 0,84, 95% ДИ: 0,59-1,18; р=0,31) [35].
Контроль АД
У пациентов с СД активное лечение артериальной гипертензии (АГ) с достижением целевых значений АД снижает риск макро- и микрососудистых осложнений. Целевой уровень систолического АД для большинства пациентов <140 мм рт.ст. Снижение целевого систолического АД до 130 мм рт.ст. еще в большей степени уменьшает риск инсульта, ретинопатии и альбуминурии, и должно достигаться у некоторых пациентов. У пациентов со стабильной ИБС в сочетании с СД для профилактики сердечно-сосудистых осложнений рекомендуется назначать иАПФ или БРА [21]. Метаанализ 17 исследований, включивший 42037 пациентов с СД, получавших ингибиторы ренин-ангиотензиновой системы, показал, что для предотвращения одного летального исхода необходимо пролечить 106 пациентов в течение 3,7 лет (number needed to treat (NNT) 106, 95% ДИ: number needed to treat to benefit (NNTB) 56 — number needed to treat to harm (NNTH) 4938). При этом значимое влияние на риск общей смертности оказывали иАПФ (NNT 48, 95% ДИ: NNTB 29 — NNTH 198), в то время как БРА не показали преимуществ перед терапией плацебо (NNT 594, 95% ДИ: NNTB 150 — NNTH 89) [36].
Противовоспалительная терапия
Помимо традиционных факторов ССР, таких как АГ, дислипидемия, СД и др., в последние годы говорят о влиянии воспаления на риск сердечно-сосудистых катастроф [37].
Например, в рамках исследования CANTOS (Anti-Inflammatory Therapy with Canakinumab for Atherosclerotic Disease) иммунодепрессивное средство канакинумаб снижал риск ССС (острый ИМ, острое нарушение мозгового кровообращения и сердечно-сосудистая смерть) на 15%, не влияя на риск общей смертности (ОР 0,94, 95% ДИ: 0,83-1,06, р=0,31) на фоне базовой терапии статинами [38].
Также в КИ LoDoCo2 изучался колхицин у пациентов с ССЗ из группы высокого риска, получавших оптимальную медикаментозную терапию. По данным КИ, включившего 5522 пациентов с хронической ИБС, колхицин показал возможность снизить риск ССС (ОР 0,69, р<0,001), однако его применение не повлияло на риск общей смертности по сравнению с плацебо (ОР 1,21, 95% ДИ: 0,86-1,71) [39].
Антитромботическая терапия
Антитромботическая терапия рекомендуется всем пациентам с ИБС. Стандартом данного вида лечения является АСК [40]. Анализ 16 исследований 17 тыс. пациентов, которым был назначен аспирин для вторичной профилактики кардиоваскулярной смерти после ИМ, инсульта или транзиторной ишемической атаки, показал возможность снизить риск ИМ/инсульта/смерть от сердечно-сосудистых причин на 20% (ОР 0,80, 95% ДИ: 0,73-0,88) и риск смерти от всех причин на 10% (ОР 0,90, 95% ДИ: 0,82-0,99) по сравнению с отсутствием терапии аспирином [41]. Возможной альтернативой при непереносимости АСК является клопидогрел. В исследовании CAPRIE терапия клопидогрелом у 19185 пациентов с атеросклеротическими заболеваниями показала снижение риска сердечно-сосудистой смерти/ИМ/инсульта на 8,7% (95% ДИ: 0,3-16,5, р=0,043), без влияния на снижение смерти от всех причин (снижение ОР на 2,2%, р=0,71) [42].
Однако наличие СД у пациентов с ИБС сопровождается значимым повышением риска тромботических ССС. Комбинация этих заболеваний приводит к повышению активности процессов тромбообразования как со стороны тромбоцитарного пути, так и коагуляционного каскада. Пациенты с ИБС и СД, требующие медикаментозного лечения, относятся к категории высокого ишемического риска и требуют рассмотрения добавления второго антитромботического препарата к АСК для коррекции остаточного тромботического риска [9][21][40].
В анализе 4 РКИ, в которых пациенты с ИБС или заболеваниями периферических артерий принимали клопидогрел, клопидогрел + АСК, ривароксабан 2,5 мг 2 раза/сут. + АСК, ривароксабан 5 мг 2 раза/сут., ворапаксар, были показаны результаты альтернативной терапии по сравнению с монотерапией АСК. Только терапия ривароксабаном 2,5 мг 2 раза/сут. в сочетании с АСК показала значимое снижение риска ИМ/инсульта/сердечно-сосудистой смерти на 24% (ОР 0,76, 95% ДИ: 0,66-0,86), а также возможность сохранения жизни пациентов за счет снижения риска общей смертности на 18% (ОР 0,82, 95% ДИ: 0,71-0,96) согласно результатам исследования COMPASS [43]. Возможность существенно повлиять на прогноз пациента с ИБС продемонстрирована в другом метаанализе, который включил данные 4 РКИ и 75167 пациентов. Среди вариантов терапии были лечение тикагрелором 60 мг + АСК, ривароксабан 2,5 мг + АСК, ривароксабан 5 мг, тиенопиридин (клопидогрел или тиклопидин) + АСК. Только комбинированная терапия "антикоагулянт ривароксабан в сочетании с антиагрегантом АСК" показала снижение риска смерти от всех причин (OР 0,76, 95% ДИ: 0,65-0,90) [44].
Учитывая патогенез формирования артериальных тромбов и результаты КИ, очевидно, что пациентам с ИБС и СД, имеющим высокий риск неблагоприятных ССС, целесообразно усиление антитромботической терапии с целью дополнительного влияния на риск сердечно-сосудистых катастроф.
Для снижения риска сосудистых событий, риска смерти от всех причин, а значит улучшения прогноза пациента, в руководствах разных мировых кардиологических обществ эксперты рекомендуют рассмотреть добавление ривароксабана 2,5 мг 2 раза/сут. к АСК [9][21][40][45].
Данные о влиянии медикаментозной терапии пациентов с ИБС и/или СД на риск смерти от всех причин приведены в таблице 1.
Таблица 1
Влияние медикаментозной терапии пациентов с ИБС и/или СД
на риск смерти от всех причин
|
Вид вмешательства |
Влияние на риск общей смертности для пациентов с ИБС и/или СД |
|
|
Изменение образа жизни, отказ от вредных привычек |
+ |
|
|
Контроль дислипидемии |
Статины |
+/- |
|
Статины+эзетимиб |
- |
|
|
Ингибиторы PCSK9 |
+/- |
|
|
Фибраты, бемпедоевая кислота |
- |
|
|
Контроль гликемии |
Метформин |
+ |
|
иНГЛТ-2 |
+ |
|
|
арГПП-1 |
+ |
|
|
иДПП-4 |
- |
|
|
Контроль давления |
иАПФ |
+ |
|
БРА |
- |
|
|
Противовоспалительная терапия |
Колхицин |
- |
|
Антитромботическая терапия |
АСК |
+ |
|
Ингибиторы P2Y12 |
- |
|
|
Ингибиторы P2Y12+АСК |
- |
|
|
Ривароксабан 2,5 мг+АСК |
+ |
|
Сокращения: арГПП-1 — агонисты рецепторов глюкагоноподобного пептида-1, АСК — ацетилсалициловая кислота, БРА — блокаторы рецепторов ангиотензина II, иАПФ — ингибиторы ангиотензинпревращающего фермента, ИБС — ишемическая болезнь сердца, иДПП-4 — ингибиторы дипептидилпептидазы-4, иНГЛТ-2 — ингибиторы натрий-глюкозного котранспортера 2 типа, СД — сахарный диабет, PCSK9 — пропротеин конвертаза субтилизин/кексин 9 типа.
Заключение
Во всем мире отмечается тенденция к увеличению количества пациентов с ИБС и СД, относящихся к группе очень высокого риска неблагоприятных событий, большая часть которых составляет последствия прогрессирования атеросклеротических заболеваний. Высокий риск может быть реализован как посредством сердечно-сосудистых катастроф, так и фатальными событиями. Для эффективной коррекции высоких рисков осложнений необходимо использовать комплекс мероприятий, направленных на модификацию образа жизни, физических параметров пациента, достижения целевых значений показателей липидного спектра, АД, глюкозы в крови, а также обязательный контроль за высокими рисками тромботических событий. И только одновременное воздействие на все возможные патогенетические пути реализации ССР может положительно влиять на стабилизацию и улучшение прогноза пациента.
Во всех патогенетических направлениях, таких как дислипидемия, АГ, гипергликемия, повышенные тромботические риски, присутствуют варианты терапевтической коррекции, дающие врачу возможность снизить риски ИМ, инсульта, прогрессирования сопутствующих заболеваний и снизить риск смерти от всех причин. Добавление антикоагулянта к АСК позволяет максимально полно воздействовать на процесс атеротромбоза, по сравнению с терапией, которая включает только антиагрегантные препараты. Из пероральных антикоагулянтов только ривароксабан 2,5 мг одобрен для назначения пациентам с ИБС на фоне синусового ритма и рекомендован как российскими, так и рядом зарубежных рекомендаций.
Отношения и деятельность. Статья подготовлена для специалистов здравоохранения при научной поддержке АО БАЙЕР. 06.2024. PP-M_RIV-RU-0085-1.
1. Федеральная служба государственной статистики. Статистический сборник "Здравоохранение в России, 2023г". https://rosstat.gov.ru/folder/210/document/13218.
2. Федеральная служба государственной статистики. Смертность населения по основным классам и отдельным причинам смерти. 2022г. https://rosstat.gov.ru/compendium/document/13269.
Список литературы
1. Шарапова О.В., Самойлова А.В., Мингазова Э.Н. и др. Картографический анализ состояния показателей общей заболеваемости и смертности населения в субъектах российской федерации за 10-летний период. Проблемы социальной гигиены, здравоохранения и истории медицины. 2020;28(спецвыпуск):822-6. doi:10.32687/0869-866X-2020-28-s1-822-826.
2. Khan MA, Hashim MJ, Mustafa H, et al. Global Epidemiology of Ischemic Heart Disease: Results from the Global Burden of Disease Study. Cureus. 2020;12(7):e9349. doi:10.7759/cureus.9349.
3. Wang EY, Dixson J, Schiller NB, et al. Causes and Predictors of Death in Patients With Coronary Heart Disease (from the Heart and Soul Study). Am J Cardiol. 2017;119(1):27- 34. doi:10.1016/j.amjcard.2016.09.006.
4. Seferovic PM, Petrie MC, Filippatos GS, et al. Type 2 diabetes mellitus and heart failure: a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2018;20(5):853-72. doi:10.1002/ejhf.1170.
5. Cho NH, Shaw JE, Karuranga S, et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045. Diabetes Res Clin Pract. 2018;138:271-81. doi:10.1016/j.diabres.2018.02.023.
6. Raghavan S, Vassy JL, Ho YL, et al. Diabetes Mellitus-Related All-Cause and Cardiovascular Mortality in a National Cohort of Adults. J Am Heart Assoc. 2019;8(4):e011295. doi:10.1161/JAHA.118.011295.
7. Yun JS, Jung SH, Shivakumar M, et al. Associations between polygenic risk of coronary artery disease and type 2 diabetes, lifestyle, and cardiovascular mortality: A prospective UK Biobank study. Front Cardiovasc Med. 2022;9:919374. doi:10.3389/fcvm.2022.919374.
8. Standl E, Khunti K, Hansen TB, et al. The global epidemics of diabetes in the 21st century: Current situation and perspectives. Eur J Prev Cardiol. 2019;26(2_suppl):7-14. doi:10.1177/2047487319881021.
9. Fauchier L, Halle M, Herrington WG, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023;44(39):4043-140. doi:10.1093/eurheartj/ehad192.
10. Бунин В.А., Линькова Н. С., Кожевникова Е.О. Ишемическая болезнь сердца и инфаркт миокарда: от патогенеза к молекулярным маркерам диагностики. Успехи физиологических наук. 2020;51(1):33-45. doi:10.31857/S030117982001004X.
11. Choi HY, Hafiane A, Schwertani A, et al. High-Density Lipoproteins: Biology, Epidemiology, and Clinical Management. Can J Cardiol. 2017;33(3):325-33. doi:10.1016/j.cjca.2016.09.012.
12. Patel AK, Suri HS, Singh J, et al. A Review on Atherosclerotic Biology, Wall Stiffness, Physics of Elasticity, and Its Ultrasound-Based Measurement. Curr Atheroscler Rep. 2016;18(12):83. doi:10.1007/s11883-016-0635-9.
13. Gimbrone MA Jr, García-Cardeña G.Endothelial Cell Dysfunction and the Pathobiology of Atherosclerosis. Circ Res. 2016;118(4):620-36. doi:10.1161/CIRCRESAHA.115.306301.
14. Ajjan RA, Kietsiriroje N, Badimon L, et al. Antithrombotic therapy in diabetes: which, when, and for how long? Eur Heart J. 2021;42(23):2235-59. doi:10.1093/eurheartj/ehab128.
15. Николаева Т.О. Роль тромбоцитов в патогенезе атеросклероза. Атеросклероз. 2021;17(3):106-19. doi:10.52727/2078-256Х-2021-3-106-119.
16. De Caterina, Raffaele, et al. Arterial thrombosis: pathophysiological background, The ESC Textbook of Thrombosis, The European Society of Cardiology Series (Oxford, 2023; online edn, Oxford Academic, 1 Oct. 2023). doi:10.1093/med/9780192869227.003.0001. ISBN: 9780192869227.
17. Навасардян А.Р., Марцевич С.Ю. Конечные точки: виды, особенности выбора, интерпретация полученных результатов на примере кардиологических исследований. Кардиоваскулярная терапия и профилактика. 2022;21(5):3243. doi:10.15829/1728-8800-2022-3243.
18. Bonaca MP, Bhatt DL, Braunwald E, et al. Design and rationale for the Prevention of Cardiovascular Events in Patients With Prior Heart Attack Using Ticagrelor Compared to Placebo on a Background of Aspirin-Thrombolysis in Myocardial Infarction 54 (PEGASUSTIMI 54) trial. Am Heart J. 2014;167(4):437-444.e5. doi:10.1016/j.ahj.2013.12.020.
19. Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017;377(7):644-57. doi:10.1056/NEJMoa1611925.
20. Ежов М.В., Кухарчук В.В., Сергиенко И.В. и др. Российское кардиологическое общество (РКО). Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471.
21. Бойцов С.А., Погосова Н.В., Аншелес А.А. и др. Российское кардиологическое общество (РКО). Кардиоваскулярная профилактика 2022. Российские национальные рекомендации. Российский кардиологический журнал. 2023;28(5):5452. doi:10.15829/1560-4071-2023-5452.
22. Kearney PM, Blackwell L, Collins R, et al. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet (London, England). 2008;371(9607):117-25. doi:10.1016/S0140-6736(08)60104-X.
23. Yang XH, Zhang BL, Cheng Y, et al. Statin use and the risk of CVD events, stroke, and all-cause mortality in patients with diabetes: A systematic review and meta-analysis. Nutr Metab Cardiovasc Dis. 2022;32(11):2470-82. doi:10.1016/j.numecd.2022.07.018.
24. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015;372(25):2387-97. doi:10.1056/NEJMoa1410489.
25. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713-22. doi:10.1056/NEJMoa1615664.
26. Schwartz GG, Steg PG, Szarek M, et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018;379(22):2097-107. doi:10.1056/NEJMoa1801174.
27. Ray KK, Wright RS, Kallend D, et al. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med. 2020;382(16):1507-19. doi:10.1056/NEJMoa1912387.
28. Imran TF, Khan AA, Has P, et al. Proprotein convertase subtilisn/kexin type 9 inhibitors and small interfering RNA therapy for cardiovascular risk reduction: A systematic review and meta-analysis. PLoS One. 2023;18(12):e0295359. doi:10.1371/journal.pone.0295359.
29. Rodriguez-Gutierrez R, Garcia-Leal M, Raygoza-Cortez K, et al. Benefits and harms of fibrate therapy in patients with type 2 diabetes: a systematic review and meta-analysis. Endocrine. 2023;81(2):231-45. doi:10.1007/s12020-023-03401-y.
30. Lin Y, Parco C, Karathanos A, et al. Clinical efficacy and safety outcomes of bempedoic acid for LDL-C lowering therapy in patients at high cardiovascular risk: a systematic review and meta-analysis. BMJ open. 2022;12(2):e048893. doi:10.1136/bmjopen-2021-048893.
31. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352(9131):837-53.
32. Li T, Providencia R, Jiang W, et al. Association of Metformin with the Mortality and Incidence of Cardiovascular Events in Patients with Pre-existing Cardiovascular Diseases. Drugs. 2022;82(3):311-22. doi:10.1007/s40265-021-01665-0.
33. Bhattarai M, Salih M, Regmi M, et al. Association of Sodium-Glucose Cotransporter 2 Inhibitors With Cardiovascular Outcomes in Patients With Type 2 Diabetes and Other Risk Factors for Cardiovascular Disease: A Meta-analysis. JAMA Netw Open. 2022;5(1):e2142078. doi:10.1001/jamanetworkopen.2021.42078.
34. Sattar N, Lee MMY, Kristensen SL, et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol. 2021;9(10):653-62. doi:10.1016/S2213-8587(21)00203-5.
35. Liu D, Jin B, Chen W, et al. Dipeptidyl peptidase 4 (DPP-4) inhibitors and cardiovascular outcomes in patients with type 2 diabetes mellitus (T2DM): a systematic review and meta-analysis. BMC Pharmacology and Toxicology. 2019;20:1-9. doi:10.1186/s40360-019-0293-y.
36. Yang XC, Shao LL, Mi YJ, et al. Effect of renin-angiotensin-aldosterone system inhibitors on all-cause mortality and major cardiovascular events in patients with diabetes: A meta-analysis focusing on the number needed to treat and minimal clinical effect. J Diabetes Complications. 2021;35(3):107830. doi:10.1016/j.jdiacomp.2020.107830.
37. Dhindsa DS, Sandesara PB, Shapiro MD, et al. The evolving understanding and approach to residual cardiovascular risk management. Frontiers in Cardiovascular Medicine. 2020;7:88. doi:10.3389/fcvm.2020.00088/full.
38. Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377(12):1119-31. doi:10.1056/NEJMoa1707914.
39. Nidorf SM, Fiolet AT, Mosterd A, et al. Colchicine in patients with chronic coronary disease. New England journal of medicine. 2020;383(19):1838-47. doi:10.1056/NEJMoa2021372.
40. Российское кардиологическое общество (РКО). Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4076. doi:10.15829/29/1560-4071-2020-4076.
41. Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 2009;373(9678):1849-60. doi:10.1016/S0140-6736(09)60503-1.
42. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). The Lancet. 1996;348(9038):1329-39. doi:10.1016/s0140-6736(96)09457-3.
43. Bauersachs R, Wu O, Briere JB, et al. Antithrombotic Treatments in Patients with Chronic Coronary Artery Disease or Peripheral Artery Disease: A Systematic Review of Randomised Controlled Trials. Cardiovasc Ther. 2020;2020(1):3057168. doi:10.1155/2020/3057168.
44. Zhu H, Xu X, Fang X, et al. Efficacy and Safety of Long-Term Antithrombotic Strategies in Patients With Chronic Coronary Syndrome: A Network Meta-analysis of Randomized Controlled Trials. J Am Heart Assoc. 2021;10(6):e019184. doi:10.1161/JAHA.120.019184.
45. Virani SS, Newby LK, Arnold SV, et al. 2023 AHA/ACC/ACCP/ASPC/NLA/PCNA Guideline for the Management of Patients With Chronic Coronary Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2023;148(9):e9-e119. doi:10.1161/CIR.0000000000001168.
Об авторах
А. А. НекрасовРоссия
Некрасов Алексей Анатольевич — д.м.н., профессор, зав. кафедрой факультетской и поликлинической терапии
Нижний Новгород
Е. С. Тимощенко
Россия
Тимощенко Елена Сергеевна — зав. городским кардиологическим диспансером и ревматологическим центром, руководитель, главный внештатный специалист по кардиологии МЗ НО
Нижний Новгород
Т. А. Некрасова
Россия
Некрасова Татьяна Анатольевна — д.м.н., профессор кафедры эндокринологии и внутренних болезней
Нижний Новгород
Е. В. Бахрак
Россия
Бахрак Екатерина Владимировна — региональный медицинский консультант
Москва
Дополнительные файлы
- При выборе терапии пациентов с ишемической болезнью сердца, сахарным диабетом и высоким риском сердечно-сосудистых событий важно влиять на прогноз и снижение риска смерти.
- Важно учитывать значительную роль гиперкоагуляции в структуре причин сердечно-сосудистых событий и смерти и контролировать ее с помощью комбинированной антитромботической терапии.
Рецензия
Для цитирования:
Некрасов А.А., Тимощенко Е.С., Некрасова Т.А., Бахрак Е.В. Прогноз пациентов с ишемической болезнью сердца и сахарным диабетом — на что обратить внимание. Российский кардиологический журнал. 2024;29(9):6030. https://doi.org/10.15829/1560-4071-2024-6030. EDN: DPDOQP
For citation:
Nekrasov A.A., Timoshchenko E.S., Nekrasova T.A., Bakhrak E.V. Prognosis of patients with coronary artery disease and diabetes — what to look for. Russian Journal of Cardiology. 2024;29(9):6030. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6030. EDN: DPDOQP
JATS XML

















































