Перейти к:
Связь полиморфных вариантов rs6842241 гена EDNRA и rs9818870 гена MRAS с предрасположенностью к ишемической болезни сердца и их влияние на гиполипидемическое действие розувастатина
https://doi.org/10.15829/1560-4071-2024-6026
EDN: BKKEXX
Аннотация
Цель. Изучить влияние полиморфных вариантов генов EDNRA (rs6842241) и MRAS (rs9818870) на гиполипидемическое действие розувастатина у пациентов, страдающих ишемической болезнью сердца (ИБС), а также определить роль данных локусов в развитии ИБС среди жителей Центральной России.
Материал и методы. В фармакогенетическом исследовании участвовали 116 пациентов с ИБС: стабильной стенокардией напряжения II-III функциональных классов. Пациенты получали розувастатин с титрованием дозы до достижения целевых значений холестерина липопротеидов низкой плотности (ХС ЛНП). В генетико-эпидемиологическое исследование были включены образцы ДНК 1960 жителей Центральной России (из них 1261 пациент с ИБС и 699 здоровых лиц). Генотипирование полиморфных вариантов выполнялось на геномном масс-спектрометре MassARRAY-4. Ассоциации полиморфизмов с динамикой изменения липидов за 1, 6 и 12 мес. наблюдения рассчитывались методом линейного регрессионного анализа с поправкой на пол, возраст, индекс массы тела и дозу розувастатина; ассоциации с риском развития ИБС — методом логистического регрессионного анализа с поправкой на пол и возраст. Статистическая значимость ассоциаций рассчитывалась с использованием пермутационного теста.
Результаты. Носительство генотипов AA и CA rs6842241 гена EDNRA было связано с ослаблением гиполипидемического действия розувастатина в отношении общего холестерина (β=0,075, p=0,001) и ХС ЛНП (β=0,145, p=0,017) по итогам первого месяца, а также 12 мес. терапии (β=0,049, p=0,013 и β=0,072, p=0,040, соответственно). Носительство генотипа AA rs6842241 гена EDNRA было связано с повышением риска развития ИБС (отношение шансов 5,36; 95% доверительный интервал: 1,62-17,71, p=0,004). rs9818870 гена MRAS не был связан ни с фармакогенетикой розувастатина, ни с риском развития ИБС. Оба полиморфных варианта не были ассоциированы с уровнями липидов вне гиполипидемической терапии, а также с динамикой изменения триглицеридов. Динамика холестерина липопротеидов высокой плотности за всё время наблюдения изменялась незначительно.
Заключение. Полиморфный вариант rs6842241 гена EDNRA связан как с ослаблением гиполипидемического действия розувастатина у пациентов с ИБС, так и с повышенным риском развития данного заболевания в популяции.
Для цитирования:
Кононов С.И., Азарова Ю.Э., Клёсова Е.Ю., Быканова М.А., Солодилова М.А., Полоников А.В. Связь полиморфных вариантов rs6842241 гена EDNRA и rs9818870 гена MRAS с предрасположенностью к ишемической болезни сердца и их влияние на гиполипидемическое действие розувастатина. Российский кардиологический журнал. 2024;29(10):6026. https://doi.org/10.15829/1560-4071-2024-6026. EDN: BKKEXX
For citation:
Kononov S.I., Azarova Yu.E., Klyosova E.Yu., Bykanova M.A., Solodilova M.A., Polonikov A.V. Relationship of EDNRA rs6842241 and MRAS rs9818870 polymorphic variants with predisposition to coronary artery disease and their effect on the lipid-lowering effect of rosuvastatin. Russian Journal of Cardiology. 2024;29(10):6026. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6026. EDN: BKKEXX
Ишемическая болезнь сердца (ИБС) представляет собой сложное многофакторное заболевание. По данным полногеномных ассоциативных исследований (GWAS) выявлено >200 ключевых хромосомных локусов, влияющих на риск развития ИБС, в числе которых полиморфные варианты в генах EDNRA и MRAS [1-3]. Ген EDNRA кодирует рецептор типа А к эндотелину — мощному сосудосуживающему фактору. Однонуклеотидные полиморфизмы (ОНП) данного гена по данным полногеномных исследований ассоциированы с сердечно-сосудистой патологией атеросклеротического генеза — кроме ИБС, это заболевание периферических артерий [2][4]. Продукт гена MRAS вовлечен в ключевые механизмы атеросклероза: адгезия лейкоцитов, баланс про- и противовоспалительных цитокинов в сосудистой стенке. Варианты данного гена связаны с изменениями гладкомышечных клеток сосудов и интимы, характерными для атеросклеротического процесса [3].
Ранее нами было показано, что одни и те же полиморфные варианты генов способны влиять как на предрасположенность к развитию ИБС, так и на фармакогенетику розувастатина у лиц, страдающих ИБС [5]. Фармакогенетические ассоциации для связанных с ИБС локусов в генах EDNRA (rs6842241) и MRAS (rs9818870) ранее не исследовались. При этом влияние указанных полиморфизмов на гиполипидемическое действие розувастатина можно рассматривать как потенциально возможное. Так, в эксперименте у крыс и кроликов, получавших флувастатин и аторвастатин в субтерапевтических и терапевтических дозах зарегистрировано снижение экспрессии EDNRA [6][7]. С другой стороны, антагонизм в отношении эндотелиновых рецепторов типа А приводит к снижению уровней холестерина липопротеидов низкой плотности (ХС ЛНП) и триглицеридов (ТГ) [8]. Таким образом, связь между эндотелиновым рецептором типа А (EDNRA) и статинами, а также между EDNRA и липидным спектром, имеет место. Для ряда полиморфных вариантов другого гена — MRAS, кроме влияния на риск ИБС, описаны ассоциации с показателями липидного обмена вне фармакогенетики [3].
Таким образом, с учетом связи генов EDNRA и MRAS и их продуктов с липидным обменом, но отсутствия фармакогенетических исследований данных локусов, целью настоящей работы было изучение влияния ОНП генов EDNRA (rs6842241) и MRAS (rs9818870) на гиполипидемическое действие розувастатина у пациентов, страдающих ИБС, а также определение роли данных локусов в развитии ИБС среди жителей Центральной России.
Материал и методы
Исследование выполнялось с соблюдением этических норм: Хельсинкской декларации, наличия добровольного информированного согласия на проведение исследования, одобрения Регионального этического комитета Курского государственного медицинского университета (КГМУ).
Описание выборки. В фармакогенетическое исследование включались 116 пациентов, страдающих ИБС: стабильной стенокардией напряжения II-III функциональных классов, подтвержденной клинически в сочетании с нагрузочными тестами (тредмил-тест, велоэргометрия). Пациенты характеризовались дислипидемией, которая определялась как повышение общего холестерина (ОХС) ≥4,0 ммоль/л и ХС ЛНП ≥1,8 ммоль/л, с учетом национальных рекомендаций по диагностике и коррекции нарушений липидного обмена V пересмотра, действовавших на момент набора материала. Выборка включала 85 мужчин (73%) и 31 женщину в постменопаузе (27%). Средний возраст 61,0±7,25 лет. 58% пациентов в прошлом перенесли инфаркт миокарда, фоновая гипертоническая болезнь имела место у 97,5% лиц. Средний индекс массы тела составил 28,8±4,2 кг/м². Стартовые уровни липидов (данные в виде медианы (первый; третий квартили)) составили: ОХС 5,28 (4,60; 6,06) ммоль/л, ХС ЛНП 3,27 (2,70; 4,08) ммоль/л, холестерин липопротеидов высокой плотности (ХС ЛВП) 1,06 (0,97; 1,29) ммоль/л, ТГ 1,71 (1,22; 2,37) ммоль/л. Для генетико-ассоциативного исследования предрасположенности к ИБС, а также исследования ассоциаций с уровнями липидов вне гиполипидемической терапии, ранее описанная выборка была расширена за счет образцов ДНК и фенотипических данных пациентов славянского происхождения (самоидентификация), аккумулированных в биобанке НИИ Генетической и молекулярной эпидемиологии КГМУ, набранных в ранее проводимых генетико-эпидемиологических исследованиях [9]. Суммарный объем выборки составил 1960 лиц (1261 случай, включавший стабильную стенокардию напряжения и постинфарктный кардиосклероз, 699 — контрольная группа), её подробное описание представлено в работе [10].
Дизайн фармакогенетического исследования. Пациенты получали розувастатин в стартовой дозе 5 мг с повышением до 10-20-40 мг при недостижении целевых показателей ХС ЛНП <1,8 ммоль/л, контроль которых проводился каждый месяц. При достижении рекомендованных уровней липидов пациенты продолжали принимать препарат в той дозе, на которой это произошло. В анализ включались уровни липидов по прошествии 1, 6 и 12 мес. наблюдения.
Биохимические исследования. Уровни ОХС, ТГ, ХС ЛВП определялись с помощью автоматических анализаторов "Vitalab Flexor E" (Vital Scientific, Нидерланды), Cobas c 311 (Roche Diagnostics, Германия). Уровни ХС ЛНП рассчитывались по формуле Фридвальда.
Генетико-ассоциативный анализ. Полиморфные варианты rs6842241 гена EDNRA и rs9818870 гена MRAS отбирались на основании известных полногеномных ассоциаций с предрасположенностью к ИБС [1-3]. Генотипирование ОНП проводилось по технологии iPLEX с помощью геномного масс-спектрометра MassARRAY-4 (Agena Bioscience, США). Дизайн мультиплексной панели разработан с помощью программного обеспечения MassARRAY Assay Design Suite (https://agenacx.com).
Статистический анализ. Распределение липидных показателей отличалось от нормального (по критериям Колмогорова-Смирнова и Шапиро-Уилка). Значимость динамики изменения липидов оценивалась по парному критерию Вилкоксона. Соответствие распределения генотипов равновесию Харди-Вайнберга (РХВ) — точным критерием Фишера. Для определения ассоциаций генотипа и риска развития ИБС использовался логистический регрессионный анализ с поправкой на пол и возраст, для ассоциаций с динамикой липидов (рассчитывалась как отношение разницы трансформированных по натуральному логарифму показателей после лечения и до лечения, деленных на показатель до лечения) — линейный регрессионный анализ с поправкой на пол, возраст, индекс массы тела и дозу розувастатина. Протестированы 3 генетические модели — доминантная, рецессивная, аддитивная. Уровни p сгенерированы с помощью пермутационного (перестановочного) теста с максимальным числом перестановок, равным 1 млн. Проверка на нормальность распределения, описательная статистика, значимость динамики липидов оценена в пакете прикладных программ Statistica 13.3 (TIBCO, США). Регрессионный анализ, пермутационные тесты, соответствие распределения генотипов РХВ выполнены в программе PLINK v1.92. Все результаты считались статистически значимыми при значении p<0,05.
Результаты
Генотипы полиморфных вариантов rs6842241 (EDNRA) и rs9818870 (MRAS) находились в РХВ (p=0,39 и 0,85, соответственно). При оценке влияния полиморфных вариантов на риск развития ИБС (табл. 1) установлено, что повышенный риск болезни наблюдался у гомозигот по вариантному аллелю rs6842241-AA гена EDNRA. Вариант rs9818870 гена MRAS не показал связи с риском развития заболевания.
Таблица 1
Частоты аллелей и генотипов полиморфных вариантов генов в группах пациентов с ИБС и контроля
|
ОНП (ген) |
Генотип, аллель |
Больные, n (%)* |
Здоровые, n (%)* |
ОШ (95% ДИ)† |
p§ |
|
Ассоциации с ишемической болезнью сердца |
|||||
|
rs6842241 (EDNRA) |
CC |
907 (73,4) |
525 (76,0) |
5,36 (1,62-17,71)R |
0,004 |
|
CA |
300 (24,3) |
163 (23,6) |
|||
|
AA |
28 (2,3) |
3 (0,4) |
|||
|
n=1235 |
n=691 |
||||
|
A |
356 (14,4) |
169 (12,2) |
1,21 (0,99-1,47) |
0,079 |
|
|
rs9818870 (MRAS) |
CC |
944 (75,7) |
503 (72,1) |
0,86 (0,71-1,04) |
0,095 |
|
CT |
281 (22,5) |
182 (26,1) |
|||
|
TT |
22 (1,8) |
13 (1,9) |
|||
|
n=1247 |
n=698 |
||||
|
T |
325 (13,0) |
208 (14,9) |
0,86 (0,71-1,03) |
0,098 |
|
Примечание: * — абсолютное число и % индивидов с представленными генотипами или аллелями, † — ОШ (95% ДИ) с поправкой на пол и возраст, в надстрочном символе указана генетическая модель (R — рецессивная) с наименьшим значением p, § — значение p по данным пермутационного теста.
Сокращения: ДИ — доверительный интервал, ОНП — однонуклеотидный полиморфизм, ОШ — отношение шансов.
В дальнейшем оценивалась связь полиморфных вариантов с уровнями липидов у пациентов, страдающих ИБС, вне гиполипидемической терапии (n=218). Установлено, что ни один из вариантов не был ассоциирован со стартовыми уровнями ОХС (p=0,14 и 0,44 для rs6842241 и rs9818870, соответственно), ХС ЛНП (p=0,06 и 0,25, соответственно), ХС ЛВП (p=0,55 и 0,37, соответственно) и ТГ (p=0,32 и 0,39, соответственно). За время наблюдения терапия розувастатином привела к достижению большинством пациентов (n=110, 94,8%) целевого уровня ХС ЛНП. Изменение уровней ОХС, ХС ЛНП и ТГ было статистически значимым по прошествии 1, 6 и 12 мес. наблюдения (p<1×10⁵ для всех показателей за указанные периоды измерения). Изменение ХС ЛВП было статистически незначимым (p=0,42, 0,16 и 0,87, соответственно, для указанных периодов).
Ассоциации исследованных полиморфизмов с динамикой изменения липидов плазмы крови представлены в таблице 2. На рисунке 1 отражены наиболее значимые ассоциации с динамикой изменения ОХС и ХС ЛНП. Ассоциации с динамикой изменения ОХС и ХС ЛНП были обнаружены для полиморфного варианта rs6842241 гена EDNRA. По итогам 1 мес. терапии розувастатином носители генотипов CA и AA rs6842241 характеризовались более слабым гиполипидемическим действием исследованного препарата по сравнению с гомозиготами CC по аллелю "дикого" типа, как в отношении ОХС (p=0,001), так и в отношении ХС ЛНП (p=0,017, табл. 2 и рис. 1). По итогам 6 мес. наблюдения значимых ассоциаций не обнаружено, а по итогам 12 мес. повторились ассоциации, обнаруженные за 1 мес. терапии. Так, носители вариантного аллеля A (лица с генотипами AA и CA) rs6842241 вновь продемонстрировали более слабый ответ на терапию розувастатином по сравнению с гомозиготами по аллелю "дикого" типа (доминантная генетическая модель) как в отношении ОХС (p=0,017), так и ХС ЛНП (p=0,040, табл. 2).
Таблица 2
Ассоциации полиморфных вариантов генов с динамикой изменения ОХС, ХС ЛНП и ТГ по итогам 1, 6 и 12 мес. терапии розувастатином у пациентов с ИБС
|
ОНП (ген) |
МА |
ЧМА |
n |
1 мес. терапии |
6 мес. терапии |
12 мес. терапии |
|||
|
β* |
p† |
β* |
p† |
β* |
p† |
||||
|
Общий холестерин |
|||||||||
|
rs6842241 (EDNRA) |
A |
0,180 |
103 |
0,075 |
0,001D |
0,030 |
0,160 |
0,049 |
0,013D |
|
rs9818870 (MRAS) |
T |
0,151 |
116 |
0,010 |
0,155 |
0,011 |
0,520 |
-0,112 |
0,060 |
|
Холестерин липопротеидов низкой плотности |
|||||||||
|
rs6842241 (EDNRA) |
A |
0,180 |
103 |
0,145 |
0,017D |
0,041 |
0,281 |
0,072 |
0,040D |
|
rs9818870 (MRAS) |
T |
0,151 |
116 |
-0,156 |
0,247 |
0,057 |
0,163 |
-0,234 |
0,056 |
|
Триглицериды |
|||||||||
|
rs6842241 (EDNRA) |
A |
0,180 |
103 |
0,814 |
0,405 |
-0,945 |
0,179 |
-0,183 |
0,857 |
|
rs9818870 (MRAS) |
T |
0,151 |
116 |
0,759 |
0,412 |
0,155 |
0,611 |
-0,236 |
0,500 |
Примечание: * — коэффициент линейной регрессии для разности трансформированных по натуральному логарифму уровней липидов после и до лечения, деленной на трансформированный по натуральному логарифму уровень липидов до лечения. β отражает различие гиполипидемического эффекта между носителями генотипов в соответствии с генетической моделью и носителями альтернативных генотипов. β с "-" знаком отражает лучший ответ на терапию (более выраженное снижения уровней липидов), с "+" знаком — более слабый ответ на терапию. Коэффициенты регрессии получены с помощью линейного регрессионного анализа с поправкой на пол, возраст, индекс массы тела и дозу розувастатина, † — уровень значимости ассоциации по результатам пермутационного теста. В надстрочном символе указана генетическая модель с наилучшей статистической значимостью (D — доминантная).
Сокращения: ОНП — однонуклеотидный полиморфизм, МА — минорный аллель, ЧМА — частота минорного аллеля, n — число генотипированных образцов ДНК.
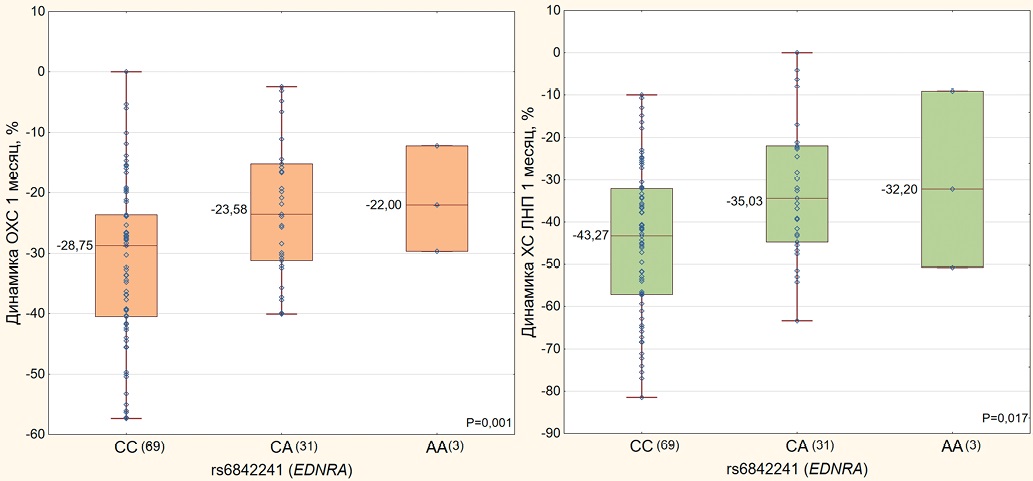
Рис. 1. Динамика изменения уровня ОХС и ХС ЛНП в зависимости от генотипа по полиморфному варианту rs6842241 гена EDNRA у пациентов с ИБС в течение первого месяца терапии розувастатином.
Примечание: данные представлены в виде диаграммы размаха ("ящик с усами") нетрансформированных значений ∆ (%) ОХС или ХС ЛНП. Горизонтальной чертой отмечена медиана с указанием её значения, верхняя и нижняя границы "ящика" соответствуют 25-му и 75-му квартилям, границы "усов" — минимальному и максимальному значениям. Рядом с генотипом в скобках указано число его носителей. Уровни статистической значимости рассчитаны для трансформированных значений липидов.
ОНП rs9818870 гена MRAS не был ассоциирован с динамикой изменения ОХС и ХС ЛНП, хотя отмечалась тенденция к значимости (p=0,06 и 0,056, соответственно) по итогам 12 мес. терапии (табл. 2). Для обоих исследованных вариантов отсутствовала связь с динамикой изменения ТГ. Ассоциации генотипа с динамикой изменения уровня ХС ЛВП не оценивались ввиду статистически незначимого изменения данного показателя за время терапии.
Обсуждение
В настоящем исследовании впервые установлена ассоциация полиморфного варианта rs6842241 гена EDNRA с гиполипидемическим действием розувастатина у пациентов с ИБС в отношении как ОХС, так и ХС ЛНП. Носительство редкого аллеля как в гомозиготном (rs6842241-АА), так и в гетерозиготном состоянии (rs6842241-СА) ослабляло эффект препарата, а липиды за время лечения снижались в меньшей степени, чем у гомозигот rs6842241-СC. Указанная направленность гиполипидемического эффекта проявилась наиболее сильно за начальный период терапии (первый месяц) и сохранилась на протяжении максимального периода наблюдения в 1 год как для ОХС, так и для ХС ЛНП. Кроме того, нами была подтверждена ранее известная по полногеномным исследованиям [1][2] ассоциация rs6842241 гена EDNRA с предрасположенностью к ИБС — гомозиготы по редкому аллелю (АА) в настоящем исследовании характеризовались повышенным более чем в 5 раз шансом заболеть ИБС в сравнении с носителями частого аллеля С. Таким образом, носительство редкого аллеля данного полиморфного варианта имело в обоих случаях негативный эффект: повышая риск заболеть ИБС и снижая эффективность гиполипидемической терапии уже при наличии ИБС.
Для определения функционального эффекта полиморфизма rs6842241 гена EDNRA проводилось функциональное аннотирование, включающее изучение его связи с изменением экспрессии генов в тканях, т. е. с наличием eQTL (expression Quantitative Trait Loci). ОНП rs6842241 локализован в геноме на расстоянии 2 тыс. пар оснований перед геном EDNRA (данные ресурса dbSNP, https://ncbi.nlm.nih.gov/snp). Тем не менее, находясь не непосредственно в гене, данный вариант ассоциировался с повышением экспрессии гена EDNRA в аорте (p=0,000034, данные ресурсов QTLBase, http://www.mulinlab.org/qtlbase и GTEx, https://gtexportal.org). Можно предположить, что повышение экспрессии мРНК рецептора к эндотелину способно вызвать повышение экспрессии самих рецепторов (белка), а повышенная экспрессия рецепторов эндотелина, как известно, связана с повреждением эндотелия сосудов, что существенно усугубляет прогрессирование атеросклероза [11]. Предполагаемый выше механизм может объяснять и увеличение риска развития ИБС, однако эта гипотеза требует экспериментального подтверждения.
Другим возможным механизмом, потенциально объясняющим связь исследуемого варианта с исходами, может быть расположение его в области ДНК, способной связывать транскрипционные факторы (ТФ). In silico поиск ТФ в области ОНП с помощью биоинформатического инструмента atSNP Search (http://atsnp.biostat.wisc.edu) был ограничен уровнем статистической значимости для совпадения последовательности ДНК, с которой взаимодействует ТФ, <0,005. В результате анализа в области ОНП rs6842241 гена EDNRA обнаружены такие ТФ, как: PBX3, E2F, EGR, GCM, SP1, IKZF1, KLF5, RAD21, CTCF, EBF1. С помощью ресурсов hTFtarget (https://guolab.wchscu.cn/hTFtarget) и Harmonizome 3.0 (https://maayanlab.cloud/Harmonizome) устанавливалось, является ли ген EDNRA мишенью для вышеупомянутых ТФ. Оказалось, что данный ген действительно является мишенью для ТФ E2F4, E2F6, EGR2, EGR3, RAD21, CTCF, EBF1. При этом при носительстве вариантного аллеля rs6842241 для всех указанных ТФ имела место потеря области связывания с ТФ ("потеря мишени"), который уже не способен связаться с данной областью и влиять на экспрессию гена EDNRA. Несомненно, представленные данные требуют экспериментального подтверждения. Среди найденных ТФ именно на липидный обмен влияет транскрипционный репрессор CTCF согласно данным ресурса UniProt (https://www.uniprot.org). CTCF регулирует экспрессию кластера генов APOA1/C3/A4/A5 [12], кодирующего аполипопротеины. Ресурс Harmonizome подтверждает, что гены APOA1, APOC3, APOA4 и APOA5 являются мишенями для CTCF. Таким образом, изменения липидного обмена при лечении розувастатином могут быть опосредованы влиянием полиморфизма rs6842241 и развиваться параллельно с изменением экспрессии гена эндотелина через действие одного и того же ТФ. Для дальнейшего аннотирования rs6842241 оценивалась его связь с эпигенетическим состоянием хроматина в аорте (ресурс HaploReg v4.2, https://pubs.broadinstitute.org/mammals/haploreg/haploreg.php, данные Roadmap Epigenomics Consortium, 2015). В результате в области ОНП rs6842241 обнаружены гистоновые метки, такие как H3K4me1 и H3K27ac, связанные с энхансерной активностью, а также H3K4me3, связанная с промоторной областью. Эти данные указывают на то, что полиморфный вариант rs6842241 находится в области ДНК, активно регулирующей транскрипцию гена посредством открытия хроматина и связывания с ТФ. Данная информация, наряду с ранее представленной связью полиморфного варианта с изменением экспрессии (eQTL), подтверждает предположение о том, что ассоциация исследуемого полиморфизма с предрасположенностью к развитию ИБС может реализоваться через регуляцию экспрессии гена эндотелинового рецептора типа А.
Ограничения исследования. Молекулярные механизмы, лежащие в основе обнаруженных в настоящем исследовании ассоциаций, предположены исходя из функционального аннотирования ОНП и поэтому требуют дальнейшего экспериментального подтверждения.
Заключение
В настоящем исследовании впервые установлено, что пациенты, страдающие ИБС с генотипом AA и СА полиморфного варианта rs6842241 гена EDNRA, характеризуются ослабленным ответом на розувастатин в отношении ОХС и ХС ЛНП по итогам 1 (первого) и 12 мес. терапии. Подтверждена ассоциация rs6842241 с риском развития ИБС. Не установлена связь rs9818870 гена MRAS с фармакогенетикой розувастатина и риском развития ИБС.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Lempiäinen H, Brænne I, Michoel T, et al. Network analysis of coronary artery disease risk genes elucidates disease mechanisms and druggable targets. Sci Rep. 2018;8(1): 3434. doi:10.1038/s41598-018-20721-6.
2. van der Harst P, Verweij N. Identification of 64 Novel Genetic Loci Provides an Expanded View on the Genetic Architecture of Coronary Artery Disease. Circ Res. 2018;122(3):433-43. doi:10.1161/CIRCRESAHA.117.312086.
3. Shah PW, Reinberger T, Hashmi S, et al. MRAS in coronary artery disease-Unchartered territory. IUBMB Life. 2024;76(6):300-12. doi:10.1002/iub.2805.
4. Matsukura M, Ozaki K, Takahashi A, et al. Genome-Wide Association Study of Peripheral Arterial Disease in a Japanese Population. PLoS One. 2015;10(10):e0139262. doi:10.1371/journal.pone.0139262.
5. Kononov S, Mal G, Azarova I, et al. Pharmacogenetic loci for rosuvastatin are associated with intima-media thickness change and coronary artery disease risk. Pharmacogenomics. 2022;23(1):15-34. doi:10.2217/pgs-2021-0097.
6. Janić M, Lunder M, France Štiglic A, et al. Sub-therapeutic doses of fluvastatin and valsartan are more effective than therapeutic doses in providing beneficial cardiovascular pleiotropic effects in rats: A proof of concept study. Vascul Pharmacol. 2017;99:45-52. doi:10.1016/j.vph.2017.09.005.
7. Lunder M, Drevenšek G, Černe D, et al. Treatment with low-dose atorvastatin, losartan, and their combination increases expression of vasoactive-related genes in rat aortas. J Cardiovasc Pharmacol Ther. 2013;18(2):177-83. doi:10.1177/1074248412463966.
8. de Zeeuw D, Coll B, Andress D, et al. The endothelin antagonist atrasentan lowers residual albuminuria in patients with type 2 diabetic nephropathy. J Am Soc Nephrol. 2014;25(5):1083-93. doi:10.1681/ASN.2013080830.
9. Клёсова Е. Ю., Азарова Ю. Э., Суняйкина О. А. и др. Валидация краткого опросника для оценки вклада средовых факторов риска в развитие возраст-зависимых заболеваний на примере сахарного диабета 2 типа и ишемической болезни сердца. Научные результаты биомедицинских исследований. 2022;8(1):130-7. doi:10.18413/2658-6533-2022-8-1-0-10.
10. Кононов С. И., Азарова Ю. Э., Клесова Е. Ю. и др. Протективный эффект полиморфизмов rs2681472 и rs17249754 в гене ATP2B1 в отношении ишемической болезни сердца и гипертонической болезни нивелируется курением. Кардиология. 2023;63(9):45-50.
11. Barton M, Yanagisawa M. Endothelin: 30 Years From Discovery to Therapy. Hypertension. 2019;74(6):1232-65. doi:10.1161/HYPERTENSIONAHA.119.12105.
12. Mishiro T, Ishihara K, Hino S, et al. Architectural roles of multiple chromatin insulators at the human apolipoprotein gene cluster. EMBO J. 2009;28(9):1234-45. doi:10.1038/emboj.2009.81.
Об авторах
С. И. КононовРоссия
Кононов Станислав Игоревич — к. м. н., ассистент кафедры внутренних болезней № 2.
Курск
Конфликт интересов:
Нет
Ю. Э. Азарова
Россия
Азарова Юлия Эдуардовна — д. м. н., доцент, профессор кафедры биохимии; зав. лабораторией биохимической генетики и метаболомики Научно-исследовательского института генетической и молекулярной эпидемиологии.
Курск
Конфликт интересов:
Нет
Е. Ю. Клёсова
Россия
Клёсова Елена Юрьевна — к.б.н., ассистент кафедры биологии, медицинской генетики и экологии; м.н.с. лаборатории биохимической генетики и метаболомики Научно-исследовательского института генетической и молекулярной эпидемиологии.
Курск
Конфликт интересов:
Нет
М. А. Быканова
Россия
Быканова Марина Алексеевна — к. б. н., ассистент кафедры биологии, медицинской генетики и экологии; н.с. лаборатории геномных исследований Научно-исследовательского института генетической и молекулярной эпидемиологии.
Курск
Конфликт интересов:
Нет
М. А. Солодилова
Россия
Солодилова Мария Андреевна — д.б.н., доцент, профессор кафедры биологии, медицинской генетики и экологии.
Курск
Конфликт интересов:
Нет
А. В. Полоников
Россия
Полоников Алексей Валерьевич — д. м. н., профессор, директор Научно-исследовательского института генетической и молекулярной эпидемиологии, профессор кафедры биологии, медицинской генетики и экологии.
Курск
Конфликт интересов:
Нет
Дополнительные файлы
- Ишемическая болезнь сердца — многофакторное заболевание с известной генетической предрасположенностью.
- Гиполипидемический ответ на лечение статинами различается в зависимости от генетических факторов (фармакогенетика).
- Полиморфизм гена эндотелинового рецептора типа А способен влиять как на фармакогенетику розувастатина, так и на риск развития ишемической болезни сердца.
Рецензия
Для цитирования:
Кононов С.И., Азарова Ю.Э., Клёсова Е.Ю., Быканова М.А., Солодилова М.А., Полоников А.В. Связь полиморфных вариантов rs6842241 гена EDNRA и rs9818870 гена MRAS с предрасположенностью к ишемической болезни сердца и их влияние на гиполипидемическое действие розувастатина. Российский кардиологический журнал. 2024;29(10):6026. https://doi.org/10.15829/1560-4071-2024-6026. EDN: BKKEXX
For citation:
Kononov S.I., Azarova Yu.E., Klyosova E.Yu., Bykanova M.A., Solodilova M.A., Polonikov A.V. Relationship of EDNRA rs6842241 and MRAS rs9818870 polymorphic variants with predisposition to coronary artery disease and their effect on the lipid-lowering effect of rosuvastatin. Russian Journal of Cardiology. 2024;29(10):6026. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6026. EDN: BKKEXX
JATS XML

















































