Перейти к:
Радиационно-индуцированная болезнь сердца у пациентов с онкопатологией органов грудной клетки: мнение по проблеме
https://doi.org/10.15829/1560-4071-2025-6018
EDN: POPAQV
Аннотация
Постлучевые поражения органов грудной клетки характеризуются развитием осложнений со стороны лёгких и сердца. Радиационно-индуцированные поражения сердечной мышцы и сосудов описаны различными авторами. В настоящее время известно 5 основных вариантов поражения сердца после лучевой терапии: перикардит, кардиомиопатия, ишемическая болезнь сердца, приобретённые клапанные пороки и нарушения ритма. Научное сообщество продолжает изучение этой группы заболеваний сердца. Однозначные данные о профилактике данных состояний отсутствуют. Целью работы послужило обобщение современных сведений о патогенезе и последствиях постлучевого поражения сердца.
Ключевые слова
Для цитирования:
Даниленко С.О., Николаева А.К., Логинова И.Ю., Каменская О.В. Радиационно-индуцированная болезнь сердца у пациентов с онкопатологией органов грудной клетки: мнение по проблеме. Российский кардиологический журнал. 2025;30(6S):6018. https://doi.org/10.15829/1560-4071-2025-6018. EDN: POPAQV
For citation:
Danilenko S.O., Nikolaeva A.K., Loginova I.Yu., Kamenskaya O.V. Radiation-induced heart disease in patients with chest cancer: opinion on the problem. Russian Journal of Cardiology. 2025;30(6S):6018. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6018. EDN: POPAQV
Лучевая терапия (ЛТ) является важным компонентом комплексного лечения опухолей грудной клетки. ЛТ улучшает выживаемость при многих видах рака, однако она сопряжена с рядом неизбежных осложнений. ЛТ злокачественных новообразований молочной железы, средостения, легких, головы и шеи сопровождается облучением здоровых тканей сердца, легких и крупных сосудов с развитием отдаленных сердечно-сосудистых и легочных осложнений.
Одним из наиболее серьезных осложнений ЛТ является радиационно-индуцированная болезнь сердца (РИБС). РИБС — это обобщающий термин, используемый для описания осложнений функционирования сердца, связанных с ЛТ. РИБС может возникать от 5 до 30 лет после завершения ЛТ. Опасность заключается в том, что до 88% пациентов имеют бессимптомное течение болезни. У 10-30% РИБС диагностируется в течение 5-10 первых лет после ЛТ. РИБС является ведущей неонкологической причиной смертности у пациентов со злокачественными новообразованиями органов грудной клетки, получающих ЛТ. Доказано, что использование высоких доз радиации при лечении рака повреждает сердечную ткань, что приводит к нарушению сердечной функции и развитию ишемической болезни сердца. Имеющиеся данные показывают, что чем выше доза облучения, тем сильнее кардиотоксичность.
Цель исследования — обобщить данные о механизмах развития и клинических вариантах сердечно-сосудистых заболеваний вследствие облучения органов грудной клетки.
Методология исследования
В ходе исследования производился анализ научных исследований, приведённых в отечественных и международных базах данных: Russian Science Citation Index (RSCI, https://www.elibrary.ru/), PubMed (https://pubmed.ncbi.nlm.nih.gov/), Google Scholar (https://scholar.google.com/). Применён описательный метод исследования.
В основе поиска статей использовались запросы "radiation induced heart injury" (53 публикации в PubMed), "radiation induced heart disease" (477 публикаций в PubMed), "радиационно-индуцированное поражение сердца" (6 публикаций в RSCI, 3 публикации в Google Scholar), "постлучевое поражение сердца" (9 публикаций в RSCI, 391 публикация в Google Scholar), "радиационно-индуцированная болезнь сердца" (10 публикаций в RSCI, 54 публикации в Google Scholar). Для отбора использованы следующие критерии включения: давность публикации не более 10 лет; тип исследования — оригинальная статья, обзор литературы, клинический случай; доступность полного текста статьи; наличие индексации журнала в RSCI, Scopus или Web of Science. Критерии исключения обратны вышеуказанным критериям включения.
РИБС у пациентов с онкопатологией органов грудной клетки
Патофизиология
Принято считать, что раннее повреждение ЛТ в основном обусловлено острыми и хроническими воспалительными изменениями, а поздняя токсичность частично вызвана совместным действием окислительного стресса (ОС) и воспаления. Эти изменения могут приводить к развитию сердечно-сосудистых заболеваний [1]. Важную роль в кардиотоксичности играет ОС (рис. 1), который является результатом избыточной продукции активных форм кислорода (АФК) и снижения способности АФК к поглощению антиоксидантной защитной системой клетки, приводящий к различным масштабным воздействиям на структуру и функционирование сердца, включая повреждение клеточных структур, липоидов, белков и ДНК [1][2].
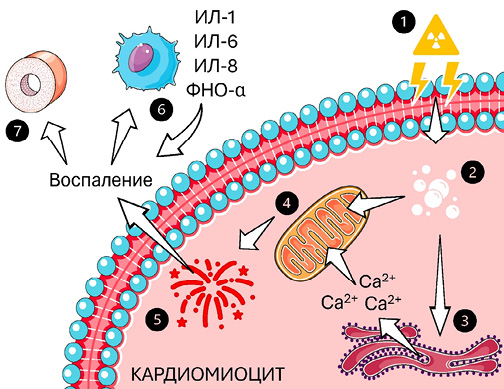
Рис. 1. Патогенез РИБС.
Примечание: 1 — ионизирующее излучение воздействует на бифосфолипидный слой мембраны клетки, а также на некоторые молекулы в цитозоле; 2 — избыточное производство АФК из повреждённых молекул; 3 — повреждение мембраны шероховатой эндоплазматической сети приводит к выбросу ионов кальция; 4 — ионы кальция совместно с АФК атакуют мембраны митохондрий, снижается выработка аденозинтрифосфата; 5 — нарушение работы митохондрий приводит к ОС, запускается процесс апоптоза клетки; 6 — миграция дендритных клеток приводит к выбросу провоспалительных цитокинов; 7 — цитотоксические эффекты распространяются на капиллярную сеть, что приводит к сужению просвета сосудов за счёт их фиброзирования.
Сокращения: АФК — активные формы кислорода, ИЛ — интерлейкин, ОС — окислительный стресс, ФНО-α — фактор некроза опухоли-альфа.
На субклеточном уровне ОС и воспалительная реакция в эндотелиальных клетках ответственны за выработку интерлейкинов 1, 6 и 8, фактора некроза опухоли-альфа (провоспалительные цитокины), ассоциированных с радиационно-индуцированной кардиотоксичностью. В дополнение происходит нарушение ферментативной активности и усиливается перекисное окисление липидов. АФК могут усиливать гипертрофию и фиброз, способствовать высвобождению кальция, приводящему к клеточному апоптозу и некрозу, и вызывать оксидативное повреждение митохондрий, нарушая их функцию [3]. Примечательно, что 40% объема кардиомиоцитов составляют митохондрии, поэтому их дисфункция может в значительной степени влиять на работу сердца [1].
Несмотря на то, что кардиомиоциты относительно устойчивы к прямому воздействию низких и умеренных доз радиации, радиационно-индуцированное повреждение эндотелия может привести к сужению и утолщению капилляров, и снижению эффективной васкуляризации, что повышает риск повреждения и гибели миоцитов (рис. 1). Это приводит к замещению коллагеновой фиброзной тканью, что повышает жёсткость миокарда [1].
Разновидности РИБС
Перикардит
Заболеваемость тесно связана с дозой облучения, полученной сердцем. При увеличении дозы облучения на 10 Гр заболеваемость возрастает в 5 раз [4][5]. Констриктивный перикардит является наиболее тяжёлой формой и обычно протекает с латентным периодом в ≥10 лет после облучения в виде застойной сердечной недостаточности [6].
С оптимизацией защитных методик и программ радиотерапии частота перикардита снизилась до 6-10% [7]. Stick, et al. (2017) в своём исследовании провели оценку сердечной токсичности после комплексной узловой фотонной и протонной терапии рака молочной железы (РМЖ). Они пришли к выводу, что современная фотонная терапия даёт ограниченный риск развития кардиотоксичности у большинства пациентов, но протонная терапия может снизить прогнозируемый риск сердечной токсичности до 2,9% [8].
Кардиомиопатия
Согласно обзору литературы, проведённому Tapio S. (2016) в центре им. Гельмгольца в г. Мюнхене, инкубационный период повреждения миокарда может достигать >10 лет. В большинстве случаев ЛТ-индуцированное повреждение миокарда не имеет клинических симптомов, поэтому частота клинической диагностики невелика и составляет всего ~10% [9][10]. Повреждение миокарда характерно для пациентов, получивших антрациклиновую химиотерапию или высокую дозу облучения (>60 Гр). Группа индийских учёных, под руководством Madan R, et al. (2015), в результате литературного обзора выявила, что у пациентов, получивших высокую дозу ЛТ, наблюдалось рестриктивное повреждение миокарда, а при химиорадиотерапии — диастолическая дисфункции миокарда [11].
Ишемическая болезнь сердца
Повреждение коронарных артерий, индуцированное радиацией, соответствует коронарному атеросклерозу, обусловленному повреждением эндотелия, инфильтрацией моноцитов в интиму, индуцирующей отложение липопротеинов низкой плотности и формирование жировых полосок [2]. Дисфункция эндотелия приводит к нарушению сократимости и проходимости сосудов и может развиваться через 10-15 лет после завершения ЛТ. Клинические исследования показали, что распространённость РИБС у пациентов достигает 85%, причём она тесно связана с дозой облучения, местом, временем и другими факторами [4].
Приобретённые (клапанные) пороки сердца
Ишемия и гипоксия миокарда, вызванные фиброзом миокарда и коронарными заболеваниями, являются основными причинами повреждения клапанной функции. Инкубационный период радиационно-индуцированного поражения клапанов сердца значительно длиннее, чем у вышеупомянутых видов сердечно-сосудистых заболеваний. Частота возникновения приобретённых пороков сердца тесно связана с дозами антрациклинов. Уменьшение дозы привело к постепенному снижению накопленной за 30 лет заболеваемости приобретёнными пороками сердца с 12,4% при дозе >40 Гр до 3% при дозе <30 Гр. Наиболее ранние изменения в общей патологии приобретённых пороков сердца, по-видимому, включают стеноз клапанов в течение первых 10 лет после ЛТ с преимущественным поражением митрального и аортального клапанов. Прогрессирование фиброзного утолщения и кальцификации клапанов происходит значительно позже, а стеноз часто возникает через 20 лет после ЛТ. Наиболее частыми пороками являются митральная и аортальная недостаточность [4][12].
Нарушения ритма
Аномалии проводящей системы, вызванные ЛТ, обычно проявляются в виде атриовентрикулярной блокады, синдрома патологического синусового узла, удлинения интервала QTc, суправентрикулярных аритмий и желудочковых тахикардий. Уровень встречаемости аномалий проводящей системы составляет ~5%, часто они возникают в течение 2 мес. после окончания ЛТ, а 70% электрокардиографических аномалий могут вернуться к норме через полгода после ЛТ, однако частота встречаемости все равно увеличивалась по сравнению с таковой до начала лечения [9]. Это свидетельствует о том, что воздействие ЛТ на сердце частично обратимо, но все же приводит к определённым повреждениям сердца [4].
Научные исследования РИБС
Кардиотоксичность может быть острой или хронической и проявляться спустя годы после окончания лечения злокачественных новообразований органов грудной клетки. Ранние проявления РИБС включают в себя миокардит и эндокардит [9]. Поздние РИБС включают в себя РИБС, фиброз миокарда и кардиомиопатию, заболевания клапанов, перикарда и аритмии [7]. Среди лекарственных препаратов для лечения онкологических заболеваний с доказанным кардиотоксическим действием выделяют цитостатические средства (антрациклиновые антибиотики, 5-фторурацил и циклофосфамид), молекулярно-таргетные препараты (трастузумаб и пертузумаб), таксаны и непосредственно ЛТ [13]. Исследования показывают, что при получении только химио- или радиотерапии повышается вероятность развития РИБС, а химиолучевая терапия увеличивает риск развития аритмии и сердечной недостаточности. Левый передний отдел миокарда, лёгочный и атриовентрикулярный клапаны сильно подвержены левому радиационному воздействию [1]. Группа учёных под руководством Skyttä Т, et al. (2019) сравнивала результаты эхокардиографии пациентов с правосторонним и левосторонним РМЖ через 3 года только ЛТ [3]. Назначенная доза курса составила 50 Гр. В результате были зарегистрированы ухудшения систолических и диастолических показателей левого желудочка (ЛЖ). Наблюдались уменьшения ударного объема, диастолическая дисфункция и ухудшение глобальной продольной деформации ЛЖ. Аналогичные изменения произошли и с правым желудочком. Эти изменения при эхокардиографии были более выражены у пациентов с РМЖ с левой стороны, чем с правой [3].
Anthony FYu, et al. (2019) оценивали субклиническую кардиотоксичность, вызванную ЛТ (назначенная доза курса составила 50 Гр) через 6 мес. после лечения, у HER2-положительных пациентов, получавших лечение антрациклинами и трастузумабом. Значительных изменений систолических и диастолических показателей функции ЛЖ не наблюдалось [14].
В исследовании женщин с HER2-положительным и отрицательным левосторонним РМЖ разовая очаговая доза облучения сердца составляла 2 Гр. Время Т1 (маркер фиброза) и фракция выброса ЛЖ значительно изменялись при лечении. Т2 (маркер отёка) и фракция выброса ЛЖ существенно не изменились. Наблюдалась значимая корреляция между исходным уровнем интерлейкина-6 и средней мощностью сердца в конце ЛТ [8].
Одним из перспективных методов минимизации дозы облучения здоровых тканей сердца является протонная терапия [15]. Разработка новых подходов с использованием передовых методов, таких как FLASH-терапия, может принести ещё большую пользу за счёт уменьшения фиброза после облучения.
Заключение
Частота встречаемости РИБС варьируется от суммарной очаговой дозы ЛТ и объема сердца, попавшего в зону облучения. Осложнения в результате ЛТ могут встречаться как во время лечения, так и спустя 5-30 лет после завершения терапии. На вероятность появления радиационно-индуцированных сердечно-сосудистых заболеваний также влияет наличие факторов риска. РИБС диагностируется у до 30% пациентов в течение первых лет после окончания ЛТ.
Основными проявлениями РИБС являются перикардит, кардиомиопатия, коронарная и клапанные патологии, аритмия и нарушения сердечной проводимости.
Актуальность проблемы для кардиологов и терапевтов, несмотря на появление современных методов лечения и относительно низких доз радиации в сравнении с историческими, остаётся высокой. Это связано с тем, что РИБС способны протекать бессимптомно, впервые проявляться спустя много лет после завершения лечения. Для специалистов важно уметь выявлять радиационно-индуцированные патологии сердца на ранних этапах для составления наиболее подходящих планов лечения и снижения рисков развития дальнейших осложнений.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Ping Z, Peng Y, Lang H, et al. Oxidative stress in radiation-induced cardiotoxicity. Oxid Med Cell Longev. 2020;3579143. doi:10.1155/2020/3579143.
2. Piroth MD, Baumann R, Budach W, et al. Heart toxicity from breast cancer radiotherapy: Current findings, assessment, and prevention. Strahlenther Onkol. 2019;195(1):1-12. doi:10.1007/s00066-018-1378-z.
3. Skyttä T, Tuohinen S, Luukkaala T, et al. Adjuvant radiotherapy-induced cardiac changes among patients with early breast cancer: a three-year follow-up study. Acta Oncol. 2019; 58(9):1250-8. doi:10.1080/0284186X.2019.1630751.
4. Васюк Ю. А., Гендлин Г. Е., Емелина Е. И. и др. Согласованное мнение Российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский кардиологический журнал. 2021;26(9):4703. doi:10.15829/1560-4071-2021-4703.
5. Marinko T. Pericardial disease after breast cancer radiotherapy. Radiol Oncol. 2018; 53(1):1-5. doi:10.2478/raon-2018-0035.
6. Omidi A, Weiss E, Trankle CR, et al. Quantitative assessment of radiotherapy-induced myocardial damage using MRI: a systematic review. Cardiooncology. 2023;9(1):24. doi:10.1186/s40959-023-00175-0.
7. Yilmaz M, Turk E, Sana MK, et al. Cardiovascular outcomes associated with exposure to radiation therapy in thoracic malignancies: an insight study using the national inpatient database. Cureus. 2023;15(10):e47113. doi:10.7759/cureus.47113.
8. Stick LB, Yu J, Maraldo MV, et al. Joint estimation of cardiac toxicity and recurrence risks after comprehensive nodal photon versus proton therapy for breast cancer. Int J Radiat Oncol Biol Phys. 2017;97(4):754-61. doi:10.1016/j.ijrobp.2016.12.008.
9. Wang H, Wei J, Zheng Q, et al. Radiation-induced heart disease: a review of classification, mechanism and prevention. Int J Biol Sci. 2019;15(10):2128-38. doi:10.7150/ijbs.35460.
10. Tapio S. Pathology and biology of radiation-induced cardiac disease. J Radiat Res. 2016; 57(5):439-48. doi:10.1093/jrr/rrw064.
11. Madan R, Benson R, Sharma DN, et al. Radiation induced heart disease: Pathogenesis, management and review literature. J Egypt Natl Canc Inst. 2015;27(4):187-93. doi:10.1016/j.jnci.2015.07.005.
12. Зубарев Д. Д., Сим С. В., Краснов В. С. и др. Клинический случай успешного транскатетерного протезирования аортального клапана у пациентки с аортальным стенозом, индуцированным лучевой терапией. Российский кардиологический журнал. 2023;28(5):5220. doi:10.15829/1560-4071-2023-5220.
13. Bikiewicz A, Banach M, von Haehling S, et al. Adjuvant breast cancer treatments cardiotoxicity and modern methods of detection and prevention of cardiac complications. ESC heart failure. 2021;8(4):2397-418. doi:10.1002/ehf2.13365.
14. Yu AF, Ho AY, Braunstein LZ, et al. Assessment of Early Radiation-Induced Changes in Left Ventricular Function by Myocardial Strain Imaging After Breast Radiation Therapy. Journal of the American Society of Echocardiography. 2019;32(4):521-8. doi:10.1016/j.echo.2018.12.009.
15. Frankart AJ, Nagarajan R, Pater L. The impact of proton therapy on cardiotoxicity following radiation treatment. J Thromb Thrombolysis. 2021;51(4):877-83. doi:10.1007/s11239-020-02303-4.
Об авторах
С. О. ДаниленкоРоссия
Сергей Олегович Даниленко — ассистент кафедры Фундаментальной медицины Факультета медицины и психологии В. Зельмана Института медицины и медицинских технологий; м. н. с. лаборатории клинической физиологии научно-исследовательского отдела анестезиологии и реаниматологии.
Новосибирск
Конфликт интересов:
нет
А. К. Николаева
Россия
Алина Константиновна Николаева — студент Факультета медицины и психологии В. Зельмана Института медицины и медицинских технологий.
Новосибирск
Конфликт интересов:
нет
И. Ю. Логинова
Россия
Ирина Юрьевна Логинова — к. б. н., с. н. с. лаборатории клинической физиологии научно-исследовательского отдела анестезиологии и реаниматологии.
Новосибирск
Конфликт интересов:
нет
О. В. Каменская
Россия
Оксана Васильевна Каменская — д. м. н., зав. лабораторией клинической физиологии научно-исследовательского отдела анестезиологии и реаниматологии.
Новосибирск
Конфликт интересов:
нет
Дополнительные файлы
Что уже известно о предмете исследования?
- Одним из серьёзных осложнений лучевой терапии (ЛТ) является радиационно-индуцированная болезнь сердца.
Что нового?
- Подробно описан патогенез постлучевого поражения сердца с точки зрения острых и отложенных реакций организма.
- Современная фотонная терапия ограничивает риск развития нарушений функции сердца, а протонная терапия может снизить его до 2,9%.
Возможный вклад в клиническую практику
- Полученные данные могут помочь в разработке более безопасных и эффективных протоколов ЛТ для уменьшения риска кардиотоксичности.
- Оптимизация мониторинга функции сердца у пациентов, прошедших ЛТ, может улучшить их долгосрочное здоровье и выживаемость.
Рецензия
Для цитирования:
Даниленко С.О., Николаева А.К., Логинова И.Ю., Каменская О.В. Радиационно-индуцированная болезнь сердца у пациентов с онкопатологией органов грудной клетки: мнение по проблеме. Российский кардиологический журнал. 2025;30(6S):6018. https://doi.org/10.15829/1560-4071-2025-6018. EDN: POPAQV
For citation:
Danilenko S.O., Nikolaeva A.K., Loginova I.Yu., Kamenskaya O.V. Radiation-induced heart disease in patients with chest cancer: opinion on the problem. Russian Journal of Cardiology. 2025;30(6S):6018. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6018. EDN: POPAQV
JATS XML

















































