Перейти к:
Т-клеточный иммунный ответ в инициации, прогрессии и дестабилизации атеросклеротического процесса: обзор
https://doi.org/10.15829/1560-4071-2024-6017
Аннотация
Детальная характеристика разнообразия, клональности и антигенной специфичности репертуара Т-клеток способствует пониманию роли адаптивного иммунного ответа в широком спектре заболеваний, включая атеросклероз артерий. В статье рассматриваются вопросы дифференцировки Т-лимфоцитов и факторов, приводящих к их активации при атеросклерозе. Также обсуждаются данные, полученные в ходе анализа Т-клеточного репертуара при атеросклеротическом поражении сонных и коронарных артерий с использованием новых технологий секвенирования, таких как технология секвенирования "единичных клеток". Отдельно подчеркивается важность и особенность изучения разнообразия субфенотипов Т-лимфоцитов, их антигенной специфичности и взаимодействия с другими клетками при атеросклерозе. Цель настоящего обзора заключалась в обобщении данных исследования Т-клеточного иммунного ответа при атеросклерозе, полученных в ходе секвенирования Т-клеточного рецептора, в т.ч. на основе технологии секвенирования "единичных клеток".
Для цитирования:
Назаренко М.С., Слепцов А.А., Пузырёв В.П. Т-клеточный иммунный ответ в инициации, прогрессии и дестабилизации атеросклеротического процесса: обзор. Российский кардиологический журнал. 2024;29(11S):6017. https://doi.org/10.15829/1560-4071-2024-6017
For citation:
Nazarenko M.S., Sleptsov A.A., Puzyrev V.P. T-cell immune response in initiation, progression, and destabilization of atherosclerosis: a review. Russian Journal of Cardiology. 2024;29(11S):6017. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6017
Предполагается, что воздействие на специфические изменения иммунной системы у пациентов с сердечно-сосудистыми заболеваниями, включая атеросклеротическое поражение артерий, представляет собой многообещающий подход к лечению и профилактике развития сосудистых событий. Для достижения такого индивидуального подхода к терапии и профилактики актуальным является понимание гетерогенного клеточного состава атеросклеротического поражения артерий и расшифровки сложных структурно-функциональных изменений, которые иммунные клетки претерпевают в ходе развития и прогрессирования заболевания [1][2].
В последние годы особое внимание исследователей привлекает изучение Т‑клеточного иммунного ответа в инициации, прогрессии и дестабилизации атеросклеротических бляшек (АСБ). Т‑лимфоциты в норме обнаруживаются в адвентиции сосудов, однако они не превышают 20% от общего количества лейкоцитов; их число резко возрастает при атеросклерозе [3]. Исследования, проведенные с помощью транскриптомики по технологии секвенирования "единичных клеток" (scRNA-seq, single cell RNA sequencing), технология позволяющая получить транскриптом каждой клетки индивидуально, подтверждают существенное накопление Т‑лимфоцитов (52,4-65%) в АСБ сонных артерий [1][4][5]. Более того, в проксимальной области АСБ сонных артерий — там, где часто происходит разрыв при формировании ее нестабильности — выявлено преимущественное накопление Т‑лимфоцитов по сравнению с ее дистальными частями [6].
У пациентов с острым коронарным синдромом количество активированных Т‑лимфоцитов в крови выше, чем при стабильной стенокардии, что предполагает их критическую роль в острых сосудистых событиях [7]. Более того, показано, что нарушение регуляции Т‑хелперов (увеличение агрессивных эффекторных и уменьшение регуляторных) может привести к дестабилизации АСБ [8]. Действительно, в результате исследования с использованием анализа единичных клеток (scRNA-seq, CyTOF и CITE-seq) выявлено, что в АСБ сонных артерий пациентов с острым нарушением мозгового кровообращения содержались специфические субпопуляции CD4-позитивных Т‑клеток памяти и активированных Т‑лимфоцитов. Кроме того, ряд субпопуляций Т‑клеток имели маркеры истощения, связанные с повышением экспрессии белка клеточной смерти PD-1 [4].
В целом, в АСБ сонных артерий Т‑лимфоциты демонстрируют большое разнообразие фенотипов, тесно связанных с их активацией. В Т‑лимфоцитах появление открытого хроматина в локусах генов цитокинов, включая ген интерферона-гамма, предполагает возможные межклеточные взаимодействия и классическую активацию провоспалительных макрофагов соседними Т‑клетками в очаге атеросклеротического поражения [5].
Цель настоящего обзора заключалась в обобщении данных исследования Т‑клеточного иммунного ответа при атеросклерозе, полученных в ходе секвенирования Т‑клеточного рецептора, в т. ч. на основе технологии секвенирования "единичных клеток".
Методология исследования
Поиск публикаций производился в информационно-поисковых и библиотечных базах данных PubMed Central, PubMed, elibrary и Google Scholar за последние 7 лет (с 2018г) со следующими словами (и их сочетаниями) atherosclerosis, T-cell, TCR, атеросклероз, Т‑клеточный рецептор, Т‑лимфоцит, Т‑клетка, TCR-seq, scTCR-seq, RNA-seq, scRNAseq, spatial transcriptomics, CyTOF, CITE-seq, single cell RNA sequencing. Критерии исключения: статьи в "хищнических" журналах, согласно списку Билла (Beall›s List), отозванные и обзорные статьи.
Дифференцировка Т‑лимфоцитов
Т‑лимфоциты определяются наличием кластера дифференцировки 3 (CD3, Cluster of Differentiation), мультипротеинового комплекса, который непосредственно участвует в активации Т‑лимфоцитов. Комплекс CD3 состоит из четырёх различных цепей, каждая из них содержит иммунорецепторный тирозиновый активационный мотив, фосфорилирование которого инициирует каскад сигнальных путей активации Т‑клеток. За возникновение сигнала активации Т‑лимфоцитов отвечает Т‑клеточный рецептор (TCR, T-cell receptor), ассоциированный с CD3. Т‑клеточный рецептор, родственный по происхождению с иммуноглобулинами, является поверхностным белковым комплексом, определяющим антигены, связанные с молекулами главного комплекса гистосовместимости (MHC) на поверхности антиген-презентирующих клеток. Мажорная субпопуляция Т‑лимфоцитов содержит TCR, состоящий из α/β‑цепей, минорная субпопуляция — из γ/δ-цепей. Адекватная работа комплекса CD3-TCR обеспечивается за счёт дополнительной репрезентации ко-рецептора CD4 или CD8 для связывания с MHC II или MHC I, соответственно.
Во время дифференцировки ранние лимфоидные предшественники претерпевают значительные транскриптомные и, самое отличительное от других соматических клеток, геномные перестройки. В тимусе предшественники Т‑лимфоцитов проходят через несколько стадий развития, главным образом "дважды-негативную" (CD4negCD8neg) и "дважды-позитивную" стадии (СВ4+СВ8+). После "дважды-позитивной" стадии предшественники проходят селекцию, где становятся либо CD4-позитивными (CD4+CD8-) Т‑хелперами, либо CD8-позитивными (CD4-CD8+) цитотоксическими Т‑лимфоцитами [9]. Во время прохождения данных стадий предшественники Т‑лимфоцитов подвергаются перестройке генов Т‑клеточных рецепторов, известной как V(D)J-рекомбинация (рис. 1 А, Б, В), которая начинается на стадии "дважды-негативной" и продолжается во время перехода в "дважды-позитивную стадию". Во время перехода из "дважды-негативной" в "дважды-позитивную" стадию происходит селекция предшественников на способность вырабатывать CD4 и CD8, которые и обеспечивают связывание с MHC I или MHC II, соответственно. После происходит селекция CD4+CD8+ Т‑клеток на способность распознавать антигены на представленные MHC и активироваться. Негативная селекция Т‑лимфоцитов является критическим процессом, который обеспечивает развитие функционального и аутотолерантного репертуара Т‑клеток, т. к. V(D)J-рекомбинация происходит случайным образом, и сборка третьего гипервариабельного участка (CDR3) Т‑клеточного рецептора, ответственного за распознавание антигенов, может привести к формированию Т‑клеточного рецептора с аутореактивными свойствами [10].
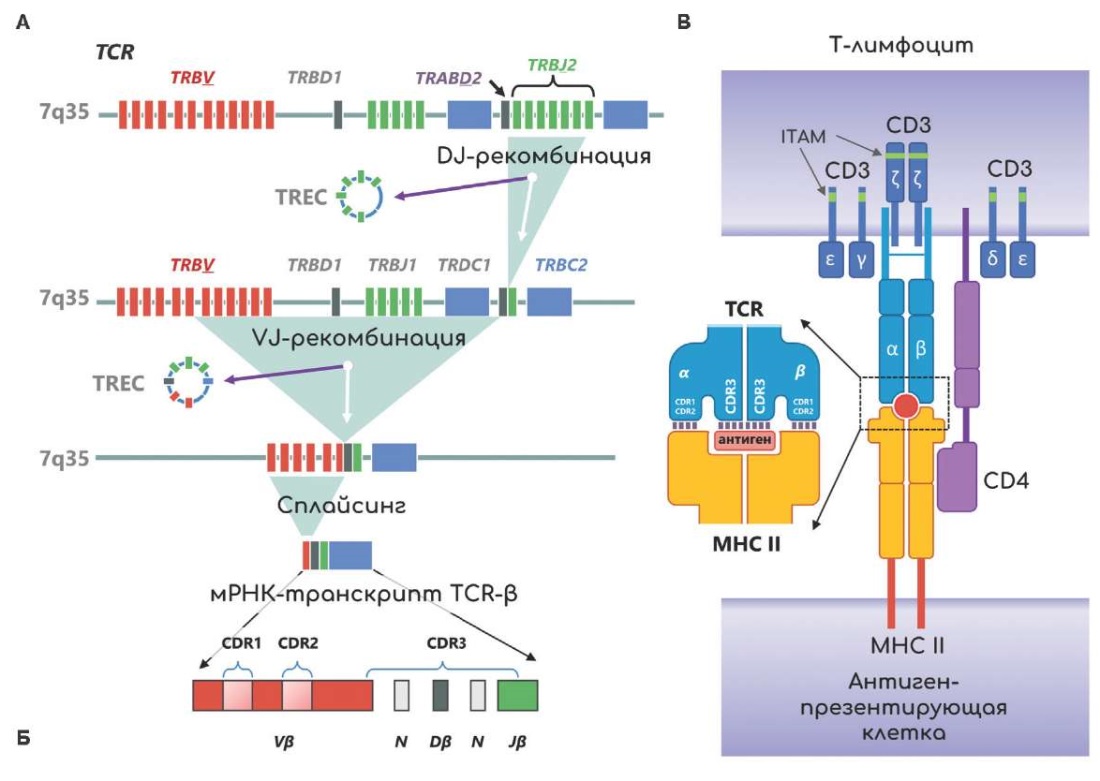
Рис. 1. Схема V(D)J-рекомбинации и структура Т‑клеточного рецептора.
Примечание: А — процесс V(D)J-рекомбинации β‑цепи Т‑клеточного рецептора при дифференцировке Т‑лимфоцита с образованием эксцизионных колец; Б — структура β‑цепи Т‑клеточного рецептора; В — взаимодействие T-лимфоцита и антиген-презентирующей клетки посредством Т‑клеточного рецептора и главного комплекса гистосовместимости.
Сокращения: АПК — антиген-презентирующая клетка, CDR — определяющая комплементарность область Т‑клеточного рецептора (complementarity-determining region), МНС — главный комплекс гистосовместимости (major histocompatibility complex), ITAM — иммунорецепторный тирозиновый активационный мотив (immunoreceptor tyrosine-based activation motif), TREC — эксцизионное кольцо Т‑клеточного рецептора (Т‑cell receptor Excision Circles), TCR — Т‑клеточный рецептор (Т‑cell receptor).
Несмотря на сложный и многоэтапный механизм формирования адаптивного иммунитета, в частности, Т‑лимфоцитов, обеспечить безупречную и безотказную негативную селекцию организм не способен, в связи с чем могут развиваться аутоиммунные реакции. Кроме того, активированные Т‑лимфоциты обладают свойством пролиферации, что, с одной стороны, может обеспечить массивный специфический адаптивный иммунитет, с другой — поддерживать пул аутореактивных Т‑лимфоцитов в случае их возникновения. Действительно, в недавнем исследовании продемонстрирована роль аутореактивных Т‑клеток в формировании и развитии воспалительной реакции в АСБ сонных артерий [11]. Отдельно подчеркивается высокая степень сходства атеросклеротического поражения артерий с аутоиммунными заболеваниями. В подкрепление аутореактивной гипотезы атеросклероза, на модельных животных обнаружена дисфункция толерантности периферических Т‑клеток в лимфатических узлах и в АСБ [12]. Выявлена также клональная экспансия и аутореактивация CD4+ Т‑хелперов, цитотоксических CD8+ и регуляторных Т‑клеток.
Аутореактивация Т‑лимфоцитов при атеросклерозе
Несмотря на то, что распространено мнение об основной активации адаптивного иммунитета во вторичных лимфоидных тканях, существуют данные о том, что местная презентация антигена, активация Т‑клеток и индукция регуляторных Т‑клеток имеют место в сосудистой стенке и в третичных лимфоидных структурах, которые формируются в адвентиции атеросклеротически-пораженных артерий [1][13]. В экспериментальных моделях атеросклероза многие Т‑клетки в АСБ демонстрировали фенотип детерминированного иммуноцита, т. е. после контакта с антигеном. Присутствие поверхностных маркеров, таких как CD44, указывает на то, что эти Т‑клетки уже подверглись воздействию аутоантигена [14][15]. Значительное увеличение количества CD69+ Т‑клеток в АСБ сонных артерий человека по сравнению с мононуклеарами периферической крови также свидетельствует в пользу локального антиген-специфического Т‑клеточного ответа [11]. Наконец, использование метода таргетного секвенирования Т‑клеточных рецепторов (TCR-seq) акцентирует внимание исследователей на активации T-клеток в АСБ через их клональную экспансию в ответ на появление специфичных для атеросклероза антигенов [11][16][17].
Среди кандидатов, которые могут служить антигенами, активирующими Т‑клетки, являются липопротеиды низкой плотности (ЛНП) с их окисленными формами и аполипопротеин B (ApoB), демонстрирующие наиболее сильную клиническую корреляцию с атеросклерозом [18]. В частности, накопление ЛНП в стенке артерии вызывает миграцию воспалительных моноцитов, которые дифференцируются в макрофаги или дендритные клетки, последние служат антиген-презентирующими клетками и активируют Т‑клетки, тем самым ещё больше усугубляют воспалительные реакции [19]. Исследования in vitro на CD4+ Т‑лимфоцитах, выделенных из АСБ человека, показывают, что многие из этих клеток распознают окисленные ЛНП при процессинге и представлении антиген-презентирующими клетками [20].
С другой стороны, целый ряд работ подтверждает наличие CD4+ Т‑лимфоцитов, распознающих ApoB, основной компонент ЛНП и хиломикронов, в качестве аутоантигена при атеросклерозе [4][21][22]. Также установлено, что Т‑клеточный рецептор связывается с пептидными эпитопами, происходящими из ApoB, представленных молекулами MHC II на антиген-презентирующих клетках [20][23].
Кроме ЛНП и ApoB, в качестве аутоантигенов могут выступать белки теплового шока (HSP60 и HSP70) [24]. В активации Т‑клеток при атеросклерозе принимают участие белки ко-ингибиторы и ко-стимуляторы (CD80/86-CD28, CD40-CD40L, GITR, CD27, PD-1), а также изменение метаболизма (переключение с окислительного фосфорилирования на гликолиз) в результате избыточного потребления жиров в рационе питания [25].
Разнообразие, клональность и аутоантигенная специфичность Т‑клеточного репертуара при атеросклерозе
Исследования клеточного состава АСБ ранее выявляли Т‑клетки и их субпопуляции, однако их антигенная специфичность начала проясняться только в настоящее время. TCR-seq в т. ч. и по технологии "единичных клеток" (scTCR-seq), позволяет проводить детальную оценку разнообразия репертуара Т‑клеток при различных патологиях. Однако исследования, в которых используется подобная технология для анализа Т‑клеточного репертуара при атеросклерозе, ограничены.
В ранних работах показано, что в АСБ и мононуклеарах периферической крови пациентов с острыми сосудистыми событиями регистрируется низкое разнообразие TCR-β CDR3 [16][17]. В работе Lin Z, et al. (2017) установлено, что разнообразие репертуаров TCR-β в АСБ ниже, чем в периферической крови пациентов и в контрольной группе [16]. В АСБ идентифицирован ряд клонов с высокой частотой, что подтверждает олигоклональное происхождение данных клеток [16]. Так, в АСБ обнаруживается повышенное содержание клонотипа TCR-V6, который тесно связан с распознаванием окисленных форма ЛНП, что, собственно, позволило предположить, что окисленные формы ЛНП являются аутоантигенами, вызывающими сильный локальный Т‑клеточный ответ в бляшках [16][20]. В АСБ и клетках периферической крови пациентов чаще всего регистрировались Т‑лимфоцитарные клонотипы V29-1J2-1, V20-1J1-6, V6-3J2-7 и V11-2J2-2, чем в контрольной группе [16].
Во работе Liu S, et al. (2020) у пациентов с острым коронарным синдромом (ОКС: нестабильная стенокардия и острый инфаркт миокарда) в мононуклеарах периферической крови наблюдалась слабая степень разнообразия репертуара TCR-β CDR3 по сравнению с контрольной группой [17]. Регистрировалась также и разница в репрезентации клонотипов TCR-β, так, например, пять клонотипов TCR-β CDR3 были обнаружены только у пациентов с ОКС. Значимые различия по репертуару Т‑лимфоцитов для мононуклеаров периферической крови пациентов с ОКС по сравнению с контрольной группой установлены в работах других исследовательских коллективов [26].
Использование scTCR-seq позволило наиболее близко подойти к решению задачи, связанной с предсказанием эпитопов, распознаваемых репертуаром Т‑клеток, исходя из последовательностей Т‑клеточного рецептора. В работе по изучению распределения Т‑клеточных рецепторов в коронарных АСБ показана клональная экспансия CD8+ Т‑клеток и выявлено, что некоторые из TCR оказались специфичны для распространенных вирусных антигенов, включая такие как грипп, цитомегаловирус и коронавирус SARS-CoV-2 [27].
Комбинация секвенирования транскриптома и Т‑клеточных рецепторов по технологии "единичных клеток" (scRNA-seq и scTCR-seq) АСБ сонных артерий и мононуклеаров периферической крови позволила обнаружить специфичную для АСБ выраженную клональную экспансию CD4+ Т‑лимфоцитов, которая возникла за счет недавнего взаимодействия TCR с антигеном, и, напротив, слабую экспансию регуляторных Т‑клеток [11]. Выявлено, что активация и клональная экспансия CD4+ Т‑хелперов в АСБ была за счет TREM2-позитивных макрофагов, выступивших как антиген-презентирующие клетки.
Использование новых технологий (ATAC-Seq, CyTOF, CITE-seq, RNA-seq и TCR-seq), в особенности в их комбинации и с использованием технологии "единичных клеток" (scRNA-seq и scTCR-Seq), а также пространственной транскриптомики позволило установить разнообразие фенотипов T-клеток с переходом от активации до истощения, охарактеризовать их антигенную специфичность и взаимодействие с другими клетками, и подтвердить клональную экспансию, нарушение контрольных точек иммунного ответа и аутореактивацию. Тем не менее, это не означает, что данные маркерные сигналы могли бы выступить в качестве точек приложения для таргетной терапии с использованием их ингибиторов, прежде необходим более тщательный и глубокий анализ получаемых результатов. Так, например, использование ингибиторов иммунных контрольных точек (анти-PD-1/PD-L1 и анти-CTLA4), которые являются высокоэффективными при лечении злокачественных новообразований, напротив, ускорило прогрессию атеросклероза и развитие сердечно-сосудистых событий [28]. Предполагается, что анти-PD-1 или анти-PD-L1 высвобождают Т‑клетки, обладающие антигенным опытом, для распознавания атеросклероз-специфичных эпитопов и, таким образом, потенциально усугубляют патологический процесс [12].
Существуют большие надежды, что детальное изучение пространственного разнообразия фенотипов Т‑клеток и антигенной специфичности T-клеточного репертуара в органах-мишенях атеросклероза с помощью комплексных и новых экспериментальных исследований (например, описанными в [29]) и биоинформатических подходов (например, описанными в [30]) анализа как новых, так и уже имеющихся данных сможет приблизить нас не только к пониманию молекулярных механизмов формирования атеросклероза и его клинических осложнений, но и к адекватной трансляции полученных знаний в клиническую практику.
Заключение
Понимание роли иммунной системы, где одними из ключевых участников являются Т‑клетки, в формировании атеросклероза и его клинических осложнений является важным для выявления молекулярных мишеней и биомаркеров диагностики, прогноза и лечения острых сосудистых катастроф.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Дягель А.Р., Зарубин А.А., Назаренко М.С., Слепцов А.А. Структурная гетерогенность Т-лимфоцитарной и макрофагальной инфильтрации при атеросклерозе по данным рнк-секвенирования единичных клеток. Медицинская генетика. 2022;21:43-5. doi:10.25557/2073-7998.2022.07.43-45.
2. Sleptcov AA, Zarubin AA, Bogaichuk PM, et al. Human exome sequence data in support of somatic mosaicism in carotid atherosclerosis. Data In Brief. 2021;39:107656. doi:10.1016/j.dib.2021.107656.
3. Zernecke A, Winkels H, Cochain C, et al. Meta-Analysis of Leukocyte Diversity in Atherosclerotic Mouse Aortas. Circ Res. 2020;127:402-26. doi:10.1161/CIRCRESAHA.120.316903.
4. Fernandez DM, Rahman AH, Fernandez NF, et al. Single-cell immune landscape of human atherosclerotic plaques. Nat Med. 2019;25:1576-88. doi:10.1038/s41591-019-0590-4.
5. Depuydt MAC, Prange KHM, Slenders L, et al. Microanatomy of the Human Atherosclerotic Plaque by Single-Cell Transcriptomics. Circ Res. 2020;127:1437-55. doi:10.1161/ CIRCRESAHA.120.316770.
6. Sun J, Singh P, Shami A, et al. Spatial Transcriptional Mapping Reveals Site-Specific Pathways Underlying Human Atherosclerotic Plaque Rupture. J Am Coll Cardiol. 2023;81:2213-27. doi:10.1016/j.jacc.2023.04.008.
7. Pekayvaz K, Losert C, Knottenberg V, et al. Multiomic analyses uncover immunological signatures in acute and chronic coronary syndromes. Nat Med. 2024;30:1696-710. doi:10.1038/s41591-024-02953-4.
8. Flego D, Liuzzo G, Weyand CM, et al. Adaptive Immunity Dysregulation in Acute Coronary Syndromes: From Cellular and Molecular Basis to Clinical Implications. J Am Coll Cardiol. 2016;68:2107-17. doi:10.1016/j.jacc.2016.08.036.
9. Taniuchi I. CD4 Helper and CD8 Cytotoxic T Cell Differentiation. Annu Rev Immunol. 2018;36:579-601. doi:10.1146/annurev-immunol-042617-053411.
10. Dupage M, Bluestone JA. Harnessing the plasticity of CD4+ T cells to treat immunemediated disease. Nat Rev Immunol. 2016;16:149-63. doi:10.1038/nri.2015.18.
11. Depuydt MAC, Schaftenaar FH, Prange KHM, et al. Single-Cell T Cell Receptor Sequencing of Paired Human Atherosclerotic Plaques and Blood Reveals Autoimmune-like Features of Expanded Effector T Cells. Nat. Cardiovasc. Res. 2023;2:112-25. doi:10.1038/s44161-022-00208-4.
12. Wang Z, Zhang X, Lu S, et al. Pairing of single-cell RNA analysis and T cell antigen receptor profiling indicates breakdown of T cell tolerance checkpoints in atherosclerosis. Nat Cardiovasc Res. 2023;2:290-306. doi:10.1038/s44161-023-00218-w.
13. Hu D, Mohanta SK, Yin C, et al. Artery Tertiary Lymphoid Organs Control Aorta Immunity and Protect against Atherosclerosis via Vascular Smooth Muscle Cell Lymphotoxin β Receptors. Immunity. 2015;42:1100-15. doi:10.1016/j.immuni.2015.05.015.
14. Yi J, Kawabe T, Sprent J. New insights on T-cell self-tolerance. Curr Opin Immunol. 2020;63:14-20. doi:10.1016/j.coi.2019.10.002.
15. Kawabe T, Yi J, Sprent J. Homeostasis of Naive and Memory T Lymphocytes. Cold Spring Harb Perspect Biol. 2021;13:a037879. doi:10.1101/cshperspect.a037879.
16. Lin Z, Qian S, Gong Y, et al. Deep Sequencing of the T Cell Receptor β Repertoire Reveals Signature Patterns and Clonal Drift in Atherosclerotic Plaques and Patients. Oncotarget. 2017;8:99312-22. doi:10.18632/oncotarget.19892.
17. Liu S, Zhong Z, Zhong W, et al. Comprehensive Analysis of T-Cell Receptor Repertoire in Patients with Acute Coronary Syndrome by High-Throughput Sequencing. BMC Cardiovasc. Disord. 2020;20:253. doi:10.1186/s12872-020-01538-6.
18. Sorokin AV, Hong CG, Aponte AM, et al. Association of oxidized ApoB and oxidized ApoA-I with high-risk coronary plaque features in cardiovascular disease. JCI Insight. 2023;8:e172893. doi:10.1172/jci.insight.172893.
19. Gil-Pulido J, Zernecke A.Antigen-presenting dendritic cells in atherosclerosis. Eur J Pharmacol. 2017;816:25-31. doi:10.1016/j.ejphar.2017.08.016.
20. Cimmino G, Cirillo P, Conte S, et al. Oxidized low-density lipoproteins induce tissue factor expression in T-lymphocytes via activation of lectin-like oxidized low-density lipoprotein receptor-1. Cardiovasc Res. 2020;116:1125-35. doi:10.1093/cvr/cvz230.
21. Wolf D, Gerhardt T, Winkels H, et al. Pathogenic Autoimmunity in Atherosclerosis Evolves from Initially Protective Apolipoprotein B100-Reactive CD4+T-Regulatory Cells. Circulation. 2020:1279-93. doi:10.1161/CIRCULATIONAHA.119.042863.
22. Kimura T, Kobiyama K, Winkels H, et al. Regulatory CD4+ T cells recognize major histocompatibility complex class II molecule-restricted peptide epitopes of apolipoprotein B.Circulation. 2018;138:1130-43. doi:10.1161/CIRCULATIONAHA.117.031420.
23. Tse K, Gonen A, Sidney J, et al. Atheroprotective vaccination with MHC-II restricted peptides from ApoB-100. Front Immunol. 2013;4. doi:10.3389/fimmu.2013.00493.
24. Hashikawa N, Ido M, Morita Y, et al. Effects from the Induction of Heat Shock Proteins in a Murine Model Due to Progression of Aortic Atherosclerosis. Sci. Rep. 2021;11:7025. doi:10.1038/s41598-021-86601-8.
25. Hinkley H, Counts DA, VonCanon E, et al. T Cells in Atherosclerosis: Key Players in the Pathogenesis of Vascular Disease. Cells. 2023;12:2152. doi:10.3390/cells12172152.
26. Zhong Z, Wu H, Zhang Q, et al. Characteristics of T cell receptor repertoires of patients with acute myocardial infarction through high-throughput sequencing. J Transl Med. 2019;17. doi:10.1186/s12967-019-1768-8.
27. Chowdhury RR, D'Addabbo J, Huang X, et al. Human Coronary Plaque T Cells Are Clonal and Cross-React to Virus and Self. Circ Res. 2022;130:1510-30. doi:10.1161/CIRCRESAHA.121.320090.
28. Drobni ZD, Alvi RM, Taron J, et al. Association Between Immune Checkpoint Inhibitors With Cardiovascular Events and Atherosclerotic Plaque. Circulation. 2020;142:2299-311. doi:10.1161/CIRCULATIONAHA.120.049981.
29. Engblom C, Thrane K, Lin Q, et al. Spatial transcriptomics of B cell and T cell receptors reveals lymphocyte clonal dynamics. Science. 2023;382(6675):eadf8486. doi:10.1126/science.adf8486.
30. Peng K, Nowicki TS, Campbell K, et al. Rigorous benchmarking of T-cell receptor repertoire profiling methods for cancer RNA sequencing. Brief Bioinform. 2023;24:bbad220. doi:10.1093/bib/bbad220.
Об авторах
М. С. НазаренкоРоссия
Назаренко М. С. - д.м.н., руководитель лаборатории популяционной генетики
Томск
А. А. Слепцов
Россия
Слепцов А. А. - к.м.н., н.с. лаборатории популяционной генетики
Томск
В. П. Пузырёв
Россия
Пузырев В. П. - д.м.н., профессор, академик РАН, научный руководитель
Томск
Дополнительные файлы
- Современные технологий секвенирования, в особенности, выполняемые по технологии "единичных клеток", позволяют раскрыть особенности субфенотипов Т-клеточного иммунного ответа при атеросклерозе.
- Клональная экспансия и аутореактивация Т-лимфоцитов играет важную роль в инициации и прогрессировании атеросклеротического процесса.
- Пространственное разнообразие субфенотипов Т-лимфоцитов, их антигенная специфичность и иммунные взаимодействия внутри атеросклеротических бляшек с использованием инновационных экспериментальных и биоинформатических подходов имеют решающее значение для внедрения знаний в клиническую практику и разработку эффективных методов лечения.
Рецензия
Для цитирования:
Назаренко М.С., Слепцов А.А., Пузырёв В.П. Т-клеточный иммунный ответ в инициации, прогрессии и дестабилизации атеросклеротического процесса: обзор. Российский кардиологический журнал. 2024;29(11S):6017. https://doi.org/10.15829/1560-4071-2024-6017
For citation:
Nazarenko M.S., Sleptsov A.A., Puzyrev V.P. T-cell immune response in initiation, progression, and destabilization of atherosclerosis: a review. Russian Journal of Cardiology. 2024;29(11S):6017. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6017
JATS XML

















































