Перейти к:
Молекулярно-генетические показатели вероятности развития ранних признаков нарушения систолической функции миокарда при химиотерапии доксорубицином у пациентов со злокачественными новообразованиями молочной железы групп среднего и низкого риска (HFA-ICOS)
https://doi.org/10.15829/1560-4071-2024-5993
EDN: TGZPDQ
Аннотация
Цель. Изучить связь rs2232228 (ген HAS3), rs2229774 (ген RARG), rs1056892 (ген CBR3), rs1786814 (ген CELF4), rs1695 (ген GSTP1), rs8187710 (ген ABCC2), rs7853758 (ген SLC28A3), rs243865 (ген MMP2), rs243866 (ген ММР2), rs35068180 (ген MMP3), rs522616 (ген ММР3), rs679620 (ген ММР3), rs17576 (ген ММР9), rs3918242 (ген ММР9) с вероятностью развития ранних признаков кардиотоксичности (КТ) доксорубицина у пациентов со злокачественными новообразованиями молочной железы групп низкого и среднего риска согласно HFA-ICOS.
Материал и методы. В исследование включено 100 пациентов (женщины, старше 18 лет) с диагнозом рак молочной железы, получавших химиотерапию (ХТ) с применением доксорубицина. Для выявления ранних признаков КТ выполняли эхокардиографию до, после и через 12 мес. с момента окончания ХТ. Определение статуса полиморфных вариантов изучаемых генов проводили методом полимеразной цепной реакции в режиме реального времени.
Результаты. На основании снижения глобальной продольной деформации миокарда (>12%) после и через 12 мес. с момента окончания ХТ пациенты были разделены на две группы: А — пациенты, у которых ранние признаки дисфункции миокарда могут быть диагностированы после окончания ХТ (19%); Б — у которых ранние признаки дисфункции миокарда выявляются впервые только через 12 мес. с момента завершения ХТ (17%). У пациентов из категории А выявлен ряд аллельных вариантов и генотипов, обладающих потенциалом в качестве независимых факторов прогнозирования развития ранних признаков дисфункции миокарда с акцентом на мишени, вовлекаемые в процессы метаболизма и детоксификации доксорубицина и его производных; из категории Б наибольшие различия в частотах встречаемости аллельных вариантов и генотипов выявлены среди генов-мишеней, кодирующих матриксные металлопротеиназы, вовлекаемые в процессы ответа на интенсификацию окислительного стресса, вызываемую доксорубицином и его производными.
Заключение. Суммарно пациенты групп низкого и среднего риска могут быть разделены как минимум на 2 категории на основании молекулярно-генетического тестирования. Для этих категорий может быть спрогнозировано развитие ранних признаков дисфункции миокарда, связанной с КТ доксорубицина до начала ХТ.
Ключевые слова
Для цитирования:
Карпуть И.А., Снежицкий В.А., Курбат М.Н., Горустович О.А., Копыцкий А.В., Бабенко А.С. Молекулярно-генетические показатели вероятности развития ранних признаков нарушения систолической функции миокарда при химиотерапии доксорубицином у пациентов со злокачественными новообразованиями молочной железы групп среднего и низкого риска (HFA-ICOS). Российский кардиологический журнал. 2024;29(10):5993. https://doi.org/10.15829/1560-4071-2024-5993. EDN: TGZPDQ
For citation:
Karput I.A., Snezhitsky V.A., Kurbat M.N., Gorustovich O.A., Kopytsky A.V., Babenko A.S. Molecular genetic indicators of the probability of early myocardial systolic dysfunction signs in doxorubicin chemotherapy in patients with breast cancer of moderate and low HFA-ICOS risk groups. Russian Journal of Cardiology. 2024;29(10):5993. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5993. EDN: TGZPDQ
В настоящее время в сфере лечения злокачественных новообразований молочной железы достигнуты большие успехи. Согласно данным литературы, показатели общей пятилетней выживаемости пациентов могут превышать 95%, при этом медиана выживаемости составляет ≥10 лет. В этих когортах на первый план выходит смертность не от основного заболевания. Часто среди причин смерти называют осложнения со стороны сердечно-сосудистой системы, которые связывают с кардиотоксическим эффектом химиотерапии (ХТ) [1]. Известно, что доксорубицин обладает кардиотоксичностью (КТ), которая может проявляться в острой форме, в следствие чего терапию этим препаратом отменяют. Однако в большинстве случаев токсический эффект наносит серьезный вред сердечно-сосудистой системе лишь в удаленной перспективе, что затрудняет своевременную диагностику и профилактику развития нарушения функции миокарда [2]. Его повреждения носят мультифокальный характер, на начальных этапах затрагивая отдельные кардиомиоциты, и далее образуя локальные очаги некроза по всему объему. Со временем эти процессы способствуют развитию фиброза и нарушению функции миокарда с исходом в кардиомиопатию и хроническую сердечную недостаточность (ХСН) [3].
Антрациклин-индуцированная КТ может проявляться в период через 3 мес. после начала ХТ и далее через 12, 24 и более мес. На данный момент разработан калькулятор риска (HFA-ICOS) развития сердечно-сосудистых событий у пациентов, которым назначена ХТ доксорубицином. Согласно этому, онкологические пациенты могут быть разделены на группы риска еще до начала лечения. План профилактических мероприятий, направленных на предупреждение развития КТ в группах высокого и очень высокого риска, включает обязательное наблюдение кардиологом и широкий спектр современных методов диагностики сердечно-сосудистой патологии. Данный подход не применяется для пациентов в группах среднего и низкого риска, либо может быть рекомендован в случае появления жалоб со стороны сердечно-сосудистой системы, что снижает вероятность своевременного выявления ранних признаков нарушения функции миокарда и реализации доступных профилактических мероприятий. Установлено, что именно на ранних этапах КТ доксорубицина носит обратимый характер и при адекватном лечении может существенно снизить процент пациентов, у которых развивается кардиомиопатия с исходом в ХСН [4].
Поскольку пациенты из групп низкого и среднего риска практически не имеют нарушений со стороны сердечно-сосудистой системы до начала ХТ, прогнозирование развития тяжелых последствий КТ доксорубицина является сложной задачей, до сих пор не решенной мировым научным сообществом. Перспективным направлением разработок в этой области является использование молекулярно-генетических методов [5]. Установлено, что КТ доксорубицина реализуется посредством широкого спектра проявлений, затрагивающих модификацию хроматина, образование прямых ДНК-аддуктов, повреждение белков цитоплазмы и внеклеточного матрикса, нарушение функции митохондрий и пр. Описано множество полиморфных вариантов генов, связанных с интенсивностью токсического эффекта на клетки организма человека. Их принято разделять на 4 основные группы: связанные с транспортом доксорубицина (45%), с вызываемым им окислительным стрессом (27%), его метаболизмом и детоксификацией (19%), его способностью повреждать ДНК (19%). Использование генетического тестирования для прогнозирования развития тяжелых последствий кардиотоксического эффекта доксорубицина считается перспективным [6][7]. К сожалению, на данный момент накопленных клинических данных недостаточно для формирования четких критериев прогноза. Более того, основная часть исследований направлена на прогнозирование развития поздних проявлений КТ, таких как кардиомиопатия, в то время как работ, посвященных предсказыванию ранних признаков КТ, чрезвычайно мало. Нам не удалось найти в литературных источниках ни одной работы, посвящённой прогнозированию для групп пациентов с низким и средним риском согласно HFA-ICOS.
Мы предположили, что ряд полиморфных вариантов генов, связанных с развитием окислительного стресса (MMP-2, MMP-3, MMP-9, HAS3, RARG), а также транспортом (ABCC2, SLC28A3), метаболизмом (CBR3, CELF4) и детоксификацией (GSTP1) доксорубицина и его метаболитов, может быть связан с вероятностью развития ранних признаков нарушения функции миокарда в следствие реализации токсического эффекта доксорубицина у пациентов групп низкого и среднего риска согласно HFA-ICOS.
Цель: изучить связь rs2232228 (ген HAS3), rs2229774 (ген RARG), rs1056892 (ген CBR3), rs1786814 (ген CELF4), rs1695 (ген GSTP1), rs8187710 (ген ABCC2), rs7853758 (ген SLC28A3), rs243865 (ген MMP-2), rs243866 (ген ММР-2), rs35068180 (ген MMP-3), rs522616 (ген ММР-3), rs679620 (ген ММР-3), rs17576 (ген ММР-9), rs3918242 (ген ММР-9) с вероятностью развития ранних признаков КТ доксорубицина у пациентов со злокачественными новообразованиями молочной железы групп низкого и среднего риска согласно HFA-ICOS.
Материал и методы
В исследование включено 100 пациентов (лица женского пола) с диагностированным раком молочной железы (РМЖ), проходивших лечение на базе УЗ "Гродненская университетская клиника" (Гродно, Беларусь). Возраст всех пациентов превышал 18 лет. Все пациенты получали ХТ доксорубицином и подтвердили участие в исследовании — подписано информированное согласие. Все включенные пациенты отнесены к группам низкого и среднего риска согласно калькулятору HFA-ICOS. Общая характеристика когорты представлена в таблице 1. Исследование одобрено комитетом по этике УЗ "Гродненская университетская клиника" протокол № 26 от 09.10.2020г.
Таблица 1
Общая характеристика пациентов, включенных в исследование
|
Показатель |
n |
% |
|
Количество пациентов |
100 |
— |
|
Лица старше 65 лет (фактор риска) |
11 |
11% |
|
Курение |
15 |
15% |
|
Ожирение (ИМТ ≥30 кг/м²) |
35 |
35% |
|
Артериальная гипертензия (1-2 степени): — диагностировано наличие — диагностировано отсутствие |
33 67 |
33% 67% |
|
Пациенты из группы среднего риска развития КТ Пациенты из группы низкого риска развития КТ |
35 65 |
35% 65% |
|
Пограничный уровень ФВ ЛЖ =50-54% |
1 |
1% |
|
Суммарная доза доксорубицина (количество курсов химиотерапии) — 240 мг/м² (4 курса) — 360 мг/м² (6 курсов) |
82 18 |
82% 18% |
Сокращения: ИМТ — индекс массы тела, КТ — кардиотоксичность, ФВ ЛЖ — фракция выброса левого желудочка.
Критерии включения пациентов: первичный подтвержденный РМЖ: стадии I-III. Люминальный А; люминальный В, HER2-отрицательный; трижды негативный рак. Назначение антрациклинов (доксорубицин) в виде комбинированной схемы с циклофосфамидом — схема AC. Средний и низкий риск согласно калькулятору HFA-ICOS.
Критерии невключения: сердечная недостаточность (СН) или кардиомиопатии; тяжелая болезнь клапанов сердца; инфаркт миокарда или предшествующая коронарная реваскуляризация — чрескожные коронарные вмешательства, аортокоронарное шунтирование; стабильная стенокардия, артериальная гипертензия (АГ) 3 степени, инфаркт головного мозга в анамнезе, сахарный диабет, хроническая болезнь почек, отказ пациента дать информированное согласие, распространенная форма РМЖ, HER2-позитивный подтип опухоли, предыдущее лечение злокачественных новообразований с применением кардиотоксичных препаратов, неоадъювантная ХТ, лучевая терапия опухолей левой молочной железы, средостения в анамнезе, ХТ, не принадлежащая к семейству антрациклинов. Высокий и очень высокий риск согласно калькулятору HFA-ICOS.
Критерии исключения: отказ пациента от участия в исследовании на любом из этапов; невозможность проведения измерения глобальной продольной деформации миокарда левого желудочка (ЛЖ) (global longitudinal strain, GLS) и/или фракции выброса (ФВ) ЛЖ. За весь период проведения 10 пациентов были потеряны для наблюдения. Из них 7 отказались от дальнейшего участия и не были обследованы через 12 мес. после окончания ХТ доксорубицином, а у оставшихся 3 не удалось провести измерение GLS из-за плохого акустического окна.
У всех пациентов, включенных в исследование, отсутствовали отдаленные метастазы. Наблюдали следующее распределение пациентов на основании стадии основного заболевания (РМЖ): n=32 (1 стадия); n=52 (2 стадия); n=16 (3 стадия) и молекулярного подтипа опухоли: n=49 (люминальный А); n=27 (люминальный В, HER-2 негативный); n=24 (трижды негативный рак).
Пациенты с сопутствующей АГ 1-2 степени, а также пациенты, у которых выявили КТ после окончания ХТ доксорубицином, получали терапию препаратами группы ингибиторов ангиотензинпревращающего фермента и бета-блокаторами.
Эхокардиографию проводили до начала ХТ, а также в течение 3 нед. после ее окончания и через 12 мес. после ее окончания на аппарате GE Vivid E95 с измерением ФВ ЛЖ по методу Симпсона и оценкой динамики GLS миокарда ЛЖ методом speckle tracking эхокардиографии. Наличие кардиотоксического эффекта оценивали на основании рекомендаций Европейского общества онкологов 2020г [8]. В соответствии с этим пациенты разделены на подгруппы с наличием КТ (КТ+) и без КТ (КТ-). Дизайн исследования представлен на рисунке 1.
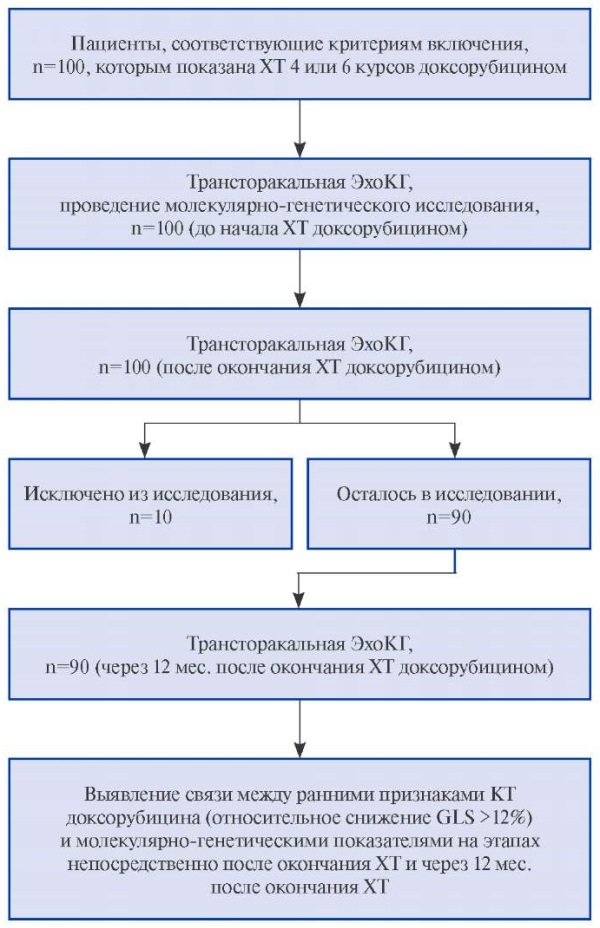
Рис. 1. Дизайн проспективного исследования.
Сокращения: КТ — кардиотоксичность, ХТ — химиотерапия, ЭхоКГ — эхокардиография, GLS — глобальная продольная деформация миокарда левого желудочка, n — количество.
Взятие образцов крови пациентов осуществлялось в стерильные пробирки, содержащие ЭДТА. Общую фракцию нуклеиновых кислот выделяли согласно инструкции производителя набора реагентов "ДНК-Экстран-1" (ЗАО "Синтол", РФ). Молекулярно-генетическое тестирование осуществляли до начала ХТ. Аллельную дискриминацию проводили методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) с использование флуоресцентно-меченых зондов на оборудовании CFX Connect (Bio Rad, США). Результаты генотипирования выборочно подтверждали методом Сенгера на базе центра коллективного пользования "Геном" (ИГЦ НАН Беларуси). Дизайн олигонуклеотидных праймеров и флуоресцентно-меченых зондов, а также все манипуляции с нуклеотидными последовательностями проводили с использованием Ugene v.47.0 (Unipro, РФ) и встроенного алгоритма Primer3. Последовательности олигонуклеотидов представлены в таблице 2.
Таблица 2
Последовательности олигонуклеотидных праймеров и зондов,
используемые для генотипирования rs2232228 (ген HAS3), rs1056892 (ген CBR3),
rs1695 (ген GSTP1), rs8187710 (ген ABCC2), rs243866 (ген ММР-2),
rs35068180 (ген MMP-3), rs522616 (ген ММР-3), rs679620 (ген ММР-3),
rs17576 (ген ММР-9), rs3918242 (ген ММР-9), rs7853758 (ген SLC28A3),
rs2229774 (ген RARG), rs1786814 (ген CELF4)
|
Код |
Последовательность |
Мод.5' |
Мод.3' |
|
rs2228_F |
TCGGTGGCACTGTGCAT |
||
|
rs2228_R |
TGAGGTCAGGGAAGGAGATG |
||
|
rs2228_Ref |
TGCCGCATACCAGGAGGACC |
FAM |
BHQ1 |
|
rs2228_Alt |
TGCCGCGTACCAGGAGGAC |
HEX |
BHQ1 |
|
rs6892_F |
GACAGACATGGATGGGAAAGA |
||
|
rs6892_R |
GCAAGAGGGCCAAGTAGACA |
||
|
rs6892_Ref |
AGCATCAGGACTGTGGAGGAG |
FAM |
BHQ1 |
|
rs6892_Alt |
GACAGCATCAGGACTATGGAGGAG |
HEX |
BHQ1 |
|
rs1695_F |
TGGTGGACATGGTGAATGAC |
||
|
rs1695_R |
TGCAGATGCTCACATAGTTGG |
||
|
rs1695_Ref |
GCTGCAAATACATCTCCCTCATCTACA |
FAM |
BHQ1 |
|
rs1695_Alt |
GCTGCAAATACGTCTCCCTCATCTAC |
HEX |
BHQ1 |
|
rs7710_F |
TTCCTTGTTTCAGGGTAATGG |
||
|
rs7710_R |
AGGGTCCAGGGATTTGTAGC |
||
|
rs7710_Ref |
GAAGATTATAGAGTGCGGCAGCC |
FAM |
BHQ1 |
|
rs7710_Alt |
GGAAGATTATAGAGTACGGCAGCC |
HEX |
BHQ1 |
|
rs3866_F |
GTCTGAAGCCCACTGAGACC |
||
|
rs3866_R |
GTCAGGGGCTGAAAGAATCA |
||
|
rs3866_Ref |
CAAGACATAATCGTGACCTCCAAT |
FAM |
BHQ1 |
|
rs3866_Alt |
ACAAGACATAATCATGACCTCCAATG |
HEX |
BHQ1 |
|
rs8180_F |
ACTAGTATTCTATGGTTCTCCATTCCTTTGA |
||
|
rs8180_R |
TCAATGTGGCCAAATATTTTCCCTGTA |
||
|
rs8180_Ref |
A[LNA+C][LNA+A][LNA+T][LNA+G][LNA+G]TTTTTCCCC |
FAM |
BHQ1 |
|
rs8180_Alt |
A[LNA+C][LNA+A][LNA+T][LNA+G][LNA+G]TTTTTTCCCC |
HEX |
BHQ1 |
|
rs2616_F |
CCACGTAGCTGCTCCATA |
||
|
rs2616_R |
GAATTTCAGTCCGGTAAGCA |
||
|
rs2616_Ref |
A[LNA+T][LNA+A][LNA+G]TTGTAGAAtTGAAATGAATTA |
FAM |
BHQ1 |
|
rs2616_Alt |
A[LNA+T][LNA+A]GTTGTAGAAcTGAAATGAATTA |
HEX |
BHQ1 |
|
rs9620_F |
CAGGACCACTGTCCTTTCTC |
||
|
rs9620_R |
AAAAATTGTAAGAGTGACCTAAAAACTA |
||
|
rs9620_Ref |
GTTTCACATCTTTTTTGAGGTCGTAG |
FAM |
BHQ1 |
|
rs9620_Alt |
GTTTCACATCTTTTTCGAGGTCGTA |
HEX |
BHQ1 |
|
rs7576_F |
CCTTTCCCACATCCTCCTC |
||
|
rs7576_R |
GATTGGCCTTGGAAGATGAA |
||
|
rs7576_Ref |
CTCTACACCCAGGACGGCAATGC |
FAM |
BHQ1 |
|
rs7576_Alt |
CTCTACACCCGGGACGGCAAT |
HEX |
BHQ1 |
|
rs8242_F |
TCAACGTAGTGAAACCCCATC |
||
|
rs8242_R |
CTCAGCCTCCCGAGTAGC |
||
|
rs8242_Ref |
GGTGGCGCACGCCTATAATA |
FAM |
BHQ1 |
|
rs8242_Alt |
GGTGGCGCATGCCTATAATACC |
HEX |
BHQ1 |
|
rs53758_F |
CATGTTTCCAAACCAGGACA |
||
|
Код |
Последовательность |
Мод.5' |
Мод.3' |
|
rs53758_R |
CCAACATCGCTGTGAATCTG |
||
|
rs53758_Ref |
GACAGCAGGGCCAGGAAG |
FAM |
BHQ1 |
|
rs53758_Alt |
GACAACAGGGCCAGGAAGG |
HEX |
BHQ1 |
|
rs29774_F |
TCATCCTCGCTAGAGGCATT |
||
|
rs29774_R |
AATCCGAGAGATGCTGGAGA |
||
|
rs29774_Ref |
GACCAGGCTGCGAGGAGTCAT |
FAM |
BHQ1 |
|
rs29774_Alt |
GACCAGGCTGCAAGGAGTCATCC |
HEX |
BHQ1 |
|
rs86814_F |
TCCAAGTCATCCTGCAATCA |
||
|
rs86814_R |
AGGCTCCCCATTTACCAACT |
||
|
rs86814_Ref |
GAGTGCCCAAGGTGGGTGAGA |
FAM |
BHQ1 |
|
rs86814_Alt |
GAGTGCCCAAGGTGGATGAGAGG |
HEX |
BHQ1 |
ПЦР-РВ проводили с использованием реагентов ОДО Праймтех, Беларусь. Конечный объем реакционной смеси (в пробирке) включающей все компоненты для проведения ПЦР-РВ, а также ДНК-матрицу — 25 мкл; концентрация ионов магния в реакционной смеси 2 мМ (2 миллимоль/литр); концентрация дНТФ (дезоксинуклеотидтрифосфатов) в реакционной смеси 0,2 мМ (миллимоль/литр) каждого (дА, дТ, дЦ и дГ); количество термостабильной Taq ДНК-полимеразы 1,25 единицы активности (1,25 ед.); количество ДНК-матрицы 50-500 нг; количество каждого олигонуклеотида, включая зонды для ПЦР-РВ 10 пикомоль (концентрация 400 наномоль/литр). Программа термоциклирования: денатурация первичная +95° С 5 мин; циклирование +95° С 5 сек, отжиг rs2232228 (ген HAS3) +64° С, rs1056892 (ген CBR3) +64° С, rs1695 (ген GSTP1) +66° С, rs8187710 (ген ABCC2) +64° С, rs243866 (ген ММР-2) +64° С, rs35068180 (ген MMP-3) +58° С, rs522616 (ген ММР-3) +58° С, rs679620 (ген ММР-3) +64° С, rs17576 (ген ММР-9) +66° С; rs3918242 (ген ММР-9) +55° С, rs7853758 (ген SLC28A3) +62° С, rs2229774 (ген RARG) +66° С, rs1786814 (ген CELF4) +62° С, элонгация +72° С 20 сек. Детекция в конце каждого цикла по каналам FAM и HEX. Генотипирование rs243865 (ген MMP-2) проводили ПЦР-РВ с использованием набора реагентов ЗАО Синтол, РФ, согласно инструкции производителя.
Статистическую обработку данных проводили с использованием программы IBM SPSS Statistics 27.0.1 IF026 (IBM, США). Для сравнения частот встречаемости генотипов и аллельных вариантов в подгруппах КТ+ и КТ- применяли точный критерий Фишера. Различия считали статистически значимыми при р<0,05. Уравнения бинарной регрессии с логит-функцией связи строили в программе Rstudio 1.1.183. Определение точки отсечения проводили на основании данных ROC-кривых. Точность модели определяли методом кросс-валидации.
Результаты
Относительное снижение GLS, %, определено для всех 100 пациентов, включенных в исследование непосредственно после окончания ХТ доксорубицином. У 19 человек выявили снижение GLS >12% — подгруппа КТ+ (после). Через 12 мес. с момента окончания ХТ доксорубицином трое из них были исключены из исследования в связи с их отказом от дальнейшего наблюдения. Также выбыли 7 человек из подгруппы КТ-. У 11 из 16 пациентов подгруппы КТ+ через 12 мес. показатель GLS повысился до первоначальных значений. При этом у оставшихся 5 человек диагностирована пролонгация процесса (относительное снижение GLS >12%). У ряда пациентов ранние признаки дисфункции миокарда впервые выявлены только через 12 мес. с момента окончания ХТ: 19 пациентов — подгруппа КТ+ (через).
Таким образом мы выявили две категории пациентов в подгруппе КТ+:
A) пациенты, у которых ранние признаки дисфункции миокарда могут быть диагностированы после окончания ХТ;
Б) пациенты, у которых ранние признаки дисфункции миокарда выявляются впервые только через 12 мес. с момента завершения ХТ доксорубицином.
На основании этого наблюдения мы сравнили распределение генотипов и аллельных вариантов генов-мишеней, включенных в исследование раздельно для пациентов, указанных выше категорий. В таблице 3 представлено распределение частот генотипов и аллелей исследуемых вариантов генов-мишеней, пациенты категории А. В анализ включены данные о генотипах и аллельных вариантах 11 пациентов. Генотипирование оставшихся 5 образцов показало, что профиль аллельных вариантов отличается от основной группы КТ+ после ХТ, в связи с этим их анализ проводили отдельно и ввиду малочисленности группы данные не представлены в рамках настоящей работы.
Таблица 3
Распределение частот генотипов и аллелей исследуемых вариантов генов-мишеней. Категория А — ранние признаки дисфункции миокарда могут быть диагностированы после окончания ХТ
|
Показатель |
Частота |
Точный критерий Фишера |
Критерий углового преобразования Фишера |
|||
|
КТ+ |
КТ- |
|||||
|
Абс. |
% |
Абс. |
% |
р (двухсторонняя) |
р |
|
|
rs2232228 (ген HAS3), n=83; КТ+ =10, КТ- =73 |
||||||
|
AA |
7 |
63,6 |
29 |
39,7 |
0,093 |
<0,05* |
|
AG |
2 |
18,2 |
20 |
27,4 |
0,724 |
>0,05 |
|
GG |
1 |
9,1 |
24 |
32,9 |
0,169 |
<0,05* |
|
A |
16 |
72,7 |
78 |
53,4 |
0,169 |
<0,01** |
|
G |
4 |
18,2 |
68 |
46,6 |
0,093 |
<0,01** |
|
rs1056892 (ген CBR3), n=86; КТ+ =11, КТ- =75 |
||||||
|
GG |
7 |
63,6 |
25 |
33,3 |
0,091 |
<0,05* |
|
GA |
3 |
27,3 |
31 |
41,3 |
0,515 |
>0,05 |
|
AA |
1 |
9,1 |
19 |
25,3 |
0,291 |
>0,05 |
|
G |
17 |
77,3 |
81 |
54,0 |
0,291 |
<0,01** |
|
A |
5 |
22,7 |
69 |
46,0 |
0,091 |
<0,01** |
|
rs1695 (ген GSTP1), n=86; КТ+ =11, КТ- =75 |
||||||
|
AA |
3 |
27,3 |
27 |
36,0 |
0,740 |
>0,05 |
|
AG |
3 |
27,3 |
35 |
46,7 |
0,333 |
>0,05 |
|
GG |
5 |
45,5 |
13 |
17,3 |
0,047* |
<0,05* |
|
A |
9 |
40,9 |
89 |
59,3 |
0,047* |
>0,05 |
|
G |
13 |
59,1 |
61 |
40,7 |
0,740 |
>0,05 |
|
rs8187710 (ген ABCC2), n=84; КТ+ =11, КТ- =73 |
||||||
|
GG |
11 |
100,0 |
66 |
90,4 |
0,587 |
>0,05 |
|
GA |
0 |
0,0 |
5 |
6,8 |
0,612 |
>0,05 |
|
AA |
0 |
0,0 |
2 |
2,7 |
1,000 |
>0,05 |
|
G |
22 |
100,0 |
137 |
93,8 |
1,000 |
>0,05 |
|
A |
0 |
0,0 |
9 |
6,2 |
0,587 |
>0,05 |
|
rs243865 (ген MMP-2), n=86; КТ+ =11, КТ- =75 |
||||||
|
TT |
1 |
9,1 |
13 |
17,3 |
0,683 |
>0,05 |
|
TC |
2 |
18,2 |
26 |
34,7 |
0,329 |
>0,05 |
|
CC |
8 |
72,7 |
36 |
48,0 |
0,197 |
>0,05 |
|
T |
4 |
18,2 |
52 |
34,7 |
0,197 |
<0,05* |
|
C |
18 |
81,8 |
98 |
65,3 |
0,683 |
>0,05 |
|
rs243866 (ген ММР-2), n=86; КТ+ =11, КТ- =75 |
||||||
|
GG |
6 |
54,5 |
34 |
45,3 |
0,748 |
>0,05 |
|
GA |
4 |
36,4 |
38 |
50,7 |
0,522 |
>0,05 |
|
GA |
1 |
9,1 |
3 |
4,0 |
1,000 |
>0,05 |
|
G |
16 |
72,7 |
106 |
70,7 |
1,000 |
>0,05 |
|
A |
6 |
27,3 |
44 |
29,3 |
0,748 |
>0,05 |
|
rs35068180 (ген MMP-3), n=86; КТ+ =11, КТ- =75 |
||||||
|
5А/5А |
5 |
45,5 |
35 |
46,7 |
1,000 |
>0,05 |
|
5А/6А |
4 |
36,4 |
31 |
41,3 |
1,000 |
>0,05 |
|
6А/6А |
2 |
18,2 |
9 |
12,0 |
0,627 |
>0,05 |
|
5А |
14 |
63,6 |
101 |
67,3 |
1,000 |
>0,05 |
|
6А |
8 |
36,4 |
49 |
32,7 |
0,627 |
>0,05 |
|
rs522616 (ген ММР-3), n=86; КТ+ =11, КТ- =75 |
||||||
|
TT |
9 |
81,8 |
52 |
69,3 |
0,498 |
>0,05 |
|
TC |
2 |
18,2 |
22 |
29,3 |
0,507 |
>0,05 |
|
CC |
0 |
0,0 |
1 |
1,3 |
1,000 |
>0,05 |
|
T |
20 |
90,9 |
126 |
84,0 |
1,000 |
>0,05 |
|
С |
2 |
9,1 |
24 |
16,0 |
0,498 |
>0,05 |
|
rs679620 (ген ММР-3), n=86; КТ+ =11, КТ- =75 |
||||||
|
TT |
1 |
9,1 |
9 |
12,0 |
1,000 |
>0,05 |
|
TC |
7 |
63,6 |
45 |
60,0 |
1,000 |
>0,05 |
|
CC |
3 |
27,3 |
21 |
28,0 |
1,000 |
>0,05 |
|
T |
9 |
40,9 |
63 |
42,0 |
1,000 |
>0,05 |
|
С |
13 |
59,1 |
87 |
58,0 |
1,000 |
>0,05 |
|
rs17576 (ген ММР-9), n=85; КТ+ =11, КТ- =74 |
||||||
|
AA |
3 |
27,3 |
26 |
35,1 |
0,742 |
>0,05 |
|
AG |
7 |
63,6 |
38 |
51,4 |
0,333 |
>0,05 |
|
GG |
1 |
9,1 |
10 |
13,5 |
1,000 |
>0,05 |
|
A |
13 |
59,1 |
90 |
60,8 |
1,000 |
>0,05 |
|
G |
9 |
40,9 |
58 |
39,2 |
0,742 |
>0,05 |
|
rs3918242 (ген ММР-9), n=86; КТ+ =11, КТ- =75 |
||||||
|
СС |
9 |
81,8 |
53 |
70,7 |
0,507 |
>0,05 |
|
СТ |
2 |
18,2 |
22 |
29,3 |
0,507 |
>0,05 |
|
ТТ |
0 |
0,0 |
0 |
0,0 |
1,000 |
>0,05 |
|
С |
20 |
90,9 |
128 |
85,3 |
1,000 |
>0,05 |
|
Т |
2 |
9,1 |
22 |
14,7 |
0,507 |
>0,05 |
|
rs7853758 (ген SLC28A3), n=86; КТ+ =11, КТ- =75 |
||||||
|
GG |
9 |
81,8 |
57 |
76,0 |
0,732 |
>0,05 |
|
GA |
1 |
9,1 |
9 |
12,0 |
1,000 |
>0,05 |
|
AA |
1 |
9,1 |
9 |
12,0 |
1,000 |
>0,05 |
|
G |
19 |
86,4 |
123 |
82,0 |
1,000 |
>0,05 |
|
A |
3 |
13,6 |
27 |
18,0 |
1,000 |
>0,05 |
|
rs2229774 (ген RARG), n=84; КТ+ =10, КТ- =74 |
||||||
|
GG |
9 |
90,0 |
62 |
83,8 |
0,699 |
>0,05 |
|
GA |
1 |
10,0 |
12 |
16,2 |
0,699 |
>0,05 |
|
AA |
0 |
0,0 |
0 |
0,0 |
1,000 |
>0,05 |
|
G |
19 |
95,0 |
136 |
91,9 |
1,000 |
>0,05 |
|
A |
1 |
5,0 |
12 |
8,1 |
0,690 |
>0,05 |
|
rs1786814 (ген CELF4), n=86; КТ+ =11, КТ- =75 |
||||||
|
GG |
7 |
63,6 |
59 |
78,7 |
0,445 |
>0,05 |
|
GA |
4 |
36,4 |
15 |
20,0 |
0,250 |
>0,05 |
|
AA |
0 |
0,0 |
1 |
1,3 |
1,000 |
>0,05 |
|
G |
18 |
81,8 |
133 |
88,7 |
1,000 |
>0,05 |
|
A |
4 |
18,2 |
17 |
11,3 |
0,445 |
>0,05 |
Примечание: КТ+ — подгруппа с кардиотоксичностью, КТ- — подгруппа без кардиотоксичности, р — уровень значимости, * — р<0,05, ** — р<0,001.
У пациентов, отнесенных к категории А, выявлен ряд аллельных вариантов и генотипов, обладающих потенциалом в качестве независимых факторов прогнозирования развития ранних признаков дисфункции миокарда с акцентом на мишени, вовлекаемые в процессы метаболизма и детоксификации доксорубицина и его производных.
В таблице 4 представлено распределение частот генотипов и аллелей исследуемых вариантов генов-мишеней, пациенты категории Б.
Таблица 4
Распределение частот генотипов и аллелей исследуемых вариантов генов-мишеней. Категория Б — ранние признаки дисфункции миокарда выявляются впервые только через 12 мес. с момента завершения ХТ доксорубицином
|
Показатель |
Частота |
Точный критерий Фишера |
Критерий углового преобразования Фишера |
|||
|
КТ+ |
КТ- |
|||||
|
Абс. |
% |
Абс. |
% |
р (двухсторонняя) |
р |
|
|
rs2232228 (ген HAS3), n=83; КТ+ =15, КТ- =68 |
||||||
|
AA |
5 |
33,3 |
31 |
45,6 |
0,410 |
>0,05 |
|
AG |
5 |
33,3 |
17 |
25,0 |
0,528 |
>0,05 |
|
GG |
5 |
33,3 |
20 |
29,4 |
1,000 |
>0,05 |
|
A |
15 |
50,0 |
79 |
58,1 |
1,000 |
>0,05 |
|
G |
15 |
50,0 |
57 |
41,9 |
0,410 |
>0,05 |
|
rs1056892 (ген CBR3), n=86; КТ+ =15, КТ- =71 |
||||||
|
GG |
6 |
40,0 |
26 |
36,6 |
1,000 |
>0,05 |
|
GA |
7 |
46,7 |
27 |
38,0 |
0,571 |
>0,05 |
|
AA |
2 |
13,3 |
18 |
25,4 |
0,503 |
>0,05 |
|
G |
19 |
63,3 |
79 |
55,6 |
0,503 |
>0,05 |
|
A |
11 |
36,7 |
63 |
44,4 |
1,000 |
>0,05 |
|
rs1695 (ген GSTP1), n=86; КТ+ =15, КТ- =71 |
||||||
|
AA |
8 |
53,3 |
22 |
31,0 |
0,136 |
>0,05 |
|
AG |
7 |
46,7 |
31 |
43,7 |
1,000 |
>0,05 |
|
GG |
0 |
0,0 |
18 |
25,4 |
0,033* |
— |
|
A |
23 |
76,7 |
75 |
52,8 |
0,033* |
<0,01** |
|
G |
7 |
23,3 |
67 |
47,2 |
0,136 |
<0,01** |
|
rs8187710 (ген ABCC2), n=84; КТ+ =15, КТ- =69 |
||||||
|
GG |
14 |
93,3 |
63 |
91,3 |
1,000 |
>0,05 |
|
GA |
1 |
6,7 |
4 |
5,8 |
1,000 |
>0,05 |
|
AA |
0 |
0,0 |
2 |
2,9 |
1,000 |
>0,05 |
|
G |
29 |
96,7 |
130 |
94,2 |
1,000 |
>0,05 |
|
A |
1 |
3,3 |
8 |
5,8 |
1,000 |
>0,05 |
|
rs243865 (ген MMP-2), n=86; КТ+ =5, КТ- =81 |
||||||
|
TT |
1 |
6,7 |
13 |
18,3 |
0,473 |
>0,05 |
|
TC |
5 |
33,3 |
23 |
32,4 |
1,000 |
>0,05 |
|
CC |
9 |
60,0 |
35 |
49,3 |
0,573 |
>0,05 |
|
T |
7 |
23,3 |
49 |
34,5 |
0,573 |
>0,05 |
|
C |
23 |
76,7 |
93 |
65,5 |
0,473 |
>0,05 |
|
rs243866 (ген ММР-2), n=86; КТ+ =15, КТ- =71 |
||||||
|
GG |
9 |
60,0 |
31 |
43,7 |
0,270 |
>0,05 |
|
GA |
5 |
33,3 |
37 |
52,1 |
0,258 |
>0,05 |
|
АA |
1 |
6,7 |
3 |
4,2 |
1,000 |
>0,05 |
|
G |
23 |
76,7 |
99 |
69,7 |
1,000 |
>0,05 |
|
A |
7 |
23,3 |
43 |
30,3 |
0,270 |
>0,05 |
|
rs35068180 (ген MMP-3), n=86; КТ+ =15, КТ- =71 |
||||||
|
5А/5А |
7 |
46,7 |
33 |
46,5 |
1,000 |
>0,05 |
|
5А/6А |
7 |
46,7 |
28 |
39,4 |
0,773 |
>0,05 |
|
6А/6А |
1 |
6,7 |
10 |
14,1 |
0,680 |
>0,05 |
|
5А |
21 |
70,0 |
94 |
66,2 |
0,680 |
>0,05 |
|
6А |
9 |
30,0 |
48 |
33,8 |
1,000 |
>0,05 |
|
rs522616 (ген ММР-3), n=86; КТ+ =15, КТ- =71 |
||||||
|
TT |
10 |
66,7 |
51 |
71,8 |
0,757 |
>0,05 |
|
TC |
4 |
26,7 |
20 |
28,2 |
1,000 |
>0,05 |
|
CC |
1 |
6,7 |
0 |
0,0 |
0,174 |
>0,05 |
|
T |
24 |
80,0 |
122 |
85,9 |
0,174 |
>0,05 |
|
С |
6 |
20,0 |
20 |
14,1 |
0,757 |
>0,05 |
|
rs679620 (ген ММР-3), n=86; КТ+ =15, КТ- =71 |
||||||
|
TT |
4 |
26,7 |
6 |
8,5 |
0,068 |
<0,05* |
|
TC |
8 |
53,3 |
44 |
62,0 |
0,571 |
>0,05 |
|
CC |
3 |
20,0 |
21 |
29,6 |
0,542 |
>0,05 |
|
T |
16 |
53,3 |
56 |
39,4 |
0,542 |
>0,05 |
|
С |
14 |
46,7 |
86 |
60,6 |
0,068 |
>0,05 |
|
rs17576 (ген ММР-9), n=85; КТ+ =15, КТ- =70 |
||||||
|
AA |
5 |
33,3 |
24 |
34,3 |
1,000 |
>0,05 |
|
AG |
9 |
60,0 |
36 |
51,4 |
0,582 |
>0,05 |
|
GG |
1 |
6,7 |
10 |
14,3 |
1,000 |
>0,05 |
|
A |
19 |
63,3 |
84 |
60,0 |
1,000 |
>0,05 |
|
G |
11 |
36,7 |
56 |
40,0 |
1,000 |
>0,05 |
|
rs3918242 (ген ММР-9), n=86; КТ+ =15, КТ- =71 |
||||||
|
СС |
6 |
40,0 |
56 |
78,9 |
0,004** |
<0,01** |
|
СТ |
9 |
60,0 |
15 |
21,1 |
0,004** |
<0,01** |
|
ТТ |
0 |
0,0 |
0 |
0,0 |
1,000 |
>0,05 |
|
С |
21 |
70,0 |
127 |
89,4 |
1,000 |
<0,01** |
|
Т |
9 |
30,0 |
15 |
10,6 |
0,004** |
<0,01** |
|
rs7853758 (ген SLC28A3), n=86; КТ+ =15, КТ- =71 |
||||||
|
GG |
13 |
86,7 |
53 |
74,6 |
0,503 |
>0,05 |
|
GA |
0 |
0,0 |
10 |
14,1 |
0,198 |
>0,05 |
|
AA |
2 |
13,3 |
8 |
11,3 |
1,000 |
>0,05 |
|
G |
26 |
86,7 |
116 |
81,7 |
1,000 |
>0,05 |
|
A |
4 |
13,3 |
26 |
18,3 |
0,505 |
>0,05 |
|
rs2229774 (ген RARG), n=84; КТ+ =14, КТ- =70 |
||||||
|
GG |
11 |
78,6 |
60 |
85,7 |
0,685 |
>0,05 |
|
GA |
3 |
21,4 |
10 |
14,3 |
0,685 |
>0,05 |
|
AA |
0 |
0,0 |
0 |
0,0 |
1,000 |
>0,05 |
|
G |
25 |
89,3 |
130 |
92,9 |
1,000 |
>0,05 |
|
A |
3 |
10,7 |
10 |
7,1 |
0,691 |
>0,05 |
|
rs1786814 (ген CELF4), n=86; КТ+ =15, КТ- =71 |
||||||
|
GG |
14 |
93,3 |
62 |
87,3 |
0,175 |
>0,05 |
|
GA |
1 |
6,7 |
8 |
11,3 |
0,173 |
>0,05 |
|
AA |
0 |
0,0 |
1 |
1,4 |
1,000 |
>0,05 |
|
G |
29 |
96,7 |
132 |
93,0 |
1,000 |
>0,05 |
|
A |
1 |
3,3 |
10 |
8,2 |
0,175 |
>0,05 |
Примечание: КТ+ — подгруппа с кардиотоксичностью, КТ- — подгруппа без кардиотоксичности, р — уровень значимости, * — р<0,05, ** — р<0,001.
У пациентов, относящихся к категории Б, наибольшие различия в частотах встречаемости аллельных вариантов и генотипов выявлены среди генов-мишеней, кодирующих матриксные металлопротеиназы, вовлекаемые в процессы ответа на интенсификацию окислительного стресса, вызываемую доксорубицином и его производными.
Оценка связи аллельных варинатов генов-мишеней исследования с вероятностью развития ранних признаков дисфункции миокарда проводилась с использованием регрессионного анализа. Для пациентов, отнесенных к категории А, линейный предиктор (z) находится согласно формуле 1:
z=-0,2323–2,2205*х1–2,2779*х2+1,5341*х3+3,0256*х4–2,2443*х5, (1)
где: х1 — полиморфный статус rs2232228 (ген HAS3), А — значение 0, G — значение 1, х2 — полиморфный статус rs243865 (ген MMP-2), Т — значение 1, С — значение 0, х3 — полиморфный статус rs35068180 (ген MMP-3), 5А — значение 0, 6А — значение 1, х4 — полиморфный статус rs1056892 (ген CBR3), G — значение 1, A — значение 0, x5 — полиморфный статус rs1695 (ген GSTP1), A — значение 1, G — значение 0.
Для расчета значения обратного логит-преобразования z в вероятность Р используется формула 2.
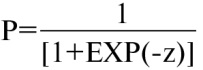 . (2)
. (2)
В качестве порогового уровня принимается значение Р0=0,6261. Чувствительность — 70,0%, специфичность — 78,08%. При значениях Р≥Р0 вероятность развития ранних признаков дисфункции миокарда у пациента считается высокой.
Для пациентов, отнесенных к категории Б, линейный предиктор (z) находится согласно формуле 3:
z=-2,6776+0,943*х1+2,096*х2–1,9597*х3+3,0309*х4, (3)
где: z — линейный предиктор в уравнении логистической регрессии, х1 — полиморфный статус rs2232228 (ген HAS3), А — значение 0, G — значение 1, х2 — полиморфный статус rs35068180 (ген MMP-3), 5А — значение 1, 6А — значение 0, х3 — полиморфный статус rs243866 (ген MMP-2), G — значение 0, A — значение 1, х4 — полиморфный rs3918242 (ген ММР-9), C — значение 0, T — значение 1.
Расчет значения обратного логит-преобразования z в вероятность Р проводится согласно формуле 2. В качестве порогового уровня принимается значение Р0=0,5874. Чувствительность — 93,3%, специфичность — 69,1%. При значениях Р≥Р0 вероятность развития ранних признаков дисфункции миокарда у пациента считается высокой.
Обсуждение
В настоящее время доксорубицин включают в большинство схем лечения злокачественных новообразований молочной железы. Этот препарат зарекомендовал себя и при лечении злокачественных новообразований яичников, лимфоидной ткани и пр. [9]. Известно, что антрациклины обладают кардиотоксическим эффектом, однако этого недостатка не лишены и другие группы препаратов. Число онкологических пациентов, которые живут ≥5 лет, из года в год увеличивается. Вне зависимости от используемой схемы ХТ у 1-5% выявляют признаки дисфункции миокарда в виде снижения ФВ ЛЖ на фоне жалоб на ухудшение состояния здоровья. У 20% наблюдается бессимптомное снижение ФВ ЛЖ. В том случае, когда возраст пациента превышает 50 лет, частота сердечно-сосудистых событий составляет ≥50%, в то время как у не онкологических пациентов порядка 15% [10]. Доксорубицин чаще других препаратов назначается в качестве первой линии ХТ [11]. В зависимости от используемой суммарной дозы доксорубицина у 5-48% пациентов в течение жизни развивается связанная с лечением ХСН [6].
В среднем 9% пациентов с РМЖ, получающих ХТ доксорубицином, диагностируют снижение ФВ ЛЖ. При этом даже при низких дозах у порядка 60% пациентов выявляют нарушения функции миокарда, с сохранением ФВ ЛЖ. В связи с этим одним из важнейших направлений современных биомедицинских исследований является поиск и выявления факторов риска развития дисфункции миокарда на как можно более ранних этапах с целью своевременного лечения развивающейся кардиомиопатии и снижения вероятности смерти пациентов от сердечно-сосудистых событий. Выявление генетических вариантов и генов, связанных с вероятностью развития КТ доксорубицина, обладает большим потенциалом как диагностический инструмент при разработке персонализированной терапии злокачественных новообразований, включая профилактику и лечение событий со стороны сердечно-сосудистой системы.
Несмотря на то, что количество исследований, посвященных этой теме, постоянно растет, только единичные варианты были изучены в рамках независимых рандомизированных исследований и в настоящее время существует необходимость получения новых клинических данных для разработки по-настоящему эффективного инструмента. Имеющиеся данные часто противоречивы из-за несоответствий использования разных контрольных точек, небольших выборок пациентов, этнических особенностей групп и пр. Однако многие авторы сходятся во мнении, что вероятность проявления КТ носит полигенный характер и требует анализа не отдельно взятых полиморфных сайтов, но построения комплексных моделей, включающих ряд вариантов для разных групп пациентов, включая группы низкого и среднего риска согласно калькулятору HFA-ICOS [12].
Из 14 вариантов, включенных в исследование на этапе после окончания ХТ, с помощью логистического регрессионного анализа для оценки вероятности развития ранней дисфункции миокарда (событие) были выбраны 5. В зависимости от вносимого вклада в предиктивную модель варианты разделяются на те, наличие которых повышает вероятность развития события (rs35068180 гена MMP-3 — вариант 6А; rs1056892 гена CBR3 — вариант G), и те, наличие которых снижает вероятность развития события (rs2232228 гена HAS3 — вариант G; rs243865 гена MMP-2 — вариант Т; rs1695 гена GSTP1 — вариант А). На этом этапе ключевую роль играет количество образующихся токсических метаболитов доксорубицина и эффективность выведения из клеток как самого препарата, так и его производных, что, вероятно, обясняет роль варианта А rs1695 гена GSTP1, связанного с высоким уровнем наработки фермента, участвующего в обевреживании токсических веществ. Romero A, et al. 2012 [13] обнаружили, что аллельный вариант G rs1695 гена GSTP1 способствует снижению скорости выведения доксорубицина и его метаболитов из клеток, что приводит к их накоплению и усугублению токсического эффекта, в то время как вариант А, наоборот, поддерживает нормальную функцию белка. Также вариант G rs1056892 гена CBR3 усиливает функцию карбомаилсинтазы и повышает концентрацию доксорубицинола в клетках. Gándara-Mireles JA, et al. 2021 [14] сообщают о том, что наличие аллельного варианта G rs1056892 гена CBR3, отвечающего за нормальную (не сниженную) функцию белка, у онкологических пациентов, получающих антрациклины, связано с более высокой вероятностью развития сердечно-сосудистых событий после окончания лечения. Несколько сложнее обосновать роль остальных вариантов, поскольку участие металлопротеиназ в развитии кардиотоксического эффекта доксорубицина изучено слабо. В рамках нашей модели на этапе после окончания ХТ доксорубицином варианты ММР-2 и ММР-3 имеют разнонаправленные вектора. Известно, что белок ММР-2 преимущественно расщепляет молекулы коллагена IV и часто его активность связывают со сродством к базальной мембране. При высоких уровнях ММР-2 целостность структуры базальной мембраны нарушается, что может приводить к нарушению функции ткани. В то же время активность ММР-3 направлена на ряд других элементов внеклеточного матрикса, например, фибронектин, ламинин, коллагены типов II, IX и XI. Вероятно, это определяет потенциально разную направленность действия ММР-2 и ММР-3 в реализации патологического эффекта доксорубицина [15][16]. Немаловажную роль в компенсации токсического эффекта доксорубицина играют такие полимеры, как гетерополисарид гиалуронан (гиалуроновая кислота). За счет своей структуры это вещество — важный компонент внеклеточного матрикса, обладает и антиоксидантными свойствами. Фермент, отвечающий за синтез гиалуроновой кислоты — гиалуронан синтаза (ген HAS3). Wang X, et al. 2014 [17] показали, что нормальная функция HAS3 (генотип АА) связана с более высоким риском развития антрациклин-опосредованной кардиомиопатии у онкологических пациентов. Важно, что гиалуронан участвует также в процессах ремоделирования ткани в результате ее повреждения и высокая активность фермента, связанная с развитием профибротических изменений, также может повышать риск развития дисфункции миокарда [18][19]. Согласно полученной нами модели на этапе после окончания ХТ высокий уровень гиалуроновой кислоты рассматривается как фактор повышающий вероятность развития ранних признаков дисфункции миокарда.
Через 12 мес. с момента окончания ХТ доксорубицином состав переменных в модели изменился. Если после окончания ХТ высокая вероятность развития события связана с вариантом, отвечающим за высокий уровень гиалуроновой кислоты, то через 12 мес. напротив этот вариант необходимо рассматривать как тот, который снижает вероятность наступления события. Аналогичная ситуация наблюдается и в случае металлопротеиназ. В качестве повышающих вероятность развития события в модель включили: вариант G rs2232228 (ген HAS3), вариант 5А rs35068180 (ген MMP-3), вариант Т rs3918242 (ген ММР-9), а в качестве снижающего вероятность наступления события только вариант А rs243866 (ген MMP-2). Hua Y, et al. 2009 [20] показали, что у этнической группы Китая — ханьцев, аллельный вариант А rs243866 гена ММР-2 связан с низким риском развития систолической СН. Далее Beber ARC, et al. 2016 [21] уточнили, что у европеоидов (Caucasian) прямая связь между вариантами rs243866 гена ММР-2 и вероятностью развития систолической СН не выявлена. Однако при анализе сочетания генотипов установили, что генотип GG связан с благоприятным течением и прогнозом СН. Оба исследования не выделяли ХТ как этиологический фактор развития ХСН. Тепляков А. Т. и др. 2015 [22] выявили, что генотип 5А/5А и аллельный вариант 5А полиморфизма rs35068180 гена ММР-3 связан с высоким риском развития ХСН. Lacchini R, et al. 2010 [23] показали, что вариант Т чаще встречается у пациентов с АГ, у которых диагностирована гипертрофия ЛЖ. Weng Y, et al. 2020 [24] выявили связь между аллельным вариантом Т rs3918242 и развитием ишемической болезни сердца.
В настоящее время молекулярно-генетические механизмы развития нарушений функции миокарда, связанные с КТ доксорубицина, изучены недостаточно для того, чтобы сделать однозначный вывод о вкладе того или иного участника в общий процесс и выработать подходящую стратегию прогнозирования. Тем не менее уже накопленные экспериментальные и клинические данные позволяют выдвигать гипотезы и разрабатывать алгоритмы прогнозирования, которые на данный момент могут снизить вероятность развития тяжелых последствий КТ доксорубицина, что отражается в рекомендациях авторитетных клинических обществ.
В рамках настоящей работы мы изучали связь ряда полиморфных вариантов генов, вовлекаемых в развитие сердечно-сосудистых событий по различным причинам с вероятностью выявления ранних признаков дисфункции миокарда в следствие приема доксорубицина. Кроме этого, мы использовали данные о пациентах групп низкого и среднего риска развития таких событий согласно HFA-ICOS. В имеющейся литературе нам не удалось обнаружить экспериментальных и клинических работ, имеющих аналогичный дизайн и посвященных этим группам онкологических пациентов. Важно отметить, что большинство имеющихся исследований принимает во внимание не ранние признаки дисфункции миокарда, часто остающиеся бессимптомными, а поздние проявления КТ доксорубицина.
Анализ полученных нами данных показал, что пациенты с ранними признаками дисфункции миокарда, связанной с КТ доксорубицина, имеют разный генетический профиль. Пациенты, у которых зарегистрированы эти признаки, могут быть разделены на дополнительные категории с помощью молекулярно-генетических тестов. Такой подход позволяет повысить чувствительность и специфичность прогнозирования этих событий. С помощью регрессионного анализа выявлены полиморфные варианты генов, данные о статусе которых позволяют прогнозировать развитие ранних признаков дисфункции миокарда на этапе непосредственно после окончания ХТ доксорубицином (категория А), отдельно на этапе через 12 мес. после ХТ (категория Б).
Ограничения исследования: а) недостаточное количество контрольных точек исследования, необходимо учитывать относительное снижение GLS, % как в процессе ХТ, так и через 3, 6, 9 мес. после окончания ХТ; б) увеличение срока наблюдения до 5 лет; в) одновременный анализ пациентов групп среднего и низкого риска.
Перспективы дальнейших исследований: а) увеличение объема выборки пациентов; б) включение в исследование большего числа молекулярных мишеней, вариантов; в) кросс-валидация результатов моделирования на аналогичной независимой выборке пациентов в рамках другого проспективного исследования.
Заключение
Таким образом, мы установили, что у ≥19% пациентов групп низкого и среднего риска согласно HFA-ICOS могут быть диагностированы ранние признаки дисфункции миокарда (относительное снижение GLS, %) с сохранением ФВ ЛЖ >50% в абсолютных значениях и отсутствием симптомов сердечно-сосудистых событий непосредственно после окончания ХТ доксорубицином. У порядка 17% пациентов аналогичные ранние признаки нарушения функции миокарда впервые диагностируются только через 12 мес. с момента окончания ХТ доксорубицином. Суммарно пациенты групп низкого и среднего риска могут быть разделены как минимум на 2 категории на основании молекулярно-генетического тестирования. Для этих категорий может быть спрогнозировано развитие ранних признаков дисфункции миокарда, связанной с КТ доксорубицина до начала ХТ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Wang Z, Fan Z, Yang L, et al. Higher risk of cardiovascular mortality than cancer mortality among long-term cancer survivors. Front Cardiovasc Med. 2023;10:1014400. doi:10.3389/fcvm.2023.1014400.
2. Song D, Shabani J, Jaiswal V, et al. Delayed doxorubicin induced cardiomyopathy in a breast cancer patient: A case report. Radiol Case Rep. 2023;18(3):1256-60. doi:10.1016/j.radcr.2022.12.048.
3. Bhatia S. Genetics of Anthracycline Cardiomyopathy in Cancer Survivors: JACC: CardioOncology State-of-the-Art Review. JACC CardioOncol. 2020;2(4):539-52. doi:10.1016/j.jaccao.2020.09.006.
4. Planek MIC, Manshad A, Hein K, et al. Prediction of doxorubicin cardiotoxicity by early detection of subclinical right ventricular dysfunction. Cardiooncology. 2020;6:10. doi:10.1186/s40959-020-00066-8.
5. Al-Otaibi TK, Weitzman B, Tahir UA, et al. Genetics of Anthracycline-Associated Cardiotoxicity. Front Cardiovasc Med. 2022;9:867873. doi:10.3389/fcvm.2022.867873.
6. Matthews ER, Johnson OD, Horn KJ, et al. Anthracyclines induce cardiotoxicity through a shared gene expression response signature. PLOS Genetics. 2024;20(2):e1011164. doi:10.1371/journal.pgen.1011164.
7. Yang X, Li G, Yang T, et al. Possible Susceptibility Genes for Intervention against Chemotherapy-Induced Cardiotoxicity. Oxid Med Cell Longev. 2020;2020:4894625. doi:10.1155/2020/4894625.
8. patients throughout oncological treatment: ESMO consensus recommendations. Ann Oncol. 2020;31(2):171-90. doi:10.1016/j.annonc.2019.10.023.
9. Thonusin C, Osataphan N, Leemasawat K, et al. Changes in blood metabolomes as potential markers for severity and prognosis in doxorubicin-induced cardiotoxicity: a study in HER2-positive and HER2-negative breast cancer patients. J Transl Med. 2024;22(1):398. doi:10.1186/s12967-024-05088-9.
10. Linders AN, Dias IB, López Fernández T, et al. A review of the pathophysiological mechanisms of doxorubicin-induced cardiotoxicity and aging. NPJ Aging. 2024;10(1):9. doi:10.1038/s41514-024-00135-7.
11. Díaz-Guerra A, Villena-Gutiérrez R, Clemente-Moragón A, et al. Anthracycline Cardiotoxicity Induces Progressive Changes in Myocardial Metabolism and Mitochondrial Quality Control: Novel Therapeutic Target. JACC CardioOncol. 2024;6(2):217-32. doi:10.1016/j.jaccao.2024.02.005.
12. Cejas RB, Petrykey K, Sapkota Y, et al. Anthracycline Toxicity: Light at the End of the Tunnel? Annu Rev Pharmacol Toxicol. 2024;64:115-34. doi:10.1146/annurev-pharmtox-022823-035521.
13. Romero A, Martín M, Oliva B, et al. Glutathione S-transferase P1 c.313A >G polymorphism could be useful in the prediction of doxorubicin response in breast cancer patients. Ann Oncol. 2012;23(7):1750-6. doi:10.1093/annonc/mdr483.
14. Gándara-Mireles JA, Lares-Asseff I, Reyes Espinoza EA, et al. Association of genetic polymorphisms NCF4 rs1883112, CBR3 rs1056892, and ABCC1 rs3743527 with the cardiotoxic effects of doxorubicin in children with acute lymphoblastic leukemia. Pharmacogenet Genomics. 2021;31(5):108-15. doi:10.1097/FPC.0000000000000428.
15. Ярмолинская М. И., Молотков А. С., Денисова В. М. Матриксные металлопротеиназы и ингибиторы: классификация, механизм действия. Журнал акушерства и женских болезней. 2012;61(1):113-25.
16. Рогова Л. Н., Шестернина Н. В., Замечник Т. В. и др. Матриксные металлопротеиназы, их роль в физиологических и патологических процессах (обзор). Вестник новых медицинских технологий. 2011;18(2):86-9.
17. Wang X, Liu W, Sun CL, et al. Hyaluronan synthase 3 variant and anthracycline-related cardiomyopathy: a report from the children's oncology group. J Clin Oncol. 2014;32(7):647-53. doi:10.1200/JCO.2013.50.3557.
18. Liu Z, Hou P, Fang J, et al. Mesenchymal stromal cells confer breast cancer doxorubicin resistance by producing hyaluronan. Oncogene. 2023;42(44):3221-35. doi:10.1038/s41388-023-02837-w.
19. Карпуть И. А., Снежицкий В. А., Курбат М. Н. и др. Аллельный вариант 6А (rs35068180) промоторной области гена MMP-3 как предиктор развития кардиотоксичности после окончания адъювантной химиотерапии доксорубицином у пациентов со злокачественными новообразованиями молочной железы. Российский кардиологический журнал. 2024;29(1):5579. doi:10.15829/1560-4071-2024-5579.
20. Hua Y, Song L, Wu N, et al. Polymorphisms of MMP-2 gene are associated with systolic heart failure risk in Han Chinese. Am J Med Sci. 2009;337(5):344-8. doi:10.1097/MAJ.0b013e31818eb2a2.
21. Beber AR, Polina ER, Biolo A, et al. Matrix Metalloproteinase-2 Polymorphisms in Chronic Heart Failure: Relationship with Susceptibility and Long-Term Survival. PLoS One. 2016;11(8):e0161666. doi:10.1371/journal.pone.0161666.
22. Тепляков А. Т., Березикова Е. Н., Шилов С. Н. и др. Оценка роли полиморфизма гена матриксной металлопротеиназы-3 в развитии хронической сердечной недостаточности. Терапевтический архив. 2015;87(4):8-12. doi:10.17116/terarkh20158748-12.
23. Lacchini R, Jacob-Ferreira AL, Luizon MR, et al. Matrix metalloproteinase 9 gene haplotypes affect left ventricular hypertrophy in hypertensive patients. Clin Chim Acta. 2010;411(23-24):1940-4. doi:10.1016/j.cca.2010.08.008.
24. Weng Y, Chen T, Ren J, et al. The Association Between Extracellular Matrix Metalloproteinase Inducer Polymorphisms and Coronary Heart Disease: A Potential Way to Predict Disease. DNA Cell Biol. 2020;39(2):244-54. doi:10.1089/dna.2019.5015.
Об авторах
И. А. КарпутьБеларусь
Карпуть Ирина Александровна — аспирант, 1-ая кафедра внутренних болезней.
Гродно
Конфликт интересов:
Нет
В. А. Снежицкий
Беларусь
Снежицкий Виктор Александрович — д.м.н., профессор, 1-ая кафедра внутренних болезней.
Гродно
Scopus ID 40762304300
Конфликт интересов:
Нет
М. Н. Курбат
Беларусь
Курбат Михаил Николаевич — к.м.н., доцент, зав. научно-исследовательской лабораторией.
Гродно
Scopus ID 9432505900
Конфликт интересов:
Нет
О. А. Горустович
Беларусь
Горустович Ольга Анатольевна — к.м.н., доцент, кафедра нормальной анатомии.
Гродно
Конфликт интересов:
Нет
А. В. Копыцкий
Беларусь
Копыцкий А. В. — к. м. н., старший преподаватель, кафедра медицинской и биологической физики.
Гродно
Конфликт интересов:
Нет
А. С. Бабенко
Беларусь
Бабенко Андрей Сергеевич — к. х. н., доцент, кафедра общей химии.
Минск
Scopus ID 57718401300
Конфликт интересов:
Нет
Дополнительные файлы
- У пациентов с установленным диагнозом рак молочной железы групп низкого и среднего риска согласно HFA-ICOS диагностируются ранние признаки дисфункции миокарда (относительное снижение глобальной продольной деформации миокарда, %) с сохранением фракции выброса левого желудочка >50% в абсолютных значениях и отсутствием симптомов сердечно-сосудистой системы.
- Ранние признаки дисфункции миокарда могут быть выявлены как непосредственно после химиотерапии доксорубицином, так и через 12 мес. с момента ее окончания.
- На основании молекулярно-генетического тестирования до начала химиотерапии может быть спрогнозировано развитие ранних признаков дисфункции миокарда, связанной с проявлениями кардиотоксического эффекта доксорубицина.
Рецензия
Для цитирования:
Карпуть И.А., Снежицкий В.А., Курбат М.Н., Горустович О.А., Копыцкий А.В., Бабенко А.С. Молекулярно-генетические показатели вероятности развития ранних признаков нарушения систолической функции миокарда при химиотерапии доксорубицином у пациентов со злокачественными новообразованиями молочной железы групп среднего и низкого риска (HFA-ICOS). Российский кардиологический журнал. 2024;29(10):5993. https://doi.org/10.15829/1560-4071-2024-5993. EDN: TGZPDQ
For citation:
Karput I.A., Snezhitsky V.A., Kurbat M.N., Gorustovich O.A., Kopytsky A.V., Babenko A.S. Molecular genetic indicators of the probability of early myocardial systolic dysfunction signs in doxorubicin chemotherapy in patients with breast cancer of moderate and low HFA-ICOS risk groups. Russian Journal of Cardiology. 2024;29(10):5993. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5993. EDN: TGZPDQ
JATS XML

















































