Перейти к:
Редкие варианты гена филамина С среди пациентов с гипертрофической кардиомиопатией, направленных на септальную миоэктомию
https://doi.org/10.15829/1560-4071-2024-5942
EDN: AIUPFZ
Аннотация
Цель. Определить частоту и спектр редких вариантов гена филамина С (FLNC) среди пациентов с обструктивной гипертрофической кардиомиопатией (ГКМП), направленных на септальную миоэктомию, а также дать клиническую характеристику ГКМП, протекающей на фоне данных вариантов.
Материал и методы. 98 взрослым пациентам с ГКМП, которым была проведена процедура септальной миоэктомии, было выполнено генетическое тестирование методом секвенирования нового поколения с использованием целевой кардиопанели (панель на 39 генов применена у 58 пациентов, и панель на 17 генов — у 40 пациентов). У пациентов с редкими вариантами FLNC (с частотой минорного аллеля <0,01%) были проанализированы данные анамнеза, эхокардиографии (ЭхоКГ), электрокардиографии, холтеровского мониторирования, а также гистологического исследования миокарда, полученного интраоперационно.
Результаты. Выявлено 4 пациента с редкими вариантами FLNC (2 мужчины и 2 женщины), что составило 4% (Pro1774Ser, Thr1317Pro и His1834Tyr, последний выявлен дважды). Указанные варианты являлись точечными однонуклеотидными заменами и классифицировались как варианты неопределенной клинической значимости. Вариант FLNC p.Thr1317Pro у одного пациента сочетался с патогенным вариантом в гене MYH7 p.Val606Leu. Дебют заболевания у всех пациентов произошел после 40 лет. Клиническая картина была представлена умеренными проявлениями сердечной недостаточности и стенокардии на уровне II функционального класса, не было зарегистрировано пароксизмов неустойчивой желудочковой тахикардии и фибрилляции предсердий, клинически значимых блокад проводимости. При ЭхоКГ у одной пациентки с вариантом p.His1834Tyr наблюдалась двояковыпуклая межжелудочковая перегородка с преобладающей гипертрофией срединных отделов, в то время как у остальных пациентов была преимущественно гипертрофия базальных отделов. Диастолическая дисфункция не превышала 1-2 степени у всех четырех пациентов.
Заключение. Клинические характеристики носителей редких вариантов FLNC в нашем исследовании не отличались от большинства пациентов с ГКМП, подвергшихся операции септальной миоэктомии. Редкие варианты гена FLNC могут выступать в качестве причинных или модификаторов течения ГКМП. Для уточнения характера патогенности редких вариантов FLNC необходимы функциональные и популяционные исследования с применением сегрегационного анализа.
Для цитирования:
Андреева С.Е., Гурщенков А.В., Зайцев В.В., Козырева А.А., Михалева А.И., Муравьев А.С., Гребенник В.К., Митрофанова Л.Б., Гордеев М.Л., Моисеева О.М., Костарева А.А. Редкие варианты гена филамина С среди пациентов с гипертрофической кардиомиопатией, направленных на септальную миоэктомию. Российский кардиологический журнал. 2024;29(10):5942. https://doi.org/10.15829/1560-4071-2024-5942. EDN: AIUPFZ
For citation:
Andreeva S.E., Gurshchenkov A.V., Zajcev V.V., Kozyreva A.A., Mihaleva A.I., Murav'ev A.S., Grebennik V.K., Mitrofanova L.B., Gordeev M.L., Moiseeva O.M., Kostareva A.A. Rare filamin C variants among patients with hypertrophic cardiomyopathy referred for septal myectomy. Russian Journal of Cardiology. 2024;29(10):5942. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5942. EDN: AIUPFZ
Гипертрофическая кардиомиопатия (ГКМП) является самым распространенным генетически обусловленным заболеванием сердца и характеризуется гипертрофией миокарда, неадекватной гемодинамической нагрузке [1][2]. Она ассоциирована с неблагоприятными исходами — фибрилляцией предсердий, сердечной недостаточностью (СН) и внезапной сердечной смертью [1][2]. В последние годы появляются новые данные, расширяющие представление об этиологии ГКМП, выводя ее за пределы "болезни саркомера": наряду с подтверждением полигенного вклада несаркомерных генов в развитие ГКМП, в спектре моногенных причин также появляются новые несаркомерные гены-кандидаты [3-5].
Примером является ген филамина С (FLNC), экспрессируемый в поперечно-полосатой мускулатуре [6][7]. В кардиомиоцитах FLNC локализован в области Z-диска, где он, соединяясь с тонкими филаментами, обеспечивает механическую стабильность саркомера [6][7]. Расположение в Z-диске и его взаимодействие с другими протеинами данной зоны позволяет ему выполнять функцию узла, обеспечивающего механосенсинг и трансдукцию сигнала [6]. FLNC — динамичный протеин, преобладающая локализация которого может меняться на различных этапах онтогенеза, а также в условиях стресса [6]. В субсарколемме FLNC является частью аппарата костамера, поддерживающего тонкие взаимодействия между саркомером и внеклеточным матриксом [6]. Также FLNC представлен в области вставочных дисков, где его количество повышается в условиях механического стресса [6].
Первые сообщения о выявлении патогенных вариантов FLNC относились к миопатиям, симптомы которых также могли включать гипертрофию левого желудочка [3, 8]. К настоящему моменту большинство сообщений о выявлении вариантов гена FLNC при заболеваниях относятся именно к кардиомиопатиям [3]. Укорачивающие варианты FLNC приводят к развитию дилатационной (ДКМП) и аритмогенной кардиомиопатии правого желудочка по механизму гаплонедостаточности, в то время как миссенс-варианты выявляются при ГКМП и рестриктивной кардиомиопатии (РКМП) и, как предполагается, формируют фенотип заболевания за счет неправильного фолдинга и агрегации протеинов [6][7][9][10]. Согласно исследованию Ader F, et al., варианты FLNC, которые можно идентифицировать как причинные, выявляются в 1,3% случаев ГКМП [10].
На настоящий момент остается актуальным вопрос о патогенности выявляемых у пациентов с ГКМП вариантов в гене FLNC, поскольку подавляющее их большинство являются миссенс и классифицируются как варианты неопределенной клинической значимости [3][7]. Изучение корреляции генотип-фенотип у пациентов с вариантами FLNC и ГКМП с более тяжелым клиническим течением может представлять актуальную научную задачу в рамках интерпретации вариантов FLNC при данной кардиомиопатии.
Наличие обструкции выносящего тракта левого желудочка (ВТЛЖ) является одним из ключевых эхокардиографических признаков, позволяющим идентифицировать подгруппу повышенного риска развития неблагоприятных событий [11][12]. Так, подавляющее большинство случаев СН при ГКМП формируется у пациентов с обструктивной формой, также наличие обструкции ВТЛЖ является фактором, повышающим риск развития внезапной сердечной смерти [11][12]. Пациенты с обструкцией ВТЛЖ имеют более выраженную диастолическую дисфункцию, выявляемую при эхокардиографии (ЭхоКГ), и более распространенный фиброз по данным магнитно-резонансной томографии, который локализован не только фокально в области гипертрофированного миокарда, но и носит диффузный характер, что, как предполагается, обусловлено хронической перегрузкой давлением [13]. Симптомным пациентам, рефрактерным к медикаментозной терапии, с тяжелой обструкцией ВТЛЖ, определяемой по пиковому градиенту в ВТЛЖ ≥50 мм рт.ст., экспертными сообществами рекомендовано проведение процедуры септальной миоэктомии [1][2].
На настоящий момент в литературе отсутствуют данные о спектре вариантов гена FLNC в когорте пациентов с обструктивной ГКМП и клинических характеристиках пациентов из данной генетической группы.
С помощью технологии секвенирования нового поколения, цель исследования — определить частоту и спектр редких вариантов FLNC среди взрослых пациентов с обструктивной ГКМП, направленных на септальную миоэктомию, дать клиническую и патоморфологическую характеристику ГКМП, протекающей на фоне данных вариантов.
Материал и методы
Исследование было проведено в соответствии с Хельсинкской декларацией и одобрено локальным этическим комитетом НМИЦ им. В. А. Алмазова, перед включением у всех участников было получено письменное информированное согласие.
В исследование включено 98 неродственных пациентов с ГКМП, госпитализированных в НМИЦ им. В. А. Алмазова с целью проведения процедуры септальной миоэктомии (рис. 1). Для 58 пациентов было выполнено генетическое исследование методом секвенирования нового поколения с использованием целевой кардиопанели для проверки 39 генов, ассоциированных с развитием кардиомиопатий (список генов в Приложении). Еще 40 пациентам генетическое исследование методом массового параллельного секвенирования было выполнено с применением целевой панели на 17 генов (список генов в Приложении). Секвенирование библиотек было проведено с использованием набора целевого обогащения SureSelect Human All Exon V6 r2 (60Mbp) (Agilent Technologies, США) при помощи секвенатора Illumina HiSeq и SBSv4 реактивов (Illumina, США). Выравнивание, обработка данных и аннотации были выполнены с использованием референса генома человека hg19.
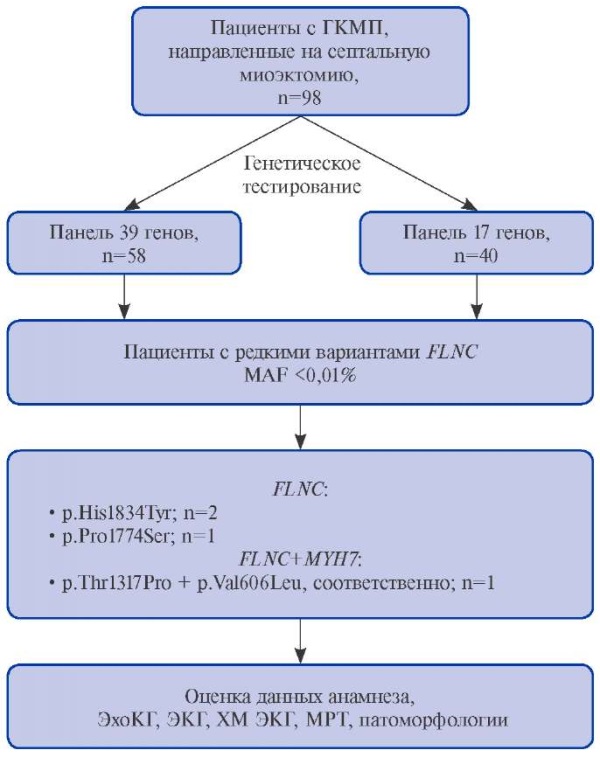
Рис. 1. Схема исследования.
Сокращения: ГКМП — гипертрофическая кардиомиопатия, МРТ — магнитно-резонансная томография, ХМ ЭКГ — холтеровское мониторирование ЭКГ, ЭКГ — электрокардиограмма, ЭхоКГ — эхокардиография, n — количество пациентов, MAF — частота минорного аллеля.
По результатам проведенного генетического тестирования были отобраны пациенты с редкими вариантами FLNC (MAF <0,01%), последние были классифицированы согласно рекомендациям Американской коллегии медицинской генетики (ACMG) [14]. Для отобранных пациентов были проанализированы данные анамнеза, ЭхоКГ, электрокардиограммы, выполненные до миоэктомии, холтеровского мониторирования. Дана патоморфологическая характеристика миокарда межжелудочковой перегородки (МЖП), полученного интраоперационно в ходе процедуры миоэктомии. Работа выполнена при финансовой поддержке гранта РНФ 15-20-00271 П.
Результаты
Генетическая характеристика. Среди 98 проанализированных пациентов выявлено 4 пациента с редкими вариантами FLNC — 2 мужчины и 2 женщины (рис. 1, табл. 1). Данные варианты определены как миссенс и находились в гетерозиготном состоянии: p.Pro1774Ser, p.His1834Tyr и p.Thr1317Pro, при этом вариант p.His1834Tyr был обнаружен дважды, у двух неродственных пациентов (пациенты А-Г, соответственно). Все указанные варианты согласно ACMG/AMP классифицированы как варианты неопределенной клинической значимости. Ни один из указанных вариантов FLNC не был описан ранее в литературе. Вариант FLNC p.Thr1317Pro выявлен в сочетании с патогенным вариантом в гене MYH7 p.Val606Leu (табл. 1). Вариант FLNC p.Thr1317Pro был локализован в домене ROD1, остальные — в ROD2. Анализ предсказания патогенности in silico на основе вычислительных моделей продемонстрировал доказательства в пользу патогенного характера вариантов p.His1834Tyr и p.Thr1317Pro и доброкачественного характера для варианта p.Pro1774Ser (табл. 2).
Таблица 1
Клинические характеристики пациентов с вариантами FLNC
Пациент А | Пациент Б | Пациент В | Пациент Г | ||
Панель | 39 генов | 39 генов | 17 генов | 39 генов | |
Пол | М | Ж | Ж | М | |
Ген | FLNC | FLNC | FLNC | MYH7 | FLNC |
Вариант | p.Pro1774Ser | p.His1834Tyr | p.His1834Tyr | p.Val606Leu | p.Thr1317Pro |
Возраст дебюта заболевания | 45 | 41 | 64 | 43 | |
Возраст миоэктомии, лет | 49 | 42 | 66 | 45 | |
Жалобы | одышка при ФН, пресинкопы | одышка, боли в грудной клетке | одышка при ФН, боли в грудной клетке | одышка при ФН, синкопальные состояния | |
ХСН, ФК | II | II | II | II | |
Артериальная гипертензия | есть, контролируемая | нет | есть, контролируемая | нет | |
Сахарный диабет, тип 2 | нет | нет | нет | нет | |
Фибрилляция предсердий | нет | нет | нет | нет | |
Нарушения проводимости | не выявлено | блокада передне-верхнего разветвления ЛНПГ | не выявлено | блокада передне-верхнего разветвления ЛНПГ | |
Неустойчивая желудочковая тахикардия | нет | нет | нет | нет | |
Гемодинамически значимые стенозы КА | нет | интрамиокардиальное прохождение ПМЖА, стеноз в систолу 75% | нет | интрамиокардиальное прохождение ПМЖА, стеноз в систолу 70% | |
Максимальный градиент в покое, мм рт.ст. | 56 | 72 | 12 | 104 | |
Максимальный градиент провоцируемый, мм рт.ст. (метод провокации) | 132 (проба Вальсальвы) | 142 (проба Вальсальвы) | 65 (стресс-ЭхоКГ) | 126 (проба Вальсальвы) | |
Толщина МЖП, мм | 22 (базально) | 20 (базально) 29 (срединные отделы) | 19 (базально) | 20 (базально) | |
ЗС ЛЖ, мм | 13 | 12 | 14 | 10 | |
ФВ ЛЖ Симпсон, % | 66 | 60 | 57 | 77 | |
иОЛП, мл/м² | 47 | 45 | 39 | 41 | |
иКДО, мл/м² | 48 | 46 | 28 | 56 | |
иКСО, мл/м² | — | 19 | 12 | 13 | |
Митральная регургитация | умеренная | умеренная | легкая | умеренная | |
РСДЛА, мм рт.ст. | не лоцируется | 38 | 35 | 40 | |
Диастолическая дисфункция, степень | 2 | 2 | 1 | 2 | |
Сокращения: Ж — женский пол, ЗС ЛЖ — задняя стенка левого желудочка, иКДО — индексированный конечный диастолический объем, иКСО — индексированный конечный систолический объем, иОЛП — индекс объема левого предсердия, КА — коронарные артерии, ЛНПГ — левая ножка пучка Гиса, М — мужской пол, МЖП — межжелудочковая перегородка, ПМЖА — передняя межжелудочковая артерия, РСДЛА — расчетное систолическое давление в легочной артерии, ФВ ЛЖ — фракция выброса левого желудочка, ФК — функциональный класс, ФН — физическая нагрузка, ХСН — хроническая сердечная недостаточность, ЭхоКГ — эхокардиография.
Таблица 2
Редкие варианты гена FLNC, выявленные среди пациентов в данном исследовании, и их оценка по шкалам предсказания патогенности in silico
Пациенты | А | Б, В | Г |
Тип варианта | Миссенс | Миссенс | Миссенс |
Домен | ROD2 | ROD2 | ROD1 |
Экзон | 32 | 33 | 33 |
Позиция g. | g.128490459C>T | g.128490958C>T | g.128486202A>G |
Позиция c. | c.5320C>T | c.5500C>T | c.3949A>G |
Позиция p. | p.Pro1774Ser | p.His1834Tyr | p.Thr1317Pro |
Номер rs | rs370823820 | rs377141822 | rs377555574 |
MAF | 0.000007 | 0.00006083 | 0.00008034 |
ACMG/AMP | VUS | VUS | VUS |
In-silico predictors | Benign Supporting - BP4 | Pathogenic Supporting - PP3 | Pathogenic Supporting - PP3 |
MetaSVM | ND | Benign Moderate | Pathogenic Moderate |
FATHMM | Uncertain | Benign Supporting | Uncertain |
FATHMM-XF | Benign Supporting | Pathogenic Supporting | Pathogenic Moderate |
PROVEAN | Benign Supporting | Pathogenic Supporting | Pathogenic Supporting |
MutationTaster | Benign Supporting | Uncertain | Uncertain |
CADD | 23.1 | 26.7 | 25.4 |
Клиническая характеристика. У всех четырех пациентов заболевание дебютировало после 40 лет — в 41, 43, 45 и 64 года, — что потребовало проведения септальной миоэктомии спустя 1-4 года (табл. 1). Клиническая картина была представлена умеренными проявлениями СН и стенокардии на уровне II функционального класса; у пациента с вариантами FLNC+MYH7 наблюдались также синкопальные состояния. Не было зарегистрировано пароксизмов неустойчивой желудочковой тахикардии и фибрилляции предсердий. По данным проанализированных историй болезней не было указаний на наследственный характер заболевания.
Анализ ЭхоКГ и данных магнитно-резонансной томографии показал, что все пациенты с вариантами FLNC характеризовались промежуточной степенью выраженности гипертрофии левого желудочка без экстремальных значений: максимальная толщина стенок составила от 19 до 29 мм. У пациентки Б с вариантом p.His1834Tyr наблюдалась двояковыпуклая МЖП, что приводило к формированию обструкции на уровне базальных и срединных отделов, в то время как у остальных пациентов преобладал вариант с гипертрофией преимущественно базальных отделов МЖП (рис. 2). Ни один из пациентов на момент исследования не достиг гипокинетической фазы ГКМП, определяемой при фракции выброса по Симпсон <50%. У всех пациентов диастолическая дисфункция соответствовала 1 или 2 степени, дилатация левого предсердия также не превышала умеренных значений (индекс объема левого предсердия от 37 до 45 мл/м²), а показатели расчетного систолического давления в легочной артерии соответствовали легочной гипертензии 1 степени. Клинические характеристики пациентов с редкими вариантами FLNC суммированы в таблице 1.
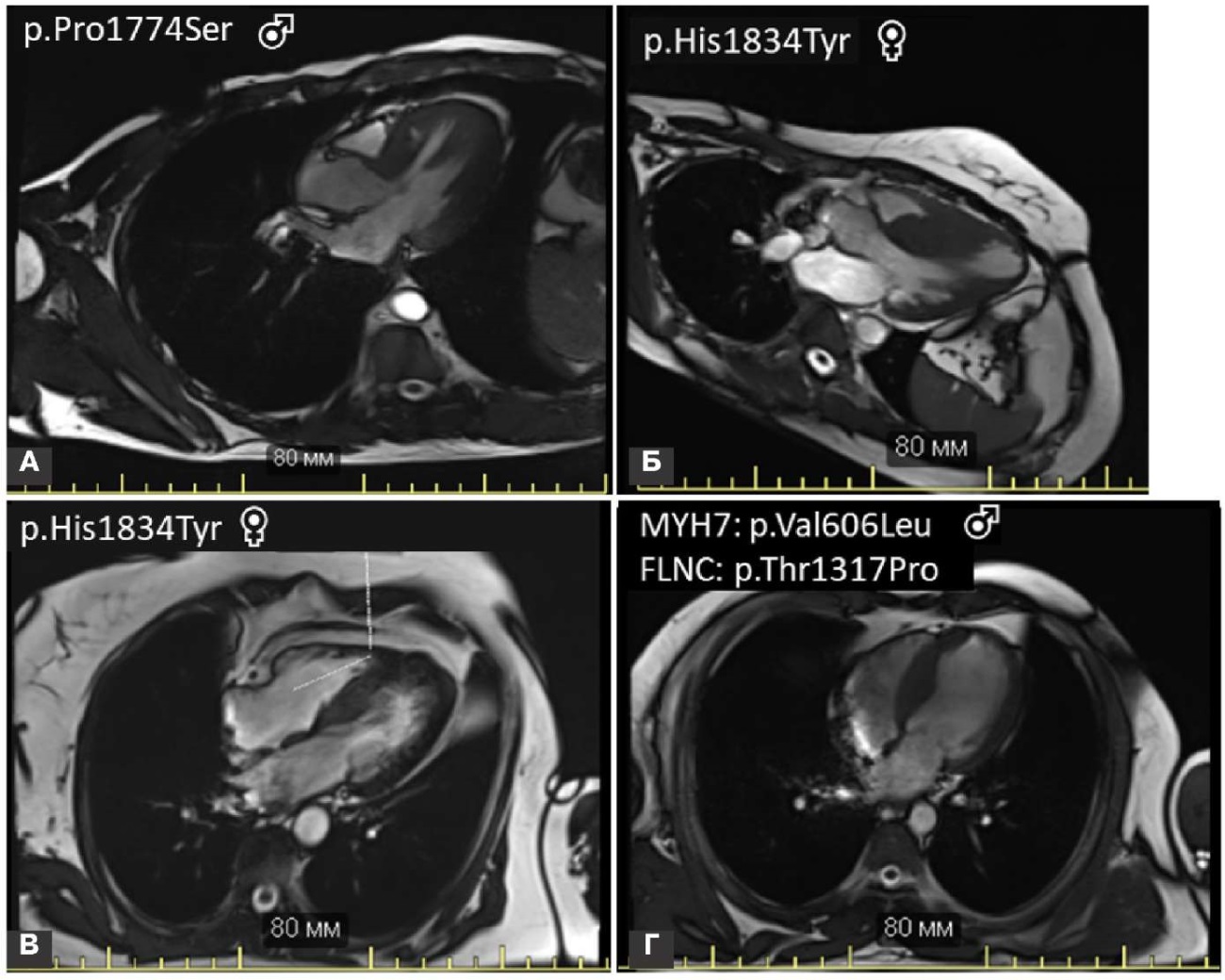
Рис. 2. Результаты магнитно-резонансной томографии носителей миссенс-вариантов FLNC. У пациентки Б с вариантом p.His1834Tyr наблюдалась двояковыпуклая МЖП с преобладающей гипертрофией на уровне срединных отделов, в то время как у остальных пациентов наблюдался вариант с гипертрофией преимущественно базальных отделов МЖП.
Во фрагментах миокарда МЖП, полученного интраоперационно, у всех пациентов наблюдались признаки ГКМП, такие как гипертрофия кардиомиоцитов, феномен "disarray" (дискомплексация) различной степени выраженности и мелкоочаговый фиброз (табл. 3). Дискомплексация кардиомиоцитов >15% выявлена у пациента с вариантом FLNC p.Pro1774Ser, а также у пациента с вариантами MYH7+FLNC p.Val606Leu и p.Thr1317Pro, соответственно, тогда как у оставшихся пациентов disarray составил <15%. Кроме того, у всех пациентов наблюдалось утолщение и фиброз эндокарда. Не было выявлено признаков амилоидоза и гликогеноза.
Таблица 3
Результаты патоморфологического исследования миокарда пациентов с вариантами FLNC среди миоэктомированных
Пациент | А | Б | В | Г |
Дискомплексация мышечных волокон | <15% | >15% | <15% | >15% |
Гипертрофия КМЦ | + | + | + | + |
Утолщение эндокарда | + | + | + | + |
Утолщение интрамуральных сосудов | + | + | — | — |
Реакция Шифф-йодной кислотой+включения | нет | есть (единичные КМЦ) | нет | нет |
Сокращение: КМЦ — кардиомиоциты.
Обсуждение
В данной работе мы сфокусировались на вариантах гена FLNC, претендующего на роль причинного в развитии несаркомерных форм ГКМП. Особенность этого исследования заключается в том, что оно выполнено в когорте пациентов с обструктивной ГКМП, отобранных для проведения процедуры септальной миоэктомии, а значит, представляющих собой подгруппу повышенного риска развития неблагоприятных клинических исходов [11][12].
Изучение генетических основ и патогенетических механизмов формирования несаркомерной ГКМП имеет особый смысл на современном этапе лечения данной патологии: появление терапии обструктивной ГКМП ингибиторами сердечного миозина, основные механизмы работы которого изучены на клетках с мутациями генов саркомера, поднимает вопросы о потенциальной эффективности данной терапии в когорте пациентов без патогенных вариантов в генах саркомера, которая составляет 40-60% всех пациентов с ГКМП [4][5][15][16].
Среди 98 проанализированных пациентов редкие варианты FLNC были выявлены у 4 пациентов, что составляет 4%, согласуется с частотой редких вариантов FLNC в общей популяции пациентов с ГКМП, варьирующей по данным литературы от 1,3 до 5,0% [10][17-19]. Два из трех выявленных вариантов (p.Pro1774Ser и p.His1834Tyr) расположены в домене ROD2, являющемся мутационной горячей точкой [6][7]. Он является важным доменом для внутриклеточного сигналлинга, димеризации филамина и взаимодействия с Z-диском, в связи с чем, как предполагается, миссенс-варианты, локализованные в домене ROD2, имеют высокую вероятность быть патогенными для ГКМП [7]. Замена p.Thr1317Pro обнаружена в домене ROD1, являющемся еще одной распространенной локализацией вариантов для FLNC-ГКМП [6][7]. Ни один из указанных вариантов не был описан ранее в литературе.
Клиническое течение у носителей редких вариантов FLNC в нашем исследовании характеризовалось умеренной тяжестью: дебют заболевания произошел после 40 лет, СН не достигала продвинутых стадий, не было зафиксировано прогностически неблагоприятных желудочковых нарушений ритма и фибрилляции предсердий. Данные ЭхоКГ продемонстрировали легкую или умеренную степень дилатации левого предсердия, диастолическую дисфункцию первой или второй стадии, отсутствие снижения контрактильности и рестриктивного кровотока. Эти результаты также согласуются с данными литературы, где по основным клиническим характеристикам большинство носителей вариантов FLNC не отличались значимо от остальных пациентов с ГКМП [17][18].
К настоящему моменту выявлены определенные закономерности в реализации фенотипа FLNC-кардиомиопатий, в зависимости от функциональных характеристик причинного генетического варианта. Так, известно, что укорачивающие варианты FLNC (truncFLNC) преобладают у пациентов с ДКМП и аритмогенной дисплазии правого желудочка. Такие варианты несут в себе стоп-кодон и, как предполагается, запускают высококонсервативный механизм нонсенс-опосредованного распада РНК, в результате которого мутантный FLNC не синтезируется, количество FLNC в клетке снижается и возникает его гаплонедостаточность [6]. Данный механизм был заподозрен на основании того, что в цитоплазме кардиомиоцитов пациентов с truncFLNC-ДКМП не было выявлено агрегатов FLNC, в животных моделях truncFLNC с применением рыб данио-рерио и крысиных миобластов также не было выявлено агрегатов FLNC [6][9]. На гистологическом уровне у пациентов с truncFLNC-ДКМП наблюдаются участки выраженного циркулярного фиброза, что приводит к электрофизиологической нестабильности и прогностически неблагоприятным желудочковым аритмиям [9]. В связи с чем наличие truncFLNC у пациентов с ДКМП выделено отдельным пунктом в клинических рекомендациях при принятии решения об имплантации кардиовертера-дефибриллятора [1].
В свою очередь, у пациентов с ГКМП truncFLNC варианты никогда не были выявлены [20]. Вместо этого у пациентов с ГКМП и РКМП преобладают неукорачивающие варианты FLNC, из которых ~95% составляют миссенс-варианты [6]. Для миссенс-вариантов FLNC основным предполагаемым механизмом формирования фенотипа кардиомиопатии является неправильный фолдинг и агрегация протеинов, которые склонны локализовываться вокруг ядра [20-22]. С точки зрения клинических проявлений, большинство сообщений о РКМП на фоне миссенс-вариантов FLNC составляют случаи неблагоприятного течения с дебютом в детском возрасте, нередко в сочетании с нейромышечным фенотипом [21-26], в то время как ГКМП на фоне миссенс-вариантов FLNC не отличалась по своим клиническим характеристикам от общей когорты пациентов с ГКМП [17][18], с чем согласуются результаты нашего исследования. Исключения представляют собой единичные описания FLNC-ГКМП с яркой клинической картиной, неблагоприятным прогнозом и высокой семейной агрегацией [20][27].
По настоящий момент однозначная клиническая интерпретация редких вариантов FLNC, выявляемых среди пациентов с ГКМП, затруднена. Во-первых, для большинства выявляемых при ГКМП миссенс-вариантов FLNC отсутствуют функциональные исследования, в связи с чем они сохраняют за собой статус вариантов неопределенной клинической значимости. Во-вторых, имеются данные, ставящее под сомнение само положение о том, что варианты FLNC вызывают ГКМП: так, в работе Cui H, et al. 2018г частота вариантов FLNC в когорте 540 пациентов ГКМП не отличалась статистически значимо от таковой в группе 307 здоровых добровольцев [17], и, таким образом, могла отражать распространенность редких, но доброкачественных вариантов. Мы полагаем, что влияние миссенс-вариантов FLNC на реализацию фенотипа кардиомиопатий может представлять собой спектр: от модифицирующего влияния к вариантам с большего размера генетическим эффектом, что, вероятно, зависит от функциональных последствий конкретного генетического варианта.
Роль гистологических находок в диагностике и ведении ГКМП на современном этапе ее изучения остается неуточненной [28]. Характерными гистопатологическими признаками ГКМП являются гипертрофия и дискомплексация (феномен disarray) кардиомиоцитов, аномалии малых интрамуральных сосудов, интерстициальный и заместительный фиброз [28]. Известно, что феномен disarray более выражен у молодых пациентов с ГКМП, погибших от внезапной сердечной смерти, однако для установления четкой взаимосвязи между степенью дискомплексации и выживаемостью существующих данных недостаточно [28-30]. Заместительный фиброз связывают с ишемией, возникающей на фоне поражения малых сосудов, и он в большей степени, по-видимому, участвует в формировании осложнений при ГКМП, в то время как интерстициальный фиброз способствует диастолической дисфункции и дилатации предсердий [28][30]. В нашем исследовании у пациентов с вариантами FLNC при гистологическом исследовании фрагментов МЖП не было выявлено участков заместительного фиброза, но у всех был описан интерстициальный его вариант, что на клиническом уровне соответствовало умеренной или легкой диастолической дисфункции и отсутствию желудочковых нарушений ритма и, таким образом, согласуется с описанными выше литературными данными [28][30]. У всех пациентов с FLNC-ГКМП было выявлено утолщение эндокарда, характерное для пациентов старшей возрастной группы [30].
Отдельно мы бы хотели обсудить случай пациента Г, у которого было выявлено сочетание несаркомерного варианта FLNC p.Thr1317Pro неопределенной клинической значимости и патогенного варианта в гене саркомера MYH7 p.Val606Leu. Несмотря на то, что выявление патогенного саркомерного варианта само по себе достаточно для объяснения формирования фенотипа ГКМП, нам представляется важным сообщать о подобных клинических случаях в связи с доказанной неполной пенетрантностью саркомерных генетических вариантов и растущими свидетельствами полигенной природы ГКМП [3-5][31][32]. Сочетание вариантов FLNC с саркомерными описано в когорте пациентов с ГКМП: так, в исследовании Cui H, et al. у каждого третьего пациента с вариантом FLNC были также выявлены патогенные и вероятно патогенные варианты в генах саркомера [17]. Мы полагаем, что вариант FLNC p.Thr1317Pro также мог участвовать в формировании фенотипа заболевания, в роли модификатора или как самостоятельный причинный вариант.
К недостаткам нашего исследования следует отнести отсутствие сегрегационного анализа, а также отсутствие функциональных исследований для выявленных вариантов, в связи с чем их клиническая интерпретация затруднена, что требует дальнейшего экспериментального подтверждения и популяционных исследований.
Заключение
В приведенных случаях клинические характеристики носителей редких миссенс-вариантов FLNC среди пациентов с обструктивной ГКМП, направленных на септальную миоэктомию, не отличались от большинства пациентов в общей когорте ГКМП и характеризовались дебютом заболевания после четвертой декады жизни, отсутствием гипокинетических форм, рестриктивного кровотока и жизнеугрожающих желудочковых аритмий. Дальнейшие функциональные и популяционные исследования должны пролить свет на корреляцию генотип-фенотип у пациентов с миссенс-вариантами FLNC и ГКМП.
Отношения и деятельность. Работа выполнена при финансовой поддержке гранта РНФ 15-20-00271 П.
Список литературы
1. Arbelo E, Protonotarios A, Gimeno JR, et al. 2023 ESC Guidelines for the management of cardiomyopathies: Developed by the task force on the management of cardiomyopathies of the European Society of Cardiology (ESC). Eur Heart J. 2023;44:3503-626. doi:10.1093/eurheartj/ehad194.
2. Габрусенко С. А., Гудкова А. Я., Козиолова Н. А. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
3. Walsh R, Offerhaus JA, Tadros R, et al. Minor hypertrophic cardiomyopathy genes, major insights into the genetics of cardiomyopathies. Nat Rev Cardiol. 2022;19:151-67. doi:10.1038/S41569-021-00608-2.
4. Harper AR, Goel A, Grace C, et al. Common genetic variants and modifiable risk factors underpin hypertrophic cardiomyopathy susceptibility and expressivity. Nat Genet. 2021;53:135-42. doi:10.1038/s41588-020-00764-0.
5. Tadros R, Francis C, Xu X, et al. Shared genetic pathways contribute to risk of hypertrophic and dilated cardiomyopathies with opposite directions of effect. Nat Genet. 2021;53: 128-34. doi:10.1038/s41588-020-00762-2.
6. Song S, Shi A, Lian H, et al. Filamin C in cardiomyopathy: from physiological roles to DNA variants. Heart Fail Rev. 2022;27:1373-85. doi:10.1007/S10741-021-10172-Z.
7. Verdonschot JAJ, Vanhoutte EK, Claes GRF, et al. A mutation update for the FLNC gene in myopathies and cardiomyopathies. Hum Mutat. 2020;41:1091-111. doi:10.1002/humu.24004.
8. Kley RA, Hellenbroich Y, Van Der Ven PFM, et al. Clinical and morphological phenotype of the filamin myopathy: a study of 31 German patients. Brain. 2007;130 Pt 12:3250-64. doi:10.1093/BRAIN/AWM271.
9. Ortiz-Genga MF, Cuenca S, Dal Ferro M, et al. Truncating FLNC Mutations Are Associated With High-Risk Dilated and Arrhythmogenic Cardiomyopathies. J Am Coll Cardiol. 2016;68:2440-51. doi:10.1016/J.JACC.2016.09.927.
10. Ader F, De Groote P, Réant P, et al. FLNC pathogenic variants in patients with cardiomyopathies: Prevalence and genotype-phenotype correlations. Clin Genet. 2019;96:317-29. doi:10.1111/CGE.13594.
11. Seferović PM, Polovina M, Bauersachs J, et al. Heart failure in cardiomyopathies: a position paper from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2019;21:553-76. doi:10.1002/EJHF.1461.
12. O'Mahony C, Jichi F, Pavlou M, et al. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J. 2014;35: 2010-20. doi:10.1093/EURHEARTJ/EHT439.
13. Avegliano G, Politi MT, Costabel JP, et al. Differences in the extent of fibrosis in obstructive and nonobstructive hypertrophic cardiomyopathy. J Cardiovasc Med. 2019;20:389-96. doi:10.2459/JCM.0000000000000800.
14. Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17:405-24. doi:10.1038/GIM.2015.30.
15. Kawana M, Spudich JA, Ruppel KM. Hypertrophic cardiomyopathy: Mutations to mechanisms to therapies. Front Physiol. 2022;13:975076.
16. Ho CY, Day SM, Ashley EA, et al. Genotype and Lifetime Burden of Disease in Hypertrophic Cardiomyopathy: Insights from the Sarcomeric Human Cardiomyopathy Registry (SHaRe). Circulation. 2018;138:1387-98. doi:10.1161/CIRCULATIONAHA.117.033200.
17. Cui H, Wang J, Zhang C, et al. Mutation profile of FLNC gene and its prognostic relevance in patients with hypertrophic cardiomyopathy. Mol Genet genomic Med. 2018;6:1104-13. doi:10.1002/MGG3.488.
18. Gómez J, Lorca R, Reguero JR, et al. Screening of the Filamin C Gene in a Large Cohort of Hypertrophic Cardiomyopathy Patients. Circ Cardiovasc Genet. 2017;10:e001584. doi:10.1161/CIRCGENETICS.116.001584.
19. Thomson KL, Ormondroyd E, Harper AR, et al. Analysis of 51 proposed hypertrophic cardiomyopathy genes from genome sequencing data in sarcomere negative cases has negligible diagnostic yield. Genet Med. 2019;21:1576-84. doi:10.1038/S41436-018-0375-Z.
20. Valdés-Mas R, Gutiérrez-Fernández A, Gómez J, et al. Mutations in filamin C cause a new form of familial hypertrophic cardiomyopathy. Nat Commun. 2014;5:article number 5326. doi:10.1038/NCOMMS6326.
21. Kiselev A, Vaz R, Knyazeva A, et al. De novo mutations in FLNC leading to early-onset restrictive cardiomyopathy and congenital myopathy. Hum Mutat. 2018;39:1161-72. doi:10.1002/HUMU.23559.
22. Brodehl A, Ferrier RA, Hamilton SJ, et al. Mutations in FLNC are Associated with Familial Restrictive Cardiomyopathy. Hum Mutat. 2016;37:269-79. doi:10.1002/HUMU.22942.
23. Muravyev A, Vershinina T, Tesner P, et al. Rare clinical phenotype of filaminopathy presenting as restrictive cardiomyopathy and myopathy in childhood. Orphanet J Rare Dis. 2022;17. doi:10.1186/S13023-022-02477-5.
24. Schubert J, Tariq M, Geddes G, et al. Novel pathogenic variants in filamin C identified in pediatric restrictive cardiomyopathy. Hum Mutat. 2018;39:2083-96. doi:10.1002/HUMU.23661.
25. Baban A, Alesi V, Magliozzi M, et al. Cardiovascular Involvement in Pediatric FLNC Variants: A Case Series of Fourteen Patients. J Cardiovasc Dev Dis. 2022;9. doi:10.3390/JCDD9100332.
26. Савостьянов К. В., Басаргина Е. Н., Рябова Е. Е. и др. Молекулярно-генетические особенности формирования рестриктивной кардиомиопатии у российских детей. Российский кардиологический журнал. 2021;26(10):4590. doi:10.15829/1560-4071-2021-4590.
27. Gaudreault N, Ruel LJ, Henry C, et al. Novel filamin C (FLNC) variant causes a severe form of familial mixed hypertrophic-restrictive cardiomyopathy. Am J Med Genet A. 2023;191:1508-17. doi:10.1002/AJMG.A.63169.
28. Rowin EJ, Fifer MA. Evaluating Histopathology to Improve Our Understanding of Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2021;77:2171-3. doi:10.1016/j.jacc.2021.03.292.
29. Varnava AM, Elliott PM, Mahon N, et al. Relation between myocyte disarray and outcome in hypertrophic cardiomyopathy. Am J Cardiol. 2001;88:275-9. doi:10.1016/S0002-9149(01)01640-X.
30. Cui H, Schaff HV, Lentz Carvalho J, et al. Myocardial Histopathology in Patients With Obstructive Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2021;77:2159-70. doi:10.1016/J.JACC.2021.03.008.
31. Lorenzini M, Norrish G, Field E, et al. Penetrance of Hypertrophic Cardiomyopathy in Sarcomere Protein Mutation Carriers. J Am Coll Cardiol. 2020;76:550-9. doi:10.1016/J.JACC.2020.06.011.
32. Baulina NM, Kiselev IS, Chumakova OS, et al. Hypertrophic Cardiomyopathy as an Oligogenic Disease: Transcriptomic Arguments. Mol Biol (Mosk). 2020;54:955-67. doi:10.1134/S0026893320060023.
Об авторах
С. Е. АндрееваРоссия
Андреева София Евгеньевна — врач-кардиолог, аспирант кафедры кардиологии, лаборант-исследователь.
Санкт-Петербург
Конфликт интересов:
Нет
А. В. Гурщенков
Россия
Гурщенков Александр Викторович — к.м.н., доцент кафедры сердечно-сосудистой хирургии, врач сердечно-сосудистый хирург.
Санкт-Петербург
Конфликт интересов:
Нет
В. В. Зайцев
Россия
Зайцев Вадим Витальевич — врач-кардиолог, ассистент кафедры кардиологии факультета подготовки кадров высшей квалификации Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
Нет
А. А. Козырева
Россия
Козырева Александра Анатольевна — к.б.н., с.н.с. научно-исследовательской лаборатории молекулярной кардиологии и генетики.
Санкт-Петербург
Конфликт интересов:
Нет
А. И. Михалева
Россия
Михалева Анна Игоревна — аспирант кафедры клеточной биологии, гистологии и цитологии.
Санкт-Петербург
Конфликт интересов:
Нет
А. С. Муравьев
Россия
Муравьев Алексей Сергеевич — врач детский кардиолог.
Санкт-Петербург
Конфликт интересов:
Нет
В. К. Гребенник
Россия
Гребенник Вадим Константинович — зав. отделением сердечно-сосудистой хирургии № 3.
Санкт-Петербург
Конфликт интересов:
Нет
Л. Б. Митрофанова
Россия
Митрофанова Любовь Борисовна — д.м.н., г.н.с. НИЛ патоморфологии, профессор кафедры патологической анатомии Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
Нет
М. Л. Гордеев
Россия
Гордеев Михаил Леонидович — профессор, д.м.н., г.н.с. НИО кардиоторакальной хирургии.
Санкт-Петербург
Конфликт интересов:
Нет
О. М. Моисеева
Россия
Моисеева Ольга Михайловна — д.м.н., г.н.с., руководитель научно-исследовательского отдела некоронарогенных заболеваний сердца.
Санкт-Петербург
Конфликт интересов:
Нет
А. А. Костарева
Россия
Костарева Анна Александровна — д.м.н., директор Института молекулярной биологии и генетики.
Санкт-Петербург
Конфликт интересов:
Нет
Дополнительные файлы
- Пациенты с обструктивной гипертрофической кардиомиопатией (ГКМП) на фоне редких миссенс-вариантов гена FLNC в нашем исследовании не отличались по основным клиническим характеристикам от большинства пациентов с ГКМП, направленных для выполнения септальной миоэктомии.
- Редкие миссенс-варианты гена FLNC могут выступать в качестве причинных или модификаторов течения ГКМП.
- Для уточнения характера патогенности редких миссенс-вариантов FLNC необходимы функциональные и сегрегационные исследования.
Рецензия
Для цитирования:
Андреева С.Е., Гурщенков А.В., Зайцев В.В., Козырева А.А., Михалева А.И., Муравьев А.С., Гребенник В.К., Митрофанова Л.Б., Гордеев М.Л., Моисеева О.М., Костарева А.А. Редкие варианты гена филамина С среди пациентов с гипертрофической кардиомиопатией, направленных на септальную миоэктомию. Российский кардиологический журнал. 2024;29(10):5942. https://doi.org/10.15829/1560-4071-2024-5942. EDN: AIUPFZ
For citation:
Andreeva S.E., Gurshchenkov A.V., Zajcev V.V., Kozyreva A.A., Mihaleva A.I., Murav'ev A.S., Grebennik V.K., Mitrofanova L.B., Gordeev M.L., Moiseeva O.M., Kostareva A.A. Rare filamin C variants among patients with hypertrophic cardiomyopathy referred for septal myectomy. Russian Journal of Cardiology. 2024;29(10):5942. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5942. EDN: AIUPFZ
JATS XML

















































